Université de Montréal
Relation entre la concentration de manganèse dans l’air du
métro de Montréal (Canada) et la densité du trafic automobile
Par
Nacéra Boudia
Département de santé environnementale et santé au travail
Faculté de médecine
Mémoire présenté à la faculté des étude supérieures en vue de
l’obtention du grade de maître ès sciences (M. Se.) en santé
environnementale et santé au travail
Fevrier 2005
‘7-R_j I
r
Dïrection des bibliothèques
AVIS
L’auteur a autorisé l’Université de Montréal à reproduire et diffuser, en totalité ou en partie, pat quelque moyen que ce soit et sur quelque support que ce soit, et exclusivement à des fins non lucratives d’enseignement et de recherche, des copies de ce mémoire ou de cette thèse.
L’auteur et les coauteurs le cas échéant conservent la propriété du droit d’auteur et des droits moraux qui protègent ce document. Ni la thèse ou le mémoire, ni des extraits substantiels de ce document, ne doivent être imprimés ou autrement reproduits sans l’autorisation de l’auteur.
Afin de se conformer à la Loi canadienne sur la protection des renseignements personnels, quelques formulaires secondaires, coordonnées ou signatures intégrées au texte ont pu être enlevés de ce document. Bien que cela ait pu affecter la pagination, il n’y a aucun contenu manquant.
NOTICE
The author of this thesis or dissertation has granted a nonexclusive license allowing Université de Montréal to reproduce and publish the document, in part or in whole, and in any format, solely for noncommercial educational and research purposes.
The author and co-authors if applicable retain copyright ownership and moral rights in this document. Neither the whole thesis or dissertation, nor substantial extracts from it, may be printed or otherwise reproduced without the author’s permission.
In compliance with the Canadian Privacy Act some supporting forms, contact information or signatures may have been removed from the document. While this may affect the document page count, it does flot represent any loss of content from the document.
Université de Montréal
Faculté des études supérieures
Ce mémoire intitulé
Relation entre la concentration de manganèse dans l’air du métro
de Montréal (Canada) et la densité du trafic automobile
Présenté par
Nacéra Boudia
A été évalué par un jury composé des persoimes suivantes:
Dr Robert Tardif
Dr Joseph Zayed
Dr Kannan Krislman
Président-rapporteur
Directeur de recherche
Membre du jury
;Li
‘t4t
Mémoire accepté
le:Sommaire
Depuis plus de deux décennies, le MMT (méthylcyclopentadiényle manganèse tricarbonyle) est utilisé comme additif dans l’essence sans plomb au Canada. La combustion du MMT entraîne l’émission de particules de manganèse (Mn), sous différentes formes chimiques. Il est de plus en plus admis qu’une des principales sources de contamination et d’exposition au manganèse inorganique en milieu urbain serait associée à la combustion du MMI. Plusieurs études ont déjà mis en évidence une relation entre les concentrations de Mn et la densité de trafic automobile, suggérant que l’émission de Mn de source MMI y joue un rôle significatif. La neurotoxicité reconnue du manganèse à des niveaux élevés d’exposition a suscité quelques préoccupations quant
à l’utilisation du MMT.
Le but de cette recherche était donc d’évaluer la concentration de Mn dans l’air du métro de Montréal, afin d’estimer la possibilité de contamination par le Mn et d’identifier l’origine de ce Mn. Pour ce faire, la recherche a été réalisée avec la collaboration de la société de transport de Montréal. Trois stations ont été choisis en fonction de leur localisation par rapport à un trafic environnant plus au moins dense. La station Jean Drapeau par son emplacement sur une fie (Ste-Helène), représente un site relativement loin de l’influence du trafic automobile. La station Snowdon, quant à elle, est située à l’intérieur d’un périmètre caractérisé par un trafic urbain. Enfin, la station Namur est localisée près d’axes autoroutiers importants.
Le Mn respirable (MnR<5pm) et le Mn total (MnT) ont été simultanément échantillonnées dans chacune des stations pendant deux semaines (22 et 29 septembre 2003). Deux pompes Gilair munies de filtres de téflon, ont été utilisées à chacune des stations au niveau du quai d’embarquement. Les filtres récupérés ont été analysées par activation neutronique.
Pour la station Jean Drapeau, les concentration obtenues étaient relativement faibles avec des moyennes de 0,019 igIm3 à 0,032 jig/m3 respectivement pour le MnR et le MnT.
Quant aux deux autres stations, les concentrations moyennes (MnR) variaient de 0,083
jig/m3 à 0,17 1 ig/m3, dépassant la concentration de référence de l’US EPA de 0,05 tg/m3 pour le MnR. Les concentrations moyennes obtenues dans les stations vont exactement dans le sens de la densité de trafic : Namur>Snowdon>Jean Drapeau.
De plus le manganèse se retrouve majoritairement dans la fraction respirable puisque le MnR représente environ 72% du MnT. Quant à la caractérisation de la structure chimique et cristallographique des particules de Mn, elle n’a pas été déterminée. L’étude statistique réalisée dans le but de déterminer le rôle des sources internes du métro à ces niveaux élevés de Mu, a montré une contribution presque nulLe de ces sources.
Les résultas de cette recherche démontrent qu’il existe une relation entre la densité du trafic et la concentration de Mn dans le métro et laisse supposer que ce Mn est d’origine MMT et vient de l’extérieur du métro par le système d’aération.
TABLE DES MATIERES
Page titre I
Identification du jury II
Sommaire III
Table des matières V
Liste des tableaux VIII
Liste des figures X
Liste des sigles et abréviations XI
Remerciements XII Dédicace XIII CHAPITRE 1 1
Introduction
I Généralités sur le Mn 2 1.1 Propriétés physico-chimiques 21.2 Usage et devenir environnemental 4
1.2.1 Production et usage 4
1.2.2 Sources et devenir environnemental 6
2 Exposition par l’air $
2.1 Concentrations ambiantes $
2.2 Problématique du MMT 8
3 Exposition par d’autres média .13
3.1 Concentration dans les aliments 13
3.2 Concentration dans l’eau 14
3.3 Concentration dans le sol 16
4 Toxicocinétïque 16 4.1 Absorption 16 4.1.1 Lavoieorale 17 4.1.2 La voie respiratoire 17 4.1.3 Lavoie olfactive 1$ 4.2 Distribution 19 4.3 Métabolisme 19 4.4 Élimination 21 5 Estimation de la toxicité 22
5.1 Dose— réponse pour effet non cancérigène 22
5.1.1 La détermination de la dose de référence par voie orale (RfD) 22 5.1.2 La détermination de la concentration de référence par inhalation(RfC).. 23
6 Effets sur la santé 24
6.1 Toxicité pulmonaire 25
6.2 Neurotoxicité 26
6.3 Effets sur la reproductivité 28
7 - Méthode d’analyse du Mn 28
7.1 L’activation neutronique 2$
7.2 La spectroscopie d’absorption atomique 29
t11.PI’L’1_F 2
.31
Manganese concentrations in the air of the Montreal (Canada)
subway
in
relation
to
surface
automobile
traffic
il en s ity. . . ... .
.32
Abstract 33
Introduction 34
Materials and methods 37
Results 40 Discussion 41 Références 44 Tables 4$ Figure 53
CHAPITRE 3
54 Discussion générale 55 Conclusion générale 60 Bibliographie 62 Annexe 74 Tableaux 75 Figure 83LISTE DES TABLEAUX
CHAPITRE 1
Tableau 1: Les propriétés physico-chimiques du manganèse 3
Tableau 2: Les niveaux de manganèse dans l’air de certains emplacements urbains canadiens comme déterminés par une surveillance d’exposition
personnelle 12
Tableau 3: Concentration de manganèse dans certains aliments 15 Tableau 4: Niveaux normaux de manganèse dans les tissus humains
et animaux 20
CHAPITRE 2
Tableau 1: Potential intemal sources ofmanganese in the Montreal subway 48 Tableau 2: Respirable Mn (MnR) and total Mn (MnT) concentrations in three subway
stations in Montreal 49
Tableau 3 : Ratios of respirable Mn to total Mn in three subway stations in Montreal 50 Tableau 4: Comparisons of respirable Mn (MnR) and total Mn (MnT) among three
subway stations inMontreal 51
Tableau 5: Ratios of respirable Mn (MnR) and total Mn (MnT) concentrations to
number of subway cars in three stations in Montreal 52
CHAPITRE 3
Tableau 1: Comparaison des concentrations de Mn du métro de Montréal avec
les étude de Thibault et al., (2002) et de Zayed et al., (1999a) 58
Annexe
Tableau 1: Chernical and physicaÏ properties ofrnanganese cornpounds (continued).. ..76 Tableau 1: Chernical and physical properties ofmanganese cornpounds (continued) 77 Tableau 2: Surnmary of uses for selected manganese compounds 7$ Tableau 3: Environmental releases (in pounds) for manganese in
the united States, 1988 — 199$ 79
Tableau 4: Environrnental releases(in pounds) for manganese compounds
in united states, 1988 — 1998 80
Tableau 5: Exposures to aerosols and Mn, London-1996 81
Tableau 6: Exposures to Mn in Tsp vs. mode of transportation for London office
LISTE DES FIGURES
CHAPITRE 1
Figure 1: Structure de tunnel du métro de Montréal (sources internes) 83
CHAPITRE 2
Figure 1 : Manganese concentration in three underground subway stations in relation to
LISTE DES SIGLES ET ABREVIATIONS
ACGIH American Conference of Governmental Industrial Hygienists
ATSDR Agency for Toxic Substances and Disease Registry
CGSB Canadian General Standards Board
CUM Communauté Urbaine de Montréal
ll\JRS Institut National de Recherche Scientifique
LOAEL Lowest Observed Adverse Effect Level.
NRC National Research Council
OMS Organisation Mondiale de la Santé
OSHA Occupational Safety and Health Administration
Ph Plomb
PM Poids Moléculaire
ppm Partie par million
RfD Oral Reference Dose
RfC li±alation Reference Concentration
SNC System Nerveux Central
TSP Total Suspended Particulates
Remerciements
Je remercie en premier lieu Dr Joseph Zayed qui a fait preuve de gentillesse
et de patience, et tous les étudiants et personnel qui ont contribué de loin ou
Dédicace
Je dédie cette recherche à tous ceux qui travaillent pour le bien de
Ï ‘humanité
CHAPITRE 1
1 Généralités sur le Mn
1.1 Propriétés physico-chimiques du Mn et de ses composés
Le manganèse (Mn) est le douzième élément le plus abondant de l’écorce terrestre (Environnement Canada, 1987) découvert par Johann Gahn (Suède) en 1774 (Rodier, 1955). A l’état élémentaire le Mn est un métal très dure, cassant de couleur gris-blanc teintée de rose. Très réactif, son numéro atomique est Z=25, sa masse atomique M=54,9 et elle a une structure cubique cristalline. Il constitue le métal de transition le plus commun après le fer et le titane. La poussière de Mn est inflammable. Il possède aussi des propriétés pararnagnétiques qui le rendent visible lors des séquences d’imagerie à résonance (Saric et al., 1996). Le Mn s’oxyde rapidement en présence d’oxygène, et peut se présenter sous 11 degrés d’oxydation (de —3 à +7) (Abbott, 1987), dont les plus communs sont (+2, +4 et +7) (US EPA, 1994), la forme (+2) étant la plus stable (Barceloux, 1999). Les formes (+2, +4) sont les plus communes dans les tissus vivants, le Mn constitue un oligo-élément essentiel pour l’humain.
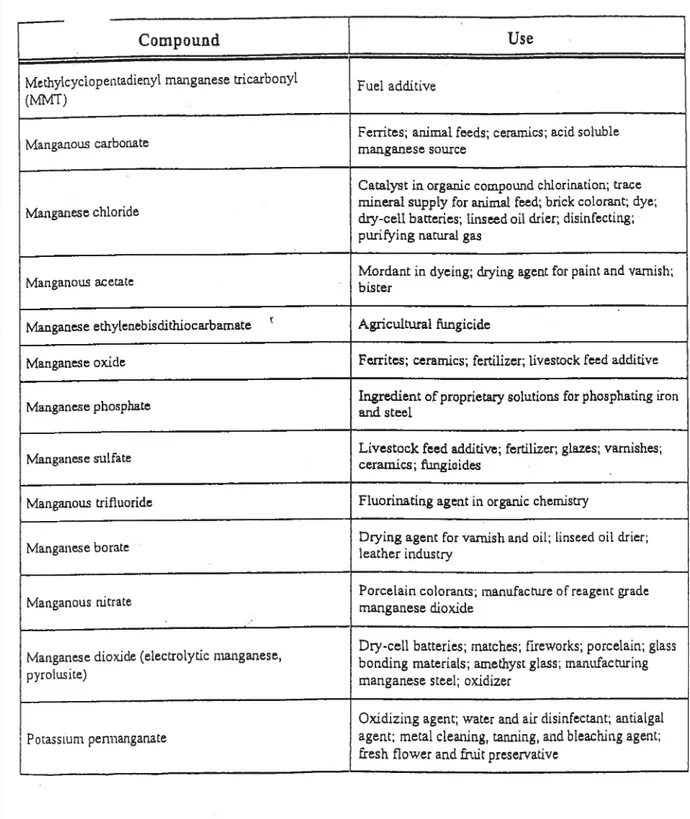
Le Mn, omniprésent dans les différents compartiments environnementaux, n’est jamais à l’état libre mais sous forme de composés, dont les plus importants incluent les oxydes, les sulfures, les carbonates et les silicates (Keen et Leach, 1988). Le Mn et ses composés sont des substances chimiques actives, qui peuvent réagir avec d’autres matériaux ou catalyser d’autres réactions. Compte tenu du fait que la majorité des émissions atmosphériques de Mn est constituée d’oxyde de Mn, certains composés prennent beaucoup d’importance et méritent d’être connus comme le pyrolusite (Mn02), 1’ hausmannite (Mn304) et le méthylcyclopentadiényle manganèse tricarbonyle (MMT). Les propriétés physico-chimiques du Mn sont résumées dans le tableau 1, pour les propriétés de certains de ces composés voir le tableau I en annexe.
Tableau 1: Les propriétés physico-chimiques du manganèse
Propriété Information
Registre des services d’abstracts 7439-96-5 chimiques_(CAS) No
Formule chimique Mn
Numéro Atomique 25
Masse Atomique 54,94
Synonymes Manganèse élémentaire; manganèse
Collodial;Cutaval;Magnacat;Tronamang NIOSH Registre des effets toxiques dus
isooo
aux substances chimiques (RTECS) No
Banque de données des substances 00550 hazardouses (HSDB) No
Point de d’ébullition 1,962 °C
Point de fusion 1,244 °C
Pression de vapeur (à 1,292°C) lmmHg
Densité (à20°C)
[
7,21 — 7,44 g/c1Solubilité dans Peau Décornposition
ubil;te dans l’acide
[
Se dissout dans les ades nuneraux dilues1.2 Usage et devenir environnemental 1.2.1 Production et usage
Le Mn constitue le 4e métal le plus utilisé au monde, et plus de 90% tOMS, 1981) de la production mondiale est utilisée dans la fabrication d’alliage en acier et dans l’industrie sidérurgique (Abott, 1987). Les composés de Mn sont produits à partir des réactions de différents éléments et composés avec les minerais de Mn ou de ferromanganèse. Les composés les plus communs incluent le chlorure de Mn, le sulfate de Mn, le dioxyde de Mii, le trioxyde de Mn et le permanganate de potassium (ATSDR, 2000). Le Mn forme aussi des alliages avec le fer, le bronze, l’argent et le chrome, alors que leurs utilisations varient (tableau 2 en aimexe).
Aux États-Unis prés de 80% du permanganate de potassium est utilisé dans le traitement de l’eati potable (US EPA, 1984). Le Mn entre également dans la fabrication des machines nécessitant une forte résistance à l’eau de mer et aussi dans un alliage à base de cuivre et/ou de nickel dans l’industrie électrique car il apporte résistance, dureté, solidité et trempabilité aux matériaux (Lauerman, 1998). Il entre dans la constitution des boites de conserve, des piles sèches, batteries et est utilisé comme oxydant dans l’industrie chimique. De nombreux composés de Mn tels le permanganate de potassium et le sulfate de Mn entrent dans la constitution d’engrais et des fertilisants, d’aliments au bétail, des produits phanriaceutiques, de siccatifs pour peintures, en soudure, dans la coloration des briques, du verre et de la céramique, d’agents de conservation du bois (OMS, 1981). Deux types de composés organiqtles de Mn dont l’importance en terme de production et d’utilisation ne cesse d’augmenter sont les pesticides, tels le Maneb ((CH2NHCS2)2Mn), le Mancozebe ((CH2NHCS2)2Mn-Zn) et le méthylcyclopentadiényle manganèse tricarbonyle (MMT). Au Canada, prés de 1380 tonnes de Maneb et de Mancozeb ont été vendues en 1985 (Ethyl Corporation, 1990). Ces pesticides ont une composition chimique très semblable et sont surtout utilisés comme fongicide pour combattre certaines maladies du gazon, de légumes et de fleurs. Quant au MMT, sa
production totale était estimée à plus de 3300 tonnes en 1977 (Cahiil et aI., 1980) et à près de 1800 tonnes en 1983 (Clay, 1989).
Les émissions atmosphériques mondiales de Mn de nature anthropique ont été estimées à environ 300 000 tonnes par année, tandis que les émissions de source naturelle ont été évaluées à environ 600 000 tonnes par année, (Salornon et Forstner, 1984).
Les émissions atmosphériques canadiennes de Mn ont été estimées à plus de 6500 tonnes en 1972 (Environnement Canada, 1976) dont plus de 99% provenait des industries métallurgiques. En 1984, ces émissions n’étaient plus que de 1225 tonnes. La réduction des émissions d’origine industrielle semblerait être attribuable au contrôle des émissions suite à une réglementation plus sévère (US EPA, 1984). Quant aux autres sources d’émission, il faut retenir par ordre décroissant: les pesticides (2,3%), les combustibles de source fixe (1,6%), la fabrication de produits non-métalliques (0,7%) et l’incinération des déchets solides (0,4%). Les tendances générales des émissions devraient se maintenir autour de 80% pour les industries métallurgiques et entre 14 et 17% pour les émissions de Mn dues à la consommation d’essence (Environnement Canada, 1987). Les émissions annuelles de Mn de source MMT sont estimées à environ 200 tonnes pour l’ensemble du Canada, avec une valeur maximale évaluée à 518 tonnes. Cette estimation est basée sur la production d’essence de 1985 et sur une teneur en Mn de 18 mg/l d’essence établie par l’office des nonnes générales du Canada (Canadian General Standards Board, 1986). Une récente étude a pu établir un taux réaliste d’émission à 86 200 kg en 1999 alors que la valeur maximale a été estimée à 344 880 kg (Zayed et al., 2003).
1.2.2 Source et devenir environnemental
Le Mn est un élément très abondant dans la nature formant 1% de la croûte terrestre (ATSDR, 2000) et se retrouve naturellement dans l’environnement sous forme de minerais. Ses composés sont largement distribués dans le sol, les roches, les sédiments marins et océaniques (Keen et Leach, 1988), l’eau, les produits biologiques, l’érosion des sols contenant du Mn, les éruptions volcaniques (Spengler et al., 1992). Les réserves mondiales en Mn sont fortement concentrées en Afrique du sud, en Russie, en Australie, au Brésil et au Gabon (Calne et al., 1994). Les formes organiques de Mn de sources naturelles se retrouvent essentiellement fixées dans la biomasse animale et végétale à des concentrations très variables (< 0,1 — 930 ppm) ainsi que dans les fossiles combustibles
tels le charbon (1- 100 ppm) et le pétrole brut (< 0,001 — 0, 15 ppm) (Nachtman et al.,
1986).
Le Mn peut être généré par les principales sources de pollution atmosphérique de l’environnement: les industries minières et métallurgiques, en particulier la fabrication des produits en alliage, les opérations de soudage et de coupes de métaux, les principaux rejets atmosphériques dont les fumées, les poussières et les aérosols qui sont répandus principalement sous forme d’oxydes de Mn. L’émission de Mn lors de la combustion du MMT est suspecté de contribuer aux concentrations de Mn atmosphérique (Hammerle et al., 1992). Les tableaux 3 et 4 en annexe résument les émissions de Mn dans l’atmosphère aux Etats-unis.
La taille des particules de Mn suspendues dans l’air, est un facteur déterminant concernant leur devenir dans l’atmosphère. Les particules émises par les industries se déposent généralement à proximité de la source en raison de leur taille plus grande. Les particules plus fines demeurent plus longtemps dans l’atmosphère (Stokes et al., 1988). Plusieurs études démontrent que les particules dont la taille est inférieure à 2,5 tm
taille supérieure correspondraient surtout à des sources naturelles (U.S. EPA, 1984). Les particules émises par les véhicules automobiles, en bordure des voies rapides, se concentrent à moins de 50 mètres et cette concentration décroît en générale rapidement à mesure qu’on s’éloigne de la route (Mosehoim et al., 1992). Les particules de Mn provenant des véhicules automobiles se retrouveraient essentiellement au niveau de la fraction fine (< 2,5 .im) (Davis et al., 1988). Certaines estimations parlent d’une contribution au bruit de fond inférieure à 10 à plus de 250 m de la route (Loranger et al., 1995). De plus, près de 90% de ces particules se déposeraient à moins de 10 m de la voie rapide (US EPA, 1990). Peu d’informations sont disponibles sur les réactions chimiques du Mn dans l’air. Mais on pense qu’il réagit avec le sulfure et le dioxyde de nitrogène. La demi-vie du Mn dans l’air est de quelques
j
ours (ATSDR, 2000). Une fois dans l’atmosphère le Mn subit différentes transformations physico-chimiques reliées notamment à la formation d’acide sulfurique dans les précipitations (Barrie, 1980). L’élimination du Mn atmosphérique à travers les processus de déposition sèche et humide joue un rôle majeur dans la dynamique géochimique de cet élément. Les caractéristiques physico-chimiques des particules (taille, solubilité) déterminent en grande partie le type de déposition (Galloway et al., 1982). Les dépositions sèches se produisent lorsque les particules sont éliminées de l’atmosphère à partir de mécanismes tels la sédimentation, l’impaction, la force électrostatique ou d’autres phénomènes reliés aux déplacement des masses d’air. Les dépositions humides se produisent lors des précipitations (pluies, neiges) soit directement par les gouttes d’eau ou indirectement par impact, absorption ou adsorption des particules en suspension dans l’air pendant la chute des gouttes d’eau.2 Exposition par l’air
2.1 Concentration ambiante
Les concentrations de Mn dans l’air dépendent d’un facteur important: la localisation environnementale de ses sources d’émission. Il y a quelques années l’us EPA (1990) a proposé une concentration moyenne annuelle (bruit de fond) de 0,04 jig/rn3 dans les
zones urbaines, basée sur les données de 24 h des concentrations moyennes de 102 villes aux USA.
Par ailleurs les concentrations mesurées dans l’air varient considérablement entre les zones non habitées et habitées. Ainsi dans les zones arctiques, en montagnes ou au dessus des océans et des continents, les concentrations peuvent varier de 0,0i.i0 à 0,015 tg/m3. Celles mesurées en zones habitées peuvent s’étendre de 0,01 à 0,04 p.g/rn3 en milieu rural (Stokes et al., 1988), alors que les concentrations dans les zones industrialisées à proximité des usines de ferromanganèse ou de fonderies, atteignent parfois plusieurs microgrammes par mètres cube (US EPA, 1984). Quant aux concentrations de Mn dans l’air en zone urbaine industrialisée, elles varient de 0,1 à plus de 0,5 ig/m3. Toutefois en milieu urbain non industrialisé, elles varient de 0,01 à 0,1 .ig/rn3 (Ethyl Corporation, 1990 ; Loranger et Zayed, 1994).
2.2 Problématique du MMT
Au Canada le Mn a fait l’objet d’une polémique depuis 1976, alors que le MMT est un additif utilisé dans l’essence sans plotnb. Ce composé a été mis au point par la firme
américaine Ethyl Corporation au début des années 50 et commercialisé aux États-Unis en 1958. Il est utilisé dans le but d’augmenter l’indice d’octane (Frumkin et Solomon, 1997) et en raison de ses propriétés antidétonantes (Cooper, 1984; US EPA, 1984). Le Canada a été le premier pays à avoir approuvé le remplacement complet du Ph par le MMT (Gatiison et al., 1995). D’autres pays commencent à l’utiliser comme l’Argentine, l’Australie, la Bulgarie, les États Unis, la France, la Russie, et la Nouvelle Zélande. En
avril 1997, le gouvernement canadien a adopté la loi C-29 qui bannissait les échanges commerciaux à base de MMT et de Mn, en raison du risque sur la santé. Mais en 1998, ce dernier supprima son interdiction et dédommagea Ethyl Corporation de 13 millions de dollars (Hileman, 1998). Au Canada le MMT contient 24,4 à 25,2 % de Mn, soit 18 ig de Mn des 72 g de MMT peuvent être ajouté à un litre d’essence. Une récente étude a montré que 6,5 ig Mn/l et 26,5 ig MMT/l sont les concentrations trouvées dans l’essence avec MMT au Québec (Zayed et al, 1999b); aux USA la concentration est de 8,3 1ug Mnll d’essence sans Pb (Lynam et al., 1999). La quantité de MMT peut varier d’un lot d’essence à un autre. En général, les supercarburants ont un indice de MMT plus élevé que l’essence ordinaire (Environnement Canada, 2000). Il se vend annuellement environ 1 milliard de litres d’essence sur le territoire montréalais (Gagnon, 1998).
On estime que la combustion du MMT entraîne une formation d’oxydes de manganèse inorganiques. L’hausmanite (Mn304) constitue 99% du produit (Lynam et al., 1990) avec des traces de monoxyde de Mn (MnO), de dioxyde de Mn (Mn02) et de trioxyde de Mn (Mn203). Récemment, une étude a été réalisée dans le but de caractériser les particules contenant du Mn, captées par le système d’échappement des véhicules utilisant l’essence avec MMT. Les résultats obtenus révèlent que le MMT brûlé est rejeté sous forme de mélange amorphe de phosphate et de sulfate de Mn, dont les éléments présents sont le manganèse, l’oxygène, le phosphore et le soufre avec une quantité de phosphate de Mn indiquant qu’il est le principal composant (Zayed et al., 1999a). D’ailleurs, les agglomérats du phosphate de Mn se combinent souvent avec le soufre et le fer (Lynam et al., 1999; Zayed et al., 1996; Zayed et al., 1999e) et ce, dépendant du moteur, de la composition de l’essence et du catalyseur (Vitarella et al., 2000).
Quant aux taux de rejet de ces produits par la combustion, ils varient selon les différents auteurs et organismes environnementaux. Hammerle et al. (1992) ont obtenu des pourcentage variant de 6 à 45%. Hare (1991) indiquait que des valeurs moyennes se situeraient entre 10 et 20 ¾ pour les voitures et à 27 % pour les camions. Toutefois Ethyl
corporation estime le pourcentage moyen des rejets de Mn émis par le tuyau d’échappement automobile à 20%, alors que l’us EPA (1990) l’estime à 30%. Par ailleurs, une récente étude l’a évalué entre 3,8 à 50 % (Ardeleanu et al., 1999). Le MMT qui n’a pas subi de combustion est rapidement décomposé photochimiquernent (15 sec) (Ter Haar et al., 1975). Cette variabilité des taux et pourcentages de rejet atmosphérique de Mn entraîne une grande incertitude quant à la prédiction de l’exposition éventuelle des populations urbaines.
En ce qui concerne la taille de ces particules générées par la combustion du MMT, des analyses par microscopie électronique à balayage ont révélé que la taille des particules de Mn de source mobile se situait entre 0,2 pin et 50 im (Ardeleanu et al., 1999), on
rapporte que 99% de ces particules sont < 5 pin et 86% ont une taille <1 tm. Lynam et
a]. (1999) citent des tailles moins de 2,5 11m. Davis et al. (1988) rapportent que la majorité des particules de Mn sont dans la fraction respirable.
En cycle de ville le pourcentage des particules < 0,5 tm
(
39%)
est supérieur à celui ducycle d’autoroute (22
%)
(Ardeleanu et al., 1999). La petite taille de ces particules soulève une question sur l’effet potentiel de cette source de contamination environnementale sur la santé publique. Relativement à un modèle reconnu de déposition des particules dans le système respiratoire (Task Group On Lung Dynamics, 1966), on peut s’attendre à un taux de dépôt de 15% dans la section nasopharyngiale, 10 % dans la section trachéobronchiale et 30 % dans la section pulmonaireL’impact du MMT sur l’environnement et la santé représente un champs nécessitant plus d’investigation. Étant donné que l’utilisation du MMT semble contribuer à accroître les concentrations de Mn dans les divers compartiments environnementaux, la santé publique pourrait en être affectée. En effet, une série d’études canadiennes a été faite sur l’évaluation de la contamination environnementale et sur l’exposition humaine au Mn
provenant de la combustion du MMT. Les concentrations de Mn les plus élevées dans l’air ambiant sont habituellement mesurées en milieu de travail. Les mécaniciens de garage sont exposés à une concentration moyenne de 0,25 tg/rn3 alors que les chauffeurs de taxi Je sont à 0,024 ig/m3 (Zayed et al., 1994). Par ailleurs, la concentration moyenne de Mn dans l’air était significativement plus élevées (p<O,OO1) chez les mécaniciens de garage (0,423 1g/m3
)
que chez les cols bleus (0,044 rg/m3) (Loranger et Zayed., 1995).Sierra et al. (1995), ont montré que le niveau en Mn au travail était de 0,45 jig/m3 pour les mécaniciens de garage et de 0,044 tg/m3 pour les cols bleus de l’Université de Montréal. Le tableau 2 en fait la synthèse. Quant à l’exposition environnementale les résultats obtenues par Bancovitch et al. (2003) ; Lorangcr et al. (1997 ; 1996 ; 1994); témoignent de concentrations élevées de Mn dans des zones à forte densité de trafic que ce soit dans le sol, les plantes, l’air ambiant et dans les tissus d’animaux. Cette augmentation serait en partie associée à la combustion du MMT.
2.3 Concentration de Mn dans le métro
L’exposition environnementale au Mn dans le métro n’est pas nouvelle, et a attiré l’attention depuis plusieurs aimées. Des études ont été réalisées dans des villes différentes. Le type de métro (structure et alimentation), les durées d’exposition personnelle, les durées d’échantillonnages sont aussi différentes. Deux de ces études sont avérées pertinentes et retiennent notre attention.
La première : a été effectué avant d’introduire le MMT dans le diesel de la ville de Londres (Pfeifer, 1999). Les concentrations de Mn obtenues varient entre 0,783 jig/rn3 à
2,2$ 1 jig/m3 respectivement pour le Mn respirable et les poussières totales (tableau 5 en annexe). Malgré le peu de temps passé dans le métro (lhlj), l’exposition des travailleurs de bureau utilisant le métro était 4 à 7 fois supérieure à celles des travailleurs qui utilisent d’autres moyens de transport tel que la bicyclette (tableau 6 en annexe). La source de Mn
Tableau 2 : Les niveaux de manganèse dans l’air de certains
emplacements urbains canadiens comme déterminées
par une surveillance d’exposition personnelle
tÏo
r
rN Moyenne Marge Référencej
(ng/m) (ng/m3)Ouvrier de garage Au travail 5 jours 10 250 9-2.067 Zayed et al Ouvrier de garage
À
la maison 2ours 10 7 4-27 (1994) Chauffeur de taxi Au travail 5 jourst
10 24 6-69Chauffeur de taxi
À
la maison 2 jours 10 1 1 t4-22Mécanicien d’auto Au travail t4semaines 35 448 tïÔTjïaeTï
Mécanicien d’auto
À
la maison t4_semaines 35 12 6-63 (1995) tJiïifié Au travailt4
semaines t30 44 iï86Non identifié
À
la maisonj
4 semaines 30 8tllede
[Àï
travail 7 jours 23 2-44j
BureauI
I
(1996)travail ïIours
t
8-73
dans ce métro a été associée aux composantes du métro comme le revêtement des roues, freins et rails. Il a été conclu que le métro représente une source d’exposition significative tout au Mn qu’à d’autres métaux.
La deuxième étude a été réalisée par Ethyl Corporation dans la ville de Toronto auprès de
925 personnes (Crurnp, 2000). Les résultats montrent une concentration moyenne de Mn de 0,42$ ig/rn3, et une exposition persomelle de 0,012 ig/rn3 pour les utilisateurs de métro comparativement à 0,007 tg/m3 pour les non-utilisateurs de métro. La source de Mn dans ce cas a été aussi associée aux frottements des rails qui contiennent plus de 14% de Mn. Cette hypothèse reste cependant incertaine.
3 Exposition par d’autres médias 3.1 Concentration dans les aliments
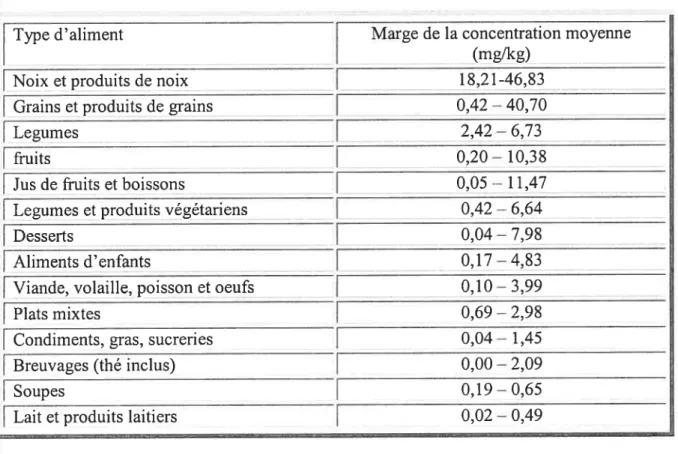
On trouve le Mn dans presque toutes les variétés d’aliments (plantes, animaux), avec des concentrations extrêmement variables. Les principales sources alimentaires de Mn sont les légumineuses (légumes verts, haricots secs, betteraves, pois secs), les noix, les grains entiers, les produits céréaliers, les épices (clous de girofle, gingembre), le café et le thé, avec des valeurs de 40 et 50 mg/kg. Les fruits, les poissons, la viande et les oeufs contiennent des concentrations intermédiaires. La présence de Mn dans le lait est faible et varie entre 10 et 30 tg /1 respectivement chez l’humain et la vache. Du Mn a été détecté avec des concentrations variant de 0,16 à 0,31 jig/g dans les muscles de thon bluefin
(
Thunnus Thynnus)(
Hellou et al., 1992). Le thé noir de United kingdom présente une moyenne de 4,6 mg/l (Poweil et al., 1998).Le tableau 3 résume les concentrations moyennes de Mn dans certains aliments. Comme dit précédemment le Mn est un élément nutritif essentiel. Sa présence dans l’alimentation est nécessaire car sa carence peut entraîner des troubles de la posture, de l’équilibre et des convulsions. Les besoins de l’adulte en Mn sont évalués de 2 à 3 mg/j (OMS, 1973), et même jusqu’à 11 rng/j (Barceloux, 1999). Cependant Les femmes ont tendance à consommer moins d’aliments que les hommes. Alors leur consommation en Mn sera aussi moins importante (Pennington et al., 1989). Les recommandations du conseil national de recherche (NRC, 1973) sont de 0,3 - 0,6 mg/j pour le nourrisson de O - 6 mois ; 0,6 - 1,0 mg/j chez celtii de 0,5 — 1 an ; 1,0 — 1,5 mg/j chez l’enfant de 1 — 3 ans;
1,5 —2,0 mg/j chez l’enfant de 4 —6 ans ; 2,0 —3,0 mg/j chez celui de 7 — 10 ans et 2,0 —
5,0 mg/l chez l’adolescent et l’adulte.
3.2 Concentration dans l’eau
Le Mn est présent dans l’eau de mer et dans l’eau douce, sous forme dissoute ou en suspension. Les concentrations de Mn retrouvées en eaux douces (de surface ou souterraine) sont très variables. L’eau de surface presente des concentrations qui varient entre 3 à 70 tg/l. Les eaux souterraines présentent les plus grandes concentrations (US EPA, 1984). Dans l’eau de mer, Turekian (1969) a observé une concentration moyenne de 0,4 pg!l.
L’eau potable contient des concentrations variables allant de 5 à 25 jig/l tOMS, 1981). D’après Loranger et Zayed (1995) l’expositionau Mn par l’eau potable a été estimé à 1% de la dose ingérée. Cette exposition peut toutefois devenir importante (17%) chez les individus s’approvisionnant à partir de puits. L’US EPA (1984) a estimé la contribution de l’eau potable à un niveau < 3% de la quantité de Mn ingérée par rapport aux aliments.
Les nonnes gouvernementales fixées par les Etats Unis, l’Europe et le Canada sont de 0,05 mg/l, surtout pour des raisons esthétiques telles que la couleur, la turbidité et le goût de l’eau (Santé et Bien être Canada, 1989).
Tableau 3: Concentration de manganèse dans certains aliments
tTnie d’aliment [idela concentration moyenne
___________________
I
(rng/kg)Noix et produits de noix 18,2 1-46,83
Grains et produits de grains 0,42—40,70
Legurnes 2,42—6,73
fruits 0,20—10,38
Jus de fruits et boissons 0,05 — 1 1,47 -______________
Legurnes et produits végétariens 0,42— 6,64
j
Desserts 0,04 —7,98j_Aliments d’enfants 0,17 —4,83
Viande, volaille, poisson et oeufs 0,10— 3,99
Plats mixtes 0,69 —2,98
Condiments, gras, sucreries 0,04 — 1,45
Breuvages (thé inclus) 0,00 —2,09
Soupes 0,19—0,65
Lait et produits laitiers 0,02 —0,49
—u___
3.3 Concentration dans le sol
Les niveaux naturels de Mn varient de 2 à 7000 mg/kg, avec une concentration géométrique moyenne de 330 mg/kg (Shacklette and Boemgen, 1984). Le Mn s’accumule généralement non pas en surface mais bien pius profondément soit dans la fraction sableuse du sol dans une proportion de 60 à 90% tOMS, 1981). Les cations échangeables et la composition de la matière organique favorisent l’absorption du Mn soluble dans le sol.
Peu de données quantifiant l’exposition au Mn associée à l’ingestion du sol ont été rapportées. Toutefois, tenant compte d’une concentration de 2 à 7000 mg de Mnlkg de sol avec une moyenne d’ingestion de 50 mg de sol /jour, la prise moyenne de Mn pour un adulte sera 0,0014 à 5 %g/kg/jour. La moyenne correspondant à un enfant de 10 kg consommant 100 mg de sol par jour sera 0,02 à 70 tg/kg/jour.
4 Toxicocinétique
Le Mn participe à plusieurs réactions d’oxydoréduction (Barbeau, 1984), à des réactions métaboliques en particulier la formation des lipides (Vander et al., 1989), et à la formation des os (Tanaka et al., 1988). Il est présent dans les cellules de tout organisme vivant (OMS, 1981). Il s’accumule dans les organes riches en mitochondries (Liccione et al., 1989) à l’exception du cerveau où sa concentration est faible.
4.1 Absorption
Les principales voies d’absorption du Mn dans l’organisme sont la voie respiratoire et la voie orale. Il semble peu probable que la peau joue un rôle important au niveau de l’absorption, même pour l’exposition aux pesticides tOMS, 1981)
4.1.1 La voie orale
Chez l’être humain, l’exposition au Mn se fait essentiellement par ingestion d’aliments. Le taux d’absorption gastro-intestinale est évalué à 4% tOMS, 1981). Ce taux d’absorption varie selon plusieurs facteurs tels la concentration du Mn et du fe dans le régime alimentaire, l’existence d’une éventuelle carence en Fe, l’âge de l’individu et la nature de la combinaison manganique. Les résultats des études sur l’homme et sur le rat concernant la relation entre l’absorption intestinale du Mn et celle du Fe ont montré que l’absorption intestinale du Mn se produit par transport actif au niveau du duodénum et du jéjunum (Thompson et al., 1971). Une augmentation du Fe peut inhiber l’absorption de Mn dans les cellules muqueuses (Davis et al, 1992). Par contre une déficience en Fe dans la diète augmente l’absorption de Mn et du Cd et peut aussi influencer leur interaction dans le cerveau (Calabrese, 1981). Fevrier (1994) a montré que la mesure de la concentration du Fe sérique permet de se renseigner d’avantage sur la signification clinique des résultats obtenus pour le Mn. L’exposition au Mn augmente considérablement l’absorption et la rétention dti Ph dans le cerveau de rat par un facteur de 2 à 4 dépendamment de la concentration du Pb administré. Par ailleurs, Greger (1999) rapporte que la prise de Fe, phosphore et calcium affecte l’absorption du Mn chez l’humain. Les phytates, les fibres, et le polyphenol dans les plantes tendent a diminué l’absorption du Mn.
4.1.2 La voie respiratoire
Elle constitue généralement la seconde voie la plus importante dans l’absorption du Mn. Cette absorption se fait soit par voie nasale ou buccale et dépend de la taille des particules. Les particules les plus grosses
(
>lOllm), sont retenues par le filtre naso pharyngé ou elles sont éliminées par le réflexe d’éternuement. Les particules < 5 p.mpeuvent être avalées avec le mucus et absorbées dans le tube digestif. Les particules les plus fines qtli se déposent dans la trachée, les bronches et les bronchioles sont éliminées
région alvéolaire du poumon seront absorbées pour se retrouver dans le sang artériel (Abott, 1987).
La dose absorbée par inhalation varie notamment en fonction de la concentration ambiante de Mn, de la taille des particules, de la forme chimique et de la durée d’exposition. Selon Lynam et al. (1990), la dose absorbée par inhalation du Mn est estimée à 0,2 tg/jour, alors que Loranger et Zayed et al. (1995) ont estimé l’apport quotidien du Mn inhalé à moins de 1% de la dose absorbée.
L’OMS (1981) a conclu que l’absorption de sels ou d’oxydes de Mn par voie respiratoire est mal coi-mue et que la majorité des domées disponibles sont basées sur les études animales et que le taux d’absorption est incertain.
4.1.3 La voie olfactive
Totit récemment une autre voie d’absorption a été investiguée il s’agit d’un chemin direct emprunté par les particules à travers le système respiratoire pour arriver au cerveau (Roels et al., 1997). Grâce aux études faites sur les animaux, ce passage débute par la captation du Mn par les neurones olfactifs au niveau du nez ; puis le Mn est acheminé par transport axonal, évitant ainsi la barrière hérnato encéphalique, jusqu’au bulbe olfactif du cerveau, puis dans le noyau gris du SNC (Anderson et al., 1999 ; Ashner et al., 1999).
4.2 Distribution
Le Mn absorbé se distribue par fixation à la transferrine et par transport axonal. La liaison à cette protéine assure une large distribution au niveau sanguin dans l’organisme. Le Mn franchit la barrière placentaire. Les concenti-ations les plus é]evées de Mn dans le corps d’une persornie sans un excès d’exposition, sont retrouvées dans le foie, le pancréas, les glandes surrénales, les reins et les intestins. Des concentrations intermédiaires sont retrouvées dans le cerveau, le coeur et les poumons. Les concentrations les plus faibles se situent dans les os et les tissus adipeux (tableau 4). Selon les données de l’OMS (1981) pour un homme de 70 kg, la charge totale en Mn est d’environ 12 — 20 mg. Sumino et al.
(1975) rapportent une moyenne de 8 mg dans les cadavres de 15 hommes et 15 femmes ayant une moyenne de poids corporel de 55 kg. Le squelette contient jusqu’à 25 % de la charge corporelle du Mn (Keen et al., 1984). Chez les animaux, Roels et al. (1997) rapportent que le Mn administré peut être distribué dans le cerveau et que sa cinétique dépend de la forme chimique du composé de Mn.
4.3 Métabolisme
Un canadien adulte consomme en moyenne 3,7 mg de Mnljour (Santé et Bien Etre Canada, 1990) ; l’ingestion quotidienne par la consommation d’eau est estimée de 10 à 50 g, tandis que l’exposition environnementale par inhalation serait inférieure à 2 g par jour pour la population générale tOMS, 1981). Le Mn ingéré doit passer par le foie pour se trouver dans la circulation sanguine puis se repartir vers les autres organes cibles dont le cerveau.
Comme élément métallique, le Mn n’est pas transformé en d’autres produits, mais il a la capacité de se retrouver sous différents états d’oxydation dans les systèmes biologiques. Les études faites sur les enzymes contenant du Mn, suggèrent qu’il existe une évidence concernant la transformation du Mn02 en Mn03 dans le corps. La conversion du dioxyde
Tableau 4: Niveaux normaux de manganèse dans les tissus
humains et animaux
Adapté de ATSDR (2000) A Tipton et Cook (1963) B Sumino et al. (1975) C Renberg et al. (1982) D Fore et Morton (1952)* Moyenne de cerebrum et cerebellum
-- Pas de dormées
t
Concentration tissulaire (cg MnIg poids humide) — —Tissus r Humain Rat Lapin
C
D
ReinI
• foie 1,681 1,2 2,1 Pancréas[ 1,21 -- 1,6 Glandes surrénalesE
0,20 0,69 2,9 0,67 0,93 0,56 0,9—1,0 1,2 Cerveau—}—-
0,34 0,30*F
0,4 0,36 Poumon [0,34 0,22 -- 0,01 Coeur r—i 0,21 -- 0,28 [iÏiies 0,20 0,4 0,36[
Ovaire r0,19 0,19F
-- 0,60 [Muscles 0,09 0,09 -- 0,13 rro,22i 0,08{
0,3 0,22[JZ
0,07t
----rdT--__
Pituitairet-- --f
O5t
2,4de Mn en trioxyde de Mn est catalysée par la Œ-globuline (Anderson et al., 1999). Cette réaction peut être augmentée par la haute affinité de la transferrine au trioxyde dc Mn. Cependant, le Mn peut former des complexes avec une variété de ligands. Ces complexes incluent 1) complexes de faibles poids moléculaire avec la bicarbonate, la citrate ou d’autres ligands ; 2) complexes échangeables avec l’albumine ; 3) complexes hermétiquement liés avec les protéines comme la transferrine et a2-rnacroglobuline. Le Mn peut assumer un rôle structural dans les métalloprotéines comme la mitocondriale superoxyde dismutase, la pyruvate décarboxylase, l’hydrolase sélectif du foie, les déhydrogénases, les kinases, la décarboxylase et les transférases (US EPA, 2002).
De plus le Mn intervient dans la synthèse des lipides (Vander et al., 1989) et le métabolisme des protéines et glucides (Keen et al., 1999). Il active aussi la synthèse du sulfate de chondroitine nécessaire à la formation des tissus conjonctifs et cartilagineux (Saric et al., 1986).
4.4 Elimination
Une fois métabolisé dans le foie, la première voie d’élimination du Mn est par les fèces à travers la bile (Davis et al., 1992). L’excrétion urinaire est faible (Lauwerys, 1990) et évaluée à 3 ig/l chez l’homme (1NRS, 1991), représentant ainsi 0,1- 0,3 ¾ de l’apport quotidien tOMS, 1981). Alternativement, il existe d’autres voies d’excrétion. Des études sur les rats, menées par Bertinchamps et al. (1966), Cotzia et al. (196$), Kato (1963) et Papavasiliou et al. (1966) ont démontré une excrétion directe du Mn à travers les parois de l’intestin. Cette voie est évidente en cas d’obstruction biliaire ou suite à l’absorption d’une forte dose de Mn. La sueur, le placenta et les cheveux sont d’autres voies d’excrétion (Saric, 1986). Pour un adulte en bonne santé, Mena et al. (1969) ont signalé une hémikrèse de 37
j
pour l’ensemble de l’organisme contre 23j
chez des patients anémiés. La demi-vie est de 25 jours au niveau du foie, 57j
dans la cuisse, 54j
dans lecerveau humain (Cotzia et al., 1968). Cette hérnikrèse s’élève à 74 jours dans le cerveau
du rat (Zheng et al., 2000) et 278
j
dans le cerveau d’un singe (Saric, 1986).5 Estimation de la toxicité
5.1 Dose— réponse pour effet non cancérigène
Même si le Mn est un élément essentiel, plusieurs maladies chez l’humain ont été associées à l’excès ou à la déficience en Mn. La dose de référence par voie orale (RfD) est basée sur l’existence d’un seuil pour des effets toxiques telle que la nécrose cellulaire. Elle est exprimée en mg/kg/jour. La concentration de référence par inhalation (RfC) est
expriméeen 1g/m3.
5.1.1 La détermination de la dose de référence (RfD)
La RfD est l’estimation de l’exposition journalière acceptable pour la population générale (incluant les sous groupes sensibles) sans risque nuisible durant toute la vie.
Plusieurs études ont été menées potir l’exposition par voie orale chez l’humain
-NRC (1989) le Conseil National de Recherche a déterminé une prise journalière sécuritaire en Mn de 2-5 mg/jour pour l’adulte, se basant sur l’étude de McLeod et Robinson (1972) qui rapportent une balance positive suite à une prise de 2,5 mgMnljour. - Freeland-Graves et al. (1987) se basant sur l’analyse de plusieurs études, suggèrent une
valeur entre 3,5 — 7 rng/jour pour un adulte.
- L’Organisation Mondiale de la Santé (OMS, 1973) a procédé à l’analyse de plusieurs
études faites sur le régime alimentaire de l’adulte et a rapporté qu’une consommation
journalière moyenne entre 2 — 8,8 mgMnljour. Selon cet organisme, une dose de 8-9
En général, la RfD n’est pas dérivée des études faites sur les rongeurs, parce que ces derniers ne présentent pas les mêmes déficits neurologiques que peut avoir l’être humain après une exposition au Mn. La combinaison de ces informations a permis à l’us EPA de déterminer une dose de référence pour le Mn à 10 mg Mnljour soit 0,14 mgMnlkg/ jour pour unadulte de 70 kg.
5.1.2 La détermination de la concentration de référence (RfC)
En général, la RfC est une estimation de l’exposition quotidienne par inhalation acceptable pour l’ensemble de la population sans effets toxiques au cours de la vie. La RfC pour le Mn a été dérivée par l’US EPA (1993) à partir de deux études épidémiologiques sur des travailleurs exposés aux poussières de dioxyde de Mn dans les études de Roels et al. (1987 et 1992) impliquant des expositions professionnelles.
- Roels et al. (1992): Les auteurs ont réalisé une étude dans une usine de batteries alcalines sur 92 travailleurs de sexe masculin exposés à la poussière de dioxyde de Mn (Mn02). Ces sujets ont été croisés avec 101 témoins appariés selon l’âge, la taille, le poids, le type de travail et la consommation d’alcool, de café et de cigarettes. La méthode d’évaluation comprenait des tests neurocomporternentaux. L’analyse des résultats a montré une prévalence élevée d’effets néfastes chez les travailleurs exposés tel que le temps des réactions simples, la coordination main-oeil et la stabilité de la main.
- Roels et al. (1987): Cette étude a été effectuée sur 141 travailleurs de sexe masculin exposés au Mn02, Mn304 et différent sels de Mn (sulfates, carbonates et nitrates). Les sujets étaient comparés à 104 témoins. La méthode comportait des examens netirologiques, des tests des fonctions neurocomportementaux (durée des réactions
simples, la mémoire courte, la coordination oeil-main, le tremblement des mains) et un test de sang et d’urine. L’analyse des résultats montrait une différence significative entre les exposés et témoins pour les tests de durée de la réaction visuelle, la coordination main-oeil, la stabilité des mains et la mémoire audiovisuelle à court terme. La prévalence des scores anormaux pour la coordination main-oeil et le tremblement des mains variaient en fonction d’une relation dose-réponse avec le taux de Mn sanguin. Pour le test de la mémoire courte, il était plutôt relié aux années de travail mais pas au Mn sanguin.
Honnis l’EPA, d’autres organismes de réglementation ont défini des normes d’exposition par inhalation. L’OMS (2000) a établi un seuil d’exposition de 0,15 tg/m3 pour le Mn atmosphérique, tandis que la Communauté Urbaine de Montréal (CUM, 1987) l’a fixé à 40 tg/m3. En milieu professionnel les limites d’exposition chez les travailleurs ont été fixées par OSHA (1981) à 1000 1g/n13 pour les fumées et poussières de Mn sur une période de 8 heures. Il y a environ une dizaine d’aimée, 1’ACGTH (1996) a établi une nouvelle valeur limite de 200 1g/m3pour la poussière et la fumée de Mn. Au Québec les nonnes établies par le Règlement sur la Santé et Sécurité du travail (Lois et règlements du Québec, 2001) sont de 1000 tg/rn3 pour la fumée de Mn et de 5000 tg/m3 pour la poussière de Mn.
6 Effets sur la santé
Compte tenu de sa toxicité relativement faible, peu d’intoxications aigus ont été rapportées chez l’humain. La première observation d’intoxication chronique au Mn fut faite par Couper en 1837 qui rapporta une maladie paralytique chez les travailleurs d’une usine de dioxyde de Mn . La description des effets reliés à une intoxication chronique
chez l’humain ou chez l’animal a, par la suite, fait l’objet de nombreuses recherches. D’après Iregren et al. (1990) l’exposition de mineurs et d’autres travailleurs industriels à des concentrations < 1 mg de Mnlm3 a montré des effets sur les systèmes respiratoire,
neurologique et reproductif. Il existe peu d’informations au sujet de son pouvoir
cancérigène.
6.1 Toxicité pulmonaire
Le Mn peut causer une toxicité considérable dans le système respiratoire, en fonction de
la nature des particules qui rentrent dans la composition de ses composés.
Une augmentation de l’incidence de pneumonie a été signalée chez des ouvriers d’une fabrique de permanganate de potassium. L’incidence de la pneumonie atteignait 26 pour 1000 contre 0,73 pour 1000 chez le groupe témoin, alors que la concentration
atmosphérique pouvait atteindre 14 mg/rn3 (Lloyde-Davies, 1946).
Des augmentations des symptômes respiratoires (pneumonie et bu bronchite) ont aussi été rapportés parmi des travailleurs exposés (Wasenrian et Mikhail, 1961 ; Roels et al., 1987) et chez des personnes habitant proche des usines de production d’alliage de Mn (Nogawa et al., 1973).
Chez l’animal, dans une étude sur la contribution de la dissolution des particules dans la clearance pulmonaire du sulfate de Mn, du phosphate de Mn et tétraoxyde de Mn chez des rats lors d’une exposition par instillation intratrachéale, Vitarella et al. (2000) suggèrent que le mécanisme de dissolution joue un rôle dans la clearance pulmonaire du MnSO4 seulement, une forme soluble du Mn, alors que le mécanisme de transport est prédominant pour les formes les moins solubles de phosphate et d’oxyde de Mn.
6.2 Neurotoxicité
Le système nerveux est l’organe cible du Mn; plus précisément les noyaux gris (le ganglion basal), soit le noyau caudé, le putamen et le globus palludis. Les noyaux gris seraient responsables de la motricité et leur atteinte peut entraîner des contractions incontrôlés des muscles squelettiques. La neurotoxicité du Mn inhalé peut être reliée à
l’accumulation de ce métal dans le cerveau via les neurones olfactifs, étant donné que le cerveau retient le Mn plus longtemps soit dc 21 jours (Gianutsos et al., 1985) à 3 mois (Gallez et al., 1997) suivant l’exposition. Plusieurs évidences ont été observées chez des travailleurs de mines, de raffineries et de fonderies de manganèse. Les travailleurs subissant une forte exposition développent un syndrome classique connu sous le nom de manganisme (Edsall et al., 1919 ; Rodier et al., 1955 ; Whitlock et al., 1966). Le
rnanganisrne est une maladie du SNC caractérisé par trois stades
1et stade : somnolence, anorexie, douleurs musculaires, excitation mentale, rire
incontrôlé, trouble psychologique, changement de personnalité, altération de la mémoire, action compulsive, hyposexualité.
2e stade: troubles psychologiques, changements de la personnalité, hallucinations,
troubles des mouvements, hyperréfléxie des membres inférieurs.
3e stade : bradykinésie, dystonie, trouble de la marche, rigidité musculaire, masque facié.
Le manganisme est une maladie ressemblant à la maladie de Parkinson. A un stade précoce, il peut être réversible.
À
un stade avancé il peut persister (Cotzias et al., 1968) et mêmeprogresser(Rodier, 1955 ; Huang et al., 1993) même après l’arrêt de l’exposition.La toxicité chronique dti Mn a été investiguée en utilisant des tests
neurocomportementaux sensibles (Iregren, 1994).
- Siegl et Bergert (1982) ont examiné l’exposition de 25 soudeurs allemands
21 témoins montre un prolongement significatif du temps des réactions chez les soudeurs.
Iregren (1990) a réalisé une étude dans une fonderie de manganèse en Suède, sur 30 sujets exposés et 60 sujets témoins. Le niveau d’exposition des travailleurs était relativement faible avec une moyenne de 0,025 mg!m3. L’exposition au Mn était associée àune faible performance aux tests de réaction comme le tapotement des doigts.
Weimberg et al. (1991) ont effectué une étude sur 30 travailleurs asymptomatiques dans deux fonderies d’acier suédoises, où le niveau de Mn dans l’air était de 0,18 mg/m3 et 0,41 mg/m3. Le groupe contrôle comprenait 60 personnes. Il a été observé chez les travailleurs une fréquence de plainte de fatigue, des mouvements longs, une baisse de libido, un prolongement du temps de réaction et un affaiblissement du tapotement des doigts.
Mergier et al. (1994) ont étudié 74 travailleurs d’usine de production d’alliage de Mn au Québec avec 74 témoins. Les travailleurs étaient exposés à une moyenne géométrique de 0,89 mg/m3 pendant 16,7 aimées de travail. Comparés aux témoins, les exposés rapportaient plus de symptômes de fatigue, des changements d’humeur, une perte de mémoire, l’occurrence de cauchemars, des difficultés du langage, des dysfonctions sexuelles, un tremblement des mains, et de l’anxiété. Lucchini et al. (1995) ont réalisé une étude dans une usine italienne d’acier, sur 58 travailleurs exposés ati Mn et dont l’exposition a diminué de 1,6 mg/m3 à 0,3 mg/rn3. Bien que le temps des réactions simples n’était pas affecté chez ces travailleurs, les tests de mémoire étaient affectés et montraient une relation dose réponse.
Ces résultats démontrent fortement que la motricité et la mémoire étaient affectées par l’exposition à des niveaux relativement bas de Mn.
6.3 Effets sur ta reproductivité
Une étude basée sur les résultats d’un questionnaire administré à 85 travailleurs exposés au Mn, rapportait une diminution de la fertilité durant la période d’exposition par rapport aux témoins
(
Lauwerys et al., 1985). Alors qu’une autre petite étude ne signale aucun effet de l’exposition au Mn sur la fertilité paternelle. Le peu de données existantes à ce niveau conduit à considérer le Mn comme un potentiel toxique sur la reproductivité, ce qui nécessite d’autres investigations.Chez l’animal, des rats mâles soumis à un régime riche en Mn montrent une diminution de la taille des testicules, des vésicules séminales et des glandes preputial, sans signe
neurologique visible comme le tremblement ou l’ataxie (Gray et Laskey, 1980). L’exposition des rats au tétrahydrate de Mn pendant la grossesse est associée à une toxicité maternelle (réduction du poids et de l’alimentation) avec une toxicité foetale (réduction du poids et augmentation des malformations) (Sanchez et al., 1993).
7 Méthode d’analyse du Mn
Il existe deux méthodes généralement utilisées pour l’analyse chimique du Mn. Il s’agit de l’activation neutronique et de la spectroscopie d’absorption atomique.
7.1 L’activation neutronique
Elle consiste à placer l’échantillon dans un réacteur nucléaire afin de lui faire subir, pendant 10 minutes, une irradiation à un flux de 1012 neutrons/cm2/s. Le bombardement neutronique transforme les éléments de l’échantillon en isotope radioactif soit pour le Mn, le Mn56, qui émettra des rayons gamma. L’énergie et l’intensité de ces rayons seront ensuite décelées, pendant 10 min par un détecteur à germanium. L’énergie produite par
ces rayons sera convertie en un spectre de voltage dont l’amplitude sera proportionnelle à la quantité de Mn présent dans l’échantillon.
Cette méthode est fiable, permet une rapidité d’exécution et possède une sensibilité élevée. La limite de détection de l’activation neutronique se situe à 0,002 jig/g (Kennedy, 1990)
7.2 La spectroscopie d’absorption atomique
L’élément a analysé doit être extrait à l’acide puis atomisé pour faciliter la transmission lumineuse à une longueur d’onde de 279,5 mii (Baruthio et al., 1988), choisi en fonction de l’absorption énergétique de l’élément étudié. Cette transmission lumineuse est détectée à l’aide d’un mono-chromètre et d’une flamme air-acétylène pour l’atomisation du Mn (Chow, 1995).
Cette méthode est utilisée pour doser le Mn dans l’eau, l’air et les milieux biologiques, et aussi pour mesurer des concentrations de Mn échangeable dans le sol après extraction dans une solution de chlorure de baryum (Hendershot et Duquette, 1986). C’est une méthode d’analyse simple et rapide (OMS, 1981).
$ Objectif de l’étude
Avec l’augmentation substantielle de l’utilisation du MMT dans l’essence canadienne, plusieurs questions se posent concernant son impact sur le niveau de contamination par le Mn sur la santé. Les études faites dans la région montréalaise indiquent un niveau élevé de Mn dans des zones urbaines, en particulier dans les secteurs à fort densité de trafic automobile. En s’intéressant à la vie quotidienne de la population montréalaise, on
constate que plusieurs passent beaucoup de temps dans les moyens de transport en particulier dans le métro. Le métro de Montréal est totalement souterrain, partiellement fermé et son aération se fait par un système de ventilation puisant l’air à l’extérieur sans aucune filtration. Parmi les 64 stations couvrant les quatre coins de l’île de Montréal, certaines sont proches de zone caractérisées par de forte densités de trafic (exp autoroute), comme les stations Narnur et Crémazie,
Objectif de l’étude
La présente recherche vise à mesurer la concentration de Mn dans l’air du métro de Montréal et à évaluer la relation avec la densité de trafic.
Manganese concentrations in the air of the Montreat (Canada) subway
in relation to surface automobile traffic densïty
Nacéra Boudia’, Renée Halley2, Greg Kennedy3, Jean Larnbert4, Lise Gareau1, Joseph Zayed’
ITOXHTLJM (Human Toxicology Research Group) and Department of Environrnental and
Occupational Health, 4Department of social and preventive medicine, Faculty of Medicine, University of Montreal; 2 Transport Montreal Society; Department of Engineering Physics, Ecole Polytechnique de Montréal, Montreal.
To whom requests for reprints should be sent: Josepli Zayed, Ph. D.
Departrnent of Environmental and Occupational Health Faculty of Medicine University of Montreal C. P. 612$ Succursale Centre-ville, Montreal, Quebec Canada, H3C 3J7 Telephone: (514) 343-5912 Fax: (514) 343-2200 e-mail:
ABSTRACT
Methylcyclopentadienyl manganese tricarbonyl (MMI) is an organic derivative of manganese (Mn), used since 1976 in Canadian gasoline as an octane enhancer. Its combustion leads to the emission of Mn particles. Several studies carried out by our research group have established a correlation between atmospheric Mn concentrations and automobile traffic density, suggesting that MMI in gasoline could play a significant roÏe. This study aims to measure Mn concentrations in the air of the underground subway in Montreal (Canada) and to examine the relation with nearby surface automobile traffic density and, by extension, with the use of MMT in gasoline. Three subway stations were chosen for their location in different rnicroenvironrnents with different traffic densities. Respirable (MnR < 5 tm) and total Mn (MnT) were sarnpled over two weeks, 5
days/week, l2hlday. For the station located in the lower traffic density area, relatively low levels ofMnR and MnT were found, with averages of 0.019 ig/m3 and 0.032 jtg/m3 respectively. These concentrations are within the range of the background levels in Montreal. For the other two stations, the average concentrations of MnR were twice as high and exceeded the US EPA reference concentration of 0.05 ig/m3. Although there may be several sources of Mn from different components of the subway structure and vehicles, no correlation was found between subway traffic and atmospheric Mn in the subway. Since the air in the underground subway is pumped directly from outside without filtration, our findings strongly suggest that the combustion of MMT in automobiles is an important factor.
Introduction
Manganese (Mn) is an abundant element, making up about 0.1% of the earth’s crust (ATSDR. 2000). It can be emitted by various anthropic sources. The main sources are associated with ferromanganese and steel production, and the mining industry (Keen and
Leach, 1988). In Canada, the total anthropogenic emissions of Mn were estirnated at 1225 tons in 1984, including Mn from industrial facilities and Mn from gasoline powered motor vehicles using MMT (methylcylopentadienyl manganese tricarbonyl) (Jacques, 1987). MMT is an organic derivative of Mn used as an antiknock agent in gasoline. $ince its introduction in 1976 in Canada, the use of MMT substantially increased and cornpletely replaced tetraethyl lead in 1990. The allowable level ofMMT in the Canadian gasoline is 0.018g MnIl (Wood and Egyed, 1994). The combustion ofgasoline containing MMT leads to the emission of Mn phosphate, Mn sulfate and Mn phosphate/sulfate mixture with particle sizes between 0.2 and 10 cm: 86% are less than 1tm (Ardeleanu et al., 1999). Based on a realistic ernission rate scenario, these emissions were estimated at 86,000 kg in 1999 in Canada (Zaycd et al., 2003).
The use of MMT in Canadian gasoline has resulted in public concenis related to the potential health effects of increased Mn exposure. Even if Mn is an essential element for human tife, at high levels it may be toxic and affect the respiratory and neurological systems. The toxicological effects have been investigated and reported in rnany studies, including those of Roels et al (1987) and Mergier et al (1994), who observed neurobehavioral dysfunctions related to occupational exposure to Mn.
Several papers have been published concerning the levels of airborne Mn in Montreal (Loranger et ai 1994; Loranger et Zayed 1997). Air concentrations are in general below the US EPA reference concentration (RfC) of 0.05 Lg/rn3 for respirable Mn, but they may be higher in specific areas (Boité et ai, 2004). This RfC is iower than Canadian or the WHO reference concentrations of 0.11 ,ig/rn3 (Wood and Egyed, 1994) and 0.15 g/m3 (WHO, 2000), respectively. Loranger et ai (1994) found that ambient Mn concentrations are correlated with traffic density. Areas with medium and high traffic densities had ambient Mn concentrations above the natural background level of 0.02 jig/rn3 (PM5) in Montreai (Loranger and Zayed, 1997). A rather high Mn concentration of 0.13$ tg/m3 (PM5) was measured in an underground parking garage in Hamilton, Canada (Thibauit et ai, 2002). In this case, industry could be the main source. In fact, Hamilton lias some of the highest measured levels of ambient Mn in Canada due to the very large presence of steel and reiated industries, which could explain why leveis were higher.
Severai studies were aiso carried out to measure personal exposure. PM5 Mn concentrations obtained from taxi drivers in Montreal ranged from 0.007 to 0.032 tg/m3, which are significantly different from those of office workers (Zayed et ai., 1996). A popuiation-based study conducted in Toronto reported an average concentration for personat non occupationai (aduit) exposure of 0.008 ig/m3 for PM2.5 Mn, whule the 99th percentile was 0.0 125 Lg/1T13 (Peiiizzari et al., 1999).
Montreai lias an underground subway with stations located in microenvironrnents charactehzed by different traffic density. Air is pumped into the stations from outside
without filtration. We hypothesized that Mn concentrations in three seÏected stations may vary according to the volume of nearby surface automobile traffic. The aims of this study are improve our knowledge of human exposure to Mn by measuring the Mn concentration in the air of the underground subway in Montreal, and exarnining the relation with traffic density and, by extension, with the use ofMMT in gasoline.
Materials and methods
Selection oftÏie subway stations
Three subway stations were selected in three areas of Montreal with different traffic densities. Jean Drapeau station is located on St. Helen’s Island with almost no automobile traffic (less than 1000 vehicles per day within 100 m). Snowdon station is in an urban area with medium traffic density (23,861 vehicles per day within 100 m; data obtained from the City of Montreal). Namur station is near a highway with high traffic density (1 86,000 vehicles per day within 100 m; data obtained from the Quebec Ministry of Transports).
Air scunpliitg
Respirable Mn (MnR<5trn) and total Mn (MnT) were sampled simultaneously in the three stations, about 25 ni below ground level for two consecutive weeks (beginning 22 Sept. 2003), 5 days a week (weekdays only), 12 hours per day, from 6:00 AIVI to 6:00 PM. Two Gilian pumps (Gilian corp. west Caldwell, NJ) equipped with Teflon filters (37 mm diameter, 0.45 im pore size) were used in each station. The MnR sampling pump included a size-selective cyclone (SKC series 225 impactor). The purnps were placed at 2 m height along the platform and 2 m from the track.
The pumps were adjusted to a constant flow rate of 1.5 L/rnin for MnT and 1.7 L/min for MnR. The ftow rate was calibrated each day before and after sampling. Filters obtained after sampling were folded in a sheet of parafilrn (parafiim M laboratory film, American
National Can, Chicago, IL 60631, USA) to prevent the Ïoss ofparticles and then inserted into a clean labeled polyethylene vial.
Chemical anaÏysis offitters
Ail ifiters were analyzed by neutron activation (Kennedy, 1990). First, each vial was placed into a larger polyethylene irradiation viai. With a pneumatic transfer system, the sample was sent to the irradiation site near the core of the Ecole Polytechnique nuclear reactor (model Slowpoke-2). Irradiation was for 10 min at a neutron flux of 5.53 x 1011
neutrons/crn2/s. The filter was then transferred to a non-irradiated polyethylene vial and placed in front of a gamma ray detector (Canberra industries, germanium semiconductor) for 10 min counting tirne. The gamma-ray spcctnirn was recorded and the total amount of Mn in each sampÏe was determined from the number of gamma-rays detected in the 6Mn peak at 846.7 keV.
AlufromSU&wav materiaÏs
Mn sarnpied in the underground subway could be drived from sources within the subway system. Three materials containing Mn were identified: the rails, the guiding rod and the switches. The Mn concentrations in these three materials are given in Table 1. Considering that Mn may be released from the main rails and the guide rails by wear, the number of subway cars per day going through each station during the sampling period was determined. These data could thus 5e used to determine a possible coirelation between the Mn concentration in the air in a station and the arnount of subway train traffic.
Statistical anatysis
Descriptive statistics (mean, minimum, maximum, standard deviation) were calculated for both MnR and MnT. A comparison of Mn concentrations between stations was done using the t-test (rnatched data). The mean Mn concentration in the air of a station was divided by die number of subway cars going through during the sampling period and the comparisons of Mn concentrationlsubway-car in the three stations were done using the t-tests.
Resuits
The Mn concentrations of 57 samples obtained in the three subway stations ranged from 0.012 ig/rn3 to 0.15 1 tg/m3 for MnR and from 0.017 jig/m3 to 0.215 tg/m3 for MnT. The highest means ofMnR and MnT were obtained in the Narnur station with 0.130 tg/m3 and 0.l71ig/m3, respectively, which were 7 and 5 tirnes higher, respectively, than those obtained in the Jean Drapeau station (Table 2).
The ratio ofMnR to MnT varied from 67% to 76%, with a mean of 71% (Table 3). The mean MnR concentrations at the three subway stations varied from 0.01$ ± 0.007 to 0.130 ± 0.013 tg/m3 and they were significantly different (P< 0.001). For MnT the mean concentrations ranged from 0.032 ± 0.012 to 0.171 ± 0.023 (jig/m3) and were also significantly different among the three stations (P<0.001) (Table 4).
The mean numbers of subway cars per sampling day were 1731.3 at Jean Drapeau, 2646.9 at Narnur and 3718.2 at $nowdon. When the ratios of Mn concentrationlnumber ofsubway cars were caÏculated, significant differences (p<O.00Ï) were found between the stations (Table 5).
finally, figure 1 shows the Mn concentrations in the three subway stations in relation to outside automobile traffic densities.