Développement de nanoparticules de silice
mésoporeuse multifonctionnelles :
Synthèse, caractérisation et applications biomédicales
Thèse
Meryem Bouchoucha
Doctorat en Chimie
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Meryem Bouchoucha, 2017
Développement de nanoparticules de silice
mésoporeuse multifonctionnelles :
Synthèse, caractérisation et applications biomédicales
Thèse
Meryem Bouchoucha
Sous la direction de :
Freddy Kleitz, directeur de recherche
Marc-André Fortin, codirecteur de recherche
René C.-Gaudreault, codirecteur de recherche
iii
Résumé
Les nanoparticules de silice mésoporeuses (MSNs) sont des matériaux prometteurs pour les applications biomédicales en raison de leurs propriétés uniques : leur taille modulable, leur grande surface, leur grand volume poreux, leur morphologie ajustable, et leur surface aisément modifiable. L’objectif principal de cette thèse était de contrôler ces paramètres afin de développer des MSNs multifonctionnelles pour la livraison des médicaments et l’imagerie biomédicale. Tout d’abord, une stratégie de fonctionnalisation sélective de la surface externe des MSNs a été développée pour éviter la perte de porosité due aux procédures conventionnelles de greffage. Un polymère biocompatible (le polyéthylène glycol) et une molécule sonde d’imagerie par résonance magnétique (IRM) ont été utilisés. Cette fonctionnalisation a mené à la conception de nanoparticules à fort potentiel pour la mise au point d’applications thérapeutiques et de diagnostic. Les nanoparticules obtenues se caractérisent par un fort potentiel de contraste en IRM, par une capacité élevée de chargement des médicaments, et par une aptitude à assurer une libération contrôlée des médicaments dans des conditions physiologiques. Ensuite, le contrôle de la taille des MSNs et de leur chimie de surface ont permis un meilleur contrôle de la capacité de piégeage et de relargage des médicaments (exemples : des agents anticancéreux). Ils ont permis également une amélioration de leur internalisation, de leur rétention cellulaire, de leur ciblage, de leur diffusion dans les matrices cancéreuses et de leur action anti-tumorale. Les meilleures performances ont été obtenues avec les nanoparticules de petites tailles (<50 nm) et fonctionnalisées avec des groupements phosphonates. Par la suite, afin de développer le potentiel de ciblage de ces produits, les particules ont été fonctionnalisées avec l’anticorps "Ri7" ciblant les cellules endothéliales de la barrière hématoencéphalique. Lors de tests in vitro et in vivo, les nanoparticules Ri7-MSN de 50 nm se sont accumulées spécifiquement et massivement dans ces cellules. Ces résultats ouvrent les portes sur l’utilisation potentielle de telles nanoparticules pour la livraison de médicaments aux cellules endothéliales de la barrière hématoencéphalique, qui sont impliquées dans plusieurs maladies du système nerveux central. Finalement, la fonctionnalisation de la surface des MSNs par des composés fluorés et des chélates de gadolinium a permis de développer des nanoparticules comme sondes potentielles pour l’IRM binucléaire (IRM du proton et du fluor). Ces particules se caractérisent par leurs excellentes propriétés relaxométriques et par leur potentiel à être détectées et à générer un contraste positif dans les images d’IRM. En résumé, l’ensemble de ces travaux a permis de concevoir de nouvelles voies prometteuses pour le développement de nanovecteurs de silice mésoporeuse pour des applications éventuelles en thérapie et en diagnostic.
iv
Abstract
Mesoporous silica nanoparticles (MSNs) have emerged as promising nanomaterials for biomedical applications owing to their unique properties: tunable size, high surface area, large pore volume, adjustable morphology and easily modifiable surface. The main objective of this thesis is to control these parameters to develop multifunctional MSNs for drug delivery and biomedical imaging. First, a selective surface functionalization strategy of MSNs was developed. Magnetic resonance imaging (MRI) probe molecule and polyethylene glycol was grafted preferentially at the outer surface. This approach is a straightforward and efficient strategy that leads to the design of potential theranostic nanoparticles without porosity loss and with high drug loading capacity. These nanoparticles not only have a remarkable MRI positive contrast enhancement but also allow a controlled drug release in physiological conditions. Then, the particle size control and surface chemistry functionalization of MSNs led to better control over loading and release of positively charged drug (doxorubicin (Dox) was used as an anticancer drug model), intracellular drug release efficiency, intratumoral diffusion, as well as tumor growth inhibition and therapeutic efficiency. Better performances were obtained with small phosphonated nanoparticles (< 50 nm). Afterwards, we demonstrated, both in vitro and in vivo, the impact of size and bioconjugation of MSNs with the antibody "Ri7" on the specific targeting of blood brain barrier endothelial cells (BMEC). 50 nm Ri7-MSN nanoparticles were shown to accumulate specifically and massively in BMEC. These results open the door to the potential application of such nanoparticles for therapeutic drug delivery to the endothelial cells of the blood-brain barrier, which are involved in several central nervous system diseases. Finally, labeling MSNs with fluorine compounds and gadolinium chelate molecules led to the development of nanoparticles as potential binuclear MRI probes (1H and 19F). These nanoparticles have shown their excellent relaxometric properties and their ability
to be detected and generate a positive contrast in 1H and 19F MRI image. All this work represents a significant
advance in the design of high colloidal stability silica-based nanovectors, which could provide novel theranostic nanocompounds.
v
Tables des matières
Résumé ... iii
Abstract ... iv
Tables des matières... v
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations et des sigles ... xv
Remerciements ... xix Avant-propos ... xxii Introduction ... 1 Mise en contexte ... 1 Objectifs ... 3 Structure de la thèse ... 5 Chapitre 1 : Théorie ... 7
1.1 Synthèse des nanoparticules de silice mésoporeuse (MSNs) ... 7
1.1.1 Mécanismes de synthèse ... 9
1.1.2 Contrôle de la taille des pores des MSNs ... 11
1.1.3 Contrôle de la forme des MSNs ... 11
1.1.4 Contrôle de la taille des MSNs ... 11
1.1.4.1 Influence du pH ... 12
1.1.4.2 Influence de la dilution et de la présence d’agents stabilisants ... 13
1.1.4.3 Influence des ratios molaires des réactifs ... 14
1.1.4.4 Influence des co-précurseurs de silice : ... 14
1.2 Chimie de surface et stabilité colloïdale des MSNs ... 15
1.3 Fonctionnalisation de la surface des MSNs... 17
1.3.1 Fonctionnalisation de la surface par co-condensation ... 17
1.3.2 Fonctionnalisation de la surface par post-greffage ... 18
1.3.3 Greffage sélectif de la surface interne et externe des MSNs : ... 19
1.3.3.1 Greffage sélectif par co-condensation ... 19
1.3.3.2 Greffage sélectif par post-greffage ... 20
1.3.4 Revêtement polymérique ... 22
Greffage du polyéthylène glycol (PEG) ... 22
1.4 Marquage des MSNs avec des sondes d’imagerie biomédicale (imagerie par résonance magnétique (IRM) et imagerie optique) ... 23
1.4.1 Marquage des MSNs avec des sondes d’IRM ... 23
1.4.1.1 IRM du proton (1H) et du fluor (19F) ... 23
1.4.1.2 Marquage des MSNs avec agents de contraste en IRM du 1H ... 24
Les agents de contraste en IRM du 1H ... 24
Marquage des MSNs avec des chélates de gadolinium ... 26
1.4.1.2 Marquage des MSNs avec des sondes d’IRM du 19F ... 28
1.4.2 Marquage des MSNs avec des fluorophores ... 29
1.5 MSNs pour la vectorisation des médicaments ... 30
1.5.1 Paramètres influençant le ciblage et l’internalisation des MSNs par les cellules ... 30
1.5.1.1 Taille des MSNs ... 30
1.5.1.2 Charge de la surface ... 32
1.5.1.3 Greffage de ligands de ciblage ... 32
L’anticorps Ri7 comme ligand ciblant les cellules endothéliales de la barrière hématoencéphalique ... 33
vi
1.5.2.1 Surface spécifique et porosité... 35
1.5.2.2. Morphologie des particules ... 36
1.5.2.3. Chimie de surface ... 37
1.5.2.4 Stabilité de la silice à l’hydrolyse ... 38
1.6 Techniques de caractérisation : ... 39
1.6.1 Diffraction des rayons X (DRX) ... 39
1.6.2 Physisorption d’azote ... 41
1.6.3 Microscopie électronique à transmission (MET) ... 42
1.6.4 Diffusion de la lumière en mode dynamique (DLS) ... 43
1.6.5 Potentiel zêta ... 44
1.6.6 Analyse thermogravimétrique (ATG) ... 45
1.6.7 Spectroscopie par résonance magnétique nucléaire (RMN) ... 45
1.6.8 Spectroscopie infrarouge à transformée de Fourier (FTIR) ... 46
1.6.9 Spectroscopie de photoélectrons induits par rayons X (XPS) ... 46
1.6.10 Spectroscopie ultraviolet-visible (UV-Vis) ... 47
1.6.11 Spectrométrie de masse couplée à un plasma inductif (ICP-MS) ... 47
1.6.12 Microscopie optique à fluorescence ... 48
1.6.13 IRM et relaxométrie ... 48
1.6.14 L’algorithme Voronoi tesselation_EBImage R package……….50
Chapitre 2 – Article 1 : Mesoporous Silica Nanoparticles: Selective Surface Functionalization for Optimal Relaxometric and Drug Loading Performances ... 52
Résumé ... 53
Abstract ... 54
2.1 Introduction ... 55
2.2 Results and Discussion ... 57
2.2.1 Synthesis and Physicochemical Characterization ... 57
2.2.2 1H Relaxometric Properties ... 65
2.2.3 Colloidal Stability ... 67
3.2.4 Biocompatibility and Viability Test ... 68
2.2.5 Drug Loading and In vitro Drug Release ... 69
2.3 Conclusion ... 72
2. 4 Experimental section ... 73
2.4.1 Materials ... 73
2.4.2 Mesoporous Silica Nanoparticles Synthesis ... 73
2.4.3 MSNs Textural Properties and Thermogravimetric Analysis ... 74
2.4.4 Particle Size and Physicochemical Analysis ... 75
2.4.5 MSNs Drug Loading and In vitro Drug Release Assays ... 76
2.4.6 Cell Viability Study ... 76
2.5 Supporting Information ... 77
2.6 Acknowledgements ... 83
Chapitre 3 – Article 2 : Size-Controlled Functionalized Mesoporous Silica Nanoparticles for Tunable Drug Release and Enhanced Anti-Tumoral Activity ... 84
Résumé ... 85
Abstract ... 86
3.1 Introduction ... 87
3.2 Results and Discussion ... 89
3.2.1 Synthesis and Characterization of Different-Sized MSNs. ... 89
3.2.2 Drug Loading, in vitro Drug Release Profiles, and Phosphonate Grafting ... 95
3.2.3 Cell Uptake Studies and Biocompatibility ... 101
3.2.4 Intracellular Drug Release and in vitro Cytotoxicity ... 103
vii
3.3 Conclusion ... 110
3.4 Experimental Section ... 111
3.4.1 Materials ... 111
3.4.2 Small-Sized MSNs (45 nm Diameter) ... 111
3.4.3 Intermediate-Sized MSNs (300, 150, and 90 nm Diameter) ... 111
3.4.5 Large-Sized MSNs (500 nm Diameter) ... 112
3.4.6 Functionalization of MSNs with Phosphonate ... 112
3.4.7 Functionalization of MSNs with Fluorophores ... 112
3.4.8 X-Ray Diffraction Characterization ... 112
3.4.9 Nitrogen Physisorption Analysis ... 113
3.4.10 Thermogravimetric Analysis (TGA) ... 113
3.4.11 TEM Size Analysis ... 113
3.4.12 Dynamic Light Scattering and Zeta Potential Measurements ... 113
3.4.13 NMR Characterization ... 113
3.4.14 MSN Drug Loading and in vitro Drug Release Assays ... 114
3.4.15 Cell Viability Study ... 114
3.4.16 Nanoparticle Cell Uptake Study ... 114
3.4.16 Chicken Embryo Chorioallantoic Membrane Assay ... 115
3.4.17 Immunohistofluorescence ... 116
3.5 Supporting Information ... 116
3.6 Acknowledgements ... 121
Chapitre 4 – Article 3 : Antibody-Conjugated Mesoporous Silica Nanoparticles for Brain Microvessel Endothelial Cells Targeting ... 122
Résumé ... 123
Abstract ... 124
4.1 Introduction ... 125
4.2 Results and Discussion ... 126
4.2.1 Physicochemical and Textural Characterization of MSN ... 127
4.2.2 Bioconjugation of Monoclonal Antibody (Ri7) to MSN ... 131
4.2.3 Colloidal stability ... 133
4.2.4 1H Relaxometric Properties and in vitro MRI Cell Imaging ... 135
4.2.5 Immunohistochemistry Studies on Coronal Brain Sections ... 136
4.2.6 Development of a quantitative cellular assay ... 137
4.2.7 Ri7-MSN Accumulation in Brain Cells ... 139
4.2.8 Uptake Affinity of Ri7-Conjugated MSN ... 142
4.2.9 Assessment of Ri7-MSN50 BBB Targeting Ability in vivo ... 145
4.3 Conclusion ... 146
4.4 Experimental Section ... 147
4.4.1 Materials ... 147
4.4.2 Production and purification of Ri7 anti-TfR antibody ... 147
4.4.3 Conventional MSN (160 nm in diameter) ... 147
4.4.4 Small sized-MSN (50 nm in diameter) ... 147
4.4.5 Amine functionalization ... 148
4.4.6 DTPA grafting ... 148
4.4.7 DTPA-Gd(III) Chelation ... 148
4.4.8 PEG grafting and conjugation of the antibody (Ab: Ri7; IgG) to MSNx-DTPA(Gd) ... 148
4.4.9 Antibody labeling with Alexa Fluor®647 ... 149
4.4.10 X-ray diffraction characterization ... 149
4.4.11 Nitrogen physisorption analysis... 149
4.4.12 Thermogravimetric analysis - Differential Scanning Calorimetry analysis (TGA-DSC) ... 150
viii
4.4.14 Dynamic light scattering ... 150
4.4.15 NMR characterization ... 150
4.4.16 X-ray photoelectron spectroscopy ... 150
4.4.17 Attenuated total reflectance-Fourier transform infrared spectroscopy (ATR-FTIR) ... 150
4.4.18 1H relaxation analysis and relaxometric properties measurement ... 151
4.4.19 MRI cell pellet imaging ... 151
4.4.20 In vitro cell uptake experiments ... 151
4.4.21 Cellular fluorescence quantification ... 152
4.4.22 Immunohistochemistry ... 152
4.5 Supporting Information ... 153
2.6 Acknowledgment ... 156
Chapitre 5 – Article 4 : Fluorinated Mesoporous Silica Nanoparticles for Binuclear Probes in 1H and 19F Magnetic Resonance Imaging ... 157
Résumé ... 158
Abstract ... 159
5.1 Introduction ... 160
5.2 Results and Discussion ... 162
5.2.1 Synthesis of MSNs, Fluorination and Textural Properties ... 162
5.2.2 Spectroscopic Characterisation of FMSNs and polyFMSNs ... 165
5.2.3 Colloidal Stability of FMSNs and polyFMSNs ... 168
5.2.4 19F Relaxometric Properties of FMSNs and polyFMSNs ... 169
5.2.5 1H Relaxometric Properties ... 171
5.2.6 Magnetic Resonance Imaging Studies (1H and 19F MRI) ... 174
5.3 Conclusion ... 175
5.4 Experimental Section ... 176
5.4.1 Materials ... 176
5.4.2 Synthesis of Functionalized Mesoporous Silica Nanoparticles ... 176
5.4.2.1 MCM-48 synthesis ... 176 5.4.2.2 DTPA grafting ... 176 5.4.2.3 Grafting of fluorosilane ... 176 5.4.2.4 Grafting of polyfluorosiloxane ... 177 5.4.2.5 PEG Grafting ... 177 5.4.3 Physicochemical characterization ... 177
5.4.3.1 Nitrogen physisorption analysis ... 177
5.4.3.2 Thermogravimetric analysis - Differential Scanning Calorimetry analysis (TGA-DSC) ... 177
5.4.3.3 TEM size analysis ... 178
5.4.3.4 Dynamic light scattering ... 178
5.4.3.5 NMR general characterization ... 178
5.4.3.6 1H relaxation analysis and relaxometric properties measurement ... 178
5.4.3.7 19F relaxometric properties measurement ... 178
5.4.3.8 19F MR Imaging ... 179
5.5 Supporting Information ... 179
5.6 Acknowledgment ... 181
Conclusions et perspectives ... 182
ix
Liste des tableaux
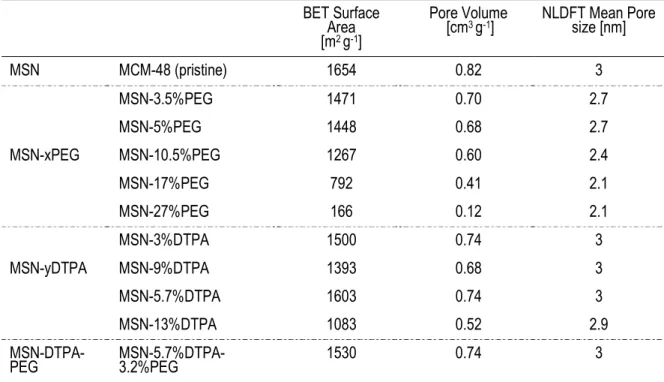
Tableau 1.1 Comparaison entre quelques matériaux de silice mésoporeuse nanostructurés………... 8 Table 2.1 Physicochemical parameters of MSN-yPEG; MSN-xDTPA and MSN-xDTPA-yPEG
nanoparticles extracted from nitrogen physisorption measurements………...….… 63 Table S2.1 Physicochemical parameters of MSN-yPEG and MSN-yPEG-xDTPA nanoparticles
obtained from nitrogen physisorption measurements………..………… 82 Table S2.2 Percentage atomic concentrations extracted from the XPS measurements……… 82 Table S2.3 Release kinetic parameters. Release kinetics parameters were obtained for profiles up
to 90% of total amount released………..… 83 Table 3.1 Physicochemical parameters of different sized nanoparticles obtained from nitrogen
physisorption measurements………..……….… 92
Table 3.2 Release kinetics parameters. Release kinetics parameters were obtained for profiles up to 90% of total amount released……….. 100 Table S3.1 Hydrodynamic diameters and polydispersion indexes of different-sized pure
nanoparticles……….. 121
Table S3.2 Hydrodynamic diameters and polydispersion indexes of different-sized
phosphonated-nanoparticles……….. 121
Table S3.3 Half maximal inhibitory concentrations (IC50, mean ± SD) of Dox@PMSN45,
Dox@PMSN150 and free Dox after 24 h, 48 h and 72 h incubation with cancer cells……. 122
Table 4.1 Physicochemical parameters from nitrogen physisorption measurements (at -196 °C)… 130 Table 4.2 XPS measurements: elemental analysis……… 132 Table S4.1 Hydrodynamic diameters and polydispersion indexes of the nanoparticles, before and
after antibody bioconjugation………... 157 Table 5.1 Porosity data of nanoparticles extracted from nitrogen physisorption measurements…... 165 Table 5.2 Percentage atomic concentrations at the surface of MSNs, extracted from the XPS
x
Liste des figures
Figure 1.1 Images MET et schéma de la structure de surface des pores des MCM-41 (a) et des
MCM-48 (b)……….. 9
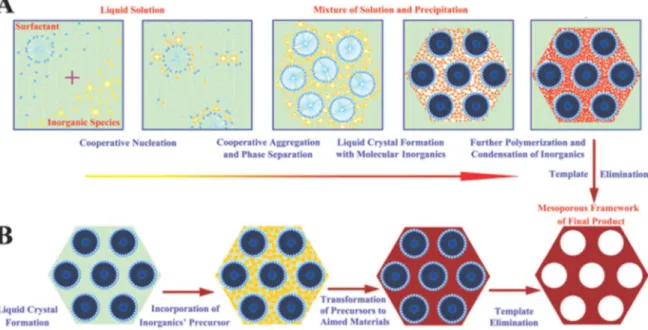
Figure 1.2 Mécanismes de formation des matériaux mésoporeux : mécanisme coopératif d’auto-assemblage (voie A) et mécanisme "liquid cristal templating" (voie B)………. 10 Figure 1.3 Représentation schématique de l’interaction à l’interface organique-inorganique
impliquée dans la synthèse des silices mésoporeuses de type MCM……….. 10 Figure 1.4 Influence du pH sur la vitesse de condensation de la silice et la charge des espèces
siliciques……….. 13
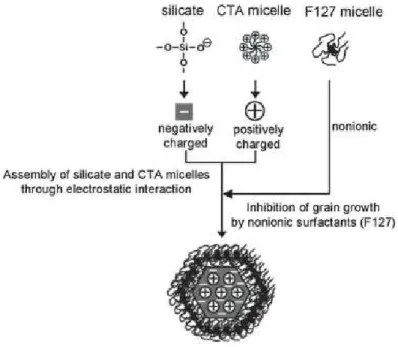
Figure 1.5 Schéma du mécanisme d’auto-assemblage de la mésostructure des MSNs en présence d’un agent inhibiteur de croissance (F127)……….. 14 Figure 1.6 Les différents types de silanols et siloxanes à la surface des MSNs……… 15 Figure 1.7 Schéma des moyens de stabilisation d’une nanoparticule : (a) stabilisation stérique et (b)
stabilisation électrostatique………..………...………. 16 Figure 1.8 Schéma illustrant la méthode de co-condensation………. 18 Figure 1.9 Schéma illustrant la méthode de post-greffage………...… 19 Figure 1.10 Stratégies de fonctionnalisation sélective de la surface interne et externe des MSNs par
co-condensation……….. 20
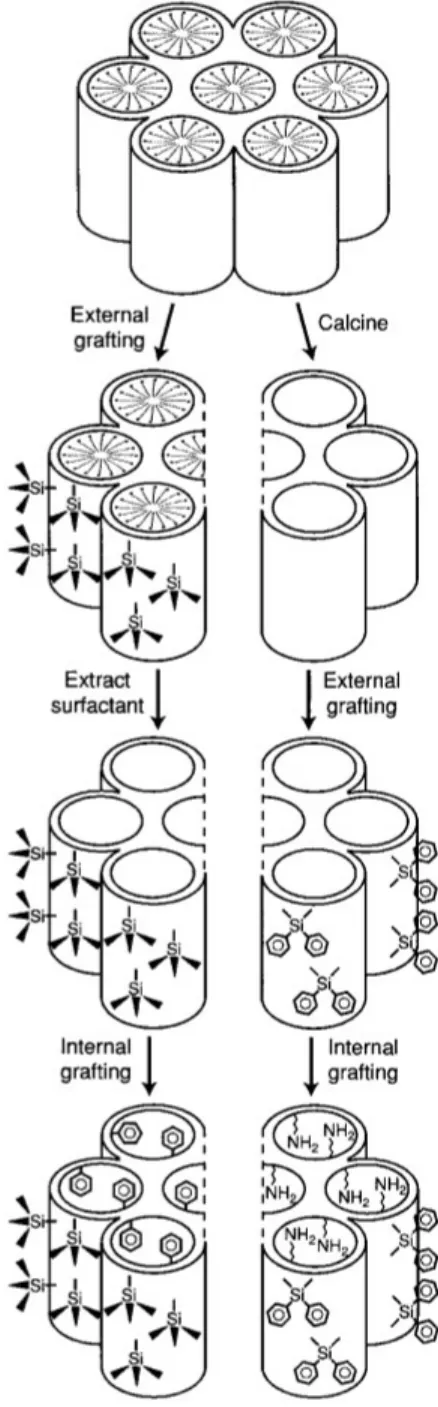
Figure 1.11 Stratégies de fonctionnalisation sélective de la surface interne et externe des MSNs par
post-greffage……… 21
Figure 1.12 Effet de rehaussement et d’atténuation du signal en IRM des agents de contracte positifs
et négatifs……….. 25
Figure 1.13 Structure moléculaire d’exemples de chélate de gadolinium………. 26 Figure 1.14 Schéma de l’accumulation d’un nanomatériau chargé d’un agent anticancéreux par effet
EPR……….……… 31
Figure 1.15 Représentation d'un anticorps de type IgG (a) et la structure cristallographique de rayons
X d'une molécule d'IgG (b)……….. 34
Figure 1.16 Schéma de la barrière hématoencéphalique et des différents mécanismes impliqués dans le transport trans-BHE de molécules………..……….. 35 Figure 1.17 Représentation de la capacité d’adsorption des 48 (Structure en 3D) et des
MCM-41 (structure en 2D) ; sphère : molécule vectorisée……….……… 36 Figure 1.18 a) Représentation générale d’une nanoparticule de silice mésoporeuse chargée d’agents
thérapeutiques et fonctionnalisée avec des "gatekeepers" ; b) Illustration du contrôle d’ouverture et fermeture des pores des MSNs par un "gatekeepers"
polymérique………..………….. 38
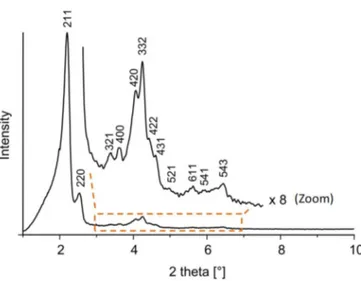
Figure 1.19 Représentation des 3 étapes de la dégradation des MCM-41……….…….. 39 Figure 1.20 Diffractogramme de silice de type MCM-48 montrant des réflexions (hkl) d’une
mésostructure cubique Ia3d……….. 40
Figure 1.21 Classification selon l’IUPAC des isothermes de physisorption mise à
jour……….….. 41
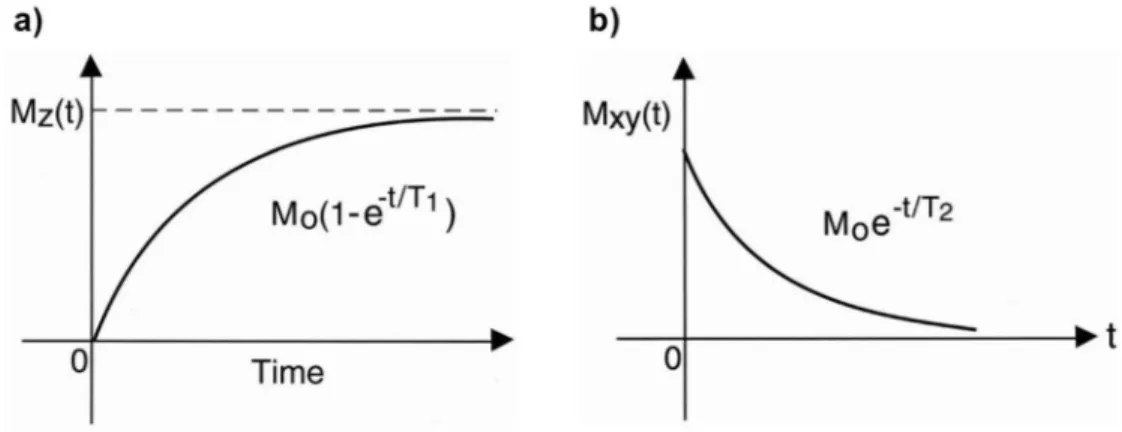
Figure 1.22 Les principaux types de signaux résultants de l'interaction électron-matière……….. 43 Figure 1.23 Courbes de relaxation longitudinale (T1) et transverse (T2), avec 𝑀⃗ comme valeur
initiale du vecteur
d'aimantation………..
49 Figure 2.1 a) MCM-48 nanoparticles imaged by TEM; b) Schematic representation in the Ia3d 3-D
cubic pore network in the MCM-48 particles; c) Schematic representation of the three steps undertaken to optimize PEG and DTPA grafting……… 59
xi
Figure 2.2 13C CP MAS NMR spectra of: a) MSN-xPEG and b) MSN-yDTPA; x = 10.5% and y = 9%;
similar peaks were found for the different combinations of DTPA and PEG concentrations
investigated……….. 60
Figure 2.3 N2 physisorption isotherms (a) and respective NLDFT pore size distributions (b) of
MSN-xPEG nanoparticles………. 62
Figure 2.4 a) Longitudinal (1/T1 + C, squares) and transverse (1/T2 + C, diamonds) relaxation rates
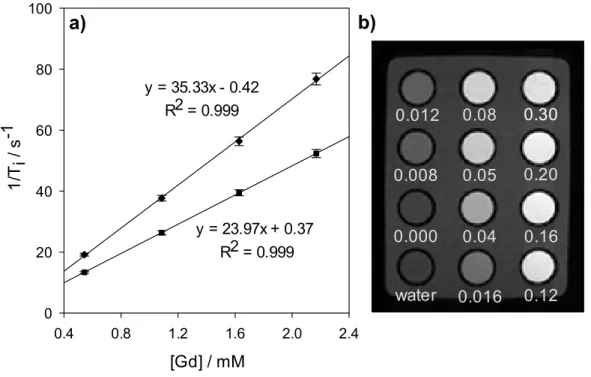
of MSN-5.7%DTPA(Gd)-3.2%PEG nanoparticles, in function of Gd3+ concentration
values. b) T1-weighted MR images of MSN-5.7%DTPA(Gd)-3.2%PEG nanoparticles
measured at clinical magnetic field strength (1 Tesla, TE/TR = 10.7/1000 ms). Numerical values indicate the Gd concentrations (mM) measured by ICP-MS…….. 67 Figure 2.5 a) DLS analysis of MSN-5.7%DTPA(Gd)-3.2%PEG suspension in: water (i), SBF (ii) and
in cell culture medium (iii); b) Zeta potential dependence on pH for MSN-5.7%DTPA-3.2%PEG before (squares) and after (diamonds) Gd chelation……… 68 Figure 2.6 Viability of P388 cells treated with MSN-5.7%DTPA-3.2%PEG (a: resazurin test; b:
trypan blue test) and MSN-5.7%DTPA(Gd)-3.2%PEG (c: resazurin test; d: trypan blue
test)……….. 69
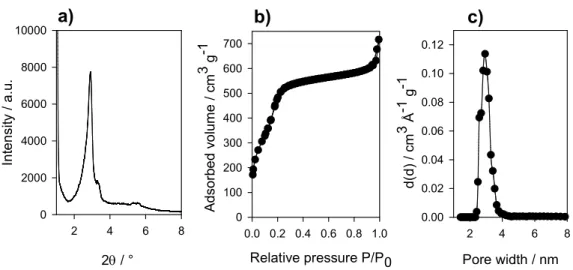
Figure 2.7 Daunorubicin release from MSN-5.7%DTPA(Gd)-3.2%PEG nanoparticles as a function of: a) initial time up to 24 h; b) total time up to 216 h (9 days) and c) viability of P388 cells incubated with free DNR, DNR-loaded nanoparticles at different DNR doses 71 Figure S2.1 Non-grafted MCM-48 nanoparticles: a) low-angle Powder XRD pattern; b) N2
physisorption isotherms and c) respective NLDFT pore size distributions………... 77 Figure S2.2 Thermogravimetric analysis of a) MSN-xDTPA and b) MSN-yPEG nanoparticles………. 78 Figure S2.3 13C CP/MAS NMR spectra of a) MSN-xPEG and b) MSN-yDTPA nanoparticles………… 78
Figure S2.4 ATR mode IR spectra of a) MSN-xDTPA and b) MSN-yPEG; i: 0%; j: 3%; k: 5.7%; l: 13%; m: 0%; n: 3.5%; o: 5%; p: 10.5%; q: 17%... 79 Figure S2.5 29Si MAS NMR spectra of a) MSN-yPEG (i: x=5; j: x=10.5; k: x=17) and b) MSN-xDTPA
(l: y=5.7; m: y=9; n: y=13)………. 79
Figure S2.6 NLDFT pore size distributions of MSN-xDTPA nanoparticles……… 80 Figure S2.7 a) 13C CP/MAS NMR spectrum of MSN-5.7%DTPA-3.2%PEG; and b) ATR-IR spectra of
i) non-grafted MSN and j) MSN-5.7%DTPA-3.2%PEG nanoparticles……….. 80 Figure S2.8 a) 13C CP/MAS NMR and b) ATR-IR spectra of MSN-5.7%DTPA(Gd)-3.2%PEG before
(i) and after (j) DNR loading………. 81
Figure S2.9 Cumulative release of Gd(III) ions from of MSN-5.7%DTPA(Gd)-3.2%PEG at different
pH values………. 81
Figure 3.1 TEM images of the different MSNs synthesized in this work, with their corresponding size distribution: a) and b) MSN45; c) MSN90; d) conventional MSN150; e) MSN300; f) MSN500.
The insets (in a, c and d) are HRTEM images………... 90 Figure 3.2 a) Powder XRD patterns of MSNx; b) N2 physisorption isotherms of MSNx, the isotherms
for MSN90, MSN150 and MSN500 samples are offset vertically by 200, 400 and 600 cm3STP
g- 1, respectively; c) corresponding NLDFT pore size distributions…………. 92
Figure 3.3 DLS analyses of pure (MSNx: a and b) and phosphonated (PMSNx ; c and d) nanoparticle
suspensions in aqueous (i) and saline solutions (ii; vertical off set)………... 94 Figure 3.4 Doxorubicin release profiles from pure MSNx (a) and PMSNx (b). Inset figure in b (i)
shows the Dox release profiles from PMSNx up to 10 h……….. 96
Figure 3.5 a) 29Si MAS NMR spectrum of pure MSNx; b) 31P MAS NMR spectrum of PMSNx; c) 13C
CP MAS NMR spectrum of PMSNx and d) 29Si MAS NMR spectrum of PMSNx. Similar
spectra were obtained regardless the size of the nanoparticles. e) Zeta potential profile of the nanoparticles. f) Schematic representations of the surface of MSNx and PMSNx,
xii
Figure 3.6 TEM images of HT1080 and M21 incubated with PMSN45 (a and b, respectively) and
PMSN150 (d and e, respectively); e) PMSN45 nanoparticles taken up in vesicles and f)
PMSN150 nanoparticles taken up in vesicles………. 102
Figure 3.7 Cell viability assay of M21 and HT1080 cells incubated with PMSN45 (a and c,
respectively) and PMSN150 (b and d, respectively) for 24 h, 48 h and 72 h……… 103
Figure 3.8 Fluorescence images (obtained at 60×) of M21 cells incubated with Dox@PMSN45-F and
Dox@PMSN150-F for 2 h 30 (a and b, cells). e-h) cross-section images analysis based
on line-scanning profile of green and red fluorescence intensity (green and red curves respectively) and 24 h (c and d, respectively). Red fluorescence: Dox; green: Alexa Fluor®488 grafted on nanoparticles; yellow/orange: merged of red and green signals; blue: anti-mouse IgG Alexa Fluor®408 (stains the cytoplasm of human cancer,
respectively)……… 105
Figure 3.9 In vitro cytotoxicity of Dox@PMSN45, Dox@PMSN150 and free Dox against M21 cells and
HT1080 cells at different Dox concentrations for 24 h (a and b, respectively), 48 h (c and d, respectively) and 72 h (e and f, respectively)………... 107 Figure 3.10 Ex vivo fluorescence images of M21 CAM tumor model treated with Dox@PMSN45 and
Dox@PMSN150 after 1 h (a and b, respectively) and 18 h (c and d, respectively) of
post-intratumoral injection. Images were obtained with IVIS Lumina II imaging system……… 108 Figure 3.11 Fluorescence images of M21 CAM tumor treated with small Dox-loaded nanoparticles
(45 nm) and large Dox-loaded nanoparticles (150 nm) after 1 h and 18 h of
post-intratumoral injection………. 110
Figure 3.12 HT1080 CAM tumor weight at t = 7 days (n = 1 for each condition), normalized to the weight of tumors at t = 0. Embryos were treated with Dox-containing MSNs (Dox@PMSN45 and Dox@PMSN150), as well as their "pure" (non-Dox) counterparts
(PMSN45; PMSN150)………... 111
Figure S3.1 TEM images and nanoparticle size distributions of MSNs with an average particle diameter of 90 nm (MSN90, a) and 300 nm (MSN300, b) obtained by increasing and
decreasing the fraction of F127, respectively……… 117 Figure S3.2 DLS analysis of MSN45 (a), MSN90 (b), MSN150 (c), MSN300 (d) and MSN500 (e)
suspensions in aqueous solutions during 24 h (continuous line) and up to 1 week (dotted line), represented in number-weighted data (A) and intensity-weighted data (B). The nanoparticles hydrodynamic diameter distributions after 1 week in are offset
vertically………... 118
Figure S3.3 Thermogravimetric analysis of phosphonated nanoparticles………... 118 Figure S3.4 Fitting of ex vitro Dox release data from Dox@PMSNx nanoparticles: plots of log of
cumulative percentage drug release as function of logarithm of the time……… 119 Figure S3.5 Fluorescence images (obtained at 60×) of M21 cells incubated with Dox@PMSN45-F for
24 h……….. 119
Figure S3.6 Fluorescence images (obtained at 60×) of HT1080 cells incubated with Dox@PMSN45-F
and Dox@PMSN150-F for 2 h 30 (a and b, respectively) and 24 h (c and d,
respectively)……….... 120
Figure 4.1 A, B) High-resolution TEM images of MSN50 and MSN160 with corresponding particle size
distributions; C) functionalization steps for DTPA-Gd and antibody grafting………... 128 Figure 4.2 A, B) TEM images of MSN50 and MSN160 after grafting of DTPA; C, D) after grafting of
the antibody………. 129
Figure 4.3 A) 13C CP/MAS NMR spectrum of MSNx-DTPA; B) 29Si MAS NMR spectrum of MSNx
-DTPA; C) FTIR spectra of functionalized and bioconjugated nanoparticles; D) Schematic representations of the surface of MSNx-DTPA……….. 131
Figure 4.4 DLS analyses of the nanoparticle suspensions (A and C for MSN50 ; B and D for MSN160)
before and after the antibody grafting, represented in number mode and intensity
xiii
Figure 4.5 T1-weighted MR images of Ri7-MSN50 (A) and Ri7-MSN160 (B) in aqueous suspensions.
Numerical values indicate the Gd concentrations (mM) measured by ICP-MS. C) Cell viability assay (trypan blue test) of Ri7-MSN50 and Ri7-MSN160 nanoparticles. D) Pellets
of bEnd5 cells after incubation without (i) or with conjugated MSN (j: Ri7-MSN50; k:
IgG-MSN50; l: Ri7-MSN160 ; m: IgG-MSN160)……….. 137
Figure 4.6 Labeling of brain microvessels by Ri7fl-MSN on mouse brain sections……… 138
Figure 4.7 Automated image-based quantification of MSN cellular uptake………. 140 Figure 4.8 Ri7fl-MSN uptake in bEnd5 and N2A cells at different temperatures and incubation
times………. 142
Figure 4.9 Cellular accumulation of Ri7fl-MSN50 at different Ri7 concentrations. A-C) Increasing
concentrations of targeted Ri7fl-MSN50, control IgGfl-MSN50 or unconjugated Ri7fl were
incubated with bEnd5 (A) and N2A (B) cells at 37 °C………. 145 Figure 4.10 Accumulation of Ri7fl-MSN50 in brain microvessels after intravenous injection. Mice were
injected twice with 0.25 nmol of IgGfl-MSN (A) or Ri7fl-MSN (B and C) at 1 h
interval………. 147
Figure S4.1 Powder XRD patterns (a), N2 physisorption isotherms (-196 °C) and (b) respective
NLDFT pore size distributions (c) of small and large nanoparticles. The isotherm for large MSN (MSN160) is offset vertically by 200 cm3 g−1 STP……….………. 154
Figure S4.2 Thermogravimetric analysis of small and large functionalized mesoporous silica nanoparticles (a and b, respectively)……….. 154 Figure S4.3 UV-Visible spectra of Ri7 labeled with Alexa Fluor®647 before and after conjugation to
small and large mesoporous nanoparticles………... 155 Figure S4.4 DLS analyses of Ri7 antibody before and after PEG grafting……… 155 Figure S4.5 Longitudinal (1/T1 + C, squares) and transverse (1/T2 + C, diamonds) relaxation rates of
Ri7-MSN (i.e. MSN-DTPA(Gd)-PEG-Ri7) nanoparticles, as a function of Gd3+
concentration values……….. 156
Figure S4.6 Specific uptake of mesoporous silica nanoparticles, obtained by subtracting the fluorescence values of Ri7fl-MSN uptake of that of IgGfl-MSN………... 156
Figure 5.1 TEM image of the MSN core (a), and (b) schematic representation of the two functionalization routes and related steps………. 163 Figure 5.2 19F (a), 13C CP (b) and 29Si (c) MAS NMR spectrum of nanoparticles; e) molecular
diagrams of DTPA and fluorosilane molecules; d) schematic representations of the surface of nanoparticles after grafting steps………. 167 Figure 5.3 DLS analysis of pure MSNs (a-i and b-j), FMSN-DTPA (a-ii and a-iii) and
PolyFMSN-DPTA-PEG (b-jj and b-jjj) aqueous suspensions; ii and jj) analysis after 2 h; iii and jjj)
analysis after 1 week………. 170
Figure 5.4 19F R1 and R2 relaxation rates (a and b, respectively) of FMSN-DPTA and
polyFMSN-DTPA-PEG nanoparticles measured by NMR spectroscopy……….. 172 Figure 5.5 NMRD profiles (r1 and r2 inset) at variable magnetic field strengths at 37 °C of
FMSN-DTPA(Gd) suspension (a) and polyFMSN-DPTA(Gd)-PEG suspension (b). Comparison of relaxivity ratios (r2/r1) measured at clinical magnetic field strength (1.4 T, 60 MHz), 37
°C (c)……… 174
Figure 5.6 Influence of temperature on the longitudinal relaxivity (r1) of FMSN-DTPA(Gd)
nanoparticles (b) and polyFMSN-DTPA(Gd)-PEG nanoparticles (c) suspended in water and in hydrogel, measured at 20 MHz. For each temperature, the mean value of 3 measurements is represented with standard deviation between 1% and 3%... 175 Figure 5.7 T1-weighted 1H MR images of FMSN-DTPA(Gd) suspensions (a) and
polyFMSN-DPTA(Gd)-PEG suspensions (b), measured at clinical magnetic field strength (1.5 Tesla, TE/TR = 10.8/1000 ms). Numerical values indicate the Gd concentrations (mM) measured by ICP-MS. c) 19F MR phantom images of polyFMSN-DTPA(Gd)-PEG
xiv
sequence. The particles were suspended in a capillary tube of diameter of 1 mm (1) and in a NMR tube of 5 mm (2). Both capillaries appear clearly visible at a low in-plane
resolution of 0.94×0.94mm2………. 176
Figure S5.1 Low-angle powder XRD patterns (a), N2 physisorption isotherms (b) and NLDFT pore
size distributions (c) of pure MCM48-Type MSN……….. 180 Figure S5.2 TGA analysis of nanoparticles after the grafting of a) DTPA and fluorosilane molecules;
and b) polyfluorosiloxane, DTPA and PEG molecules……… 181 Figure S5.3 (a) 19F NMR spectrum of FMSN-DTPA colloidal suspension in H2O/D2O (90/10, v/v); (b)
19F signal-to-noise ratio linearity……….. 181
Figure S5.4 19F relaxation rates (R1 and R2) of nanoparticles ([F] = 0.01mM) before and after
xv
Liste des abréviations et des sigles
𝐵⃗ Champ magnétique
𝑀⃗ Vecteur d'aimantation
2D Bidimensionnel / bidimensional 3D Tridimensionnel / tridimensional APTES Aminopropyltriéthoxysilane ATG Analyse thermogravimétrique ATR Attenuated total reflectance BEMC Brain microvessel endothelial cells BET Brunauer Emmett Teller
BHE Barrière hématoencéphalique CCD Charge coupled device
CEMC Cellules endothéliales des micro-vaisseaux du cerveau CERMA Centre de recherche sur les matériaux avancés CP Cross polarisation/Transfert de polarisation CPMG Carr – Purcell – Meiboom – Gill
CQMF Centre québécois des matériaux fonctionnels
CR-CHUQ Centre de recherche du Centre hospitalier universitaire de Québec-Université Laval CTAB Cetyltrimethylammonium bromide / Bromure de cetyltriméthylammonium
DLS Diffusion de la lumière en mode dynamique
DMEM Milieu Eagle modifié de Dulbecco / Dulbecco’s modified eagle’s medium DOTA 1,4,7,10-tétraazacyclododecane-1,4,7,10-tétraaminopentaacetique acid DOX Doxorubicine / doxorubicin
DRX Diffraction des rayons X
DTPA Diethylenetriaminepentaacetic acid / Acide diethylènetriaminopentaacétique
EDX Energy dispersive X-ray spectroscopy / Spectroscopie par dispersion en énergie des rayons X
EPR Enhanced permeability and retention FDA Food and Drug Administration
FITC Fluorescein isocianate / Isothiocyanate de fluorescéine
FTIR Fourier Trransform Infrared Spectroscopy / Spectroscopie infrarouge à transformée de Fourier
Gd Gadolinium
HRTEM High-resolution transmission electron microscopy
HRXPS High-resolution X-ray photoelectron spectroscopy / Spectroscopie photoélectronique induite par rayons X de haute résolution
ICP-MS Inductively coupled plasma mass spectrometry / Spectrométrie de masse couplée à un plasma inductif
Ig Immunoglobuline
IRM Imagerie par résonance magnétique
IUPAC International Union of Pure and Applied Chemistry MAS Magic spinning angle / Rotation à l’angle magique MCM Mobil Composition of Matter / Mobile Corporation Material MCM-41 Mobil Composition of Matter n°41
MCM-48 Mobil Composition of Matter n°48 MET Microscopie électronique à transmission MRI Magnetic resonance imaging
MSN Mesoporous silica nanoparticles/Nanoparticules de silice mésoporeuse NLDFT Non-linear density functional theory
xvi nm Nanomètre / nanometer
NMR Nuclear magnetic resonance
NMRD Nuclear magnetic resonance dispersion / Dispersion de résonance magnétique nucléaire OE Oxyde d’éthylène
OP Oxyde de propylène
PBS Tampon phosphate salin PEG Polyéthylène glycol PEI Polyéthylène imine
PET Positron emission tomography PFC Perfluorocarbures
r1 Relaxivité longitudinale
R1 Longitudinal relaxation rate
r2 Relaxivité transverse
R2 Transverse relaxation rate
RGD Arginine-glycérine-acide aspartique RMN Résonance magnétique nucléaire
S Signal
SBF Simulated body fluid
Si Silicium
t½ Temps de demi-vie
T1 Temps de relaxation longitudinale
T2 Temps de relaxation transverse
TE Temps d’écho
TEA Triéthanolamine
TEM Transmission electron microscopy
TEOS Orthosilicate de tétraéthyle / Tetraethyl orthosilicate TEP Tomographie par émission de positons
TGA Thermogravimetric analysis
TMB Triméthybenzène
TMOS Orthosilicate de tétraméthyle / Tetramethyl orthosilicate TR Temps de répétition
XPS X-rayphotoelectron spectroscopy /Spectroscopie de photoélectrons induits par rayons X XRD X-ray diffraction
xvii
À mes chers parents, À mon adorable époux, Que ce travail soit le reflet de vos prières incessantes, de vos encouragements, et de tous vos sacrifices...
xviii
« L'obstination est le chemin de la réussite » - Charlie Chaplin -
«Tout ira pour le mieux à la fin. Si ce n'est pas mieux, c'est que ce n'est pas la fin » - Ed Sheeran -
« La découverte consiste à voir ce que tout le monde a vu et à penser ce que personne n'a pensé » - Albert Szent-Gyorgyi -
« Pour accomplir des grandes choses, nous devons ne pas seulement agir, mais aussi rêver ; ne pas seulement planifier, mais aussi croire » - Anatole France -
xix
Remerciements
Sans l’aide et le soutien de plusieurs personnes, ce projet n’aurait jamais vu son terme. Je tiens donc à remercier tous ceux qui, de près ou de loin, m’ont aidée et encouragée tout au long de cette expérience.
Je tiens à exprimer ma gratitude la plus sincère à mon directeur de recherche, professeur Freddy Kleitz, et à mes co-directeurs, Marc-André Fortin et René C.-Gaudreault. Un grand merci à vous trois pour vos directives qui ont contribué à la réalisation, avec soin, de ce travail laborieux. Votre expérience et votre expertise ont grandement enrichi ce travail. C’est toujours agréable et très enrichissent de discuter avec vous et c’était vraiment un honneur pour moi de travailler avec vous. Je vous remercie aussi pour votre patience et votre compréhension en dépit de toutes les circonstances et de tous les problèmes rencontrés. J’aimerais remercier spécialement le professeur Freddy Kleitz pour avoir cru en ma candidature pour mener à bien cette thèse de doctorat et de m’avoir accueilli dans son laboratoire. Je tiens aussi à lui exprimer ma reconnaissance pour son encadrement et sa confiance, pour m’avoir permis de travailler avec une grande autonomie, et pour m’avoir encouragé à aller jusqu’au bout de mes idées. Aussi, il me tient à cœur de le remercier pour m’avoir permis de voyager à l’autre bout du monde pour présenter mes travaux à des conférences internationales. De la même manière, je tiens particulièrement à exprimer mes remerciements les plus sincères au professeur Marc-André Fortin pour la qualité de son encadrement, son suivi constant, son aide si précieuse, et pour ses exigences qui m’ont permis d’aller toujours plus loin et me surpasser. Je le remercie énormément du fond du cœur pour les multiples belles opportunités qu’il m’a accordées. Il m’est important d’exprimer aussi ma reconnaissance au professeur René C.-Gaudreault pour son soutien, ses conseils avisés et ses petits mots d’encouragement qui me redonnaient toujours espoir pour la suite. Il était pour moi comme un père spirituel.
Je remercie aussi les professeurs Jean-François Lambert, Anna Ritcey et Jesse Greener d'avoir accepté d'être membres de mon jury et d'évaluer mon travail.
Mes vifs remerciements vont aussi aux professionnels de recherche, notamment Dr Pascale Chevalier, Dr Jean Lagueux, Mme Marie-France Côté, M. Jacques Lacroix, M. Pierre Audet et Mme Rodica Plesu, pour leur aide si précieuse. Ils étaient toujours là quand j’avais besoin de leur expertise! C’était vraiment une chance de vous avoir eu à mes côtés! Un merci spécial à Pascale pour les ″miracles″ qu’elle a faits quand elle réussissait toujours à analyser les peu de quantités de produit électrostatique et mes échantillons de dernières minutes, pour m’avoir dépanné et soutenu plusieurs fois durant ma grossesse, et pour son grand cœur et sa générosité. Je remercie aussi Jean pour les riches discussions qu’on a eus ensemble, pour sa disponibilité et son efficacité hors pair lors des scans en imagerie par résonance magnétique (IRM), pour sa patience lors des essais radioactifs, pour sa particularité, ainsi que pour les agréables moments passés avec lui lors de l’atelier à Mons (j’ai vraiment
xx
adoré ces 3 jours de travail intense ensemble.) Merci à Marie-France pour son implication incroyable et sa patience lors des études in vitro et in vivo ainsi que pour sa gentillesse sans fin. Je remercie aussi Jacques pour son support lors des premières expériences cellulaires de ma vie. Enfin, à Pierre et Rodica, merci pour la formation que vous m’aviez donnée pour l’utilisation des appareils du département et pour le temps que vous m’aviez accordé pour résoudre les différents problèmes techniques.
Je souhaite vivement remercier nos collaborateurs pour le projet BBB au CHUL : Dr Éric Béliveau pour son implication et sa coopération lors des études in vitro et in vivo, Dr Vincent Emond pour ses conseils et ses commentaires pertinents, ainsi qu’au professeur Frédéric Calon pour m’avoir permis de travailler dans son laboratoire avec autonomie. Je remercie de la même manière le professeur Yves Gossuin de m’avoir chaleureusement accueillie dans son laboratoire et de m’avoir aidée lors des analyses NMRD.
Je tiens aussi à remercier mes collègues et ami(e)s qui ont rendu la vie au laboratoire plus agréable. Une pensée très particulière à : Fanny, Myriam, Yen, Mathieu, Diane, Lilit, Maëla, Binh et Teresa. Merci les amis pour les moments très agréables passés ensemble. Merci de m’avoir écouté, encouragé, fait rire et aidé à plusieurs reprises à ″décrocher un peu″. Merci aussi pour la bonne ambiance, la chaleur et la convivialité que vous avez apportées au laboratoire ainsi que pour votre soutien en dehors du laboratoire. Vous êtes tout simplement géniaux et exceptionnels! Je vous adore! Je suis très heureuse de vous avoir connus et vous souhaite, à toutes et tous, beaucoup de réussite et de bonheur.
Je remercie aussi mes autres collègues : Merci à Maria pour sa joie de vivre, à Mahesh pour sa folie, à Rémy pour son aide au début de cette thèse, à Luc pour ses conseils durant ma pratique de prédoc, à Solange pour sa douceur, à Marie et Sébastien pour leur gentillesse, à Jean-François pour m’avoir dépannée pendant ma grossesse en lavant les supports d’échantillon pour l’analyse XPS, à Louis pour son aide à changer les bonbonnes d’azote, à Nima et Justyna pour le soutien technique avec les appareils de physisorption. Merci à Yimu et Simon de m’avoir dépanné ces derniers mois à plusieurs reprises. Je remercie également Luis, Wan, Andrée-Anne, Lucie et Stéphane d’être aussi sympathiques. Merci aux stagiaires aventureux qui sont venus nous rendre visite de loin et ont apporté de la joie avec eux, notamment Caroline, Thomas, Christopher et Yen Chua. Merci aussi à Maxime pour ces délicieux plats. Merci aux étudiants du professeur Anna Ritcey, nos voisins de bureau, qui étaient toujours prêts à m’emprunter de la verrerie supplémentaire quand je lançais milles expériences en même temps et qui m’accueillent chaleureusement dans leur laboratoire lors de l’utilisation de l’ultracentrifugeuse ou de leur puissant bain de sonication.
Pour finir, rien de tout cela n'aurait été possible sans l'amour, la patience, l’encouragement, le support inconditionnel et le soutien continu des êtres les plus chers à mon cœur : mes parents et mon époux. Merci d’avoir été toujours là dans les hauts et les bas. Merci d’avoir partagé avec moi mon bonheur quand je me
xxi
réjouissais d’expériences qui fonctionnent. Merci d’être toujours à l’écoute quand je racontais les problèmes scientifiques que j’affrontais, sans nécessairement avoir compris de quoi il s’agissait. Merci d’avoir essuyé mes larmes avec votre tendresse et vos prières. Je suis heureuse que vous puissiez enfin voir le fruit de mon travail, de mon acharnement et de tout ce que vous avez fait pour que je puisse aller jusqu’au bout de cette aventure. Merci papa! Toi qui a cru en moi et qui m’a toujours soutenue et encouragée dans toutes mes démarches, même si elles m’emmenaient à l’autre bout de la terre. Merci maman! Toi qui prie sans cesse pour moi et qui as tout abandonné en Tunisie pendant trois précieux mois et es venue me soutenir et m’aider pendant mon accouchement pour pouvoir avancer dans la rédaction. Merci papa et maman! Je vous dois ce que je suis aujourd’hui et ce que je serai demain. J’espère que vous êtes fiers de moi et que vous le resterez toujours. Merci Naoufel! Toi qui m’as comblée par ta tendresse et ton affection tout au long de ces années. Je n’aurais jamais pu accomplir ce travail tel qu’il est sans ta patience sans fin, ta compréhension et tes sacrifices.
Papa, Maman et Naoufel, aucune phrase aussi expressive soit-elle ne serait suffisante pour vous remercier ou vous exprimer le degré de ma gratitude et l’ampleur de ma reconnaissance à votre égard. Je vous dis alors tout simplement que je vous aime du tréfonds de mon cœur ; Que Dieu vous protège!
Enfin, Je remercie mon rayon de soleil de tous les jours, mon petit bébé et ma princesse "Maram". Son sourire de chaque matin me remplissait d’énergie positive pour aller de l’avant dans cette aventure ; parce qu’être une nouvelle maman, avoir une charge de cours, achever la rédaction des articles et rédiger une thèse en même temps, c’est tout une aventure!
xxii
Avant-propos
Cette thèse a été rédigée en utilisant le modèle d’insertion d’articles à raison d’un article par chapitre (les chapitres 2, 3, 4 et 5). Ce projet de thèse est un projet multidisciplinaire associant des domaines de recherche complémentaires et ayant nécessité des collaborations impliquant plusieurs laboratoires. Le travail présenté dans les deux premiers articles (chapitres 2 et 3), a été effectué dans le laboratoire des matériaux fonctionnels nanoporeux du professeur Freddy Kleitz au département de chimie, le laboratoire des Biomatériaux pour l'Imagerie Médicale du professeur Marc-André Fortin, et le laboratoire du professeur René C.-Gaudreault (axe oncologie) au centre de recherche du centre hospitalier universitaire (CR-CHU) de Québec-Université Laval. Le troisième article, présenté au chapitre 4 de ce manuscrit, a nécessité la collaboration supplémentaire du laboratoire du professeur Frédéric Calon, axe neuroscience, au centre de recherche du centre hospitalier universitaire (CR-CHU) de Québec-Université Laval. Le travail présenté dans le dernier article est principalement effectué dans les laboratoires du professeur F. Kleitz et du professeur Fortin avec quelques expériences réalisées en coopération avec le centre d’imagerie biomédicale à Lausanne (Suisse) et le service de physique expérimentale et biologique de l’Université de Mons (Belgique).
La première partie de cette thèse (chapitre 2) présente la fonctionnalisation sélective de la surface externe des nanoparticules de silice mésoporeuse (MSNs) par un polymère biocompatible (le polyéthylène glycol), et une molécule sonde d’IRM (le chélate de gadolinium). Cette fonctionnalisation a mené à la conception de nanoparticules à fort potentiel théranostique sans perte de porosité, avec une capacité de chargement de médicaments élevée, une performance remarquable pour améliorer le contraste en IRM, et une aptitude à assurer une libération contrôlée de médicaments dans des conditions physiologiques. Ce travail a été publié en 2014 dans la revue "Advanced Functional Materials" (Facteur d’impact 2014 = 10,4). J’ai réalisé l’ensemble du travail : de la conception des MSNs multifonctionnelles, à l’évaluation de leurs performances pour des applications théranostiques. J’ai donc synthétisé tous les matériaux utilisés, j’ai effectué toutes les étapes de la fonctionnalisation et les caractérisations physicochimiques associées, à savoir : l’analyse thermogravimétrique (ATG), la physisorption, la spectroscopie par résonance magnétique nucléaire (RMN), la spectroscopie infrarouge (IR), la microscopie électronique à transmission (MET), et l’analyse par diffusion de la lumière (DLS). L’analyse par XPS (Spectroscopie de photoélectrons induits par rayons X) a été effectué par Dr Pascale Chevalier (professionnelle de recherche au laboratoire du professeur Fortin) et l’analyse DRX par Jean Frenette (technicien au département de génie des mines, de la métallurgie et des matériaux de l’Université Laval); et je me suis occupée de la mise en forme des résultats de ces analyses et de l’interprétation des données. J’ai préparé, planifié, analysé, traité et interprété les tests de viabilité cellulaire qui étaient effectués par M Jacques Lacroix (professionnel de recherche dans le laboratoire du professeur C.-Gaudreault). J’ai effectué toutes les mesures relaxométriques, ainsi que le piégeage des médicaments et les tests de relargage. Dr Jean Lagueux
xxiii
(professionnel de recherche au laboratoire du professeur Fortin) s’est occupé de l’acquisition des images d’IRM. Enfin, j’ai produit l’ensemble des figures présentées, j’ai effectué l’interprétation de tous les résultats et contribué à l’ensemble de la rédaction du manuscrit.
Le deuxième article porte sur l’influence de la taille des MSNs et de leurs propriétés de surface sur leur efficacité en tant que nanovecteurs de médicaments pour le traitement du cancer en particulier. Ce travail a été publié en 2016 dans la revue "Chemistry of Materials" (facteur d’impact 2016 = 9,4). Le contrôle de la taille des MSNs, leur fonctionnalisation et les différentes analyses physicochimiques (ATG, MET, physisorption, RMN, DLS et UV-Visible) ont été élaborés par moi-même. Les images MET de haute résolution ont été enregistrées par Dr Yongbeom Seo au Korea Advanced Institute of Science and Technology qui se trouve à Daejeon, en Corée du Sud. L’analyse par XPS a été faite par Dr Pascale Chevalier (professionnelle de recherche au laboratoire du professeur Fortin), et la caractérisation par DRX par Jean Frenette (technicien au département de génie des mines, de la métallurgie et des matériaux de l’Université Laval). J’ai réalisé aussi les essais de piégeage des médicaments et les tests de relargage in vitro. Les expériences sur les études cellulaires, les injections in vivo et les tests d’immunohistofluorescence ont été faites par Mme Marie-France Côté et moi-même. La préparation des échantillons pour les observations microscopiques (MET et fluorescence), les tests de cytotoxicité, le prélèvement et la mesure du poids des tumeurs avant et après traitement, l'étude d'imagerie par fluorescence ex vivo, la planification des expériences, le traitement des résultats et des images, l’interprétation des données, et enfin la production des figures ont été effectués par moi-même. J’ai contribué à l’ensemble de la rédaction du manuscrit.
Le troisième article s’intéresse à l’étude du potentiel des MSNs conjuguées avec un anticorps pour la livraison des médicaments au cerveau en évaluant leur capacité à cibler les cellules endothéliales de la barrière hématoencéphalique (la première ligne de défense du cerveau). Cet article est publié en 2017 dans la revue "Journal of Materials Chemistry B" (facteur d’impact 2017= 4,5). La synthèse des MSNs et l’ensemble des étapes de fonctionnalisation et des caractérisations (ATG, physisorption, MET, RMN, IR et DLS), ainsi que les mesures des propriétés relaxométriques ont été élaborés par moi-même. Le greffage de la molécule sonde d’IRM a été réalisé, sous ma supervision, par la stagiaire Caroline Germain. Pour le lot qui a servi à l’étude in vivo (injection dans un modèle animal), l’étape du greffage des amines a été effectuée par Dr Pascale Chevalier en raison de ma grossesse (interdiction de manipuler des solvants organiques à potentiel toxique au laboratoire). Dr Pascale Chevalier a aussi effectué les analyses XPS. Les études cellulaires ont été réalisées par Dr Éric Béliveau (stagiaire post-doctoral au laboratoire du professeur Calon) et moi-même. Les images par microscopie fluorescence, la quantification de l’absorption cellulaire et l’essai in vivo ont été élaborés par le Dr Éric Béliveau. Dr Jean Lagueux s’est occupé des procédures d’acquisition des images d’IRM. Les figures et la rédaction du manuscrit ont été faites principalement par Dr Éric Béliveau et moi-même.
xxiv
Le quatrième article porte sur l’étude du potentiel des MSNs multifonctionnelles pour l’IRM binucléaire (IRM du proton et du fluor). Ce travail est publié en 2017 dans la revue "Langmuir" (facteur d’impact 2017 = 3,8). La synthèse, la fonctionnalisation, les caractérisations physicochimiques, et les mesures des propriétés relaxométriques du proton ainsi que ceux du fluor ont été faites par moi-même. M Pierre Audet (professionnel de recherche au département de chimie de l’université Laval) a mis place la séquence CPMG pour les mesures des temps de relaxations par RMN. Dr Pascale Chevalier a effectué les analyses XPS. Les valeurs des profils NMRD ont été mesurées par Dr Yves Gossuin et moi-même pendant un atelier à Mons (Belgique). Les procédures d’acquisition des images en IRM du proton et celui en IRM du fluor ont été effectués par Dr Jean-Lagueux et Dr Ruud B. van Heeswijk (stagiaire post-doctoral au centre hospitalier universitaire vaudois à Lausanne (Suisse)), respectivement. Enfin, j’ai produit l’ensemble des figures présentées, j’ai effectué l’interprétation de tous les résultats et rédigé l’ensemble du manuscrit.
En plus des travaux qui ont mené aux articles de cette thèse, j’ai contribué aux travaux d’autres étudiants et qui ont aussi mené à des articles scientifiques déjà publiés ou en cours de réalisation, ainsi :
J’ai contribué au travail de maitrise de Mme Myriam Laprise-Pelletier en effectuant les caractérisations physicochimiques des nanoparticules (ATG, RMN, physisorption d’azote, et MET) et en contribuant à la rédaction des sections correspondantes pour l’article "Metal chelate grafting at the surface of mesoporous silica nanoparticles (MSNs): physico-chemical and biomedical imaging assessment", publié dans la revue "Journal of Materials Chemistry B" en Octobre 2014.
Les nanoparticules de silice mésoporeuse que j'ai synthétisées et la stratégie de greffage des molécules sondes d’IRM ont servi au travail de thèse de Mme Fanny Silencieux (sous la supervision du professeur Marc-André Fortin). Je suis deuxième auteure dans un premier article découlant de ces travaux, intitulé "Mesoporous Silica Nanoparticles under Sintering Conditions: A Quantitative Study" et publié dans la revue "Langmuir" en Octobre 2015. Dans cet article, j’ai réalisé la synthèse et les différentes caractérisations physicochimiques des nanoparticules, ainsi que le frittage des échantillons déposés sur des couches minces. Je suis également co-auteure dans un deuxième article qui est en cours de finalisation et intitulé "Paramagnetic hydrogels for high signal-enhancement of interventional biomedical devices in MRI". Pour cet article, j’ai effectué la fonctionnalisation des nanoparticules par des molécules sondes d’IRM, leur caractérisation physicochimique (par ATG, RMN, physisorption d’azote, DLS, et MET), ainsi que les mesures des propriétés relaxométriques à différents champs magnétiques (profils NMRD).
J’ai également contribué au travail de maitrise de Mme Eya Mejri (sous la direction du professeur Jesse Greener) sur le développement d’un revêtement intelligent à base de nanoparticules de silices
xxv
mésoporeuses fonctionnalisées pour le relargage stimulé d’agents antimicrobiens. J’ai synthétisé, fonctionnalisé et caractérisé (par ATG, RMN, physisorption d’azote, DLS, et MET) les nanoparticules utilisées pour ce travail. J’ai aussi contribué à la rédaction de l’article correspondant qui est en cours de finalisation.
Les nanoparticules de silice mésoporeuse que j’ai développées lors de cette thèse ont été utiles pour le travail de Mme Estelle Juère (sous la supervision du professeur Freddy Kleitz) et j’ai contribué à la rédaction de l’article correspondant qui sera soumis bientôt.
Les travaux réalisés au cours de ce doctorat ont été présentés à l’échelle nationale et internationale et plusieurs prix, bourses et distinctions en ont découlés :
Prix et bourses :
- Prix de la meilleure présentation par affiche lors du "International Chemical Congress of Pacific Basin Societies 2015" – Honolulu – Hawaii (25 décembre 2015) ;
- Bourse pour communication scientifique (congrès) de la faculté des études supérieure de l’Université Laval – Québec (09 octobre 2015) ;
- Bourse pour communication scientifique (congrès) de l’association des étudiantes et des étudiants de Laval inscrits aux études supérieures (AELIÉS) – Québec (06 septembre 2015) ;
- 3ème prix de la meilleure présentation par affiche lors du colloque annuel des étudiants CERMA
(centre de recherche sur les matériaux avancés) – Université Laval – Québec (28 octobre 2014) ; - 1er prix de la meilleure présentation orale lors du "1st International Chemical Engineering Congress"
– Djerba – Tunisie (19 décembre 2013) ;
- Bourse d’études : Bourse de doctorat en recherche des Fonds québécois de la recherche sur la nature et les technologies, FRQNT (avril 2013 – août 2014) ;
- Attestation d’excellence : Parcours académique 2012 – Faculté des sciences et de génie – Université Laval – Québec (17 mai 2013) ;
- Prix d’excellence – Présentation par affiche lors du 81e Congrès de l’ACFAS – Colloque 128 :
Nanoparticules et Nanomatériaux pour la Médecine – Québec (07 mai 2013) ;
- Prime d’excellence : Performance exceptionnelle-Examen de doctorat – Plan de soutien financier 2012-2013 – Département de Chimie – Université Laval – Québec (avril 2013) ;
- Bourse d’études et d’excellence des Fonds Arthur-Labrie (janvier 2012 – avril 2012) ;
- 1er prix de la meilleure présentation par affiche en nanotechnologie (Prix nano-ulaval) lors du 5ème
xxvi
- 1er prix de la meilleure présentation par affiche (Prix Suraj Manrao) lors du "25th MOOT NMR
Minisymposium" – Université Laval – Québec (20 octobre 2012). Présentations orales à :
- "International Mesostructured Materials Symposium 9", Brisbane, Australie, 20 août 2015 ; - Colloque annuel du CQMF, Shawinigan, Québec, Canada, 7 novembre 2014 ;
- "1st International Chemical Engineering Congress", Djerba, Tunisie, 17 décembre 2013 ;
- "96th Canadian Chemistry Conference and Exhibition", Québec, Canada, 28 mai 2013 ;
- 81e Congrès de l’ACFAS, Québec, Canada, 7 mai 2013.
Présentations par affiche à :
- "10th World Biomaterials Congress (WBC) 2016", Montreal, Canada, 17 – 22 Mai 2016 ;
- "The International Chemical Congress of Pacific Basin Societies 2015", Honolulu, Hawaii, 15 et 17 décembre 2015 ;
- Colloque Etudiant CERMA 2014, Université Laval, Québec, Canada, 28 octobre 2014 ; - Journée MEDTEQ, IRDPQ, Québec, Canada, 21 octobre 2014 ;
- 1ère journée IMA, Sherbrooke, Québec, Canada, 26 septembre 2014 ;
- "International Symposium – Nanoporous Materials-7", Niagara Falls, Canada, 22 juin 2014 ; - European Materials Research Society (E-MRS 2014), Lille, France, 29 mai 2014 ;
- 82e Congrès de l’ACFAS, Montréal, Canada, 12 mai 2014 ;
- Colloque annuel du CQMF, Québec, Canada, 7 novembre 2013 ; - 81e Congrès de l’ACFAS, Québec, Canada, 7 mai 2013 ;
- 5ème Colloque annuel du CQMF, Québec, Canada, 2 novembre 2012 ;
- 25th Moot NMR Minisymposium, Québec, Canada, 20 octobre 2012 ;
- Colloque Etudiant CERMA 2012, Université Laval, Québec, Canada, 7 septembre 2012 ; - NanoQuébec 2012, Montréal, Québec, Canada, 20 mars 2012.
Finalement, pendant ma thèse de doctorat j’ai eu l’occasion d’enrichir mon expérience académique et professionnelle en étant chargée de cours et auxiliaire d’enseignement plusieurs fois, en encadrant plusieurs stagiaires et en m’impliquant dans la vie universitaire :
- Chargée de cours (Matériaux inorganiques et hybrides) au département de chimie – Université Laval (septembre 2016 – décembre 2016) ;
xxvii
- Auxiliaire d’enseignement des travaux pratiques de synthèse inorganique au département de chimie – Université Laval (5 fois : janvier 2017 – avril 2017 ; janvier 2015 – avril 2015 ; janvier 2014 – avril 2014 ; janvier 2013 – avril 2013 ; et janvier 2012 – avril 2012) ;
- Auxiliaire d’enseignement des travaux pratiques du cours techniques d’analyse au département de génie des mines, de la métallurgie et des matériaux de l’université Laval (2 fois : juin 2015 – juillet 2015 et juin 2013 – juillet 2013) ;
- Encadrement de stagiaire (mars 2015 – août 2015 et avril 2013 – septembre 2014) ; - Représentante des étudiants au bureau de direction du CERMA (2014 – 2016) ; - Juge des projets régionaux pour la compétition Expo-Sciences (2012 et 2017) ; - Co-présidente du comité d’organisation du 5ème colloque des étudiants du CERMA ;
- Animatrice scientifique, mentor à la coupe de science et guide scientifique pour les étudiants du Cegep (2012 – 2017).
1
Introduction
Mise en contexte
De nos jours, le secteur biomédical fait face à des besoins accrus en matériaux biomédicaux utilisés pour le diagnostic et le traitement des maladies. Pour satisfaire ces besoins, le développement des matériaux avancés pour le génie biomédical est un secteur en forte expansion. Les progrès réalisés dans le domaine des nanomatériaux destinés à la livraison d’agents thérapeutiques, permettent d’élaborer de nouveaux vecteurs thérapeutiques prometteurs.
De nombreux médicaments à fort potentiel thérapeutique, présentent une efficacité limitée une fois administrés, et ce, pour plusieurs raisons. D’abord, plusieurs principes actifs présentent des caractéristiques physico-chimiques peu propices à leur administration : instabilité/dégradation dans les milieux biologiques ; insolubilité/hydrophobicité ; poids moléculaire élevé. Ensuite, d’autres agents thérapeutiques se caractérisent par une toxicité très élevée et/ou une livraison non-ciblée, engendrant plusieurs effets secondaires. Enfin, certaines molécules bioactives ne peuvent pas affranchir les différentes barrières biologiques pour atteindre leur site d’action et d’exercer leur activité thérapeutique. La vectorisation des médicaments est donc considérée comme une solution adéquate pour remédier à tous ces problèmes et améliorer ainsi la qualité et l’efficacité du traitement. Pour ces raisons, le développement de nanovecteurs de médicaments a pris un essor considérable au cours des dernières années.
Les hydroxydes doubles couches, les dendrimères, les liposomes, les micelles, et les nanoparticules polymériques comptaient parmi les premiers matériaux développés pour la vectorisation des médicaments.1-3 À
cause de leur structure instable, le relargage des médicaments vectorisés dans ces matrices est souvent très rapide. Ainsi, un relargage prématuré et indésirable est presque toujours observé avant que le vecteur n’atteigne le site ciblé.4 Pour résoudre ce problème, la recherche s’est orientée ces dernières années vers le
développement de systèmes de livraison de médicaments structurellement plus stables, et en particulier à base de matériaux inorganiques poreux.5, 6 Ces matériaux se caractérisent par leur stabilité chimique relative, leur
résistance mécanique, leur biocompatibilité, et leur résistance aux attaques microbiennes par rapport à leurs homologues organiques.7 Ces systèmes sont en mesure de livrer une grande quantité d’agents thérapeutiques
aux sites d’action ciblés (organes, cellules, organites intracellulaires, etc.).4 À cette fin, les nanoparticules de
silice mésoporeuse (MSNs) sont les plus prometteuses.4, 7-9
La silice est souvent considérée comme un matériau de choix pour plusieurs applications biomédicales.10, 11 Par
exemple, elle est très utilisée dans la formulation d’implants artificiels12 et pour le revêtement de surface d’autres
2
uniques, les nanoparticules de silice mésoporeuse sont considérées comme des candidats de premier ordre comme vecteurs de livraison des médicaments. En effet, ces nanoparticules se caractérisent par une petite taille permettant leur administration par voie intraveineuse et orale. Elles peuvent s’accumuler dans les sites ciblés, et sont internalisées par les cellules.14 Elles se différencient aussi par une grande surface spécifique (~1000 m2
g-1), par un volume poreux considérable (0,7 - 1 cm3 g-1) et par une porosité facilement modulable, ce qui favorise
le piégeage de grandes quantités de molécules de tailles, de formes, et de fonctionnalités différentes.9,15 Les
MSNs se distinguent en plus par des propriétés de surface remarquables. En effet, les silices mésoporeuses ont la particularité d’avoir une surface très riche en sites actifs (les silanols de surface) et facilement modifiables. La fonctionnalisation de la surface des MSNs permet d’améliorer leurs interactions avec les molécules à vectoriser et avec les différents compartiments biologiques (tissus, organes, cellules et etc.). Ceci est très avantageux pour un meilleur contrôle du piégeage, du ciblage, et de la libération des agents thérapeutiques. Récemment, des essais cliniques utilisant des nanoparticules de silice ont été approuvés par l’agence américaine d’administration des denrées alimentaires et des médicaments (la FDA).16, 17
Tout d’abord, plusieurs recherches ont montré le potentiel des nanoparticules de silice mésoporeuse pour la livraison et le relargage de différents médicaments : l’ibuprofène5, 18-22 (anti-inflammatoire), l’aspirine23, 24
(analgésique et anti-inflammatoire), l’érythromycine23, 25, 26 (antibiotique), etc.7, 8 Ensuite, les recherches se sont
orientées vers l’étude du potentiel des MSNs pour la vectorisation des molécules anticancéreuses notamment le paclitaxel,27, 28 la camptothécine,29-32 et la doxorubicine,33, 34 molécules typiquement utilisées en
chimiothérapie. Ces recherches ont pour but d’améliorer le traitement du cancer et de diminuer les effets indésirables de la chimiothérapie. En effet, la chimiothérapie classique (i.e. sans utilisation d’agents de ciblage) a l’inconvénient d’avoir un mode d’action non-spécifique qui ne tue pas seulement les cellules cancéreuses mais endommage aussi les cellules saines du corps.35 De plus, seule une très faible fraction de la dose injectée peut
atteindre les tumeurs. Les agents anticancéreux, malgré leur efficacité, sont donc pour la plupart très toxiques. Lorsqu’ils sont administrés par voie intraveineuse, ils peuvent rencontrer des barrières physiologiques avant d’atteindre leur site d’action.35 Enfin, très récemment (à partir de 2016), le potentiel des MSNs pour la livraison
des médicaments au cerveau a été envisagé, en évaluant d’abord leur capacité à traverser la barrière hématoencéphalique (BHE).36-39 La BHE est une barrière biologique qui sépare physiquement le cerveau de la
circulation sanguine. Bien qu’elle protège le cerveau des toxines et des éléments pathogènes, elle constitue cependant un obstacle qui empêche la majorité des agents thérapeutiques d’y pénétrer. La livraison des médicaments au cerveau par le biais de nanovecteurs est donc un enjeu majeur pour le traitement de plusieurs maladies cérébrales et neurodégénératives (par exemple, l'Alzheimer, le Parkinson et le cancer).
La capacité des MSNs à vectoriser les médicaments peut être suivie et mise en image par l’utilisation de sondes d’imagerie biomédicales greffées à leur surface. Cet avantage permet leur visualisation par un système