EFFET À LONG TERME DE LA DOULEUR À LA NAISSANCE
Par Mélanie Morin
Programmes des sciences cliniques
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.) en sciences cliniques
Sherbrooke, Québec, Canada Avril 2013
Membres du jury d’évaluation :
Sylvie Lafrenaye MD, Ph.D., directrice de thèse, Faculté de Médecine et des sciences de la santé, département de pédiatrie, Université de Sherbrooke
Serge Marchand Ph.D., directeur de thèse, Faculté de Médecine et des sciences de la santé, service de neurochirurgie, Université de Sherbrooke
Anne-Monique Nuyt, MD, évaluatrice externe à l’Université, Université de Montréal Allen Finley, MD, évaluateur externe aux programmes, IWK Health Center Patrick Boissy, Ph.D., président du jury, Faculté de Médecine et des sciences de la santé,
service d’orthopédie, Université de Sherbrooke © Mélanie Morin, 2013
1+1
Published Heritage Branch Direction du Patrimoine de l'édition 395 Wellington Street Ottawa ON K1A0N4 Canada 395, rue Wellington Ottawa ON K1A 0N4 CanadaYour file Votre référence ISBN: 978-0-494-96342-5 Our file Notre référence ISBN: 978-0-494-96342-5
NOTICE:
The author has granted a non
exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
telecomm unication or on the Internet, loan, distrbute and sell theses
worldwide, for commercial or non commercial purposes, in microform, paper, electronic and/or any other formats.
AVIS:
L'auteur a accordé une licence non exclusive permettant à la Bibliothèque et Archives Canada de reproduire, publier, archiver, sauvegarder, conserver, transmettre au public par télécomm unication ou par l'Internet, prêter, distribuer et vendre des thèses partout dans le monde, à des fins com merciales ou autres, sur support microforme, papier, électronique et/ou autres formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
L'auteur conserve la propriété du droit d'auteur et des droits moraux qui protege cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement
reproduits sans son autorisation.
In compliance with the Canadian Privacy A ct some supporting forms may have been removed from this thesis.
W hile these forms may be included in the document page count, their removal does not represent any loss of content from the thesis.
Conform ém ent à la loi canadienne sur la protection de la vie privée, quelques
form ulaires secondaires ont été enlevés de cette thèse.
Bien que ces form ulaires aient inclus dans la pagination, il n'y aura aucun contenu manquant.
Par Mélanie Morin
Programmes de sciences cliniques
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en sciences cliniques, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Résumé
Les avancées technologiques et les améliorations au niveau des options de traitements ont augmenté les chances de survie des bébés prématurés. Toutefois, ce succès entraîne une augmentation du nombre de procédures douloureuses subies par le nouveau- né. Les nouveau-nés à terme peuvent également subir de la douleur suite à une chirurgie à la naissance. Ces procédures surviennent à une période critique du développement du cerveau et peuvent entraîner des conséquences néfastes à long terme. Le but de ce projet doctoral était de combler le manque de connaissances au niveau de la réponse à la douleur de sujets ayant subi des procédures douloureuses à la naissance. En évaluant la perception de la douleur avant et après l’immersion du bras dans un bain d’eau froide à 10°C pour 2 minutes, il fut possible de déterminer l’efficacité des mécanismes de contrôle de la douleur (CIDN : Contrôle Inhibiteur Diffus Nociceptif). Les seuils de douleur étaient également mesurés chez ces sujets âgés de 7 à 25 ans. Un électrocardiogramme était enregistré avant et pendant le bain d’eau froide pour déterminer la réponse cardiaque à la douleur. Bien que les seuils de douleur fussent comparables entre les différents groupes, nous avons retrouvé des différences au niveau du CIDN lorsque la douleur à la naissance était prise en compte. En effet, les sujets nés prématurément ayant subi beaucoup de procédures douloureuses à la naissance présentaient un CIDN inefficace, contrairement aux sujets nés à terme et prématurés ayant été exposés à peu de douleur néonatale. De plus, il y avait des différences au niveau de la variation du rythme cardiaque (RC) pendant la procédure du bain d’eau froide. Les sujets nés à terme démontraient une augmentation stable au niveau du RC qui se prolongeait pendant toute la procédure. Les sujets prématurés présentaient au contraire une grande augmentation au début, qui diminuait pour revenir à un RC près de celui de base au milieu de la procédure. La douleur à la naissance avait également un impact sur la fonction autonomique de base. En effet, les sujets (à terme ou prématurés) ayant subi beaucoup de douleur à la naissance présentaient un RC de base plus élevé, une activité sympathique plus forte et une activité parasympathique plus faible. Toutes les analyses sont demeurées significatives en ajoutant l’âge lors de l’évaluation comme covariable; ainsi,l’âge présentait une corrélation positive avec les seuils de douleur et le CIDN. Ces résultats démontrent que l’ampleur des douleurs subies à la naissance corrèle avec les réponses altérées à la douleur expérimentale même chez des sujets adulte. Ainsi, ces sujets pourraient être plus à risque de développer de la douleur chronique, des études longitudinales sont toutefois nécessaires pour vérifier le lien causal.
Mots clés : Prématurité, douleur néonatale, âge, seuil de douleur, mécanisme de modulation de la douleur, variabilité cardiaque
By Mélanie Morin Clinical sciences program
Thesis presented to the Faculty of medicine and health sciences for the grade of philosophiae doctor (Ph.D.) in clinical sciences, Faculty of medicine and health sciences,
Université de Sherbrooke, Sherbrooke, Quebec, Canada, J1H 5N4 Abstract
In the last decades, advances in knowledge and improvements in treatment options have increased survival rates for preterm infants. However, this success leads to an increase in the number o f painful procedures in preterm babies. Full-term newborns can also experience pain after birth, such as following surgery. These procedures occur at a critical time of brain development and can lead to long-lasting undesirable consequences. By evaluating the pain perception before and after the immersion of the forearm in 10°C cold water (cold pressor test) for 2 minutes, it was possible to determine the efficacy of the pain control mechanisms (DNIC: Diffuse Noxious Inhibitory Control) o f subjects either bom preterm or at term who experienced or not pain following birth. Pain thresholds to warm temperatures were also measured in those subjects aged between 7 and 25 years old. An electrocardiogram was recorded before and during the cold pressor test to determine heart rate responses to pain. This study revealed that even with comparable pain thresholds, our subjects showed differences on the pain control mechanisms when pain at birth was considered. In fact, preterm subjects who suffered more painful procedures at birth did not show an efficient DNIC, whereas full-term and preterm subjects that were exposed to less painful procedures experienced a significant reduction in pain perception following DNIC activation. Furthermore, preterm and full-term subjects differed in regards to the variation in their heart rate during the cold pressor test. Full-term subjects showed a stable increase in heart rate throughout the procedure whereas preterm participants showed a strong increase at the beginning, which decreased over time. Moreover, pain experienced at birth had an impact on baseline autonomic activity. Preterm subjects who underwent a lot of painful procedures and full-term subjects with surgery showed higher resting heart rate, stronger sympathetic activity and lower cardiac vagal activity. When age at testing was added as a covariate, all analysis remained significant and age was a significant covariable. Age showed also a significant positive correlation with pain thresholds and DNIC. These results imply that pain at birth leads to impaired reactions to pain or stress until young adulthood and that subjects who suffered neonatal pain could be more at risk of developing chronic pain and cardiac diseases in later life. However, longitudinal studies are needed to verify the causality of this hypothesis.
Keywords: Prematurity, neonatal pain, age, pain threshold, pain modulation, heart rate variability
-List e des t a b l e a u x...v m
List e des f ig u r e s... ix
List e des a b r é v ia t io n s... x
Ch a p it r e I - In t r o d u c t io n... 1
1.1 La d o uleu r...1
1.2 Développement de l’en fant...4
1.3 Développement des voies de transm ission de la douleur...5
1.4 Développement des mécanismes de m odulation de la d o u le u r... 7
1.5 Le système nerveux autonom e... 8
1.6 Les nouveau-nés et la d o u le u r... 10
Ch a p it r e II - Re c en sio n des é c r it s...14
2.1 Les nouveau-nés prém aturés...14
2.2 Développement de troubles cognitifs, psychologiques et com portem entaux chez les prém aturés... 15
2.3 Impact sur la variabilité du rythme ca rd ia q u e ... 18
2.4 Les nouveau-nés prématurés et la douleur... 21
2.4.1 Influence de l’âge gestationnel... 25
2.4.2 Influence de l’âge postnatal...26
2.4.3 Influence du nombre de procédures douloureuses... 28
2.4.4 Influence du type de stimulation... 30
2.5 Les nouveau-nés prématurés et le C ID N ...32
2.6 Les nouveau-nés à term e et la douleur... 34
2.7 Évolution de la neurophysiologie de la douleur avec l’â g e ...37
2.8 Évolution du CIDN avec l’âg e...38
2.9 Justification du projet et hypothèses...40
Ch a p it r e II I - Ob je c t if s... 47 3.1 O bjectif général...47 3.2 Objectifs spécifiques...47 3.2.1 Objectif 1... 47 3.2.2 Objectif2 ... 47 Ch a p it r e IV - Mé t h o d o l o g ie...48
4.1 Recrutement des sujets... 48
4.2 Questionnaires u tilisés... 49
4.2.1 Description de la population... 49
4.2.2 Séparation des groupes...51
4.3 Procédure expérim entale... 52
4.3.1 Évaluation de la douleur...52
4.3.2 Évaluation de la fonction cardiaque... 55
Ch a p it r e V - Ré s u l t a t s... 57
5.1 Séparation des g ro u p es... 57
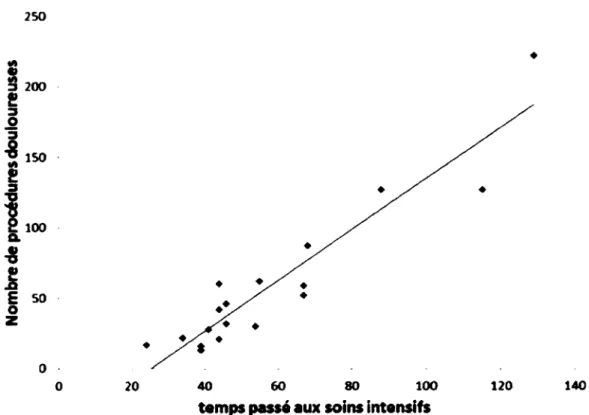
5.1.1 Corrélation entre la durée du séjour aux soins intensifs et le nombre de procédures douloureuses chez les sujets nés prématurément...57
5.1.2 Sujets nés à terme ayant subi une chirurgie à la naissance...58
6.2 Résumé de l’article... 62
6.3 Article 1 ... 63
Ch a pit r e V II - Ar t ic l e 2 ...82
7.1 Avant propos de l’article...82
7.2 Résumé de l’article... 83
7.3 Article 2 ... 84
Ch a p it r e V III - Dis c u s s io n... 101
8.1 Influence de l’âge... 104
8.1.1 Corrélation entre l’âge et le seuil de douleur...104
8.1.2 Corrélation entre l’âge et le fonctionnement du CIDN...106
8.2 Influence de la douleur à la naissance...107
8.2.1 Impact au niveau des seuils de douleur...107
8.2.2 Impact au niveau des mécanismes de contrôle de la douleur... 109
8.2.3 Impact au niveau de la fonction autonomique de base... 112
8.2.4 Impact au niveau de la variabilité du rythme cardiaque...114
8.3 Validité interne et externe de l’étude...117
8.3.1 Validité interne...117
8.3.2 Validité externe...119
8.4 Taille d’échantillon et puissance statistique... 120
8.4.1 Calcul de la taille d’échantillon...120
8.4.2 Estimation de la puissance de l’étude... 121
8.5 Forces et limites de l’étude... 122
8.5.1 Forces de l’étude... 122 8.5.2 Limites de l’étude...124 Ch a pit r e IX - Co n c l u s io n... 128 Re m e r c ie m e n t s... 130 Ré f é r e n c e s...132 A N N E X E S ...150
ANNEXE 1 Certificats des comités d’éthique de la recherche... 151
ANNEXE 2 Formulaires de consentement... 156
ANNEXE 3 Autorisations d’intégration des articles écrits en collaboration...181
ANNEXE 4 Preuve de soumission des articles... 184
ANNEXE 5 Questionnaire CBCL...189
ANNEXE 6 Questionnaire BECK...192
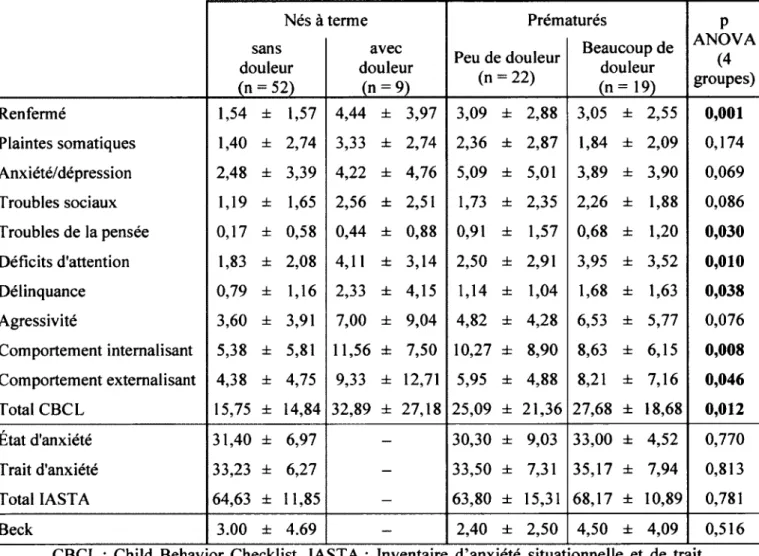
Tableau 1 : Résumé des études en fonction des différents facteurs influençant la réponse à la douleur... 41 Tableau 2 : Résumé des études sur la variabilité du rythme cardiaque...43 Tableau 3 : Différences au niveau du comportement (moyenne ± écart-type)... 60
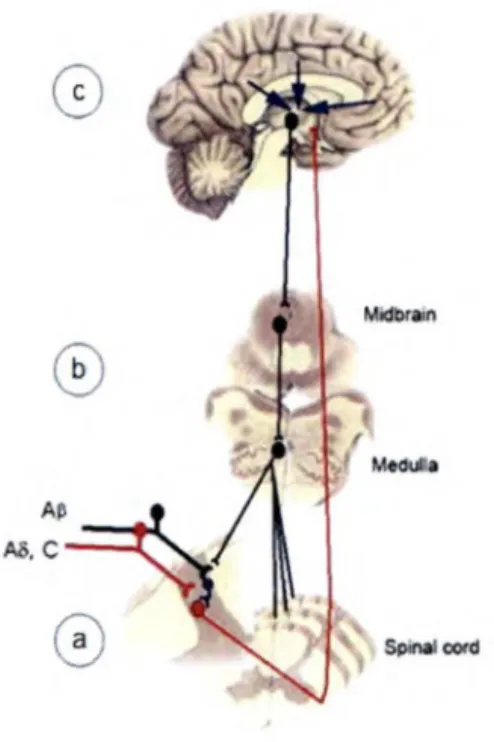
Figure 1 : Voie de modulation de la douleur... 4
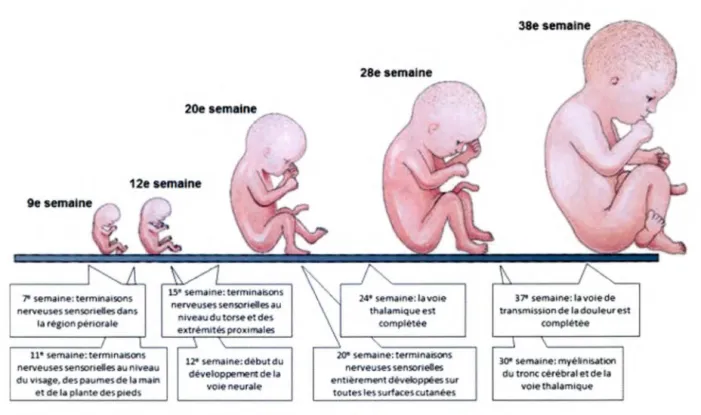
Figure 2 : Développement des voies nociceptives... 7
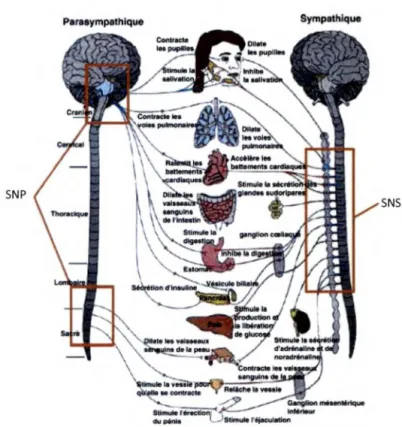
Figure 3 : Les deux composantes du système nerveux autonome...9
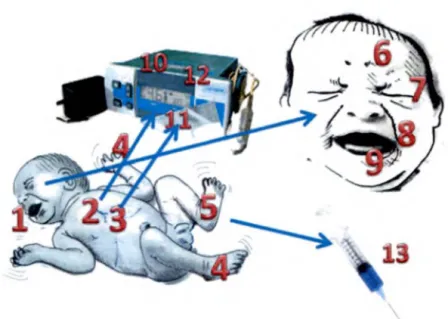
Figure 4 : Signes de douleur chez les enfants...12
Figure 5 : Différences anatomiques entre la corne dorsale des adultes et des nouveau-nés.23 Figure 6 : Étapes du test au laboratoire...54
Figure 7 : Corrélation entre le temps passé aux soins intensifs et le nombre de procédures douloureuses...58
Abréviation Sienification
bpm Battements par minutes
CBCL Child Behavior Checklist
CHUS Centre Hospitalier Universitaire de Sherbrooke CIDN Contrôle Inhibiteur Diffus Nociceptif
ECG Électrocardiogramme
EEG Électro-encéphalogramme
HHS Hypothalamo-hypophyso-surrénalien
HF High frequency
Hz Hertz
IASP International Association fo r the Study o f Pain
IASTA Inventaire d ’anxiété situationnelle et de trait d’anxiété
LF Low frequency
mmHg millimètre de mercure
NRM Noyau raphé magnus
QST Quantitative sensory testing
RC Rythme cardiaque
SGPA Substance grise périaqueducale
SNA Système nerveux autonome
SNS Système nerveux sympathique
SNP Système nerveux parasympathique
La majorité des êtres humains, à un moment ou à un autre de leur vie, ressentiront de la douleur. Certains, comme les bébés prématurés, auront à subir, dès la naissance, des procédures leur causant potentiellement de la douleur. Le développement du corps débute dès sa création et se poursuit durant toute la vie. Ce développement peut être influencé par différents facteurs, menant ainsi à l’être humain que nous sommes devenus. La douleur est un facteur important à considérer puisqu’elle peut influencer nos réactions futures. En effet, cette sensation désagréable visant normalement à nous protéger, peut malheureusement nuire à notre développement si elle survient à un moment critique de formation des connections neuronales, comme lors de la naissance. Le développement des voies de transmission et de modulation de la douleur peut donc être affecté par le déroulement de la période gestationnelle. Les points qui étaient importants à considérer lors de ce projet doctoral étaient donc la douleur et ses mécanismes de modulation, l’impact d’une naissance prématurée ou de la douleur subie à la naissance sur la réponse ultérieure à la douleur et finalement les différences entraînées par ces facteurs sur le développement normal de cette réponse à la douleur, et ce jusqu’à l’âge adulte.
1.1 La DOULEUR
La douleur est essentielle à la survie. Elle sert de signal d’alarme et permet de favoriser la guérison en nous poussant à consulter et recevoir les soins appropriés pour une maladie qui n’aurait pas nécessairement de manifestations physiques visibles. Cependant, la douleur peut parfois dépasser sa fonction principale et devenir une menace pour l’organisme. En effet, un patient qui souffre peut perdre l’appétit et l’organisme sera donc privé des apports énergétiques essentiels. Il faut alors trouver un moyen de la soulager. Il existe différents mécanismes endogènes qui contrôlent naturellement la douleur. En effet, les afférences nociceptives peuvent subir de nombreuses influences des systèmes endogènes de modulation de la douleur (Marchand, 2009). Ces influences sont retrouvées à
trois niveaux du système nerveux central : au niveau spinal, au niveau du tronc cérébral et au niveau des centres supérieurs (voir figure 1).
a) Niveau spinal : dès son entrée dans la moelle épinière, l’information nociceptive
peut être modulée. Cette idée a été avancée pour la première fois par Melzack et Wall (1965) avec la publication de la théorie du portillon. En effet, selon cette théorie, la stimulation des fibres Ap (fibres responsables des afférences non-nociceptives) active les intemeurones inhibiteurs des cornes postérieures de la moelle et bloque alors les fibres nociceptives (A8 et C) au niveau de la moelle, produisant ainsi une analgésie localisée à cette région spinale.
b) Niveau du tronc cérébral : plusieurs régions du tronc cérébral, comme la
substance grise périaqueducale (SGPA) et le bulbe rostro-ventral, peuvent produire une modulation de la douleur (Basbaum et Fields, 1978). Une stimulation nociceptive qui recrute les fibres de petit diamètre peut activer les neurones du bulbe rostro-ventral qui vont ensuite inhiber l'activité des neurones nociceptifs des cornes dorsales de la moelle. Cette inhibition porte le nom de contrôle inhibiteur diffus nociceptif (CIDN). Contrairement à la théorie du portillon, le CIDN produit une inhibition descendante de la douleur qui ne se limite plus à la région stimulée (Le Bars et a l, 1979). L'application d'un stimulus nociceptif intense, c’est-à-dire d’une durée assez longue, sur une surface assez grande et d’une intensité assez forte, envoie des afférences vers la SGPA et le noyau raphé magnus (NRM) qui vont à leur tour envoyer des efférences inhibitrices vers différents segments de la moelle et donc produire une inhibition diffuse de la douleur. Plusieurs neurotransmetteurs sont responsables de cette inhibition dont la sérotonine et la noradrénaline, qui se retrouvent plus particulièrement dans le NRM et la SGPA, ainsi que les opioïdes endogènes (Millan, 2002).
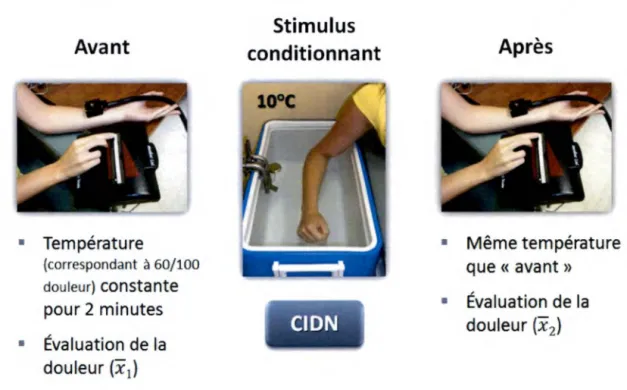
L’effet du CIDN peut être mesuré en laboratoire par l’application d’un stimulus nociceptif avant et après l’utilisation d’un stimulus conditionnant. Le stimulus nociceptif peut consister en l’application d’une température chaude, d’une pression ou d’une
stimulation électrique sur une partie du corps différente de celle utilisée pour le stimulus conditionnant. Le premier stimulus nociceptif (par exemple une température chaude déterminée) est repris sans modification après le stimulus conditionnant. Le stimulus conditionnant, qui consiste en l’application d’une stimulation douloureuse sur une autre partie du corps, doit provoquer une douleur d’une intensité assez élevée pour aller recruter le CIDN. Une étude a démontré qu’une intensité de plus de 20/100 de douleur pouvait activer ce mécanisme (Granot et al., 2008). La force de cette activation est déterminée par la comparaison de l’évaluation de la douleur avant et après le stimulus conditionnant.
Une récente étude a démontré que l’activation du CIDN lors d’un bain d’eau froide (12°C), c’est-à-dire la diminution diffuse de la douleur, était reproductible dans une même séance, avec un excellent coefficient de corrélation. Ce coefficient demeurait bon si plusieurs séances étaient comparées (Lewis et a i, 2012). Ils ont également démontré que le CIDN demeurait activé 10 minutes après la stimulation, mais revenait à un niveau de base après 15 minutes. Les différentes études sur le sujet ne s’entendent pas sur la durée de l’inhibition de la douleur, principalement parce que les techniques utilisées diffèrent (Pud et
a i, 2009; Serrao et al., 2004; Tuveson et al., 2006). Toutefois, il semble certain que
l’activation se maintiendrait pour au moins 5 minutes suite au stimulus conditionnant ce qui permettrait de voir efficacement l’effet du CIDN sur le stimulus douloureux appliqué par la suite.
c) Niveau des centres supérieurs : c’est au niveau des régions corticales que les
composantes sensorielles et émotionnelles de la douleur sont interprétées. L’hypnose est un bon exemple du potentiel analgésique des centres supérieurs. En effet, l’hypnose permettrait une maîtrise volontaire de la perception de la douleur (Rainville, 2002). Une stimulation externe comme les odeurs peut également influencer la réponse à la douleur au niveau des centres supérieurs. En effet, une odeur sucrée agréable peut augmenter la tolérance à la douleur (Prescott et Wilkie, 2007).
Figure l : Voie de modulation de la douleur
a) au niveau spinal (théorie du portillon), b) au niveau du tronc cérébral (CIDN), c) au niveau des centres supérieurs (composantes sensorielles et émotionnelles).
Tiré de Marchand (2009).
1.2 DÉVELOPPEMENT DE L'ENFANT
La période gestationnelle est divisée en 3 trimestres. À la fin du premier trimestre, tous les systèmes majeurs sont développés. Une grossesse à terme compte 40 semaines de gestation tandis qu 'une gestation de moins de 36 semaines entraîne une naissance prématurée. Les bébés de plus de 32 semaines ont de bonnes chances de survie malgré leur naissance prématurée. Néanmoins, à partir de 26 semaines de gestation, un nouveau-né peut survivre s' il est gardé en observation aux soins intensifs néonataux (Moore et Persaud, 2008).
Suite à la naissance, l'enfant va passer par plusieurs stades de développement avant d'atteindre l'âge adulte. L'adolescence est la période de transition entre l'enfance et l'âge adulte. Les différents stades de développement peuvent être caractérisés par les 5 stades de
Tanner (Marshall et Tanner, 1969; Marshall et Tanner, 1970). Le début de la puberté marquant le stade 1, la puberté avancée étant caractérisée par le stade 3 et la fin de la puberté survenant au stade 5 (Lu et al., 2005).
La puberté chez l’homme débute habituellement vers l’âge de 12 ans tandis qu’elle survient plus tôt chez la femme, soit vers l’âge de 10 ans (PAMF, 2001). Durant cette période, le taux d’hormones sexuelles va augmenter. En effet, durant la puberté, le niveau d’œstrogène est 8 fois plus élevé qu’en période prépubère chez la femme tandis que chez l’homme le niveau de testostérone est 18 fois plus élevé (Litt, 1991). Les femmes terminent leur période pubertaire vers l’âge de 16-17 ans tandis que les hommes la complètent vers
17-18 ans (Marshall et Tanner, 1986).
1.3 Dé v e l o p p e m e n t des v o ie s de t r a n s m is sio n d e la d o u l e u r
Scientifiques et médecins ont longtemps pensé que les bébés et les jeunes enfants ne ressentaient pas la douleur et qu’ils n’avaient aucun souvenir de celle-ci (McGrath, 1990; Ross et Ross, 1984). Jusque dans les années 1990, il était considéré que l’expérience de la douleur débutait à environ 12 mois postnatals (Derbyshire, 1999). Il est maintenant bien accepté que les bébés ont non seulement le bagage nécessaire pour ressentir la douleur, mais que leur système nerveux est suffisamment développé à 24 semaines in utero pour transmettre les stimuli nociceptifs (Fitzgerald, 1995; Fitzgerald et Anand, 1993; Grunau, 2002). Suite à ces observations, V International Association fo r the Study o f Pain (IASP) a reconnu la nécessité de modifier la définition de la douleur généralement acceptée pour ajouter que l’impossibilité de communiquer ne permet en aucun cas de supposer que l’individu ne vit aucune douleur et il doit donc pouvoir recevoir un traitement considéré approprié, visant à soulager sa douleur (IASP, 2001).
Il est maintenant bien démontré que le système permettant la transmission de la douleur se développe tout au long de la grossesse (voir figure 2). En effet, à la 11e semaine de grossesse, les terminaisons nerveuses sur le visage, les paumes et les plantes des pieds
sont développées. Celles du tronc cérébral et des membres proximaux sont terminées dès la 15e semaine. À partir de la 20e semaine, les terminaisons nerveuses sensitives sur les muqueuses et le reste des aires cutanées se développent (Anand, 2000; Anand et Craig, 1996). Dès la 24e semaine de gestation, les voies thalamiques de transmission de la douleur sont complètes (Anand et Hickey, 1987; Kostovic et Rakic, 1990). À la 30e semaine, la myélinisation des voies de transmission de la douleur vers le tronc cérébral et le thalamus est complétée. Finalement, à la 37e semaine, la myélinisation complète des voies nociceptives est terminée (Dooling, 1983).
Le troisième trimestre de la grossesse est un moment critique pour l’organisation du système nerveux (Fitzgerald et Anand, 1993; Mitchell et Boss, 2002). De plus, au moment de la naissance, le cerveau connaît une période de croissance rapide (Anand et Scalzo, 2000; Rakic, 1985; Rakic, 1998). Toutes les structures neurologiques et les neurotransmetteurs requis pour la transmission et l’interprétation de la douleur sont présents à la naissance (Anand et Carr, 1989; Bouza, 2009), ce qui suggère que les nouveau-nés sont très sensibles à la douleur et possiblement même plus qu’un adulte. Plusieurs raisons peuvent expliquer cette sensibilité accrue. En effet, la densité de fibres nociceptives sur la peau d’un bébé est similaire ou possiblement plus grande que chez les adultes (Anand, 2000). Aussi, les neurotransmetteurs impliqués dans la nociception sont fonctionnels et présents en abondance dès la 20e semaine de gestation. De plus, la myélinisation incomplète des fibres responsables de la transmission de la douleur chez le bébé prématuré n’empêche pas la transmission de la douleur. En effet, la plus courte distance du trajet de la douleur compense pour la transmission plus lente causée par la myélinisation incomplète (Anand, 1998; Anand et Scalzo, 2000; Perreault et a i, 1997).
9esemalne
n..v uses iensori 1 <lions la régl6n pérl otale
nerveus.es sensorielles au n eau du vls.;oge, d s~umesde l• ~h 1 d I~ piani d s ple-ds nive uduto"t ldH eiurémltés proximales 12" semalne:d but du d veloppeml!'/11 de li VOIO Me\lr• I
Figure 2 : Développement des voies nociceptives. Traduit de Puchalski et Hummel (2002)
30" semai ne: myéNnisat;on du 'tronc têrét>r.11 et de la
vol thal•miqu
1.4 DÉVELOPPEMENT DES MÉCANISMES DE MODULATION DE LA DOULEUR
Comme mentionné précédemment, plusieurs régions du tronc cérébral comme la SGPA et le bulbe rostro-ventral peuvent produire une modulation de la douleur (Basbaum et Fields, 1978). Une stimulation nociceptive qui recrute les fibres de petit diamètre peut activer les neurones du bulbe rostro-ventral qui vont ensuite inhiber l'activité des neurones nociceptifs des cornes dorsales de la moelle. Cette inhibition porte le nom de contrôle inhibiteur diffus nociceptif (CTDN). Le CIDN produit une inhibition descendante de la douleur qui ne se limite pas à la région stimulée (Le Bars et al., 1979; Talbot et al. , 1989; Talbot et al., 1987).
Chez les nouveau-nés, cette voie inhibitrice descendante n'est pas fonctionnelle à la naissance et ne mature complètement que dans la première année de vie (Coskun et Anand, 2000; Fitzgerald, 1995; Fitzgerald et Koltzenburg, 1986; Mitchell et Boss, 2002; Porter et
al., 1999). Les études animales ont permis de confirmer cette théorie en utilisant le test à la
formaline. Ce test consiste en l’injection de formaline (une substance inflammatoire) dans la patte d’un rat afin de produire trois phases de réponse : la phase nociceptive, l’interphase et la phase inflammatoire. Les réactions inflammatoires produites par la formaline causent des changements au niveau du comportement de l’animal face à sa patte injectée. Ce test est reproductible et fréquemment utilisé en recherche animale pour étudier la douleur. (Gaumond et al., 2002). L’inhibition de la douleur retrouvée lors de l’interphase est un phénomène d’inhibition endogène qui s’apparente au CIDN (Henry et al., 1999). Cette inhibition est retrouvée seulement à partir du 15e jour postnatal chez le rat (Guy et Abbott, 1992). De plus, l’analgésie engendrée par un stimulus provenant de la substance grise périaqueducale (SGPA) est produite seulement à partir du 21e jour postnatal chez le rat, ce qui pourrait être expliqué par le manque d’inhibition descendante dû à un développement incomplet des voies inhibitrices descendantes (van Praag et Frenk, 1991).
Chez le nouveau-né, la maturation des voies inhibitrices pourrait être retardée dans la région supraspinale. En effet, les intemeurones situés dans la région supraspinale maturent principalement après la naissance (Bicknell et Beal, 1984). Il pourrait également y avoir à la naissance un manque de neurotransmetteurs inhibiteurs tels la sérotonine et la noradrénaline ou encore de leurs récepteurs (Bregman, 1987; Commissiong, 1983). Ces études permettent de conclure que les mécanismes de contrôle de la douleur ne sont pas complètement développés à la naissance.
1 .5 Les y s t è m e n e r v e u xa u t o n o m e
Le système nerveux autonome (SNA) contrôle, en autre, les fonctions cardiovasculaires et a pour but de maintenir l’homéostasie. Il se divise en deux sous- systèmes soit le système nerveux sympathique (SNS) et le système nerveux parasympathique (SNP). Ces deux fonctions sont essentiellement antagonistes. Le SNS a comme fonction l’accélération, en produisant de l’énergie tout en bloquant la digestion, tandis que le SNP sert plutôt de frein, en permettant le retour à la fonction de base,
favorisant la digestion. Le SNS entraîne généralement une augmentation du rythme cardiaque, tandis qu'à l'inverse, le SNP Je ralentit (voir figure 3 pour les différentes influences des deux systèmes).
Par11ympathlque Sympathique
SNP
Figure 3 : Les deux composantes du système nerveux autonome. Tiré de Bertrandy-Loubat et al. (2009)
SNS
Les deux sous-systèmes du SNA peuvent être évalués à l'aide d' un électrocardiogramme (ECO). L'analyse spectrale de l'ECG permet, en effet, de déterminer deux composantes, les basses et hautes fréquences, représentant respectivement les influences sympathiques et parasympathiques sur le SNA (TaskForce, 1996). Le pic retrouvé dans les basses fréquences (0,05-0, 15 Hz) lors de l'analyse spectrale du rythme cardiaque, reflète les oscillations cardiaques lentes. Ces oscillations, régulées par les baroréflexes, sont influencées par les réponses sympathiques (Berntson et al. , 1997). Le deuxième pic, observé dans les hautes fréquences (0, 15-0,4 Hz), représente l'activité vagale (parasympathique) sur Je SNA (Berntson et al., 1997).
Il est important de considérer la régulation cardiaque par le système nerveux autonome lors de l’étude de la douleur puisque plusieurs structures du cerveau sont impliquées dans les deux mécanismes. En effet, la substance grise périaqueducale, le locus coeruleus, la médulla rostro-ventrale ainsi que le tractus solitaire jouent un rôle tant dans l’inhibition descendante de la douleur que dans la régulation cardiaque (Millan, 2002). Les systèmes contrôlant les fonctions cardiovasculaires sont donc fortement associés aux systèmes de modulation de la douleur (Randich et Maixner, 1984). Puisque ces deux systèmes sont inter reliés, il est possible de penser que la fonction à cardiaque pourrait être modifiée en réponse à la douleur à la naissance.
1.6 Les no uveau-nés et la d o u l e u r
Les mécanismes de transmission de la douleur sont donc bien développés chez les nouveau-nés (Puchalski et Hummel, 2002), mais leur système de modulation de la douleur est encore immature (Mitchell et Boss, 2002; Winberg, 1998). De plus, puisque les afférences sensorielles peuvent être modifiées ou s’adapter en période néonatale (Ren et Dubner, 2007), les expériences douloureuses à la naissance pourraient entraîner des effets néfastes à long terme. Une étude chez le rat, qui est semblable à la naissance à un bébé né prématurément, vient appuyer cette hypothèse. En effet, les rats ayant été blessés à la patte aux jours 3 et 6 suivant la naissance, donc au moment correspondant à la période néonatale chez l’humain, présentent une augmentation de leur réponse à la douleur 2 semaines plus tard comparativement aux animaux n’ayant pas subi de procédure douloureuse à la naissance. Toutefois, lorsque cette procédure douloureuse était réalisée à un âge plus avancé (aux jours 10, 21 ou 40, correspondant à la période entre l’enfance et l’adolescence chez l’humain), elle n’entrainait pas de différence au niveau de la réponse à la douleur 2 semaines plus tard par rapport aux animaux contrôles (Walker et al., 2009b). La première semaine de vie serait donc une période critique pour provoquer une modification dans la réponse à la douleur à long terme. Nous pouvons donc penser que la combinaison de ces facteurs diminue alors la capacité de l’enfant à gérer la douleur survenant après naissance. En effet, lorsque le stimulus nociceptif atteint le cortex, il provoque une activation de régions spécifiques en réponse à la douleur, comme le cortex somatosensoriel (Bartocci et
a i, 2006; Slater et a i, 2010b), et modifie le traitement de l’information douloureuse de
façon périphérique (Fitzgerald, 2005; Walker et a i, 2009a) et centrale (Goffaux et al., 2008; Ozawa et al., 2011; Slater et al., 2010b) chez le nouveau-né.
Malheureusement, il est difficile d’évaluer la douleur chez les nouveau-nés puisqu’ils sont incapables de verbaliser leur douleur (Whitfield et Grunau, 2000). D’autres outils ont dû être développés pour tenter d’évaluer la douleur en période néonatale (voir figure 4). L’évaluation des pleurs, des expressions faciales, des mouvements ou encore des variations dans le rythme cardiaque ou la saturation en oxygène est fréquemment utilisée aux soins intensifs néonataux (Bellieni, 2012; Craig, 1998; Craig et al., 2002; Craig et al., 1993; Stevens et a i, 2010; Sweet et McGrath, 1998). Toutefois, les échelles comportementales développées à partir de ces évaluations comportent plusieurs limites comme par exemple, le fait que l’évaluation dépend d’un jugement subjectif de la part du médecin ou de l’infirmière peut entraîner une mauvaise évaluation de la douleur (Riva et
a i, 2011). Les variabilités inter juges peuvent être diminuées par la formation ou
l’expérience, néanmoins elles ne sont pas complètement éliminées. Aussi, les réponses observées peuvent être causées par d’autres facteurs, par exemple les pleurs qui peuvent être déclenchés par la faim ou la colère (Hadjistavropoulos et a i, 1997). Lors de l’évaluation comportementale, il est également important de prendre en considération que les enfants ne sont pas toujours capables de produire une réponse face à la douleur (Awhonn, 2002). En effet, il est rapporté que les nouveau-nés prématurés, possiblement à cause d’un stress chronique, ne présentent pas les comportements liés à la douleur normalement retrouvés chez les bébés à terme (Grunau et a i, 2001b). Le stress peut également influencer la réponse physiologique observée et donc ne pas refléter directement la réponse à la douleur.
Figure 4 : Signes de douleur chez les enfants
1 : pleurs, 2 : tachycardie, 3 : polypnée, 4 : mouvements des mains et des pieds, 5 : sudation, 6 : sourcils froncés, 7 : paupières serrées, 8 : sillon naso-labial accentué, 9 : ouverture de la bouche, 10 : rythme cardiaque, 11 : saturation en oxygène, 12 : pression artérielle, 13 : adrénaline, cortisol, endorphines.
Tiré de Bellieni (2012)
En plus des problèmes d'évaluation de la douleur, le fait que les procédures soient souvent effectuées en urgence et que les médecins ont peur des effets secondaires des médicaments analgésiques (qui seraient potentiellement plus grands que les bénéfices) peut entraîner une sous-analgésie chez ces nouveau-nés (Johnston et al., 1997; Lago et al.,
2009). De plus, les techniques actuelles pour soulager la douleur aigüe posent des limites. En effet, elles permettent de diminuer les signes visibles de douleur, mais leur impact au niveau de la transmission de la douleur est controversé. Par exemple, l'administration orale d' une solution sucrée concentrée (notamment le sucrose), le contact peau à peau entre la mère et le nouveau-né ou encore l'allaitement maternel durant les gestes douloureux mineurs peuvent être utilisés pour diminuer les réponses visible de la douleur (Johnston et al., 2011 ). Néanmoins, ces techniques peuvent réussir à diminuer la réponse comportementale et physiologique sans toutefois réussir à diminuer le signal au niveau cortical (Slater et al., 201 Oa). Ceci reste toutefois à être confirmé. Malgré tout, ceci pourrait
entraîner une certaine vulnérabilité cérébrale chez ces enfants. De plus, les analgésiques topiques pouvant être utilisés lors de procédures de courte durée, comme les prises de sang, n’ont pas démontré d’efficacité pour diminuer la réponse à la douleur (Stevens et a i, 1999). Alors, considérant que les procédures douloureuses sont rarement correctement soulagées (Simons et al., 2003), il est important de vérifier l’impact à long terme de ces expériences.
Toutefois, la douleur étant multifactorielle, l’ensemble des études sur le sujet suggère qu’il pourrait y avoir plusieurs facteurs influençant la réponse à la douleur, dont l’âge gestationnel, l’âge au moment de l’évaluation subséquente de la douleur, ainsi que le nombre de procédures douloureuses subies à la naissance. Il est donc important de tenir compte de tous ces facteurs lors de l’évaluation de l’impact d’une naissance prématurée ou de la douleur à la naissance sur la douleur à long terme. Plusieurs études se sont penchées sur l’influence de ces différents facteurs, elles seront donc présentées dans la prochaine section de la thèse.
Chaque année, plusieurs accouchements surviennent prématurément. Un nouveau- né prématuré est très différent d’un nouveau-né à terme au niveau du stade de développement à la naissance. De plus, chez ces bébés, plusieurs procédures douloureuses seront nécessaires au suivi médical. Ces procédures surviennent à un moment critique du développement cérébral de ces enfants. Une modification au niveau du cerveau pourrait être une conséquence grave de cette naissance avant terme. Plusieurs études se sont intéressées à cette population vulnérable et démontrent des différences tant au niveau du comportement, de la variabilité cardiaque que de la réponse à la douleur, et ce, même après la sortie des soins intensifs. Un nouveau-né à terme peut également subir des procédures douloureuses dès les premiers jours de vie. Puisque le cerveau de ces bébés poursuit son développement lors de ces procédures, quelques auteurs se sont intéressés aux impacts retrouvés chez ces sujets. De plus, la réponse à la douleur, tant la transmission que la modulation, varie en fonction de l’âge, il est donc important de tenir en compte ce facteur lors de l’évaluation de la douleur chez cette population. Les études évaluant ces différents facteurs seront explicitées dans les prochaines sections de la thèse.
2 .1 LES NOUVEAU-NÉS PRÉMATURÉS
Au Québec, il y a environ 7% des naissances qui surviennent avant 37 semaines de gestation, donc qui sont dites prématurées, ce qui représente globalement plus de 6000 naissances vivantes par année selon Statistique Canada (2010). Une naissance prématurée entraîne une augmentation du temps passé aux soins intensifs néonataux, et par conséquent une augmentation du stress subi par le nouveau-né par la lumière, le bruit, les manipulations fréquentes, mais surtout par les procédures douloureuses invasives. En effet, un bébé prématuré peut subir jusqu’à 766 procédures invasives lors de son séjour aux soins intensifs, ce qui correspond à environ 14 procédures par jour (Porter et al., 1999; Simons et
al., 2003). Ces procédures causent, bien évidemment, de la douleur aigüe. Cette douleur est
situation d’urgence et donc on rapporte un manque de temps pour l’utilisation d’analgésiques (Johnston et a l, 1997).
Une étude prospective plus récente a évalué toutes les procédures douloureuses subies par les nouveau-nés admis aux soins intensifs néonataux, qui n’étaient toutefois pas nécessairement nés prématurément (âge gestationnel variant de 24 à 42 semaines) (Carbajal
et a l, 2008). Ils rapportent que presque 70 000 procédures ont été enregistrées, et de ce
nombre, 70% étaient douloureuses. De plus, 11 500 procédures ont nécessité plus d’un essai et 90% étaient douloureuses. Une procédure était considérée douloureuse si elle envahissait l’intégrité corporelle du nouveau-né, provoquant des lésions cutanées ou des muqueuses par l’introduction ou le retrait de corps étrangers dans les voies respiratoires, le tube digestif ou la voie urinaire. Ces nouveau-nés ont subi une médiane de 115 procédures durant les 14 premiers jours de vie, desquelles 75 étaient douloureuses. De toutes les procédures douloureuses, une forme d’analgésie était utilisée dans seulement 20,8% des cas, ce qui incluait des techniques non pharmacologiques (18,2%), seulement pharmacologiques (2,1%) ou une combinaison des 2 (0,5%). Cela implique donc que dans 79,2% des cas, aucune forme d’analgésie n’était utilisée (Carbajal et al., 2008).
2.2 Dé v e l o ppe m e n t de t r o u b l e s c o g n it if s, p s y c h o l o g iq u e s e t COMPORTEMENTAUX CHEZ LES PRÉMATURÉS
Plusieurs études ont porté sur le développement cognitif, comportemental et émotionnel des anciens prématurés. Il y a maintenant plusieurs évidences démontrant qu’une naissance prématurée a un grand impact au niveau du développement.
Une étude a démontré qu’à l’âge de 6 ans, 22% des enfants nés avec un petit poids de naissance (< 2500g) présentaient au moins un problème psychiatrique; les déficits d’attention et les problèmes d’anxiété étant les plus communs (Whitaker et al., 1997). Les enfants prématurés (nés à moins de 37 semaines) maintenant d’âge scolaire ont effectivement 2,64 fois plus de risque (intervalle de confiance à 95% : 1,8-3,8, p<0,001) de
développer des problèmes d ’attention et d’hyperactivité et manifestent plus fréquemment des comportements extemalisant et intemalisant à cet âge (Bhutta et al., 2002). Les comportements extemalisant sont caractérisés par des comportements visant à blesser les autres, à diriger son énergie problématique à l’extérieur. Ceux-ci incluent les agressions physiques, le vandalisme ou l’intimidation. Au contraire, les comportements intemalisant sont des actions visant à se blesser soi-même. Ils comprennent des comportements comme la dépression, l’abus de substances ou la mutilation. Un suivi de 137 enfants de très petit poids de naissance (< 1250g), âgés d’environ 12 ans, a également démontré que 23% de ceux-ci présentaient un problème d’attention et d’hyperactivité, 34% présentaient des symptômes dépressifs (Botting et al., 1997), contrairement à seulement 8% dans la population en général chez ce même groupe d’âge (Eapen et Cmcec, 2012). De plus, 8% des adolescents nés prématurément (< 30 semaines de gestation) présentaient une anxiété généralisée et une augmentation des difficultés comportementales lorsqu’ils étaient évalués par les parents et les professeurs (Botting et al., 1997). Une autre étude a démontré que les adolescents nés prématurément ont 11 fois plus de risque de développer un problème de dépression que des adolescents nés à terme (Patton et al., 2004). Les problèmes de dépressions sont d’autant plus importants à vérifier dans cette population puisque la dépression est un phénomène souvent reliée à la douleur chronique chez l’adulte. En effet, la dépression et la douleur partagent les mêmes neurotransmetteurs et voies de transmission (Bair et al., 2003). Plusieurs études ont démontré un lien bidirectionnel entre ces 2 facteurs (Bair et al., 2003; Leino et Magni, 1993; Von Korff et Simon, 1996). Les patients souffrant de douleur chronique présentent plus de symptômes de dépression, mais la dépression pourrait également augmenter les symptômes de douleur (Gayman et al., 2011). Les sujets nés prématurément pourraient donc potentiellement avoir une réponse à la douleur différente de la réponse des sujets nés à terme qui serait en partie expliquée par la présence de dépression chez ces sujets. Il est donc essentiel de l’évaluer lorsqu’on s’intéresse à la réponse à la douleur.
Une naissance prématurée a donc plusieurs impacts tant au niveau du développement cognitif et psychologique qu’au niveau des comportements. En voici d’autres exemples : il a été démontré que les enfants nés prématurément âgés de 3 à 9 ans,
même ceux ayant des scores d’intelligence normaux, redoutaient la nouveauté et présentaient des comportements anxieux lorsqu’ils avaient à participer à une nouvelle tâche cognitive (Grunau, 2003; Whitfield et al., 1997). De plus, une augmentation significative de la prévalence de déficits neurologiques, de troubles comportementaux et de problèmes psychosociaux ont été retrouvés chez d'anciens prématurés tant dans l’enfance qu’à l’adolescence. Les enfants prématurés ont donc plus de risques de développer des déficits au niveau cognitif, des problèmes d’apprentissage, des déficits moteurs, des problèmes de comportement et d’attention (Bouza, 2009; Hack et al., 2002; Hack et al., 1995; Marlow et
al., 1993; Rickards et al., 2001).
L’étude de Rickards et collaborateurs (2001) a comparé des enfants nés prématurément (âge gestationnel moyen 29,5 semaines ±1.7), âgés de 14 ans, à des enfants du même âge nés à terme. Les anciens prématurés démontraient significativement plus de difficultés cognitives lors des tests de mémoire visuelle ou des tests de résolution de problèmes. Les professeurs identifiaient ces enfants nés prématurément comme étant plus rejetés par les autres enfants. De plus, les parents indiquaient la présence de troubles d’apprentissage à l’école chez ces enfants. À 14 ans, ces enfants avaient plus de problèmes cognitifs, académiques ainsi que comportementaux et démontraient une plus faible estime de soi que les enfants nés à terme. Il est possible de penser que ces différences seraient moins flagrantes de nos jours puisque de plus en plus d’enfants, pas nécessairement nés prématurément, présentent des troubles de comportement comme le trouble déficitaire de l’attention avec ou sans hyperactivité (TDAH) (Greydanus et al., 2007). Toutefois, aucune étude plus récente ne rapporte de données sur ce sujet.
11 a également été démontré que l’impulsivité, l’incapacité à faire face à des situations nouvelles, les difficultés d’adaptation et les problèmes d’apprentissage sont très fréquents chez les enfants nés prématurément (âge gestationnel moyen 30 semaines ± 2) (Vohr et al., 1992). Ces conséquences se maintiennent à long terme. En effet, le suivi jusqu’à l’adolescence d’une cohorte de sujets nés prématurément a démontré que ces sujets présentaient des difficultés à l’école, lors d ’interactions sociales ainsi que des problèmes d’estime de soi et des problèmes d’anxiété et de dépression (Whitfield et Grunau, 2000).
Une étude a démontré qu’il semble y avoir une courbe dose-réponse entre le degré de prématurité et les niveaux sous-optimaux de développement cognitif même en absence de troubles physiques ou mentaux sévères (Bhutta et a i, 2002). L’impact au niveau cognitif persiste pendant l’adolescence et même jusqu’à l’âge adulte (Msall et Park, 2008). Comme pour les problèmes cognitifs, les problèmes comportementaux et émotionnels ont une relation dose-réponse avec le degré de prématurité. En effet, les enfants nés prématurément présentent un plus haut taux de dépression et d’anxiété comparé à ceux nés à terme (Wolke,
1998).
2.3 Im pa c t sur la v a r ia b il it é du r y t h m e c a r d ia q u e
Tel que mentionné précédemment, une naissance prématurée survient à un moment critique du développement des différents systèmes, tant au niveau de la douleur que de la régulation cardiaque. En effet, Randich et Maixner (1984) ont démontré que les systèmes contrôlant les fonctions cardiovasculaires sont fortement associés aux systèmes de modulation de la douleur. Cette naissance avant terme peut donc entraîner des altérations au niveau de la modulation du rythme cardiaque chez les enfants et adolescents nés prématurément, ce qui laisse croire que ces systèmes pourraient être modifiés soit par une naissance prématurée ou encore par la douleur à la naissance. En effet, des études démontrent que les sujets nés prématurément présentent une pression artérielle au repos plus élevée comparés à des sujets nés à terme (Norman, 2010). De plus, une étude récente rapporte que des sujets prématurés âgés de 18 à 24 ans présentent au repos une pression systolique plus haute, une pression diastolique plus faible, un rythme cardiaque plus élevé, mais une variabilité de la pression diastolique plus grande comparés à des sujets sains (Kerkhof et al., 2012). En fait, l’âge gestationnel est inversement corrélé avec tous ces facteurs, sauf la pression diastolique, qui elle présente une association positive. Ces corrélations demeurent significatives même après l’ajustement pour des facteurs confondants incluant le poids et la taille à la naissance. L’étude de Siewert-Delle et Ljungman (1998) va dans le même sens. Ils rapportent que chaque semaine de gestation additionnelle entraînerait une diminution de la pression systolique de 7,2 mmHg.
Plusieurs mécanismes sont avancés pour expliquer cette pression artérielle plus élevée chez les anciens prématurés. Toutefois, la plupart des études rapportent des différences en fonction du poids à la naissance plutôt que directement en fonction de l’âge gestationnel. Néanmoins, les bébés prématurés ayant, la plupart du temps, un plus petit poids de naissance que les bébés nés à terme, il est possible de penser que ces conclusions s’adressent également à ce groupe. Parmi ces mécanismes, un faible poids de naissance a été associé à une réduction du nombre de néphrons (l’unité fonctionnelle du rein, responsable entre autre de la formation d’urine), ce qui pourrait expliquer l’augmentation de la pression artérielle retrouvée chez ces sujets (Hoy et al., 2005). En effet, ceci causerait une diminution dans la filtration glomérulaire, ce qui a été associé au développement de l’hypertension chez le rat (Woods, 1999). Cette réduction du nombre de néphrons pourrait être expliquée par le fait que le petit poids de naissance est possiblement causé par un apport en nutriments inadéquat durant la grossesse, qui entraînerait le développement préférentiel de certaines fonctions considérées comme vitales au détriment des autres, comme le rein. Une fonction rénale altérée pourrait donc être retrouvée chez des enfants prématurés et expliquer la hausse de pression artérielle, (pour une revue de la littérature sur le sujet, voir Nuyt (2008) et Nuyt et Alexander (2009)).
En plus des modifications au niveau du rythme cardiaque et de la pression artérielle de base, la variabilité cardiaque est également importante à considérer chez cette population puisqu’elle est souvent utilisée comme outil d’évaluation de la douleur procédurale survenant suite à la naissance. En effet, puisque l’évaluation verbale de la douleur n’est pas possible chez les nouveau-nés, l’évaluation de la réponse cardiaque face à la douleur peut être utilisée en combinaison avec l’évaluation comportementale (Bellieni, 2012; Craig, 1998; Craig et al., 2002; Craig et al., 1993; Schechter et al., 1993; Stevens et a l, 2010; Sweet et McGrath, 1998). Toutefois, il faut être vigilant lors de l’interprétation de cette variabilité cardiaque chez les nouveau-nés prématurés, puisque ces variations peuvent être influencées par différents facteurs comme le contexte ou encore le stress relié à la douleur. Les bébés nés à terme présentent une augmentation des pleurs et des mouvements accompagnés d’une augmentation du RC et de la pression artérielle suite à une procédure douloureuse. Au contraire, les nouveau-nés prématurés deviennent bradycardes,
léthargiques et ne répondent plus lors de la répétition de douleurs procédurales (Awhonn, 2002). Ce phénomène peut être expliqué par le fait que le système nerveux central n’est pas capable de produire une réponse à la douleur et non par une absence de douleur (Awhonn, 2002).
Chez des enfants à terme, les changements au niveau du RC diffèrent en fonction de l’âge. Lorsqu’ils sont évalués pendant une prise de sang à 4 mois et 8 mois, le RC augmente suite à la procédure. De plus, il y a une diminution significative dans le contrôle parasympathique à 4 et à 8 mois. Toutefois, il y a un changement développemental dans la réponse. En effet, à 4 mois il y a une augmentation de la modulation sympathique plus grande, mais de plus courte durée, tandis qu’à 8 mois cette augmentation est au contraire plus soutenue et le retrait parasympathique est plus faible (Oberlander et al., 1999).
Les études ayant évalué spécifiquement la variabilité du rythme cardiaque en réaction à des procédures douloureuses chez les nouveau-nés prématurés présentent jusqu’à présent des résultats contradictoires. Quelques études démontrent une augmentation du RC ainsi qu’une diminution du tonus sympathique pendant une prise de sang chez les nouveau- nés prématurés (Grunau et al., 2001a; Lindh et al., 1997; McIntosh et al., 1993). Toutefois, une étude par Grunau et collaborateurs (2001b) vient nuancer ces résultats. En effet, ils rapportent qu’un âge gestationnel plus bas est lié à une réponse cardiaque plus faible à la douleur, donc une variation du RC en réponse à la douleur plus faible. Une explication possible serait que les enfants présentent une paralysie causée par la peur face à une situation de douleur, entraînant une inhibition temporaire du système nerveux sympathique (Lindh et al., 1999). Dans l’étude de Grunau et collaborateurs (2001b), les nouveau-nés prématurés présentaient également un RC de base plus élevé. Les auteurs concluent donc que l’exposition fréquente à la douleur dans un jeune âge est associée au développement d’un état de stress constant chez ces enfants. 11 est donc possible de penser qu’ils se protégeraient en n’augmentant plus leur rythme cardiaque lors d’un stress.
Une autre étude ajoute que les nouveau-nés prématurés présentent une diminution de la variabilité du RC (évaluée par l’analyse des basses et des hautes fréquences, représentant respectivement les influences sympathique et parasympathique) lors d’une prise de sang (Padhye et al., 2009). Toutefois, deux études récentes rapportent que les enfants nés prématurément ne présentent pas de modification de leur réponse cardiaque, donc pas d’augmentation ni de diminution de leur rythme cardiaque, suite à une procédure douloureuse, soit une prise de sang ou la vaccination (Grunau et a l, 2005; Grunau et al., 2010). Les résultats des études antérieures ne sont donc pas constants.
Toutes les études présentées précédemment ont évalué les changements dus à la douleur chez de jeunes enfants. Il semble toutefois y avoir une influence de l’âge. En effet, Johnston et collaborateurs (1996) ont démontré que la variation du rythme cardiaque moyen en réponse à une prise de sang diminue avec la maturité de l’enfant, suggérant indirectement un possible développement de la réponse cardiaque à la douleur. Toutefois, à notre connaissance, une seule étude a évalué ces changements au niveau du RC chez des enfants plus âgés (entre 7 et 12 ans), nés prématurément ou à terme, lors d’une procédure expérimentale (Goffaux et al., 2008). Après avoir séparé les sujets prématurés en fonction du niveau de douleur subi à la naissance, les analyses ont montré que les sujets nés à terme et les prématurés avec peu de douleur néonatale présentaient une augmentation significative du RC pendant le test de douleur qui consistait à immerger le bras dans un bain d’eau à 10°C pendant 2 minutes. Toutefois, les sujets ayant subi beaucoup de procédures douloureuses à la naissance ne présentaient pas de changements au niveau du RC moyen pendant le bain d’eau froide. Les procédures douloureuses subies à la naissance semblent donc avoir un impact à long terme sur la variabilité du rythme cardiaque.
2.4 Les nouveau-n é s p r é m a t u r é s e t la d o u l e u r
Une naissance prématurée entraîne des conséquences au niveau du développement du cerveau qui sont représentées par des problèmes de comportement. De plus, le troisième trimestre de la grossesse étant un moment critique pour l’organisation du système nerveux
et ce stade correspondant au moment où un enfant prématuré subit plusieurs procédures douloureuses aux soins intensifs néonataux (Mitchell et Boss, 2002), il est possible que des impacts soient également retrouvés au niveau de la réponse et de l’interprétation de la douleur. En effet, durant cette période critique, la transmission supraspinale des influx nerveux est facilitée tandis que la modulation de ces influx est rudimentaire (Ben-Ari et al., 1997; Flint et al., 1998; Vicario-Abejon et a l, 1998). La plasticité du cerveau pendant cette période explique que le cerveau de l’enfant est plus vulnérable aux effets délétères de la douleur (Mitchell et Boss, 2002). En effet, les expériences vécues par le nouveau-né peuvent modifier le développement des synapses et donc influencer l’organisation des structures nerveuses responsables de la perception de la douleur.
Des études effectuées chez l’animal ont permis de mettre en lumière la vulnérabilité à la naissance en réponse à ces procédures douloureuses. En effet, il a été démontré que la douleur répétée à la naissance chez les rats crée une augmentation de l’excitation neuronale et de la mort cellulaire dans de nombreuses régions corticales et sous-corticales, suggérant ainsi que la douleur a un impact généralisé sur le développement du cerveau (Anand et al., 2007). En effet, chez le nouveau-né, il a été suggéré que les procédures douloureuses répétées pourraient provoquer la rétention d’un grand nombre de synapses qui auraient autrement été détruites ou entraîner la formation de connexions anormales, ce qui expliquerait la sensibilité accrue à la douleur chez ces enfants (Anand et al., 1997; Grunau, 2000).
Ce phénomène de modification du développement des synapses est facilité de par l’anatomie de la corne dorsale des nouveau-nés qui est différente de celle des adultes (voir figure 5). En période néonatale, les fibres responsables de la transmission de l’influx douloureux, les fibres C, sont très près de celles responsables du toucher, les fibres A (Fitzgerald et Beggs, 2001). Une surutilisation des fibres C pourrait entraîner la formation de connexions anormales et donc, un stimulus normalement non douloureux comme le toucher deviendrait douloureux (Ren et Dubner, 1996). La différenciation entre les fibres du toucher et de la douleur se produit à un stade de développement cérébral plus avancé. En effet, Fabrizi et collaborateurs (2011) ont démontré à l’aide d’enregistrements
électro-encéphalographiques (EEG) chez des nouveau-nés prématurés que la réponse due au toucher et à la douleur est complètement séparable seulement après 35 à 37 semaines de gestation. À moins de 35 semaines, la décharge neuronale est non spécifique (Fabrizi et al. ,
2011 ). A fibera - carry touch meaugn C fibers - carry palnmeaagn SplnalCord Cl'OM4ecik>n
Figure 5 : Différences anatomiques entre la corne dorsale des adultes et des nouveau-nés. Tiré de Puchalski et Hummel (2002).
Chez ces nouveau-nés, toutes les structures neurologiques requises pour la transmission et l' interprétation de la douleur sont présentes à la naissance, toutefois les voies de modulation de la douleur continuent de se développer durant l'enfance. Les expériences douloureuses pourraient ainsi déterminer l'architecture finale du cerveau et donc modifier le développement général du système de douleur (Anand et Carr, 1989).
Une étude par Anand et collaborateurs (1999) a tenté de mettre en lumière l' impact de ces procédures douloureuses sur le développement des systèmes de douleur chez des rats. Les animaux exposés à de la douleur entre 0 et 7 jours de vie présentaient une expression diminuée de Fos (utilisé comme marqueur de l'activation neuronale suite au test de la plaque chaude à 65 jours de vie) au niveau du cortex somatosensoriel en comparaison
à un groupe de rats contrôle, en plus d'une diminution du seuil de douleur. La diminution de l'expression de Fos pourrait être expliquée par le fait que les animaux exposés à de la douleur néonatale présentaient des réactions de peur et figeaient lors du test de la plaque
chaude tandis que les animaux contrôle tentaient de s’échapper, ce qui aurait entraîné une réponse corticale plus forte. Les auteurs concluent donc qu’une augmentation de la plasticité du cerveau en période néonatale pourrait permettre ces changements, causant une augmentation de leur vulnérabilité au stress plus tard.
Une deuxième étude par Ruda et collaborateurs (2000), a déterminé que les rats ayant subi de la douleur à 0 ou 3 jours de vie, donc à un moment où les rats sont comparables à un nouveau-né prématuré au niveau de leur développement, présentaient également une augmentation différences nociceptives primaires dans les lames I et II de la moelle du côté affecté et ce même à l’âge adulte. Ceci démontre donc encore une fois que la douleur à la naissance peut avoir un impact sur le développement des systèmes de douleur. Toutefois, les rats stimulés à 14 jours de vie ne présentaient pas cette augmentation, ce qui laisse croire à une période critique pouvant entraîner de conséquences à long terme.
L’impact de la douleur en période néonatale alors que les voies de transmission et de modulation de la douleur sont en développement est donc potentiellement important, les enfants prématurés étant particulièrement susceptibles à ces changements. Toutefois, l’impact à long terme des douleurs subies à la naissance n’est pas encore très bien démontré. Quelques études se sont penchées sur l’influence de ces processus douloureux sur la sensibilité à la douleur dans l’enfance, mais à notre connaissance, une seule étude a tenté de déterminer l’impact à l’adolescence et aucune à l’âge adulte. La sensibilité à la douleur pouvant varier avec l’âge, il est important de considérer l’impact des procédures douloureuses et ce à différent moments de la vie.
Plusieurs études ont en effet rapporté une réponse altérée à la douleur chez des enfants nés prématurément (Grunau et al., 2001a; Grunau et al., 2001b; Hermann et al., 2006; Johnston et Stevens, 1996; Oberlander et al., 2000). Ces études ont déterminé que plus le nombre de procédures douloureuses subies à la naissance est élevé, plus la réponse comportementale à la douleur est faible dans la jeune enfance (Grunau et al., 2001a;
Johnston et Stevens, 1996). D’autres études ont démontré que des jeunes enfants nés prématurément expriment moins de comportements douloureux lors d’une procédure causant de la douleur. En effet, ils semblent avoir une réponse faciale diminuée à la douleur ainsi qu’une récupération plus rapide suite à une procédure douloureuse (Grunau et a l, 2001b; Oberlander et a l, 2000). Le niveau de cortisol plus bas retrouvé chez les enfants prématurés pourrait empêcher une réponse normale face au stress chez ces sujets et ainsi expliquer ce phénomène.
Toutefois, la plupart de ces études étaient effectuées chez des sujets dans la jeune enfance et évaluaient la réponse comportementale à la douleur suite à une prise de sang au niveau du talon. De plus, les études qui évaluaient les effets à long terme de la douleur à la naissance présentent des résultats divergents, quelques-unes démontrant une hyperalgésie (Buskila et a l, 2003; Fitzgerald et a l, 1989; Peters et a l, 2003; Saigal et a l, 1996; Taddio
et al, 1995), d’autres démontrant une hypoalgésie (Grunau et a l, 2001a; Grunau et a l,
2001b; Grunau et a l, 2005; Grunau et a l, 1994; Johnston et Stevens, 1996; Oberlander et
a l, 2000). Au contraire, une étude effectuée dans notre laboratoire a démontré que les
seuils de douleurs ne variaient pas entre les sujets nés à terme ou nés prématurément ayant subi ou non plusieurs procédures douloureuses à la naissance, suggérant une sensibilité à la douleur comparable (Goffaux et a l, 2008). Plusieurs raisons peuvent expliquer les divergences entre ces résultats; par exemple, la différence au niveau de l’âge gestationnel et l’âge postnatal des sujets étudiés, le temps passé aux soins intensifs ou le type de stimulation douloureuse utilisé lors de l’étude. Chacun de ces points sera discuté dans les prochains paragraphes.
2.4.1 I n f l u e n c e d e l ’â g e g e s t a t i o n n e l
Une étude a comparé la réponse comportementale à une prise de sang au niveau du talon chez un groupe d ’enfants nés à 32 semaines de gestation comparé à un groupe d’enfants nés à 28 semaines de gestation et maintenant âgés de 32 semaines, ces derniers ayant passé 4 semaines aux soins intensifs néonataux et donc ayant subi de nombreuses