© Chirine Cherif, 2019
Valorisation de la gourgane (Vicia faba L. major cultivar
Baie-St-Paul) dans l'alimentation de la vache laitière :
Effets sur l'utilisation de l'azote, le méthane d'origine
entérique et les performances zootechniques
Mémoire
Chirine Cherif
Maîtrise en sciences animales - avec mémoire
Maître ès sciences (M. Sc.)
Valorisation de la gourgane (Vicia faba L. major
cultivar Baie-St-Paul) dans l’alimentation de la
vache laitière : Effets sur l’utilisation de l’azote, le
méthane d’origine entérique et les performances
zootechniques
Mémoire
Chirine Cherif
Sous la direction de :
Rachel Gervais, directrice de recherche
Chaouki Benchaar, codirecteur de recherche
iii
Résumé
L’objectif de ce projet est de comparer l’effet de remplacement du tourteau de soja et du maïs grain par la gourgane (moulue ou roulée) sur l’ingestion, les fermentations ruminales, l’utilisation de l’azote, la production de méthane et la production laitière. Neuf vaches de race Holstein (120 jours de lactation) ont été utilisées selon un dispositif en carré latin 3×3 (période de 35 jours dont 14 jours d’adaptation). Les traitements expérimentaux étaient : 1) Ration totale mélangée (RTM) contenant du tourteau de soja (Témoin), 2) RTM contenant de la gourgane roulée et 3) RTM contenant de la gourgane moulue. La gourgane a été incluse à raison de 17% de la matière sèche en remplaçant complètement le tourteau de soja et partiellement le maïs grain sur une base iso-azotée et iso-énergétique. Après 14 jours d'adaptation aux régimes expérimentaux, la consommation alimentaire, les caractéristiques des fermentations ruminales (incluant le dénombrement des protozoaires), la dégradabilité ruminale (in sacco), la digestibilité gastro-intestinale apparente, l'excrétion azotée, la production laitière et la production de CH4 ont été mesurées.L'incorporation de la gourgane
(moulue ou roulée) dans la ration n'a pas eu d'incidence sur l’ingestion, la production laitière et la composition du lait. Le traitement expérimental n'a eu aucun effet sur la concentration ruminale des acides gras volatils totaux, le rapport acétate:propionate et le nombre de protozoaires. Comparativement aux vaches recevant le régime témoin, la concentration d’ammoniac (NH3) a augmenté et tendait à augmenter chez les vaches nourries avec la gourgane roulée et moulue, respectivement.Cependant, il n'y avait aucune différence dans la concentration ruminale de NH3 entre les deux gourganes traitées. La digestibilité totale apparente de la protéine brute (PB) était similaire chez les vaches nourries avec le régime témoin et celles nourries avec la gourgane roulée et tendait à augmenter chez les vaches nourries avec la gourgane moulue comparativement à celles nourries avec le régime témoin. L’excrétion de l’azote (g/j ou en proportion de l’azote ingéré) dans les urines et le fumier (fèces + urine) n'a pas été affectée par l'inclusion de la gourgane dans l'alimentation. La production de CH4 entérique était similaire entre les régimes expérimentaux. En conclusion, l’inclusion de la gourgane (17% de MS) en remplacement du tourteau de soja et du maïs grain dans la ration n'a eu aucun effet sur la production de lait, l'excrétion d’azote et la production de CH4 entérique des vaches laitières.
iv
Abstract
The objective of this study was to compare the effect of replacing soybean meal (SBM) and corn grain with ground or rolled faba bean (FB) on nutrient digestion, rumen fermentation, N utilization, methane production and milk performance. Nine Holstein cows (120 days of milk) were used in a 3 × 3 Latin square design (35-d period). The experimental treatments were: 1) Total mixed ration (TMR) containing SBM (control), 2) TMR containing rolled FB and 3) TMR containing ground FB. SBM and corn grain were completely and partially replaced (17% of diet DM), respectively, with either rolled or ground FB, on an isonitrogenous and isoenergetic basis. After 14-d days of adaptation to the experimental diets, feed intake, rumen fermentation characteristics (including protozoa enumeration), in sacco ruminal degradability, apparent total-tract digestibility, N excretion, milk performance (production and composition), and CH4 production were measured. Including FB in the diet
did not affect dry matter intake, milk production and milk composition. Experimental treatment had no effect on total VFA concentration, acetate:propionate ratio and protozoa numbers. Compared with cows fed the control diet, ruminal NH3 concentration increased and
tended to increase for cows fed ground FB and rolled FB, respectively. However, there was no difference in ruminal NH3 concentration between the two processed FB. Apparent
total-tract digestibility of crude protein was similar between cows fed the control diet and cows fed rolled FB and tended to increase for cows fed ground FB compared with cows fed the control diet. Urinary and manure (feces + urine) N excretion (g/d or as a proportion of N intake) were not affected by the inclusion of FB in the diet. Enteric CH4 production was
similar among the experimental diets. In conclusion, this study showed that including FB (17% of dietary DM) at the expense of SBM and corn grain in the diet had no effect on milk production, N excretion and enteric CH4 production of dairy cows.
v
Table des matières
Résumé ... iii
Abstract ... iv
Liste des tableaux ... viii
Chapitre 1 ... viii
Liste des figures ... ix
Liste des abréviations ... x
Remerciements ... xi
Avant-propos ... xii
Introduction ... 1
CHAPITRE 1: Revue des travaux antérieurs ... 3
1.1 Anatomie de l’appareil digestif des ruminants ... 3
1.2 Les microbes dans le rumen ... 3
1.2.1 Les bactéries ... 4
1.2.2 Les protozoaires ... 4
1.2.3 Les champignons ... 5
1.3 La digestion microbienne dans le rumen ... 6
1.3.1 La digestion des protéines ... 6
1.3.1.1 Activité protéolytique ... 6
1.3.1.2 Métabolisme des protéines, des peptides et acides aminés ... 6
1.3.1.2.1 La protéolyse ... 7
1.3.1.2.2 La désamination ... 7
1.3.1.3 La synthèse des protéines par les microbes ... 8
1.3.2 La digestion des glucides ... 10
1.3.2.1 La digestion des glucides intracellulaires (sucres et amidon) ... 12
1.3.2.2 La digestion des glucides structuraux ... 13
1.3.4 La digestion des lipides ... 14
1.4 La production de méthane (méthanogenèse) ... 16
1.4.1. Voies métaboliques de la production de méthane dans le rumen ... 16
1.4.2 Techniques de mesure de la production de méthane ... 18
vi
1.4.2.2 Les traceurs ... 19
1.4.2.3 Système GreenFeed (GF) ... 20
1.4.3 Stratégies de réduction de la production de méthane ... 22
1.4.3.1 Les analogues halogénés ... 23
1.4.3.2 L’utilisation des ionophores ... 24
1.4.3.3 La défaunation du rumen... 26
1.4.3.4 L’utilisation des métabolites secondaires de plantes ... 27
1.4.3.4.1 Les plantes riches en tanins ... 27
1.4.3.4.2 Les plantes riches en saponines ... 28
1.4.3.4.3 Les huiles essentielles ... 28
1.4.3.5 Ajout de lipides dans la ration ... 29
1.4.3.6 Qualité et nature des fourrages ... 30
1.4.3.7 Ajout d’aliments concentrés (riches en amidon) ... 33
1.4.3.8 Augmentation de la productivité des animaux ... 35
1.5 Les graines protéagineuses ... 36
1.5.1 Utilisation des graines protéagineuses ... 36
1.5.2 Pois protéagineux ... 36
1.5.3 Le lupin ... 38
1.5.4 La gourgane ou la féverole ... 39
1.5.5 Effet des protéagineux sur l'ingestion et les performances laitières ... 45
1.5.6 Effet des graines protéagineuses sur l’utilisation azotée et la production de méthane ... 47
1.6 Conclusion et hypothèses de recherches ... 51
1.7 Liste des ouvrages cités ... 52
CHAPITRE 2 ... 62
Faba bean (Vicia faba L. major) inclusion in dairy cow diets: Effect on nutrient digestion, rumen fermentation, nitrogen utilization, methane production and milk performance. ... 62
Résumé ... 63
Abstract ... 64
2.1 Introduction ... 65
2.2 Material and Methods ... 66
2.2.1 Cows, Experimental Design, and Diets ... 66
vii
2.2.3 In Sacco Ruminal Degradability ... 68
2.2.4 Ruminal Fermentation Characteristics and Protozoa Enumeration ... 69
2.2.5 Milk Production and Milk Composition ... 69
2.2.6 Enteric Methane Production ... 70
2.2.7 Chemical Analyses ... 71
2.2.8 Statistical Analyses ... 72
2.3 Results ... 72
2.3.1 Chemical Composition ... 72
2.3.2 In sacco Ruminal Degradability ... 73
2.3.3 Intake, Apparent Total-Tract Digestibility, and BW ... 74
2.3.4 Ruminal Fermentation Characteristics and Protozoa Population ... 75
2.3.5 Milk Production and Milk Composition ... 75
2.3.6 Nitrogen Utilization ... 76
2.3.7 Methane Production ... 76
2.4 Discussion ... 77
2.4.1 Chemical Composition of Faba Bean ... 77
2.4.2 Intake and Apparent Total-Tract Digestibility ... 77
2.4.3 Ruminal Fermentation Characteristics ... 79
2.4.4 Milk Production and Milk Composition ... 79
2.4.5 Nitrogen Utilization and Excretion ... 80
2.4.6 Enteric Methane Production ... 81
2.5 Conclusion ... 81
Conclusion générale ... 82
viii
Liste des tableaux
Chapitre 1
Tableau 1.1. Répartition de la production du pois au Canada (Statistique Canada, 2017). . 37 Tableau 1.2. Production annuelle de la féverole en fonction du pays (× 1 000 tonnes)
(Adapté de UNIP, 2013). ... 41 Tableau 1.3. Composition chimique et caractéristiques nutritionnelles du tourteau de soja, de la féverole, du pois et du lupin blanc (Adapté de Froidmont et al., 2006). ... 44
Chapitre 2
Table 2.1. Ingredient and chemical composition of the experimental diets ... 89 Table 2.1. Chemical composition of faba bean, soybean meal and corn grain ... 90 Table 2.2. In sacco degradation kinetic parameters and degradability of DM and CP of soybean meal, ground and rolled faba bean (FB) ... 91 Table 2.3. Intake and apparent total-tract digestibility of nutrients in lactating cows fed diets without (Control) or with ground or rolled faba bean (FB) ... 92 Table 2.4. Ruminal fermentation characteristics and protozoa count in ruminal fluid of lactating dairy cows fed diets without (Control) or with ground or rolled faba bean (FB) .. 93 Table 2.5. Milk production and milk composition of lactating cows fed diets without
(Control) or with ground or rolled faba bean (FB) ... 94 Table 2.6. Nitrogen utilization in lactating cows fed diets without (Control) or with ground or rolled faba bean (FB)... 95 Table 2.7. Enteric methane production of lactating cows fed diets without (Control) or with ground or rolled faba bean (FB) ... 96
ix
Liste des figures
Chapitre 1
Figure 1.1. Métabolisme des protéines, des peptides et acides aminés dans le rumen (Benchaar, 2016). ... 8 Figure 1.2. Incorporation de NH3 dans les protéines microbiennes (Nolan et al., 2007). ... 9
Figure 1.3. Métabolisme des glucides dans le rumen (Jouany, 1994). ... 11 Figure 1.4. Relation entre la digestion intestinale de l'amidon et la quantité d'amidon ayant échappé à la dégradation dans le rumen (ANDR) (Nocek et Tamminga, 1991). ... 13 Figure 1.5. Métabolisme de l’hydrogène dans les différentes voies fermentaires du rumen (Jouany et Thivend, 2008). ... 17 Figure 1.6. Chambre calorimétrique en circuit ouvert (Bhatta et al., 2007). ... 18 Figure 1.7. Matériel nécessaire à la mise en œuvre de la méthode au traçage à l’hexafluorure de soufre (SF6) (Hassouna et Eglin, 2015). ... 19
Figure 1.8. Système « GreenfeedTM » avec ses principales composantes (d’après C-Lock Inc). ... 22 Figure 1.9. Effet des traitements (AL = Acide linoléique; AAL = Acide α-linolénique; F =
Furamate; M = Malate; ABS = Acide 2-bromoéthane sulfonique; DIPM = Diimide pyroméllitique) sur la production de CH4. (a, b, c, d, e: Les moyennes affectées d'une lettre différente sont
significativement différentes à P < 0,05; adaptée de Choi et al., 2004). ... 23 Figure 1.10. Effet du monensin sur les émissions de CH4 chez des vaches Holstein en lactation (P <
0,03). Adaptée d’Odongo et al. (2007). ... 25 Figure 1.11. Influence du niveau d’alimentation sur la part d’énergie métabolisable perdue sous forme de méthane (ECH4) (Giger-Reverdin et al 2000; Sauvant et Giger-Reverdin 2007). ... 31
Figure 1.12. Relation stoechiométrique entre le méthane et les acides gras volatils produits au cours des fermentations ruminales (Moss et al., 2000). ... 32 Figure 1.13. Influence de la teneur en concentrés de la ration sur la part d’énergie métabolisable perdue sous forme de méthane (Giger-Reverdin et al., 2000; Sauvant et Giger, 2007). ... 34 Figure 1.14. Effet du niveau de production des vaches laitières sur les émissions de méthane par kilogramme de lait. Les cercles et le trait plein sont adaptés de Vermorel (1995); le trait pointillé constitue l’extrapolation de la courbe (Doreau et al., 2011). ... 35 Figure 1.15. Composition moyenne du pois sec en grain entier (INRA-AFZ, 2004). ... 37 Figure 1.16. Composition moyenne d’une graine de lupin (Terres Univia, 2016)... 39 Figure 1.17. Comparaison des dimensions de la gourgane (en haut) et de la féverole (en bas) (Pilote et al., 2017). ... 40 Figure 1.18. Composition moyenne de la graine de fèverole (INRA_AFZ, 2004). ... 43 Figure 1.19. Profil en acides aminés principaux des graines de protéagineuses (Froidmont et al., 2013). ... 45 Figure 1.20. Effet de la taille des particules sur la dégradation in sacco du lupin (Adaptée de Freer et Dove, 1984). ... 48
x
Liste des abréviations
Françaises
AA: acides aminés, AL: acide linoléique, AAL: acide α-linolénique, ABS: acide 2 bromoethane sulforique, AGV: acides gras volatils, ANDR: amidon non dégradé dans le rumen, ATP: adénosine triphosphate, CH4: méthane, DIPM: diimide pyroméllitique, DSDS:
drêches de maïs sèches avec solubles, DTN: dégradabilité théorique ruminale, DVE:
protéines alimentaires non dégradées dans les préestomacs + protéines microbiennes – protéines endogènes des matières fécales, F: furamate, GR: gourgane roulée, GM: gourgane moulue, HE: huiles essentielles, M: malate, MA: matière azotée, MAT: matières azotées totales, MG: matière grasse, MOF: matière organique fermentée dans le rumen, MS: matière sèche, MSI: matière sèche ingérée, N : azote, NADH: nicotinamide adénine dinucléotide réduit, NADPH: nicotinamide adénine dinucléotide phosphate réduit, NDF: fibre au détergent neutre, NH3: ammoniac, NPN: azote non protéique, OEB: protéines microbiennes permises par l’azote – protéines microbiennes permises par l’énergie, PDIA: protéines alimentaires non dégradées dans le rumen, RTM: ration totale mélangée, SF6: hexafluorure
de soufre, TS: tourteau de soja, VEM: l’énergie nette réellement valorisée par l’animal en vue de satisfaire ses besoins d’entretien et ses besoins de production.
Anglaises
ADF: acid detergent fiber, ADIN: acid detergent insoluble nitrogen, BCVFA: branched-chain VFA, BW: body weight, CP: crude protein, DIM: days in milk, DM: dry matter, DMI: dry matter intake, EE: ether extract, ERD: effective ruminal degradability, FB: fava bean, GE: gross energy, GF: greenfeed, HAP: hyper-ammonia-producing, MUN: milk urea nitrogen, N: nitrogen, NDF: neutral detergent fiber, NDIN: neutral detergent insoluble N, NEL: net energy for lactation, OM: organic matter, RUP: rumen-undegradable protein,
SBM: soybean meal, SCC: somatic cell count, SD: standard deviation, TMR: total mixed ration, VFA: volatile fatty acids.
xi
Remerciements
La réalisation de mes cours de maîtrise au département des sciences animales de l'Université Laval et de mes activités de recherche au Centre de recherche et de développement de Sherbrooke (Sherbrooke, Québec, Canada) ont été une merveilleuse expérience. Bien sûr, les quelques lignes qui suivent ne sauraient exprimer mon profond sentiment de gratitude envers toutes les personnes qui m’ont aidée pendant cette formidable période de ma vie.
Mes premiers remerciements s'adressent à « ma directrice de maîtrise », Professeure Rachel Gervais pour sa supervision scientifique, son support et ses conseils tout au long de mon parcours. J'adresse mon éternelle reconnaissance à mon codirecteur Dr. Chaouki Benchaar pour son accueil dans son laboratoire, pour les ressources humaines et matérielles mises à ma disposition, pour son aide à l’analyse des résultats et pour le temps qu’il m’a consacré, pour avoir répondu à toutes mes interrogations.
Je remercie également aussi chaque membre de l’équipe du Dr. Benchaar: Fadi Hassanat, Lisa Croteau, Isabelle Blanchet et Mathieu Béchard pour leur collaboration, aide et sympathie. J’aimerais remercier le personnel du centre laitier pour la bonne humeur et leur sympathie au cours du stage. J'aimerais aussi souligner l'importante contribution des coauteurs de mon article intégré à ce mémoire: Fadi Hassanat, Stéphanie Claveau, Jean Girard, Rachel Gervais, et Chaouki Benchaar.
Enfin, c'est avec beaucoup d’amour et d’admiration que je remercie mes chers parents, Hichem Cherif et Wafa Darragi. Autant de phrases aussi expressives soient-elles ne sauraient montrer le degré d’amour et d’affection que j’éprouve pour vous. Vous m’avez comblé avec votre tendresse tout au long de mon parcours. Vous n’avez cessé de me soutenir et de m’encourager durant toutes les années de mes études, vous avez toujours été présents à mes côtés pour me consoler quand il fallait. Je vous dois ce que je suis aujourd’hui et ce que je serai demain et je ferai toujours de mon mieux pour rester votre fierté. Je vous aime énormément !
A mon très cher frère Achref Cherif et ma chère sœur Chayma Cherif. Pour tous les meilleurs moments qui nous unissent, ce travail est un témoignage de mon attachement et de mon amour.
xii
Avant-propos
Le Chapitre 2 de ce mémoire est présenté sous forme d’un article scientifique. Je suis la première auteure de cet article. Les co-auteurs de l’article sont le chercheur responsable du projet C. Benchaar et l’assistant de recherche F. Hassanat du Centre de recherche et de développement de Sherbrooke (Sherbrooke, QC), R. Gervais de l’Université Laval (Québec, QC), S. Claveau et J. Girard d’Agrinova, (Alma, QC).
L’article s’intitule « Faba bean (Vicia faba L. major) inclusion in dairy cow diets: Effect on nutrient digestion, rumen fermentation, nitrogen utilization, methane production and milk performance» et il est accepté pour publication dans le « Journal of Dairy Science».
1
Introduction
La fermentation entérique représente la principale source d’émission de méthane (CH4) par
les élevages de bovins laitiers. La vache laitière peut émettre entre 400 à 600 litres de CH4
par jour (INRA, 2008), justifiant ainsi la modification de l’alimentation des vaches comme moyen le plus efficace pour réduire les émissions de CH4. En plus des effets bénéfiques sur
l’environnement, la modification de la ration permet d’augmenter l’efficacité de l’utilisation de l’énergie à des fins de production (i.e., bénéfices économiques).
Récemment, les spécialistes en nutrition s’intéressent davantage à améliorer les performances laitières en diminuant les coûts d’alimentation et les impacts environnementaux. En 2012, le pourcentage de protéines alimentaires des rations laitières se situait autour de 18,1% (Valacta, 2013). Ce pourcentage pourrait facilement être diminué à 16,5% sans affecter la production laitière, si les rations étaient équilibrées adéquatement en fournissant les acides aminés nécessaires pour répondre aux besoins de l’animal (AAC, 2016). Cette baisse permettrait de diminuer l’excrétion azotée de plus de 17 000 tonnes par année au Canada (-15%), représentant ainsi une économie de 77,5 millions de dollars pour les fermes laitières canadiennes (AAC, 2016). Rappelons que l’azote excrété peut contribuer significativement à la pollution, notamment par son impact sur l’eutrophisation des eaux superficielles, des eaux souterraines en nitrates, et sur l’acidification des sols et la formation de gaz à effet de serre lorsque transformé en protoxyde d’azote (Hristov, 2011).
Les raisons de la faible utilisation des ressources protéiques locales comme certains protéagineux par les éleveurs sont principalement d’ordre économique. Les producteurs laitiers canadiens ont tendance à préférer le tourteau de soja comme une source protéique à cause de l’apport en protéines brutes (PB) élevé (499 vs 378 g/kg de matière sèche [MS]) et en énergie métabolisable (13,5 vs 12,0 MJ/kg MS) (NRC, 2001) et à cause des prix très intéressants.
Aujourd’hui, les contraintes économiques intègrent de nouvelles composantes telles que la durabilité des systèmes de production, la traçabilité et la qualité des produits. Le contexte est favorable pour encourager les éleveurs à utiliser les graines de protéagineux tel que la
2
gourgane (la féverole), le pois et le lupin en remplacement du tourteau de soja pour contribuer à une plus grande autonomie protéique et énergétique des exploitations d’élevage. Ces protéagineux présentent l’avantage d’être riches en énergie avec 40 à 50% d’amidon, et 24 à 32% en protéine (Carouée et al., 2003).
Jusqu’à présent, plusieurs essais d’alimentation réalisés sur des vaches laitières ont montré des performances identiques en remplaçant en totalité ou partiellement le tourteau de soja par des graines protéagineuses. Dans cette optique, la gourgane (Vicia faba L. major, cultivar Baie-St-Paul) faisant l’objet de la présente recherche, est riche en amidon et également bien pourvue en protéines et en tanins condensés (Bond, 1976; Archambault, 1992; Tufarelli et al., 2012). Elle représente donc une bonne alternative économique pour remplacer le tourteau de soja dans l’alimentation de la vache laitière. De par la présence de tanins dans cette graine protéagineuse, la gourgane pourrait représenter une bonne stratégie alimentaire pour réduire l’impact de l’élevage laitier sur l’environnement (moins de CH4 émis et d’azote excrété).
3
CHAPITRE 1: Revue des travaux antérieurs
1.1 Anatomie de l’appareil digestif des ruminants
Le complexe gastrique des ruminants est composé des quatre compartiments: le rumen (panse), le réticulum (bonnet ou réseau), l'omasum (feuillet) et l'abomasum (caillette). Les trois premiers compartiments composent les préestomacs et le dernier équivaut à l'estomac des monogastriques. Parmi ces organes digestifs, le rumen est celui qui occupe le plus grand volume puisqu’il correspond à 80% des quatre compartiments stomacaux (Chiquette et Ouellet, 2008). Le rumen n'est jamais vide et son contenu est continuellement enrichi par l'ingestion régulière d'aliments. Il présente toutes les caractéristiques essentielles d'un "fermenteur" grâce à son pH près de la neutralité et à sa température d'environ 38°C. Ces conditions sont propices au développement des micro-organismes composés essentiellement de protozoaires, de bactéries et de champignons. Les enzymes de certaines bactéries favorisent la dégradation de la fibre, de l’amidon, des sucres et des protéines en produits utilisables par l'hôte. Les bactéries du rumen sont capables d’utiliser l'azote-non-protéique incorporé à la ration pour synthétiser leurs propres protéines. Quant à l’omasum et l’abomasum, ils ont respectivement pour fonction de recycler l’eau et les minéraux, et de sécréter de nombreuses enzymes digestives (Chiquette et Ouellet, 2008).
1.2 Les microbes dans le rumen
Comme mentionné précédemment, ce sont les micro-organismes du rumen qui sont responsables de la dégradation et la fermentation des aliments ingérés (Jouany, 1994). Grâce à la fermentation anaérobie, les micro-organismes (bactéries, protozoaires et champignons) facilitent la digestion des aliments fibreux que les ruminants ne pourraient utiliser efficacement.
Dans le rumen, les micro-organismes fermentent les aliments produisant du CO2, du CH4, de
la chaleur, de l'ammoniac (NH3) et des acides gras volatils (AGV) dont certains sont utilisés
4
1.2.1 Les bactéries
Les bactéries sont les micro-organismes les plus nombreux dans le rumen. Elles peuvent représenter jusqu’à 50% de la biomasse microbienne et leur concentration peut atteindre 1011
cellules vivantes/mL de contenu ruminal (Hungate, 1966). D’après Jouany (1978), elles représentent environ 1 kg de matière sèche chez la vache. Czerkawski et al. (1988) ont classé les bactéries ruminales en quatre groupes en fonction de leur environnement:1) les bactéries vivant librement dans la phase liquide du rumen, 2) les bactéries associées aux particules alimentaires, 3) les bactéries associées à l’épithélium ruminal et 4) les bactéries attachées à la surface des protozoaires. Il existe plusieurs types de bactéries: cellulolytiques, hémicellulolytiques, amylolytiques, protéolytiques ou uréolytiques et pectinolytiques. Les espèces de bactéries les plus importantes appartiennent au groupe des cellulolytiques (appelées aussi fibrolytiques) qui comprennent principalement Bacteroides succinogenes, Ruminococcus albus, Ruminococcus flavefaciens, et Butyrivibrio fibrisolvens (Hungate, 1966).
1.2.2 Les protozoaires
Les protozoaires sont moins nombreux que les bactéries mais ils peuvent représenter jusqu’à 40% de la biomasse totale. Leur concentration est évaluée à 106cellules vivantes/mL de contenu ruminal (Fonty et al., 1995). Ce sont des microorganismes très sensibles aux conditions régnant dans le rumen et aux caractéristiques de la ration. L'étude de leur rôle et de leur utilité pour le ruminant est difficile en raison de ces variantes.
Les protozoaires du rumen peuvent être flagellés ou ciliés. Les flagellés sont peu nombreux (103 à 104/mL) et leur rôle dans les fermentations ruminales est encore mal connu. Il semblerait que les flagellés se retrouvent souvent chez les jeunes animaux, avant que la population de ciliés ne soit établie. Les ciliés (holotriches et entodiniomorphes) constituent la majorité des protozoaires du rumen. Ils sont 20 à 100 fois plus grands en taille que les bactéries mais sont 104 fois moins nombreux (Jouany, 1994). On les retrouve dans la phase liquide et au niveau des particules solides (Jouany, 1994). Ils sont distingués en deux groupes : les holotriches et les entodiniomorphes. Ces derniers ont une grande capacité à ingérer des particules solides de petite taille (grains d’amidon, chloroplastes, fibres cellulosiques). Ils
5
absorbent continuellement des bactéries avec une vitesse d’ingestion variant en fonction du pH du milieu (optimum à 6,0 et minimum à 5,0) et le degré de digestion dépendant de la nature des bactéries (Jouany, 1994). De plus, la plupart des protozoaires ingèrent des bactéries dont les protéines sont dégradées. Ils sont activement protéolytiques mais n’utilisent pas le NH3. Les protozoaires exercent un rôle modérateur dans la fermentation du rumen. Ils
empêchent les fermentations trop rapides et maintiennent la population bactérienne à un niveau acceptable. Ils sont également utiles à l'hôte en produisant des AGV dans le rumen et en offrant une protéine de bonne qualité au niveau intestinal. Les protozoaires peuvent représenter 40 à 50 % de la biomasse du rumen lorsque le pH y est stable entre 6 et 7. Avec des rations très riches en concentrés (donc en amidon), le pH peut baisser à 5,5 ce qui fait diminuer le nombre des protozoaires voire les fait disparaitre (Thivend et al., 1985). Il a également été rapporté que les protozoaires jouent un rôle important dans la digestion des fibres dans le rumen. Certains auteurs suggèrent que la contribution des protozoaires dans la digestion des fibres peut représenter jusqu’à 62% de l’activité fibrolytique totale (Williams et al., 1991). Cependant, Dijkstra et France (1995) estiment que les protozoaires seraient responsables de 20% de l’activité fibrolytique totale dans le rumen.
1.2.3 Les champignons
La présence de champignons dans l'écosystème du rumen n'a été découverte qu’en 1975 par Orpin. Trois genres sont identifiés: Neocallimastix, Piromyces et Caecomyces (Jouany, 1994). Les champignons sont moins nombreux que les bactéries et les protozoaires avec une densité pouvant atteindre 103 zoospores/mL de contenu ruminal (Jouany, 1994). Ils représentent entre 8 et 25% de la biomasse du rumen et peuvent fermenter la plupart des mono- et di-saccharides mais ils ne peuvent pas utiliser le mannose et le fructose comme source de carbone. Le lactate, le formate, l’acétate, l’hydrogène, le dioxyde de carbone et l’éthanol sont principalement formés lors de la fermentation. Généralement, les champignons ne sont pas indispensables et sont parfois absents et augmentent avec des rations contenant des fourrages de mauvaise qualité (Guillaume, 2007).
6
1.3 La digestion microbienne dans le rumen
1.3.1 La digestion des protéines
1.3.1.1 Activité protéolytiqueLes étapes initiales de l’activité protéolytique sont faites par des enzymes microbiennes périplasmiques ou extracellulaires. D’après Brugère (1983), les bactéries cellulolytiques ont un développement maximum pour des valeurs de pH légèrement acides: 6,2 < pH < 6,8. Une grande partie de l’activité protéolytique (75%) est associée à la phase solide dans le rumen (Brock et al., 1982). Les bactéries amylolytiques et les protozoaires ont une activité protéolytique importante. Les bactéries amylolytiques, à l’inverse des bactéries cellulolytiques se développent à la faveur des valeurs de pH franchement acides (pH < 5,5; Brugère, 1983). Les bactéries du rumen ont une activité protéolytique 6 à 10 fois supérieure à celle des protozoaires. Un pH compris entre 6 et 7 et l’anaérobiose favorisent l’activité protéolytique (Jouany, 1994). Cependant, lorsque le pH chute en dessous de 6, on observe des réductions marquées de la dégradation de la matière sèche et de la fibre. À un pH inférieur à 5,0, la digestion de la fibre cesse complètement. Or, plusieurs bactéries du rumen arrêtent leur croissance à un pH qui varie entre 5,0 et 5,5 (Brugère, 1983). Les ciliés du rumen (holotriches et entodiniomorphes) ont une activité protéolytique (Jouany, 1994). Les protozoaires cellulolytiques de grande taille sont moins actifs que Entodinium sp. (Jouany, 1994).
Les champignons ont aussi une activité protéolytique qui pourrait contribuer jusqu’à 30% à l’activité protéolytique globale du rumen (Wallace et Joblin, 1985). Cette capacité ajoutée à leur activité cellulolytique, leur procurerait la facilité de dégrader des parois végétales avec les bactéries cellulolytiques (Fonty et al., 1988).
1.3.1.2 Métabolisme des protéines, des peptides et acides aminés
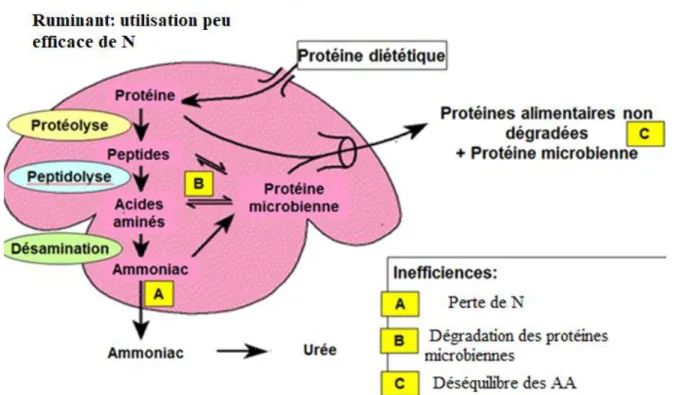
Le rumen est essentiellement une chambre de fermentation (Figure 1.1) contenant une population microbienne de bactéries, de protozoaires et de mycètes très variée, ce qui rend les ruminants bien adaptés et capables d’utiliser du NPN pour synthétiser des protéines, et dégrader la paroi cellulaire des plantes (Jouany, 1994). Grâce aux processus de protéolyse et
7
de désamination, les bactéries du rumen dégradent les vraies protéines en peptides, en acides aminés (AA) et en NH3 (Figure 1.1). Les bactéries sont également capables d'utiliser des
sources de NPN qui comprennent des AA libres, des peptides, des amines, des amides, des nitrates, des nitrites, de l'urée du NH3 pour leur croissance et pour la synthèse d'acides aminés
(Van Soest, 1982).
1.3.1.2.1 La protéolyse
La protéolyse est le processus par lequel la protéine alimentaire est convertie dans le rumen en peptides et en AA. La protéolyse est réalisée par l'action de plusieurs protéases et peptidases de micro-organismes (Figure 1.1). Ces derniers agissent pour hydrolyser les liaisons peptidiques reliant divers AA de la protéine. Wallace et Cotta (1988) ont rapporté que 40% de la population bactérienne ruminale présente une activité protéolytique.
Les microorganismes responsables et le degré d'activité protéolytique dépendent en grande partie de la nature du régime alimentaire, du degré de transformation des aliments, du temps de rétention des aliments dans le rumen et du pH ruminal (NRC, 2001).
1.3.1.2.2 La désamination
La concentration d'AA libres dans le rumen est faible. Ces AA peuvent être utilisés par la flore du rumen pour synthétiser des protéines microbiennes ou pour être désaminés (Figure 1.1). La désamination résulte en la formation de NH3 et des chaines carbonées (Fonty et al.,
1995). Ces dernières sont ensuite fermentées, ce qui entraine la formation d’AGV (Wallace et Cotta., 1988). D'autres réactions conduisent à la formation d’AGV, de CO2, de CH4 et de
chaleur. La dégradation des AA est principalement réalisée par un petit groupe de bactéries présentant une activité de désamination élevée (NRC, 2001). Ces bactéries possèdent une faible capacité protéolytique et sont communément appelées bactéries hyper-productrices de NH3 «HAP: hyper-ammonia-producing bacteria» (Attwood et al., 1998).
L'azote ammoniacal est la principale source d'azote utilisée pour la croissance des bactéries ruminales (NRC, 2001). On estime que jusqu'à 50% des protéines alimentaires peuvent être convertis en NH3 par l'intermédiaire de microorganismes ruminaux (Rychlik et Russell,
8
2000). La concentration de NH3 ruminal est influencée par les taux de dégradation des
glucides et des protéines alimentaires ainsi que le taux d'absorption de NH3 à travers la paroi
ruminale. Selon Hungate (1988), la protéine soluble est généralement dégradée plus rapidement que les glucides dans le rumen. Si la concentration de NH3 dans le rumen dépasse
l'énergie disponible, elle devient alors inutile pour les microbes. L'excès de NH3 est absorbé
à travers la paroi du rumen dans la circulation sanguine et transporté vers le foie (Attwood et al., 1998). Le NH3 dans le sang est détoxifié par le foie par sa conversion en urée. L’urée
quittant le foie est soit recyclée dans le rumen via la salive, par diffusion à travers la paroi ruminale ou éliminée par les reins dans l’urine (Lapierre et Lobley, 2001).
Figure 1.1. Métabolisme des protéines, des peptides et acides aminés dans le rumen (Benchaar, 2016).
1.3.1.3 La synthèse des protéines par les microbes
La synthèse des protéines microbiennes du rumen est limitée par la quantité d'énergie sous forme d’adénosine triphosphate (ATP) ou matière organique digestible disponible pour les bactéries et par l’efficacité avec laquelle les bactéries utilisent cette énergie. La synthèse protéique dans le rumen est difficile à évaluer car l'énergie disponible et l'efficacité
9
énergétique des rations diffèrent. La synthèse bactérienne varie de 20 à 45 g d’azote microbien par kilogramme de matière organique fermentée dans le rumen (MOF) (Jouany, 1994).
La plupart des bactéries du rumen, principalement les bactéries cellulolytiques, sont capables d’utiliser l’azote ammoniacal en présence d’ATP pour synthétiser les protéines. Lorsque la concentration de NH3 est faible, la captation de l’azote pour la synthèse des protéines
microbiennes se fait par la réaction impliquant la glutamine synthétase, enzyme qui montre une grande affinité pour le NH3 mais qui requiert de l’ATP. Toutefois, lorsque la
concentration de NH3 dans le rumen est élevée, il est capté par la voie de l’enzyme glutamate
déshydrogénase qui ne requiert pas d’ATP (Nolan et al., 2007); (Figure 1.2). Donc, à des concentrations de NH3 faibles, la croissance microbienne diminuerait, puisqu'une partie de
l'ATP disponible serait utilisée pour la captation du NH3. Pour assurer une bonne croissance
microbienne et donc une bonne synthèse de protéines microbiennes, une quantité minimale de NH3 doit être présente dans le rumen. D’après Hoover (1986), cette limite se situe entre
3,3 et 8 mg d’azote ammoniacal/100 mL de fluide ruminal.
Comparer aux bactéries anaérobies facultatives, les bactéries anaérobies strictes ont des besoins énergétiques plus faibles et une efficacité d’utilisation de l’ATP plus élevée pour la croissance (Jouany, 1994). Plus le taux de dilution du rumen est augmenté plus l’efficacité est améliorée (Jouany, 1994).
10
1.3.2 La digestion des glucides
La population microbienne du rumen possède un système enzymatique capable de digérer les composants structuraux de la plante, tels que la cellulose, l'hémicellulose et substances pectiques (Figure 1.3).
Les glucides représentent en moyenne 75% de la MS ingérée (Brugère, 1983). Leur digestion par la microflore du rumen se fait en deux étapes principales: 1) l'hydrolyse extracellulaire de polymères glucidiques (polyholosides) et 2) la fermentation intracellulaire de glucides simples (Brugère, 1983). Durant la première phase, (i.e., l'hydrolyse extracellulaire), les microbes s'attachent au matériel végétal et sécrètent des enzymes qui attaquent les fragments végétaux libérant ainsi des unités de glucides simples. Par la suite, les microbes passent à la deuxième phase où ils captent ces glucides et les fermentent à l'intérieur de leurs cellules en formant des AGV, le lactate, le formate et le succinate (Figure 1.3).
11
12
1.3.2.1 La digestion des glucides intracellulaires (sucres et amidon)
Les sucres solubles (oses en C5 et C6 et les diholosides) sont dégradés rapidement en CO2 et
en AGV avec libération d’énergie. Après l’ingestion, leur dégradation est très rapide et pratiquement complète (Brugère, 1983).
Parmi les autres glucides facilement fermentescibles, les polysaccharides de réserve, tels l'amidon et les fructosanes sont les plus facilement dégradables dans le rumen. L'amidon représente jusqu'à 50 % de la MS ingérée (MSI) chez les bovins en lactation (Campling, 1991). Le rumen est le principal site de digestion de l'amidon où 60 à 95 % de l'apport en amidon est fermenté en AGV ou incorporé dans la matière microbienne (Nocek et Tamminga, 1991; Russell et al., 1992 ; Sauvant et al., 1994). Les fortes quantités d'amidon facilement dégradable peuvent modifier l'écologie du rumen, entraîner la chute du pH et causer de différents troubles digestifs et métaboliques. Selon Offner (2004), les variations de la vitesse de digestion de l'amidon ont d’autres effets sur les nutriments absorbés (AGV vs glucose) et la synthèse des protéines d'origine microbienne.
Les études réalisées sur la digestion post-ruminale de l'amidon sont un peu limitées (Offner, 2004). Au niveau de l'intestin grêle, l'amidon est hydrolysé en glucose grâce à l’action des amylases d'origine pancréatique.
La digestion de l’amidon peut se déplacer du rumen vers l’intestin suite à une forte ingestion alimentaire. D’après Nocek et Tamminga (1991), la digestibilité intestinale de l'amidon diminue quand la quantité ingérée augmente (Figure 1.4). Certains facteurs limiteraient donc la digestion et l'utilisation de l'amidon au niveau de l’intestin grêle tels, l'activité limitée des principales enzymes glucidiques, l'absorption limitée du glucose, le temps insuffisant pour l'hydrolyse complète de l'amidon et l'accès réduit des enzymes aux granules d'amidon, dû à leur insolubilité ou imperméabilité (Owens et al., 1986).
13
Figure 1.4. Relation entre la digestion intestinale de l'amidon et la quantité d'amidon ayant échappé à la dégradation dans le rumen (ANDR) (Nocek et Tamminga, 1991).
1.3.2.2 La digestion des glucides structuraux
La paroi cellulaire des végétaux est une structure complexe mais qui peut être dégradée par la microflore du rumen. Le taux et l'ampleur de la dégradation varient considérablement en fonction de la composition des parois, de l'activité microbienne et de l'efficacité avec laquelle l'animal diminue la taille des particules par la mastication.
Les pectines sont dégradées par plusieurs bactéries, quelques protozoaires, mais ne sont pas attaquées par les mycètes. Les enzymes nécessaires pour la dégradation des pectines sont la méthylestérase et la polygalacturonidase (Jouany, 1994). La dégradation extracellulaire des pectines produit du méthanol et des acides organiques qui sont transformés en glucides simples. Certaines pectines sont dégradées en acide galacturonique qui sera métabolisé par
14
la voie de pentoses en fructose-P et en glycéraldéhyde 3-P. Ces composantes formeront éventuellement de l'acide pyruvique par l'action glycolytique des microbes (Figure 1.3).
Les hémicelluloses sont constitués d’une famille de polyosides de chaînes linéaires de β (1-4) D-xylose portant un petit nombre de courtes chaînes latérales (Jarrige et al., 1995). Celles-ci peuvent être de trois types: une seule unité d’arabinose; une seule unité d’aCelles-cide glucuronique; ou des chaînes plus longues : arabinose + acide glucuronique + xylose + galactose (Jarrige et al., 1995).
Les hémicelluloses sont attaquées par des enzymes microbiennes, libérant ainsi des pentoses (Figure 1.3). Les hémicellulases microbiennes hydrolysent les polysaccharides, libérant du xylose. Les sucres simples sont ensuite métabolisés en fructose-P et en glycéraldéhyde-3-P par la voie des pentoses. Ces derniers sont finalement métabolisés en acide pyruvique par la voie glycolytique (Figure 1.3).
La cellulose est un glucane formé de longues chaînes linéaires de milliers d’unités de D-glucose uniformément liées en β (1-4) qui sont orientées et disposées parallèlement (Jarrige et al., 1995). La cellulose est digestible par des enzymes extracellulaires d'origine microbienne. Les microbes du rumen sont capables d'hydrolyser le polymère et de libérer du cellobiose ou du glucose qui sont fermentés par la suite en pyruvate. Suite à cette fermentation, des AGV sont formés dans le rumen. Différents microbes utilisent des voies métaboliques spécifiques pour former soit l'acétate, le propionate ou le butyrate (Figure 1.3).
Les glucides structuraux ayant échappé à la dégradation dans le rumen peuvent être dégradés partiellement dans le cæcum grâce à l'action de la microflore. En effet, le cæcum contient des bactéries fibrolytiques qui attaquent les polysaccharides et les fermentent de la même façon que dans le rumen. Donc, on y observe une production importante d'AGV, de CO2 et de CH4.
1.3.4 La digestion des lipides
Les lipides alimentaires sont facilement dégradés par les microorganismes du rumen; très peu de lipides traversent le rumen sans n’avoir subi aucune transformation, spécialement
15
lorsque les lipides alimentaires ne sont pas protégés contre la dégradation microbienne. La lipolyse est une étape nécessaire pour les transformations que subissent les lipides durant leur passage dans le rumen.
L'activité lipolytique est réservée principalement aux bactéries, le rôle des protozoaires ciliés dans l'hydrolyse ruminale des lipides alimentaires n'est pas encore bien défini (Gervais, 2009). Néanmoins, on estime que 30 % de l'activité lipolytique des microorganismes du rumen est réalisée par les protozoaires (Harfoot et Hazlewood, 1997). Par ailleurs, aucune activité d'hydrolyse des lipides n'a encore été associée aux phycomycètes anaérobiques (Gervais, 2009). Parmi les lipides des plantes fourragères, près des deux tiers sont estérifiés, dont 33 % sous forme de lipides simples, 50 % sous forme de galactolipides et 17 % sous forme de phospholipides (Bauchart et al., 1985). C'est au niveau des feuilles que se concentre la majeure partie des lipides des plantes fourragères, qui représentent de 6 à 7 % du poids sec de ce tissu (Harfoot et Hazlewood, 1997). Les plantes fourragères sont riches en acides gras polyinsaturés.
Les acides gras polyinsaturés occupent donc une place importante dans l'alimentation lipidique des bovins laitiers. Cependant, les acides gras insaturés sont toxiques pour certains des microorganismes du rumen (Harfoot et Hazlewood, 1997). Pour se protéger de ces effets inhibiteurs, la population microbienne a recours à des mécanismes biochimiques qui, dans un premier temps, lui permettent d'hydrolyser les glycérolipides, pour ensuite hydrogéner les chaînes d'acides gras ainsi libérées (Gervais, 2009).
La présence d'un radical carboxyle libre est nécessaire afin de permettre l'hydrogénation des acides gras insaturés (16 et 18 atomes de carbone) par les bactéries du rumen (Jouany, 1994). C'est donc uniquement suite à leur libération par lipolyse des structures de galactolipides, de phospholipides ou encore de triacylglycérols que les acides gras insaturés, adsorbés à la surface des particules du contenu ruminal, pourront être biohydrogénés et incorporés dans la fraction lipidique des bactéries associées à la phase solide (Gervais, 2009).
16
Les microbes du rumen sont capables de synthétiser leurs propres lipides. Ces microorganismes synthétisent les acides gras à partir de précurseurs courts: l’acétate, le propionate, le valérate ou des chaînes carbonées ramifiées issues de la dégradation de la valine, la leucine, et l’isoleucine (Sauvant et Bas, 2001). L’utilisation d’amorces tel que le propionate ou les chaînes carbonées ramifiées entraîne la formation d’acides gras à chaine impaire ou ramifiée (Sauvant et Bas, 2001).
1.4 La production de méthane (méthanogenèse)
1.4.1. Voies métaboliques de la production de méthane dans le rumen
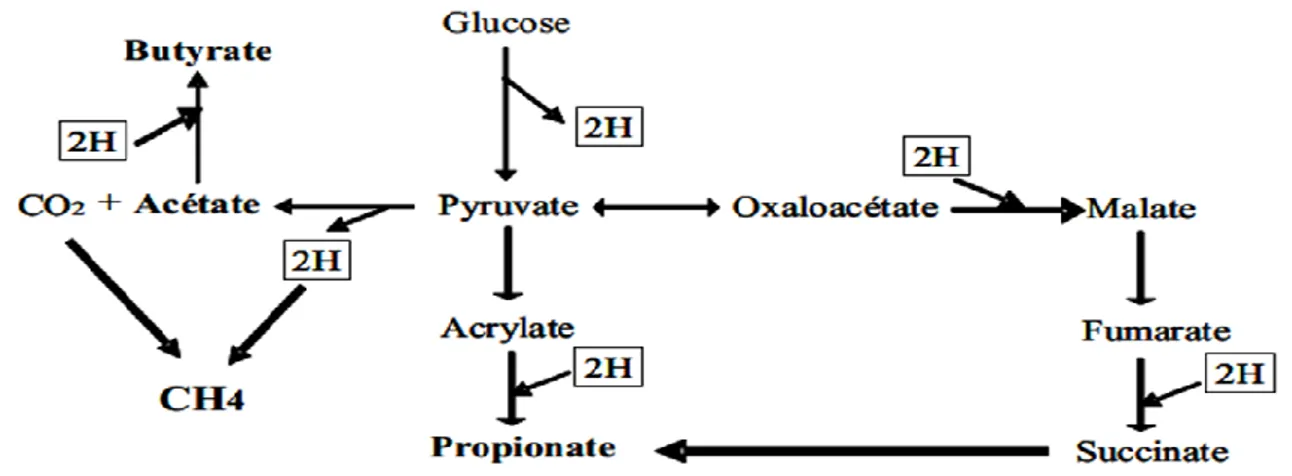
Chez les ruminants, le CH4 est produit au cours des fermentations digestives ayant lieuprincipalement dans le rumen. Comme les glucides constituent la base des régimes alimentaires des ruminants, sous forme d’amidon, de cellulose ou d’hémicellulose, la digestion de ces glucides s’effectue en grande partie sous l’action des microorganismes anaérobiques du rumen en deux étapes soit: les glucides complexes sont dégradés en glucides simples puis ces derniers sont utilisés par les microorganismes pour la fermentation (Popova et al., 2011). Les produits terminaux libérés par cette fermentation sont principalement des AGV (acétate, propionate et butyrate), des gaz (CO2, H2, et CH4) et de l’eau. Les AGV issus
des fermentations sont absorbés à travers la paroi du rumen et fournissent plus de 70% de l’énergie utilisée par le ruminant (Demeyer et Fievez, 2000). La production d’énergie au cours des processus fermentaires est le résultat de réactions d’oxydation qui en milieu anaérobie, se traduisent par la libération d’hydrogène métabolique (Figure 1.5) que l’on retrouve dans la cellule sous différentes formes de cofacteurs réduits comme le NADH, NADPH, FADH. La forme oxydée de ces cofacteurs (NAD+, NADP+, FAD+) doit être ensuite régénérée pour que les fermentations puissent se poursuivre. Cette dernière étape conduit à la formation d’hydrogène libre (H2) dans le mélange gazeux du milieu fermentaire
(Jouany et Thivend, 2008). Les AGV jouent un rôle déterminant dans la production d’hydrogène dans le rumen; or les ions hydrogènes libérés sont utilisés par les archées méthanogènes pour la production du CH4 entérique (Doreau et al., 2011). Lorsqu’il y a
17
la formation du butyrate; la formation du propionate, par contre nécessite de l’hydrogène. Or, comme l’accumulation d’hydrogène dans le rumen nuit à la croissance et à l’activité des bactéries et, par conséquent, à la digestion des glucides (Janzen et al., 2008). Il est utile de faire en sorte qu’il ne s’accumule pas d’hydrogène dans le rumen. Les archées méthanogènes éliminent cet hydrogène gazeux qui s’accumule ; s’il n’était pas éliminé, l’action des déshydrogénases dans le processus d’oxydation serait stoppée et il y aurait arrêt des fermentations (Demeyer et Fievez, 2000). Pour ce faire, on peut influer sur le processus de fermentation pour favoriser la production de propionate ou de butyrate, aux dépens de la formation d’acétate, ce qui réduit la quantité hydrogène assimilable par les archées méthanogènes pour la formation de CH4.
Figure 1.5. Métabolisme de l’hydrogène dans les différentes voies fermentaires du rumen (Jouany et Thivend, 2008).
La plus grande partie de CH4 entérique que produisent les bovins est produite dans le rumen.
Toutefois, L’intestin peut aussi être le siège d’un processus de fermentation. Dans l’une des études réalisées sur la production de CH4 dans le rumen et dans l’intestin, Janzen et al. (2008)
ont constaté que 13 % du CH4 est produit dans l’intestin, mais 89 % passe dans le sang par
la paroi intestinale. De même, 95 % du CH4 produit dans le rumen passe dans la circulation
sanguine. Le CH4 qui se trouve dans le sang est acheminé jusqu’aux poumons et expiré durant
18
1.4.2 Techniques de mesure de la production de méthane
1.4.2.1 Chambres respiratoires
Le CH4 émis par l’animal par éructation et par flatulence est mesuré par les chambres
respiratoires. Cette technique consiste à installer un animal dans une chambre avec une circulation d’air contrôlée. Dans ce cas, l’air extérieur pénètre dans la chambre et circule autour de l’animal, comme le montre la figure 1.6. L’air de la chambre est pompé à travers un débitmètre et différents analyseurs de gaz. L’émission de CH4 est alors calculée à partir
du débit d’air et de la concentration du gaz, en l’occurrence le CH4 présent dans l’air à l’entrée
et à la sortie (Bhatta et al., 2007). Les concentrations en O2 et en CO2 à l’entrée et à la sortie
de la chambre peuvent également être mesurées. Les mesures sont effectuées normalement sur une durée de 3 à 5 journées pour diminuer les variations entre les jours. Plus le nombre d’animaux requis est important, moins la variation entre les groupes de vaches sera importante. Ce type de mesures nécessite l’adaptation des animaux durant plusieurs jours à cet environnement. Celui-ci peut en effet affecter le comportement de l’animal, notamment la prise alimentaire. Or, les émissions de CH4 dépendent de la MS consommée (Storm et al.,
2012).
19 1.4.2.2 Les traceurs
La méthode au traçage à l’hexafluorure de soufre (SF6) est apparue dans les années 1990
(Johnson et al., 1994). Elle est basée sur le fait que si l’on connaît le taux d’émission d’un gaz provenant du rumen, ayant le même comportement que le CH4, alors il est possible de
mesurer le taux de CH4 émis par la vache. Ceci suppose également de connaître les
concentrations de ces deux gaz à la fois dans l’air expiré et dans l’air atmosphérique ou ambiant (Storm et al., 2012; Brouček, 2014). La méthode consiste à placer un tube de perméation libérant du SF6 à un taux constant dans le rumen. La vitesse de libération du SF6
du tube est connue avant sa mise en place dans le rumen. Les gaz éructés sont récoltés à l’aide d’un dispositif d'échantillonnage relié à un tube capillaire dont l’extrémité libre est positionnée au-dessus des naseaux (Figure 1.7). Le but est d’obtenir une aspiration constante sur 24 heures.
Figure 1.7. Matériel nécessaire à la mise en œuvre de la méthode au traçage à l’hexafluorure de soufre (SF6) (Hassouna et Eglin, 2015).
20
Les émissions de CH4 sont calculées à partir du rapport CH4/SF6 et de la vitesse de libération
de SF6 spécifique au tube de perméation.
Les émissions de CH4 (FCH4 en g/j) seront ensuite calculées à partir du flux de SF6 (FSF6 en
g/jour) de la manière suivante (Storm et al., 2012):
FCH4= F SF6 × [(CCH4 animal – CCH4 atm) ÷ (CSF6 animal – CSF6 atm)]
CCH4 animal et CSF6 animal (en ppm) sont les concentrations de CH4 et SF6 mesurées dans le
dispositif de collecte (Figure 1.7). CCH4 atm et CSF6 atm sont les concentrations de CH4 et SF6
dans l’air ambiant.
Le SF6 est choisi comme gaz traceur car il possède les caractéristiques suivantes: il est
non-toxique et physiologiquement inerte, stable, il se mélange avec la phase gazeuse du rumen de la même façon que le méthane. Il n’est pas cher, sa limite de détection est très faible et il est simple à analyser (Storm et al., 2012).
La technique du traceur SF6 peut être utilisée pour étudier tous les aspects de nutrition et
d’alimentation. Il permet à l’animal de bouger. Cette technique présente l'avantage d'être beaucoup moins lourde et onéreuse que celle des chambres mais elle est moins précise. Cependant, des problèmes avec cette technique ont été notés. En fait, les résultats obtenus sont souvent inférieurs à ceux collectés avec la méthode des chambres (Johnson et al., 1994). Cette sous-estimation de la production de CH4 a également été notée par Liang et al. (1989)
et a été estimée à 9 %. De plus, le SF6 est un gaz à effets de serre avec un pouvoir de
réchauffement global 22 200 plus puissant que celui du CO2 (Houghton et al., 2001). Des
résidus de SF6 peuvent être retrouvés dans la viande et le lait sur les animaux en
expérimentation. Cette méthode nécessite également l’adaptation de l’animal au port du masque; de plus, les émissions de CH4 par le gros intestin ne peuvent être mesurées (Bhatta
et al., 2007).
1.4.2.3 Système GreenFeed (GF)
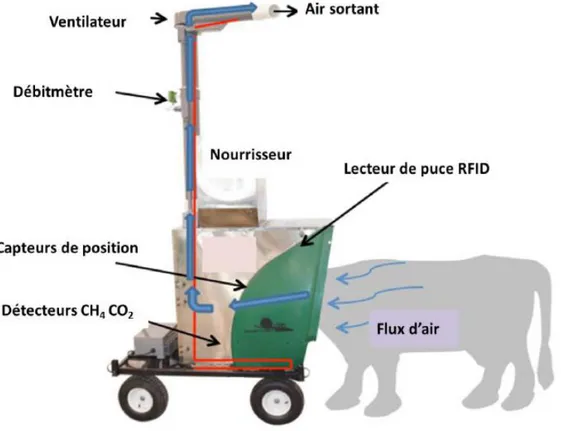
Le système GreenfeedTM a été proposé en 2011 (U.S. Patent 7966971) par l’entreprise CLock Inc. (South Dakota, États-Unis d’Amérique) afin de mesurer les émissions de CH4 chez les
21
des mesures en bâtiments ou au pâturage (Waghorn et al., 2013). Ce système permet d’obtenir des mesures ponctuelles en continu sur un grand nombre d’animaux (e.g., 20 animaux par système) et sur une durée suffisamment longue pour obtenir un nombre de visites permettant de calculer une valeur moyenne représentative des émissions de l’animal. Selon Renand et al. (2013), avec une cinquantaine de visites au total (c'est-à-dire, 3 à 4 visites par jour sur 2 semaines), la répétabilité de la moyenne des émissions mesurées dépasse 70%.
Les mesures de CH4 et CO2 sont réalisées à chaque fois que l’animal visite le système
GreenfeedTM. L’auge intégrée dans le Greenfeed™ est utilisé pour déposer des aliments qui attireront l’animal, mais aussi comme système qui permettra la collecte des gaz éructés. Lorsque l’animal insère sa tête dans l’auge, sa boucle électronique permet de déclencher la distribution alimentaire (i.e., l’appât) et de contrôler la fréquence et le nombre de ses visites. Les gaz émis au niveau des naseaux sont échantillonnés par une aspiration à débit contrôlé et entraînés vers un analyseur infrarouge pour déterminer les concentrations en CH4 et CO2
(Figure 1.8). On peut calculer les émissions de CH4 à partir des concentrations en CH4 et CO2
(corrigées par les concentrations respectives dans l’air ambiant), le débit d’air, et le taux de récupération:
CH4 volume = Fc ×CR ×Σ tp [Δt × (CH4_avg - CH4_bkgrnd) ×Qair]
CR = Taux de récupération des gaz, déterminé à l’aide d’un traceur (%)
Δt = Période de mesure des émissions (1 seconde)
CH4_avg = Moyenne des concentrations en CH4 pendant la période de mesure (%)
CH4_bkgrnd = Concentration de fond en CH4 (%)
Qair = Débit d’air du ventilateur pendant la période de mesure (flux par unité de temps)
22
Figure 1.8. Système « GreenfeedTM » avec ses principales composantes (d’après C-Lock Inc).
1.4.3 Stratégies de réduction de la production de méthane
Tel que mentionné précédemment, la production d’acide acétique dans le rumen est associée à une libération d’ions hydrogène qui seront utilisés par les archées méthanogènes pour la synthèse de CH4 (Doreau et al., 2011). Inversement, la production d’acide propionique dans
le rumen utilise de l’hydrogène réduisant ainsi la disponibilité de ce dernier pour produire du CH4 (Doreau et al., 2011). En plus de l’aspect environnemental à considérer, la production
entérique de CH4 chez le bovin constitue une perte d’énergie pouvant aller jusqu’à 10 % de
l’énergie brute ingérée (Martin et al., 2006). Dans la section suivante, différentes méthodes employées dans le but de diminuer les rejets de CH4 entériques chez le ruminant sont
23 1.4.3.1 Les analogues halogénés
Les composés halogénés peuvent être constitués de fluor, de chlore, de brome, d’iode ou d’astate, éléments chimiques appartenant à la 17ème colonne du tableau périodique. Le
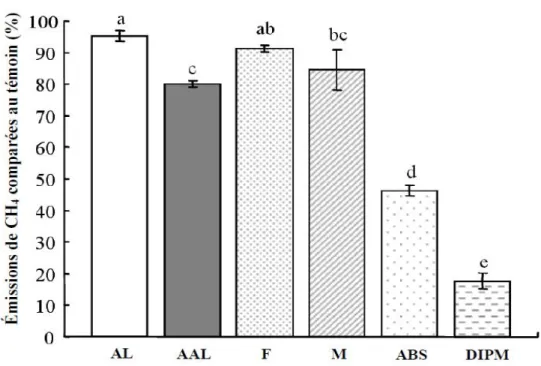
bromochlorométhane, l’acide 2-bromoéthane sulfonique, le 3-bromopropanesulfonique, le chloroforme et la diimide pyroméllitique (DIPM) comptent parmi les composés halogénés évalués pour réduire la méthanogenèse (Hwang et al., 2012). Par contre, selon l’étude de Choi et al. (2004), l’ABS et la DIPM sont considérés comme étaient les plus efficaces pour inhiber la production de CH4 lors d’une expérience menée en condition in vitro (Figure 1.9).
Le mode d’action de l’ABS, un analogue de la coenzyme M, serait l’inhibition de la méthyl-coenzyme M réductase, enzyme catalysant la réduction du CO2 en CH4 (Balch et Wolfe,
1979). En ce qui concerne le DIPM, il agirait directement contre les archées responsables de la production de CH4 (Choi et al., 2004).
Figure 1.9. Effet des traitements (AL = Acide linoléique; AAL = Acide α-linolénique; F = Furamate; M = Malate; ABS = Acide 2-bromoéthane sulfonique; DIPM = Diimide pyroméllitique) sur la production de CH4. (a, b, c, d, e: Les moyennes affectées d'une lettre
24 1.4.3.2 L’utilisation des ionophores
Les antibiotiques ionophores tels que le lasalocide, le salinomycine et le monensin sont des additifs alimentaires reconnus pour leurs propriétés antibactériennes, le monensin étant un des ionophores les plus utilisés. Des études ont montré que ce dernier a la capacité d’inhiber la production de CH4 dans le rumen (Sauer et al., 1998). L’utilisation des ionophores permet
de modifier le profil des AGV vers la production de propionate au détriment de l’acétate permettant ainsi, du moins à court terme, une diminution de 0 à 30% de la production de CH4
(Doreau et al., 2011).
L’effet du monensin ajouté dans la ration à raison de 40 mg/kg a été observé par Odongo et al. (2007) qui ont rapporté une baisse de 7 à 9% de la production de CH4 sur une période de
6 mois (Figure 1.10). Cependant, sur des bouvillons, Guan et al. (2006) ont rapporté que la baisse de production de CH4 de 9% observée durant le premier mois suite à l’administration
du monensin (33 mg/kg) ne s’est pas maintenue ultérieurement, en lien avec une chute transitoire de la population de protozoaires, qui se sont adaptés aux ionophores. Dans une autre étude, Grainger et al. (2010) n’ont observé aucun effet significatif sur les émissions de CH4 lorsque le monensin a été supplémenté à forte dose (450 mg/jour) à des vaches au
25
Figure 1.10. Effet du monensin sur les émissions de CH4 chez des vaches Holstein en
26 1.4.3.3 La défaunation du rumen
Les protozoaires du rumen jouent un rôle important dans la production de CH4. On estime
qu’ils constituent un habitat pour jusqu'à 20 % des méthanogènes. Ces derniers vivant sur et au sein des protozoaires sont censés être responsables d'environ 37 % de la production de CH4 (Klieve et Hegarty, 1999). La défaunation consiste en l’élimination des protozoaires,
microorganismes qui jouent un rôle important dans la digestion du rumen mais qui ne sont pas essentiels pour les ruminants (Jouany, 1994). Différentes techniques de défaunation sont disponibles dans les laboratoires de recherche mais ne sont pas réalisables dans la pratique (Popova et al., 2011): elles sont basées soit sur l’utilisation d’agents chimiques à doses toxiques pour les protozoaires, sur la distribution des rations très digestibles (i.e., riches en amidon) avec un court temps de séjour dans le rumen, ou soit sur l’isolation de jeunes animaux naissant dans un environnement exempt de protozoaires (Jouany et Senaud, 1979).
La défaunation du rumen est aussi reconnue pour son activité anti-méthanogène principalement par un effet indirect sur les proportions molaires d’AGV (Demeyer et Van Nevel, 1979) et par un effet direct sur les protozoaires hébergeant les archées méthanogènes (Hook et al., 2010). L'élimination des protozoaires produisant de l’hydrogène peut conduire à une réduction de la méthanogenèse allant jusqu'à 50 % bien que son importance dépende en grande partie du régime alimentaire (Martin et al., 2010).
Plusieurs autres techniques biologiques peuvent aussi être utilisées pour réduire les émissions de méthane tel que l'ajout de bactéries acétogènes dans le rumen. L’acétogenèse réductrice est un processus métabolique où la réduction du CO2 et du dihydrogène mène à la biosynthèse
d’acétate (Morgavi et al., 2010). Ce processus est effectué par des microorganismes provenant principalement des souches Streptococcus, Ruminococcus et Clostridium (Leclerc, 1997); la plupart étant des bactéries Gram positives (Bernalier et al., 1996). La croissance des bactéries acétogènes ainsi que leur efficacité quant à l’utilisation de l’hydrogène seraient favorisées au détriment des méthanogènes, ce qui résulte en une augmentation de la concentration d’acétate (Chaucheyras et al., 1995). Cependant, l’utilisation de l’acétogenèse comme moyen de réduire le CH4 serait difficilement applicable car dans le rumen, les
27
bactéries acétogènes ne sont pas très compétitives avec les archées méthanogènes pour l’utilisation de l’hydrogène (Doreau et al., 2011).
1.4.3.4 L’utilisation des métabolites secondaires de plantes
L’utilisation des antibiotiques alimentaires tels que les ionophores (monensin; lasalocid) dans l’alimentation de la vache laitière n’est pas toujours acceptée des consommateurs. Depuis 2006, leur usage est interdit dans l’ensemble des pays de l’Union Européenne. De nouveaux produits considérés comme « naturels » ont été évalués pour diminuer la production du CH4
dans le rumen (Doreau et al., 2011). Les trois principaux métabolites secondaires employés dans le but de réduire les émissions de CH4 sont : les saponines, les tanins et les huiles
essentielles. Globalement, ces métabolites modulent la croissance et le développement des microorganismes de la flore ruminale (Bodas et al., 2012; Cieslak et al., 2013).
1.4.3.4.1 Les plantes riches en tanins
Les tanins sont connus depuis plusieurs années pour leur action inhibitrice sur la production de CH4 d’origine entérique. Leurs effets inhibiteurs sur la production de CH4 se font via une
forte réduction des archées méthanogènes (Popova et al., 2011) ou une limitation de la production d’ions hydrogène (Hook et al., 2010).
Plusieurs études ont montré l’effet des tanins sur la production de CH4. Carulla et al. (2005)
ont montré que l’extrait de tanins condensés d’acacia réduisait la production de CH4 à raison
de 2,5% de la MS. Woodward et al. (2004) ont signalé des diminutions de 13% des émissions de CH4 chez le bovin laitier lorsque des doses de tanins condensés (2,62 g/100g de MS)
provenant du lotier étaient ingérées. Wischer et al. (2012) ont évalué les effets de 10 extraits de tanins sur la production de CH4 et ont noté des réductions allant de 8 à 28 %. En revanche
Beauchemin et al. (2007) n’ont signalé aucun effet de l’extrait de tanin de quebracho distribué à raison de 2% de la MS, de même que Sliwinski et al. (2002) avec 1 à 2% de tanins de châtaignier dans la MS.
28 1.4.3.4.2 Les plantes riches en saponines
Les saponines sont des glycosides que l'on trouve dans certaines plantes. Ils ont un effet bénéfique pour le ruminant et l'environnement; ils favorisent la synthèse de protéines microbiennes, ce qui réduit la quantité de l’hydrogène et par la suite la production de méthane (Doreau et al., 2011). De plus, les saponines réduisent les protozoaires dans le rumen (Newbold et Rode, 2006). Leur effet sur les différentes populations microbiennes du rumen dépend du type de régime alimentaire (Popova et al., 2011). Dans un essai in vitro par Holtshausen et al. (2009), des diminutions de 25% de la production de CH4 ont été mises en
évidence lorsque des concentrations de Yucca schidigeria et Quillaja saponaria allant jusqu’à 4,5 g/kg de MS ont été ajoutées dans les incubations. Cependant, lors d’une expérience menée in vivo sur des vaches laitières après des périodes d’adaptation de 4 semaines, aucun effet significatif sur les émissions de CH4 n’a été observé par les mêmes
auteurs lorsque des concentrations de Yucca schidigera et de Quillaja saponaria allant jusqu’à 45 g/kg de MS ont été administrées.
1.4.3.4.3 Les huiles essentielles
Les huiles essentielles sont des mélanges hétérogènes où on retrouve des constituants terpénoïdes ou non-terpénoïdes, certaines formes d’alcools, d’acides, d’esters, d’aldéhydes, de cétones, d’amines, de sulfides ou même des composés halogénés (Cieslak et al., 2013). Considérant les propriétés antimicrobiennes des huiles essentielles, les scientifiques ont tenté d’établir si ces composés pourraient être utilisés pour inhiber la méthanogenèse dans le rumen. Le défi consiste à identifier les huiles essentielles qui réduisent la production de CH4
sans diminuer la digestion des aliments. Evans et Martin (2000) n'ont observé aucun effet sur la concentration de CH4 lorsque le thymol a été utilisé à 50, 100 et 200 mg/L dans des
incubations de 24 heures de cultures de bactéries mixtes du rumen. Cependant, à une concentration plus élevée de 400 mg/L, le thymol a fortement diminué la concentration de méthane, mais les concentrations d'acétate et de propionate ont également été réduites. Macheboeuf et al. (2008) ont évalué dans des cultures in vitro de type batch (16 h d'incubation), les effets du thym (T. vulgaris, 470 g/kg de thymol, 200 g/kg de terpinène et