Université de Montréal
La fonction protectrice des acides gras oméga-3 dans la
neuroinflammation et les comportements anxio-dépressifs
induits par l’obésité et l’implication du récepteur GPR120
par Geneviève Demers
Département de nutrition Faculté de médecine
Mémoire présenté à la Faculté des études supérieures
en vue de l’obtention du grade de maîtrise ès sciences (M.Sc.) en nutrition
Janvier 2019
Résumé
Introduction: L'obésité peut provoquer un statut pro-inflammatoire dans plusieurs régions du cerveau, incluant le noyau accumbens (NAc), impliquées dans le contrôle des comportements anxio-dépressifs. Les acides gras polyinsaturés oméga-3 (n-3) diminuent les symptômes de dépression majeure et peuvent inhiber l’inflammation métabolique. GPR120 est un récepteur couplé à la protéine G qui est activé par les n-3. En périphérie, GPR120 est impliqué dans la résolution de l'inflammation au sein des macrophages.
Hypothèse: Une supplémentation en n-3 améliore les comportements anxio-dépressifs de même que des paramètres métaboliques et inflammatoires altérés par une obésité induite par la diète, et ce, entre autres, via l’implication de GPR120. Objectifs principaux: Mesurer les effets d’une supplémentation chronique en n-3 en contexte d’obésité sur des paramètres métaboliques, comportementaux et inflammatoires de même que de décrire les effets anti-inflammatoires de l’activation microgliale de GPR120.
Méthodes: Dans la première étude, des souris C57Bl/6 ont été nourries avec une diète riche en gras saturés ou une diète contrôle pour ensuite être gavées quotidiennement avec des huiles de poisson ou de maïs. Des mesures comportementales, métaboliques et inflammatoires ainsi qu’une quantification des neurolipides ont été effectuées. Dans la deuxième étude, l'expression de GPR120 a été évaluée dans plusieurs types cellulaires cérébraux. Des marqueurs inflammatoires ont été mesurés dans des cultures microgliales primaires de souris exposées à un agent pro-inflammatoire, le lipopolysaccharide (LPS), et à un agoniste spécifique de GPR120 (cpdA). Des traitements semblables ont été administrés in vivo afin d’étudier leurs effets sur les comportements de type anxieux.
Résultats: La supplémentation en n-3 a amélioré les comportements de type anxieux, le déficit exploratoire, l’intolérance au glucose et les modulations de la lipidomique cérébrale induits par la diète riche en gras. Nous avons rapporté l’expression de GPR120 principalement dans la microglie et le cpdA a diminué l'expression et la
sécrétion de marqueurs pro-inflammatoires induites par le LPS dans la microglie. Le traitement avec le cpdA in vivo a également amélioré les comportements de maladie démontrés par une résolution de la diminution locomotrice engendrée par le LPS. Ces résultats démontrent les effets bénéfiques comportementaux et anti-inflammatoires des n-3 en contexte d’obésité et suggèrent que l’activation microgliale de GPR120 médie ces effets.
Mots-clés: Acides gras n-3, neuroinflammation, obésité, GPR120, comportements anxio-dépressifs.
Abstract
Introduction: Obesity can elicit cerebral inflammation, including in the nucleus accumbens (NAc), a brain region involved in the control of anxio-depressive behaviors. Omega-3 polyunsaturated fatty acids (n-3) reduce symptoms of major depression and may inhibit metabolic inflammation. GPR120 is a G-protein coupled receptor activated by n-3. Peripherally, GPR120 is involved in the resolution of inflammation within macrophages.
Hypothesis: N-3 supplementation improves anxio-depressive behaviors as well as metabolic and inflammatory parameters altered by diet-induced obesity through the involvement of GPR120.
Objectives: To measure the effects of a chronic n-3 supplementation in a context of obesity on metabolic, behavioral and inflammatory parameters as well as to describe the anti-inflammatory effects of GPR120 microglial activation.
Methods: In the first study, C57Bl/6 mice were submitted to a high-fat or control diet and then gavaged daily with fish oil or corn oil. Behavioral, metabolic, inflammatory markers, as well as neurolipids measurements were performed. In the second study, GPR120 expression was assessed in several brain cell types. Inflammatory markers expression was measured in mouse primary microglia cultures exposed to a pro-inflammatory agent, the lipopolysaccharide (LPS) and a GPR120 specific agonist (cpdA). Similar treatments were administered in vivo to study their impact on anxiety-like behaviors.
Results: Chronic n-3 supplementation improved anxiety-like behavior, exploratory deficit, glucose intolerance, and cerebral lipidomic modulations induced by a high-fat diet. We reported that the expression of GPR120 primarily in microglia and cpdA decreased the expression and secretion of pro-inflammatory markers induced by LPS in microglia. Treatment with cpdA in vivo also improved sickness behaviors demonstrated by the resolution of locomotor deficit caused by LPS. These results demonstrate the behavioral and anti-inflammatory benefits of n-3 in the context of obesity and suggest that GPR120 microglial activation mediates these effects.
Keywords: Omega-3 fatty acids, neuroinflammation, obesity, GPR120, anxiodepressive behaviors.
Table des matières
La fonction protectrice des acides gras oméga-3 dans la neuroinflammation et les comportements anxio-dépressifs induits par l’obésité et l’implication du récepteur GPR120 ...
Résumé ... i
Abstract ... iii
Table des matières ... v
Liste des figures ... vii
Liste des abréviations ... viii
Remerciements ... xi
Chapitre 1: Introduction ... 1
1.1. Obésité et les troubles anxieux et dépressifs ... 1
1.1.1. Définition de l’obésité ... 1
1.1.2. Définition de troubles anxieux et dépressifs ... 3
1.1.3. Mécanismes expliquant l’association entre l’obésité et les troubles dépressifs ... 4
1.2. Neuroinflammation ... 5
1.2.1. Généralités ... 5
1.2.2. Conséquences comportementales de la neuroinflammation induite par l’obésité 6 1.3. Les acides gras oméga-3 ... 9
1.3.1. Généralités ... 9
1.3.2. Sources alimentaires ... 10
1.3.3. Apports recommandés... 11
1.3.4. Rôles physiologiques ... 11
1.3.5. Effets bénéfiques des n-3 sur le syndrome métabolique ... 12
1.3.6. Effets bénéfiques des n-3 sur les comportements anxieux et dépressifs 14 1.3.7. Composition lipidique du cerveau ... 18
1.4.2. Rôles métaboliques et anti-inflammatoires ... 21
1.4.3. Mécanisme anti-inflammatoire ... 22
1.5. Hypothèses et objectifs de recherche ... 25
1.6. Contribution aux articles ... 25
Chapitre 2: Article 1 (non publié) ... 26
Omega-3 fatty acid supplementation defends against metabolic, anxiogenic and neurolipid consequences of a saturated high-fat diet ... 26
Introduction ... 30 Methods ... 32 Results ... 36 Discussion ... 39 References ... 43 Figure Legend ... 55
Chapitre 3: Article 2 (non publié) ... 57
Microglial GPR120 activation protects against neuroinflammation and associated behavioral alterations ... 57 Introduction ... 60 Methods ... 62 Results ... 69 Discussion ... 71 Conclusion ... 74 References ... 75 Figure Legend ... 86 Chapitre 4: Discussion ... 88 Chapitre 5: Références ... 97
Liste des figures
Figure 1. Mécanismes neurobiologiques communs à l’obésité et la dépression (adapté de Ouakinin et coll. 2018[17]). ... 5 Figure 2. Représentation d’un labyrinthe en croix surélevé standard (EPM; de l’anglais elevated-plus maze)(d’après Sweis et coll.[29]) ... 8 Figure 3. Représentation du test de la nage forcée (FST; de l’anglais forced swim test)[31]….. .. ………..9 Figure 4. Critères diagnostiques du syndrome métabolique (adapté de la FID, 2006[57])…… ... 13 Figure 5. Représentation d’un light/dark box (LDB)[69] ... 15 Figure 6. Diagramme de type snake-plot (d’après Moniri, 2016)[112]. ... 20 Figure 7. Schéma du mécanisme anti-inflammatoire de GPR120 dans un macrophage (adapté de Oh et coll., 2010[115] et Zhang, 2014[110]). ... 24
Liste des abréviations
ALA: Alpha-linolenic acidAS: Apport suffisant BBB: Blood–brain barrier CpdA: Compound A
CRF: Corticotropin-releasing factor CRP: C-reactive protein
CX3CR1: CX3C chemokine receptor 1 DHA: Docosahexaenoic acid
EPA: Eicosapentaenoic acid EPM: Elevated-plus maze FFA4: Free-fatty acid receptor-4 FO: Fish oil
FST: Forced swim test
GPCR: G-protein coupled receptor
GPR120: G-protein coupled receptor 120 HFD: High fat diet
HPA: Hypothalamic–pituitary–adrenal
Iba1: Ionized calcium-binding adapter molecule 1 IKK: IκB kinase
IL-1β: Interleukine 1 bêta IL-6: Interleukine 6
IMC: Indice de masse corporelle JNK: c-Jun N-terminal kinase KO: Knock-out
LPS: Lipopolysaccharide
MDD: Major depressive disorder
n-3: Acides gras polyinsaturés oméga-3 NAc: Noyau accumbens
OFT: Open field test
OLM: Object location memory ORM: Object recognition memory
PPARγ: Peroxisome proliferator-activated receptor gamma PUFA: Polyunsaturated fatty acid
SNC: Système nerveux central
TAB1: Transforming growth factor-β activated kinase 1-binding protein TAK1: Transforming growth factor-β activated kinase 1
TLR4: Toll-like receptor 4
TNF-α: Tumor necrosis factor alpha TNRF: tumor necrosis factor receptor WAT: White adipose tissue
Remerciements
J’aimerais d’abord et avant tout remercier ma directrice de recherche, Stephanie Fulton, de même que Thierry Alquier pour leur support constant à travers cette aventure. Dans les bons comme dans les moins bons moments, vous avez su trouver les bons mots pour m’encourager à continuer et à persévérer. Non seulement cette maîtrise a été une expérience professionnelle des plus enrichissantes, mais elle le fut également du point de vue personnel. Merci du fond du cœur, j’ai énormément appris.
Je souhaiterais profiter de l’occasion pour remercier tous les membres de mon labo qui ont de près ou de loin contribué à cette aventure mémorable. Un merci tout particulier à Arturo Israel Machuca Parra, Alexandre Fisette, Khalil Bouyakdan, Demetra Rodaros, Diane Bairamian et Zahra Dashtehei Pour pour votre aide précieuse à la réalisation de ces deux articles. Merci de m’avoir si bienveillamment transmis vos connaissances et d’avoir fait preuve d’autant de patience à mon égard. Je l’apprécie énormément.
Je tiens à remercier également ma famille, Maman, Papa et Momon. Avoir des gens autour de soi qui s’intéresse à ce que l’on fait, c’est précieux. J’ai de la chance de vous avoir, vous ne savez pas à quel point. Merci d’être là, tout le temps, sans compromis.
Finalement, j’aimerais dire merci à la personne qui partage ma vie, mes joies, mes peines, mes angoisses comme mes défauts. Tony, tu sais et je sais que sans toi, je ne serais pas où j’en suis maintenant. Je t’en serais toujours reconnaissante.
« Vise la lune et si toutefois tu la manques, tu finiras tout de même parmi les étoiles… et les étoiles c’est magnifique! »
Chapitre 1: Introduction
1.1.
Obésité et les troubles anxieux et dépressifs
1.1.1. Définition de l’obésité
L’obésité se caractérise par une accumulation anormale ou excessive de tissu adipeux pouvant avoir des conséquences néfastes sur la santé des individus. L’indice de masse corporel (IMC) constitue l’outil standard pour dépister l’embonpoint et l’obésité. La formule de l’IMC se détaille comme suit :
𝑀𝑎𝑠𝑠𝑒 𝑐𝑜𝑟𝑝𝑜𝑟𝑒𝑙𝑙𝑒 (𝑒𝑛 𝑘𝑔) 𝑇𝑎𝑖𝑙𝑙𝑒 (𝑒𝑛 𝑚)2
Une personne dont l’IMC est en deçà de 18,5 est considérée en insuffisance pondérale. Entre 18,5 et 24,5, l’IMC se catégorise comme « normal ». Au-dessus de 24,5, la personne est considérée en surpoids, et au-dessus de 30, en obésité[1].
Le phénomène de l’obésité à l’échelle planétaire s’est aggravé au courant des dernières décennies. En 1975, l’IMC moyen des hommes et des femmes était de 21,7 et 22,1 kg/m2 respectivement. En 2014, il était de 24,2 et 24,4 kg/m2 chez les hommes et les femmes respectivement. Ces chiffres sont alarmants considérant que si la situation reste inchangée, la prévalence de l’obésité à l’échelle populationnelle pourrait atteindre 18% chez les hommes et 21% chez les femmes en 2025[2]. La situation canadienne n’est guère mieux avec un taux de 62% d’embonpoint et environ 25% d’obésité au sein de la population en 2012[3].
L’IMC possède tout de même ses limites en matière d’outil de dépistage de l’obésité. En effet, ce ratio ne prend pas en considération la composition corporelle de l’individu, un facteur qui s’avère déterminant afin de déterminer le risque de maladies cardiométaboliques. Plus précisément, cet outil ne distingue pas la masse grasse viscérale de la graisse sous-cutanée, ainsi que la masse musculaire de la masse adipeuse, ce qui soulève un questionnement face à son efficacité à détecter l’obésité et les complications associées[4,5].
L’étiologie de l’obésité est très complexe, dynamique et multifactorielle. Ce phénomène découle d’une combinaison de plusieurs déterminants en interaction. Selon Egger et Dixon, les maladies chroniques, telle l’obésité, peuvent être expliquées en partie par une prédisposition génétique, mais également par ce que les auteurs appellent des « anthropogènes ». Par définition, il s’agit d’« environnements créés par l'Homme, leurs sous-produits et/ou modes de vie encouragés par ceux-ci, dont certains peuvent nuire à la santé humaine » (Traduction libre). Ces « anthropogènes » suivent l’acronyme NASTIE ODOURS qui correspond à :
1. La nutrition
2. L’activité (ou inactivité) physique 3. Le stress/anxiété/dépression
4. La pathologie induite par la technologie (Technology-induced-pathology) 5. Le sommeil inadéquat (Inadequate sleep)
6. L’environnement 7. L’occupation
8. La drogue/cigarette/alcool
9. La surexposition ou la sous-exposition au soleil (Over- and
underexposure)
10. Les relations
11. Les facteurs sociaux (Social factors) [6]
Pour en revenir à l’aspect génétique, il est important de mentionner qu’une personne peut, en raison de ses gènes, être prédisposée à l’obésité. En 2015, Locke et coll. ont découvert que la majorité des loci associés à l’IMC se trouve dans le système nerveux central (SNS)[7]. Il n’en reste pas moins que cette prédisposition génétique ne sera exprimée que si cette personne est exposée à un environnement obésogène, dénotant ainsi l’importance de l’environnement dans le développement de l’obésité.
Aussi, il est difficile d’établir l’orientation de la relation entre l’obésité et les différents facteurs de risque « anthropogènes »; sont-ils les causes ou les conséquences de l’obésité? Somme toute, l’obésité est corrélée aux risques de maladies
cardiovasculaires, cancers, diabète, mortalité, diverses limitations physiques de même que des troubles psychologiques[8].
1.1.2. Définition de troubles anxieux et dépressifs
La 5e édition du Diagnostic and Statistical Manual of Mental Disorders discrimine les troubles dépressifs et les troubles anxieux en deux classifications distinctes.
Les troubles anxieux se définissent comme une sensation de peur excessive ou une anticipation exagérée d’un danger futur, le tout s’accompagnant de perturbations comportementales importantes. Les personnes qui en souffrent surestiment généralement le danger associé à une situation qui les effraye. Les troubles anxieux diffèrent du stress ou de la peur transitoire normaux par leur style cognitif persistant qui alimente l’anxiété. Les troubles dépressifs, pour leur part, constituent un ensemble de conditions psychologiques qui affectent l’humeur. Les symptômes sont multiples et varient d’une personne à l’autre. Ils incluent entre autres une tristesse marquée, une perte d’intérêt général, des changements cognitifs et somatiques, de même qu’un sentiment de vide intérieur[9]. Autant dans le cas des troubles anxieux que dépressifs, les émotions intenses et désagréables perdurent dans le temps en plus de nuire au bien-être, à la santé physique et au fonctionnement global[10]. Ces pathologies sont malheureusement très communes de nos jours dans les sociétés occidentales. En 2012, 12,6% de la population canadienne, soit 3,5 millions de personnes, répondaient à un moment durant leur vie aux critères diagnostiques de troubles de l’humeur. Pour l’anxiété généralisée, ce pourcentage s’élève à 8,7% ou 2,4 millions de Canadiens. Cette prévalence élevée est alarmante non seulement puisqu’elle démontre l’impact négatif de ces maladies sur la santé de la population, mais aussi les répercussions économiques qu’elles représentent. En effet, on peut penser à la perte de productivité et l’absentéisme au travail de même que les soins de santé et chômage réclamé[11]. En revanche, ces deux conditions psychologiques coexistent fréquemment. Il a été démontré que 85% des patients dépressifs souffrent également de troubles anxieux. Inversement, 90% des patients anxieux sont atteints d’un trouble dépressif[12]. Non seulement ces deux pathologies sont comorbides, mais elles pourraient prédisposer
également les personnes qui en souffrent à des maladies cardiovasculaires et au syndrome métabolique, incluant l’obésité[12,13].
1.1.3. Mécanismes expliquant l’association entre l’obésité et les troubles dépressifs
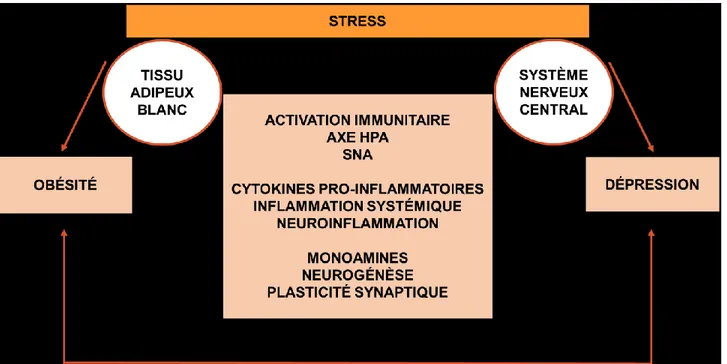
Le surplus pondéral augmente le risque de souffrir de pathologies du système nerveux central (SNC)[14]. Plus précisément, la croissance de l’obésité dans nos populations est concomitante avec l’augmentation de l’incidence de démence, d’accident vasculaire cérébral, d’Alzheimer et de dépression[15]. D’ailleurs, l’obésité augmente le risque de dépression de 55%, et inversement un individu dépressif aura 58% plus de chances de devenir obèse au courant de sa vie[16]. La communauté scientifique s’entend pour dire que la pierre angulaire de ces deux pathologies est la conséquence de l’exposition chronique au stress. Évidemment, la vulnérabilité au stress est très variable d’un individu à l’autre et est influencée par plusieurs facteurs cognitifs, émotionnels et contextuels[17]. L’axe hypothalamo-hypophyso-surrénalien (HPA; de l’anglais hypothalamic–pituitary–adrenal) est un système dynamique qui a pour rôle fondamental de protéger l’organisme lorsqu’un danger ou une menace imminente survient. Le noyau paraventriculaire de l’hypothalamus produit et sécrète alors de la corticolibérine (CRF; de l’anglais corticotropin-releasing factor) qui atteindra l’hypophyse. La liaison du CRF à son récepteur favorisera la synthèse et le relargage de l’adrénocorticotrophine qui à son tour, atteindra les glandes corticosurrénales. Ceci provoquera la libération de glucocorticoïdes ou cortisol chez l’Humain[18]. Cette activation engendrera la production et la sécrétion de cytokines pro-inflammatoires. L’augmentation du tissu adipeux blanc (WAT; de l’anglais white adipose tissue) induite par l’obésité favorise aussi l’augmentation de la libération de ces cytokines[17]. L’axe HPA interagit également avec le système nerveux autonome, responsable du maintien de l’homéostasie de l’organisme. En effet, la libération du CRF par l’axe HPA favorisera la libération de monoamine incluant la norépinéphrine qui, à son tour, promeut la sécrétion de cytokines pro-inflammatoires. En outre, l’inflammation systémique
chronique induite par l’obésité perturbe également la neurogenèse et la plasticité neuronale qui, elles, augmentent le risque de dépression (Figure 1)[17].
Figure 1. Mécanismes neurobiologiques communs à l’obésité et la dépression (adapté de Ouakinin et coll. 2018[17]).
Quoique l’obésité et la dépression possèdent des étiologies et pathophysiologies différentes, il est bien accepté aujourd’hui qu’ils partagent un point commun: un état pro-inflammatoire chronique, et ce, particulièrement au niveau du SNC[19].
1.2.
Neuroinflammation
1.2.1. GénéralitésLa neuroinflammation se définit comme l’ensemble des réponses immunitaires dans le SNC[20]. Cet ensemble de réactions a pour objectif de rétablir l’homéostasie en favorisant la régénération des cellules suite à une agression, un traumatisme ou une lésion[21]. Le SNC a longtemps été considéré du point de vue de l'immunité comme privilégié, et ce, pour plusieurs raisons. D’abord, structuralement parlant, le SNC est protégé par la barrière hématoencéphalique (BBB; de l’anglais blood–brain barrier), un
bouclier cellulaire entre la circulation sanguine et le parenchyme cérébral, ainsi que par l’absence de drainage lymphatique conventionnel[21]. Ces derniers permettent de limiter la diffusion de molécules et donc de limiter les attaques par des agents pathogènes. C’est d’ailleurs pourquoi certains experts considèrent la neuroinflammation comme de la « pseudo-inflammation » puisque le cerveau n’utilise pas les mêmes processus inflammatoires qu’en périphérie. En effet, le modèle classique d’inflammation implique un mécanisme de recrutement des cellules immunitaires périphériques, ce qui n’est pas le cas du cerveau[22]. Pour pallier ceci, le SNC possède son propre arsenal de cellules participant aux réponses immunitaires, incluant les cellules endothéliales, les astrocytes, les oligodendrocytes ainsi que la microglie[23]. La microglie, étant la cellule immunitaire résidente du cerveau, est au centre des processus de neuroinflammation. À l’état basal, la microglie participe activement à la surveillance de l’équilibre immunitaire du cerveau. Lorsqu’une agression survient, la microglie produira des cytokines, chimokines, des dérivés réactifs de l’oxygène, ainsi que d’autres médiateurs inflammatoires[20].
1.2.2. Conséquences comportementales de la neuroinflammation induite par l’obésité
L’obésité induit la libération en circulation de multiples facteurs pro-inflammatoires, et ce de manière chronique, participant ainsi au phénomène appelé low-grade
inflammation[24]. Les cytokines atteignent le cerveau où elles causent des
perturbations des fonctions cérébrales. Plusieurs évidences démontrent d’ailleurs des altérations comportementales secondaires à la neuroinflammation. Jusqu’à maintenant, la majorité de la recherche à ce sujet est effectuée chez le rongeur. Ces études mesurent généralement ces paramètres sur deux fronts, soit l’apprentissage et la mémoire spatiale ainsi que l’anxiété et la dépression.
D’abord, l’évaluation des capacités cognitives reliées à la mémoire spatiale est principalement effectuée dans les études à l’aide de l'Object Recognition Memory (ORM) et de l'Object Location Memory (OLM) test. L’ORM consiste à exposer une
Ensuite, lors de l’expérimentation, un des deux objets sera remplacé par un objet sensiblement similaire sur le plan de la taille et de la forme sans être exactement identique. Plus l’animal explorera ce nouvel objet, plus cela signifie qu’il reconnaît que cet objet est différent, ce qui reflète ses capacités de mémorisation. L’OLM est un test similaire. Par contre, dans ce cas-ci, ce n’est pas l’objet qui est modifié durant l’expérimentation, mais bien la localisation de celui-ci[25]. L’avantage de combiner ces deux tests est que le test de l’ORM est dit indépendant des processus de mémorisation de l’hippocampe, une structure-clé dans les mécanismes cognitifs impliquant l’apprentissage et la mémoire, alors que celui de l’OLM en est dépendant[26]. Il a été démontré que l’exposition chronique à une diète riche en gras chez le rongeur induit des déficits de mémorisation dans le test de l’ORM et de l’OLM[26,27]. Ainsi, l’hippocampe est une région cérébrale sensible à l’obésité avec des niveaux de facteur de nécrose tumorale (TNF-α; de l’anglais tumor necrosis factor alpha) et de ionized
calcium-binding adapter molecule 1 (Iba1), un marqueur d’activation microgliale,
augmentés par rapport à ceux de souris soumises à une diète basse en gras[28]. Ensuite, l’anxiété est évaluée chez le rongeur principalement à l’aide du labyrinthe en croix surélevée (EPM; de l’anglais elevated-plus maze) et du test du champ ouvert (OFT; de l’anglais open field test). Ces deux tests sont basés sur l’aversion instinctive des souris pour les espaces ouverts, par mesure de protection contre les prédateurs. L’EPM est constitué d’une croix surélevée du sol comportant deux bras fermés à l’aide de murs ainsi que de deux bras ouverts exposés (Figure 2). Plus l’animal reste dans les bras fermés durant le test, plus celui-ci est considéré comme anxieux.
Figure 2. Représentation d’un labyrinthe en croix surélevé standard (EPM; de l’anglais elevated-plus maze)(d’après Sweis et coll.[29])
L’OFT, pour sa part, consiste en une boîte fermée où l’animal y est déposé en début de test. La préférence d’un animal à longer les murs par opposition à la section centrale de la boîte est synonyme d’anxiété. Des résultats préalablement publiés par notre laboratoire démontrent que l’obésité induite par une diète riche en gras saturés suscite des comportements anxieux, autant dans l’EPM que dans l’OFT. Cette même recherche a conclu que ces altérations comportementales étaient associées à une augmentation de paramètres inflammatoires dans le noyau accumbens (NAc), une région d’intérêt impliquée dans la motivation et les comportements anxio-dépressifs[30]. Pour ce qui est des comportements dépressifs chez la souris, il semble être plus complexe et nuancé à évaluer. En effet, le test classique utilisé chez les rongeurs est le test de la nage forcée (FST; de l’anglais forced swim test) qui mesure un type de comportement s'apparentant au désespoir (Figure 3). Ce test consiste à placer l’animal dans un bécher rempli d’eau et de mesurer l’amplitude et la vigueur avec lesquelles l’animal tente d’échapper à cette situation aversive. Un animal qui exprime des comportements de type dépressif aura tendance à être immobile dans l’eau.
Figure 3. Représentation du test de la nage forcée (FST; de l’anglais
forced swim test)[31]
L’obésité exacerbe ce type de comportement chez la souris, entre autres en augmentant les taux de cytokines pro-inflammatoires telle l’interleukine 1 bêta (IL-1β) dans l’amygdale[32]. Cette structure cérébrale, tout comme le NAc, fait partie du système limbique, une interconnexion entre différentes structures cérébrales impliquées dans la modulation des processus émotionnels.
1.3.
Les acides gras oméga-3
1.3.1. Généralités
Les oméga-3 (n-3) font partie de la famille des acides gras polyinsaturés (PUFA; de l’anglais polyunsaturated fatty acid) à chaînes longues qui par définition sont des acides gras comportant un minimum de deux insaturations. Les n-3 se caractérisent par leur premier double lien sur le carbone 3 à partir du groupement méthyle de la chaîne carbonée[33]. Il existe plusieurs types d’acides gras n-3, dont l’acide alpha linolénique (ALA; de l’anglais alpha-linolenic acid), l’acide eicosapentaénoïque (EPA; de l’anglais eicosapentaenoic acid) et l’acide docosahexaénoïque (DHA; de l’anglais
docosahexaenoic acid). L’EPA et le DHA sont considérés comme les acides gras n-3
les plus actifs biologiquement chez l’être Humain[34].
L’Humain peut synthétiser tous les types d’acides gras nécessaires au bon fonctionnement des fonctions biologiques à l’exception des acides gras à chaînes longues n-3 et oméga-6 (n-6) [35]. En effet, l’ALA est considéré comme un acide gras essentiel puisqu’il ne peut être synthétisé à partir d’aucun autre acide gras, en raison de l’absence de désaturase qui insère un double lien au carbone en position 15. Il est donc essentiel de se procurer cet acide gras dans l’alimentation. L’ALA peut, par contre, être convertie en EPA et subséquemment en DHA[36]. Quoi qu'il en soit, plusieurs critiquent cette allégation en dénotant le taux de conversion très faible de l’ALA en EPA et puis en DHA[37]. Par ailleurs, il semble qu’il y ait un dimorphisme sexuel important à ce niveau. Les femmes convertiraient l’ALA en EPA et en DHA à un taux de 21% et 9.2% respectivement. Pour leur part, les hommes le convertiraient à un taux de 8% et 4% pour l’EPA et le DHA respectivement[38]. C’est pourquoi il est nécessaire de consommer régulièrement des aliments riches en EPA et en DHA afin d’atteindre un apport optimal [37].
1.3.2. Sources alimentaires
L’ALA est présente majoritairement dans les huiles végétales, les noix, la graine de lin et les produits dérivant du soya[39], ce qui en fait l’acide gras n-3 prédominant dans l’alimentation des Nord-Américains[40]. L’EPA et le DHA se retrouvent principalement dans les aliments d’origine marine. Plus précisément, l’huile dérivée du krill et des algues sont les plus riches en EPA et DHA[41]. Les poissons pélagiques d’eau froide tel le saumon, la sardine et le hareng sont également d’excellentes sources de ces n-3. En revanche, il est maintenant connu que la teneur en acides gras de ces poissons varie grandement selon la localisation géographique, la période de l’année où ils sont pêchés, ainsi que l’alimentation des poissons eux-mêmes. En effet, les poissons issus de pisciculture, mangeant une diète à contenu constant en n-3, auront une teneur en n-3 beaucoup plus stable tout au long de l’année comparativement aux poissons sauvages. D’importantes variations dans le contenu en EPA et DHA des suppléments
sous forme de capsule ont également été observées[34]. Cette variabilité complique l’évaluation de l’apport exact en ces acides gras auprès de la population à l’aide de méthodes traditionnelles telles que le rappel de 24 heures ou le questionnaire de fréquence alimentaire.
1.3.3. Apports recommandés
Santé Canada a déterminé un apport recommandé journalier pour l’ALA. Il s’agit d’un apport suffisant (AS) fixé à 1,6 g/jour et à 1,1 g/jour pour les hommes et les femmes de plus de 14 ans respectivement[42]. Cette recommandation est critiquée puisqu’il s’agit d’un AS, valeur établie lorsque les données scientifiques sont insuffisantes pour déterminer un apport de nutritionnel recommandé. Pour être plus précis, «L'AS est l'apport quotidien moyen recommandé en s'appuyant sur des observations, des expérimentations ou des estimations approximatives de l'apport nutritionnel chez un ou plusieurs groupes de personnes apparemment en bonne santé qui semblent conserver un statut nutritionnel adéquat»[43]. Donc, cette évaluation des besoins pourrait être inexacte dans certaines situations dues au manque de données probantes pour établir une recommandation précise selon l’âge, le sexe et l’état de santé par exemple. Au niveau des apports journaliers en EPA et DHA, les grandes instances gouvernementales incluant l’Organisation mondiale de la santé, l’Association américaine de diététique ainsi que les diététistes du Canada s’entendent pour recommander une consommation de deux portions de poissons gras par semaine, équivalant approximativement à 500 mg d’EPA et de DHA par jour[40,44].
1.3.4. Rôles physiologiques
Les n-3 possèdent de multiples rôles variés au sein de divers systèmes. Entre autres, les n-3 entrent dans la composition des phospholipides présents dans les membranes cellulaires. Celle-ci varie grandement en fonction du type de cellules et de son emplacement. Le DHA est davantage intégré dans les membranes cellulaires que l’EPA, et ce, majoritairement au sein des cellules cérébrales et de la rétine[41,45]. La composition membranaire est également influencée par l’apport alimentaire. En effet,
il a été démontré qu’une supplémentation en n-3, et plus spécifiquement en DHA, augmente la fluidité membranaire[46,47]. D’ailleurs, la fluidité membranaire est essentielle à l’expansion des membranes cellulaires, démontrant l’importance des n-3, en particulier le DHA, lors du développement neuronal[48]. L’intégration des n-3 dans cette structure influence aussi les mécanismes de signalisation intracellulaire, l’activation et la formation des récepteurs transmembranaires, l’épaisseur de même que la perméabilité de la membrane[35,48]. Aussi, les n-3 jouent un rôle crucial dans la réduction de l’inflammation. Entre autres, l’augmentation de l’apport en n-3 favoriserait la biosynthèse de médiateurs anti-inflammatoires, au détriment de ceux dérivés des n-6 pro-inflammatoires, puisque ces deux types d’acides gras partagent les mêmes enzymes de conversion[49]. De multiples évidences ont aussi démontré l’effet des n-3 sur les niveaux circulants de molécules pro-inflammatoires telles les interleukines 6 (IL-6), d’IL-1β, TNF-α ainsi que la protéine C réactive (CRP; de l’anglais
C-reactive protein) [50–52]. Dans le même ordre d’idée, les n-3 bloquent la cascade
d’activation du facteur de transcription pro-inflammatoire nuclear factor-kappa B (NFκB), qui lui-même promeut l’expression de cytokines pro-inflammatoires[53]. Les n-3 ont également démontré des effets bénéfiques au niveau du développement fœtale[54], de la fonction visuelle[55] et immunitaire[35,56].
1.3.5. Effets bénéfiques des n-3 sur le syndrome métabolique
Selon la Fédération internationale de diabète, le syndrome métabolique est une combinaison des facteurs de risques cardiaques les plus nocifs pour la santé[57] et la synergie entre eux potentialise leurs effets délétères. Les critères diagnostiques de cette condition sont détaillés à la figure 4.
Figure 4. Critères diagnostiques du syndrome métabolique (adapté de la FID, 2006[57])
Les effets bénéfiques des n-3 sur la santé cardiométabolique ont fait l’objet de recherche extensive depuis 60 ans. Hugh Macdonald Sinclair, en 1953, a été l’un des premiers à observer la basse prévalence de maladies cardiovasculaires chez les Inuits du Grand Nord canadien malgré l’apport élevé en gras provenant des produits de la mer[58]. Par la suite, en 1976, des chercheurs danois ont mis en évidence les hautes concentrations en n-3 présentes dans leur sang d’Inuits du Groenland en plus de discuter des effets bénéfiques des acides gras polyinsaturés sur la santé cardiovasculaire[59]. Depuis, plusieurs essais contrôlés randomisés ont confirmé l’effet protecteur des n-3 entre autres sur la réduction des taux circulants de triacylglycérol[60–62]. Pour leur part, les n-3 auraient un effet mitigé ou nul chez l’Humain sur les taux sanguins de lipoprotéines à haute densité et sur la pression artérielle[63]. Dans le cas de l’homéostasie glucidique, des études chez l’animal démontrent clairement les effets positifs des n-3. Ces acides gras sont connus pour être des agonistes et des activateurs du récepteur gamma activé par les proliférateurs de peroxysomes nucléaires (PPARγ; de l’anglais peroxisome proliferator-activated
receptor gamma). Ce récepteur s'exprime principalement dans les adipocytes où son
activation favorise l'expression de gènes impliqués dans le métabolisme du glucose, améliorant ainsi la tolérance au glucose[64,65]. Chez l’Humain, les bienfaits des n-3 sur la sensibilité au glucose restent incertains et nécessitent davantage de recherche[63]. Il n’en reste pas moins que les effets anti-inflammatoires connus des n-3 pourraient moduler la low-grade inflammation induite par l’obésité, et donc indirectement contribuer à l’amélioration de certains paramètres métaboliques.
1.3.6. Effets bénéfiques des n-3 sur les comportements anxieux et dépressifs
Une des premières études à adresser l’impact des n-3 sur les comportements anxieux remonte à 1995. L’équipe de Francès et coll. a soumis des femelles gestantes de même que leurs progénitures mâles et femelles à une diète déficiente ou adéquate en ALA. Ils n’ont dénoté, tout comme Belzung et coll., aucune différence significative des comportements anxiogènes ni dans l’EPM ni dans le test du light/dark box (LDB)[66,67]. Ce test mesure les comportements de type anxieux en utilisant l’aversion naturelle des souris pour les espaces ouverts (Figure 5). Il consiste à exposer une souris à une boîte divisée en deux compartiments : l'un est éclairé et ouvert, l’autre est fermé et sombre. Les deux compartiments communiquent entre eux par une petite ouverture. Plus un animal est anxieux, plus il tentera d’éviter le compartiment clair pour se réfugier dans le compartiment sombre[68].
Figure 5. Représentation d’un light/dark box (LDB)[69]
Plus tard, en 2000, Carrié et coll. ont soumis des femelles gestantes à une diète déficiente ou adéquate en ALA. Les souris de la deuxième génération ont été nourries après sevrage avec la même diète que leur mère. À l’âge de 7 semaines, les souris nourries à la diète déficiente en ALA ont été soumises à une diète enrichie en n-3 provenant de jaune d’œuf ou de phospholipides de cerveaux de porc, ces deux dernières étant riches en DHA. Cette équipe a découvert un important effet anxiolytique des diètes supplémentées en n-3 dans l’EPM et l’OFT comparativement au groupe nourri de la diète déficiente en ALA[70]. Toutefois, il est important de dénoter l’importante réduction de concentration cérébrale en n-3 observée chez les souris déficientes, ce qui pourrait expliquer les effets comportementaux bénéfiques observés. Dans les années qui ont suivi, plusieurs autres équipes de recherche utilisant des approches variées ont démontré les effets bénéfiques des n-3 sur l’anxiété chez le rongeur[71,72].
Parallèlement, d’autres chercheurs ont étudié l’impact des n-3 sur les comportements de type dépressifs chez le rongeur. Comme mentionné précédemment, le test de la
nage forcée (FST) est l’expérience la plus fréquemment utilisée en recherche pour étudier les comportements de type dépressif chez le rongeur. En 2008, Venna et coll., à l’aide de ce même test, ont remarqué une réduction significative de l’immobilité des animaux suivant une diète enrichie en n-3 durant six semaines. Cette équipe a obtenu un résultat semblable en administrant une dose journalière très élevée (2,5 g/kg) d’n-3 aux animaux pour six semaines[73]. Certains auteurs ont argumenté que cet effet serait majoritairement dû à l’effet du DHA et non de l’EPA. Par ailleurs, Huang et coll. ont démontré une diminution de l’immobilité dans le FST suite à une diète fort différente en termes d’acides gras n-3, soit 36,80% pour la diète expérimentale contre 0,39% pour la diète contrôle, durant six semaines. Par contre, ils ont également observé que cette diminution corrèle inversement avec une augmentation du DHA cérébral, mais pas de l’EPA[74]. Ces résultats sont appuyés par ceux rapportés précédemment par Shaldubina et coll., en 2002, qui ont démontré l’inefficacité d’un traitement aigu d’EPA injecté à diverses concentrations à diminuer le temps d’immobilité dans le FST. Néanmoins, plusieurs autres études publiées subséquemment ont démontré non seulement l’efficacité des n-3 à améliorer les comportements de type dépressif chez le rongeur, mais aussi à potentialiser les effets des antidépresseurs classiques tels que la fluoxétine[75,76]. Il est toutefois important de mentionner que, bien qu’il soit très présent dans la littérature, le FST reste très critiqué par plusieurs auteurs[77,78]. Ceux-ci argumentent que l’immobilité des animaux, classiquement interprétée comme un comportement de désespoir, serait en fait une stratégie adaptative à une situation stressante.
La plupart des recherches cliniques interventionnelles sur les n-3 et les troubles de l'humeur sont relativement nouvelles et portent principalement sur la dépression. L'anxiété est souvent un résultat secondaire de ces recherches et à ce sujet, les études démontrent des résultats controversés dépendamment des populations étudiées. En effet, plusieurs recherches ont documenté l’inefficacité d’un traitement aux n-3 sur l’anxiété chez les personnes âgées[79], les enfants et les adolescents souffrant de troubles du comportement alimentaire[80] ainsi que chez les femmes ménopausées[81]. Ces trois études ont d’ailleurs utilisé une dose d’EPA et de DHA se
DHA par jour[40], qui s’avère être peu élevée comparativement à celles utilisées dans plusieurs études animales. D'un autre côté, des équipes de recherche ont démontré leur efficacité sur l’anxiété secondaire au syndrome prémenstruel[82], chez les alcooliques abstinents[83], chez les personnes souffrant de toxicomanie[84], de même que chez les étudiants en médecine n’ayant pas d’antécédents d’anxiété[85]. Ces deux dernières études ont toutefois utilisé des doses très élevées d’EPA et de DHA, soit environ cinq fois la recommandation canadienne journalière.
Pour ce qui est de la dépression, une méta-analyse d’essais randomisés contrôlés a été publiée en 2014 analysant l'efficacité d’un traitement aux n-3 chez les personnes souffrant de troubles dépressifs majeurs (MDD; de l’anglais major depressive disorder) et souffrant de symptômes dépressifs sans diagnostic de MDD[86]. Ils ont montré qu’une supplémentation en n-3 est efficace pour réduire les symptômes dépressifs chez les personnes diagnostiquées MDD et chez celles souffrant de symptômes dépressifs, mais non diagnostiqués. Elle est aussi efficace pour traiter les comportements dépressifs chez les personnes souffrant de bipolarité. À l’inverse, une supplémentation en n-3 est inefficace pour traiter les symptômes dépressifs chez les femmes enceintes, les gens ayant des maladies cardiovasculaires, les gens souffrant de schizophrénie, d’Alzheimer et autres troubles cognitifs de même que chez les femmes souffrant de dépression post-partum. Fait intéressant, ils ont démontré que la supplémentation en n-3 est inefficace pour prévenir l’apparition de symptômes dépressifs chez les individus sains. Contrairement à ce qui a été observé chez les animaux, cette équipe a découvert que l’efficacité des n-3 dans le traitement de la dépression chez l’Humain repose davantage sur l’EPA que sur le DHA.
Les résultats de toutes ces études antérieures démontrent que ce sujet est encore mal compris et que davantage de recherches standardisées sont nécessaires. En effet, il est difficile de comparer les résultats des études, autant chez l’animal que chez l’Humain, puisque ceux-ci peuvent être grandement influencés par de multiples variables confondantes. On pense, entre autres, au manque de rigueur dans les méthodes d’évaluation nutritionnelle[87], de l’hétérogénéité des outils d’évaluation des symptômes anxio-dépressifs[88] ainsi que de la durée, dose et types d’acides gras administrés[89]. Ces deux derniers points sont d’ailleurs des raisons qui ont motivé
notre équipe à développer le protocole de recherche de l’article 1, en utilisant des doses d’EPA et de DHA chez la souris qui sont proportionnelles à ce qui est utilisé chez l’Humain.
1.3.7. Composition lipidique du cerveau
Le rôle essentiel des PUFA au niveau du cerveau a été largement étudié dans les dernières décennies. L’étude de la composition lipidique du cerveau remonte aux années 60[90]. Durant les années qui ont suivi, plusieurs équipes ont étudié l’effet d’une déficience en ALA et comment celle-ci altère drastiquement non seulement la composition en acides gras, mais aussi les fonctions du cerveau[91,92]. Nous savons aujourd’hui que le système nerveux possède la plus grande concentration de lipides après le tissu adipeux. D’ailleurs, dans le cerveau, un tiers des acides gras sont polyinsaturés[93]. Plus spécifiquement, les membranes des cellules nerveuses sont majoritairement formées de deux acides gras polyinsaturés : un n-6, l’acide arachidonique et un n-3, le DHA[94]. Le DHA est l’acide gras le plus prédominant dans le cerveau [48,95]. Les autres n-3 sont très peu présents dans le cerveau. Par exemple, l’EPA y est présent à une concentration environ 275 fois inférieure au DHA[96]. Une des hypothèses principales qui expliquerait cette faible concentration porterait sur la β-oxydation rapide de l’EPA comparativement au DHA, présent davantage dans les membranes cellulaires[97]. La synthèse endogène d'EPA et de DHA au niveau du cerveau serait relativement faible[97]. Leurs concentrations cérébrales sont grandement influencées par la teneur de la diète en ces mêmes acides gras ainsi que par la synthèse endogène provenant du foie à partir de l’ALA[98]. Toutefois, le taux de DHA cérébral semble plus difficile à moduler par la diète qu'au sein d’autres organes [90,93,99]. L’EPA, pour sa part, est plus sensible que le DHA aux fluctuations d’apports alimentaires en acides gras[100]. L’hypothèse derrière cette préservation des niveaux de DHA est qu’il s’agit d’un acide gras essentiel à la structure et aux fonctions cérébrales, c’est pourquoi des mécanismes encore inconnus seraient mis en œuvre afin d’y maintenir une concentration stable[99]. La composition lipidique de certains organes peut être associée à certaines psychopathologies. C’est le cas entre autres
de la dépression. Une relation inverse existe entre le risque de souffrir de dépression et les niveaux d’n-3 présents dans les globules rouges[101,102]. Ces derniers constituent un biomarqueur fréquemment utilisé dans les études cliniques pour déterminer l’apport alimentaire à court terme en n-3[103]. Pour ce qui est de la composition lipidique du cerveau reliée à la dépression, les études cliniques ont démontré, jusqu'à présent, des résultats négatifs[104–106]. Considérant les effets bénéfiques des n-3 sur ce type de pathologie, plus de recherches sont donc nécessaires pour mieux comprendre la mécanistique derrière cette observation.
1.4.
GPR120
1.4.1. Classification et structure
Les G-protein coupled receptor (GPCR) sont des récepteurs transmembranaires qui participent à des mécanismes de signalisation intracellulaires impliqués dans une multitude de fonctions à travers l’organisme. D’ailleurs, ceux-ci font partie d’une famille importante de récepteurs comptant environ 850 différents GPCR dans le corps humain[107] et constituent la cible de près de 50% des médicaments sur le marché[108]. Par définition, ces récepteurs possèdent un domaine N-terminal extracellulaire, sept hélices alpha qui traversent la membrane[109], que l’on appelle également domaine transmembranaire, ainsi qu’un domaine C-terminal intracellulaire[110]. Les GPCR peuvent être activés par de multiples ligands qui incluent les acides gras à chaînes courtes, moyennes et longues, les neurotransmetteurs, les hormones de même que les ondes lumineuses[107]. Les GPCR sont généralement classifiés selon leur séquence d’acides aminés ainsi que par leurs similarités fonctionnelles. La classe A inclut les récepteurs de type rhodopsine. Elle est considérée comme la plus grande famille de GPCR, puisqu’elle regroupe les récepteurs aux hormones, aux neurotransmetteurs et à la lumière. Les autres classes se détaillent comme suit :
• La classe B ou famille de récepteurs de la sécrétine
• La classe D ou famille de récepteurs de phéromones de reproduction fongique • La classe E ou famille de récepteurs de l’adénosine monophosphate cyclique • La classe F ou famille de récepteurs frizzled/smoothed[111].
GPR120 (G-protein coupled receptor 120) ou FFA4 (Free-fatty acid receptor-4) est un GPCR de type rhodopsine qui a été décrit pour la première fois en 2003[109] (Figure 6).
Figure 6. Diagramme de type snake-plot (d’après Moniri, 2016)[112]. Légende : A : Alanine, C: Cystéine, D: Acide aspartique, E: Acide glutamique, F: Phénylalanine, G: Glycine, H: Histidine, I: Isoleucine, K: Lysine, L: Leucine, M: Méthionine, N : Asparagine, P : Proline, Q : Glutamine, R: Arginine, S: Sérine, T: Thréonine, V: Valine, W: Tryptophane, Y: Tyrosine
Ce récepteur est entre autres exprimé dans les membranes cellulaires de l’intestin, des poumons de même qu’au sein d’adipocytes et de macrophages [113–115]. GPR120 est activé par une large gamme d’acides gras saturés et insaturés à chaînes longues[116], avec une affinité plus prononcée pour les acides gras n-3[117].
1.4.2. Rôles métaboliques et anti-inflammatoires
Les rôles attribués à GPR120 sont multiples, considérant son modèle d’expression dans divers organes à travers l’organisme[118]. Néanmoins, ceux-ci tournent majoritairement autour de deux grands thèmes : son implication dans les fonctions métaboliques et dans les fonctions anti-inflammatoires.
D’abord, Hirasawa et coll., en 2005, ont été l’une des premières équipes de recherche à identifier l’implication de ce récepteur dans l’homéostasie de l’insuline et du glucose. En effet, ils ont démontré qu’une stimulation de GPR120 chez la souris par des acides gras à longues chaînes induisait une augmentation de la sécrétion de GLP-1 (glucagon-like peptide-1) dans l’intestin. Cette équipe a montré que cette activation, autant in vitro qu’in vivo, induit une augmentation de l’insuline circulante[119]. Plus tard, en 2012, l’équipe du Dr Philippe Forguel a confirmé le rôle joué par GPR120 dans la balance énergétique. Ils ont démontré qu’un variant dysfonctionnel du gène de GPR120 augmente les risques de souffrir d’obésité, et ce, autant chez la souris que chez l’Homme[120]. Ensuite, en 2014, l’équipe de Dr Jerrold M. Olefsky rapporte qu’un agoniste spécifique de GPR120, le compound A (cpdA), diminue l’inflammation de manière dépendante à GPR120. En effet, ces chercheurs ont généré des souris
knock-out (KO) de GPR120 spécifiquement dans les macrophages. Ils ont nourri ces souris
avec une diète riche en gras enrichie de cpdA. Ils ont démontré que GPR120 est essentiel à la réduction de l’inflammation, puisque le cpdA perd ses effets bénéfiques chez la souris GPR120 KO. Ils ont aussi montré les effets protecteurs de l’agoniste sur la sensibilité à l’insuline et la tolérance au glucose chez les souris obèses, effet qui est complètement perdu avec l’invalidation du gène de GPR120. Ils rapportent également les bénéfices de cet agoniste sur la potentialisation de l’insuline dans le foie en diminuant la stéatose hépatique chez les souris obèses[121]. Néanmoins, les résultats
démontrant les effets anti-inflammatoires et d’augmentation de la sensibilité à l’insuline de ce récepteur restent controversés. En effet, un article publié en 2016 par une équipe danoise argumente que ces effets bénéfiques sont indépendants de GPR120[122]. Ces contradictions démontrent que plus de recherches sont nécessaires pour élucider l’implication de ce récepteur au niveau métabolique et anti-inflammatoire.
Au niveau cérébral plus spécifiquement, les connaissances au sujet du rôle de GPR120 restent limitées. Une équipe brésilienne a démontré en 2012 qu’une injection intracérébroventriculaire (ICV) d’n-3 réduit l’inflammation cérébrale induite par une diète haute en gras. Ils ont également montré l’expression de GPR120 dans le noyau arqué de l’hypothalamus et plus précisément dans les neurones orexigènes AgRP/NPY[123]. Par la suite, une autre équipe a démontré qu’une injection ICV d’un agoniste non spécifique de GPR120 réduirait les comportements de type anxieux chez la souris[124]. Il n’en reste pas moins que l’implication de GPR120 dans la réduction de l’inflammation cérébrale et des comportements anxio-dépressifs sous-jacents reste méconnue et nécessite plus de recherche. Ce dernier point, combiné aux contradictions actuellement présentes au sujet du rôle métabolique et anti-inflammatoire de GPR120, ont grandement motivé l’initiation du projet présenté dans l’article 2 de ce mémoire.
1.4.3. Mécanisme anti-inflammatoire
En fonction du type cellulaire où GPR120 est exprimé, celui-ci utilisera un mécanisme de signalisation cellulaire différent. Lorsque ce récepteur est impliqué dans la fonction inflammatoire et exprimé à la membrane des cellules immunitaires comme les macrophages, GPR120 implique la signalisation de β-arrestin-2. Comme il est démontré à la figure 7, lorsqu’un ligand extracellulaire comme les n-3 se lie au récepteur, celui-ci sera phosphorylé par des kinases qui augmenteront l’affinité de son domaine intracellulaire qui séquestrera la protéine β-arrestin-2. Cette liaison entraînera l’internalisation du complexe GPR120-β-arrestin-2 vers le cytoplasme. Ce complexe interagira avec la protéine TAB1 (Transforming growth factor-β activated kinase
1-binding protein) qui empêchera sa liaison avec TAK1 (Transforming growth factor-β activated kinase 1)[118]. La cascade pro-inflammatoire qui s’ensuit l’activation de TAK1
est possible entre autres via l’activation de deux récepteurs membranaires distincts. Premièrement, TNRF (tumor necrosis factor receptor) peut être activé par TNF-α circulant. Deuxièmement, le lipopolysaccharide (LPS), la composante active des endotoxines produites par les bactéries Gram négatives[125], ou encore les acides gras saturés [126] peuvent activer le récepteur TLR4 (Toll-like receptor 4 )[115]. La liaison de TAB1 et TAK1 engendre une cascade de signalisation pro-inflammatoire qui implique entre autres l’activation de JNK (c-Jun N-terminal kinase), IKK (IκB kinase) et NFκB. En bloquant l’interaction de TAB1 et TAK1, GPR120 court-circuite l’effet de l’activation des récepteurs TNRF et TLR4, et empêche donc l’expression et la sécrétion de cytokines pro-inflammatoires telles IL-6, IL-1β et TNF-α[118].
Figure 7. Schéma du mécanisme anti-inflammatoire de GPR120 dans un macrophage (adapté de Oh et coll., 2010[115] et Zhang, 2014[110]). Les flèches rouges représentent l’effet anti-inflammatoire médié par les n-3 et les
flèches noires représentent l’effet pro-inflammatoire médié par l’activation des récepteurs TNFR ou TLR4.
1.5.
Hypothèses et objectifs de recherche
1.5.1. Hypothèses
Nous formulons l’hypothèse qu’une supplémentation chronique en n-3 en contexte pro-inflammatoire induit par l’obésité améliore les comportements anxio-dépressifs, la sensibilité au glucose, la composition lipidique cérébrale ainsi la neuroinflammation. Nous émettons également l’hypothèse que l’activation microgliale de GPR120 diminue la neuroinflammation in vitro de même que les comportements anxio-dépressifs associés in vivo.
1.5.2. Objectifs
- Mesurer les impacts d’une supplémentation chronique en n-3 en contexte d’obésité induite par la diète sur les paramètres métaboliques, incluant entre autres la composition corporelle, la sensibilité au glucose et la dépense énergétique, les comportements anxio-dépressifs, la composition lipidique du cerveau et la neuroinflammation.
- Décrire les effets de l’activation microgliale in vitro de GPR120 en contexte pro-inflammatoire de même que ses répercussions comportementales et inflammatoires in vivo.
1.6.
Contribution aux articles
Les deux manuscrits présentés dans ce mémoire sont des versions préliminaires non publiées au moment du dépôt de ce mémoire. Pour l’article 1, j’ai effectué en majorité les mesures et analyses métaboliques, comportementales de même que les mesures d’expression génique. J’ai collaboré sur cet article avec la plateforme de phénotypage métabolique et physiologie biocellulaire du CRCHUM pour les mesures de sécrétion protéique et avec l’équipe de Christine DesRosiers à l’Institut de cardiologie de Montréal pour les analyses de composition lipidique cérébrale. Pour l’article 2, j’ai effectué toutes les mesures d’expression génique, de sécrétion protéique en plus des tests de comportement. J’ai finalement majoritairement contribué à la rédaction de ces deux manuscrits.
Chapitre 2: Article 1 (non publié)
Omega-3 fatty acid supplementation defends against metabolic, anxiogenic and neurolipid consequences of a saturated high-fat diet
Geneviève Demers1,3, Arturo Israel Machuca Parra1,2, Diane Bairaman1,3, Zahra Dashtehei Pour1,3, Caroline Daneault5, Christine Des Rosiers3,5, Thierry Alquier1,4* and Stephanie Fulton1,3*
1Montreal Diabetes Research Center and Centre de Recherche du CHUM. Departments of: 2 Neuroscience, 3 Nutrition, 4 Medicine - Université de Montréal. 5Montreal Heart Institute. *Equal contribution
Corresponding author: Stephanie Fulton, PhD
Centre de Recherche du CHUM 900 rue Saint-Denis, 8-428 Montréal, QC H2X 0A9 Canada
Acknowledgments
This work was supported by grants from the Natural Sciences and Engineering Research Council of Canada to SF and from Merck Sharp Dohme Corp to SF, TA and CD. GD was supported by a FRQS graduate fellowship, and SF and TA are supported by FRQS salary awards.
Conflict of interest
Abstract
Background: Dietary omega-3 polyunsaturated fatty acids (n-3) improve obesity-associated insulin resistance and chronic inflammation and are effective in alleviating neuroimmune activation and depressive-like symptomology. Obesity significantly elevates the odds of developing depression whereas in mice chronic consumption of a diet rich in saturated fat elicits anxiety and despair in a manner linked to metabolic dysfunction and neuroinflammation.
Hypothesis: N-3 supplementation improves energy homeostasis, anxiodepressive behavior and neurolipid composition altered by diet-induced obesity.
Objectives: To measure the effects of a chronic n-3 supplementation in a context of obesity on metabolic, behavioral and inflammatory parameters as well as neurolipid composition.
Methods: Male C57Bl/6J mice were fed a saturated high-fat diet (HFD) or chow for 20 weeks. During the last 5 weeks mice received daily supplementation (gavage) of fish oil or corn oil. Food intake and body weight were measured throughout while additional metabolic parameters and anxiodepressive behaviors (elevated-plus maze, light-dark box and forced swim test) were evaluated during the final week of supplementation. Forebrain lipid composition and markers of reactive gliosis were assessed by gas chromatography mass spectrometry and real-time PCR, respectively. Data were analyzed by two-way ANOVA and Tukey pairwise post-tests, p<0.05.
Results: Five weeks of n-3 supplementation completely normalized glucose intolerance in HFD mice without affecting body weight or fat mass. N-3 supplementation also defended against anxiety- and despair-like behavioral responses to HFD. Brain lipids, particularly polyunsaturated fatty acids, were altered by HFD and largely reversed by n-3 supplementation whereas markers of microglial activity were diminished by n-3 supplementation.
Conclusions: Fish oil supplementation following obesity onset and during consumption of a saturated high-fat diet corrects glucose homeostasis, inhibits anxiodepressive behaviors, restores neurolipid composition and decreases indices of
supplementation for the improvement of peripheral and central metabolic disturbances associated with poor dietary lifestyle and obesity.
Keywords Diet-induced obesity; Omega-3 fatty acids; Glucose tolerance; Anxiety; Brain lipidomic.
Introduction
Obesity is a multifactorial health problem that confers a major economic burden. While often associated with heightened risk for cardiovascular and metabolic diseases1–4, obesity also significantly increases the incidence of mood disorders5–7. Anxiety and depressive disorders impair quality of life, motivation and occupational functioning, and these consequences diminish treatment adherence to further enhance metabolic dysfunction and associated complications8. As metabolic and mood deficits exacerbate the threat of obesity there is an imminent need to identify suitable therapeutic interventions.
Obesity is often characterized by a state of low-grade inflammation. Several lines of evidence suggest that enhanced immune activation, especially that concurrent with visceral obesity, contributes to metabolic and mood impairments, including insulin resistance and anxiodepressive behaviors, respectively. Excess consumption of saturated fats, in particular, is known to aggravate metabolic dysfunction in obesity, in part by generating physiological responses that favour deposition of pro-inflammatory visceral adipose tissue9–11. We recently reported that saturated (but not monounsaturated) high-fat feeding in mice that promotes visceral obesity, peripheral inflammation and glucose intolerance triggers anxiodepressive behavior via NFκB-mediated neuroinflammatory processes in the nucleus accumbens (NAc), a brain region linked to the hedonic and motivation deficits associated with depression. These findings along with clinical and epidemiological data linking poor diet quality (including excess saturated fat), metabolic dysfunction and depressive symptomology10–13 and the protective effects of a Mediterranean diet14 strongly suggest that the type and amount of dietary lipids contribute to the development of anxiodepressive disorders. Consumption of omega-3 fatty acids (n-3), such as eicosapentaenoic (EPA) and docosahexaenoic acids (DHA), has been shown to reduce cerebral inflammation coincident with obesity15. In addition, n-3 dietary deficiency and lower brain n-3 concentrations are reported to potentiate anxiety- and depressive-like behaviors in
depressive symptoms in people suffering from bipolar and major depressive disorders19. Despite these findings, the impact of n-3 supplementation in the context of obesity and ongoing consumption of a diet high in saturated fat on metabolic and emotional endpoints has not been fully explored.
The present study aimed to determine the effects of a chronic n-3 supplementation in mice following the onset of obesity and during a saturated high-fat diet on metabolic, behavioral, anti-inflammatory neurolipids and brain gliosis markers.
Methods
Animals
All experimental procedures were approved by the Institutional Animal Care Committee of the CRCHUM in accordance with the standards of the Canadian Council on Animal Care. Seven to eight-week-old male C57BL/6J mice were obtained from Jackson Laboratories (Bar Harbor, Maine, USA). Upon arrival, mice were individually housed and maintained in an environmentally controlled room (22–24ºC) with ad libitum access to standard chow and water. Mice were acclimatized to a reverse light/dark cycle for at least seven days prior to initiation of experiments. Mice were decapitated under isoflurane anesthesia. Brains and blood samples were harvested and stored at -80oC.
Diets and Fish Oil Supplementation
Mice (n=12/group) received ad libitum access to either a saturated high-fat diet (HFD) containing 50% kcal palm oil or an ingredient-matched, control chow diet containing 16.8% kcal soybean oil for 20 weeks (Supplemental Fig. 1A). During the last 5 weeks (from the 16th to the 20th week) of the diet protocol, mice from the HFD and chow groups received daily gavage of fish oil (FO; Omega Protein; Houston, TX, USA) or control corn oil (Ctrl; Sigma–Aldrich; St. Louis, MO, USA) (Table 1) defining four experimental groups: high-fat diet + control (HFDCtrl); high-fat diet + fish oil (HFDFO); chow diet + control (chowCtrl); chow diet + fish oil (chowFO). Fish oil supplementation (0.7 mg/kg body weight) was based on the American Dietetic Association and Dietitians of Canada recommendations for humans of 500 mg of combined DHA and EPA per day20 and subsequently dose-converted for mice according to published standards21. Diets and supplementation continued throughout metabolic and behavioral testing.
Metabolic Profiling
Body weight and food intake were measured weekly whereas additional metabolic measurements were performed during the 19th and 20th week of diet. For glucose tolerance tests (GTT), mice were fasted for four hours prior to intraperitoneal (IP) injection of glucose (2 g/kg of body weight). Blood glucose was measured at 0, 15, 30, 60 and 120 minutes post-injection. Lean and fat mass were measured using nuclear Echo MRI (Echo Medical Systems; Houston, Texas). Energy expenditure (normalized to lean mass), respiratory exchange ratio (RER: VCO2/VO2) and ambulatory activity were assessed for 24 hours after a 24-hour habituation period in the Comprehensive Lab Animal Monitoring System (CLAMS; Colombus Instruments) set at 22°C.
Behavioral Experiments
All behavioral tests were video recorded and analyzed using Ethovision XT software system (Noldus). Behavioral testing was carried out during the 19th week of diet. All testing was performed in the light just before dark cycle onset.
Elevated-Plus Maze
The elevated-plus maze (EPM) was used to assess anxiety-like behavior as previously reported22. In brief, each mouse was placed in the center of the maze facing an open arm opposing the experimenter. Number of open arm entries, percentage of open arm time and distance travelled were measured over a period of five minutes.
Light/Dark Box
The light/dark box (LDB) was used as an additional measure of anxiety-like behavior. The mouse LDB apparatus (Med Associates, Inc.) consists of an illuminated compartment next to a dark compartment covered by a lid (both 13.7 cm X 13.7 cm X 20.3 cm). The two boxes were separated by a partition wall with an opening at the
![Figure 2. Représentation d’un labyrinthe en croix surélevé standard (EPM; de l’anglais elevated-plus maze)(d’après Sweis et coll.[29])](https://thumb-eu.123doks.com/thumbv2/123doknet/2040315.4694/20.918.293.624.116.414/figure-representation-labyrinthe-sureleve-standard-anglais-elevated-sweis.webp)

![Figure 5. Représentation d’un light/dark box (LDB)[69]](https://thumb-eu.123doks.com/thumbv2/123doknet/2040315.4694/27.918.247.675.137.480/figure-representation-d-un-light-dark-box-ldb.webp)
![Figure 6. Diagramme de type snake-plot (d’après Moniri, 2016)[112]. Légende : A : Alanine, C: Cystéine, D: Acide aspartique, E: Acide glutamique, F: Phénylalanine, G: Glycine, H: Histidine, I: Isoleucine, K: Lysine, L: Leucine, M: Méthionine, N : Asparagine, P : Proline, Q : Glutamine, R: Arginine, S: Sérine, T: Thréonine, V: Valine, W: Tryptophane, Y: Tyrosine](https://thumb-eu.123doks.com/thumbv2/123doknet/2040315.4694/32.918.145.767.398.839/diagramme-phenylalanine-isoleucine-methionine-asparagine-glutamine-threonine-tryptophane.webp)
![Figure 7. Schéma du mécanisme anti-inflammatoire de GPR120 dans un macrophage (adapté de Oh et coll., 2010[115] et Zhang, 2014[110])](https://thumb-eu.123doks.com/thumbv2/123doknet/2040315.4694/36.918.82.831.131.575/figure-schema-mecanisme-anti-inflammatoire-macrophage-adapte-zhang.webp)