© Géraldine Ong, 2019
Les facteurs associés à l’atteinte des cibles
lipidiques chez les patients ayant souffert d’un
infarctus du myocarde
récent à l’Institut universitaire de
cardiologie et de pneumologie de Québec
Mémoire
Géraldine Ong
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Les facteurs associés à l’atteinte des cibles lipidiques
chez les patients ayant souffert d’un infarctus du
myocarde récent à l’Institut universitaire de cardiologie
et de pneumologie de Québec
Mémoire
Géraldine Ong
Sous la direction de :
iii
Résumé du mémoire
Ce travail tentera de démontrer l’importance de la prise en charge de la dyslipidémie des patients souffrant de maladie coronarienne athérosclérotique. Nous examinerons tout d’abord la physiopathologie cardiovasculaire dans le contexte de la présence d’une dyslipidémie, puis détaillerons le plan de traitement tel que recommandé par la Société canadienne de cardiologie. Nous présenterons une revue de la littérature sur le traitement de la dyslipidémie en prévention secondaire et soulèverons les bénéfices ainsi que les obstacles potentiels à un tel traitement. Ceci permettra au clinicien d’avoir une approche globale et favoriser la prise en charge du risque attribuable à la dyslipidémie chez les patients souffrant de maladie coronarienne athérosclérotique.
iv
Abstract
This work will attempt to demonstrate the importance of the management of dyslipidemia in patients with atherosclerotic coronary artery disease. We will first review the cardiovascular pathophysiology of dyslipidemia and then detail its management plan, as recommended by the Canadian Cardiovascular Society. We will review the literature regarding the treatment of dyslipidemia in secondary prevention and will raise the benefits and potential barriers to an optimal management. This will allow the clinician to have a holistic approach and promote the management of risk attributable to dyslipidemia in patients with atherosclerotic coronary artery disease.
v
Tables des matières
Résumé du mémoire ... iii
Abstract ... iv
Tables des matières ... v
Liste des tables ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Remerciements ... x
Avant-propos ... xi
1. Introduction ... 1
1.1. Les facteurs de risque de la maladie coronarienne ... 1
1.2. Le rôle de l’inflammation dans la maladie coronarienne ... 3
1.3. La dyslipidémie est un facteur de risque important de la maladie coronarienne ... 5
1.4. Traitement de la maladie cardiovasculaire ... 7
1.5. L’absorption, la synthèse, le transport et l’excrétion du cholestérol ... 9
1.5.1. La voie des lipides exogènes ... 9
1.5.2. La voie des lipides endogènes ... 10
1.6. Les approches hypolipémiantes non-pharmacologiques ... 10
1.6.1. L’approche nutritionnelle ... 10
1.6.2. L’exercice physique ... 11
1.7. Les traitements pharmacologiques ... 12
1.7.1. Les statines ... 12
1.7.1.1. Les effets pléïotropiques des statines dans le traitement du syndrome coronarien aigu ... 14
1.7.1.2. Statine et effet anti thrombotique ... 15
1.7.1.3. Statine et inflammation ... 15
1.7.1.4. Les effets des statines sur la stabilisation et la régression de la plaque ... 17
1.7.1.5. Les études cliniques supportant l’utilisation des statines en période post-infarctus ... 19
1.7.1.6. Initiation précoce de la statine après l’événement coronarien ... 21
1.7.1.7. L’intensité du traitement de statine en prévention secondaire ... 22
1.7.1.8. L’utilisation des statines en prévention primaire ... 26
1.7.2. Les hypolipémiants autres que les statines ... 27
1.8. Guidelines et cibles thérapeutiques ... 29
1.8.1. Les recommandations de la Société canadienne de cardiologie ... 30
vi
1.8.3. Les nouveaux marqueurs d’athérosclérose et prédicteurs d’événements cardiovasculaires 32
1.9. La non-atteinte des cibles recommandées ... 33
1.9.1. La sous-utilisation des statines ... 33
1.9.1.1. Effets secondaires des statines ... 34
1.9.1.2. La dysfonction hépatique ... 34
1.9.1.3. La rhabdomyolyse ... 35
1.9.1.4. D’autres effets néfastes ... 36
1.9.2. La non-observance au traitement ... 37
1.10. Conclusion de l’introduction ... 39
Chapitre 1. Les facteurs associés à la non-atteinte des cibles lipidiques chez des patients
ayant souffert un infarctus du myocarde à Québec, Canada ... 41
Avant-propos ... 41 Résumé ... 43 Abstract ... 44 1. Introduction ... 45 2. Methods ... 45 3. Statistical Analysis ... 46 4. Results ... 47 5. Discussion ... 48 6. Conclusion ... 50
Tables and Figures ... 51
References ... 55
Discussion générale ... 58
Conclusion ... 60
vii
Liste des tables
Table 1. Facteurs de risque de la maladie coronarienne………2 Table 2. Mesures non-pharmacologiques du traitement de la dyslipidémie……... ………...12 Table 3. Tableau synthèse des études randomisées évaluant l’utilisation des statines à
haute dose en prévention secondaire ……….….26
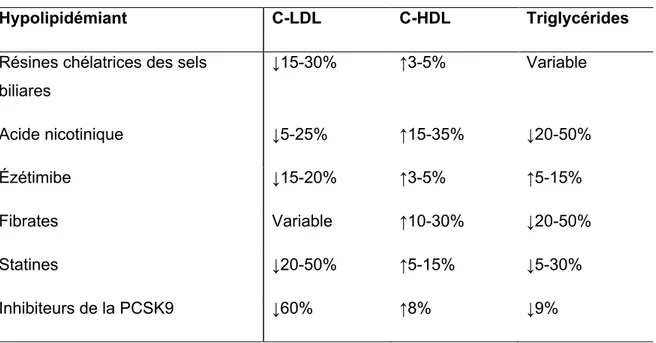
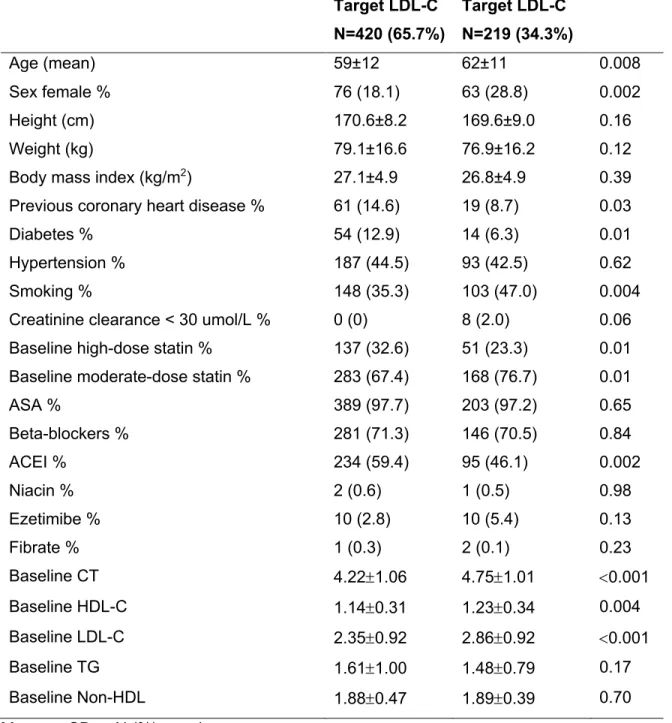
Table 4. Effets des hypolipidémiants sur le bilan lipidique ………...28 Table 5. Nouveaux biomarqueurs prédicteurs d’événements cardiovasculaires…………...32 Table 6. Les causes de la non-observance au traitement ………..…………...39 Table 7. Baseline characteristics of the study groups ………51 Table 8. Lipid profiles of the study population………..52
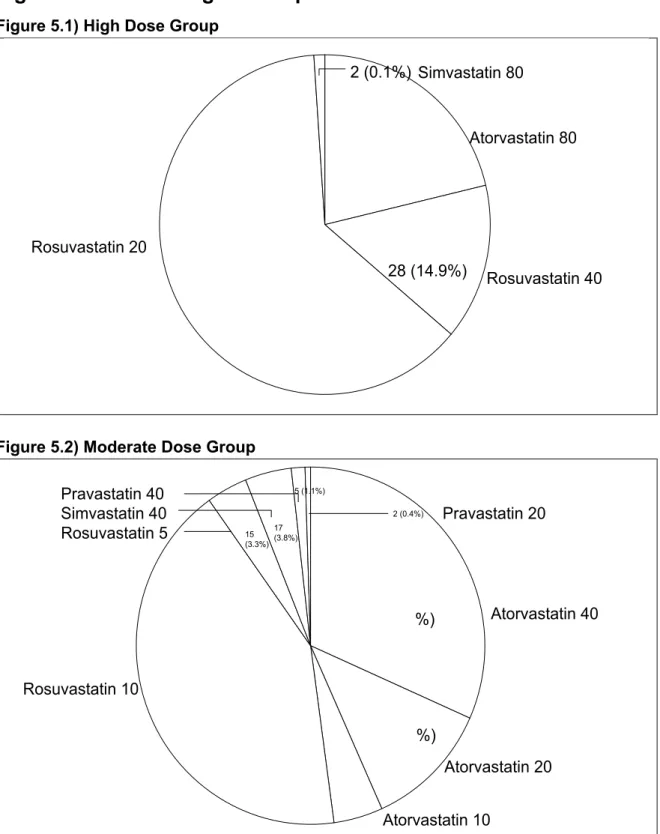
8,1) High dose group, 8,2) Moderate dose group
Table 9. Independent predictors for failure to achieve target LDL-C at one
viii
Liste des figures
Figure 1. La cascade inflammatoire………4
1,1) Formation de la plaque d’athérosclérose dans l’artère coronarienne, 1,2) La dysfonction endothéliale, 1,3) Recrutement des monocytes, libération des cytokines inflammatoires et changements morphologiques des macrophages en cellules spumeuses, 1,4) Formation de la plaque d’athérome Figure 2. Évaluation du risque coronarien : Grille de Framingham……….8
Figure 3. Le mécanisme des statines………...13
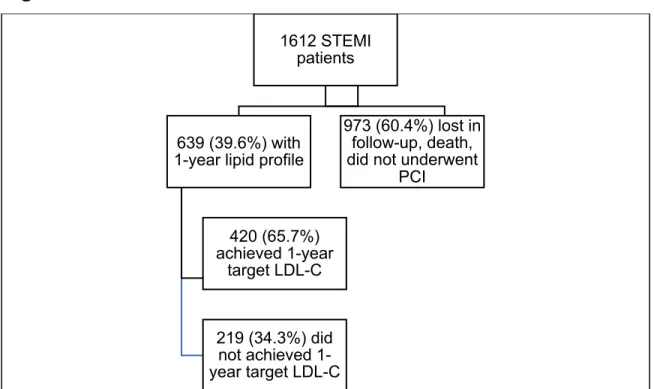
Figure 4. Flow-chart………53
Figure 5. Statin dosage for all patients……….54 5,1) High dose group, 5,2) Moderate dose group
ix
Liste des abréviations
VCAM-1 : vascular cell adhesion molecule-1 MCP-1 : monocyte chemoattractant protein-1 IFN- γ: interféron- γ
M-CSF: macrophage colony-stimulating factor LDL : lipoprotéine de basse densité
HDL : lipoprotéine de haute densité
Proprotéine convertase subtilisin-kexin type 9 : PCSK9 LPL : lipoprotéine lipase
Hydroxyméthylglutaryl-CoA: HMG-CoA VLDL : lipoprotéine à densité très faible IDL : lipoprotéine à densité intermédiaire PCR : protéine C réactive
x
Remerciements
Ce présent mémoire a été un projet à la fois exigeant et enrichissant. Bien que sa rédaction n’ait pas été de tout repos, c’est grâce aux incroyables personnes qui m’ont supportée qu’elle s’est faite de façon positive et motivée. Je tiens à remercier ces personnes qui, grâce à leur soutien et encouragements, m’ont permis à relever ce grand défi et de mener ce mémoire à terme.
Mes premiers remerciements vont au Dr Paul Poirier, qui a tenu le rôle de mentor dès le début de ma résidence en médecine interne pour finalement ajouter le rôle de directeur de recherche. Je ne lui dirai jamais assez à quel point je suis reconnaissante de l’avoir eu comme superviseur. Son authenticité, son enthousiasme infini, ses commentaires constructifs et son support inconditionnel m’a énormément aidé à rester positive et confiante.
Paul, c’est un plaisir de travailler avec toi. Grâce à toi, j’ai été guidée « vers la lumière » à entreprendre une carrière académique en cardiologie. Tu m’as inspiré à devenir une clinicienne-chercheure, mais surtout à développer une curiosité scientifique et un enthousiasme débordant face à la découverte de nouvelles connaissances.
Je remercie également le Dr Jean-Pierre Déry, Madame Mélanie Roy et Monsieur Serge Simard pour leur précieuse aide qui m’a permis de réaliser mon projet de recherche.
Je tiens finalement à remercier mes parents pour m’avoir supportée et encouragée dans tout ce que j’ai entrepris jusqu’à présent dans ma vie.
xi
Avant-propos
La maladie athérosclérotique est une maladie fréquente, et est associée à la survenue d’événements cardiovasculaires tel que l’infarctus du myocarde, l’accident cérébrovasculaire et le décès. Par une meilleure connaissance des mécanismes physiopathologiques sous-jacents, l’identification des facteurs impliqués dans le développement de cette maladie, ainsi que l’utilisation des traitements prouvés efficaces pour réduire le risque d’événements cardiovasculaires, il est possible d’améliorer la qualité de vie et la survie de la population.
1
1. Introduction
1.1.
Les facteurs de risque de la maladie coronarienne
La maladie cardiovasculaire est fréquente dans la population générale, majoritairement chez les adultes âgés de plus de 60 ans(1). Ce diagnostic regroupe la maladie coronarienne qui se manifeste par l’infarctus du myocarde, l’angine, l’insuffisance cardiaque et le décès; la maladie cérébrovasculaire; la maladie vasculaire périphérique; l’anévrysme de l’aorte abdominale et l’athérosclérose aortique. L’organisation mondiale de la Santé observe que, depuis 2013, 17,5 millions de décès sont attribuables aux maladies cardiovasculaires. De plus, >75% des décès liés aux maladies cardiovasculaires surviennent dans des pays à revenu faible ou intermédiaire(2). Au Canada, la maladie cardiovasculaire est responsable de 69 500 décès par année(3). Ceci représente 30% de tous les décès annuels et est la deuxième cause de mortalité au pays après le cancer(3). Les maladies cardiaques et les
accidents cérébrovasculaires coûtent à l’économie canadienne plus de 20 milliards de dollars annuellement et constituent la principale cause d’hospitalisation au pays2. Les
facteurs de risque, dits traditionnels, et associés à la maladie cardiovasculaire sont : 1) l’âge >65 ans(2), 2) l’hypertension artérielle, 3) le diabète, 4) l’obésité, 5) le tabagisme, 6) la sédentarité, 7) l’hérédité et, 8) la dyslipidémie. Neuf canadiens sur 10 affichent au moins 1 de ces facteurs, augmentant ainsi leur risque de développer cette maladie(1). Ces facteurs de risque ont été identifiés dans l’étude « Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries » (INTERHEART)(4). Cette étude a évalué l’association de différents facteurs de risque et la survenue d’infarctus du myocarde dans 52 pays. Cette étude cas-témoins a démontré que la présence de neufs facteurs pouvait prédire jusqu’à 90% le risque de la survenue d’événements coronariens, et ce, chez toutes les populations étudiées. Les neufs facteurs identifiés par cette étude étaient: 1) la dyslipidémie, 2) le tabagisme, 3) l’hypertension artérielle, 4) le diabète, 5) l’obésité abdominale, 6) des facteurs psychosociaux (présence de stress ou de dépression), 7) une faible consommation quotidienne de fruits et légumes, 8) l’alcool et, 9) l’activité physique régulière (Table 1). Ces facteurs étaient significativement associés à la survenue d’infarctus du myocarde dans toutes les régions du monde, autant chez les femmes et les hommes, qu’ils soient jeunes ou plus âgés.
2
Ces facteurs de risque prédisposent donc à la survenue et au développement d’une maladie coronarienne athérosclérotique. Nous verrons dans la prochaine section comment débute la formation de la plaque athérosclérotique.
Table 1. Facteurs de risque de la maladie coronarienne
Facteurs de risque modifiables associés au risque de survenue d’évènements coronariens (Étude
INTERHEART)
Rapport des cotes (intervalle de confiance de 95%)
Rapport apolipoprotéine B/apolipoprotéine A-l 1,47 (1,28-1,68)
Tabagisme ancien (> 12 mois) et actif 2,27 (2,11-2,44)
Obésité abdominale : ratio taille/hanche (dernier percentile
par rapport au premier) 1,36 (1,24-1,48)
Diabète type 2 3,08 (2,77-3,42)
Hypertension artérielle 2,48 (2,30-2,68)
Présence de facteurs psychologiques (perception de vivre du stress à la maison ou au travail, sentiment de perte de contrôle, événements sociaux majeurs)
2,51 (2,15-2,93)
Apport quotidien de fruits et légumes 0,70 (0,64-0,77)
Consommation modérée en alcool (< 3 consommations par
semaine) 0,79 (0,73-0,86)
Activité physique (d’intensité modérée quotidienne et
d’intensité élevée > 4 heures par semaine) 0,72 (0.65-0,79)
3
1.2.
Le rôle de l’inflammation dans la maladie coronarienne
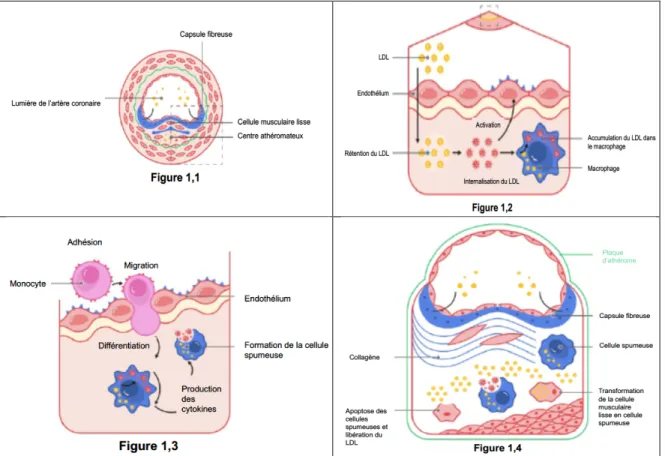
La maladie coronarienne athérosclérotique est une maladie dynamique. Elle est caractérisée par une réaction inflammatoire dynamique et d’un dépôt de lipides et d’éléments fibreux dans les coronaires (Figure 1). L’interaction entre la dyslipidémie et l’inflammation comme étant une étape initiale au développement de l’athérosclérose a été largement étudié depuis les années 1970(5). Plusieurs études ont démontré que la maladie coronarienne athérosclérotique débute par une réaction inflammatoire impliquant une dysfonction endothéliale et la dyslipidémie(6-11). Cette dysfonction endothéliale est caractérisée par un défaut de synthèse, d’activité et/ou de relâche d’oxyde nitrique et entraine une mauvaise régulation des effets protecteurs de l’intégrité intimale(12) (Figure
1,2). Il en résulte une augmentation nette de molécules d’adhésion des leucocytes à la
surface cellulaire, attirant ainsi des monocytes circulants. Ceux-ci se lient à l’endothélium puis migrent dans la paroi de l’intima (Figure 1,3). Une de ces molécules d’adhésion se démarque par son rôle précoce dans l’étape d’adhésion des leucocytes à l’endothélium. Il s’agit de la « vascular cell adhesion molecule-1 (VCAM-1), qui a la propriété particulière de se lier aux monocytes et aux lymphocytes T(5). VCAM-1 est fortement exprimée par les cellules endothéliales où se formera éventuellement une plaque d’athérosclérose. Activés par une multitude de cytokines pro-inflammatoires, les monocytes internalisent des particules de lipoprotéines oxydées et produisent d’autres cytokines inflammatoires, telle que la « monocyte chemoattractant protein-1 » (MCP-1) et l’interféron- γ (IFN- γ)(9,11,13-17). La surexpression de MCP-1 entraine le recrutement des phagocytes mononucléaires et de d’autres leucocytes dans l’intima. L’endothélium active d’autres cytokines pro-inflammatoires dont la IFN- γ et la « macrophage colony-stimulating factor » (M-CSF)(18,19). Les monocytes subissent alors des changements morphologiques. Ces monocytes deviennent alors des macrophages intimaux puis éventuellement se transforme en cellules spumeuses dérivées des macrophages(20,21). Ces cellules spumeuses sont riches en lipides et constituent la majorité de la composition de la strie lipidique, l’élément central de la composition hâtive de la plaque d’athérome dans les coronaires(5) (Figure
4
Ces nombreux travaux illustrent bien les mécanismes par lesquels la réaction inflammatoire participe à la formation de la plaque athérosclérotique. Ce processus clé dans le développement de la plaque d’athérome amplifie l’inflammation locale et favorise la survenue de complications thrombotiques telle que la rupture de la plaque. Ces phénomènes expliquent bien le lien entre le processus inflammatoire lié à l’athérosclérose et le rôle des lipides dans formation de la maladie coronarienne athérosclérotique.
Figure 1. La cascade inflammatoire
1,1) Formation de la plaque d’athérosclérose dans l’artère coronarienne 1,2) Dysfonction endothéliale
1,3) Recrutement des monocytes, libération des cytokines inflammatoires et changements
morphologiques des macrophages en cellules spumeuses
5
1.3.
La dyslipidémie est un facteur de risque important de la
maladie coronarienne
Comme nous venons de le voir, la formation de stries lipidiques est un des éléments centraux de la plaque athérosclérotique. De plus, des taux sériques anormaux de lipoprotéines sont des facteurs de risque substantiels de développer de l’athérosclérose(10). La dyslipidémie joue donc un rôle important dans le développement de la maladie coronarienne.
Le terme « dyslipidémie » est fréquemment utilisé en clinique et fait référence à un large spectre de conditions dont on retrouve une augmentation ou une diminution de la concentration de l’une ou de l’autre des lipoprotéines dans la circulation sanguine. Plus spécifiquement, on retrouve une augmentation de la concentration des particules de lipoprotéines à faible densité (cholestérol-LDL), des taux de particules de lipoprotéines à haute densité (cholestérol-HDL) abaissés et des taux de triglycérides et du cholestérol total élevés. Bien que certaines rares dyslipoprotéinémies peuvent causer des symptômes (angine, xanthomes) et des trouvailles à l’examen physique (lipemia retinalis, xanthélasmas), le diagnostic de la dyslipidémie est fait sur la base de résultats laboratoires.
Les causes des dyslipoprotéinémies sont variées et comprennent l’hypercholestérolémie, l’hypertriglycéridémie ou une association des deux, soit la forme dite mixte. Elles peuvent se diviser en deux grandes classes, selon l’origine, soit primaire ou secondaire. Certaines sont monogéniques, oligéniques, résultent de facteurs environnementaux (sédentarité, alimentation) ou de maladies systémiques (maladies rénales, dysthyroïdies). La plupart d’entre elles sont le résultat d’une interaction entre la composante génétique et la composante secondaire, ce qui explique le caractère très hétérogène de ce regroupement de maladies. La distinction entre la forme primaire et secondaire est importante puisqu’elle permet d’évaluer le risque global encouru par le patient et permet de mieux cibler le traitement. La forme primaire d’hypercholestérolémie peut résulter de maladies génétiques telles que :1) l’hypercholestérolémie familiale homozygote ou hétérozygote, 2) le déficit familial de l’apolipoprotéine B, 3) l’hyperlipémie familiale combinée et, 4) la
6
dysbêtalipoprotéinémie de type III(22). Par exemple, l’hypercholestérolémie familiale homozygote atteint 1 personne par 160 000-300 000 dans la population mondiale(22). Au Québec, la prévalence de l’hypercholestérolémie familiale homozygote est particulièrement élevée, atteignant 1 personne sur 270 et jusqu’à 1 personne sur 80 dans la région de Kamouraska(23). Cette maladie héréditaire est particulièrement importante puisqu’elle augmente de 16 fois le risque d’événements cardiovasculaires sur 10 ans(24). Quant aux dyslipidémies secondaires, il est important d’identifier les causes puisque cela permettra l’instauration de traitements ciblés. Il n’est pas rare cependant qu’un patient ayant une prédisposition génétique à développer une dyslipidémie présente également une cause secondaire. Parmi les causes secondaires les plus communes, on retrouve : 1) le diabète, 2) l’hypothyroïdie, 3) l’insuffisance rénale chronique, 4) la prise d’estrogènes ou de progestatifs, 5) le tabagisme, 6) l’obésité et, 7) la prise d’alcool.
L’avancement des connaissances dans le domaine de l’athérosclérose et de la dyslipidémie s’est traduit par une meilleure prise en charge médicale des patients. Des études observationnelles ont d’ailleurs démontré que le taux de mortalité associé à la maladie cardiovasculaire a diminué au cours des dernières décennies. En effet, le taux de décès par maladie cardiovasculaire a diminué de 3.8% depuis 2000, passant de 941 526 à 807 775 par 100 000 habitants(1,25). Ceci s’explique par une meilleure identification et maîtrise des facteurs de risque, par à l’avancement important des connaissances dans le domaine de la dyslipidémie, et aussi par une meilleure compréhension des mécanismes physiopathologique de l’athérosclérose. L’identification des anomalies lipidiques et la prise en charge du risque attribuable à la dyslipidémie améliore la survie et réduit les complications liées à l’hospitalisation des patients à haut risque et constitue donc un traitement rentable. Par exemple, une étude américaine a démontré que la prise de simvastatine chez des patients non diabétiques et souffrants de maladie coronarienne a permis de sauver entre 8 799 et 21 628 dollars par année de vie sauvée(26). Cette question de rentabilité sera particulièrement intéressante dans les années à venir, avec l’avenue des inhibiteurs de la « proprotéine convertase subtilisin-kexin type 9 » (PCKS9), une nouvelle classe d’hypolipémiants. Bien que les données d’efficacité à long terme ainsi que les études de coûts/bénéfices n’ont pas encore été publiées, il est actuellement estimé qu’un traitement hypolipémiant avec ces nouvelles molécules coûterait jusqu’à 100 fois plus cher qu’un traitement d’atorvastatine(27).
7
Plusieurs groupes dont la Société canadienne de cardiologie ont publié des lignes directrices pour aider les cliniciens à reconnaitre les patients à haut risque de développer une maladie athérosclérotique et de prendre en charge les patients en termes de lipides(1). Une alimentation saine, l’activité physique et le maintien de saines habitudes de vie sont la pierre angulaire de la prévention des maladies cardiovasculaires. Bien que de saines habitudes de vie puissent réduire les taux de cholestérol total et de cholestérol-LDL, un ajout de médication est souvent nécessaire chez la majorité des patients pour atteindre les cibles thérapeutiques surtout en prévention secondaire(1). La médication réduisant le cholestérol-LDL comprend; 1) les inhibiteurs de la bêta-hydroxy-bêta-méthylglutaryl-coenzyme A réductase (statines), 2) les inhibiteurs de l’absorption du cholestérol (ézétimibe), 3) les séquestrants des sels biliaires (résines), 4) la niacine, 5) les fibrates et 6) les inhibiteurs de la PCSK9. Les statines sont les médicaments les plus utilisées car elles ont été prouvées efficaces pour réduire le cholestérol-LDL en plus de prévenir la survenue d’événements cardiovasculaires en plus de diminuer la mortalité(1). Nous détaillerons ces différents traitements dans les prochaines sections de ce travail.
1.4.
Traitement de la maladie cardiovasculaire
Une fois que le diagnostic de dyslipidémie est posé, il est important d’établir un plan de traitement global. Les principales étapes sont de repérer les causes secondaires de dyslipidémie, estimer le niveau de risque d’événements cardiovasculaires (prévention primaire ou prévention secondaire), discuter des diverses interventions sur les habitudes de vie, instaurer un traitement pharmacologique si nécessaire et d’assurer un suivi médical périodique.
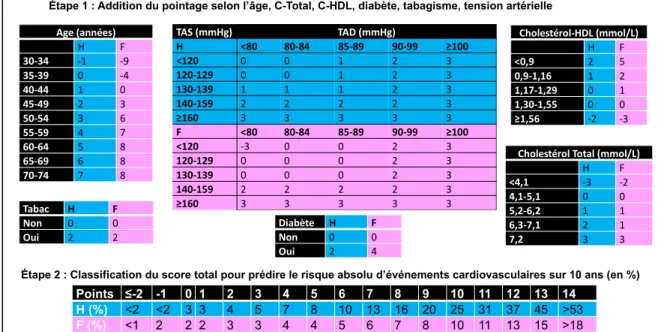
La détermination du niveau de risque d’événements cardiovasculaires et de décès chez les patients repose sur l’utilisation de différents algorithmes dont le plus connu repose sur les données de Framingham. Ce niveau de risque absolu au cours des 10 prochaines années repose sur l’étude « Framingham Heart Study » qui a suivi 7733 individus non-atteints de maladie cardiovasculaire(1,28,29). Cette étude a démontré que le niveau de risque à vie
8
d’événements cardiovasculaires est fortement dépendant du fardeau des facteurs de risque présents chez l’individu. Cette étude a développé un score de risque qui prédit le risque de maladie coronarienne à 10 ans. Les personnes à faible risque ont un risque de maladie coronarienne de ≤10% à 10 ans, un risque intermédiaire de 10 à 20% et un risque élevé de >20% à 10 ans. Les seuils de ces pourcentages ont été déterminés de façon arbitraire. De plus, l’histoire familiale de maladie coronarienne précoce, définit par la présence de maladie cardiovasculaire chez les membres de famille du 1er degré (homme < 55 ans et femme < 65
ans) double le pourcentage du risque calculé selon l’échelle de Framingham(30). Aussi, cette étude a démontré que le risque à vie de développer la maladie cardiovasculaire des hommes âgés de 40 ans est de 49% et de 32% chez les femmes du même âge et qu’il demeure élevé à 35% chez les hommes asymptomatiques âgés de 70 ans et de 24% des femmes du même âge. Le score de risque de Framingham a été validé aux États-Unis, tant chez les hommes que chez les femmes, tant chez les Américains d'origine européenne que chez les Afro-américains(31). Il est important de noter que le score de risque de Framingham ne prédit que les événements coronariens, et non tous les événements cardiovasculaires, ce qui signifie qu'il ne prédit pas de risque d'accidents cardioemboliques, d'accidents cérébraux ischémiques ni d'insuffisance cardiaque(32).
Figure 2. Évaluation du risque coronarien : Grille de Framingham
Étape 1 : Addition du pointage selon l’âge, C-Total, C-HDL, diabète, tabagisme, tension artérielle
Étape 2 : Classification du score total pour prédire le risque absolu d’événements cardiovasculaires sur 10 ans (en %)
Cholestérol Total (mmol/L)
H F <4,1 -3 -2 4,1-5,1 0 0 5,2-6,2 1 1 6,3-7,1 2 1 7,2 3 3 Cholestérol-HDL (mmol/L) H F <0,9 2 5 0,9-1,16 1 2 1,17-1,29 0 1 1,30-1,55 0 0 ≥1,56 -2 -3 TAS (mmHg) TAD (mmHg) H <80 80-84 85-89 90-99 ≥100 <120 0 0 1 2 3 120-129 0 0 1 2 3 130-139 1 1 1 2 3 140-159 2 2 2 2 3 ≥160 3 3 3 3 3 F <80 80-84 85-89 90-99 ≥100 <120 -3 0 0 2 3 120-129 0 0 0 2 3 130-139 0 0 0 2 3 140-159 2 2 2 2 3 ≥160 3 3 3 3 3 Age (années) H F 30-34 -1 -9 35-39 0 -4 40-44 1 0 45-49 2 3 50-54 3 6 55-59 4 7 60-64 5 8 65-69 6 8 70-74 7 8 Diabète H F Non 0 0 Oui 2 4 Tabac H F Non 0 0 Oui 2 2 Points ≤-2 -1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 H (%) <2 <2 3 3 4 5 7 8 10 13 16 20 25 31 37 45 >53 F (%) <1 2 2 2 3 3 4 4 5 6 7 8 10 11 13 15 >18
9
1.5.
L’absorption, la synthèse, le transport et l’excrétion du
cholestérol
Pour bien comprendre les thérapies hypolipémiantes, il est important de comprendre le métabolisme des lipides. Chez l’adulte, le cholestérol provenant de l’alimentation n’est pas ultimement requis puisque le foie, ainsi que d’autres organes comme le cerveau, sont capables de faire la synthèse du cholestérol. Le foie et l’intestin sont les sites où se produit le métabolisme du cholestérol. Ce cycle entéro-hépatique permet une autorégulation du taux de cholestérol disponible par l’organisme. Le métabolisme des lipides peut être divisé en deux parties : 1) le transport par voie exogène (à partir de l’intestin vers les autres tissus) et 2) la voie endogène (du foie aux autres tissus).
1.5.1. La voie des lipides exogènes
L’absorption du cholestérol alimentaire se fait au niveau du duodénum et du jéjunum proximal. Les lipides sont alors réestérifiés et assemblés à l’aide de l’apolipoprotéine B-48 pour former des chylomicrons. Sous la forme de chylomicrons, ils sont sécrétés par les entérocytes et pénètrent le réseau lymphatique mésentérique et se retrouvent dans la circulation sanguine. La lipoprotéine lipase (LPL), une enzyme clé dans le métabolisme des lipides, hydrolysent les chylomicrons en résidus de chylomicrons et en acides gras libres. Les résidus de chylomicrons sont captés au foie via le récepteur du cholestérol-LDL et la protéine apparentée au récepteur du cholestérol-LDL. Les acides gras libres, quant à eux, sont transférés au tissu adipeux et aux tissus périphériques pour le stockage ou la production d’énergie. Habituellement, il ne reste que de très bas niveaux de chylomicrons en circulation après environ 12 heures suivant un repas.
10
1.5.2. La voie des lipides endogènes
Ainsi, lorsque la quantité de chylomicrons en circulation est faible (quelques heures suivant un repas), les besoins en lipides des tissus périphériques sont assurés par les lipides synthétisées et régulées par le foie. Lorsque le taux sérique de cholestérol est bas, une cascade d’événements se produit pour augmenter la biosynthèse du cholestérol et l’importation du cholestérol extracellulaire. L’acétate intrahépatique est converti en hydroxyméthylglutaryl-CoA (HMG-CoA), le substrat de l’HMG-CoA réductase, qui à son tour est transformé en acide mévalonique puis finalement en cholestérol. Le foie produit ainsi des lipoprotéines à densité très faible (cholestérol-VLDL) qui seront excrétées dans le plasma. Elles sont ensuite métabolisées par la LPL en lipoprotéines à densité intermédiaire (cholestérol-IDL) puis en cholestérol-LDL. Il en résulte une production endogène d’acides gras libres et de cholestérol-LDL. Cette augmentation du taux sérique de cholestérol-LDL favorise sa conversion en énergie par les tissus périphériques.
Les inhibiteurs de l’HMG-CoA réductase, dits les statines, sont une classe d’hypolipémiants agissant précisément sur cette étape du métabolisme du cholestérol. Nous verrons plus loin dans ce travail les effets bénéfiques de cette médication.
1.6.
Les approches hypolipémiantes
non-pharmacologiques
1.6.1. L’approche nutritionnelle
L’élément central du traitement de la dyslipidémie repose sur l’adoption de saines habitudes de vie (Table 2). De façon générale, l’alimentation peut contribuer à une baisse de 5 à 15% de la cholestérolémie à jeun, selon les habitudes alimentaires initiales(33). Une méta-analyse de 37 études portant sur les 2 étapes du programme alimentaire du « US National Cholesterol Education Program » a démontré une baisse significative du taux sérique des lipides et du risque cardiovasculaire(33). En effet, l’étape 1 (gras représentant <30% de
11
l’apport énergétique totale dont les gras saturés représentant <10%) est associée à une baisse de 12% du taux de cholestérol-LDL tandis que l’étape 2 (gras saturés représentant <7% et le cholestérol alimentaire <200 mg/jour), de 16%. Le programme « United Kingdom Lipid Clinics Program » a observé chez 2508 patients qu’un régime alimentaire riche en fruits et légumes sans autre intervention a permis une baisse de 1,8% du poids tout en étant associé à une réduction de 5 à 7% du cholestérol-LDL(34). Cette baisse de cholestérol-LDL se produit de 6 à 12 mois après le début du changement de régime alimentaire(34). Bien qu’un changement de régime alimentaire soit bénéfique sur la réduction du cholestérol-LDL, son maintien à long terme n’est malheureusement pas respecté(35). Bien qu’une consultation par une nutritionniste amène plus souvent des changements alimentaires plus durables, elle peut être inefficace à long terme(36). Par conséquence, l’introduction d’une médication hypolipémiante est souvent inévitable. Que l’adoption de saines habitudes alimentaires soit associée à une médication ou non, elle devra maintenir les objectifs suivants : 1) permettre le maintien un poids idéal, 2) augmenter les proportions de fruits, légumes et grains entiers et, 3) être faible en sodium, en gras saturés et en glucides raffinés et en sucre(1).
1.6.2. L’exercice physique
Plusieurs études ont démontré les bienfaits de l’exercice régulier sur la prévention des événements cardiovasculaires(37-39). En effet, une méta-analyse de 11 études randomisées regroupant 2285 patients avec maladie coronarienne et assignés à un programme d’exercice physique ou non, en plus du traitement médical adéquat(40) a démontré une réduction relative et significative de 28% de la mortalité toute cause. Une réduction relative non-significative de 24% de la récidive d’infarctus a aussi été notée. Cette méta-analyse comprend aussi 15 études randomisées de 4655 patients étant assignés à un programme combiné de réadaptation cardiaque et de contrôle des facteurs de risque ou non. L’adhésion à une clinique de réadaptation cardiaque dans cette étude était associée à une réduction relative non-statistiquement significative de la mortalité toute-cause de 12% mais aussi d’une réduction relative et significative de 38% de récidive d’infarctus du myocarde(40). Les lignes directives canadiennes recommande ainsi aux Canadiens de
12
pratiquer au moins 150 minutes d’activité physique d’intensité modérée à intense par semaine(1). Cette recommandation est applicable autant chez les patients en prévention primaire que secondaire et est aussi associée à une diminution du cholestérol-LDL et de la tension artérielle(1).
Table 2. Mesures non-pharmacologiques du traitement de la
dyslipidémie
Le traitement des habitudes de vie
Cesser le tabagisme
Alimentation d’apport calorique modéré et réduite en gras saturés et en sucre raffiné comprenant :
- Alimentation de type méditerranéenne, portfolio, DASH - Riche en fruits et légumes (> 5 portions par jour)
- Apport en noix (> 30 grammes par jour) et en huile d’olive (> 60 ml par jour) - Haute teneur en fibres (> 30 grammes par jour)
Perte de poids et maintien d’un poids santé :
- Patients avec index de masse corporelle >30 ou >25 avec facteurs de risque : viser perte de poids de > 3-5% (pour viser une réduction des événements cardiovasculaires)
Exercice physique : 150 min/semaine à intensité modéré à élevée
1.7.
Les traitements pharmacologiques
1.7.1. Les statines
L’adoption de saines habitudes de vie et l’instauration du traitement de ces facteurs de risque peut certes abaisser la survenue d’événements coronariens. Cependant, un
13
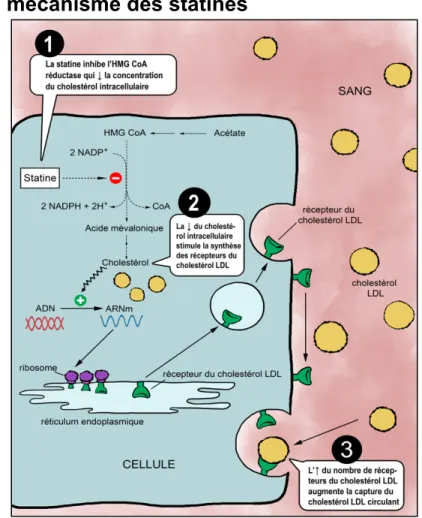
traitement pharmacologique est malgré tout souvent indiqué chez les patients souffrant de maladie cardiovasculaire. Le choix du type de traitement pharmacologique peut varier selon la présentation clinique du patient et selon le type de dyslipidémie. Les inhibiteurs de la HMG CoA réductase, dits statines, sont efficaces pour réduire le cholestérol-LDL et elles sont, à ce jour, la pierre angulaire du traitement de l’hypercholestérolémie et de la prise en charge du risque cardiovasculaire chez les patients atteint de maladie cardiovasculaire(29). Elles inhibent de façon compétitive la synthèse hépatique du cholestérol en bloquant l’activité de la HMG CoA réductase. En réduisant la concentration de cholestérol dans les hépatocytes et en augmentant les récepteurs du cholestérol-LDL à la surface cellulaire, il en résulte une diminution du taux de cholestérol-LDL circulant (Figure 2). Il existe actuellement six statines disponibles sur le marché canadien, soient la fluvastatine, la lovastatine, la pravastatine, la simvastatine, l’atorvastatine et la rosuvastatine(41). Les études pharmacologiques ont démontré que la classe des statines peut réduire de 20% à 60% le taux de cholestérol-LDL, selon la statine et la dose utilisée(41). Cette réponse dépend de la dose utilisée et suit une relation logarithmique(41).
14
Les statines ont un rôle particulier par rapport aux autres classes pharmacologiques d’hypolipémiants dans le traitement de la dyslipidémie puisque la classe des statines a démontré son efficacité à réduire les événements coronariens et à diminuer le cholestérol-LDL dans plusieurs grandes études randomisées et des méta-analyses(29). Cette efficacité sera détaillée dans les sections suivantes de ce document. Bien qu’il y ait un effet de classe des statines sur la réduction des événements cardiovasculaires, il est important de noter qu’il existe des différences entre les différentes statines quant à leur structure chimique, leur pharmacocinétique et leurs profils d’effets secondaires. Weng et al. ont en effet démontré dans une revue systématique, qu’à doses équivalentes, les statines ont un effet sur la réduction du taux de cholestérol-LDL et que seuls l’atorvastatine et la rosuvastatine ont la capacité de réduire de plus de 40% le cholestérol-LDL(41). Aussi, Mauger et al. ont démontré l'impact divergent de la simvastatine et de l'atorvastatine sur les concentrations plasmatiques de cholestérol-HDL, ce qui était attribuable, au moins en partie, à un plus grand taux de production d’apolipoprotéine A-I avec la simvastatine(42).
Les effets bénéfiques des statines se manifestent au-delà de leur effet sur la réduction du taux de cholestérol-LDL chez les patients souffrant de dyslipidémie. Différents mécanismes, dits pléïotropiques(43) contribuent à l’efficacité de cette classe de médicaments.
1.7.1.1. Les effets pléïotropiques des statines dans le traitement du
syndrome coronarien aigu
Des événements coronariens peuvent se manifester même en absence de facteurs de risque traditionnels, laissant penser que d’autres mécanismes tels que des anomalies de l’hémostase, de la réaction inflammatoire et de la formation de thrombose y participent également(44). Il a été démontré que les statines ont des effets bénéfiques sur la prévention primaire et secondaire de la maladie coronarienne pouvant s’expliquer par plusieurs mécanismes autres qu’uniquement la baisse du cholestérol-LDL et l’amélioration du profil lipidique(45,46). En effet, plusieurs études expérimentales et des essais cliniques ont démontré l’existence de ces effets dits pléïotropiques, c’est-à-dire indépendants de la diminution du cholestérol-LDL.
15
1.7.1.2. Statine et effet anti thrombotique
Les effets anti thrombotiques et anticoagulants des statines sont des effets pléïotropiques potentiellement utiles dans le traitement du syndrome coronarien aigu. Il a été établi que l’hypercholestérolémie est associée à une augmentation de l’agrégation plaquettaire, et à la formation du thrombus responsable de l’infarctus du myocarde(44). Les statines réduisent la formation de thrombus par plusieurs mécanismes comme par exemple la réduction de l’expression du facteur tissulaire des cellules endothéliales et des macrophages(20,47,48). Les statines réduisent également l’activation de la prothrombine(49,50), améliore la fonction fibrinolytique et diminuent l’agrégation plaquettaire par leur effet antioxydant(51,52). Ces mécanismes ont été observé dans plusieurs études dont une, plus spécifiquement, qui a démontré qu’une utilisation à long terme de simvastatine diminue la thromboxane A2 responsable de l’agrégation plaquettaire accrue chez les patients souffrant d’hypercholestérolémie(53). Une autre étude a conclu que la pravastatine et la simvastatine réduisent la thrombogénécité sanguine et la dysfonction endothéliale mesurée par le taux de molécules d’adhésion chez 50 patients souffrants d’hypercholestérolémie(49).
1.7.1.3. Statine et inflammation
Nous avons brièvement discuté que l’inflammation est un élément clé dans la pathogénèse de l’athérosclérose. L’inflammation est également un élément important du phénomène de rupture de plaque instable dans le contexte d’un syndrome coronarien aigu(5),(54). Avec
l’avancée des technologies moléculaires de la dernière décennie, l’identification des marqueurs inflammatoires est devenue possible et grandement étudiés comme marqueurs prédictifs de la survenue de maladie cardiovasculaire. En effet, plusieurs études de cohorte ont démontré que les biomarqueurs inflammatoires telle que la protéine C réactive (PCR), prédisent le risque de récidive d’infarctus du myocarde, d’accident cérébraux vasculaire et de décès(7,55-57). Par exemple, l’étude « Emerging Risk Factors Collaborators » a démontré qu’une augmentation du risque de maladie cardiovasculaire est associée à un taux croissant de PCR(58). Actuellement, la PCR est un marqueur inflammatoire qui prédit
16
la survenue d’événements cardiovasculaires autant chez les patients asymptomatiques que ceux atteints de la maladie coronarienne(59). La PCR, une protéine produite par les cellules hépatiques mais aussi par le tissue adipeux et par les cellules endothéliales et musculaires lisses, est un marqueur d’inflammation systémique(9). Cependant, une controverse entourant le rôle causal de la PCR sur la pathogénèse de la maladie coronarienne est débattue depuis plusieurs années. En effet, cet effet de causalité a été démontré par des études observationnelles qui ont décrit une association entre le taux de PCR et le risque de la survenue de la maladie cardiovasculaire. Cette association est statistiquement robuste mais n’implique pas nécessairement un lien de causalité. Des études randomisées devront être réalisées, comme c’était le cas des autres facteurs de risque traditionnels de maladie coronarienne, pour prouver cette relation de cause à effet. Une étude menée par Zacho et al. a démontré, par une méthode de randomisation mendélienne, que des polymorphismes du gène de la PCR sont associés des taux de PCR sérique élevé capables de prédire la survenue d’événements cardiovasculaires mais que ces polymorphismes ne sont pas eux-mêmes associés à un risque augmenté de maladie coronarienne ischémique(60). La PCR demeure malgré tout un marqueur de l’inflammation et les études ont permis de démontrer le rôle important de l’inflammation dans la pathogénèse de l’athérosclérose et permet de mieux définir, chez une population de patients non coronariens en prévention primaire par exemple, le risque de survenue d’événements cardiovasculaires.
Les statines semblent avoir un effet antiinflammatoire bénéfique en plus de ses effets hypocholestérolémiants sur le traitement de la maladie athérosclérotique et pourraient devenir une cible thérapeutique dans les prochaines années(61). La prise de statines réduit les taux sériques de PCR indépendamment des valeurs du bilan lipidique obtenues(62). L’importance de la réduction de marqueurs inflammatoires sur la récidive d’événements cardiovasculaires a été soulevée par une analyse de l’étude « Cholesterol and recurrent events » (CARE)(63). Cette étude a démontré que les patients ayant un taux sérique de PCR situé dans le quintile le plus élevé ont une augmentation du risque d’avoir la récidive d’un événement cardiovasculaire par rapport à ceux avec un taux de PCR moins élevé. Le mécanisme par lequel les statines interfèrent avec la réponse inflammatoire n’est pas, malgré ces recherches, entièrement compris. L’effet des statines sur différentes cellules inflammatoires a été rapporté. Par exemple, il a été observé qu’un taux élevé de facteur de nécrose tumorale (TNF-α) est aussi associé à la maladie cardiovasculaire(64). En effet, il a
17
été démontré dans une étude de cohorte de 272 sujets que ceux ayant subi des événements cardiovasculaires avaient un taux de TNF-α plus élevé par rapport à ceux qui n’en ont pas eu(64). Un autre exemple est celui d’une étude de 59 patients ayant des sténoses carotidiennes(65). Les patients ayant subi une première endartérectomie et étant en attente d’une deuxième étaient alors randomisés à prendre de l’atorvastatine 20 mg id ou un placebo. La composition des spécimens des endartérectomies a été analysée lors des deux interventions. Chez les patients ayant été traités à l’atorvastatine, la composition de leur plaque d’athérome comprenait significativement moins de macrophages et des taux moins élevés de l’antigène du facteur tissulaire, du facteur tissulaire activé et de l’inhibiteur de la voie d’activation du facteur tissulaire; tous sont des biomarqueurs inflammatoires.
1.7.1.4. Les effets des statines sur la stabilisation et la régression de la
plaque
Un des effets principaux pléïotropiques des statines consiste à stabiliser la plaque d’athérome(66). Cette action bénéfique débute rapidement quelques heures après la prise de la médication et est la raison pour laquelle certains auteurs suggèrent une administration de la statine très rapidement lors d’un syndrome coronarien aigu(53,67). Le risque de thrombose et de rupture de la plaque d’athérome dépend de la composition de la plaque bien plus que du degré d’obstruction de la lumière du vaisseau sanguin atteint. La stabilisation de la plaque est un objectif thérapeutique important et plusieurs traitements pharmacologiques ont tenté d’y parvenir. Tel que démontré dans les études moléculaires, les statines ont aussi des effets sur le remodelage de la plaque, par les mécanismes antiinflammatoires, anti-thrombotiques et sur la fonction endothéliale(12,68-70). La stabilisation de la plaque d’arhérosclérose avec la prise de statine a été observée dans plusieurs études d’imagerie avancées. L’étude « Atorvastatin and thrombogenicity of carotid atherosclerotic plaque » (ATROCAP) a démontré des changements quant à l’épaisseur de la couche fibreuse, de la composition lipidique de la plaque, du degré de calcifications, de la surface et du volume de la plaque au niveau de la carotide chez des patients sous traitement de statines à différentes doses(71).
18
L’étude « Reversal of atherosclerosis with aggressive lipid lowering » (REVERSAL) est souvent citée comme étant la plus grande étude randomisée ayant étudié l’effet d’une thérapie intensive par rapport à une d’intensité modérée sur la progression de la maladie coronarienne(72). Cette étude multicentrique de 654 patients a comparé l’effet de la pravastatine 40 mg par jour à celui de l’atorvastatine 80 mg sur le changement du volume de la plaque d’athéromatose tel que mesuré par échographie intra-coronarienne chez des patients souffrant de maladie coronarienne. Cette étude a démontré que l’utilisation d’une thérapie intensive réduisait significativement le volume d’athéromatose par rapport à une thérapie moins intensive et même que les patients traités à la thérapie moins intensive ont vu une progression du fardeau d’athéromatose. Subséquemment, l’étude « A study to evaluate the effect of rosuvastatin on intravascular ultrasound-derived coronary atheroma burden » (ASTEROID) a, quant à elle, démontré une régression de la plaque d’athérosclérose chez des patients traités avec une statine à haute dose(73). Cinq cent sept patients coronariens ont été traités avec la rosuvastatine 40 mg par jour pendant 2 ans. Le taux moyen de cholestérol-LDL a été réduit de 53,2% par rapport à la valeur de départ, atteignant 1,57 mmol/L. Cette réduction est associée à une réduction statistiquement significative de 6,8% du volume d’athéromatose (p<0,001) mesurée par échographie intra coronarienne. D’autres études ont également observé que les statines remodèlent non seulement la composition de la plaque mais diminue aussi sa progression et vont jusqu’à la faire régresser, produisant ainsi des plaques d’athérosclérose plus stables(20,74). Finalement, les résultats de ces 2 études ainsi que ceux de 2 méta-analyses ont conclu qu’une réduction de cholestérol-LDL induite par un traitement de statine à haute dose, et à un taux en dessous de 1,8 mmol/L, est associée à une régression de la plaque d’athéromatose coronarienne et renforce l’importance d’un traitement de statine de haute intensité(75,76). Plusieurs autres études ont conclu que les statines augmentent la synthèse d’oxyde nitrique de l’endothélium réduisent le taux de cholestérol-LDL oxydé et la perméabilité de l’endothélium au cholestérol-LDL(8,9,11,12,77-79). Finalement, en inhibant la prolifération des cellules musculaires lisses, les statines empêchent la formation de lésions vasculaires dans les cas de resténose suivant une angioplastie et de la survenue d’une occlusion d’un greffon veineux(5,80).
Aucune étude n’a pu cependant conclure si les statines ont un effet bénéfiques sur d’autres caractéristiques morphologiques telles que l’ulcération, ou l’hémorragie au sein de la plaque
19
ou même la néovascularisation(81). Ces phénomènes surviennent lors d’un syndrome coronarien aigu.
1.7.1.5. Les études cliniques supportant l’utilisation des statines en
période post-infarctus
Tous les patients ayant subi un syndrome coronarien aigu bénéficient de la prise d’une statine à long terme(82). Cette recommandation a d’ailleurs été incluse dans le guide de pratique de la Société canadienne de cardiologie(1). Au cours de la dernière décennie, un nombre impressionnant d’études ont confirmé que les statines dans le traitement de la maladie coronarienne préviennent les événements cardiovasculaires et améliorent la survie des patients atteints de maladie athérosclérotique mais aussi de ceux en prévention primaire ayant des facteurs de risque de maladie coronarienne(82). Des études observationnelles ont rapporté une forte relation logarithmique entre le taux de cholestérol sérique et la mortalité de cause coronarienne(83). Ces résultats ont par la suite été confirmés par une vingtaine d’études randomisées avec groupe contrôle sous placebo puis par plusieurs grandes méta-analyses et revues systématiques. L’étude « Scandinavian simvastatin survival study » (4S) est la première étude randomisée évaluant l’efficacité de la simvastatine par rapport au placebo à réduire la mortalité chez des patients en prévention secondaire(84). Quatre mille quatre cent quarante-quatre patients ont été suivis sur une période de 5,4 années. La mortalité de cause cardiovasculaire a été réduite de 42 % et la survenue d’événements coronariens de 34 % chez les patients ayant reçu la simvastatine de 10 à 40 mg par jour par rapport à ceux ayant reçu le placebo. Cette étude a conclu que la simvastatine réduisait la mortalité chez les patients en prévention secondaire. Par la suite, l’étude CARE a examiné l’efficacité de la pravastatine à réduite la mortalité coronarienne et la survenue d’infarctus du myocarde chez les patients considérés normocholestérolémiques ayant déjà présenté un infarctus du myocarde(85). Cette étude a résulté en une diminution de 24% des événements coronariens chez les patients traités à la pravastatine 40 mg par jour par rapport au groupe placebo sur une période de suivi de 5 ans. Par rapport au placebo, la pravastatine a réduit de 20% le taux de cholestérol total, de 32% le cholestérol-LDL, de 14% les triglycérides et a augmenté le cholestérol-HDL de 5%. Ces patients avaient des valeurs de base de cholestérol total de 5,40 mmol/L et de cholestérol-LDL de 3,59
20
mmol/L. Par rapport aux résultats obtenus dans l’étude 4S où les patients avaient des taux plus élevés, 6,72 mmol/L et 4,65 mmol/L respectivement, les experts ont émis l’hypothèse que le traitement aux statines réduit de façon significative la mortalité et la survenue d’événements cardiovasculaires chez les patients en prévention secondaire, peu importe la valeur de base du cholestérol, c’est-à-dire qu’ils soient hypercholestérolémiques ou pas. L’étude « Long term intervention with pravastatin in ischemic disease study » (LIPID) a démontré des conclusions similaires, soient une réduction de 24% de la mortalité et des événements coronariens chez les patients traités à la pravastatine 40 mg par jour par rapport à ceux ayant reçu un placebo(86). Les 9 014 patients avaient des valeurs de base de cholestérol total et de cholestérol-LDL plus basses, c’est-à-dire 5,64 mmol/L et 3,88 mmol/L respectivement. L’étude « Prospective study of pravastatin in elderly at risk » (PROSPER) a inclut 5 804 patients plus âgés, de 75 ans en moyenne pour étudier l’effet de la pravastatine 40 mg par jour par rapport au placebo, sur la mortalité coronarienne et la survenue d’événements cardiovasculaires(87). Ce traitement en prévention primaire et secondaire a diminué l’incidence de l’issue primaire de 408 événements par rapport à 473 événements (rapport de cote 0,85, IC95% (0,74-0,97), p=0,014). La mortalité a été réduite de 24% chez les patients prenant la pravastatine par rapport à ceux ayant reçu le placebo. L’étude a également observé une augmentation de la survenue de cancer dans le groupe traité sur la période de suivi de 3 ans. Ce résultat a conséquemment émis un doute sur la sécurité à long terme de la prise des statines. Ceci n’a pas été confirmé par plusieurs études ayant des suivis prolongés(88) et par une méta-analyse regroupant un grand nombre d’études de statines(89). La méta-analyse du « Cholesterol treatment trialists collaborators » incluant les données prospectives de 90 056 patients provenant de 14 études randomisées, a étudié durant 5 ans en moyenne, la survenue de différents événements cardiovasculaires en fonction de la réduction du cholestérol-LDL par un traitement de statines, à différentes molécules et différentes doses(90). Cette méta-analyse a démontré que les statines réduisent de 19% la mortalité par maladie coronarienne et de 12% la mortalité de toute cause par baisse de 1 mmol/L du cholestérol-LDL. Ceci se détaille par une diminution significative de l’incidence d’événements coronariens, d’accidents cérébrovasculaires et de procédures de revascularisation et de la diminution non-significative de la mortalité non-cardiovasculaire. Ces bénéfices surviennent indépendamment de la valeur initiale du cholestérol-LDL sur une période de suivi de 5 ans en moyenne. L’analyse n’a pas démontré d’augmentation de la survenue de cancers ni de risque excessif d’épisodes de rhabdomyolyse chez ces patients traités avec des statines.
21
Finalement, l’étude « Heart protection study » (HPS) a comparé la mortalité toute cause chez 20 536 patients en prévention primaire et secondaire, comprenant un grand nombre de femmes et de personnes âgées, chez des patients traités à la simvastatine 40 mg par jour par rapport à un groupe placebo(88). Les résultats obtenus sont une diminution de 12% de la mortalité toute cause, grandement influencée par une diminution marquée de 18% de décès de cause coronarienne, sans augmentation de l’incidence de cancer ni d’hospitalisation de toute cause.
1.7.1.6. Initiation précoce de la statine après l’événement coronarien
Ainsi, la plupart des patients bénéficient de la prise d’une statine après avoir subi un événement coronarien. Plusieurs évidences suggèrent qu’il serait bénéfique de débuter la statine dans les heures suivants l’événement coronarien aigu. Ceci pourrait s’expliquer par les mécanismes pléïotropiques des statines que nous avons décrit plus haut, et qui entrainent une réduction de l’inflammation et de la thrombogénicité, une stabilisation de la plaque d’athérosclérose, une amélioration de la fonction endothéliale. La prise de statine dans les 48 heures suivant l’événement coronarien aigu a possiblement un effet bénéfique sur la réduction du taux de cholestérol-LDL et possiblement sur la survenue d’événements cardiovasculaires(91). Ceci a été démontré, entre autres, dans l’étude « Pravastatin or atorvastatin evaluation and infection therapy–thrombolysis in myocardial infarction 22 » (PROVE-IT TIMI 22) dans laquelle le traitement d’atorvastatine 80 mg par jour a été initié chez tous les patients dans les 10 jours suivants l’infarctus du myocarde et aussi précocement que dans les 24-48 heures suivantes l’événement coronarien et dans l’étude « Myocardial ischemia reduction with aggressive cholesterol lowering » (MIRACL), dans laquelle les patients ont tous été traités avec l’atorvastatine 80 mg débutée dans les 48-96 heures suivant leur admission pour un infarctus du myocarde sans élévation du segment ST(92). Les résultats des 2 études ont conclu à une diminution statistiquement significative sur la survenue d’événements cardiovasculaires combinés à 30 jours et à 4 mois. Les bénéfices de débuter un traitement de statine précocément n’a toutefois pas été démontré dans la phase Z de l’étude A to Z, dans laquelle les patients ayant subi un événement coronarien aigu étaient traités avec une thérapie intensive (simvastatine 40 mg pour 1 mois
22
puis 80 mg par la suite) par rapport à une thérapie moins intensive (un placebo pour 4 mois puis simvastatine 20 mg)(93). Durant les 4 mois suivants le début de l’étude, le taux de cholestérol-LDL a significativement diminué chez les patients traités de façon intensive mais celui-ci n’était pas associé à une diminution de l’incidence d’événements cardiovasculaires combinés. Le bénéfice d’une réduction d’événements cardiovasculaires a cependant été observé dans les 4 mois suivants le début de l’étude et ce, jusqu’à la fin de l’étude. Ces différentes conclusions pourraient s’expliquer par les différences démographiques des populations étudiées et possiblement par le dosage de la statine étudiée, l’atorvastatine 80 mg étant beaucoup plus puissante que simvastatine 80 mg. Une méta-analyse subséquente d’études randomisées contrôlées (statine contre placebo) n’a cependant pas pu conclure que l’initiation de la statine dans les 14 jours suivants l’infarctus aigu du myocarde diminue la survenue d’un accident cérébrovasculaire, une récidive d’infarctus ou le décès chez ces patients à 30 jours et à 1 mois mais pourrait possiblement diminuer la survenue d’un infarctus du myocarde sans élévation du segment ST dans les 4 mois suivant l’événement coronarien initial(94). Il est important de noter que l’étude PROVE-IT TIMI 22 a été exclue de cette méta-analyse puisqu’elle comparait 2 différents dosages de statine et non une statine contre un placebo et que les études incluses mettaient principalement en évidence la pravastatine, qui pourrait avoir minimisé les bénéfices recherchés puisque cette statine est moins puissante.
1.7.1.7. L’intensité du traitement de statine en prévention secondaire
Comme nous venons de discuter, l’avenue des statines plus puissantes pour réduire le cholestérol-LDL a permis d’étudier l’effet d’un traitement agressif différentiel à l’aide de statine plus puissante sur la survenue d’événements cardiovasculaires. Ces grandes études contrôlées et randomisées avec groupe placebo ont permis de conclure à l’efficacité des statines à réduire le LDL et d’établir la relation entre la baisse du cholestérol-LDL et la mortalité coronarienne. Ce bénéfice est similaire peu importe la valeur de cholestérol-LDL initiale des patients. Ceci a par la suite soulevé la question de la cible optimale à atteindre pour réduire la survenue d’événements cardiovasculaires et de décès. Malgré plusieurs grandes études randomisées et méta-analyses, cette question n’est pas
23
entièrement résolue. Les études récentes, qui ont évalué l’efficacité de la nouvelle classe hypolipémiante des inhibiteurs de PCKS9, sont démontré une association entre une diminution du cholestérol-LDL en dessous de la valeur actuellement recommandée et une réduction des événements cardiovasculaires majeurs. Ces patients coronariens étaient traités sous haute dose de statines et avec l’addition d’un inhibiteur de PCKS9 ou d’un placebo(95,96). La récente étude « Further cardiovascular outcomes research with PCSK9 inhibition in subjects with elevated risk » (FOURIER), a démontré que l’atteinte d’un taux médian de cholestérol-LDL à 0,78 mmol/L (diminution de 59% du taux de cholestérol-LDL) était associée à une diminution de 15% du risque d’événements cardiovasculaires majeurs(97). Les 27 564 patients souffrants de maladie athérosclérotique étaient traités avec une statine à haute dose et l’evolocumab ou un plabebo. Ceci suggère qu’il y aurait un bénéfice à réduire le taux de cholestérol-LDL au-delà des recommandations actuelles. La découverte de nouvelles connaissances portant sur les cibles idéales de cholestérol-LDL et des autres lipoprotéines et la réduction des événements cardiovasculaires permettra de changer les guides de pratiques.
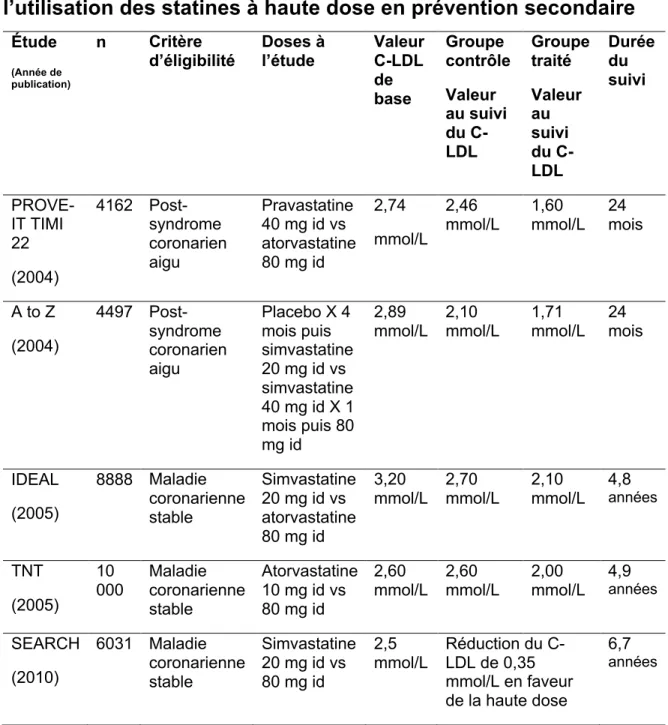
Cela étant dit, la littérature existante permet tout de même d’établir qu’un traitement de statine plus intensif permet de diminuer les événements cardiovasculaires et la mortalité par rapport à un traitement de statine utilisant des doses plus faibles. Les études REVERSAL, PROVE-IT TIMI 22 et MIRACL et la « Study of the effectiveness of additional reductions in cholesterol and homocysteine » (SEARCH) l’ont démontré(72,91,92,98). L’étude REVERSAL a démontré chez 654 patients porteurs d’une maladie coronarienne objectivée angiographiquement, l’efficacité d’un traitement à l’atorvastatine 80 mg par jour par rapport à la pravastatine 40 mg par jour sur le changement du volume de la plaque d’athérome et de la baisse du cholestérol-LDL sur une période de 18 mois(72). Les résultats obtenus ont montré une stabilité de la plaque chez les patients randomisés dans le groupe atorvastatine à haute dose par rapport à une progression plus importante dans le groupe pravastatine (p=0,02). La baisse du cholestérol-LDL obtenue lors du suivi est significative (3,86 mmol/L à 2,03 mmol/L pour le groupe atorvastatine et 3,86 mmol/L à 2,84 mmol/L, p<0,001 pour le groupe pravastatine). L’étude PROVE-IT-TIMI 22, quant à elle, a inclus 4162 patients ayant subi un syndrome coronarien aigu qui ont été randomisés à un traitement d’atorvastatine 80 mg par jour ou de pravastatine 40 mg par jour(91). L’issue primaire était la sommation du décès par toute cause, l’infarctus du myocarde, l’angine instable nécessitant une
24
hospitalisation, la revascularisation dans les 30 jours et l’accident cérébral vasculaire. La courbe de survie de type Kaplan-Meier a démontré au suivi de 24 mois un taux d’événements combinés de 22,4% dans le groupe atorvastatine et de 26,3% dans le groupe pravastatine (p=0,005). Les patients traités à l’atorvastatine ont eu une baisse significative (p<0,001) de leur taux sérique de cholestérol-LDL (2,4 mmol/L à 1,6 mmol/L) par rapport à l’autre groupe (2,74 mmol/L à 2,46 mmol/L). Ces effets désirables sont présents dans tous les sous-groupes analysés mais les patients ayant une valeur initiale de cholestérol-LDL de plus de 3,2 mmol/L semblent en bénéficier le plus. Finalement, peu d’effets secondaires ont été rapportés dans cette grande étude, bien que les valeurs sériques des transaminases hépatiques aient été significativement plus élevées dans le groupe traité à l’atorvastatine, aucune différence quant à la survenue de myopathie ni d’arrêt de la médication n’a été observée. Il est a noté qu’il s’agissait d’une cohorte très sélectionnée dont les patients recevant des inhibiteurs du cytochrome P450 3A4 étaient exlcus. La phase Z de l’étude randomisée A to Z a également étudié l’effet d’une thérapie hypocholestérolémiante intensive par rapport à un traitement utilisant des doses moins élevées, chez une population de patients ayant présenté un syndrome coronarien aigu(93). De plus, la majorité des patients avaient une « période d’essai » avant d’être randomisés, ce qui permettait de ne pas inclure les patients non-observants ou ceux avec des effets secondaires de toutes sortes. Quatre milles-quatre-cent-quatre-vingt-dix-sept patients étaient randomisés à recevoir de la simvastatine 40 mg par jour pour 1 mois puis 80 mg par jour ou un placebo pour les 4 premiers mois puis simvastatine 20 mg par jour par la suite. Après un suivi de 24 mois, la survenue d’événements cardiovasculaires ne différaient pas selon l’intensité du traitement (taux d’événements cardiovasculaires de 14,4% pour le groupe au traitement intensif par rapport à 16,7% pour l’autre, p=0,14). La baisse du cholestérol-LDL selon le traitement étaient significatif (2,90 mmol/L à 1,76 mmol/L pour le groupe intensif par rapport à 2,87 mmol/L à 2,10 mmol/L pour l’autre, p<0,001). Tout comme dans l’étude PROVE-IT-TIMI 22, une augmentation significative des transaminases hépatiques a été observée dans le groupe intensif. L’étude « Treating to new target trial » (TNT) a suivi 10 001 patients porteurs d’une maladie coronarienne stable et d’un taux sérique de cholestérol-LDL de moins de 3,4 mmol/L(99). Les patients ont été randomisés à recevoir de l’atorvastatine 80 mg par jour ou 10 mg par jour. L’issue primaire a été la survenue d’événement cardiovasculaire. Après la période de suivi de 4,9 années, il y a eu 8,7% d’événements cardiovasculaires dans le groupe ayant la thérapie intensive par rapport à 10,9% dans l’autre groupe ; cette différence était significative (p<0,001), la baisse du cholestérol durant
25
l’étude n’a été significative que dans le groupe au traitement intensif. Contrairement aux études précédentes, il y a eu une différence significative entre les 2 groupes quant à la survenue d’une augmentation importante des transaminases hépatiques et de la nécessité d’arrêter la médication à l’étude à cause d’effets indésirables (p<0,001 dans les 2 cas). L’étude « Incremental decrease in end points through aggressive lipid lowering » (IDEAL) a obtenu les mêmes résultats que l’étude précédente(100).
Une seule étude a évalué la relation entre le changement du taux de cholestérol-HDL et la régression de la plaque d’athérosclérose chez des patients traités avec une haute dose de statine(101). En effet, cette étude de 1455 patients a démontré qu’une haute dose de statine était associée à une réduction du volume d’athérome intracoronarien (> 5% par rapport au volume initial) lorsqu’il y avait une réduction de du cholestérol-LDL (< 2,26 mmol/L) et une augmentation du cholestérol-HDL (> 7,5%). L’analyse multivariée a démontré que le taux moyen de cholestérol-LDL et une hausse du cholestérol-HDL étaient des prédicteurs indépendants de la régression du volume d’athérome. Ce résultat suggère que la prise d’une haute dose de statine peut avoir des répercussions bénéfiques via la réduction du cholestérol-LDL mais aussi par une augmentation du cholestérol-HDL.
En somme, 10 grandes études randomisées de près de 40 000 patients porteurs d’une maladie coronarienne et d’âges différents ont évalué l’efficacité d’une thérapie à haute dose de statine par rapport à une thérapie moins intensive pour prévenir la mortalité totale sans augmentation des décès de d’autres causes et prévenir la survenue d’événements cardiovasculaires tels que l’infarctus du myocarde, l’angine, la récidive d’événements coronariens après une procédure de revascularisation et les accidents cérébraux vasculaires et ce, peu importe les valeurs initiales de cholestérol-LDL, qui variaient dans ces études entre 2,74 mmol/L et 3,98 mmol/L.