Effets de la L-DOPA et des autres principaux
antiparkinsoniens sur le fonctionnement cognitif dans la
maladie de Parkinson idiopathique
Mémoire doctoral
Marc-André Roy
Doctorat en psychologie
Docteur en psychologie (D. Psy.)
Québec, Canada
Effets de la L-DOPA et des autres principaux
antiparkinsoniens sur le fonctionnement cognitif dans la
maladie de Parkinson idiopathique
Mémoire doctoral
Marc-André Roy
Sous la direction de :
III
RÉSUMÉ DU MÉMOIRE
La maladie de Parkinson (MP) atteint principalement les fonctions motrices, mais est également associée à plusieurs symptômes non-moteurs, incluant des altérations cognitives. Celles-ci sont associées à de nombreuses conséquences sur le fonctionnement et la qualité de vie des patients et de leur entourage. Il est donc pertinent d’identifier des facteurs qui pourraient moduler ces conséquences, de même que de comprendre leur patron de fonctionnement. Par leurs effets sur la neurotransmission dopaminergique, les antiparkinsoniens actuellement prescrits à une vaste majorité de patients MP pourraient affecter leur cognition et, par conséquent, leur fonctionnement quotidien. Considérant ce rationnel, plusieurs chercheurs se sont intéressés à étudier l’association entre ces médications et la cognition dans la MP, mais les études en découlant n’ont jamais été recensées de manière systématique.
Ce mémoire étudie les effets des antiparkinsoniens actuellement prescrits en clinique sur le fonctionnement cognitif chez des patients MP en stades léger à modéré présentant ou non des atteintes cognitives légères et ce, via une recension systématique de la littérature de nature quantitative. Le Chapitre 1 établi l’état actuel des connaissances scientifiques entourant la problématique étudiée. Le Chapitre 2 présente les résultats de la recension systématique quantitative qui a été réalisée au cours de ce projet. Globalement, chaque molécule étudiée a présenté un patron distinct d’effets sur les différents domaines cognitifs, avec certaines produisant principalement des effets délétères (pramipexole, sélégiline), et d’autres apportant surtout des bénéfices ou aucun changement (levodopa, rasagiline). Enfin, le Chapitre 3 explore différentes interprétations et réflexions en lien avec les résultats. Il contient également des pistes de recherches futures, certaines implications cliniques des résultats obtenus, de même qu’une critique de l’état de la littérature sur la problématique étudiée et du présent mémoire doctoral.
IV
TABLE DES MATIÈRES
RÉSUMÉ DU MÉMOIRE ... III TABLE DES MATIÈRES ... IV LISTE DES TABLEAUX ... VI LISTE DES FIGURES ... VII LISTE DES ABRÉVIATIONS ... VIII REMERCIEMENTS ... X AVANT-PROPOS ... XII Structure du mémoire doctoral ... XII
CHAPITRE 1 : INTRODUCTION GÉNÉRALE ... 1
Présentation clinique de la maladie de Parkinson ... 2
Diagnostic ... 2 Symptômes moteurs ... 2 Symptômes non-moteurs ... 3 Neuropathologie de la MP ... 9 Corps de Lewy ... 10 Dégénérescences neurofibrillaires ... 11
Altérations neurochimiques dans la MP ... 12
Dopamine (DA) ... 12 Acétylcholine (ACh) ... 13 Noradrénaline (NA) ... 13 Sérotonine (5-HT) ... 13 Glutamate et GABA ... 14 Interventions pharmacologiques ... 14 Traitements nootropes ... 15
Traitements pro-dopaminergiques (Pro-DA) ... 16
Objectifs de la recension ... 21 CHAPITRE 2 : ARTICLE ... 22 Abstract ... 23 Résumé ... 24 Introduction ... 25 Method ... 26
V
Article selection and data extraction... 26
Statistical analysis ... 27 Results ... 27 Levodopa ... 27 Pramipexole ... 30 Selegiline... 31 Rasagiline ... 32 Discussion ... 33
Psychometric qualities of the cognitive tests ... 36
Limitations ... 36 Future research ... 37 Clinical implications ... 38 Acknowledgments ... 39 References ... 40 Tables ... 51 Figures ... 72
CHAPITRE 3 : DISCUSSION GÉNÉRALE ... 73
Effets des antiparkinsoniens sur le fonctionnement cognitif ... 73
Levodopa ... 74
Pramipexole ... 77
Sélégiline... 79
Rasagiline ... 81
Limites et forces du mémoire doctoral ... 83
Implications des résultats et recommandations ... 87
Recommandations pour les recherches futures ... 87
Implications cliniques ... 90 Conclusion ... 91 Références ... 92 Annexes ... 114 Annexe A ... 114 Annexe B ... 116 Annexe C ... 117 Annexe D ... 119
VI
LISTE DES TABLEAUX
Table 1: Search strategy and keywords used in the MEDLINE, EMBASE, PsychNET and EBSCO
databases ... 51
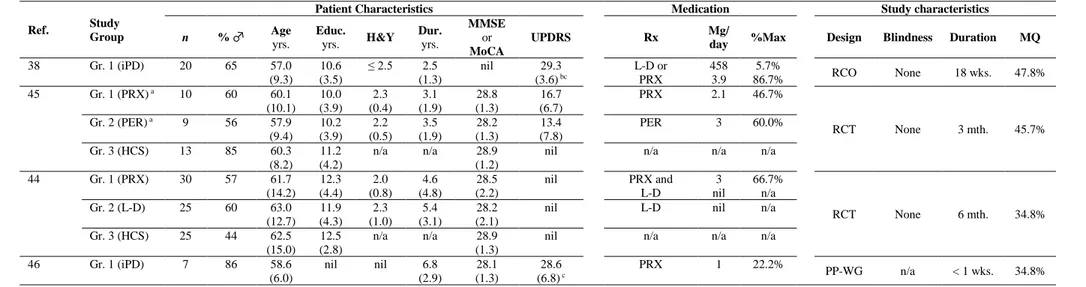
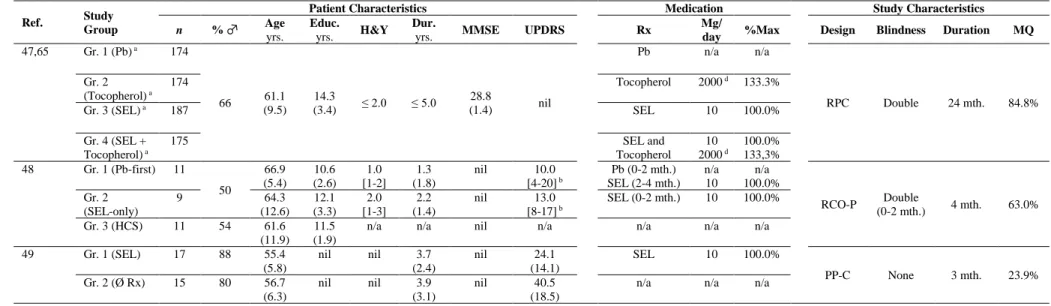
Table 2a: Characteristics of Participants and Medications in Studies on the Effects of Levodopa on Cognition ... 53
Table 2b: Characteristics of Participants and Medications in Studies on the Effects of Pramipexole on Cognition ... 54
Table 2c: Characteristics of Participants and Medications in Studies on the Effects of Selegiline on Cognition ... 55
Table 2d: Characteristics of Participants and Tested Medications in Studies on the Effects of Rasagiline on Cognition ... 56
Table 3: Cognitive Measures of Efficacy ... 57
Table 4a: Effects of Levodopa on Cognitive Outcome Measures ... 65
Table 4b: Effects of Pramipexole on Cognitive Outcome Measures ... 68
Table 4c: Effects of Selegiline on Cognitive Outcome Measures... 69
Table 4d: Effects of Rasagiline on Cognitive Outcome Measures ... 71
Tableau 1 : Critères diagnostiques de la maladie de Parkinson idiopathique selon la QSBB et la NINDS ... 114
VII
LISTE DES FIGURES
Figure 1 : Flowchart of the different phases of selection for the systematic review ... 72 Figure 1 : Représentation des circuits fronto-striataux, de la progression de la déplétion
dopaminergique dans chacun d'eux et des conséquences sur le fonctionnement cognitif. ... 116 Figure 2 : Sommaire comparatif des effets des différentes médications étudiées en fonction de chaque
VIII
LISTE DES ABRÉVIATIONS
5-HT : 5-hydroxytryptamine (Sérotonine) ACh : Acétylcholine
APA : American Psychological Association ARoC : Annual Rate of Change
BSRT : Buschke Selective Reminding Test
CCDAN : Cochrane Collaboration Depression, Anxiety and Neurosis Review CdL : Corps de Lewy
COMT : Catéchol-O-méthyltransférase
COWAT : Controlled Oral Word Association Test CPhA : Canadian Pharmacists Association CVLT: California Verbal Learning Test DA : Dopamine
DATATOP : Deprenyl and tocopherol antioxidative therapy of parkinsonism DDCI : Dopa-Decarboxylase Inhibitors
DLPFC : Dorso-Lateral Prefrontal Cortex DNF : Dégénérescences Neurofribrillaires DOT-A : Digit Ordering Test
DSM : Diagnostic and Statistical Manual of mental disorders FTT : Finger Tapping Test
GABA : Gamma-Aminobutyric Acid H&Y : Hoehn & Yahr
IAChE : Inhibiteur de l’Acétylcholinestérase IMAO : Inhibiteur de la Monoamine Oxydase L-D/L-DOPA : Levodopa
L-D+DDCI : Levodopa and concomitant Dopa-Decarboxylase Inhibitor MA : Maladie d’Alzheimer
MAO : Monoamine Oxydase MCI : Mild Cognitive Impairment MDS : Movement Disorders Society MMSE : Mini-Mental State Examination MoCA : Montréal Cognitive Assessment MP : Maladie de Parkinson
IX MP-D : Maladie de Parkinson avec Démence
MP-TCL : Maladie de Parkinson avec Trouble Cognitif Léger MQ : Methodological Quality
mWCST : Modified Wisconsin Card Sorting Test NA : Noradrénaline
NINDS : National Institute of Neurological Disorders and Strokes NMDA : N-Methyl-D-Aspartate
OFC : Orbitofrontal Cortex OMO : Odd Man Out Pb : Placebo
PD : Parkinson’s Disease
PD-MCI : Parkinson’s disease with Mild Cognitive Impairment PDD : Parkinson’s Disease Dementia
PGIMS : PGI Memory Scale
PPMI : Parkinson’s Progression Markers Initiative PRX : Pramipexole
QM : Qualité Méthodologique QSBB : Queen Square Brain Banq RAS : Rasagiline
RAVLT : Rey Auditory Verbal Learning Test RBMT : Rivermead Behavioral Memory Test RCT : Randomised Controlled Trial
ROCFT : Rey-Osterrieth Complex Figure Test ROT : Rod Orientation Test
RPM : Raven’s Progressive Matrices SDMT : Symbol-Digit Modalities Test SEL : Sélégiline
TCL : Trouble Cognitif Léger TMT : Trail Making Test
X
REMERCIEMENTS
Je souhaite avant tout exprimer ma gratitude envers celle sans qui ce projet n’aurait tout simplement pas pu arriver à terme ; Martine Simard. Ses années d’expérience ont indéniablement transparu dans la grande compétence avec laquelle elle a exercé son rôle de directrice de recherche. Toutefois, je n’aurais pu être aussi reconnaissant sans la patience, la bienveillance, la chaleur, la disponibilité, le tact et le respect dont elle a fait preuve tout au long de ces quatre années de travail. Merci pour les nombreux conseils et bons mots bien placés qui m’ont maintes fois sorti des états de découragement ou de stress dans lesquels j’ai tendance à m’embourber. Merci également pour les opportunités présentées, que ce soit par des contrats d’auxiliaire ou pour les encouragements à publier mon projet et présenter ses résultats à l’étranger. Mon parcours doctoral arrivant à sa fin, j’ai la conviction que sa participation n’aura pas su que bonifier mon projet de recherche, mais m’aura aidé à développer un sens critique aiguisé et de nombreuses connaissances en lien avec une population qui me tient à cœur ; des atouts que je juge indispensables pour un futur neuropsychogue clinicien.
Un autre acteur clé dans la réussite de ce projet qui mérite nombre d’éloges a été Maxime Doiron, second auteur de l’article. Son expérience de recherche, notamment en ce qui a trait à la maladie de Parkinson, de même que sa patience et sa rigueur ont tous contribué à bonifier la qualité de ce projet de façon inestimable. Merci de t’être rendu disponible à de nombreuses reprises malgré les multiples engagements et échéances serrées que tu avais à gérer.
Mes remerciements vont également à Jessica Talon-Croteau, troisième auteur de l’article. Ta contribution a été précieuse pour me permettre de terminer cet ambitieux projet dans les temps prévus.
Je tiens également à témoigner ma reconnaissance au Dr Nicolas Dupré, membre de mon comité d’encadrement. Son expérience clinique a été d’une grande valeur pour assurer une bonne adéquation entre les objectifs de recherche et les objectifs cliniques visés par ce projet. Ses nombreux conseils auront indéniablement permis d’hausser significativement la qualité et la pertinence de ce projet de recherche pour les cliniciens qui pourraient le consulter.
Merci à Ariane, Marianne, Marika, Laila, Éva, Élodie, et tout particulièrement à Valérie, qui ont su me prêter main forte à des moments où la montagne paraissait impossible à gravir.
Dans la réalisation d’un projet de cette envergure, il est impossible de quantifier à quel point le support moral est fondamental. Papa, maman, merci pour les encouragements, les tapes dans le dos, l’écoute, la patience, la confiance et l’amour inconditionnel dont vous avez fait preuve. Audrey, merci de m’avoir accompagné au cours de ce long périple. Merci d’avoir été par moments compréhensive et patiente, par
XI
moments ricaneuse et taquine et même par moments découragée ou révoltée avec moi, mais surtout d’avoir su rester toujours aimante et toujours là pour me tenir la main dans la tempête.
XII
AVANT-PROPOS
Structure du mémoire doctoral
Le présent mémoire doctoral a été rédigé sous une structure dite « sur article » qui comporte trois chapitres. Le chapitre 1 renferme l’Introduction générale du mémoire, qui a pour objectif de situer le projet de recherche dans le contexte scientifique qui y est associé. Le chapitre 2 consiste en l’article scientifique qui a été rédigé suite au projet de recherche associé à ce mémoire doctoral. L’article présenté consiste en une revue systématique de la littérature de nature quantitative qui aborde les effets des principales médications antiparkinsoniennes sur le fonctionnement cognitif de patients en stade léger-modéré de maladie Parkinson présentant ou non un trouble cognitif léger. Une description détaillée de la méthodologie utilisée ainsi que des résultats obtenus y sont notamment présentés. Finalement, le chapitre 3 constitue la Discussion générale du mémoire, qui a permis d’explorer et d’approfondir davantage les réflexions ayant découlé des résultats rapportés au chapitre 2.
La rédaction des trois chapitres a été assurée par l’auteur du présent mémoire doctoral. Plus spécifiquement, il a pris part aux processus de définition de la problématique, d’élaboration des objectifs de recherche, de collecte et d’analyse des données, ainsi que d’interprétation des résultats. Les quatre co-auteurs de l’article scientifique ont fourni une contribution intellectuelle légitimant leur affiliation à cette publication. Les deuxième et troisième auteurs ont principalement contribué au processus de collecte de données, notamment afin d’en assurer un haut standard de qualité. Les quatrième et cinquième auteurs ont fourni un apport intellectuel inestimable à travers les nombreuses révisions complétées et suggestions apportées.
L’article présenté au chapitre 2 de ce mémoire doctoral est en préparation pour soumission à la revue scientifique Movement Disorders. Conséquemment, celui-ci a été rédigé en anglais et son format suit les règles de rédaction exigées par la revue. Les chapitres 1 et 3 du mémoire ont été rédigés en français, conformément à la politique de la Faculté des Études Supérieures et Postdocorales (FESP) de l’Université Laval concernant l’insertion d’articles rédigés dans une autre langue que le français dans un mémoire ou une thèse. Leur format respecte les normes de rédaction et de présentation de la FESP, de même que les normes en vigueur à l’École de psychologie de l’Université Laval concernant les citations et références, soit celles de l’American Psychological Association (APA).
1
CHAPITRE 1 : INTRODUCTION GÉNÉRALE
La maladie de Parkinson (MP) est la deuxième maladie neurodégénérative en importance après la maladie d'Alzheimer (MA) chez les personnes âgées de 65 ans et plus (Hirtz et al., 2007; Jellinger et Attems, 2015]). Elle touche 6,3 millions de personnes mondialement (Galvagnion & Buell, 2015), dont environ 67 500 au Canada (Wong, Gilmour & Ramage-Morin, 2014). Son incidence croît avec l'âge. En effet, une grande proportion des patients MP sont âgés de 65 ans et plus, soit 79% des patients MP qui habitent dans des maisons privées et 97% des patients MP qui habitent dans des résidences de soins longue durée (Wong et al., 2014). Les projections suggèrent que d'ici 2030, cette tranche d'âge croîtra au point où la prévalence mondiale de MP passera à 8,67 millions (Dorsey et al., 2007). D'abord une pathologie motrice, la MP atteint aussi la cognition. Le trouble cognitif léger et la démence y sont diagnostiqués dans environ 40% à 50% (Aarsland et al., 2009; 2010; Dujardin et al., 2010; Nazem et al., 2009; Riedel et al., 2008) et 15% à 30% (Aarsland, Zaccai & Brayne, 2005) des cas, respectivement.
Par ses atteintes motrices, psychologiques, comportementales et cognitives, la MP affecte lourdement le quotidien des personnes touchées, leur entourage et la société. Les coûts socio-économiques y étant reliés s'élevaient à 446,9 millions de dollars au Canada en 2000-2001 et ne cesseront de s'alourdir étant donné le vieillissement démographique (Tator et al., 2007). La MP étant incurable, les traitements antiparkinsoniens actuels visent surtout à pallier à ses symptômes moteurs et à ralentir sa progression. Mieux comprendre leur effet global et, plus précisément, leurs effets sur certains symptômes qu'ils ne ciblent pas en priorité, tels les symptômes cognitifs, permettrait une meilleure gestion des soins et de la médication des patients par l'équipe traitante. En effet, ces informations pourraient être un support important aux clinicien lors des décisions concernant la prise d'antiparkinsoniens, pouvant ainsi contribuer au maintien de l'autonomie des patients.
L'objectif du mémoire doctoral sera donc d'évaluer les effets des principaux traitements antiparkinsoniens pro-dopaminergiques (la Levodopa, les agonistes dopaminergiques et les inhibiteurs de la monoamine-oxydase B [IMAO-B]) sur la cognition dans la maladie de Parkinson idiopathique par l'entremise d'une recension systématique des écrits.
Ce premier chapitre sera consacré à présenter la MP et ses traitements pharmacologiques. Le profil clinique et les aspects neurobiologiques de la maladie seront d'abord abordés afin de rappeler le contexte dans lequel agissent ces traitements. Suivront ensuite un descriptif des principales médications d'intérêt, des mécanismes d'action sous-tendant leurs effets, puis de la justification du choix des molécules à l'étude. Une présentation des objectifs de la recension viendra clore ce chapitre.
2
Présentation clinique de la maladie de Parkinson
Diagnostic
Il n'existe aucun test diagnostique ou biomarqueur suffisamment fiable pour confirmer avec certitude la présence de la MP avant le décès. Son diagnostic est donc clinique; il repose sur une combinaison de facteurs observés ou rapportés. Plusieurs auteurs ont défini des ensembles de critères pour le diagnostic de la MP et tous se basent sur sa symptomatologie motrice. Les critères les plus utilisés et validés actuellement sont ceux de la Queen Square Brain Bank (QSBB) (Gibb & Lees, 1988) et ceux de la National Institute of Neurological Disorders and Stroke (NINDS) (Gelb, Oliver & Gillman, 1999). Pour une description détaillée des critères, voir l'annexe A. Chaque ensemble comporte ses particularités, mais ils partagent surtout plusieurs points communs. Un diagnostic de MP requiert 1) une combinaison de ses symptômes moteurs cardinaux; 2) l'exclusion des autres causes connues de ces symptômes; et 3) l'existence d'autres manifestations supportant la présence de la pathologie.
De nouveaux critères diagnostiques pour la MP ont été développés au cours des dernières années par la Movement Disorders Society (MDS; Postuma et al., 2015). Ces nouveaux critères sont le résultat des nombreuses avancées scientifiques ayant eu lieu au cours des 20 dernières années, concernant notamment l'identification de l'alpha-synucléine et l'importance des symptômes non-moteurs dans la maladie. Publiés en octobre 2015, ils ont comme objectifs principaux la standardisation de la définition utilisée dans le cadre de la recherche clinique, en plus de faciliter le processus diagnostique, notamment pour les neurologues moins expérimentés en troubles du mouvement. La structure de ces critères en trois catégories (comme décrit ci-haut) demeure semblable aux précédents, bien que le contenu de ces catégories se distingue, notamment par 1) l'exclusion de l'instabilité posturale comme l'un des symptômes cardinaux ; 2) le retrait de la démence comme critère d'exclusion de la MP ; et 3) une importance accrue de la chronologie et du moment d'apparition des symptômes. Pour plus de détails, voir l'annexe A.
Bien que ces critères aient été considérés, ils ne seront pas utilisés dans le cadre du présent projet de recherche. En effet, puisque la période couverte par la présente recension précède la date de publication de ces nouveaux critères, aucun des articles publiés dans cette période ne les aura employés.
Symptômes moteurs
La MP compte quatre symptômes moteurs cardinaux : la bradykinésie, l'hypertonie musculaire, les tremblements au repos et l'instabilité posturale. Ces symptômes peuvent se manifester par une démarche traînante, à petits pas, sans balancement des bras ; une écriture micrographique ; une voix faible et monocorde ; de la difficulté avec les activités de la vie quotidienne (s'habiller, se laver) ; une rigidité de l'expression faciale
3
; une posture fléchie et le phénomène de la rigidité à roue dentelée (Lees, 2009). Les tremblements au repos atteignent majoritairement les extrémités des membres supérieurs et inférieurs, ainsi que le menton parfois. Ces tremblements s'apparentent à un mouvement d'émiettement, à raison de 4 à 6 cycles par seconde. Ils sont favorisés au cours d'efforts intellectuels ou de situations de stress et disparaissent lors des mouvements volontaires ou durant le sommeil. L'instabilité posturale entraîne quant à elle un risque plus élevé de chutes. Cela crée une crainte croissante de se blesser chez le patient, l'amenant ainsi à diminuer ses déplacements et ses activités physiques.
La MP étant une maladie neurodégénérative, ses symptômes apparaissent de manière progressive. Hoehn et Yahr ont développé en 1967 (Hoehn & Yahr, 1967) une échelle d'évaluation des symptômes moteurs comprenant cinq stades. Celle-ci a été modifiée dans les années 1990 pour y ajouter deux stades intermédiaires (Goetz et al., 2004). Au stade 1, les symptômes sont unilatéraux. Des atteintes axiales s'ajoutent ensuite et définissent le stade 1,5. Le stade 2 est quant à lui caractérisé par des manifestations bilatérales sans difficulté d'équilibre. Au stade 2,5 la maladie est toujours considérée légère et on observe un bon rétablissement au test de la poussée. Le stade 3 est marqué par l'apparition d'instabilité posturale restreignant le fonctionnement du patient, qui reste toutefois physiquement autonome. La sévérité de la maladie est alors considérée légère à modérée. Au stade 4, les difficultés fonctionnelles sont sévères, mais le patient est toujours en mesure de marcher ou de se tenir debout sans aide, bien que l’usage d’une canne ou d’un déambulateur soit relativement commun à ce stade. Finalement, une personne est considérée au stade 5 si elle doit se déplacer en fauteuil roulant ou être alitée quand elle ne peut être aidée.
Symptômes non-moteurs
Tel que mentionné précédemment, la MP est d'abord une pathologie motrice et son diagnostic est basé sur la présence des symptômes de cette nature. Toutefois, elle entraîne également une vaste gamme de symptômes non-moteurs. Ceux-ci se présentent chez une large proportion de patients, peuvent même précéder l'apparition des symptômes moteurs, et contribuent fortement à alourdir le fardeau de la maladie (Bonnet & Czernecki, 2013). Dans le cadre du traitement des symptômes moteurs, les molécules administrées peuvent avoir des effets sur la remédiation, mais aussi sur l'apparition et la sévérité des symptômes non-moteurs (Bonnet & Czernecki, 2013; Lee & Koh, 2015; Müller et al., 2013). Les prochains paragraphes aborderont d'abord brièvement les symptômes non-moteurs les plus fréquemment rencontrés dans la maladie pour dresser un portrait clinique plus complet de la MP. La relation entre les antiparkinsoniens et les symptômes non moteurs sera également discutée afin de mieux cerner l'étendue des effets de ces molécules. Enfin, une des familles des symptômes non moteurs sera décrite plus en détails dans l'optique de situer plus précisément la problématique sur laquelle portera le projet de recherche.
4 Symptômes psychologiques et comportementaux
Parmi les symptômes psychologiques et comportementaux, le plus fréquent est la dépression, qui touche 30 à 50% des patients (Tan, 2012). Elle n'est pas toujours reconnue, car ses manifestations peuvent être confondues avec l'akinésie, mais aussi avec l'apathie ou l'anxiété, qui sont les symptômes les plus prévalents après la dépression (Bonnet & Czernecki, 2013). Parmi les autres symptômes psychologiques et comportementaux, la MP peut également être marquée par des difficultés de sommeil, de la fatigue, des hallucinations, surtout visuelles, et des troubles du contrôle des impulsions (Arnulf et al., 2015; Bonnet & Czernecki, 2013; Chaudhuri, Odin, Antonini, & Martinez-Martin 2011). D'ailleurs, les troubles du contrôle des impulsions font partie des troubles du comportement pouvant se développer à la suite de la prise de médication dopaminergique. En effet, leur utilisation peut conduire à un syndrome de dysrégulation dopaminergique, que l'on définit comme une utilisation compulsive de ces médications par le malade, associée au développement de certains troubles comportementaux pouvant venir altérer son fonctionnement (Weintraub et al., 2010). Ce désir d'obtenir la médication, injustifié par l'existence ou l'ampleur de la symptomatologie motrice, conduit à une surdose dopaminergique associée au développement de différents troubles de l'humeur (e.g. état maniaque) ou du contrôle des impulsions (e.g. jeu pathologique). Il importe donc de tenir compte de ce type de conséquences lors du choix et de la gestion de la médication antiparkinsonienne.
Symptômes autonomes et sensitifs
Les patients MP présentent aussi fréquemment des troubles dysautonomiques et des troubles sensitifs (Bonnet & Czernecki, 2013). Les troubles dysautonomiques se démarquent par leur variété, pouvant se présenter sous diverses formes, incluant notamment l'hypotension orthostatique, la tachycardie, les nausées, la constipation, la dysphagie, la bouche sèche, l'hypersalivation, l'hypersudation, l'hyperthermie et la rétention urinaire (Bonnet & Czernecki, 2013). Ces symptômes prennent une place importante dans la vie des patients atteints de MP et ont conséquemment souvent une influence sur le choix des traitements prescrits. La relation entre ces symptômes et la médication est bidirectionnelle, le clinicien devant à la fois considérer les symptômes dysautonomiques présents susceptibles d'être mieux gérés avec certaines médications, ainsi que les symptômes pouvant apparaître ou être amplifiés par celles-ci. Les résultats de Müller et ses collaborateurs (2013) illustrent bien ces effets différentiels de la médication. Après un an de traitement dopaminergique, la constipation et l'hypotension orthostatique s'étaient amplifiées, alors que la dysphagie s'était améliorée.
Symptômes cognitifs
Les problématiques mentionnées ci-haut ne sont pas les seules catégories de symptômes non-moteurs dans la MP. En effet, des dysfonctions cognitives sont également rapportées, et ce même chez les patients nouvellement diagnostiqués (Yarnall et al., 2014). Elles se présentent sous forme de trouble cognitif léger (TCL) en début de maladie et peuvent évoluer jusqu'à la démence dans les stades plus avancés (Muslimović, Post, Speelman, De Haan & Schmand, 2009). À l'image d'autres catégories de symptômes non moteurs, les
5
dysfonctions cognitives peuvent elles aussi être affectées par les traitements antiparkinsoniens (Poletti & Bonuccelli, 2013). Il est donc dans l'intérêt des patients de les considérer adéquatement lors des décisions cliniques en lien avec ces médications. Les prochains paragraphes aborderont d’abord la définition et le diagnostic du TCL, puis les profils d'atteintes cognitives typiques dans la MP, pour finir avec les enjeux méthodologiques associés à la recherche sur les troubles cognitifs dans la MP.
Trouble cognitif léger dans la MP
Le TCL se définit en général comme un état impliquant le déclin d'une ou plusieurs fonction(s) cognitive(s) sans entraîner d'altération significative du fonctionnement quotidien (Petersen, 2004). Bien que tous les TCL n'évoluent pas vers une démence, ce trouble représente chez plusieurs patients un état transitionnel entre un fonctionnement cognitif normal et un syndrome démentiel (Litvan et al., 2012). Petersen (2004) propose quatre sous-types de TCL, qui sont divisés en fonction du nombre de domaines cognitifs touchés et de la présence ou non d'une atteinte mnésique. Il décrit le TCL à domaine unique amnésique ou non-amnésique, ainsi que le TCL à domaines multiples, lui aussi amnésique ou non. Les deux sous-types où la mémoire est touchée risquent davantage d'évoluer vers une démence de type Alzheimer. Or, ceux affectant d'autres domaines (fonctions exécutives, visuo-spatiales, etc.) évolueraient plus souvent vers des démences d'autres types, telles que la démence à corps de Lewy ou la démence parkinsonienne. En somme, le TCL est un concept d’importance ; il permet d'étudier la pathogenèse du déclin cognitif, d'intervenir précocement pour prévenir ce dernier, en plus d'aider à prédire vers quel type de démence le patient pourrait évoluer (Yarnall, Rochester & Burn, 2013; Petersen, 2004).
Le concept du TCL dans la Maladie de Parkinson (MP-TCL) a reçu un intérêt grandissant dans les dernières années. Plusieurs constats émergents peuvent être à l'origine de ce gain d'intérêt : 1) Aussi tôt qu'au moment du diagnostic de MP, jusqu'à 30% des patients présentent au moins des altérations cognitives mineures (Aarsland, Bronnick, Larsen, Tysnes & Alves, 2009; Aarsland et al., 2010; Muslimovic, Post, Speelman & Schmand, 2005) : 2) Les altérations cognitives dans la MP sont des prédicteurs de la MP-D, avec un taux annuel de transition du MP-TCL à la MP-D d'en moyenne 11% (Hobson & Meara, 2015), bien que la relation entre l'apparition de ces symptômes et le moment de la transition demeure nébuleuse, avec dans certains cas une transition très rapide, et dans d'autres une stabilité de l'état pendant plusieurs années (Hely, Reid, Adena, Halliday & Morris, 2008) : 3) Les altérations cognitives chez les patients MP sans démence sont associées à de nombreuses conséquences, telles des difficultés à accomplir les activités de la vie quotidienne, une augmentation des coûts socio-économiques, une diminution de la qualité de vie des patients, ainsi qu'une augmentation du fardeau des aidants et de la dépression chez ceux-ci (Aarsland et al., 2010; Rosenthal et al., 2010; Leroi, McDonald, Pantula & Harbishettar, 2012; Yarnall, Rochester & Burn, 2013; Carter, Stewart, Lyons & Archbold, 2008). La contribution des symptômes cognitifs à l'altération de la qualité de vie des patients, ainsi
6
que sur le fardeau et la dépression des aidants, serait même supérieure à celle des symptômes moteurs (Carter et al., 2008).
En 2012, la Movement Disorder Society (MDS) a défini le premier ensemble de critères diagnostiques pour la MP-TCL (Litvan et al., 2012). Ceux-ci sont basés sur les critères du TCL de Petersen (2004), qui avaient été définis en relation avec la MA, et ils sont adaptés pour tenir compte des enjeux spécifiques à la MP. Ils proposent deux niveaux de confiance du diagnostic en fonction de l'exhaustivité de l'évaluation cognitive réalisée. Selon ces critères, le diagnostic de MP-TCL nécessite les aspects suivants : 1) un diagnostic de MP préétabli ; 2) un déclin cognitif graduel au début insidieux ; 3) des déficits cognitifs, objectivés par une échelle d'évaluation globale de la cognition (Niveau I) ou par une évaluation neuropsychologique formelle (Niveau II) ; et 4) que ces déficits n'altèrent pas significativement l'indépendance fonctionnelle. De plus, la démence et les autres explications possibles des déficits cognitifs observés doivent être exclues.
Bien qu'en moyenne le taux de transition de la MP-TCL vers la MP-D soit de 11% (Hobson & Meara, 2015), plusieurs auteurs rapportent que le risque de développer une démence varie selon le profil d'atteintes cognitives observé (Di Battista et al., 2015; Janvin et al., 2006), justifiant l'importance de s'intéresser à ce sujet. Chez la plupart des patients nouvellement diagnostiqués et non-médicamentés (de novo), on retrouve au premier plan un syndrome dysexécutif dorso-latéral (ou fronto-sous-cortical dorso-latéral), marqué par des déficits exécutifs et attentionnels complexes, notamment au niveau des capacités de planification, de contrôle attentionnel, de flexibilité mentale, d’inhibition, de même qu'en mémoire de travail (Godefroy et al., 2010; Matteau, Dupré, Langlois, Provencher & Simard, 2012; Pfeiffer, Løkkegaard, Zoetmulder, Friberg, & Werdelin, 2014; Williams-Gray et al., 2009). Des déficits en mémoire épisodique peuvent aussi se présenter en début de maladie (Muslimović et al., 2009; Pfeiffer et al., 2014; Yarnall et al., 2014) et pourraient en partie s'expliquer par les atteintes exécutives (Brønnick, Alves, Aarsland, Tysnes & Larsen, 2011). De subtiles difficultés exécutives seraient même perceptibles chez les patients avec TCL à domaine unique amnésique, suggérant que des dysfonctions exécutives pourraient toujours être présentes à un certain degré chez les MP-TCL (Petrova, Raycheva, Zhelev & Traykov, 2010). Bien que les déficits de type fronto-sous-cortical soient les plus prévalents, des altérations des fonctions visuospatiales/visuoconstructives, de la mémoire épisodique et du langage sont observés chez jusqu'à 50% des patients MP sans démence (Caviness et al., 2007; Matteau et al., 2012; Muslimovic et al., 2005; Pfeiffer et al., 2014). Parmi eux, environ 20% du total des patients présentent des altérations cognitives associées à des processus plus typiquement qualifiés de «postérieurs-corticaux» tels que les praxies de construction et l'encodage en mémoire épisodique; dysfonctions plus fréquemment rencontrées dans la MA (Kulisevsky & Pagonabarraga, 2009; Muslimovic et al., 2005; Pagonabarraga & Kulisevsky, 2012; Williams-Gray et al., 2009). L'apparition de ce type d'altérations serait plutôt abrupte et rapide, contrairement aux altérations dites fonto-sous-corticales, qui présenteraient un déclin plus linéaire et lent (Aarlsand et al., 2011;
7
Pagonabarraga et al., 2008). Ces particularités amènent certains auteurs à formuler l'hypothèse que la transition vers la MP-D serait caractérisée par ce type d'altérations (Aarsland, Andersen, Larsen Lalk & Kragh-Sorensen, 2003; Aarsland, Muniz & Matthews, 2011; Di Battista et al., 2015; Kulisevsky et al., 2009; Williams-Gray et al., 2009).
Avec cette variété d'altérations possibles, il va sans dire que le profil d'atteintes cognitives est hétérogène dans la MP-TCL. Même la prévalence de ce diagnostic varie considérablement dans la littérature, les estimations passant de 18,5% à 52% selon les études (pour une revue, voir Martinez-Horta & Kulisevsky, 2015). Cela est aussi vrai pour les différents sous-types de TCL chez les patients MP, comme peuvent le témoigner ces estimations de prévalence: 1) non-amnésique à domaine unique : 11,3% à 47,7%; 2) amnésique à domaines multiples: 4,8% à 30,5%; 3) amnésique à domaine unique 6,4% à 24,3%; et 4) non-amnésique à domaines multiples: 1,3% à 23,4% (Muslimovic et al., 2005; Caviness et al., 2007; Aarsland et al., 2009; Aarsland et al., 2010; Litvan et al., 2011; Goldman et al., 2012; Yu et al., 2012; Matteau et al., 2012; Kalbe et al., 2016).
Cette hétérogénéité peut en partie s'expliquer par des variabilités méthodologiques entre les différentes études, celles-ci compliquant par le fait même le processus de recension des écrits concernant les patients souffrant de dysfonctions cognitives dans la MP. La majorité des études à ce sujet incluent des patients déjà sous médication antiparkinsonienne, recevant parfois également différents psychotropes, et qui se situent dans des stades plus ou moins avancés de la maladie. L'évolution vers ces stades est associée à la détérioration des fonctions motrices et cognitives, ainsi qu'à une plus grande prévalence de troubles comorbides et de démence (Muslimović et al., 2009; Emre et al., 2007). Il est donc compréhensible que les participants à ces stades soient plus nombreux à recevoir un ou plusieurs type(s) de médication. Cette situation peut compliquer la mise en place d’une méthodologie pour isoler l'effet d’une seule médication sur la cognition. Par ailleurs, avant 2012, il n’existait pas de définition opérationnelle spécifiquement pour la MP-TCL. En conséquence, la définition d’un trouble cognitif léger dans le cadre de la MP dans les années précédant 2012 varie de manière importante entre les études. Une variété de tests des fonctions cognitives globales ou des tests de différents domaines cognitifs sont utilisés et diffèrent d’une étude à l’autre, tandis que parfois un seul test cognitif est administré. Les seuils psychométriques définissant un déficit diffèrent également d'une étude à l'autre (Liepelt-Scarfone et al., 2011; Yarnall et al., 2014).
De plus, l'exclusion des patients MP-D repose souvent sur leur performance au MMSE1. La sensibilité
de cet outil est faible pour la MP-D (Hoops et al., 2009; Riedel et al., 2008) et les seuils utilisés pour son
1 Mini-Mental State Examination; un outil d'évaluation de la cognition globale (Folstein, Folstein & McHugh,
8
diagnostic sont variables entre les études. Tout cela soulève un problème de diagnostic différentiel à l'étape de la composition des groupes MP-TCL. L’utilisation d’un seuil trop bas au MMSE fait encourir le risque d'inclure dans les échantillons d’études ciblant des TCL des participants souffrant possiblement d’une démence légère à modérée. Ce faisant, les études peuvent ainsi inclure des participants ayant des diagnostics cognitifs de différentes sévérités, ce qui altère la validité des profils rapportés. Pour ces raisons, les travaux incluant des patients atteints de MP-D ou utilisant un seuil diagnostic inférieur à 26 au MMSE, tel que recommandé par la MDS (Dubois et al., 2007), seront exclus de la recension. Nous nous concentrerons également sur les premiers stades de la MP, où la MP-D est moins prévalente et où il est possible pour les chercheurs de recruter des patients n'ayant pas encore débuté leur traitement aux antiparkinsoniens. De plus, il ne sera pas possible de ne sélectionner que les études recrutant exclusivement les patients MP-TCL, étant donné le caractère récent de sa définition et le fait que peu d'auteurs utilisent les outils nécessaires pour le distinguer correctement des patients cognitivement sains. Dans cette optique, les échantillons des études sélectionnées pourront être constitués à la fois de patients cognitivement sains et de patients MP-TCL, pourvu que la MP-D soit exclue selon les critères mentionnés ci-haut. La population cible de la recension sera donc, plus précisément, les patients se situant dans les stades léger à modéré de MP et étant soit cognitivement intacts ou présentant un TCL.
Au plan clinique, se concentrer sur cette population précise pour étudier les effets des antiparkinsoniens sur la cognition peut avoir des apports considérables. En effet, le moment du diagnostic de la MP et plus largement les premières phases de la maladie chez les patients cognitivement intacts ou présentant un TCL est une période où le choix de la médication antiparkinsonienne demeure à faire ou est relativement récent. À ce moment, les médecins responsables du suivi des patients MP peuvent bénéficier plus que jamais d'informations supplémentaires sur les effets cognitifs positifs et négatifs des antiparkinsoniens. Ces informations leur permettront de prendre une décision éclairée sur le traitement en tenant compte des effets de la médication sur les symptômes parmi les plus invalidants pour le patient, soit les symptômes moteurs et les symptômes cognitifs. Comme il est mentionné plus tôt, le déclin cognitif avec ou sans démence, parfois plus que la symptomatologie motrice, contribue à de nombreuses conséquences dans la vie du patient et de son entourage (Carter et al., 2008). D'ailleurs, pour ces raisons, Carter et ses collaborateurs (2008) recommandent de porter une attention d’une égale importance aux symptômes moteurs et cognitifs, ainsi qu’aux autres symptômes non moteurs, lors de l'évaluation du patient, de la discussion des symptômes avec le patient et sa famille, de même que lors du suivi du patient. Ainsi, connaître les effets potentiels des médications antiparkinsoniennes sur chacun des domaines cognitifs pourra inciter le clinicien à éviter de prescrire certaines molécules risquant d'accentuer les altérations cognitives du patient et les difficultés fonctionnelles qui en découleraient. Inversement, un clinicien pourra décider de prescrire une médication qui, outre des effets bénéfiques attendus sur le fonctionnement moteur, pourra aussi améliorer quelque peu certaines fonctions cognitives chez le patient. Le caractère
9
hétérogène des altérations motrices et cognitives dans la MP, sans oublier les autres symptômes non moteurs, oblige à adopter une approche très personnalisée du traitement.
Le tableau clinique présenté ci-haut s'explique vraisemblablement par une multitude de processus pathologiques en interaction. Comprendre ces processus est essentiel pour ensuite cerner les cibles thérapeutiques des médications antiparkinsoniennes et les façons avec lesquelles elles risquent d'affecter la cognition. Les prochaines sections aborderont donc d'abord les anomalies neuropathologiques et les altérations des systèmes neurochimiques retrouvées dans le cerveau des patients MP. Ensuite, les mécanismes d'action de la grande variété d'antiparkinsoniens utilisés en clinique actuellement seront présentés et discutés plus en détails.
Neuropathologie de la MP
La maladie de parkinson idiopathique est une pathologie dégénérative de la famille des synucléinopathies, associée à des lésions multifocales du système nerveux central, autonome et périphérique (Djaldetti, Lev & Melamed, 2009; Wakabayashi, Mori, Tanji, Orimo & Takahashi, 2010). Plusieurs hypothèses ont été avancées quant à son étiologie, suggérant notamment des origines infectieuses (Hawkes, Del Tredici & Braak, 2007), endocriniennes (Willis, 2008) ou génétiques (Houlden & Singleton, 2012), mais sa cause exacte demeure encore inconnue. Les travaux en génétique ont révélé que des mutations de certains gènes, tels SNCA, PARK2, LRRK2, PINK1 ou ATP13A22 causaient une forme rare de MP, dite familiale. Concernant sa
forme idiopathique (ou sporadique), sur laquelle le mémoire portera, les associations sont plus incertaines (pour une revue, voir Houlden & Singleton, 2012). Le sujet des étiologies possibles de la MP ne sera cependant pas développé davantage dans le présent document, puisqu'il ne fait pas partie des objectifs et thèmes abordés par le mémoire doctoral.
Au niveau des processus pathologiques, la dégénérescence des neurones dopaminergiques de la substance noire pars compacta et la présence de corps de Lewy (CdL) intra-neuronaux sont reconnus comme des éléments centraux de la MP (Lees, Hardy & Revesz, 2009; Aarsland, Brønnick & Fladby, 2011). Toutefois, d'autres populations cellulaires sont vulnérables au cours de la maladie, dont celles du noyau dorsal du nerf vague, du locus cœruleus, des noyaux du raphé et du noyau basal de Meynert (Damier, Hirsch, Agid & Graybiel, 1999; Cummings, 2003; Dickson et al., 2009). L'élément neuropathologique le plus souvent décrit dans la MP est la formation de CdL (Braak et al., 2003), mais plusieurs autres types d'anomalies sont observés, notamment les dégénérescences neurofibrillaires (DNF; Braak & Braak, 1990).
2 Produit de chaque gène : α-synucléine (SNCA), Parkin (PARK2), Pten-induced kinase 1 (PINK1), Leucine-rich
10
Corps de Lewy
Les CdL sont des inclusions cytoplasmiques présentes au niveau du corps cellulaire du neurone résultant de l'agrégation anormale de la protéine α-synucléine. Leur présence est associée à une perte neuronale importante dans la structure hôte (Forno, 1996; Lees, 2009). Dans la MP, les CdL se propagent le long des voies axonales connectant les régions cérébrales vulnérables selon une séquence prévisible, qui fut divisée en six stades par Braak et ses collaborateurs (2003). Au stade 1, les CdL se présentent d'abord au niveau du plexus de Meissner et du noyau olfactif, puis dans des régions spécifiques de la medulla oblongata. Ces structures étant entre autres impliquées dans l'olfaction et les fonctions autonomes, plusieurs auteurs avancent ainsi que les troubles olfactifs et dysautonomiques pourraient être les premières manifestations précliniques de la MP (Chaudhuri et al., 2011; Hoyles & Sharma, 2013). Les CdL progressent ensuite dorsalement pour atteindre le tegmentum pontique (stade 2) et le mésencéphale (stade 3), où se situent notamment les noyaux du raphé, la formation réticulée, le locus cœruleus et la substance noire pars compacta. C'est à partir du stade 3 que les premiers symptômes moteurs (liés aux lésions de la substance noire) et qu'une première tendance au déclin cognitif sont observables. Le stade 4 marque les premières atteintes corticales, restreintes au mésocortex temporal, qui inclut la région transentorhinale. Les lésions du mésocortex altèrent la communication entre le néocortex et les structures limbiques. Elles sont donc associées à l'aggravation du déclin cognitif observé au stade 4 (Braak, Rüb & Del Tredici, 2006). La pathologie atteint ensuite le néocortex, touchant d'abord sa région préfrontale et ses aires associatives (stade 5), puis ses aires prémotrices et sensorielles primaires (stade 6). À ces stades, le déclin cognitif est souvent sévère et la majorité des patients rencontrent le diagnostic de démence (Braak et al., 2006; Parkkinen, Pirttilä & Alafuzoff, 2008).
Peu de données existent quant aux bases neuropathologiques de la MP-TCL, mais, à l'image de sa présentation clinique, les constats sont hétérogènes (Jellinger, 2013). La majorité des patients qui ont été étudiés présentaient des CdL principalement au niveau du tronc cérébral, correspondant aux stades 2 et 3 de Braak. Une moins grande proportion en présentait également dans les structures limbiques (stades 3 et 4 de Braak), tandis que des cas plus rares en présentaient dans le néocortex (stades 5 et 6 de Braak) (Aarsland, Perry, Brown, Larsen & Ballard, 2005; Adler et al., 2010; Jellinger, 2010). Plus récemment, Skogseth et ses collaborateurs (2015) ont rapporté que la concentration d'α-synucléine dans le liquide céphalo-rachidien pourrait être associée à la présence d'altérations cognitives au stade léger de la MP. En effet, dans leur échantillon de 414 patients de novo, de plus faibles concentrations étaient associées à une performance réduite dans le domaine attentionnel/exécutif et à leur indice de cognition globale. D'autres biomarqueurs potentiellement intéressants pour la compréhension de la neuropathologie de la MP-TCL ont fait l'objet d'études récemment. Notamment, une plus grande quantité de lésions de la matière blanche pourrait être associée à l'intensité des altérations cognitives dans la MP avec ou sans démence (Veselý & Rektor, 2016) et une réduction du volume
11
du lobe temporal médian serait associée à de subtiles altérations en mémoire épisodique chez des patients MP sans TCL (Pirogovsky-Turk, Filoteo, Litvan & Harrington, 2015).
La MP-D est elle aussi hétérogène au plan neuropathologique, mais dans la plupart des cas, la progression des CdL atteint les régions limbiques et corticales (stades 4-5-6) (Irwin et al., 2012). Par contre, ce type de lésion n'est pas nécessairement associé à la MP-D, puisqu'une présence de CdL corticaux peut être détectée chez des patients MP sans signe de démence (Colosimo, Hughes, Kilford & Lees, 2003; Parkkinen et al., 2008).
Dégénérescences neurofibrillaires
Les DNF sont des agrégats de protéine tau hyperphosphorylée caractérisés par la présence de neurofilaments anormaux au niveau du corps cellulaire et des dendrites du neurone. Bien qu'elles soient plus connues pour leur rôle dans la MA, il est bien établi que les DNF font partie des anomalies retrouvées dans la MP (Lewy, 1913; Braak & Braak, 1990). Chez les patients non-déments, ces anomalies sont surtout retrouvées au niveau du cortex entorhinal, alors que dans la MP-D, elles sont aussi observées dans le reste de la formation hippocampique, dans le gyrus fusiforme, et dans le néocortex temporal latéral (Compta et al., 2011).
La contribution des DNF quant au déclin cognitif dans la MP reste matière à débat. Certaines études rapportent une relation entre leur distribution cérébrale et la démence parkinsonienne (Hurtig et al., 2000; Irwin et al., 2012), tandis que d’autres résultats décrivent plutôt un rôle conjoint de la DNF et des plaques séniles, plus important que celui des CdL dans la MP-D (Jellinger, 2008; Williams-Gray et al., 2009; Weintraub et al., 2012). Toutefois, les CdL et les DNF semblent interreliés; l'accumulation de l'une des deux protéines les constituant (α-synucléine ou tau) semble accentuer l'agrégation de l'autre (Badiola et al., 2011; Waxman & Giasson., 2011). La combinaison de leur charge cérébrale pourrait donc être le corrélat le plus robuste de la MP-D (Clinton, Blurton-Jones, Myczek, Trojanowski & LaFerla, 2010; Compta et al., 2011; Gao et al., 2016; Horvath, Herrmann, Burkhard, Bouras & Kövari, 2013). Parallèlement, d'autres auteurs soutiennent que la clé du déclin cognitif dans la MP réside dans le dysfonctionnement des systèmes neurochimiques plutôt que dans l'atrophie des structures touchées par les CdL et les DNF (Vazey & Aston-Jones 2012; Xu et al., 2012). Bien qu'il soit difficile de statuer sur la contribution individuelle du fardeau neuropathologique et des altérations neurochimiques sur le déclin cognitif dans la MP, une interaction de ces différents processus pathologiques est très probable. D'ailleurs, Hall et al. (2014) rapportent que la présence de CdL dans une structure n'ayant pas subi de perte neuronale peut être associée au dysfonctionnement des systèmes neurochimiques associés à celle-ci chez des patients parkinsoniens sans démence. Toutefois, comme le mémoire doctoral portera sur les interventions pharmacologiques, qui agissent directement sur les systèmes neurochimiques, nous nous
12
attarderons plus en détails sur les anomalies de ces systèmes en relation avec le déclin cognitif, plutôt que sur les substrats neuropathologiques de la maladie.
Altérations neurochimiques dans la MP
Un certain équilibre est nécessaire dans l'activité des systèmes neurochimiques pour assurer un fonctionnement optimal, notamment au niveau cognitif. Or, de nombreuses altérations dans le fonctionnement de ces systèmes ont été observées chez les patients MP à travers les années. Les découvertes dans ce domaine ont sans nul doute joué un rôle important dans le développement et l'optimisation des traitements pharmacologiques pertinents pour remédier aux symptômes de la maladie. Ainsi, les prochaines sections aborderont les altérations dans le fonctionnement des différents systèmes neurochimiques plus affectés chez les patients MP, de même que le rôle potentiel de ces altérations sur le déclin cognitif.
Dopamine (DA)
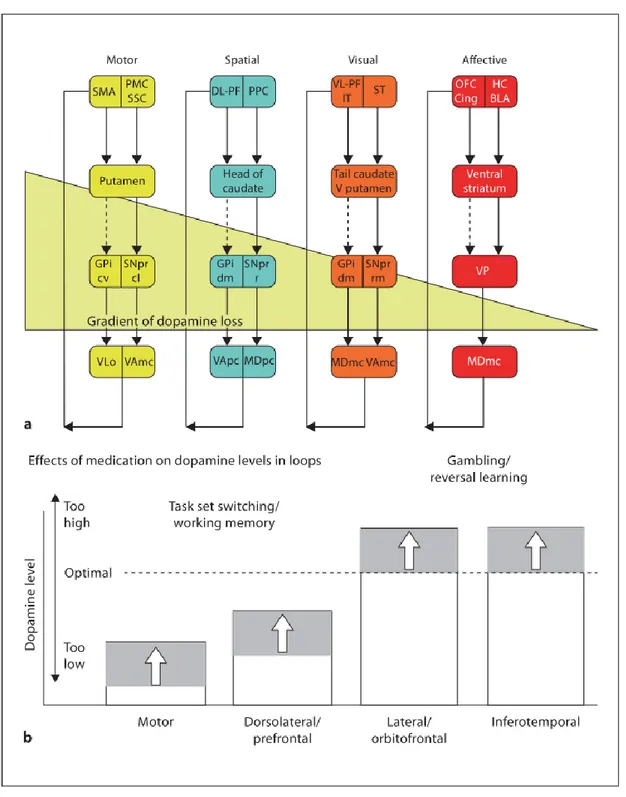
Le rôle des altérations dopaminergiques dans la MP est central. La dégénérescence des neurones dopaminergiques de la voie nigro-striatale débute avant même la formation des CdL dans cette région (Milber et al., 2012). Il en résulte une déplétion en DA dans le striatum (comprenant le putamen et le noyau caudé), qui affecte progressivement le fonctionnement de quatre circuits fronto-striataux, tel qu'illustré à l'annexe B. Le putamen, une structure du circuit impliqué dans la motricité, est le plus affecté par la déplétion. Dans le noyau caudé, la déplétion progresse de la portion dorso-latérale à la portion ventro-médiane de la structure. Chacune de ces sous-divisions est reliée à l'un des deux circuits plus impliqués dans le fonctionnement exécutif, soit le circuit dorso-latéral et le circuit orbitofrontal, respectivement. L'altération progressive du noyau caudé reflète la présence souvent précoce d'un syndrome dysexécutif (circuit dorso-latéral) dans la MP, et la survenue plus tardive de difficultés en contrôle comportemental basé sur la récompense (circuit orbitofrontal) (Pour des revues, voir Cools, 2006 et Poletti & Bonuccelli, 2012).
Des pertes neuronales sont aussi rapportées dans le système dopaminergique mésocorticolimbique. Ce système innerve plusieurs structures impliquées dans la cognition, dont le cortex préfrontal et la formation hippocampique. Les pertes neuronales subies provoquent ainsi une baisse des niveaux de DA dans ces structures, pouvant perturber leur fonctionnement (Agid, Javoy-Agid & Ruberg, 1987; Gotham, Brown, & Marsden, 1988).
D'autres symptômes non-moteurs sont aussi reliés au dysfonctionnement des systèmes DA dans la MP, dont la dépression, l'anxiété, l'apathie, les troubles du contrôle des impulsions (Sinha, Manohar & Husain, 2013; Vriend et al., 2014) et les hallucinations (Kiferle et al., 2014).
13
Acétylcholine (ACh)
Dans la MP, deux des sources principales de projections cholinergiques, soit le noyau tegmental pédonculopontin et le noyau basal de Meynert, subissent des pertes importantes (Calabresi, Picconi, Parnetti & Filippo, 2006; Karachi et al., 2010; Liu, Chang, Pearce, & Gentleman, 2015). Alors que la dénervation du premier noyau est associée à la sévérité des symptômes moteurs (Karachi et al., 2010; Rinne, Ma, Lee, Collan, & Roytta, 2008), celle du second, qui fournit la majorité de l'apport cholinergique cortical, est corrélée à l'intensité des symptômes cognitifs (Bohnen et al., 2015; Gratwicke, Jahanshahi & Foltynie, 2015; Jellinger, 2006). Chez les patients sans démence, ces dénervations contribueraient aux déficits exécutifs, attentionnels et mnésiques (Bohnen et al., 2006; 2010; 2015) et pourraient être prédicteurs de la MP-D (Lee et al., 2013). Cette dernière est quant à elle associée à une dégénérescence plus sévère des systèmes cholinergiques et à une réduction de l'activité de l'acétylcholinestérase dans tout le cortex (Bohnen et al., 2003; Hall et al., 2014; Shimada et al., 2009). Par ailleurs, les altérations des systèmes cholinergiques seraient également associées aux déficits olfactifs (Bohnen et al., 2010), à l'apathie, à la dépression (Bohnen et al., 2007), aux troubles du sommeil (Barone, 2010) et aux hallucinations visuelles (Manganelli et al., 2009) dans la MP.
Noradrénaline (NA)
Le locus cœruleus, source principale de l'innervation noradrénergique cérébrale, subit de lourdes pertes neuronales tôt dans la MP (2ème stade de Braak) (Braak et al., 2003). Ce noyau projette notamment dans
la formation hippocampique, le gyrus cingulaire, de même que dans le cortex préfrontal (Halliday, 2004), et serait entre autres impliqué dans la régulation des processus attentionnels et exécutifs (Chudasama & Robbins, 2006; McGaughy, Ross & Eichenbaum, 2008; Braver, Paxton, Locke & Barch, 2009). Le dysfonctionnement de ces circuits pourrait donc contribuer au syndrome dysexécutif dans la MP (pour une revue, voir Vazey & Aston-Jones, 2012). Par ailleurs, la NA aurait des propriétés anti-inflammatoires et pourrait jouer un rôle protecteur contre la dégénérescence des neurones nigro-striataux (Fornai, Bassi, Torracca, Scalori & Crosini, 1995). Enfin, l'atteinte du locus coeruleus précédant celle de la substance noire (Braak et al., 2003; Del Tredici, Rüb, De Vos, Bohl & Braak, 2002), elle serait liée à l’apparition de certains symptômes précliniques, dont la dépression, l'anxiété et les troubles du sommeil (Aston-Jones & Bloom, 1981; Aston-Jones, Rajkowski, Kubiak, Valentino & Shipley 1996; Kalaitzakis, Gentleman & Pearce, 2013; Remy, Doder, Lees, Turjanski & Brooks, 2005; Richard, 2005).
Sérotonine (5-HT)
Les circuits sérotoninergiques prennent origine en majorité dans les noyaux du raphé et projettent dans plusieurs régions cérébrales, dont le néocortex, le striatum et le système limbique (Tork, 1990). Ils seraient relativement préservés tôt dans la MP (Strecker et al., 2011), bien que certaines altérations soient déjà
14
perceptibles (Politis et al., 2010) au stade précoce de la MP. Cependant, une plus importante variété d'anomalies sont rapportées dans les stades plus avancés de la maladie (Halliday et al, 1990; Kish et al., 2008; Politis et al., 2010). Au plan cognitif, des auteurs proposent qu'une déplétion des marqueurs 5-HT dans le noyau caudé puisse contribuer aux déficits exécutifs dans la MP (Kish et al., 2008; Ye et al., 2014). Par ailleurs, les dysfonctions des systèmes 5-HT sont davantage associées à d'autres symptômes non-moteurs de la maladie (pour une revue, voir Politis & Niccolini, 2015), telles la dépression (Ballanger et al., 2012; Tong et al., 2015), l'anxiété (Melamed, Zoldan, Friedberg, Ziv & Weizmann, 1996), et possiblement les douleurs (Djaldetti, Yust-Katz, Kolianov, Melamed & Dabby, 2007; Tong et al., 2015).
Glutamate et GABA
Le glutamate et le GABA contribuent fortement à la régulation de l'activité des circuits des ganglions de la base, particulièrement entre le striatum et le globus pallidus interne. Dans la MP, la déplétion DA striatale entraînerait un débalancement de l'activité excitatrice (du glutamate) et inhibitrice (du GABA) dans les circuits striato-pallidaux. Cela provoquerait notamment une hyperactivité des noyaux sous-thalamiques, qui ont des projections glutamatergiques vers le globus pallidus interne et la substance noire pars compacta. Ainsi, l'action inhibitrice du globus pallidus interne sur le cortex augmenterait, contribuant aux symptômes moteurs de la MP. Dans la substance noire, la hausse de concentration en glutamate aggraverait la dégénérescence des neurones DA par le phénomène d'excitotoxicité3, accélérant le processus pathologique de la MP (Pour une revue, voir
Ambrosi, Cerri & Blandini, 2014 ou Barone, 2010).
Les neurotransmetteurs présentés dans les sections précédentes sont tous impliqués de près ou de loin dans les différentes fonctions, incluant la cognition, altérées par la MP. Plusieurs options de traitements pharmacologiques se présentent donc en fonction des symptômes du patient et des conséquences prévisibles que les molécules peuvent avoir sur les différents systèmes neurochimiques. Actuellement, les traitements pharmacologiques pour la MP visent plus particulièrement à remédier le fonctionnement des systèmes dopaminergiques, cholinergiques, ou glutamatergiques.
Interventions pharmacologiques
Au cours des dernières décennies, une grande variété de médicaments a été développés pour le traitement symptomatique de la MP. De plus, certaines médications initialement développées pour la MA sont utilisées ou à l'étude pour des sous-groupes de patients MP. Parmi toutes ces options, certaines catégories sont utilisées pour cibler plus directement les symptômes cognitifs (traitements nootropes non dopaminergiques),
3 Atteinte de niveaux toxiques de la concentration intracellulaire d'ions calcium via la suractivation des
15
alors que d'autres sont prescrits principalement pour les symptômes moteurs (traitements pro-dopaminergiques).
Traitements nootropes
Les médications non dopaminergiques se divisent en deux classes, les inhibiteurs de l'acétylcholinestérase (IAChE), incluant donépézil, rivastigmine et galantamine, ainsi qu'un antagoniste des récepteurs N-methyl-D-aspartate (NMDA) du nom de mémantine. Parmi les nootropes, rivastigmine est le seul IAChE approuvé au Canada pour le traitement de troubles cognitifs dans la MP, plus spécifiquement chez les patients souffrant de MP-D aux stades léger à modéré (Goldman & Holden, 2014; Canadian Pharmacists Association [CPhA], 2016). Dans cette population, les IAChE semblent apporter certains bénéfices, principalement en ralentissant la progression habituelle des symptômes cognitifs et comportementaux. De plus, ces agents semblent généralement bien tolérés par les patients MP-D (Wang et al., 2014; Wesnes et al., 2014; Emre, Poewe et al., 2014). Toutefois, les IAChE n'étant recommandés que dans la MP-D, peu de chercheurs ont étudiés leur effet chez les patients MP-TCL, soit la population ciblée par la présente recension. Selon Connoly & Lang (2014), il n'existerait que deux études investiguant les effets d'un IAChE dans la MP-TCL telle que définie par la MDS (Litvan et al., 2012) ou par Petersen (2004). Actuellement, une seule de ces deux études est publiée (Mamikonyan, Xie, Melvin & Weintraub, 2015), alors que l'autre est toujours en cours. D'autres études ont toutefois testé ces agents chez des patients MP sans démence sans utiliser de critères diagnostiques pour le TCL (Fabbrini et al., 2002; Linazasoro et al., 2005; Grace et al., 2009). Les constats émanant des quatre études disponibles suggèrent globalement que, chez des patients MP sans démence avec ou sans diagnostic de TCL, ces agents sont parfois mal tolérés et n'ont que peu ou pas d’effets sur la cognition. Conséquemment, malgré leur visée cognitive, ces molécules ne seront pas abordées davantage dans la présente recension.
À l'inverse, les médications dopaminergiques sont les premières à être administrées après que le diagnostic de la MP ait été posé, que les patients présentent ou non un trouble cognitif, puisqu'elles visent les symptômes moteurs. Ainsi, les antiparkinsoniens pro-dopaminergiques sont largement administrés en milieu clinique à la population cible de cette recension, soit les patients aux stades léger à modéré de la MP, avec ou sans trouble cognitif léger. Bien qu’il y ait plusieurs études au sujet des effets cognitifs de ces médications pro-dopaminergiques qui ont été publiées au cours des dernières années, il n’existe toutefois aucune recension systématique ayant colligé et quantifié les effets de ces médicaments sur les différents domaines cognitifs. Ainsi, toutes les molécules pro-DA utilisées pour le traitement des patients dans les premiers stades de la MP seront d’abord considérées pour la présente recension, puis celles présentant un potentiel à moduler la cognition, tout en ayant un profil d’effets secondaires acceptables seront finalement retenues.
16
Traitements pro-dopaminergiques (Pro-DA)
Les agents pro-DA sont reconnus pour leur efficacité dans le traitement des symptômes moteurs de la MP. Ils y parviennent en compensant la déplétion DA striatale constituant un élément central du développement de la maladie (Müller, 2012). Comme discuté, les altérations liées aux systèmes DA sont également associées à l'avènement de troubles cognitifs dès le début de la maladie. Ainsi, des molécules pouvant améliorer la transmission DA pourraient affecter la cognition des gens qui en souffrent. Plusieurs molécules aux propriétés pro-DA sont indiquées (niveau A) pour le traitement de la MP dans ses premiers stades, selon les lignes directrices canadiennes sur la maladie de Parkinson établies par la Société Parkinson Canada et approuvées par la Fédération des sciences neurologiques du Canada (Grimes et al., 2012). Ces molécules sont divisées en trois catégories, soit les agonistes DA, les IMAO-B4 et un précurseur de la DA (levodopa). Les prochaines
sections exploreront donc le potentiel de ces molécules à moduler la cognition chez des patients dans les premiers stades de la MP.
Agonistes dopaminergiques
Les agonistes DA sont généralement indiqués pour le traitement des symptômes moteurs pendant les stades léger à modéré de la MP. Ils se lient directement sur les récepteurs DA et exercent sur ceux-ci une stimulation tonique sans dépendre des neurones DA en dégénérescence. Il existe 2 types d'agonistes DA, ceux dérivés d'ergot-alcaloïdes (ergotés) et ceux qui ne le sont pas (non-ergotés), développés plus récemment. Ce qui distingue les deux types d'agonistes DA dans leur fonctionnement est leurs profils de liaison différents. Les non-ergotés se lient habituellement plus spécifiquement aux récepteurs de la famille D2 (incluant les récepteurs
D2, D3 et D4), alors que les ergotés se lient généralement en plus à des récepteurs de la famille D1 (comprenant
D1 et D5) (Cools, 2006). Ces deux familles de récepteurs sont distribuées dans plusieurs régions cérébrales
impliquées dans la cognition et dont la transmission DA est altérée dans la MP, telles le noyau caudé, le cortex frontal et la formation hippocampique (Hall et al., 1994; Cools, 2006). En somme, tous les agonistes DA favorisent la transmission DA, mais les propriétés pharmacodynamiques et pharmacocinétiques de chaque molécule pourraient entraîner des effets différentiels sur la cognition. En clinique toutefois, les ergotés sont présentement des agents de second choix, puisqu'ils ont été associés à des risques de fibrose pleuropulmonaire et cardiaque (Grimes et al., 2012). La présente étude ayant des visées cliniques, ce type d'agonistes ne sera pas retenu pour la recension.
Plusieurs agonistes DA non-ergotés ont été développés, mais tous ne sont pas utilisés en clinique à l'heure actuelle. Selon les lignes directrices canadiennes sur la maladie de Parkinson (Grimes et al., 2012), les
17
agonistes DA actuellement recommandés (niveau A) et prescrits pour le traitement de la MP dans ses stades léger à modéré sont les suivants.
Pramipexole
Malgré un certain niveau d'affinité pour tous les récepteurs de la famille D2, pramipexole se lie presque
exclusivement aux récepteurs D3 (Piercy, 1998). La stimulation des récepteurs D3 a été associée à de possibles
effets neuroprotecteurs et neurorestorateurs dans la MP (pour une revue, voir Joyce & Millan, 2007). Étant donné la haute affinité de pramipexole pour ces récepteurs, il pourrait contribuer à prévenir ou compenser les pertes neuronales pouvant induire des déficits cognitifs. D'ailleurs, cet agent a été associé à une amélioration généralisée des mesures cognitives dans un sous-groupe de patients bipolaires (Burdick et al., 2012); population qui, comme dans la MP, présente souvent des déficits exécutifs et mnésiques (Aprahamian, Nunes & Forlenza, 2013). Chez des participants en santé, certaines études rapportent des effets néfastes sur des mesures attentionnelles, d'efficacité intellectuelle et de sédation (Hamidovic, Kang & de Wit, 2008; Samuels, Hou, Langley, Szabadi & Bradshaw, 2006), de même que, inversement, des indications d'effets bénéfiques sur le contrôle des impulsions (Yang, Glizer, Seergobin & MacDonald, 2016) . Au plan neuropsychiatrique, pramipexole est utile pour le traitement des symptômes dépressifs dans la MP (Seppi et al., 2011), mais est également associé à des troubles du contrôle des impulsions (Müller, 2012; Poletti, Logi, et al., 2013). En somme, pramipexole semble avoir le potentiel de moduler le fonctionnement cognitif et fera ainsi l'objet d'analyses supplémentaires dans le mémoire doctoral.
Ropinirole
Comme pramipexole, cet agent se lie à tous les récepteurs de la famille D2. Or ropinirole a une moins
grande affinité pour les récepteurs D3 que pramipexole (Shepherd, Edelstyn, Mayes & Ellis, 2013), bien que cela
ne lui retire pas son potentiel neuroprotecteur (pour une revue, voir Joyce & Millan, 2007). Ce potentiel ne semble toutefois pas s'accompagner d'une capacité à moduler la cognition. Mavrikaki et ses collègues (2014) se sont intéressés à ce sujet via des modèles animaux de MP, mais ils ne rapportent aucun effet de ropinirole sur leurs mesures cognitives. Malgré cette apparente absence d’effets cognitifs, les données concernant les effets de cet agent sur la cognition de patients atteints de MP pourraient tout de même être intéressantes. En effet, compte tenu de son profil de liaison similaire à pramipexole, comparer les résultats en provenance de ces deux agents pourrait notamment clarifier le rôle de la stimulation des récepteurs D3 dans la cognition. De plus,
ropinirole aurait un potentiel thérapeutique vis-à-vis les symptômes anxieux, dépressifs (Rektorova et al., 2008; Mavrikaki, Schintu, Nomikos, Panagis & Svenningsson, 2014) et apathiques (Czernecki et al., 2008), en plus de pouvoir induire des troubles du contrôle des impulsions (Bodi et al., 2009; Poletti, Logi, et al., 2013). Pour toutes ces raisons, cet agent fera partie de la recension.