Boissons fermentées de type yogourt à boire enrichies
en protéines de lactosérum et en probiotiques
Mémoire
Germaine Enyoh Forkwa
Maîtrise en sciences et technologie des aliments
Maître ès Sciences (M. Sc.)
Québec, Canada
iii
Résumé
Le but de ce projet était de développer de nouvelles boissons laitières fermentées à base de lactosérum aux propriétés organoleptiques attrayantes. D’autres caractéristiques recherchées pour ces boissons étaient une concentration élevée en protéines, une haute teneur en probiotiques et sans additif (ni sucre, ni polysaccharides, ni colorants, ni arômes artificiels). Ces boissons auraient donc un effet bénéfique potentiel sur la santé cardiovasculaire, le poids corporel et le bien-être des consommateurs. Des boissons contenant 10% de protéines de lactosérum ont été fabriquées par fermentation de concentré de protéines de lactosérum (CPL) et/ou isolat de protéines de lactosérum (IPL). Dix CPL et deux IPL ont été évalués pour leur aptitude à la fermentation lactique. Sept ferments thermophiles et 2 souches probiotiques furent utilisés. L’impact des ferments, la stabilité des ferments et des probiotiques, la post acidification ainsi que les propriétés organoleptiques ont été évalués. Les conditions de fermentations ont été optimisées afin de générer des produits ayant au moins 1 à 10 milliards de probiotiques par portion. Ce projet a permis de développer des boissons fermentées (de type yogourt à boire) contenant 10% de protéines de lactosérum et 2 milliards de bactéries probiotiques par mL, et ce, uniquement à partir de dérivés de lactosérum. Par portion de 100 mL, ces boissons contiennent 200 milliards de probiotiques et seraient considérées comme les produits les plus riches en probiotiques sur le marché québécois. Ces résultats pourraient conduire à la mise en marché de nouveaux produits au fort potentiel de croissance qui répondent à plusieurs tendances de marché dans le secteur des aliments santé.
iv
Abstract
The aim of this project was to develop new fermented milk beverages from whey protein concentrates with attractive sensory properties. Other desired characteristics for these beverages were high protein concentration, high probiotic content and no use of additives (sugar, polysaccharides, colorants, artificial flavors). These drinks would have potential benefits on cardiovascular health, body weight and the well-being of consumers. Beverages containing 10% whey protein were obtained by fermenting whey protein concentrates (WPC) and/or whey protein isolates (WPI). Ten WPCs and two WPIs were evaluated for their ability to allow lactic fermentation by 2 types of mesophilic starter cultures. The medium with the best fermentation kinetics and the best organoleptic properties was selected. The impact of 7 thermophilic starter and 2 probiotic cultures on cell concentration and stability, post acidification and organoleptic properties was studied. The fermentations were adapted to generate products with at least 1 to 10 billion probiotics per serving. This project allowed the development of fermented beverages (drinking yogurt type) with 10% whey proteins and 2 billion probiotic bacteria per mL, exclusively from whey derivatives. Each 100 mL serving contained 200 billion probiotics and would be considered as a product with the highest probiotics counts on the Quebec market. These results could lead to the marketing of new products with high growth potential that respond to several market trends in the health food sector.
v
Tables de matières
Résumé ... iii
Abstract ... iv
Tables de matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations et des sigles ... xii
Remerciements ... xv
Avant-propos ... xvi
Chapitre 1 : Introduction générale ... 1
Chapitre 2 : Revue de la littérature ... 3
2.1 Le lactosérum ... 3
2.2 Caractéristiques physico-chimiques des principaux constituants du lactosérum ... 4
2.2.1 Le lactose... 5
2.2.2 Les protéines de lactosérum (PL) ... 5
2.3 Propriétés des protéines de lactosérum ... 10
2.3.1 Propriétés nutritionnelles ... 10
2.3.2 Propriétés santé ... 11
2.3.3 Propriétés fonctionnelles ... 12
2.4 Ingrédients laitiers obtenus à partir du lactosérum ... 14
2.5 Ingrédients laitiers à haute teneur en protéines de lactosérum ... 15
2.6 Développement de boissons à base de lactosérum ... 16
2.6.1 Boissons et jus de fruits au lactosérum non fermentées ... 16
2.6.2 Boissons fermentées à base de lactosérum ... 17
2.6.2.1 Les bactéries lactiques (BL) ... 18
2.6.2.2 Les probiotiques ... 20
2.6.2.3 Amélioration de la croissance des probiotiques ... 22
2.6.3 Boissons au lactosérum fermentée par des bactéries lactiques ... 24
Chapitre 3 : Hypothèse et objectifs ... 27
Chapter 4: Selection of starter cultures and whey protein sources for the production of a high protein whey beverage ... 28
vi
Résumé ... 29
Abstract ... 30
4.1 Introduction ... 31
4.2 Materials and Methods ... 33
4.2.1 Whey powders ... 33
4.2.2 Rehydration of whey and derived whey powders ... 34
4.2.3 Determination of the buffering capacity (BC) ... 34
4.2.4 Lactose analysis... 35
4.2.5 Bacterial strains and cultures ... 35
4.2.6 Fermentation... 36
4.2.7 Sensory analysis of fermented solutions ... 37
4.3 Results and Discussion ... 39
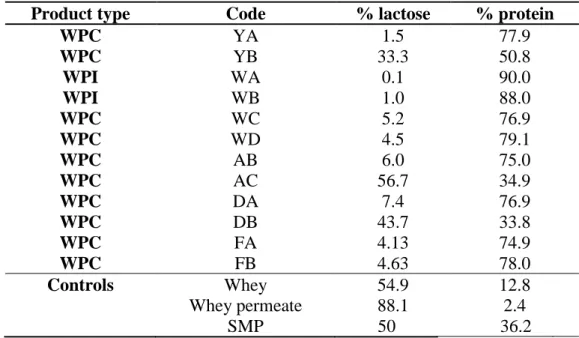
4.3.1 Some chemical attributes of the different milk and whey solutions... 39
4.3.2 Fermentation of WPCs and WPIs ... 41
4.3.3 Lactose supplementation ... 44
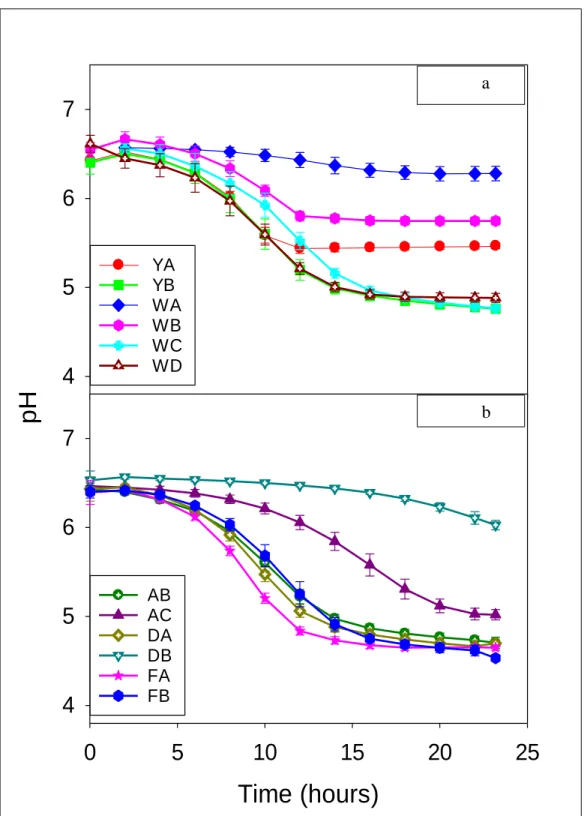
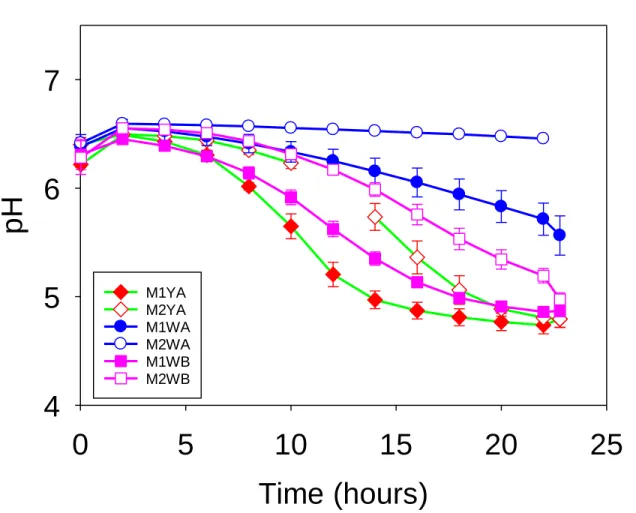
4.3.4 Influence of starter culture ... 45
4.3.5 Sensory analysis of WPIs /WPCs fermented with mesophilic culture “M1” ... 47
4.3.6 Fermentation of YB whey concentrate ... 48
4.3.7 Sensory analysis of WPIs / WPCs fermented with thermophilic starter cultures ... 50
4.3.8 Commercial application ... 51
4.4 Conclusion ... 52
4.5 Acknowledgements ... 53
Chapter 5: Effect of whey protein concentrate and starter culture on the growth and stability of probiotic bacteria in fermented high protein whey beverage ... 54
Résumé ... 55
Abstract ... 56
5.1 Introduction ... 57
5.2. Material and Methods... 59
5.2.1 Strains ... 59
5.2.2 Fermentation media ... 59
5.2.3 Fermentation... 60
5.2.4 Acidification ... 60
vii
5.2.6 Microbial analysis ... 60
5.2.7 Buffer capacity ... 61
5.2.8 Statistical analysis ... 61
5.3 Results and Discussion ... 62
5.3.1 Growth during fermentation ... 62
5.3.2 Acidification during storage ... 63
5.3.3 Stability of streptococci during storage ... 65
5.3.4 Stability of probiotic strains during storage ... 66
5.3.5 Dissolved oxygen ... 68
5.3.6 Market potential ... 69
5.4 Conclusion ... 71
5.5 Acknowledgments ... 72
Chapter 6: Effect of growth promoting factors in a high protein probiotic whey beverage .... 73
Résumé ... 74
Abstract ... 75
6.1 Introduction ... 76
6. 2 Material and Methods... 78
6.2.1 Starter culture ... 78
6.2.2 Probiotic strains ... 78
6.2.3 Whey protein concentrate and milk ingredients ... 78
6.2.4 Preparation of W and WM media... 79
6.2.5 Supplementation of W medium for AS screening assays ... 79
6.2.6 Automated spectrophotometry assays ... 83
6.2.7 Fermentations ... 83
6.2.8 Microbial analyses ... 84
6.2.9 Carbohydrates and organic acid analysis ... 84
6.2.10 Statistical analysis ... 85
6. 3 Results and Discussion ... 86
6.3.1 Biocompatibility assays between the starter and the probiotics ... 86
6.3.2 Effect of MRS constituents on probiotic growth in fermented W medium ... 87
6.3.3 Effect of various sources of peptones on the growth of Lactobacillus helveticus R0052 89 6.3.4 W medium fermentation by Lactobacillus helveticus R0052 ... 92
viii
6.5 Acknowledgments ... 98 Conclusion générale ... 99 Bibliographie ... 101
ix
Liste des tableaux
Tableau 2.1 Composition du lactosérum doux et du lactosérum acide………….…. 4
Table 4.1 Main composition of WPC and WPI powders ………...……. 33
Table 4.2
References for descriptive analysis of fermented whey protein blends in sensory analysis………...……….…………...…38
Table 4.3 Composition and buffer capacities of rehydrated
powders.……….40
Table 6.1
Concentrations of MRS-based ingredients added to clarified fermented “W medium” supernatant………..81
Table 6.2
Concentrations of protein hydrolysates added to clarified fermented W medium…………...……….………..……82
Table 6.3
Influence of supplementation of the W medium and external pH control (EpHC) on the growth of and acidification of Lb. helveticus R0052 and St.
thermophilus …...………...….94
Table 6.4 Effect of external pH control (EpHC) on levels of carbohydrates and of lactic acid during the fermentation of whey-based beverages………...96
x
Liste des figures
Figure 2.1 Ingrédients laitiers obtenus à partir du lactosérum liquide………..9
Figure 2.2 Valeur biologique [A] et composition en teneur en A.A essentiels [B] de différentes sources de protéines………...10
Figure 2.3 Les différentes étapes de gélification des protéines du lactosérum ……...13
Figure 4.1 System used to carry out fermentation and continuously monitor pH...37
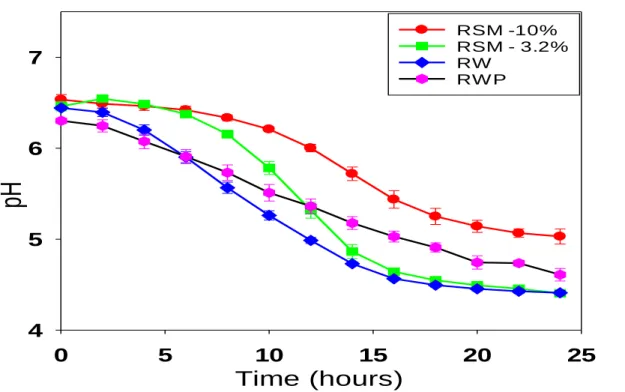
Figure 4.2 Fermentation profiles of whey and milk controls with mesophilic starter “M1”……….……...42
Figure 4.3 Mesophilic “M1”………....43 fermentation of whey-bases with starter culture
Figure 4.4 Supplementation of powders which could not undergo complete acidification in lactose. Fermented with “M1”………..………...45
Figure 4.5 Lactose supplemented protein concentrates with two types of mesophilic cultures (“M1”compared to “M2”) ………46
Figure 4.6 Sensory analysis of fermented whey drinks with starter culture “M1”………...47
Figure 4.7 Acidification profile of YB with different commercial thermophilic starter cultures……….…49
Figure 4.8 Sensory analysis of fermented whey drinks with thermophilic starter cultures F1 to F7………..……50
Figure 5.1
Viable counts of probiotic strains (Lb. helveticus R0052 and Lb. rhamnosus R0011) after fermentation in association with a commercial yoghurt starter culture………...……..….63
xi Figure 5.2
Effect of fermentation medium and of a probiotic culture (Lb. helveticus R0052 and Lb. rhamnosus R0011) on viable counts of St. thermophilus
during storage at 4°C of the 10% protein fermented
drinks………...…64
Figure 5.3
Effect of medium and probiotic strains (Lb. helveticus R0052 or Lb.
rhamnosus R0011) on pH changes during 45 days of storage at 4°C of 10%
protein fermented drinks……….……….…66
Figure 5.4
Effect of fermentation medium on the viable counts of two probiotic cultures (Lb. helveticus R0052 or Lb. rhamnosus R0011) during storage at 4°C of the 10% protein fermented drinks………67
Figure 5.5
Effect of medium and probiotic strain (Lb. helveticus R0052 or Lb.
rhamnosus R0011) on the levels of dissolved oxygen in the 10% protein
fermented drinks during storage à 4°C…...……….68
Figure 6.1
Effect of a pre-fermentation by YO-Mix T11 yogurt starter and of the addition of glucose (Glu) or MRS to W medium on the subsequent growth of two probiotic cultures (Lb. helveticus R0052 and Lb. rhamnosus R0011)……….86
Figure 6.2
Effect of supplementing the clarified fermented “W medium” (W) with constituents of MRS broth………..……….88
Figure 6.3
Effect of the supplementation of the clarified pre-fermented whey-based medium (W) with individual or combined components of the amino acid based group of MRS broth………..……….……90
Figure 6.4
Effect of the supplementation of the clarified pre-fermented whey-based medium (W) with various protein hydrolysates on the growth of Lb.
helveticus R0052………..……91
Figure 6.5 Effect of the supplementation of the clarified pre-fermented whey-based medium (W) with various dairy-based hydrolysates……..……….92
xii
Liste des abréviations et des sigles
Chapitre 2
DBO Demande biologique en oxygène
β –lg β -lactoglobuline
α -lac α - lactalbumine
Ig Immunoglobulines
Lp Lactoperoxydase
ABS L’albumine sérique bovine
Lf Lactoferrine bovine
PL Protéines du lactosérum
IECA Inhibiteur de l'enzyme de conversion de l’angiotensine
UF Ultrafiltration
CPL Concentré protéique de lactosérum
IPL Isolat protéique de lactosérum
BL Bactéries lactiques Lb Lactobacillus L. Lactococcus St. Streptococcus EPS Exopolysaccharides FOS Fructooligosaccahrides CMP Caséinomacropeptides
UFC Unité formant une colonie
A.A Acides Aminés
VB Valeur Biologique
CEpH Contrôle externe de pH
Chapter 4
WPC Whey protein concentrate
WPI Whey protein isolate
BC Buffering capacity
RSM Reconstituted skim milk powder
RW Reconstituted whey powder
RWP Reconstituted whey permeate
LAB Lactic acid bacteria
SEM Standard Error of Means
WHO/FAO World Health Organisation/ Food and Agriculture organization
xiii
WM media Whey protein concentrate and skim milk medium
Chapter 6
WPC Whey protein concentrate
WPI Whey protein isolate
W media Whey protein concentrate medium
WM media Whey protein concentrate and skim milk medium
CFU Colony Forming Unit
AS Automated spectrophotometry
xiv
Je dédie ce travail A mon mari Serges-Armand Youmbi qui sans cesse était présent et m’encourageait tout au long de cette expérience.
A mes parents; Raymond Taneck et Alice Abang Forkwa de m’avoir donné l’opportunité de connaître ce qu’est l’amour parental, je vous serai toujours reconnaissante. A mes sœurs, je vous aime et vous souhaite beaucoup de bonheurs A tous mes ami (e) s, vous êtes précieux pour moi A Dieu tout puissant pour la grâce de m'avoir accordé l'intelligence et la bonne santé sans lesquelles je ne peux rien.
xv
Remerciements
Je tiens à remercier de tout cœur mon directeur de recherche, le Dr Jean Christophe Vuillemard qui m'a offert cette unique occasion d’explorer la passion et les talents cachés que j’avais pour la recherche. Sa confiance, son calme et ses mots d’encouragements ne seront jamais oubliés. Merci d’avoir cru en moi et de m’avoir soutenu tout au long de ces deux années.
Je tiens également à remercier mon co-directeur, le Dr Claude Champagne de m'avoir accueillie dans son incroyable équipe. Sa disponibilité, ses bonnes capacités d'écoute, ses encouragements et son approche humoristique m'ont grandement aidé lors de cette expérience. Je dirais de lui, un patron exceptionnel, car il m’a appris travailler de façon structurée et surtout comment gérer méthodiquement les imprévus de la recherche. Merci d’avoir fait de moi une scientifique aguerrie.
Je remercie également Marie Josée Lemay, pour sa bonne humeur, sa patience, sa simplicité et surtout pour son aide lors de la mise au point de protocoles et la réalisation des expériences au laboratoire. Je tiens à remercier Yves Raymond, pour sa disponibilité et son aide technique au laboratoire et lors des analyses des résultats. Un merci à Nancy Graveline et à mon stagiaire Philippe Bouchard qui m’a permis d’obtenir des résultats de qualité. Un grand merci à Marc-Olivier Leroux et mes collègues à la maîtrise Andréanne, Valérie et Noémie pour leur amour, leurs conseils et leur aide.
Je souhaiterais également remercier tous les partenaires de ce projet : le ministère de l'Agriculture des Pêcheries et de l'Alimentation du Québec (programme InnovAction) ainsi qu’Agriculture et Agroalimentaire Canada pour le soutien financier de ce projet.
xvi
Avant-propos
Ce mémoire est composé de six chapitres dont trois sont rédigés sous formes d’articles scientifiques en anglais, tous précédés d’un résumé en français.
Germaine Enyoh Forkwa, est l’auteure principale de tous les articles scientifiques qui accompagnent ce travail. Les renseignements sur les co-auteurs (noms et adresses) sont présentés à la page titre de chacun des chapitres rédigés sous forme de publication. Les chapitres 4, 5 et 6 seront soumis pour publication dans des revues scientifiques.
Après une brève introduction sur le sujet, la revue de littérature présente un ensemble de connaissances sur le lactosérum, les propriétés santé et fonctionnelles liées à ses protéines ainsi que les produits fermentés ou non, à base de lactosérum ou enrichis en protéines de lactosérum.
Le chapitre 4 est présenté sous forme d’un article scientifique intitulé « Selection of starter cultures and whey protein sources for the production of a high protein whey beverage ». L'objectif de ce chapitre était d’identifier un concentré protéique parmi douze concentrés protéiques de lactosérum (CPL) / isolats protéiques de lactosérum (IPL) permettant une bonne fermentation lactique ainsi que les ferments les plus performants.
Le chapitre 5, aussi rédigé sous forme d’article scientifique est intitulé: « Effect of whey protein concentrate and starter culture on the growth and stability of probiotic bacteria in fermented high protein whey beverage ». Ce chapitre vise le développement d’une boisson fermentée contenant 10% de protéines et des concentrations élevées en bactéries probiotiques.
Le sixième chapitre sous forme d’article scientifique est intitulé « Effect of growth promoting factors in a high protein probiotics whey beverage ». Ce chapitre avait pour objectif de déterminer l'effet de la supplémentation de la boisson laitière par des facteurs de croissance pour les bactéries probiotiques.
xvii
Finalement une conclusion générale met en évidence la réponse à l’hypothèse de départ, l’atteinte des objectifs, la réussite du projet et les perspectives pour la continuité du projet sont aussi présentées.
1
Chapitre 1 : Introduction générale
En réponse à l’augmentation du nombre de consommateurs désirant des aliments ayant des effets bénéfiques sur la santé, tels que l’amélioration du bien-être et la réduction du risque de maladie, l'industrie alimentaire a développé une variété de nouveaux produits alimentaires dits fonctionnels (Granato et al., 2010). Les aliments fonctionnels sont des aliments ou des composants alimentaires qui sont scientifiquement reconnus comme ayant des avantages physiologiques autres que ceux de la nutrition de base (Ozer et al., 2010). Le marché mondial des aliments/boissons fonctionnels continue d'être un segment dynamique et croissant de l'industrie alimentaire (Corbo et al., 2014; Ozer et al., 2010). Les laits fermentés, en particulier les produits de type yogourt et le kéfir sont les boissons fonctionnelles les plus populaires en Europe occidentale, en Amérique du Nord et au Danemark (Marsh et al., 2014). La fonctionnalité d'un grand nombre de ces boissons fermentées peut être attribuée à la présence et à l'activité de bactéries probiotiques (Verbeke
et al., 2009). Les effets bénéfiques des probiotiques sur la santé sont l'amélioration du système immunitaire et la prévention des infections intestinales telles la diarrhée et la gastrite tout en inhibant les pathogènes microbiens entériques et d'origine alimentaire (Cho et al., 2015; Kasipathy, 2010; Ravinder et al., 2013).Suite au succès des produits laitiers, de nouveaux produits contenant des probiotiques ont été mis en marché, en particulier les boissons à base de fruits et les céréales à déjeuner (Champagne et al., 2009)
Le lactosérum, un coproduit laitier obtenu après coagulation du lait et égouttage du coagulum est un produit riche en protéines fonctionnelles et en substances bioactives (Pescuma et al., 2008). À cet effet, les protéines de lactosérum sont de plus en plus reconnues et acceptées comme des ingrédients fonctionnels. L’industrie laitière utilise dans la fabrication du yogourt et des boissons fermentées une grande variété de produits issus du lactosérum tels que la poudre de lactosérum, les concentrés protéiques de lactosérum (CPL), les isolats protéiques de lactosérum (IPL) et des hydrolysats protéiques de lactosérum (HPL) (Cho et al., 2015).
Auparavant, les protéines de l’œuf étaient considérées comme les protéines ayant la plus haute valeur biologique (VB). Toutefois, des études ont montré que les protéines de
2
lactosérum ont une VB qui dépasse d'environ 15% celle de la protéine d'œuf (Smithers, 2008). Akhavan et al. (2013) ont rapporté que la consommation de protéines de lactosérum abaisse la glycémie. De même, Zafar et al. (2013) ont montré que l’enrichissement d’une boisson en protéines de lactosérum permet de contrôler le poids corporel en réduisant l’appétit, la prise alimentaire et de ce fait l’apport énergétique. Les protéines de lactosérum sont donc une excellente source de protéines pour les personnes qui pratiquent le culturisme, les athlètes ou les personnes présentant des problèmes de santé comme le surpoids, etc. (Ha et al., 2003).
Les boissons lactées à base de lactosérum représentent un segment émergent de produits laitiers non conventionnels (Almeida et al., 2009). Cependant, pour être acceptées par des consommateurs habitués aux produits laitiers conventionnels, ces boissons santé doivent posséder une apparence, une texture et des caractéristiques gustatives souhaitables (Varghese et al., 2013). Les boissons à base de lactosérum liquide ou de poudre de lactosérum réhydratée présentent parfois des saveurs désagréables (Whetstine et al., 2005). De nombreuses formulations de boissons à base de protéines de lactosérum avec de meilleures caractéristiques organoleptiques ont été développées par l’ajout de concentrés de fruits (Magalhaes et al., 2011; Sabokbar et al., 2014a) ou par fermentation (Pescuma et al., 2008). Les CPL et les IPL sont généralement utilisés dans les aliments non fermentés (Lagrange et al., 2015). Très peu d’information n’est disponible dans la littérature au sujet de produits fermentés à base de CPL ou d’IPL. Toutefois, Pescuma et al. (2010) ont démontré que la fermentation d’un CPL 35% avec des souches sélectionnées de bactéries lactiques pourrait être une nouvelle voie pour développer des boissons lactées.
L’objectif de ce travail est de développer une nouvelle boisson fermentée de type yogourt à boire riche en protéines de lactosérum et en probiotiques.
3
Chapitre 2 : Revue de la littérature
2.1 Le lactosérum
Le lactosérum est un co-produit laitier obtenu lors d’une production fromagère. Toujours sous forme liquide et généralement de couleur jaunâtre à verdâtre, environ 9kg de lactosérum est généré pour 1kg de fromage pâte pressée produit. En 2015, la production mondiale de protéines du lactosérum a été estimée à approximativement 240 millions de tonnes pour une valeur monétaire de 5,59 milliards $. Des études estiment que ce taux augmentera de 3,5% par an et atteindra une valeur de 8,4 milliards $ en 2020 (Global Whey Protein Market - Growth, Trends And Forecast (2015-2020), 2016). Au Canada, environ 372,000 tonnes de fromage sont produites chaque année, y compris 200,000 tonnes au Québec, ce qui résulte à environ 2,100,000 tonnes de lactosérum (soit environ 1,200,000 tonnes au Québec) (Quebec Dairy Council Inc; Modified Milk Ingredients Fact sheet, 2015). Selon la méthode de fabrication et du type de fromage, deux principaux types de lactosérum peuvent être obtenus : le lactosérum doux et le lactosérum acide. Le lactosérum doux est obtenu par coagulation enzymatique du lait ou des caséines à un pH d'environ 6,5 tandis que le lactosérum acide (pH inférieur à 5) est obtenu par la coagulation du lait par ajout d’acides forts (phosphorique, hydrochlorique, sulfurique, etc.) ou organiques (lactique, citrique). Les principales différences entre les deux types de lactosérum se situent au niveau de leur teneur en minéraux, leur acidité et leur teneur en fraction protéique (Tableau2.1) (Yadav et al., 2015). Le lactosérum doux est moins minéralisé, car lors de la production fromagère, plus de la moitié du phosphore et des cations divalents sont retenus dans le caillé. Au contraire, lors d’une coagulation acide, la plupart des minéraux colloïdaux (calcium, phosphate, citrate de calcium et magnésium) se solubilisent et se retrouvent dans le lactosérum acide (Bozanic et al., 2014; St-Gelais et al., 2010). Comparé au lactosérum doux, le lactosérum acide a une plus faible teneur en lactose en raison du procédé de fabrication qui implique une fermentation avant coagulation au cours de laquelle une partie du lactose est converti en acide lactique. Cependant, le lactosérum doux a une fraction protéique plus élevée que le lactosérum acide.
4
Tableau 2.1 : Composition du lactosérum doux et du lactosérum acide
Constituantes Lactosérum doux (g/L) Lactosérum acide (g/L)
Solides totaux 63,0-70 63,0-70,0 Lactose 46,0-52,0 44,0-46,0 Protéines 6,0-10,0 6,0-8,0 Lipides 5,0 0,4 Lactate 2,0 6,4 Cendres 5,0 8,0 Calcium 0,4-0,6 1,2-1,6 Phosphates 1,0-3,0 2,0-4,5 Chlorures 1,1 1,1
Source: (Yadav et al., 2015) Le lactosérum contient environ 6.5% de solides totaux constitués principalement de lactose, de protéines, de minéraux, d’acide lactique et de matière grasse (Tsakali et al., 2010). En raison de sa haute teneur en lactose, de la présence de protéines et de matière organique, le lactosérum a une demande biologique en oxygène très élevée (DBO > 35,000 ppm) (Smithers, 2015) et un caractère polluant. Le lactosérum a longtemps été éliminé dans des installations de traitement de déchets ou épandu sur les champs pour l’enrichissement des sols (Onwulata et al., 2008). Mais en raison de sa DBO élevée, des réglementations environnementales strictes dans de nombreuses juridictions empêchent aujourd'hui son élimination sans un traitement préalable (Smithers, 2015). De plus, grâce au développement et l’utilisation des nouvelles technologies de transformation et de valorisation telles que les procédés de concentration membranaire et séchage par atomisation, le lactosérum peut être utilisé pour l'alimentation humaine.
2.2 Caractéristiques physico-chimiques des principaux constituants du
lactosérum
Dans le cadre de cette revue de littérature, l'accent sera mis sur les principales composantes (lactose et protéines) du lactosérum qui lui confèrent des propriétés exceptionnelles et de multiples utilisations dans les produits alimentaires.
5
2.2.1 Le lactose
Ce disaccharide est le sucre principal du lait et par conséquent du lactosérum. Il est formé par l’union de deux monosaccharides (le D-glucose et le D-galactose) par un lien glycosidique C1(β)-C4 (Amiot et al., 2010). Lors d’une fermentation, le lactose est le seul glucide fermentescible et ce, sous la dépendance des bactéries lactiques (BL). Ces BL possèdent une enzyme (β-galactosidase), qui est capable d’hydrolyser le lactose en glucose et galactose. Ces deux monosaccharides sont par la suite transformés en acide lactique, ce qui entraîne une baisse du pH. En fonction des BL utilisées, d’autres produits peuvent être aussi obtenus dont l’acide acétique, l’éthanol et le gaz carbonique (Vuillemard, 2013). Certains de ces métabolites jouent un rôle important au niveau de la saveur et de l’arôme typiques des produits laitiers fermentés.
Sous forme purifiée et cristallisée, le lactose est utilisé dans de nombreux produits de confiserie, de boulangerie, dans les formulations pour enfants, boissons, etc. De même, il peut être utilisé pour diminuer la saveur sucrée de certains aliments. En industrie pharmaceutique, il est utilisé comme transporteur ou support pour la fabrication des comprimés (Huffman et al., 2011).
2.2.2 Les protéines de lactosérum (PL)
Les protéines du lactosérum représentent environ 17% de l’azote protéique du lait et sont constituées essentiellement de la β-lactoglobuline (β-lg), l’α-lactalbumine (α-lac), les immunoglobulines (Ig), la lactoferrine bovine (Lf), l'albumine sérique bovine (ABS) et la lactoperoxydase (LP). Un traitement thermique de ces protéines en milieu acide favorise leur précipitation (Vuillemard, 2013). En effet, la solubilité des PL est fortement influencée par la chaleur (dénaturation de leur structure globulaire). Les immunoglobulines sont les plus sensibles et sont dénaturées à une température de 70°C. Toutefois, si la dénaturation est suivie par une rupture du pont disulfure, les molécules se déplieront et deviendront insolubles. De plus, les PL ont une valeur nutritionnelle supérieure aux caséines, car elles contiennent en proportion relativement importante les acides aminés essentiels tels que les acides aminés soufrés, la lysine et le tryptophane (Vuillemard, 2013). Les différents constituants des PL sont décrits ci-dessous :
6
➢ La β -lactoglobuline: La β–lg constitue environ 50% des protéines du lactosérum (Vuillemard, 2013). Absente dans le lait humain, la β–lg est une protéine globulaire contenant deux ponts disulfures et une cystéine libre conférant de bonnes propriétés fonctionnelles aux PL (Jeewanthi et al., 2015). Cette protéine a été identifiée comme l’une des principales causes d’allergie chez les nourrissons. Cette propriété limite l’utilisation du lait de vache dans les préparations pour nourrissons (Lucena et
al., 2006). Toutefois, des traitements industriels, tels que la stérilisation, le
chauffage ou les hautes pressions hydrostatiques améliorent sa digestibilité et une fermentation peut potentiellement réduire son allergénicité (Pescuma et al., 2008). La β–lg possède de bonnes propriétés gélifiantes, démontre une bonne stabilité et solubilité sur une large gamme de pH lors de traitements à haute température. Cette protéine a une valeur nutritionnelle élevée comme en témoigne son profil d'acides aminés essentiels. De même, cette protéine présente une excellente aptitude au fouettage et peut être une alternative à l’albumine d'œuf (blanc d’œuf) dans certaines applications alimentaires (Chatterton et al., 2006). Ces propriétés de la β-lg ont facilité son utilisation comme agent actif dans diverses boissons protéiques enrichies, telles que les jus de fruits et boissons pour sportifs (Chatterton et al., 2006).
➢ L’α–lactalbumine : Elle constitue environ 20% des protéines de lactosérum et a une structure globulaire en solution aqueuse. Elle présente une forte affinité pour des ions métalliques particulièrement le calcium. En présence de quantités saturantes de calcium, l’α–lac est thermostable tandis qu’en absence, elle devient très instable (Chatterton et al., 2006). L’α–lac est une protéine riche en acides aminés (cystéine et tryptophane) précurseurs de sérotonine et du glutathion, respectivement. L’α-lac possède des caractéristiques antimicrobiennes, anti-cancérigènes, joue un rôle important dans l'inhibition de l'enzyme de conversion de l’angiotensine (IECA) et dans la gestion du stress (Chatterton et al., 2006; Madureira et al., 2007).
➢ Les immunoglobulines: Les Ig représentent environ 11% des protéines de
7
lactosérum (Vuillemard, 2013). Présentes dans le lait maternel, les Ig confèrent aux nourrissons « une immunité maternelle passive» qui aide leur système immunitaire (Madureira et al., 2007; Shugarman, 2016). Elles possèdent des propriétés antimicrobiennes, antivirales et, à l’état natif, jouent un rôle important dans la modulation du système immunitaire du nourrisson.
➢ La lactoferrine bovine: La Lf représente moins de 1% des protéines du
lactosérum. Sa bonne capacité de chélation du fer, un élément essentiel pour la croissance des micro-organismes, lui confère des propriétés antimicrobiennes et antivirales (Farnaud et al., 2003). Plusieurs autres études ont mis l'accent sur l'activité biologique de la Lf et son rôle dans la lutte contre le cancer, les toxines, son soutien au système immunitaire, la cicatrisation des plaies, et l'activité anti-inflammatoire (Madureira et al., 2007; Shugarman, 2016).
➢ L'albumine sérique bovine: L’ABS représente environ 7% des protéines du
lactosérum et est riche en acides aminés essentiels (Vuillemard, 2013). L’ABS se lie facilement aux acides gras libres et d’autres matières grasses et, de ce fait contribue aux propriétés émulsifiantes des protéines de lactosérum. Elle possède aussi des propriétés antioxydantes et joue un rôle important dans l’inhibition de la croissance des tumeurs dans les glandes mammaires (Madureira et al., 2007).
➢ La lactoperoxydase : La Lp représente moins de 1% des protéines de
lactosérum. Elle joue un rôle important dans la prévention des infections, en agissant comme agent antimicrobien (Yadav et al., 2015). En fait, elle n’a pas d’activité antimicrobienne en soi, mais, en présence de cofacteurs, elle devient un puissant catalyseur pour le système défensif. Ces cofacteurs sont, d’une part le peroxyde d’hydrogène (H2O2) et, d’autre part, un ion, qui selon le type d’enzyme peut être l’ion thiocyanate (SCN-), l’ion chlorure (Cl-), l’ion bromure (Br-) ou l’ion iodure (I-) (Perraudin, 1991). Cette, réaction peut se résumer comme suit :
Comme rapporté par Perraudin (1991), le lait cru à une activité bactéricide contre
Bacillus thyphosa et Bacillus rathyphosa et cette activité est liée à l’activité des
oxydases et peroxydases présentes. Par exemple, en présence de H2O2 et SCN-, la H2O2 + X- H2O+ OX- (où X- = SCN-, Cl-, Br-, I-)
8
Lp produit l’anion hypothiocyanate qui est bactéricide à de très faibles concentrations (l’ordre de quelques µmol/l).
La figure 2.1 présente quelques produits qui peuvent être obtenus à partir du lactosérum et de ses principaux constituants, les plus utilisés étant le lactosérum en poudre, les concentrés protéiques et le lactose.
9 Lactosérum en poudre Hydrolysé Altération chimique Conversion Protéines de lactosérum Perméat Concentration Chromatographie /échange d’ions Précipitation Ultrafiltration Lactalbumine Isolat protéique de lactosérum Protéines individuelles Isolat protéique du lactosérum Concentré protéique de lactosérum Cristallisation Lactosérum réduit en lactose Lactose Lactosérum Fractionnement
Protéine Lactose Minéraux
Précipitation Chromatographie /échange d’ions Lactosérum déminéralisé Minéraux laitiers Protéines hydrolysées Lactosérum hydrolysé Dérivés de lactose
Figure 2.1 : Ingrédients laitiers obtenus à partir de lactosérum liquide.
10
2.3 Propriétés des protéines de lactosérum
2.3.1 Propriétés nutritionnelles
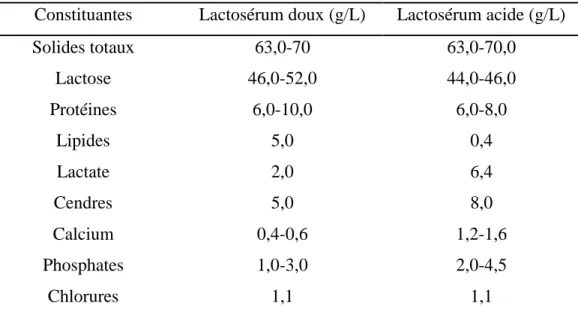
De nos jours, les PL sont largement utilisées comme ingrédients alimentaires en raison de leur propriétés nutritionnelles (Morr et al., 1993). Chaque protéine est spécifique et unique en raison de sa séquence spécifique d’acides aminés. Les acides aminés (A.A) sont généralement classés en deux grands groupes : les A.A non essentiels (synthétisés par le corps) et les A.A essentiels (fournis par l’alimentation). Les protéines qui contiennent ces A.A en proportion similaire à la quantité requise par le corps humain ont une valeur biologique (VB) élevée. Les protéines de l’œuf ont longtemps été considérées comme la source de protéines ayant la plus haute valeur biologique. Toutefois, des études ont montré que les protéines de lactosérum ont une VB qui dépasse d'environ 15% celle de la protéine d'œuf (fig. 2.2A). Comparées à d’autres types de protéines alimentaires, les protéines de lactosérum sont riches en A.A essentiels (figure 2.2B), et en A.A à chaîne ramifiée (leucine, isoleucine et valine) (> 20% p/p) (Smithers, 2008). Les protéines de lactosérum sont donc une excellente source de protéines pour les sportifs, pour les personnes ayant des problèmes de santé et pour les personnes qui pratiquent le culturisme (Ha et al., 2003).
Figure 2.2: Valeur biologique [A] et composition en teneur en A.A essentiels [B] de différentes sources de protéines (Smithers, 2008).
11
2.3.2 Propriétés santé
Plusieurs travaux confirment les bienfaits des protéines de lactosérum sur la santé (Smithers, 2015).
• Les protéines et les composantes bioactives du lactosérum ont la capacité de favoriser la synthèse et la reconstruction des tissus musculaires (Paddon-Jones et
al., 2009; Reidy et al., 2013; Tipton et al., 2004). Il a été démontré que les PL
possèdent également d’autres fonctions physiologiques telles que la modulation de la multiplication des adipocytes, l’amélioration du système immunitaire ainsi qu’une activité anti-oxydante (Ha et al., 2003; Zemel, 2013).
• Akhavan et al. (2013) ont rapporté que la consommation de PL abaisse la glycémie après le repas par des mécanismes dépendants et indépendants de l'insuline.
• Une autre étude réalisée sur un groupe de 158 obèses soumis 12 semaines à un régime hypocalorique (réduction de 500 cal/jour) a montré que le groupe expérimental qui avait ingéré un supplément de 20 g de protéines du lactosérum par jour a montré une perte de poids (2,81 kg) supérieure au groupe placebo sans supplément (1,62 kg) (Frestedt, 2008). De plus, les sujets ayant ingéré le supplément protéique ont perdu moins de masse musculaire (1,07 kg) que le groupe témoin (2,41 kg), ce qui s’est traduit par un ratio kg de gras/kg de muscle perdu de 3,75 pour le groupe supplément protéique (79% du poids perdu était du gras) contre 1,05 pour le groupe témoin. Zafar et al. (2013) ont aussi démontré que l’enrichissement d’une boisson en protéines de lactosérum permet de contrôler le poids corporel en réduisant l’appétit, la prise alimentaire et de ce fait l’apport énergétique. Luhovyy et al. (2007) et Poppitt (2011) ont aussi mis en évidence l’effet des PL sur la satiété, l’obésité et la réduction de la prise alimentaire.
• Fluegel et al. (2010) ont montré dans une étude que des sujets humains hypertendus consommant quotidiennement pendant 6 semaines une boisson de lactosérum contenant 28 g de protéines ont subi une diminution de pression artérielle tandis qu’aucune variation de pression artérielle n’a été observée chez le groupe de pression artérielle normale.
12
2.3.3 Propriétés fonctionnelles
Outre les propriétés nutritionnelles, les protéines de lactosérum possèdent des propriétés fonctionnelles exceptionnelles, principalement en raison de leur haut degré de solubilité, d'absorption d’eau, de gélification, émulsifiantes et moussantes (Baldasso, 2011).
a) Solubilité : La solubilité est considérée comme la propriété clé pour plusieurs ingrédients à base de protéines du lactosérum. Elles démontrent une excellente solubilité sur une large gamme de pH (2 à 10) (Onwulata et al., 2008). La plupart des systèmes alimentaires ayant des valeurs de pH dans la gamme de 3 à 7, les ingrédients à base de protéines de lactosérum sont solubles dans tous les milieux et la plupart des aliments (sauf ceux traités thermiquement) (Huffman et al., 2011).
b) Propriétés gélifiantes : La gélification est l’aptitude des protéines du lactosérum à former un gel cohésif stable lorsque chauffé. Soumis à une température de chauffage appropriée, les protéines de lactosérum forment deux types de gels : filamenteux ou agrégé. Le type de gel dépend non seulement du traitement thermique appliqué, mais aussi du pH et de la force ionique (Bertrand, 2008). En conditions favorisant les répulsions électrostatiques, les gels filamenteux sont formés et ces gels présentent de bonnes capacités de rétention d’eau tandis que les gels agrégés possèdent une capacité de rétention d’eau inférieure (Bertrand, 2008). La gélification des protéines de lactosérum soumises à un traitement thermique a lieu généralement en deux ou trois étapes (figure 2.3): la dénaturation de la structure globulaire des protéines natives, un dépliement partiel, suivie par une agrégation des protéines dénaturées sous la forme d’une matrice gélifiée qui peut lier de grandes quantités d'eau (Huffman et al., 2011). Cependant, un équilibre entre les liaisons attractives et répulsives est nécessaire pour obtenir le gel désiré.
13
Tiré de Bertrand (2008)
Figure 2.3 : Les différentes étapes de gélification de protéines du lactosérum.
c) Propriétés émulsifiantes : La capacité émulsifiante peut être définie comme la
quantité d'huile pouvant être émulsionnée par une certaine quantité de protéines avant l'inversion de phase ou l'effondrement de l'émulsion. Les protéines de lactosérum ont à la fois des régions hydrophobes et hydrophiles qui leur confèrent de bonnes aptitudes d’émulsification. Les protéines de lactosérum sont capables de diminuer la tension interfaciale entre les composants hydrophiles (eau) et hydrophobes (huile) dans les aliments.
d) Propriétés moussantes et fouettantes : Le moussage est une propriété qui peut être désirée pour certaines applications (crème glacée) et non pour d’autres (fortification protéique des jus de fruits). Les propriétés moussantes peuvent être définies comme la capacité d’une protéine à former une mousse stable par incorporation d’air. Les différentes étapes de formation de la mousse sont : la dénaturation des protéines, l’adsorption à l’interface air-eau, le piégeage de l’air, la réparation, le contact, la stabilisation (Huffman et al., 2011). Un traitement thermique doux favorise ou améliore l’aptitude des protéines du lactosérum à être fouettées. La présence de matières grasses est particulièrement néfaste pour la formation de mousses en raison de la perturbation de la tension de surface du film (Huffman et al., 2011). Les
14
isolats de protéines de lactosérum démontrent les meilleures propriétés moussantes en raison de leur teneur réduite en matière grasse.
e) Viscosité et capacité de liaison de l’eau : La faible viscosité des protéines de lactosérum favorise leur utilisation à de hautes concentrations. Cependant, soumises à un chauffage, leur viscosité et leur capacité de liée d’eau augmentent, et leur solubilité diminue (Huffman et al., 2011).
2.4 Ingrédients laitiers obtenus à partir du lactosérum
➢ Le lactosérum en poudre est un produit laitier obtenu par séchage du lactosérum frais. Selon le type de lactosérum, divers types de poudre de lactosérum peuvent être obtenus.
➢ La poudre de lactosérum doux est obtenue après écrémage et séchage du lactosérum frais issu de la production des fromages fabriqués par une coagulation de type présure (cheddar, mozzarella, Suisse) (Canadian Dairy Commission; Milk Ingredients, 2011). Sur la base de la matière sèche, sa composition est la même que celle du lactosérum liquide et son pH en solution est supérieur à 5.6. Cette poudre de lactosérum présente une saveur douce (Huffman et al., 2011) et constitue la principale production canadienne (Canadian Dairy Commission; Milk Ingredients, 2011).
➢ La poudre de lactosérum acide est obtenue par séchage du lactosérum frais issu de la fabrication de fromages non affinés fabriqués principalement par coagulation acide, tels que le cottage et la ricotta. Sa composition ressemble à celle de la poudre de lactosérum doux à l’exception de sa teneur en lactose inférieure (Tableau 2.1) et est une source riche en calcium laitier (Huffman et al., 2011). Son indice d’acide plus élevé lui confère un goût plus acide (pH en solution inférieur à 5.1) (Canadian Dairy Commission; Milk Ingredients, 2011).
➢ La poudre de lactosérum déminéralisée est un produit dont la plupart des minéraux a été éliminée de façon sélective (Canadian Dairy Commission; Milk Ingredients, 2011).
15
➢ La poudre de lactosérum délactosée est un produit dont la majorité du lactose a été retirée par cristallisation tout en conservant les autres constituants du lactosérum.
Les différentes poudres de lactosérum sont utilisées dans plusieurs produits alimentaires pour leurs propriétés fonctionnelles. Dans le cas des produits dont le profil et la concentration en minéraux sont des attributs cruciaux (aliments pour bébés), l’utilisation du lactosérum déminéralisé et délactosé est recommandée (Canadian Dairy Commission; Milk Ingredients, 2011).
2.5 Ingrédients laitiers à haute teneur en protéines de lactosérum
➢ Les concentrés protéiques de lactosérum (CPL) sont des ingrédients laitiers dérivés du lactosérum obtenus après élimination d’une partie des minéraux et du lactose par diverses techniques, telles que l’ultrafiltration et la diafiltration, suivie d’une évaporation et d’un séchage par atomisation (Siso, 1996). Généralement, la concentration en protéines des CPL varie entre
35 et 80%.
Les CPL sont utilisés dans plusieurs produits alimentaires pour leur haute teneur protéique et leur richesse en acides aminés essentiels. De plus, ces produits sont utilisés comme suppléments dans des boissons nutritionnelles, des barres nutritionnelles et des boissons fortifiées (Onwulata et al., 2008). Comparé au lactosérum natif qui a un goût salé, les CPL ont une saveur douce, typique du lait et dégagent des arômes sucrés, cuits et laiteux malgré le fait que dans certains cas, l’oxydation des lipides résiduels peut donner lieu à des odeurs désagréables (Whetstine et al., 2005). Renner et al. (1991) ont montré que les CPL sont typiquement exempts de pathogènes, de substances toxiques, ont des propriétés antimicrobiennes et possèdent des propriétés recherchées en industrie alimentaire telles que leur solubilité, leur bonne capacité émulsifiante et leur capacité de former des complexes avec d’autres ingrédients. ➢ Les isolats protéiques de lactosérum (IPL) contiennent un minimum de 90% deprotéines (Huffman et al., 2011), ce qui en fait la source de protéines la plus pure (Hoffman et al., 2004) et par conséquent très peu de lactose et de minéraux.
16
➢ Les hydrolysats protéiques du lactosérum (HPL) sont des protéines hydrolysées. Le processus d’hydrolyse est très similaire au processus de digestion et génère des peptides facilement absorbés. Ils sont principalement utilisés dans les suppléments de culturisme (contribue à la synthèse des protéines musculaires) (Kanda et al., 2014) et pour l’alimentation parentérale. Toutefois, un des inconvénients des hydrolysats réside dans leur amertume qui augmente avec le degré d’hydrolyse.
2.6 Développement de boissons à base de lactosérum
Depuis la Grèce antique, le lactosérum a été consommé pour ses effets thérapeutiques et bénéfiques dans la prévention de maladies comme l’arthrite, l’anémie et les problèmes de foie (Prendergast, 1985). De nos jours, le lactosérum est essentiellement utilisé comme ingrédient dans la formulation de divers produits alimentaires. Cependant, il existe quelques produits à base de lactosérum.
2.6.1 Boissons et jus de fruits au lactosérum non fermentées
Des études ont mis en évidence que l’ajout de concentrés/jus de fruits au lactosérum améliore significativement les défauts de goût salé et l’arôme désagréable du lactosérum liquide. Le lactosérum acide est recommandé, car il est compatible avec la nature et la saveur acide des fruits (Ozer et al., 2010). Ces boissons peuvent être des substituts aux jus de fruits santé en raison d’attributs comme bonne source de vitamines (Jelen, 2010) ou de minéraux. Quatre types de boissons à base de lactosérum additionné de concentrés de fruits (d’orange, de poires, des pommes et des pêches), d’acide citrique et de sucrose ont été développées par Djurić et al. (2004). Les meilleurs résultats sur le plan de la qualité et des propriétés organoleptiques ont été obtenus avec les concentrés de pêche, et que ceci était dépendant de l’interaction entre la matière sèche et le taux de sucrose du milieu (Djurić et
al., 2004). Ils ont aussi constaté que les boissons à base de poires avaient une tendance à
sédimenter. Pour surmonter le problème de sédimentation, une autre étude a démontré qu’il était possible de stabiliser un mélange de lactosérum (chauffé) et de jus de poire par ajout de sucre et de pectine hautement méthylée (Baccouche et al., 2013). Gad et al. (2013) ont obtenu une boisson à base de lactosérum, mangue, huile de lin et pectine montrant très peu de sédimentation, avec d’excellentes qualités organoleptiques, une faible viscosité et une richesse en omega-3. Cependant, d’autres types de boissons, comme dans le cas de boissons
17
obtenues avec du lactosérum et du cassis (Ribes nigrum) ont montré des problèmes de goût et d’odeur (Jaworska et al., 2011) et que le cassis n’était pas capable de masquer les saveurs non désirées des boissons de lactosérum. Djurić et al. (2004) rapportent que, selon la littérature, les saveurs d'orange et d'agrumes sont des concentrés / fruits à favoriser.
2.6.2 Boissons fermentées à base de lactosérum
Le kéfir est une boisson laitière acide, légèrement carbonatée avec un faible taux d’alcool fermenté par une microflore de bactéries lactiques, acétiques et des levures qui sont habituellement emprisonnées dans une matrice de polysaccharides et protéines appelée «grain de kéfir» (Londero et al., 2012). Ces microorganismes sont capables de métaboliser le lactose, et de ce fait peuvent être utilisés pour fermenter le lactosérum (Sabokbar et al., 2016). Cette microflore est peu sensible à l’acidité des fruits et a la capacité de fermenter les sucres des concentrés et jus de fruits. Sabokbar et al. (2014a) ont étudié la fermentation d’une boisson à base de lactosérum et de concentré de jus de grenade par des grains de kéfir. L’étude a montré que le mélange de jus de grenade et de lactosérum reconstitué fut un bon substrat de fermentation pour les grains de kéfir et de ce fait a donné lieu à la production d’une nouvelle boisson lactée contenant des probiotiques et du jus de fruits. Deux températures de fermentation (19 ºC et 25 ºC) avec deux concentrations (5% et 8% p/v) d'inoculum de grains de kéfir ont été testées. La diminution du pH, la production d'acide lactique et d'acide acétique dépendaient de la température et de la concentration des grains de kéfir utilisés. Les boissons inoculées à 5% p/v et fermentées à 25 ºC ont été fortement appréciées en ce qui concerne l’odeur, la consistance et l’acceptabilité globale. Le compte microbien des BL était significativement différent pour toutes les boissons qui étaient à l’étude avec des comptes moyens d’environ 7.5 log CFU/mL. Toutefois, dans toutes les boissons à l’étude, aucune différence significative dans les comptes en levures (~5.3 log CFU/mL) n’a été observée. Des résultats sensoriels similaires ont été obtenus lorsqu'un mélange de lactosérum et de jus de pomme a été fermenté avec des grains de kéfir (Sabokbar et al., 2015). Ces études montrent la potentialité de développer et de masquer la saveur du lactosérum en utilisant la fermentation par les grains de kéfir. Cependant, des chercheurs ont également exploré d'autres possibilités de fermenter seulement le lactosérum (sans mélange avec le jus de fruit) avec des grains de kéfir.
18
Magalhaes et al. (2011) ont étudié la production d’une nouvelle boisson fermentée en utilisant du lactosérum comme substrat principal. Comme dans les études précédentes, les grains de kéfir étaient capables d'utiliser le lactose (standardisé à 46g/L dans toutes les boissons) comme substrat et de ce fait produisaient des quantités similaires d'éthanol (12g/L), d'acide lactique (6g/L) et d'acide acétique (1,5g/L) que lors de la fermentation du lait. Les composés volatils (des alcools et des esters éthyliques) responsables des bonnes qualités sensorielles des boissons étaient les composés les plus dominants dans les boissons, Aucune information n'a été fournie sur les concentrations d'inoculum utilisées ni sur les comptes microbiens obtenus après fermentation. Néanmoins, les résultats de cette étude ont montré que la fermentation du lactosérum donnait un profil sensoriel similaire à celui des boissons lactées fermentées. Cela indique que de nouvelles boissons aux propriétés organoleptiques acceptables peuvent être produites par la fermentation de lactosérum par des grains de kéfir. Il est cependant important de noter que les grains de kéfir sont constitués de bactéries lactiques. Il est dont probable qu'une fermentation lactique permet d’obtenir des profils sensoriels acceptables.
2.6.2.1 Les bactéries lactiques (BL)
La plupart des bactéries utilisées pour la fermentation du lait sont appelées bactéries lactiques (BL) dû au fait qu'elles produisent principalement de l'acide lactique par le catabolisme du lactose (Cogan et al., 1996). Sous forme de coques ou de bâtonnets, ces bactéries Gram-positif ne produisent pas de spores, sont habituellement non mobiles et ont des besoins de croissance importants (Jespersen, 2004). Les BL peuvent être homofementaires ou hétérofermentaires. Les homofementaires sont des bactéries qui produisent, après fermentation, principalement de l’acide lactique (>90%) tandis que les BL hétérofermentaires produisent une variété de métabolites. La conversion du lactose par les BL hétérofermentaires produit environ 50% d’acide lactique et d’autres métabolites (acide acétique, éthanol et CO2) (Jespersen, 2004; Widyastuti et al., 2014). Les BL peuvent
améliorer la digestion du lactose (Mater et al., 2005) et ont été jugées bénéfiques pour la santé humaine et la nutrition (Deeth et al., 1981; EFSA, 2010). Les cultures commerciales de BL peuvent être thermophiles ou mésophiles (Lamontagne et al., 2002) ou parfois contenir des souches des deux types.
19
Les principales BL mésophiles sont Lactococcus lactis subsp. cremoris (L.
cremoris), Lactococcus lactis subsp. lactis (L. lactis), Lactococcus lactis subsp. lactis
biovar. diacetylactis (L. diacetylactis), Leuconostoc mesenteroides subsp. cremoris, et
Leuconostoc lactis. De plus, L. diacetylactis, Leuconostoc mesenteroides subsp. cremoris et Leuconostoc lactis peuvent cataboliser le citrate en CO2 et en diacétyle. En fromagerie, le
CO2 est responsable de la présence d’ouvertures dans les fromages et le diacétyle est
souvent responsable du goût caractéristique du beurre et des saveurs des produits laitiers fermentés. Ces bactéries capables de produire le diacétyle sont appelées producteurs d’arômes, par exemple L. lactis subsp. lactis (citrate+) (Jespersen, 2004).
Ce que le secteur laitier considère comme bactérie thermophile ne correspond pas à la nomenclature classique en microbiologie qui considère les thermophiles comme étant des cultures pouvant se multiplier à 55°C. Cette nomenclature sied tout de même bien le secteur pour distinguer les souches et leurs applications potentielles. Les principales BL thermophiles sont Streptococcus thermophilus, Lactobacillus delbrueckii subsp. bulgaricus
et lactis et Lactobacillus helveticus. Lors d’une fermentation, Streptococcus thermophilus,
Lb. delbrueckii subsp. bulgaricus et certains Lb. delbrueckii subsp. lactis catabolisent le
lactose et produisent du lactate et du galactose (Jespersen, 2004). D’autre part, Lb.
helveticus utilise le galactose produit comme source de carbone et de ce fait élimine le
galactose résiduel. Certaines souches de Lb. helveticus sont très protéolytiques et peuvent affecter le goût et la texture comme dans le cas d’un fromage (Ardö et al., 1988). Les BL thermophiles sont capables de produire de l'acétaldéhyde qui est la saveur caractéristique du yogourt.
En Amérique du Nord, seuls les genres Lactobacillus, Lactococcus, Leuconostoc et
Streptococcus sont communément utilisés pour la fermentation des produits laitiers. Pour
être utilisé comme culture pour la production du yogourt, le ferment doit obligatoirement être une culture mixte constituée de St. thermophilus et Lb. delbrueckii ssp. bulgaricus (Nauth, 2004).
20 2.6.2.2 Les probiotiques
Les BL renferment plusieurs espèces considérées comme probiotiques. Ces derniers sont définis comme des «microorganismes vivants qui, lorsqu'ils sont administrés en quantité suffisante, confèrent un avantage pour la santé de l'hôte» (WHO et al., 2002). Les aliments dits «fonctionnels» sont des produits démontrant des effets santé au-delà de leur valeur nutritionnelle de base (Ozer et al., 2010). Dans les produits laitiers fonctionnels, les probiotiques sont les composés bioactifs qui procurent aux produits laitiers fermentés leur fonctionnalité. Les probiotiques sont de plus en plus connus pour leurs effets positifs sur la santé et le bien-être. Pour en citer quelques-uns, les effets bénéfiques des probiotiques sont :
➢ amélioration de la santé du tractus intestinal (Kasipathy, 2010; McFarland, 2007) ; ➢ amélioration du système immunitaire (Ravinder et al., 2013);
➢ traitement de la colite ulcéreuse, de la maladie de Crohn et de la pouchite ; ➢ réduction de l'infection à Helicobacter pylori ;
➢ soulagement du syndrome du côlon irritable et particulièrement chez les patients présentant des symptômes prédominants de constipation (Floch, 2014; Kasipathy, 2010; Maulik, 2011; Ravinder et al., 2013) ;
➢ traiter et/ou prévenir l’obésité et l’inflammation (Mathieu, 2015); ➢ Assimilation du lactose (Schrezenmeir et al., 2001), etc.
Les effets santé procurés par les bactéries probiotiques sont dépendants de la souche et les effets santé documentés pour une souche ne sont pas nécessairement applicables à d'autres (Maulik, 2011).
L’activité protéolytique de Lb. helveticus est généralement plus élevée que les autres bactéries lactiques (Yamamoto et al., 1999), ce qui est un avantage pour la fermentation du lait. Elle fermente le lactose et tous ses produits de dégradation (glucose, galactose) alors que la plupart des souches de St. thermophilus n’ont pas la capacité de fermenter le galactose (Roy et al., 1986). Au cours des 20 dernières années, l'utilisation de Lb. helveticus est devenue plus importante en raison de sa capacité de produire des composés bioactifs pendant la fermentation (Griffiths et al., 2013). La souche Lb helveticus R0052 a
21
le potentiel d'inhiber la croissance des pathogènes et possède des propriétés pouvant renforcer le système immunitaire (Foster et al., 2011).
Bien que très peu d'information soit connue quant à l'utilisation de Lb. rhamnosus en industrie alimentaire, les souches, GG et R0011 ont des propriétés probiotiques (Champagne et al., 2008). En outre, Lb. rhamnosus R0011 est producteur d'exopolysaccharides (Champagne et al., 2008) qui ont des effets bénéfiques sur la texture et les rendements. Comme la souche R0052, la souche R0011 inhibe les pathogènes et améliore le système immunitaire (Foster et al., 2011).
Les produits laitiers sont de bons vecteurs de probiotiques pour les humains (Champagne et
al., 2005). Pour obtenir des effets thérapeutiques ou des effets santé, il a été suggéré que la
portion déterminée du produit doit contenir au moins 1,0 x109 UFC de l’un ou plusieurs des microorganismes admissibles faisant l’objet de l’allégation (Agence Canadienne d'Inspection des Aliments: Allégations relatives aux probiotiques, 2016) et que cette concentration soit présente à la fin du cycle de vie du produit. Dans une étude réalisée par Shah (2000b), il a été démontré que la plupart de boissons porteuses d'allégations relatives à la présence de probiotiques avaient en réalité des concentrations cellulaires très faibles au moment de la vente. Pendant la fabrication et l’entreposage des produits fermentés, des facteurs tels que l’acidité, l’oxygène dissous et le potentiel redox peuvent affecter la croissance et la survie des probiotiques (Lankaputhra et al., 1996). Afin d’obtenir le compte viable requis en fin de vie du produit, il faut tenir compte de la mortalité qui aura lieu lors de l’entreposage.
Pour que les probiotiques se développent dans les produits laitiers qui contiennent déjà des cultures lactiques, l'antibiose doit être évitée et, idéalement, une symbiose doit s’établir entre le ferment lactique et les probiotiques. Ainsi, il faut prendre soin de choisir des souches probiotiques compatibles avec les cultures lactiques (Champagne et al., 2005; Tamime et al., 2007). Comme rapporté par McComas et al. (2003), les probiotiques croissent lentement par rapport aux cultures lactiques dans un milieu laitier. Il est donc nécessaire d’utiliser des moyens qui permettront d’augmenter et maintenir des concentrations élevées de probiotiques.
22
2.6.2.3 Amélioration de la croissance des probiotiques
Puisque le lait ne contient que peu de peptides ou d’aminés libres, les probiotiques doivent hydrolyser les protéines du lait. Pour des raisons technologiques, dans certains milieux contenant des probiotiques, l’addition de cultures de yogourt peut diminuer le temps de fermentation (Dave et al., 1998). Dans une culture de yogourt, Lb. delbrueckii ssp. bulgaricus est la souche qui initie la protéolyse et, de ce fait, génère des peptides et acides aminés essentiels qui sont utilisés par St. thermophilus. Cependant, lors de l’entreposage, Lb. delbrueckii ssp. bulgaricus produit de l'acide lactique qui est responsable de la post-acidification. Pour pallier à ce problème, la tendance actuelle est d'utiliser des cultures de yogourt contenant des quantités négligeables de la souche Lb. delbrueckii ssp. bulgaricus. Pour une telle culture, l'incorporation de micronutriments (peptides et acides aminés) peut s’avérer bénéfique. Ainsi, une approche pouvant être utilisée pour promouvoir la croissance des bactéries probiotiques dans du lait ou du lactosérum est l'utilisation de suppléments (Gaudreau et al., 2005).
➢ Ajout de facteurs de croissances ou de suppléments
L’extrait de levure est le supplément le plus commun et le plus efficace pouvant augmenter la croissance bactérienne (Champagne et al., 1999). Aeschlimann et al. (1990) ont étudié l’effet de facteurs de croissance (extrait de levure, hydrolysat de caséines, CPL, liqueur de maïs et malt) sur la croissance et la capacité productrice d’acide lactique par Lb. helveticus dans du perméat. Ils ont obtenu les meilleurs résultats lorsque les milieux ont été supplémentés en extrait de levure à une concentration de 10 g/L. Dans une autre étude, le glucose, l'extrait de levure et les fractions de protéines du lait ont également amélioré la croissance des probiotiques, suggérant que ceci pourrait être un moyen par lequel les probiotiques pourraient être utilisés seuls dans les produits laitiers fermentés (Saxelin et al., 1999).
Outre les peptides et acides aminés, les extraits de levure renferment plusieurs autres ingrédients pouvant stimuler la croissance des probiotiques : nucléosides, nucléotides, vitamines, acides gras libres. Ces ingrédients sont parfois requis dans les milieux destinés à cultiver les lactobacilles (Elli et al., 1999; Morishita et al., 1981). Cependant, l’utilisation

![Figure 2.2: Valeur biologique [A] et composition en teneur en A.A essentiels [B] de différentes sources de protéines (Smithers, 2008)](https://thumb-eu.123doks.com/thumbv2/123doknet/5565729.133407/27.918.125.562.633.1044/figure-valeur-biologique-composition-essentiels-sources-protéines-smithers.webp)