HAL Id: hal-02796274
https://hal.inrae.fr/hal-02796274
Submitted on 5 Jun 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Le statut nutritif des écosystèmes terrestres :
distribution globale des limitations de la croissance des
plantes
David Vidal
To cite this version:
David Vidal. Le statut nutritif des écosystèmes terrestres : distribution globale des limitations de la croissance des plantes. [Stage] Université de Bordeaux (UB), FRA. 2015, 22 p. �hal-02796274�
Maîtres de stage : Laurent AUGUSTO, Pierre TRICHET
Laboratoire d'accueil : Interactions Sol - Plante - Atmosphère
INRA Bordeaux-Aquitaine, La Grande Ferrade 71 Rue Edouard Bourlaux
33140 Villenave-d'Ornon
Site : https://www6.bordeaux-aquitaine.inra.fr/ispa
MASTER SCIENCES, TECHNOLOGIES, SANTÉ
Mention Sciences de la Terre et Environnement, Écologie
S
PECIALITEF
ONCTIONNEMENT DESE
COSYSTEMEST
ERRESTRESAnnée universitaire 2014-2015
David VIDAL
Le statut nutritif des écosystèmes
terrestres :
Distribution globale des limitations de la
croissance des plantes
Remerciements :
Je remercie toute l’équipe de l’UMR ISPA de l’INRA du site de la Grande Ferrade pour son accueil. Je remercie tout particulièrement mon maître de stage Laurent Augusto pour son encadrement de qualité et sa sympathie. Merci également à Pierre Trichet qui m’a accueilli sur le site de l’INRA de Pierroton.
Merci à Bruno Ringeval qui m’a pris en charge les premiers jours de mon arrivée et qui a donné de son temps pour nous aider à compléter la base de données. Je remercie aussi David Achat qui m’a été d’une grande aide de par ses multiples conseils et sources bibliographiques, avec le concours d’Anne Gallet-Budynek que je remercie également.
Sur un aspect plus « technique », je remercie Patricia Braconnier pour s’être chargé de mon dossier administratif indiscipliné et Eric Martin pour m’avoir installé dans un environnement informatique agréable.
Un grand merci également à Sylvain Pellerin et Mathieu Jonard pour leur attention et leur critique envers mon travail scientifique. Une même pensée pour Marion Valentin, documentaliste, sans qui tant d’articles n’auraient pu être traité.
Enfin je souhaite tout particulièrement remercier les thésards et stagiaires avec qui j’ai pu travailler dans de très bonnes conditions durant ces 6 mois. Un grand merci à Emma, Yoann et Hugo pour leur bonne humeur, leur sympathie et leur aide. Pour les mêmes raisons je souhaite remercier Rodolphe qui a pris du temps pour m’aider sur R !
Pour tous les lecteurs avisés, je remercie Haixiao Li pour sa version de mon résumé que voici :
摘要 陆地生态系统中氮,磷营养元素限度的纬度模型所能呈现的是相关科学文献中的研究共识。然而, 这种模式仅仅给出的是一种简化的土壤营养状况视角。通常这种模式只是基于气候的变化去研究由 低纬地区(赤道)的磷元素限度或是高纬度(极地)的氮元素限度所带来的纬度梯度。但是基于这 种模式,荟萃分析的应用可以允许我们研究世界范围内的氮和磷的限度,抑或是两者共同的限度。 相比之下,二者共同的限度的研究似乎更具优势,因为对于任何纬度,两种元素都被认为会对作物 产量产生影响。本文中,我们同样观测到了生物群落规模下营养状况的多样性。而这些差异可能会 部分抵消营养元素限度间的纬度差异,同时表明另一些因素诸如土壤类型,土壤发生因素(母质成 分,气候多样性,等等)也需要被考虑其中。此外,植物的生理可塑性同样扮演重要的作用,因为 其生理作用会倾向于缓冲由元素可迁移性所造成的限度差异。然而,必须指出的是,本文所选取的 研究地点数目及相关的参数指标依然是有限的。因此,目前还是难以对每个过程的作用做出准确的 结论,也无法对模式的准确性进行校正。
Sommaire :
Introduction 1
1/ Matériels et méthodes 4
1.1/ Cas d’étude et règles d’inclusion / exclusion 4
1.2/ Approximations 2
1.3/ Intégration des études dans la base de données 6 1.4/ Transformation de la base de données 8
1.5/ Analyses statistiques 11
2/ Résultats 11
3/ Discussion 14
Conclusion 19
Bibliographie 20
Annexe 1 : Répartition mondiale des sites de l’étude (indication du type d’écosystème)
Table des figures et des tableaux de l’étude :
Figures de l’étude :
Figure 1 : Espace théorique de limitation basé sur les indices relatifs de contribution de l’azote (RCIN) et du phosphore (RCIP) 9
Figure 2 : Gradient des limitations nutritionnelles exprimées par l'indice relatif de
colimitation entre N et P (RCINP) 10
Figure 3 : Réponses des différents biomes aux essais de fertilisation 11 Figure 4 : Réponse en biomasse des écosystèmes à la fertilisation en N (RRN) en fonction
de l'indice climatique de décomposition de la matière organique des sols (f_Climate) 12 Figure 5 : Graphique de l'évolution de l'indice relatif de colimitation entre N et P (RCINP)
en fonction des types de sols pour le biome Temperate humid 13 Tableaux de l’étude :
1
Introduction
La fertilité des sols est une problématique à laquelle s’intéresse l’homme depuis les débuts de l’agriculture, dont les premières traces datent du VIIIème
millénaire av. J.-C. dans la zone du croissant fertile (actuel Proche-Orient).
Les conséquences directes ou indirectes des activités humaines sur la fertilité des sols sont bien connues. En revanche, les causes exactes de sa variation sont restées largement méconnues jusqu’aux dernières décennies avec les avancées de la recherche scientifique dans ce domaine. La fertilité d’un sol correspond à l’aptitude culturale d’un sol ou, plus largement pour les écosystèmes, sa capacité à produire de la biomasse. On parle de production lorsque l’on s’exprime en unité de biomasse par unité de surface et on parle de productivité lorsque l’on s’exprime en production par unité de temps. La productivité est limitée par des facteurs biophysiques. On peut citer le climat, la disponibilité en eau, la lumière et la concentration en carbone atmosphérique. Ces facteurs sont assez bien décrits dans la littérature scientifique au niveau notamment de leur influence et des processus qui s’y appliquent (Nemani et al., 2003). Cependant les écosystèmes terrestres peuvent aussi être limités par la disponibilité en nutriments (Fisher et al., 2013), particulièrement en azote (N) et en phosphore (P) mais la nature et l’influence des limitations nutritionnelles semblent moins bien connues.
Des théories ont été proposées afin d’expliquer les phénomènes de limitation en nutriments. C’est le cas de la Loi du Minimum de Justus Freiherr von Liebig (chimiste allemand du 19ième siècle) qui défendait l’idée que cette limitation était causée par l’élément le moins disponible dans l’environnement (cas actuellement qualifié de limitation simple). Il a été ensuite démontré que les végétaux, à travers la plasticité de leur fonctionnement, pouvaient modifier leur demande nutritionnelle en fonction de la biodisponibilité des nutriments du sol (Bloom et al., 2012). Par exemple, il est connu que dans un milieu pauvre en phosphore, les plantes allouent d’avantage d'azote à la production et l’émission de phosphatases libératrices de P biodisponible, et que, dans le même temps, les plantes résorbent (recyclent) d’avantage le phosphore de leur tissus sénescents (racines fines, feuilles, etc.). De la même manière, dans un milieu pauvre en azote minéral (biodisponible), certaines plantes vont stimuler les phénomènes de fixation de l’azote atmosphérique au niveau de leur racine en s’appuyant notamment sur la disponibilité en P (activité enzymatique ; (Houlton et al., 2008)). On comprend ainsi que les biodisponibilités des éléments sont interdépendantes, par l’intermédiaire de l’activité des plantes. C’est pour cela que les limitations sont qualifiées de synergiques (Townsend et al., 2011). Ainsi, lorsque les écarts entre demande et biodisponibilité des éléments ne sont pas trop importants, le statut nutritif d’un sol,
2
correspondant à la concentration totale des éléments du sol et à leur biodisponibilité pour la croissance des plantes, n’est plus limité par un seul élément mais plusieurs à la fois. On parle de colimitation (synergique) (Davidson & Howarth, 2007) et il peut alors être difficile de déterminer le statut nutritif des écosystèmes.
De nombreux indices permettent de déterminer le statut nutritif des écosystèmes et ils se répartissent en deux grandes familles (Sullivan et al., 2014). La première recense les indices relatifs aux parties aériennes comme les rapports N/P ou C/N foliaires ou bien les taux de résorption (Yuan
et al., 2011). Ils ont l’avantage d’être représentatifs du statut nutritif de l’ensemble du volume de sol
dans lequel les racines évoluent, mais ne sont pas forcément fiables à cause de la plasticité physiologique / stœchiométrique des plantes (Sullivan et al., 2014) (Alvarez-Clare & Mack, 2015). Les indices souterrains, comme ceux de la méthode « root ingrowth core » (mesure du développement racinaire dans des sacs enrichis en différents éléments et enfouis dans le sol) ou les mesures de l’activité bactérienne, ne sont relatifs qu’à la fraction de sol testée. En effet, les différents horizons du sol ne possèdent pas toujours le même statut nutritif. Ainsi ces indices présentent des limites méthodologiques car ils ne sont pas forcément cohérents avec le statut nutritif du sol et ne se suffisent pas à eux-mêmes (Sullivan et al., 2014). Une autre méthode existe, plus lourde à mettre en place, appelée « essai de fertilisation ». Le principe est de tester in situ individuellement, et/ou de manière combinée, l’effet de l’ajout de nutriments sur la croissance des végétaux. Les réponses observées se basent sur les gains de biomasse (le plus souvent aérienne) suivant les différentes modalités en comparaison à un témoin (non fertilisé). Plus la différence de biomasse aérienne entre les végétaux de la parcelle témoin et la parcelle fertilisée en un élément (N, P, K…) est importante et plus le sol pourra être considéré comme nutritivement limité par cet élément. On pourra ainsi interpréter les limitations nutritionnelles du sol de manière qualitative et quantitative. Bien qu’ayant ses propres limites méthodologiques (Sullivan et al., 2014), cette méthode est perçue par une majorité de scientifiques comme la plus rigoureuse pour conclure sur le statut nutritif d’un écosystème.
L’ensemble de la ressource bibliographique montre, par ces essais de fertilisation, que l’azote et le phosphore sont majoritairement impliqués dans les limitations des écosystèmes terrestres (Elser et
al., 2007). Les cycles biogéochimiques de ces deux éléments sont très différents, notamment au
niveau de leur réservoir principal et de leurs transferts (Attiwill & Adams, 1993). L’azote est principalement contenu dans l’atmosphère et pénètre dans la biosphère via la fixation biologique et les dépôts atmosphériques. La quantité d’azote total est minimale en début de formation des sols et augmente par fixation avec leur vieillissement (Chadwick et al., 1999). Le phosphore est contenu en majorité dans les roches et les sédiments, et il est libéré par altération. A l’inverse de l’azote, la
3
quantité de phosphore total est maximale en début de formation du sol puis diminue au fur et à mesure de l’altération de la roche mère (Chadwick et al., 1999). Plus la zone d’étude est située vers les basses latitudes, plus l’humidité et la température augmentent et plus les conditions climatiques sont favorables à l’altération et à l’activité des organismes vivants. Les processus biogéochimiques seront ainsi plus dynamiques et la formation (i.e. le vieillissement) du sol sera accélérée (Walker &
Syers, 1976).
Il a ainsi été soutenu que la nature de la limitation était fonction de la latitude, corrélée à l’âge des sols et au climat. Ainsi peut-on formuler le paradigme de la limitation nutritionnelle basé sur le facteur complexe de la latitude (Vitousek & Howarth, 1991) (Wang et al., 2010) :
- une limitation simple en N dans les écosystèmes de haute latitude (sols jeunes, processus biogéochimiques lents) comme les toundras,
- une limitation simple en P dans les écosystèmes de basse latitude (sols vieux, processus biogéochimiques dynamiques) comme les forêts tropicales,
- une colimitation synergique en N et en P au niveau des écosystèmes de latitude intermédiaire, comme les forêts tempérées.
Ce modèle, largement soutenu de diverses manières (Wang et al., 2010) (McGroddy et al., 2004), est aujourd’hui de plus en plus remis en cause par des études conduites à une échelle locale (Vadeboncoeur, 2010) : la latitude pourrait ne pas être la grande variable explicative du statut nutritif au niveau mondiale.
Dans le cadre du stage que j’ai effectué au sein du site de la Grande Ferrade, à l'INRA, nous nous sommes proposés d’étudier à travers les publications de la littérature scientifique les limitations uniquement en azote et en phosphore des écosystèmes terrestres au niveau mondial, afin de tester le paradigme du gradient latitudinal de limitation et de mettre en avant toute autre variable pouvant expliquer les éventuels écarts à ce modèle théorique, comme la pédologie et la géologie.
4
1/ Matériels et méthodes
Afin de répondre à la question scientifique de l’étude, nous avons utilisé la méthode de la méta-analyse (Ainsworth et al., 2007). La méta-méta-analyse est une étude statistique dont les échantillons sont des études scientifiques. Elle a pour intérêt de synthétiser les informations recueillies autour d’un cas d’étude (case study) afin de distinguer les tendances et les lois générales qui s’y appliquent.
1.1/ Cas d’étude et règles d’inclusion / exclusion
Les études sélectionnées dans la ressource bibliographique ont dû respecter trois conditions expérimentales strictes pour que celles-ci servent à la construction de la base de données :
- la présence de quatre traitements de fertilisation : azote (N), phosphore (P), azote + phosphore (NP ; effets synergiques) et le témoin (C ; contrôle),
- ceux-ci doivent-être mis en place in situ au sein d’un ou plusieurs écosystèmes terrestres (forestiers de préférence) non-anthropisés (absence de fertilisation avant l’étude ; exclusion des essais agricoles de grandes cultures),
- les mesures sont effectuées sur la biomasse végétale aérienne, exprimée en unité de biomasse (production, en g/ha par exemple), ou de croissance (productivité, en g/ha/an par exemple).
Ces règles d’inclusion / exclusion posent la base du cas d’étude et doivent-être respectées afin de conserver le caractère impartial de l’opérateur dans le choix des références à intégrer dans la méta-analyse (Ioannidis, 2010).
Néanmoins, dans notre étude, la base de données doit aussi respecter une couverture mondiale vaste et homogène, afin de donner la valeur globale à notre méta-analyse. Ce dernier point révèle la principale difficulté du sujet car de nombreuses zones géographiques dans le monde ne référencent que peu ou pas d’études. Il existe plusieurs raisons à cela, comme le faible développement économique, les problèmes géopolitiques (Afrique, Asie du Sud-Est), le protectionnisme scientifique (Russie) ou l’absence de végétation (zone désertique comme le Sahel, l’Antarctique, etc.). En suivant cette même logique on peut expliquer pourquoi certaines zones sont bien couvertes, comme l’Europe et l’Amérique du Nord.
Il existe deux manières de rééquilibrer les données récupérées à partir de la littérature:
- intensifier les recherches bibliographiques sur les zones moins renseignées et, dans la même idée, ne pas intégrer dans la base de données de nouvelles références concernant des régions de petite taille qui font déjà l’objet de plusieurs publications (Pays-Bas, France, Hawaï),
5
- accepter d’intégrer des approximations vis-à-vis du cas d’étude et ainsi assouplir parfois les règles d’inclusion / exclusion.
La première approche a consisté à élargir les recherches à plus de revues, comme les journaux nationaux, et à profiter de contacts du laboratoire d’accueil pour recevoir d’avantage d’informations (réseaux de chercheurs, bibliothèques).
Lorsque l’intensification des recherches ne suffit pas, la seconde approche consiste à accepter un assouplissement des règles d’inclusion / exclusion au travers de quelques approximations.
1.2/ Approximations
Il est arrivé de trouver des études relatives à des écosystèmes de zones peu renseignées mais qui comportaient des écarts aux règles d’inclusion / exclusion du cas d’étude. Nous avons ainsi été confrontés au dilemme entre favoriser l’intégrité de la base de données et tendre vers une couverture mondiale plus homogène. Notre choix a été d’accepter des écarts modérés au cas d’étude, du fait de la mauvaise répartition des sites sur le globe.
Voici la liste des différentes sources d’approximation enregistrées dans la base de données :
- « Traitement-fert », les essais de fertilisation N, P, NP comportent un autre élément, comme par exemple le potassium K. On peut alors se retrouver avec des traitements NK, PK, NPK. Le risque est de fausser la caractérisation du statut nutritif en N et P si la réponse de K est importante lors d’une fertilisation. Ce type d’essai n’a été intégré que s’il existait un traitement simple qui ne montrait pas de différence avec le témoin (dans l’exemple du K, un traitement « K-seul » pour lequel la croissance des plantes n’était pas significativement différente de celle des plantes témoins),
- « Mesure », les auteurs ont renseigné la réponse à la fertilisation avec des mesures qui ne se rapportent pas directement à la biomasse aérienne produite (biomasse racinaire, Net
Ecosystème Production, Normalized Difference Vegetation Index).
- « Exp-pot », les essais de fertilisation se font ex situ dans des pots en conditions contrôlées sous serre en raison de diverses contraintes liées à l’expérimentation. Les plantes, autochtones en général, sont plantées dans du sol provenant de prélèvements d’horizons superficiels d’un sol local,
- « Déduction », parfois les auteurs ne renseignent pas les réponses pour certains traitements car ceux-ci ne sont pas significativement différents d’autres résultats déjà renseignés. Il faut alors s’appuyer sur le texte pour indiquer les biomasses obtenues. Par
6
exemple, si le traitement N ne donne pas de réponse significative alors on lui attribue la valeur du témoin.
Les cas d’études pour lesquels une approximation a été nécessaire représentent 22% de l’ensemble de la base de données. La variable spécifique « approximation » a été créée afin d’étudier l’impact éventuel de ces approximations sur nos résultats, mais aucun écart significatif n’a été observé lorsque ces données étaient incluses / exclues des analyses.
1.3/ Intégration des études dans la base de données
Une fois qu’une publication est sélectionnée, il faut l’intégrer à la base de données. Cela consiste à informer 92 colonnes de renseignements (77 variables) sur le tableur Excel, dont voici la liste non-exhaustive :
- les renseignements « indispensables », comme l’identité de l’étude avec le(s) nom(s) du ou des auteur(s), l’identifiant dans la base de données, la localisation (continents, pays), le type de végétation (forêt, prairies, savanes, zones humides…), la réponse aux essais de fertilisation avec la nature des traitements, les unités de croissance,
- les renseignements « importants », comme les coordonnées géographiques en degrés décimaux, la systématique des plantes cibles (famille, genre, espèce), la caractérisation pédologique sous la classification USDA (United States Department of Agriculture) et FAO (Food and Agriculture Organization) et différents renseignements du sol (horizon de surface, texture, pH H2O, rapport C/N) ainsi que les modalités des traitements (temps
de fertilisation, dose) et les concentrations minérales foliaires,
- les renseignements « utiles », comme le type de climat, ses caractéristiques (MAT (Mean
Annual Temperature), MAP (Mean Annual Precipitation)), la topographie, la géologie,
les K, Ca, Mg échangeables du sol, les P totaux et disponibles,
- les renseignements « facultatifs », comme les valeurs de pente, les associations mycorhiziennes, les valeurs en Fe, en Al et en carbonates du sol, la CEC, la Soil Organic
Matter (Matière Organique du sol, nommé MO par la suite).
Les variables devaient être entrées selon une unique unité de mesure (sauf la réponse à la fertilisation, possédant plus de liberté) afin de pouvoir être comparées. C’est pour cela que les différentes valeurs de l’étude nécessitaient souvent d’être converties. Les réponses à la fertilisation demandaient plus d’attention du fait de la grande variabilité méthodologique des expérimentations.
7
Cela nous a amené à instaurer certaines règles, toujours par souci de conformité entre les différentes études et pour le cas d’étude :
Si la référence comporte plusieurs doses pour un même traitement, on choisira la dose la plus forte sauf si un effet dépresseur (une diminution de biomasse) est observé par rapport aux témoins ou aux autres doses car cela signifie que la quantité totale de l’élément dans le sol devient toxique pour les végétaux.
Bien souvent les traitements et les mesures sont répétés plusieurs fois au fil des années or, dans la base de données on ne renseigne qu’une seule valeur par traitement. Il faut donc choisir une seule année de mesure, ce qui nous a amené à établir une règle sur ce point. Pour les écosystèmes forestiers nous prendrons les mesures de la dernière année, sauf si le temps écoulé entre cette année et la dernière fertilisation est trop important. En effet si ce temps devient trop long, les différences de biomasse entre le témoin et les parcelles traitées diminuent jusqu’à devenir proche de zéro (Trichet et al., 2009).
En revanche, pour les pelouses, savanes, etc., on prend les mesures correspondant à la saison de végétation juste après la fertilisation. La raison à cela est que les herbacés répondent à la fertilisation bien plus vite en terme de biomasse en comparaison aux forêts, et ainsi on pourra obtenir dès l’année du traitement un résultat représentatif du statut nutritif.
Ensuite, lorsque la valeur de la réponse à intégrer a été sélectionnée, celle-ci doit parfois être modifiée car elle peut ne pas exprimer de manière directe la biomasse produite. Si la litière est inclue dans la biomasse totale, il est préférable de la soustraire. Il faut faire attention à ne pas confondre celle-ci avec la biomasse foliaire sur pied (vivante) qui, elle, doit-être incluse puisqu’elle fait partie de la biomasse produite l’année de la mesure.
Lorsque l’on calcule la biomasse à partir du « basal area » (surface terrière exprimée en m² par arbre), il faut transformer cette valeur en la multipliant par le « stem density » (densité d’arbres exprimée en arbres par hectare). On obtient ainsi une mesure en m² par hectare. Il faut s’attendre à de possibles déformations des réponses de biomasse et/ou de croissance selon les 4 modalités (C, N, P, NP) puisque les densités d’arbres ne sont pas les mêmes entre les différentes parcelles (sauf pour les plantations). Si les densités sont trop différentes, on ne peut pas utiliser les données et la publication est rejetée.
De la même manière, si dans une étude les réponses en biomasse entre les différents blocs d’un même traitement n’ont pas les mêmes caractéristiques (conditions abiotiques, différences de diversité spécifique au niveau qualitatif et/ou quantitatif), on ne pourra pas faire la moyenne entre
8
les biomasses ou les taux de croissance. Il faudra alors utiliser la moyenne des indices de réponse (RRX : cf. ci-dessous).
Enfin pour les données autres que celles correspondant à la réponse à la fertilisation (valeurs pédologiques, concentrations foliaires), nous avons pris la couche superficielle de sol du témoin afin de rendre compte de l’état initial des sols (i.e. avant fertilisation).
Notre objectif était de tendre vers un maximum de renseignements. Ainsi les étapes de recherche, d’intégration et de transformation des données ont composé la partie la plus laborieuse et pour laquelle j’ai consacré la majeure partie de mon temps.
1.4/ La transformation de la base de données
Une fois la base de données terminée, c’est-à-dire que nos recherches sont arrivées à leur terme, il faut procéder à sa transformation afin de pouvoir l’exploiter.
La première étape a été de supprimer les variables, qui étaient a priori intéressantes, mais qui dans les faits étaient très peu renseignées dans les publications (les concentrations minérales foliaires par exemple).
La seconde étape a été de compléter certaines variables d’intérêt peu renseignées ou de les développer par de nouvelles variables. Pour cela nous nous sommes appuyés sur des modèles globaux géo-référencés. Voici les outils utilisés :
- le modèle ISRIC (Soil Reference and Information Center) WISE Global Database (Gray
et al., 2009). C’est un modèle de distribution et de formation des sols, renseignant sur la
nature géologique des propriétés pédologiques comme le pH, la CEC, les différentes teneurs que nous avons utilisées ainsi que les altitudes des sites,
- le modèle Koppen-Geiger du Global Precipitation Climatology Centre (Kottek et al.,
2006). Ce modèle climatique nommé classification de Koppen décrit les grands types de
climat sous la forme de trois déclinaisons de lettres,
- un modèle sur les grands biomes terrestres (Chesworth et al. 2008) a permis de compléter la variable des classes de biomes. Un biome est un ensemble d'écosystèmes caractéristiques d'une aire biogéographique et nommé à partir du climat et de la végétation dominants. Les modalités de cette variable sont Ice, Tundra, Boreal,
Temperate, Mediterranean, Desert et Tropical. Les modalités Ice, Tundra et Boreal ont
été fusionnées en Cold et les modalités Mediterranean, Desert temperate et Temperate
9
- la base de données World Clim (http://worldclim.org/bioclim) a permis de compléter beaucoup de données climatiques comme le MAT, le MAP, l’ETP et l’ETR (Evapotranspiration Réelle).
La troisième et dernière étape a été de calculer de nouveaux indices (et donc de créer encore de nouvelles variables) à partir de variables déjà présentes.
Pour les données climatiques, nous avons calculé la variable « f_Climate ». C’est un indice relatif à l’indice de décomposition climatique de la matière organique CDI (Climatic Decomposition Index ; (Adair et al., 2008)), et qui se calcule avec la relation :
f Climate = 0,4565 x (CDI)0,4466 avec CDI = f T°C x f H2O
f T°C est calculé à partir du MAT (moyennes des températures mensuelles) et f H2O est calculé avec le MAP (précipitations annuelles) et l’ETP (évapotranspiration réelle).
Le f_Climate est compris en entre 0 et 1. Plus le f_Climate est proche de 1 et plus la décomposition de la matière organique du sol est favorisée par les conditions climatiques.
Les réponses en biomasse des essais de fertilisation ont aussi été transformées afin de les rendre plus exploitables. Le premier indice se nomme le RRX (Response Ratio ; (Ainsworth et al., 2007)).
Il permet de calculer la réponse en biomasse relative d’un traitement par rapport à la biomasse du traitement témoin C :
RR(X) = ln (biomasse(X) / biomasse(C)) avec
X correspondant au traitement N, P ou NP. Il permet de faire l’analyse quantitative du gain de croissance avec la fertilisation. On obtient les trois nouvelles variables « RR_MAIN_N », « RR_MAIN_P » et « RR_MAIN_NP ». De l’analyse quantitative ont été déterminée des classes de limitation (analyse qualitative) :
- pour un gain < 10%, la limitation est faible ou nulle,
- pour 10% < gain < 30%, la limitation est modérée,
- pour un gain > 30%, la limitation est forte (Augusto et al., 2013).
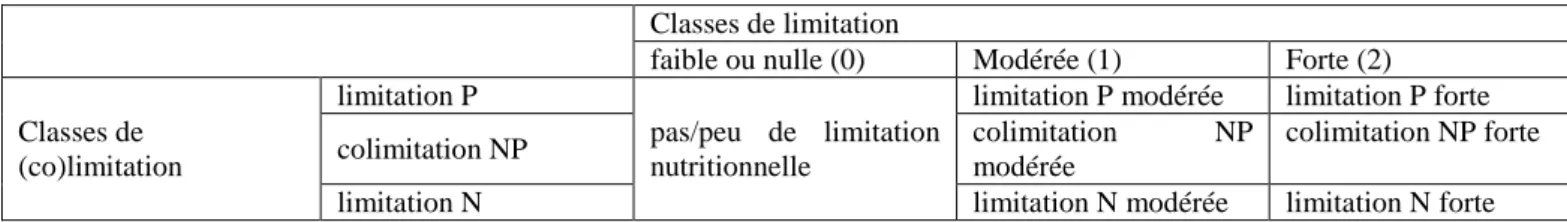
Figure 1 : Espace théorique de limitation basée sur l’évolution du RCI(P) en fonction du RCI(N)
10
Le dernier indice calculé est nommé RCI (Relative Colimitation Index) (Craine & Jackson, 2010), RCI(X) = (biomasse(X) – biomasse(C)) / (biomasse(NP) – biomasse(C)) avec X = traitement N ou P.
0 (biomasse(X) = 0) < RCI(X) < 1 (biomasse(X) = biomasse(NP)) et la colimitation est forte près de 0,5.
Les RCI(P) et RCI(N) doivent être comparés ensemble pour permettre d’obtenir l’information exacte
sur le type de (co)limitation, comme le montre la figure 1 au dessus.
En termes d'équation, le classement de la limitation d'un cas d'étude (figure et tableau 1) est donc résolu de la façon suivante :
- (RCI(N) – 0.2) / RCI(P) > 1 alors N est plus limitant que P,
- (RCI(P) – 0.2) / RCI(N) > 1 alors P est plus limitant que N,
- pour tous les autres cas, c'est une colimitation NP.
Le croisement avec l'analyse qualitative de la limitation sur la base du RRX et du RCI donne ainsi un total de 7 classes, renseignées dans la nouvelle variable « SP_CLSS_COLIM » :
Tableau 1 : Classes de limitation déterminées par l'analyse qualitative
Classes de limitation
faible ou nulle (0) Modérée (1) Forte (2)
Classes de (co)limitation
limitation P
pas/peu de limitation nutritionnelle
limitation P modérée limitation P forte
colimitation NP colimitation NP
modérée
colimitation NP forte
limitation N limitation N modérée limitation N forte
Pour l’analyse qualitative de la (co)limitation, l’indice synthétique nommé RCINP est quantifié
comme étant la distance à la bissectrice (droite de pente 1:1 passant par 0 dans l’espace théorique de limitation, figure 1) et permet d’obtenir le gradient suivant (figure 2) :
Il permet, en une seule valeur, de déterminer la nature et l’amplitude de la limitation pour un site donné. Les valeurs de RCIX et RCINP n’incluent pas les limitations faibles ou nulles.
Une fois toutes ces étapes de transformation effectuées, la base de données est exploitable. Elle comporte 83 types de renseignements soit 9 de moins que la base de données brute du début seulement les variables sont bien plus fournies qu’au départ et la masse d’information est supérieure. Au final, la base de données inclut les résultats en provenance de 95 cas d’études décrits par 83 variables (Annexe 1).
11
1.5/ Analyses statistiques
La base de données a pu ensuite être traitée avec le logiciel Rstudio afin de déterminer et quantifier statistiquement les corrélations qui existent entre les différentes variables et les réponses des essais de fertilisation.
Un test de Student en fonction de 0 a permis de distinguer sur la figure 3 l’effet du traitement (RRN,
RRP et RRNP) par rapport à celui du témoin pour chacun des 5 grands biomes de l’étude (et de
l’ensemble des sites, nommé Global). Un test de Bonferroni a discriminé à posteriori les RRX pour
chaque biome (lettre A, B et C ; a, b, et c pour P < 0,1).
La corrélation du RRN en fonction du f_climate de la figure 4 a été étudiée par un modèle linéaire.
Enfin une Anova a permis d’étudier l’évolution du RCINP en fonction des types de sols du biome
Temperate humid, figure 5. Ce biome a été sélectionné car il rassemblait le plus grand nombre de
sites renseignés. Un test post-hoc de Tukey a montré les différences de RCINP entre les sols.
2/Résultats
La figure 3 donne une grande quantité d’informations, qui pose la base des résultats de la méta-analyse. Chaque point représente une valeur de RRX pour un traitement. Chaque étude possède 3
RRX, un par modalité (N, P, NP). Les RRX des études ont été rassemblés en fonction des biomes
dans lesquels se trouvent les sites d’expérimentation. On obtient alors les box plots de la figure 3. Premièrement, dans les différents biomes, les écosystèmes présentent toujours des RRX
significativement supérieurs à 0 pour les trois traitements, sauf pour le biome Tropical semi-aride (Tropical semi-arid) où le traitement phosphore n’est pas statistiquement différent de 0.
Figure 3 : Réponses des différents biomes aux essais de fertilisation. En abscisse sont inscrits les 5 grands biomes (plus le Global pour l’ensemble des sites). En ordonnée est renseigné le Relative growth rate, qui correspond au RRX, pour chaque traitement N (box plots bleu), P (box plots rouge) et NP (box plots marron).
12
Au regard de l’indice de Bonferroni (figure 3), on observe que les RRNP sont toujours supérieurs
aux RRN et aux RRP, sauf pour le biome Tropical semi-aride où les RRN ne sont pas différents des
RRNP. En revanche les RRN et RRP ne sont pas statistiquement différents l’un de l’autre pour les
biomes Tropical humide (Tropical humid), Tempéré humide (Temperate humid), Sec et Méditerranéen (Dry & Mediterranean) et Tropical semi-aride (Tropical semi-arid). Pour le biome Froid (Cold) les RRN sont supérieurs aux RRP. Enfin, pour la classe Globale (Global), on note la
tendance suivante : RRNP> RRN > RRP (P = 0,059).
La figure 4 représente l’évolution du RRX en fonction du f_Climate. Le RRX traduit la réponse en
terme de biomasse lors d’un ajout de N. Plus il est fort et plus le système est limité en N. Le f_Climate est l’indice climatique de décomposition de la MO du sol (cf. Matériels et Méthodes). Plus il est proche de 1 et plus les conditions climatiques sont favorables à la décomposition (humidité et température élevées, à droite de la figure 4). A l’inverse, plus il est proche de 0 (à gauche de la figure 4) et plus le climat est contraignant. On observe une diminution du RRN lorsque
l’indice f_Climate augmente. Ceci a été quantifié par un modèle linéaire ayant une pente de – 0,818 (P = 0,0037). On observe donc sur l’ensemble des sites une corrélation négative très significative entre le RRN (la limitation en N) et le climat.
Figure 4 : Réponse en biomasse des écosystèmes à la fertilisation en N (RRN) en fonction de
13
La figure 5 présente l’évolution de l’indice relatif de contribution à la colimitation entre N et P nommé RCINP, en fonction du type de sol de la classification USDA dans le biome Tempéré
humide. La relation apparaît significative entre les valeurs de l’indice RCINP et les types de sols des
sites testés dans le biome Tempéré humide (P = 0,012). En y regardant de plus près, par un test post-hoc de Tukey (résultats représentés par les lettres A et B en rouge), seuls les RCINP des
spodosols (SPOD) et des entisols (ENTI) sont significativement différents.
Les spodosols sont des sols très altérés (USDA Soil Taxonomy). La part de P dans les limitations est très supérieure à celle de N (figure 2). Au regard de la moyenne des RCIN (0,097) et des RCIP
(0,821) et en reportant ces valeurs sur la figure 1, la limitation peut être qualifiée de limitation simple en P. Ensuite, la valeur du RRP (0,324) permet de déterminer que la limitation en P est forte,
au regard du tableau 1 (exponentiel (RRP) = 1,383).
Les entisols sont des sols jeunes et peu altérés (USDA Soil Taxonomy). La part de N dans la limitation est très supérieure à celle de P (figure 2). Comme précédemment, en reportant sur la figure 1 les valeurs de RCIN (0,64) et RCIP (0,108), le système se situe entre une limitation en série
N vers P et une limitation simple en N (figure 1). La valeur du RRN (0,38) indique que la limitation
en N est forte, en se rapportant au tableau 1 (exponentiel (RRN) = 1.462).
Les sites sur histosols, inceptisols et mollisols sont colimités car leur RCINP est aux alentours de 0.
Figure 5 : Graphique de l'évolution de l’indice relatif de colimitation entre N et P (RCINP) en fonction des types de sols de la
classification USDA pour le biome Temperate humide. En abscisse sont inscrits 5 types de sols du biome avec ENTI pour entisol, HIST pour histosol, INCE pour inceptisol, MOLL pour mollisol et SPOD pour spodosol. En ordonnée est renseigné le RCINP. Les alfisols et les ultisols ont été retirés en raison du faible nombre de sites concernés (n=1).
14
Beaucoup de variables ont été testées pour expliquer les limitations nutritionnelles des sites de la méta-analyse. Cependant peu d’entre elles permettent d’obtenir des corrélations significatives. Certaines variables comme le MAT ne présentaient tout simplement pas de relation, d’autres ne possédaient pas assez de données (beaucoup de valeurs manquantes) comme la géologie ou la pédologie. Ainsi, les variables géologie et pédologie de nos hypothèses de départ n’ont pas permis de donner des corrélations significatives avec les limitations nutritionnelles (mis à part avec la pédologie dans le biome Tempéré humide, figure 5).
Les variables testées sans succès sont les suivantes :
- les caractéristiques pédologiques comme la texture, le pH H2O ou le ratio C/N, les N et P
totaux,
- certaines variables climatiques comme le MAT, le MAP ou des variables dérivées, - la latitude (légère corrélation positive non significative avec le RRN),
- le type de végétation (forêt, prairies, savanes, etc.) et ses caractéristiques (formes et durées de vie des feuilles).
3/ Discussion
La méta-analyse a produit de nombreux éléments de compréhension de la variation du statut nutritif en azote et en phosphore des écosystèmes au niveau mondial. Ces résultats permettent d’interpréter certains processus vis-à-vis de leurs influences sur les limitations nutritionnelles et sur leurs liens avec le paradigme latitudinal (Vitousek & Howarth, 1991).
La figure 3 donne une vision globale de la variabilité des réponses à l’ajout de N, P ou NP et donc des limitations et colimitations de ces éléments grâce à l’expression du Response Ratio (RRX). De
manière générale la réponse à l’apport simultané en N et en P est toujours significativement supérieure à l’apport d’un seul élément, sauf pour le biome Tropical semi-aride où la réponse à l’ajout d’azote n’est pas significativement différente de celle du traitement NP. Cela montre la prépondérance au niveau terrestre de la colimitation en N et en P, et un effet généralement additionnel des limitations en N et en P (Harpole et al., 2011).
Au vu des RRX des éléments apportés individuellement, on constate que N et P limitent toujours la
productivité des écosystèmes, mais dans une moindre mesure que le traitement NP. Ce n’est peut-être pas le cas en revanche du phosphore dans le biome Tropical semi-aride où la réponse n’est pas différente de 0. Si l’on compare les RRX des deux éléments on observe rarement une différence
significative, sauf pour les biomes de climat froid (Cold) qui sont plus limités en azote. Cependant, les limitations en N semblent relativement plus prononcées que celles en P pour les différents
15
biomes. Cette tendance semble être soutenue au niveau global (figure 1) : l’importance de la limitation en N des écosystèmes terrestres semble supérieure à celle de la limitation en P.
Ces premiers éléments contredisent partiellement le paradigme de la distribution latitudinale des limitations en montrant que le statut nutritif a bien plus de variabilité que ce qu’il était convenu de penser, et que les écosystèmes sont le plus souvent colimités (Harpole et al., 2011). On observe que les écosystèmes de basse latitude (tropicaux) ne sont pas limités simplement par P. En effet N joue un rôle aussi important en zone Tropicale humide où l’on observe en moyenne une colimitation additive indépendante (figure 1). Il devient même l’élément le plus limitant lorsque le climat est aride (zone Tropicale semi-aride). Le schéma est similaire dans le biome Sec et Méditerranéen, où N a tendance à plus limiter la productivité (même si ici P a un effet significatif). Dans les biomes froids (Cold), de la même manière, on ne retrouve pas de limitation simple en N car la productivité reste sensible, dans une moindre mesure, à l’apport de P. Ainsi, même aux extrêmes du gradient latitudinal, la colimitation reste présente.
Le paradigme montrerait donc des lacunes importantes pour prédire le statut nutritif. Ces écarts, au regard de nos résultats, sont soutenus par l’absence de corrélation entre les limitations de l’ensemble de nos sites avec la latitude (mis à part une tendance à l’augmentation du RRN avec la
latitude). Le gradient latitudinal n’est donc pas vérifié.
Néanmoins, tous les résultats ne vont pas tout à fait à l’encontre du paradigme. Bien que les écosystèmes du biome Cold soient colimités, la réponse en terme de biomasse des plantes à un apport de N reste significativement supérieure à celle de P. Le paradigme statue aussi sur une colimitation dans les écosystèmes de latitudes intermédiaires, ce qui est vérifié avec les biomes Tempéré sec et Tempéré humide avec une colimitation additive indépendante (figure1), bien qu’il y ait une grande variabilité de réponses à la fertilisation.
Le paradigme ne peut être validé à la vue de nos résultats, cependant, dans certains cas et notamment dans les écosystèmes de hautes et moyennes latitudes, pour l’élément N, le gradient latitudinal ne peut être non plus démenti.
Dans une seconde partie nous mettons en lumière les processus et paramètres sous-jacents qui peuvent expliquer les différents statuts nutritifs.
L’évolution de la réponse à l’ajout d’azote en fonction de l’indice f_Climate montre l’importance du rôle que joue le climat sur les limitations en N (figure 4). Lorsque celui-ci contraint la décomposition de la matière organique (valeurs faible du f_Climate, dans la partie gauche de la
16
figure 4), ou plus précisément lorsque la température et/ou l’humidité diminuent, la limitation en N augmente. Cela est dû à l’activité microbienne qui est inhibée par le froid et/ou la sécheresse. Or celle-ci est l’actrice de la décomposition dans les sols (Aerts & Chapin, 2000). Si cette activité ralentit alors c’est aussi la libération des éléments minéraux (ou minéralisation) qui ralentit. La matière organique s’accumule et conserve l’azote sous forme organique, non disponible pour les plantes. Ainsi, même si la teneur en N total du sol est élevée, la teneur en N minéral (disponible) est faible, et la productivité s’en retrouve limitée. C’est pour cela que la fertilisation en N (minéral) donne de plus grands gains de biomasse dans les écosystèmes de haute latitude, du fait de la lente décomposition de la MO, comme c’est le cas des taïgas et des toundras qui accumulent la MO dans les sols. A l’inverse, dans les climats chauds et humides, comme dans la zone Tropicale humide, l’azote est rapidement minéralisé, ce qui augmente sa disponibilité pour les végétaux.
Il est important de rappeler que la température et l’humidité ne sont pas les seuls facteurs impliqués dans la décomposition. La présence de métabolites secondaires produits lors des interactions allélopathiques entre les végétaux (phénols, terpénoïdes, alcaloïdes), d’un rapport C/N fort, d’une trop grande quantité d’eau dans le sol (anoxie) peuvent être contraignants (Attiwill & Adams, 1993). Néanmoins, le climat reste le facteur expliquant le mieux la décomposition de la matière organique et peut expliquer en bonne partie les limitations en N. Et ceux, d’autant plus que les symbioses nodulaires (fixatrice d’azote) sont stimulées par la température (tant que celle-ci n’est pas trop élevée ; (Houlton et al., 2008)), ce qui permet d’augmenter l’azote total de l’écosystème et donc aussi expliquer le rôle du climat.
On comprend pourquoi nous retrouvons une corrélation entre le climat et la limitation en N. Le biome Tropical semi-aride est limité par l’azote puisque c’est ici la sécheresse qui est inhibitrice. Ensuite, il est admis que climat est fonction de la latitude, ce qui explique pourquoi, dans la figure 3, le biome Froid et la tendance du RRN soutiennent en partie le paradigme.
En reliant le climat aux processus de limitation en N on parvient à expliquer en partie nos résultats, ce qui n’est pas le cas du P qui semble être moins corrélé à la variable climatique. Le cycle biogéochimique de cet élément indique que P est très lié à la géologie du sol (Attiwill & Adams,
1993). Il est libéré de la roche mère par altération puis par diffusion des ions phosphate. On a ainsi
été amené à penser que le phosphore disponible serait fonction de la nature géologique (altérabilité et concentration en phosphore dans la roche) et à son niveau d’altération (lié à la fois à la nature géologique et au climat).
Il n’a pas été possible de montrer une quelconque relation avec les caractéristiques géologiques ni pédologiques (texture, pH, concentrations en nutriments). Cependant, la figure 5 montre que la
17
variabilité du RCINP peut dépendre du type de sol, en se plaçant dans un seul biome afin d’atténuer
l’expression de la latitude et donc de la variable climatique : les sols jeunes (i.e. entisols) sont plutôt limités en N alors que des sols altérés (i.e. spodosols) sont plutôt limités en P. La première conclusion que l’on peut apporter provient du fait que, pour un même biome (ici Tempéré humide), et donc une même zone latitudinale, le statut nutritif peut présenter de la variabilité suivant les sites (figure 5). Cela va à l’encontre du paradigme qui, en région tempérée, prédit uniquement des colimitations.
Ensuite on a pu mettre en évidence l’influence du type de sol et des facteurs pédogénétiques sur le statut nutritif (Hahm et al., 2014) (figure 5). Les entisols sont des sols peu développés dont la roche mère est peu altérée. Ce sont donc des sols qualifiés de jeunes et peu altérés. Les spodosols, en revanche, sont profonds ( > 2 mètres), d’une part parce qu’ils sont plus vieux mais aussi parce que la roche mère (souvent siliceuse) est pauvre en éléments altérables. Ce sont des sols très altérés. En reliant ces caractéristiques à la théorie du vieillissement des sols (Walker & Syers, 1976), les entisols sont riches en composés phosphatés mais l’azote ne s’est pas encore beaucoup accumulé : limitation en N. A l’inverse, les spodosols sont pauvres en composés phosphatés mais sont riches en azote : limitation en P.
Les facteurs pédogénétiques dans leur ensemble (la nature géologique et la teneur en P du sol, le climat, la végétation) peuvent expliquer les limitations en P et aussi en N. Ceux-ci sont très variables et peuvent expliquer la diversité des statuts nutritifs observée dans la zone Tempérée humide (figure 5). En effet le climat est corrélé à la latitude mais enregistre aussi des variations locales. La géologie est indépendante de la latitude et présente beaucoup de variabilité spatiale (Hartmann & Moosdorf, 2012).
Ainsi on observe que des facteurs locaux, comme la géologie ou les micro-variations du climat, influent sur le statut nutritif et peuvent amener des écarts au paradigme se référant d’avantage à des processus globaux tels que les macro-variations du climat.
On a donc pu donner des éléments d’explication des limitations nutritionnelles, et notamment en P en intégrant la géologie et la pédologie. Cependant nous manquons de données pour conclure réellement sur ces processus locaux et sur les limitations en P.
Pour revenir sur la prépondérance de la colimitation au niveau mondial, cela peut relever de l’importance des effets synergiques entre ces deux éléments, sous-estimés par le paradigme (et la loi de Liebig). Les plantes peuvent, modérément, adapter leur teneur et leur stœchiométrie en nutriments à la disponibilité (Bloom et al., 2012) (Davidson & Howarth, 2007). Par ailleurs, dans les écosystèmes plurispécifiques, la complémentarité des stratégies d’acquisition et d’utilisation des
18
ressources des différentes espèces, comme les nutriments, tend aussi à induire plus de colimitation
(Danger et al., 2008).
En résumé, le paradigme donne une vision simplifiée et réductrice des processus de limitation nutritionnelle qui affectent les écosystèmes terrestres. En effet, considérer le climat comme la seule variable explicative du vieillissement des sols et des limitations ne permet pas de rendre compte de l’ensemble de la variabilité des statuts nutritifs présentés ici. A la fois pour N et pour P, des paramètres climatiques, pédologiques et géologiques interviennent au niveau local, sans dépendre complètement de la latitude. Enfin le rôle de la végétation dans l’équilibre des disponibilités en N et en P n’est pas à négliger. L’azote semble tout de même limiter d’avantage les écosystèmes terrestres (Vitousek & Howarth, 1991).
Deux limites sont à souligner en ce qui concerne la portée de notre étude. La première réserve est le manque de données pour pouvoir conclure sur certains processus et facteurs, comme la pédologie et la géologie (à l’origine de nos hypothèses). Cela relève à la fois de notre méthodologie très stricte, mais est aussi dû à la nature et à l’échelle des processus qui sont parfois difficilement renseignables tel que la géologie. C’est la raison pour laquelle si peu d’explications ont été trouvées pour le phosphore. Deuxièmement, nos résultats nous amènent à conclure que tous les écosystèmes terrestres sont limités par les nutriments. Toutefois il existe en méta-analyse un biais bien connu : le biais de publication (Gurevitch & Hedges, 1999), voulant que l’acte de publication soit facilité par la mise en évidence de limitations nutritionnelles. Il conviendrait de tester ce possible biais dans les prochaines étapes d’analyse des données.
Il serait également possible de pallier au manque d’informations en élargissant le cadre trop restreint de l’étude, en intégrant les essais de fertilisation uniquement en P (i.e. en intégrant des essais n’ayant que les traitements C et P). Dans une autre mesure, et cela rejoint le paragraphe des indices (cf. introduction), il serait possible d’utiliser les indices foliaires et de sols pour compléter nos résultats basés sur les essais de fertilisation. Ces trois axes de recherche forment le cadre du projet GNL (Global Nutrient Limitation) porté par l’équipe Bionut de l’UMR ISPA (INRA), dont le but est d’étudier de manière globale les statuts nutritifs des écosystèmes terrestres.
19
Conclusion
Le paradigme latitudinal nutritionnel (Vitousek & Howarth, 1991) prédit un gradient de limitation de P vers N avec l’augmentation de la latitude. Ce paradigme se base sur le climat comme unique variable explicative du vieillissement des sols et des processus biogéochimiques, conditionnant la disponibilité de N et de P pour les plantes.
Une méta-analyse synthétisant des données mondiales de limitation nutritionnelle terrestre a montré les limites et la simplicité du paradigme au regard des processus en jeu. En effet la répartition de ces limitations entrait en contradiction avec les prédictions du gradient latitudinal.
Le climat ne peut pas expliquer à lui seul la diversité de statut nutritif retrouvée. A l’échelle mondiale, la grande majorité des sols serait colimitée, même aux latitudes extrêmes. Il se pourrait que les effets synergiques, en contradiction avec la loi de Liebig, aient été sous-estimés.
A l’échelle d’un biome, une forte variabilité des statuts nutritifs apparaît, qui n’est pas attendu sous le paradigme. On a démontré que le type de sol influait sur les limitations nutritionnelles. Cela met en évidence l’importance des deux grands facteurs pédogénétiques avec l’ensemble des variations du climat (macro, meso et microclimat) et de la diversité des substrats géologiques.
La suite logique serait de poursuivre et d’affiner nos connaissances en étendant nos recherches sur la caractérisation du statut nutritif par l’utilisation des indices sol et foliaires. Cela forme le cadre du projet GNL (Global Nutrient Limitation) de l’équipe Bionut de l’UMR ISPA de la Grande Ferrade (INRA).
20
Bibliographie
Adair, E. C., Parton, W. J., Del Grosso, S. J., Silver, W. L., Harmon, M. E., Hall, S. a., … Hart, S. C. (2008). Simple three-pool model accurately describes patterns of long-term litter decomposition in diverse climates. Global Change Biology, 14(11), 2636–2660. http://doi.org/10.1111/j.1365-2486.2008.01674.x
Aerts, R., & Chapin, F. S. (2000). The Mineral Nutrition of Wild Plants Revisited: A Re-evaluation of Processes and Patterns. Advances in Ecological Research.
Ainsworth, E. A., Rosenberg, M. S., & Wang, X. (2007). Meta-analysis: the past, present and future. New Phytologist, 176(4), 742–745. http://doi.org/10.1111/j.1469-8137.2007.02296.x
Alvarez-Clare, S., & Mack, M. C. (2015). Do Foliar, Litter, and Root Nitrogen and Phosphorus Concentrations Reflect Nutrient Limitation in a Lowland Tropical Wet Forest? Plos One, 10(4), e0123796. http://doi.org/10.1371/journal.pone.0123796
Attiwill, P. M., & Adams, M. A. (1993). Tansley Review No . 50 Nutrient cycling in forests, (50), 561–582.
Augusto, L., Delerue, F., Gallet-Budynek, A., & Achat, D. L. (2013). Global assessment of limitation to symbiotic nitrogen fixation by phosphorus availability in terrestrial ecosystems using a meta-analysis approach. Global Biogeochemical Cycles, 27(3), 804–815.
http://doi.org/10.1002/gbc.20069
Bloom, A. J., Chapin, F. S., & Mooney, H. A. (2012). Plants-an Economic Analogy. Too Long, 16(1985), 363–392.
Chadwick, O. A., Derry, L. A., Vitousek, P. M., Huebert, B. J., & Hedin, L. O. (1999). Changing sources of nutrients during four million years of ecosystem development. Nature, 397, 491 – 497. http://doi.org/10.1038/17276
Craine, J. M., & Jackson, R. D. (2010). Plant nitrogen and phosphorus limitation in 98 North American grassland soils. Plant and Soil, 334(1), 73–84. http://doi.org/10.1007/s11104-009-0237-1
Danger, M., Daufresne, T., Lucas, F., Pissard, S., & Lacroix, G. (2008). Does Liebig’s law of the minimum scale up from species to communities? Oikos,
117(11), 1741–1751. http://doi.org/10.1111/j.1600-0706.2008.16793.x
Davidson, E. A., & Howarth, R. W. (2007). Nutrient in synergy. Nature, 449, 1000–1001. http://doi.org/10.1111/j.1461-0248.2007.01113.x Elser, J. J., Bracken, M. E. S., Cleland, E. E., Gruner, D. S., Harpole, W. S., Hillebrand, H., … Smith, J. E. (2007). Global analysis of nitrogen and
phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems. Ecology Letters, 10(12), 1135–1142. http://doi.org/10.1111/j.1461-0248.2007.01113.x
Fisher, J. B., Malhi, Y., Torres, I. C., Metcalfe, D. B., van de Weg, M. J., Meir, P., … Huasco, W. H. (2013). Nutrient limitation in rainforests and cloud forests along a 3,000-m elevation gradient in the Peruvian Andes. Oecologia, 172(3), 889–902. http://doi.org/10.1007/s00442-012-2522-6 Gray, J. M., Humphreys, G. S., & Deckers, J. A. (2009). Relationships in soil distribution as revealed by a global soil database. Geoderma, 150(3-4),
309–323. http://doi.org/10.1016/j.geoderma.2009.02.012
Gurevitch, J., & Hedges, L. V. (1999). Statistical issues in ecological meta-analyses.
Hahm, W. J., Riebe, C. S., Lukens, C. E., & Araki, S. (2014). Bedrock composition regulates mountain ecosystems and landscape evolution.
Proceedings of the National Academy of Sciences of the United States of America, 111(9), 3338–43.
http://doi.org/10.1073/pnas.1315667111
Harpole, W. S., Ngai, J. T., Cleland, E. E., Seabloom, E. W., Borer, E. T., Bracken, M. E. S., … Smith, J. E. (2011). Nutrient co-limitation of primary producer communities. Ecology Letters, 14(9), 852–862. http://doi.org/10.1111/j.1461-0248.2011.01651.x
Hartmann, J., & Moosdorf, N. (2012). The new global lithological map database GLiM: A representation of rock properties at the Earth surface.
Geochemistry, Geophysics, Geosystems, 13(12), 1–37. http://doi.org/10.1029/2012GC004370
Houlton, B. Z., Wang, Y.-P., Vitousek, P. M., & Field, C. B. (2008). A unifying framework for dinitrogen fixation in the terrestrial biosphere. Nature,
454(7202), 327–330. http://doi.org/10.1038/nature07028
Ioannidis, J. P. A. (2010). Meta-research: The art of getting it wrong. Research Synthesis Methods, 1(3-4), 169–184. http://doi.org/10.1002/jrsm.19 Kottek, M., Grieser, J., Beck, C., Rudolf, B., & Rubel, F. (2006). World map of the Köppen-Geiger climate classification updated. Meteorologische
Zeitschrift, 15(3), 259–263. http://doi.org/10.1127/0941-2948/2006/0130
McGroddy, M. E., Daufresne, T., & Hedin, O. L. (2004). Scaling of C : N : P Stoichiometry in Forests Worldwide : Implications of Terrestrial Redfield- Type Ratios. Ecology, 85(9), 2390–2401. http://doi.org/10.1890/03-0351
Nemani, R. R., Keeling, C. D., Hashimoto, H., Jolly, W. M., Piper, S. C., Tucker, C. J., … Running, S. W. (2003). Climate-driven increases in global terrestrial net primary production from 1982 to 1999. Science (New York, N.Y.), 300(5625), 1560–1563.
http://doi.org/10.1126/science.1082750
Sullivan, W., Alvarez-Clare, S., Castle, S. C., Porder, S., Reed, S. C., Schreeg, L., … Cleveland, C. C. (2014). Assessing nutrient limitation in complex forested ecosystems: alternatives to large-scale fertilization experiments. Ecology, 95(3), 668–681.
Townsend, A. R., Cleveland, C. C., Houlton, B. Z., Alden, C. B., & White, J. W. C. (2011). Multi-element regulation of the tropical forest carbon cycle.
Frontiers in Ecology and the Environment, 9(1), 9–17. http://doi.org/10.1890/100047
Trichet, P., Bakker, M. R., Augusto, L., Alazard, P., Merzeau, D., & Saur, E. (2009). Fifty years of fertilization experiments on Pinus pinaster in Southwest France: The importance of phosphorus as a fertilizer. Forest Science, 55(5), 390–402.
Vadeboncoeur, M. A. (2010). Meta-analysis of fertilization experiments indicates multiple limiting nutrients in northeastern deciduous forests.
Canadian Journal of Forest Research, 40(9), 1766–1780. http://doi.org/10.1139/X10-127
Vitousek, P. M., & Howarth, R. W. (1991). Nitrogen Limitation on Land and in the Sea : How Can It Occur ? Biogeochemistry, 13(2), 87–115. Walker, T. W., & Syers, J. K. (1976). The fate of phosphorus during pedogenesis. Geoderma, 15(1), 1–19.
http://doi.org/10.1016/0016-7061(76)90066-5
Wang, Y. P., Law, R. M., & Pak, B. (2010). A global model of carbon, nitrogen and phosphorus cycles for the terrestrial biosphere. Biogeosciences,
7(7), 2261–2282. http://doi.org/10.5194/bg-7-2261-2010
Yuan, Z. Y., Chen, H. Y. H., & Reich, P. B. (2011). Global-scale latitudinal patterns of plant fine-root nitrogen and phosphorus. Nature
21
22 la légende, avec la savane (savanna), le désert (desert), la formation arbustive (shrubland), la forêt (forest), la toundra (tundra), la prairie (grassland) et la zone humide (wetland).
23
Résumé :
Le modèle latitudinal des limitations nutritionnelles en azote (N) et en phosphore (P) des écosystèmes terrestres fait consensus dans la littérature scientifique. Cependant ce paradigme donne une vision simplifiée des statuts nutritifs des sols. Il se base uniquement sur l’influence du climat, en prédisant un gradient latitudinal allant d’une limitation en P pour les écosystèmes de basses latitudes (zone intertropicale) vers une limitation en N pour les écosystèmes de hautes latitudes (zones boréales). Une méta-analyse a permis d’étudier les limitations en N, P et NP (colimitations) au niveau mondial, au regard de ce paradigme. Il semble que la colimitation soit prépondérante puisque chacun des deux éléments conserve souvent un effet sur la productivité, quelle que soit la latitude. On a aussi mis en évidence une forte variabilité des statuts nutritifs à l’échelle d’un biome. Ces écarts au paradigme ont permis de l’invalider partiellement tout en montrant le rôle d’autres facteurs comme le type de sol, les facteurs pédogénétiques comprenant la nature géologique et l’ensemble de la variabilité du climat. Le rôle de la plasticité physiologique des végétaux n’est pas à ignorer non plus, en effet elle tend à atténuer les différences de disponibilité entre les nutriments et donc à favoriser la colimitation. Néanmoins, le nombre de sites d’étude reste relativement faible et certaines variables explicatives n’étaient pas suffisamment renseignées. Il est donc encore difficile de conclure de manière formelle sur le rôle de l’ensemble des processus et sur la validité du paradigme.
Abstract:
The latitudinal model of nitrogen (N) and phosphorus (P) nutritional limitations in terrestrial ecosystems embodies a consensus in scientific literature. However, this paradigm gives a simplified vision of soil nutritional status. It only draws upon climate influence, predicting a latitudinal gradient of P limitation in low latitudinal ecosystems (inter tropical area) to N limitation in high latitudinal ecosystems (boreal areas). Concerning the paradigm, a meta-analysis enabled us to study N and P limitations and NP colimitations at world scale. It seems that colimitation is preponderant because each of the elements has an effect on productivity, independently of latitude. We also show a high variability in biome scale nutritional status. These discrepancies with the model permit us to partially invalidate it, while showing the role of other factors, such as soil type and pedogenetic factors — including bedrock composition and the full range of climate variability —. In addition, plant physiological plasticity plays a major role, tending to moderate availability differences between nutrients (promoting colimitation). Nevertheless, the number of study sites and their related parameters remain insufficient to definitively conclude about every processes role and the validity of the paradigm.