Dysfonction des tissus adipeux et obésité viscérale
chez la femme
Thèse
Andréanne Michaud
Doctorat en nutrition
Philosophiae Doctor (Ph.D.)
Québec, Canada
© Andréanne Michaud, 2016
Dysfonction des tissus adipeux et obésité viscérale
chez la femme
Thèse
Andréanne Michaud
Sous la direction de :
iii
Résumé
Une accumulation excessive de tissu adipeux à l’intérieur de la cavité abdominale est fortement associée aux altérations métaboliques. La dysfonction des tissus adipeux, conduisant à un stockage limité des lipides, pourrait représenter l’un des principaux mécanismes pour expliquer le lien entre l’obésité viscérale et les altérations métaboliques. La pathogenèse d’un tissu adipeux dysfonctionnel se caractérise, entre autres, par : 1) une accumulation préférentielle de graisse viscérale; 2) une hypertrophie adipocytaire; 3) une augmentation du nombre de cellules immunitaires infiltrant le tissu adipeux; 4) des changements dans la composition cellulaire du tissu adipeux; et 5) une hypersécrétion de cytokines proinflammatoires. L’objectif général de cette thèse est d’examiner les caractéristiques fonctionnelles et morphologiques des tissus adipeux abdominaux en relation avec la physiopathologie de l’obésité viscérale. Afin de rencontrer cet objectif, nous avons développé une approche méthodologique permettant de cibler plusieurs aspects de la dysfonction adipeuse à partir d’échantillons de tissus adipeux sous-cutané et omental prélevés chez des femmes couvrant le spectre d’adiposité de mince à obèse. Nous avons également mesuré la distribution des graisses et la composition corporelle par tomographie axiale et absorptiométrie aux rayons X (DEXA), respectivement. D’abord, nous avons démontré qu’une accumulation excessive de graisse viscérale est un prédicteur significatif d’un tissu adipeux dysfonctionnel, caractérisé, entre autres, par une hypertrophie adipocytaire et une augmentation de la proportion des petits adipocytes dans les deux compartiments adipeux. De plus, nos résultats ont révélé que les adipocytes hypertrophiés des deux compartiments adipeux sont caractérisés par une réponse lipolytique augmentée et une expression altérée des gènes codant pour des protéines impliquées dans le métabolisme de l’adipocyte ou l’inflammation. Par ailleurs, nous avons montré que les préadipocytes localisés dans le tissu adipeux viscéral sécrètent plus de PGF2α en réponse aux stimuli inflammatoires que ceux localisés
dans les dépôts adipeux sous-cutanés, suggérant une prédisposition des cellules du compartiment viscéral à répondre à l’inflammation. Tel que rapporté dans d’autres modèles, nous avons observé que l’aldo-céto réductase AKR1B1 semble avoir un rôle prédominant dans la synthèse de PGF2α par
les préadipocytes humains. Enfin, nos études ont démontré que seulement l’accumulation de collagène autour des adipocytes, spécialement dans le dépôt adipeux omental, est associée aux mesures d’adiposité et aux altérations métaboliques. Ainsi, l’accumulation de collagène péricellulaire pourrait être plus délétère que la déposition de collagène totale et pourrait contribuer à la dysfonction des tissus adipeux en limitant l’expansion des adipocytes. En conclusion, nos travaux montrent que plusieurs aspects de la dysfonction adipeuse sont associés à l’obésité viscérale et aux altérations cardiométaboliques.
iv
Abstract
Robust clinical and epidemiological studies now support the notion that excess fat accumulation within the abdominal cavity is strongly associated with metabolic alterations such as insulin resistance and dyslipidemia. Adipose tissue dysfunction, leading to limited lipid storage and reduced adipose tissue expandability, represents one of the major mechanisms to explain the link between visceral obesity and metabolic alterations. The pathogenesis of adipose tissue dysfunction is characterized by 1) excess visceral fat accumulation; 2) adipocyte hypertrophy and impaired adipogenesis; 3) increased number of immune cells infiltrating adipose tissue; 4) changes in the cellular composition of adipose tissue; and 5) secretion of pro-inflammatory cytokines. The overall objective of this thesis is to examine functional and morphological characteristics of human abdominal adipose tissues in association with the pathophysiological impact of visceral obesity. To achieve our objective, we have developed approaches to target each aspect of adipose tissue dysfunction using omental and subcutaneous fat surgical samples obtained in lean to obese women. Body composition and fat distribution were measured by dual-energy x-ray absorptiometry (DEXA) and computed tomography, respectively. First, we found that excess visceral fat accumulation is a strong marker of dysfunctional adipose tissue, which is characterized by hypertrophic adipocytes of the large cell populations and increased proportion of small cells in both fat compartments. Furthermore, our results revealed that hypertrophic adipocytes in both fat compartments are characterized by alterations in adipocyte lipolysis and adipose tissue expression of genes coding for proteins involved in adipocyte metabolism or inflammation. We demonstrated that preadipocytes from the omental fat compartment released more PGF2α in response to inflammatory stimuli
compared to those from the subcutaneous fat, indirectly suggesting a predisposition of omental fat cells to respond to inflammation through this mechanism. As previously demonstrated in other models, we found that the aldose reductase AKR1B1 has a predominant role in PGF2α synthesis by
human preadipocytes. Our studies demonstrated that only collagen deposition around adipocytes, especially in the omental fat compartment, is associated with adipocyte measurements and cardiovascular risk variables. Our findings are consistent with the hypothesis that pericellular collagen accumulation may be more detrimental than total collagen accumulation and may contribute to adipose tissue dysfunction by limiting further adipocyte expansion. In conclusion, our studies show that many aspects of adipose tissue dysfunction are associated with visceral obesity and cardiometabolic alterations.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... x
Liste des abréviations ... xiii
Remerciements ... xix
Avant-propos ... xxi
Introduction ... 1
1. Problématique de l’obésité ... 1
1.1 Définition, prévalence et étiologie ... 1
1.2 Distribution régionale du tissu adipeux ... 2
1.2.1 Dimorphisme sexuel ... 2
1.2.2 Localisation anatomique des compartiments adipeux ... 3
1.2.3 Complications métaboliques associées à l’obésité viscérale ... 5
1.2.4 Variation interindividuelle ... 10
2. Dysfonction des tissus adipeux abdominaux et altérations métaboliques ... 12
2.1 Composition et rôles généraux des tissus adipeux abdominaux ... 12
2.2 Taille adipocytaire ... 13
2.2.1 Méthodes de mesure ... 13
2.2.2 Relation avec le sexe, le dépôt anatomique et le niveau d’adiposité ... 15
2.2.3 Déterminants des altérations cardiométaboliques ... 19
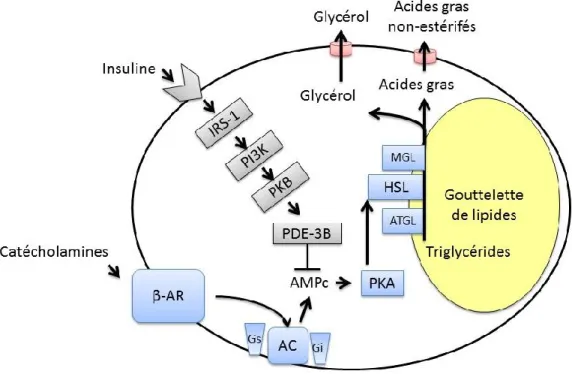
2.3 Lipolyse altérée ... 23
2.4 Lipogenèse altérée ... 25
2.5 Adipogénèse altérée ... 28
2.6 Homéostasie du glucose et de l’insuline altérée ... 29
2.7 Inflammation du tissu adipeux ... 30
2.7.1 Adipocytokines... 31
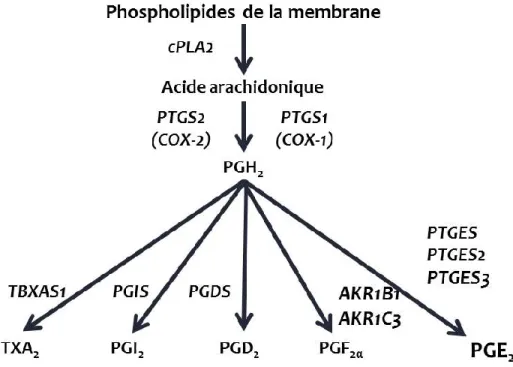
2.7.2 Prostaglandines... 33
2.7.3 Macrophages ... 40
vi
2.8 Matrice extracellulaire et fibrose ... 49
2.8.1 Définition et rôles généraux ... 49
2.8.2 Lien avec l’adiposité ... 50
2.8.3 Différence de dépôt adipeux ... 54
2.8.4 Lien avec les complications cardiométaboliques ... 55
2.8.5 Origine cellulaire et facteurs impliqués dans le développement de la fibrose du tissu adipeux ... 56
3. Problématique de recherche ... 58
Objectifs et hypothèses... 59
Méthodologie ... 62
CHAPITRE 1: Populations des adipocytes abdominaux chez les femmes avec une obésité viscérale ... 66
Résumé ... 67
Abstract ... 69
Introduction ... 70
Subjects and Methods ... 72
Results ... 76
Discussion ... 81
References ... 86
CHAPITRE 2: Morphologie des adipocytes omentaux et sous-cutanés et relation avec l’expression génique, la réponse lipolytique et les niveaux d’adipocytokines chez la femme ... 100
Résumé ... 101
Abstract ... 103
Introduction ... 104
Materials and Methods ... 106
Results ... 109
Discussion ... 111
References ... 116
CHAPITRE 3: Synthèse de prostaglandine (PG) F2 alpha par les tissus adipeux abdominaux humains : modulation par les cytokines inflammatoires et rôle de l’aldose réductase humaine AKR1B1 ... 126
Résumé ... 127
Abstract ... 129
vii
Materials and Methods ... 132
Results ... 137
Discussion ... 140
References ... 144
CHAPITRE 4: L’expression des gènes impliqués dans la synthèse des prostaglandines et leurs récepteurs dans les tissus adipeux humains sous-cutané et omental: différence de dépôt et modulation par l’adipogenèse ... 158
Résumé ... 159
Abstract ... 161
Introduction ... 162
Materials and Methods ... 164
Results ... 169
Discussion ... 173
References ... 178
CHAPITRE 5: Importance de la fibrose totale et péricellulaire des tissus adipeux dans la physiopathologie de l’obésité viscérale et du risque cardiométabolique associé ... 192
Résumé ... 193
Abstract ... 195
Introduction ... 196
Subjects and Methods ... 198
Results ... 201
Discussion ... 204
References ... 208
Conclusion... 219
Bibliographie ... 232
Annexe : Dérivation biliopancréatique avec commutation duodénale chez les personnes âgées : résultats à long terme d’une étude contrôlée ... 252
viii
Liste des tableaux
Introduction :
Tableau 1. Sommaire des études ayant examiné le lien entre des marqueurs de fibrose dans le tissu adipeux, l’adiposité et les complications cardiométaboliques ... 53 Chapitre 1 :
Table 1. Characteristics of the 60 women of the study ... 89 Table 2. Pearson correlation coefficients between OM and SC adipocyte size bimodal distribution parameters and age or adiposity measurements. ... 90 Table 3. Multiple linear regression analysis for Mode, Nadir and % of small cells in SC and OM adipose tissues ... 91 Table 4. Pearson correlation coefficients between OM or SC adipocyte sizes bimodal distribution parameters and metabolic alterations. ... 92 Chapitre 2 :
Table 1. Characteristics of women matched for overall and regional adiposity but with either hypertrophic or hyperplasic adipocytes in omental or subcutaneous adipose tissue ... 119
Supplemental Table 1. Sequences of primers used in real-time RT-PCR quantification ... 125
Chapitre 3 :
Table 1. Oligonucleotides used in real-time RT-PCR quantification ... 147 Table 2. Characteristics of the sample (n=46) ... 148 Table 3. Pearson correlation coefficients between AKR1B1 mRNA expression level in
subcutaneous (SC) or omental (OM) adipose tissue and anthropometric measurements or HOMAir
Index (n=46) ... 149 Chapitre 4 :
Table 1. Characteristics of the sample (n=46) ... 181 Table 2. Pearson correlation coefficients between PLA2G16, AKR1B1, PTGDS, PTGER3 or PTGER4 mRNA expression level in subcutaneous (SC) or omental (OM) adipose tissue and body composition or fat distribution (n=46) ... 182 Supplemental Table 1. Oligonucleotides used in realtime RT-PCR quantification ... 191
ix Chapitre 5 :
Table 1. Pearson correlation coefficients between total or pericellular collagen % in subcutaneous (SC) (n=56) or omental (OM) (n=53) adipose tissue and age, anthropometrics, body fat mass, CT-scan data or adipocyte size. ... 211 Table 2. Pearson correlation coefficients between total or pericellular collagen % in subcutaneous (SC) (n=56) or omental (OM) (n=53) adipose tissue, and lipid profile or glucose homeostasis .... 212
x
Liste des figures
Introduction :
Figure 1. Patron de distribution des graisses chez l’humain et risque cardiométabolique associé... 3 Figure 2. Localisation anatomique des principaux dépôts adipeux abdominaux ... 4 Figure 3. Représentation des aires de tissus adipeux viscéral et sous-cutané mesurées par
tomographie axiale au niveau des vertèbres L4-L5 ... 5 Figure 4. Mécanismes reliant l’accumulation de gras au niveau viscéral et les complications
métaboliques ... 10 Figure 5. Variabilité interindividuelle importante dans l’accumulation de tissu adipeux viscéral... 11 Figure 6. Distribution des tailles adipocytaires.. ... 15 Figure 7. Moyenne des tailles adipocytaires des dépôts adipeux abdominaux omental (OM) et sous-cutané (SC) de 176 groupes d’individus provenant de 78 études publiées. ... 18 Figure 8. Schéma représentatif de la stimulation ou l’inhibition de la lipolyse ... 24 Figure 9. Voie de synthèse des prostaglandines de la série 2 ... 35 Figure 10. Schéma des voies de signalisation des récepteurs membranaires spécifiques à PGF2α et
PGE2. ... 38
Figure 11. Augmentation de l’infiltration de macrophages dans les tissus adipeux de sujets obèses ... 42 Figure 12. Images représentatives de tissus adipeux humains colorés au rouge de picrosirius pour identifier les fibres de collagène. ... 50 Figure 13. Représentation des diverses expériences effectuées à partir des échantillons de tissus adipeux ... 65
Chapitre 1 :
Figure 1. Comparison of adipocyte size bimodal distribution parameters between SC and OM adipose tissue (n=54) ... 95 Figure 2. Correlations between the mode of large adipocyte populations, the nadir of the
distribution or the percentage of small cells in OM (n=55) (A) or SC (n=59) (B) adipose tissues... 96 Figure 3. Comparison of OM and SC adipocyte size bimodal distribution parameters between women characterized by normal (n=28) or visceral adiposity (n=31), but with similar overall
adiposity ... 97 Figure 4. Comparison of OM adipocyte size bimodal distribution parameters (A-C), HOMAir index
(D) and isolated OM adipocyte lipolysis (E-F) in women characterized by larger- (n=26) or smaller- (n=29) than-predicted OM adipocytes, but similar overall adiposity... 98 Figure 5 Comparison of SC adipocyte size bimodal distribution parameters (A-C), HOMAir index
(D) and isolated SC adipocyte lipolysis (E-F) in women characterized by larger- (n=33) or smaller- (n=26) than-predicted SC adipocytes, but similar overall adiposity. ... 99
xi Chapitre 2 :
Figure 1. (A) Comparison of isolated omental adipocyte lipolysis in women characterized by hypertrophic or hyperplasic omental adipocytes, but similar total body fat mass and body fat distribution; (B) Comparison of isolated subcutaneous adipocyte lipolysis in women characterized by hypertrophic or hyperplasic subcutaneous adipocytes, but similar total body fat mass and body fat distribution ... 121 Figure 2. Subcutaneous (SC) or omental (OM) PPARG, CEBPB, GLUT4 and PLIN mRNA
expression in women characterized by hyperplasic or hypertrophic omental (A) and subcutaneous (B) adipocytes, but with similar overall and regional adiposity ... 122 Figure 3. Subcutaneous (SC) or omental (OM) CD68 (A), CD14 (B), CD31 (C) and vWF (D) mRNA expression in women with omental adipocyte hyperplasia or hypertrophy, but with similar overall and regional adiposity. ... 123 Figure 4. Plasma adiponectin and IL-6 levels in women characterized by hyperplasic (n=19) or hypertrophic (n=21) omental (A) and subcutaneous (B) adipocytes, but with similar overall and regional adiposity ... 124 Chapitre 3 :
Figure 1. PGF2α release by omental and subcutaneous fat cells ... 152
Figure 2. COX-2 and PGF synthase expression in primary preadipocytes ... 153 Figure 3. Depot differences in COX-2 expression in primary preadipocytes ... 154 Figure 4. Effect of aldose reductase inhibitor on PGF2α release by human primary preadipocytes
... 155 Figure 5. PGF2α release by omental mature adipocytes... 156
Figure 6. PGF2α release by omental mature adipocytes in relation with body fatness and metabolic
variables ... 157 Chapitre 4 :
Figure 1. Basal release of PGE2 and PGF2α by subcutaneous and omental (A) adipose tissue
explants (n=8) or (B) primary preadipocyte cultures ... 185 Figure 2. Omental and subcutaneous adipose tissue mRNA expression of several transcripts coding for enzymes involved PG synthesis or PG receptors in women (n=46) ... 186 Figure 3. Omental (n=4) and subcutaneous (n=5) preadipocyte mRNA expression of several transcripts coding for enzymes involved PG synthesis or PG receptors ... 187 Figure 4. A) PPARγ mRNA expression during omental (n=4) or subcutaneous (n=5) preadipocyte differentiation (0h, 6h, 1d, 8d); and B) Eight days after induction of differentiation, lipid storage was assessed using phase contrast microscopy at 20 X magnification imaging of differentiated, Oil Red O-stained cells ... 188 Figure 5. A) PLA2G16, B) COX-1 (PTGS1), C) COX-2 (PTGS2), D) AKR1B1, E) PTGDS, F) PTGIS, G) PTGES, H) PTGES2, I) PTGES3 J) PTGFR, K) PTGER2 and L) PTGER3 mRNA expression during omental (n=4) or subcutaneous (n=5) preadipocyte differentiation... 189
xii
Figure 6. PGE2 (A) and PGF2α (B) production rate during omental (n=4) or subcutaneous (n=5)
preadipocyte differentiation ... 190
Chapitre 5 :
Figure 1. Representative images of total collagen staining (picrosirius red) in OM (A) and SC (B) adipose tissue samples from an overweight women. ... 214 Figure 2. Representative images at X10 magnification of pericellular collagen staining (picrosirius red) in OM and SC adipose tissue samples from a lean woman and an obese woman, selected according to their BMI value. ... 215 Figure 3. (A) Representative detection of a crown-like structure (CLS) in SC adipose tissue from an obese woman. (B) Representative detection of CD68+ macrophages in collagen areas of SC adipose tissue from an obese woman. (C) Representative detection of immunohistochemical staining of CD68+ macrophages in SC adipose tissue from an obese woman. ... 216 Figure 4. OM fibro-inflammation marker score in relation to body fatness and metabolic variables ... 217
Conclusion :
xiii
Liste des abréviations
AA : acide arachidonique AC : adénylate cyclase
adPLA : phospholipase du tissu adipeux AE1-329 : agoniste du récepteur EP4 AE3-208 : antagoniste du récepteur EP4 AKRs : aldo-céto réductases
AKR1B1 : aldo-céto réductase 1B1 AKR1C3 : aldo-céto réductase 1C3 Akr1b3 : aldo-céto réductase 1b3 Akr1b7 : aldo-céto réductase 1b7 Akr1b5 : aldo-céto réductase 1b5 AL8810 : antagoniste du récepteur FP AMPc : adénosine monophosphate cyclique Apo : apolipoprotéine
ARNm : acide ribonucléique messager ATGL : triglycérides lipase du tissu adipeux β-AR: récepteurs β-adrénergiques
BMI: body mass index
CCL3 : Chimiokine (C-C motif) ligand 3 CCL5 : Chimiokine (C-C motif) ligand 5
CCR2 : récepteur chimiokine (C-C motif) de type 2 CCR5 : récepteur chimiokine (C-C motif) de type 5 C/EBPα : CCAAT/enhancer binding proteins α CETP : protéine de transfert des esters de cholestérol COL5A1 : gène du collagène de type 5α1
xiv COL6A1 : gène du collagène de type 6α1
COL6A3 : gène du collagène de type 6α3 COX-1/PTGS1 : cyclooxygénase 1 COX-2/PTGS2 : cyclooxygénase 2
cPGES/PTGES-3 : synthase de la prostaglandine E2 cytosolique
cPLA2 : phospholipase A2 cytosolique
DBP : Dérivation biliopancréatique DEXA : absorptiométrie aux rayons X DGAT : diacylglycérol acyltransférase DI : indice de disposition / disposition index ELISA : essai d’immuno-absorption enzymatique EP: récepteur de la prostaglandine E2
FABP4 : fatty acid binding protein 4 FAS : acide gras synthase
FF : hyperalimentation (fast-food) FP : récepteur de la prostaglandine F2α
G3PDH : glycérol-3-phosphate déshydrogénase GAPT 1 : glycérol-phosphate acyltransférase 1
GDR: taux de disposition de glucose / glucose disposal rate GLUT4 : transporteur de glucose 4
HbA1c : hémoglobine glycquée HDL : lipoprotéine de haute densité HIF-1 : hypoxia-inducible factor-1
HOMA-IR : indice de résistance à l’insuline
hMADs : cellules souches multipotentes humaines isolées à partir du tissu adipeux 17β-HSD type 5 : 17-β hydroxystéroïde-déshydrogénase
xv HSL : lipase hormono-sensible
IFN-γ : interferon-γ
IMC : indice de masse corporelle IRO : obèse résistant à l’insuline
IRS-1 : substrat du récepteur de l’insuline ISO : obèse sensible à l’insuline
KRH : Krebs-Ringer-Henseleit L4-L5 : 4e et 5e vertèbres lombaires
LDL : lipoprotéine de faible densité IL : interleukine
LOX : Lysyl oxidase
IP : récepteur de la prostaglandine I2
LPL : lipoprotéine lipase LPS : lipopolysaccharide
M1 : macrophages M1 activés par la voie classique M2 : macrophages M2 activés par la voie alternative MAPK: mitogen-activated protein kinase
MCP-1 : monocyte chemoattractant protein-1 MEFs : fibroblastes embryonnaires de souris MGL : lipase des monoglycérides
MMPs : métalloprotéinases matricielles
mPGES-1/PTGES1 : synthase microsomale de la prostaglandine E2
mPTGES-2/PTGES2 : synthase microsomale de la prostaglandine E2
MRP4: protéine 4 associée à la résistance à plusieurs médicaments
NCEP-ATP III: National Cholesterol Education Program/Adult Treatment Panel III report NFκB : nuclear factor kappa-light-chain-enhancer of activated B cells
xvi OM : omental
OMS : Organisation mondiale de la Santé PDE-3B : phosphodiestérase de type 3B PGD2 : prostaglandine D2
PGDS : Prostaglandine D2 synthase
PGE2 : prostaglandine E2
PGES : prostaglandine E2 synthase
PGF2α : prostaglandine F2α
PGFS : prostaglandine F2α synthase
PGG2 : prostaglandine G2
PGH2 : prostaglandine H2
PGI2 : prostaglandine I2 / prostacycline
PGIS : prostaglandine I2 synthase
15d-PGJ2 : 15-Deoxy-prostaglandine J2
Δ12-PGJ
2 : Delta12-prostaglandine J2
PGT: transporteur de prostaglandines PI3-K : phosphatidylinositol 3-kinase PKA : protéine kinase AMP-c dépendante PKB : protéine kinase B
PLIN : périlipine
PPARγ : Peroxisome Proliferator Activated Receptor γ
QUICKI: Quantitative insulin sensitivity check index / indice de sensibilité à l’insuline RP : rouge de picrosirius
SC : sous-cutané
SI : sensibilité à l’insuline
xvii STAT-1 : signal transducer and activator of transcription 1 TA : tissu adipeux
TBXAS1 : TXA synthase Tg : triglycérides
TGF-β: transforming growth factor-β TLR4: toll-like receptor 4
TM : trichrome de Masson
TNF-α : facteur de nécrose tumorale alpha TXA2 : thromboxane A2
TZDs : thiazolidinediones
VEGF : facteur de croissance de l’endothélium vasculaire VLCD : diète très faible en calorie/ very low caloric diet VLDL : lipoprotéines de très faible densité
xviii
À Dave, pour tes encouragements, ton
support et ton amour
xix
Remerciements
La réalisation de cette thèse de doctorat aurait été impossible sans la contribution scientifique et le soutien de nombreuses personnes. Je tiens donc à leur adresser mes plus sincères remerciements.
J’adresse d’abord mes remerciements à mon directeur de recherche, le Dr André Tchernof, qui a contribué de façon inestimable à l’accomplissement de mes études. Mon stage en recherche dans son laboratoire en 2009 a été un point tournant de ma vie professionnelle. J’ai découvert à ce moment un grand intérêt pour sa problématique de recherche. Cette expérience positive m’a conduit vers la poursuite de mes études graduées dans son équipe. En premier lieu, j’aimerais remercier mon directeur de recherche pour sa confiance, ses encouragements, son support, son encadrement et sa rigueur scientifique. Sa passion pour la recherche et l’excellence de ses travaux sont une source de motivation et d’inspiration. Mes études graduées dans son laboratoire m’ont permis de m’épanouir d’un point de vue scientifique, personnel et professionnel. Je le remercie de m’avoir offert de belles opportunités de congrès, ainsi qu’un stage en recherche à l’étranger. J’aimerais également le remercier pour son écoute, son soutien et ses précieux conseils quant à mon avenir professionnel. André, tu es un mentor exceptionnel. Merci pour tout!
Je tiens également à remercier sincèrement tous les membres qui font ou qui ont fait partie de l’équipe du Dr Tchernof pendant mes études : Mélissa Pelletier, Mélanie Nadeau, Julie Anne Côté, Anne-Sophie Morisset, Julie Lessard, Marc Lapointe, Thomas Grenier-Larouche, Anne-Marie Carreau, Sofia Laforest, Marie-Michèle Boulet, Alain Veilleux, Maude Caron-Jobin, Renée Drolet, Nathalie Paquet, Annick Ouellet, Judith Marcoux, Mohamed Mansour, Geneviève B. Marchand, Jennifer Labrecque et Mouna Zerradi. J’aimerais les remercier pour leur contribution scientifique, leur support, leur disponibilité et leurs conseils au cours des dernières années. J’aimerais remercier plus spécialement Mélissa et Alain qui m’ont initié au travail de laboratoire et sans qui la réalisation de mes travaux de recherche aurait été impossible. Je remercie également des collègues formidables qui sont devenues des amies précieuses : Mélissa, Julie Anne, Anne-Sophie, Maude et Julie. Merci de faire partie de ma vie!
Pendant mon doctorat, j’ai eu la chance d’effectuer un stage à l’étranger dans le laboratoire du Dre Karine Clément à Paris. Je tiens à remercier Karine et toute son équipe qui m’ont fourni le support et le matériel nécessaire à la réalisation de mon projet de stage. J’aimerais remercier spécialement Joan Tordjman, Yuejun Liu et Gilles Le Naour pour leur contribution scientifique et leur aide essentielle en laboratoire. J’aimerais également remercier plusieurs collaborateurs qui ont contribué
xx
significativement aux projets de recherche présentés dans cette thèse : Dr Nicolas Lacroix-Pépin, Dr Michel A Fortier, Serge Simard, Dr Laurent Biertho et Dr Alain Géloën. Je remercie également les étudiants et les professionnels de recherche du Centre de recherche de l’IUCPQ que j’ai eu le plaisir de côtoyer pendant mon doctorat.
J’aimerais également remercier le FRQS, le centre de recherche de l’IUCPQ, ainsi que les Fonds d’opération des IRSC (MOP-102642) pour le soutien financier. Je remercie également les IRSC pour la bourse de développement des compétences en recherche sur le genre, le sexe et la santé ainsi que les nombreuses bourses de voyage obtenues au cours de mon doctorat.
En terminant, je tiens à remercier ma famille et ma belle-famille qui m’appuient dans tous les projets que j’entreprends. Un merci spécial à mes parents Lyne et Michel, mon frère Olivier et ma grand-mère Madeleine qui me supportent dans tous mes choix de vie. Merci pour votre présence, vos encouragements et votre amour. Enfin, merci à mon amoureux Dave, à qui je dédie cette thèse. Je te remercie pour ton support, tes encouragements constants et ton amour depuis maintenant 10 ans. Merci pour ta présence à mes côtés depuis le début de cette aventure. C’est un privilège de partager ma vie avec toi.
xxi
Avant-propos
Cette thèse de doctorat présente l’ensemble des travaux que j’ai réalisés sous la supervision du Dr André Tchernof, professeur titulaire à l’École de Nutrition de l’Université Laval. Celle-ci porte essentiellement sur la dysfonction des tissus adipeux abdominaux en lien avec l’obésité viscérale chez la femme. L’introduction décrit, dans un premier temps, la problématique de l’obésité abdominale et la relation avec le développement des complications métaboliques. Dans un deuxième temps, l’introduction présente une description plus détaillée des principales caractéristiques d’un tissu adipeux dysfonctionnel, soit 1) l’hypertrophie adipocytaire, 2) le métabolisme des lipides altéré, 3) le métabolisme du glucose altéré, 4) la sécrétion de cytokines inflammatoires, 5) l’infiltration des macrophages et 6) le remodelage de la matrice extracellulaire et la fibrose. Les chapitres 1 à 5, ainsi que l’Annexe présentent les travaux effectués au cours de mon doctorat sous forme de manuscrits originaux rédigés en anglais. Ces manuscrits seront présentés tels que publiés ou soumis dans les revues scientifiques avec comité de lecture. Cette thèse se terminera par une discussion et une conclusion générale des principaux résultats afin de situer la contribution de ces travaux à l’avancement des connaissances dans le domaine.
Les manuscrits présentés dans cette thèse sont le fruit du travail de plusieurs personnes. J’aimerais d’abord souligner la contribution essentielle de mon directeur de doctorat à la réalisation des travaux de cette thèse. Effectivement, le Dr André Tchernof est le chercheur principal de chaque étude. Il est responsable du financement, de la conception, de l’élaboration et de la supervision des études présentées dans les chapitres 1 à 5. De plus, il a été impliqué dans toutes les étapes de la rédaction des manuscrits telles que l’analyse et l’interprétation des données ainsi que la rédaction, la révision et l’approbation finale des articles. Les prochains paragraphes décriront plus en détail ma contribution et celle des co-auteurs à chaque article.
Chapitre 1 : Michaud A, Laforest S, Pelletier M, Nadeau M, Simard S, Daris M, Lebœuf M, Vidal H, Géloën A,Tchernof A. Abdominal Adipocyte Populations in Women with Visceral Obesity. European Journal of Endocrinology, 2015 Nov 17. pii: EJE-15-0822. (Article sous presse)
Dans le cadre de ce projet nous avons examiné la relation entre la distribution bimodale des tailles adipocytaires et la physiopathologie de l’obésité viscérale dans une cohorte de femmes minces à obèses ayant subi une chirurgie gynécologique élective. Pour ce projet, j’ai participé à la collecte, à la compilation, à l’analyse statistique et à l’interprétation des données, ainsi qu’à la rédaction complète du manuscrit. Sofia Laforest, étudiante à la maîtrise sous la supervision du Dr André
xxii
Tchernof, a participé à l’analyse et l’interprétation des données. Mélissa Pelletier et Mélanie Nadeau, deux professionnelles de recherche dans l’équipe du Dr André Tchernof, ont effectué la coordination du projet, le recrutement des participantes et les expériences en laboratoire. Serge Simard, statisticien au Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec, m’a offert une aide précieuse pour l’analyse statistique des données avec le logiciel SAS. La Dre Marleen Daris et le Dr Mathieu Lebœuf, deux gynécologues au CHU de Québec, ont participé à la supervision des aspects cliniques de l’étude et au prélèvement des échantillons de tissus adipeux. Le Dr Hubert Vidal, chercheur à l’Université de Lyon (CARMEN INSERM U1060, INSA-Lyon, Villeurbane, France), a participé à l’analyse et l’interprétation des données, ainsi qu’à la révision finale du manuscrit. Le Dr Alain Géloën, également chercheur à l’Université de Lyon, a collaboré de façon significative à l’analyse des échantillons de tissus adipeux avec le compteur Coulter Multisizer. Il a également participé à la collecte, à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction du manuscrit. Lilas Hadji et Véronique Pierre ont également participé à l’analyse des échantillons avec le compteur Coulter Multisizer.
Chapitre 2 : Michaud A, Boulet MM, Veilleux A, Noël S, Paris G, Tchernof A. Abdominal adipocyte morphology and its relation to adipose tissue metabolism, gene expression, lipolysis and adipokine levels. Metabolism Clinical and Experimental, 2014 Mar, 63 (3): 372-81.
Dans le cadre de ce projet, nous avons examiné la relation entre la morphologie des adipocytes abdominaux et diverses fonctions du tissu adipeux chez la femme. Pour ce projet, j’ai effectué les analyses statistiques et l’interprétation des données, ainsi que la rédaction complète du manuscrit. Marie-Michèle Boulet, qui était étudiante à la maîtrise sous la supervision du Dr André Tchernof au moment de la réalisation de cet article, a participé à l’analyse statistique des données. De plus, Dr Alain Veilleux, maintenant professeur à l’École de Nutrition de l’Université Laval, a contribué à l’analyse statistique des données avec le logiciel SAS. Dre Suzanne Noël et Dr Ga
ëtan Paris,
deux gynécologues au CHU de Québec,
ont participé à la supervision des aspects médicaux del’étude et au prélèvement des échantillons de tissus adipeux.
Chapitre 3 : Michaud A, Lacroix-Pépin N, Pelletier M, Veilleux A, Noël S, Bouchard C, Marceau P, Fortier MA, Tchernof A. Prostaglandin (PG) F2 alpha synthesis in human subcutaneous and omental adipose tissue: modulation by inflammatory cytokines and role of the human aldose reductase AKR1B1. PLOS ONE, 2014 Mar 24; 9(3):e90861.
xxiii
Chapitre 4 :
Michaud A, Lacroix-Pépin N, Pelletier M, Daris M, Biertho L, Fortier MA, Tchernof A. Expression of genes related to prostaglandin synthesis or signaling in human subcutaneous and omental adipose tissue: depot differences and modulation by adipogenesis. Mediators of Inflammation, Novembre 2014.451620Ces deux manuscrits ont été réalisés dans le cadre d’un projet subventionné par les IRSC qui visait à évaluer la synthèse des prostaglandines de la série 2 par les divers types cellulaires du tissu adipeux humain. Ce projet était réalisé en collaboration avec l’équipe du Dr Michel A. Fortier, chercheur au Centre de recherche du CHU de Québec-Axe reproduction, santé de la mère et de l’enfant. Le Dr Fortier a participé à la conception de l’étude et à la planification des expériences ainsi qu’à la rédaction des manuscrits. Pour ma part, j’ai participé aux expériences en laboratoire (culture cellulaire et culture d’explants de tissus adipeux). Mélissa Pelletier et Dr Alain Veilleux m’ont enseigné les différentes méthodes en laboratoire et ils ont participé à la planification des expériences. J’ai également analysé l’ensemble des données et j’ai rédigé les deux manuscrits dans leur entièreté. Je tiens aussi à souligner le travail de Mélissa Pelletier pour les expériences en laboratoire (buvardages western, extraction d’ARN et culture cellulaire). Dr Nicolas Lacroix-Pépin a procédé aux dosages des prostaglandines. De plus, il a contribué significativement à la planification des expériences. Dre Suzanne Noël, Dre Céline Bouchard et Dre Marleen Daris
,
des gynécologues au CHU de Québec,
ont participé à la supervision des aspects cliniques desétudes et au prélèvement des échantillons de tissus adipeux chez les femmes admises pour une chirurgie gynécologique. Dr Picard Marceau et Dr Laurent Biertho, chirurgiens bariatriques à l’Institut universitaire de cardiologie et de pneumologie de Québec, ont participé au prélèvement des échantillons de tissus adipeux chez les patientes obèses sévères. Nathalie Paquet, responsable de la plateforme d’expression génique (RT-qPCR) au Centre de recherche du CHU de Québec, a effectué la quantification des gènes dans ces deux études.
Chapitre 5 : Michaud A, Tordjman J, Pelletier M, Liu Y, Le Naour G, Laforest S, Noël S, Bouchard C, Clément K, Tchernof A. Relevance of total and pericellular adipose tissue fibrosis in the pathophysiology of human visceral obesity and related cardiometabolic risk. (Manuscrit soumis à la revue International Journal of Obesity le 18 décembre 2015)
Dans le cadre de cette étude, nous avons examiné l’impact de la fibrose totale et péricellulaire en lien avec la physiopathologie de l’obésité abdominale chez la femme. Nous avons réalisé ce projet en collaboration avec l’équipe du Dre Karine Clément, chercheure à l’Université Pierre et Marie Curie (INSERM, U872, Nutriomique, Centre de recherche des cordeliers, Paris, France). Dans les
xxiv
dernières années, l’équipe du Dre Clément a développé l’expertise nécessaire afin de quantifier la fibrose dans les tissus adipeux humains. J’ai donc effectué un stage de recherche dans son équipe en novembre 2014 afin de mesurer la fibrose et l’infiltration des macrophages dans nos échantillons de tissus adipeux par immunohistochimie. Dans le cadre de cette étude, j’ai également effectué la compilation, la saisie, l’analyse statistique et l’interprétation des données, ainsi que la rédaction du manuscrit. Dre Joan Tordjman, maître de conférences à l’Université Pierre et Marie Curie, a contribué à la réalisation des expériences d’immunohistochimie, à l’analyse des images de fibrose et à la planification des expériences. Elle m’a enseigné les techniques en laboratoire. Dre Yuejun Liu, qui était étudiante au doctorat sous la supervision du Dre Clément et du Dre Tordjman au moment de la réalisation de ce projet, a participé aux expériences d’immunohistochimie et à l’analyse des données. Gilles Le Naour, ingénieur au Département de Pathologie à l’hôpital
Pitié-Salpêtrière à
Paris,
a contribué significativement à l’analyse des lames avec le logiciel CaloPix. MélissaPelletier a coordonné le projet de recherche et recruté les participantes. Elle a également coordonné l’envoi des échantillons à Paris. Sofia Laforest a mesuré la taille des adipocytes sur les coupes histologiques en utilisant le logiciel Calopix. Dre Suzanne Noël et Dre Céline Bouchard ont participé à la supervision des aspects médicaux de l’étude et au prélèvement des échantillons de tissus adipeux. Enfin, Dre Clément a contribué de manière significative à la réalisation de mon stage en recherche, à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction et à la révision finale du manuscrit.
Je termine en remerciant tous les participants de nos projets, puisque sans leur précieuse collaboration, la réalisation de ces études n’aurait pas été possible. De plus, j’aimerais souligner la contribution des gynécologues, du personnel infirmier et des techniciens en radiologie du Centre de recherche du CHU de Québec.
Annexe : Michaud A, B Marchand G, Nadeau M, Lebel S, Hould FS, Marceau S, Lescelleur O, Biron S, Tchernof A, Biertho L. Biliopancreatic diversion with duodenal switch in the elderly: Long-term results of a matched-control study. Obesity Surgery, 2015 juillet.
Au cours de mon doctorat, j’ai également participé à un projet rétrospectif en collaboration avec l’équipe de chirurgiens bariatriques de l’IUCPQ. L’étude présentée dans l’Annexe avait pour objectif de comparer les complications périopératoires et les résultats à long terme de la dérivation biliopancréatique avec commutation duodénale par laparotomie entre les patients âgés et les patients plus jeunes. Pour réaliser ce projet, nous avons obtenu des données rétrospectives à partir d’une base de données prospectives maintenue par l’équipe de chirurgie. Tous les patients âgés de plus de
xxv
60 ans ayant subi une dérivation bilipancréatique avec commutation duodénale (DBP) par laparotomie entre novembre 1992 et septembre 2011 à l’IUCPQ ont été inclus dans l’étude. Ces patients ont ensuite été appariés (1 :1) pour le sexe, l’IMC, la présence de diabète de type 2 et l’année de chirurgie à un groupe de jeunes patients (≤ 55ans). Dr Laurent Biertho a planifié et supervisé l’ensemble du projet. Il a également participé à l’analyse et à l’interprétation des résultats, de même qu’à la rédaction et à la révision finale du manuscrit. J’ai travaillé en étroite collaboration avec Paule Marceau, responsable de la base de données à l’IUCPQ, pour extraire les données et effectuer la compilation. De plus, j’ai effectué le pairage des participants et j’ai participé à la saisie, à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction complète du manuscrit. Geneviève B. Marchand, étudiante d’été au baccalauréat en nutrition sous la supervision du Dr André Tchernof, a contribué significativement à la collecte des données dans les dossiers médicaux et à l’élaboration des bases de données. Mélanie Nadeau a également participé à la collecte des données dans les dossiers médicaux. Les chirurgiens bariatriques de l’IUCPQ (Dr Stéfane Lebel, Dr Frédéric-Simon Hould, Dr Simon Marceau, Dr Simon Biron et Dre Odette Lescelleur) ont participé à la collecte de données, à l’évaluation médicale des participants et à la révision du manuscrit. Enfin, Dr André Tchernof a contribué à l’analyse et à l’interprétation des données ainsi qu’à la rédaction et à la révision finale du manuscrit. Je remercie la participation des patients inclus dans l’étude et la contribution du personnel infirmier de l’IUCPQ.
1
Introduction
1. Problématique de l’obésité
1.1 Définition, prévalence et étiologie
Au Canada, les taux d’embonpoint et d’obésité ont augmenté constamment au cours des dernières décennies (1, 2). En 1998, les données canadiennes montraient que la proportion d’adultes obèses était de 13.8%, alors qu’en 2004 cette proportion s’élevait à 23.1% (1). De plus, le taux d’obésité sévère (IMC>40kg/m2) a augmenté de 225% entre 1990 et 2003 (1). Bien que certaines études plus
récentes semblent montrer que la proportion d'individus obèses soit entrée dans une période de stabilité relative caractérisée par des augmentations moins marquées chez l'adulte et possiblement aussi chez l'enfant (3-5), le nombre d'individus atteints par cette condition demeure très élevé et constitue encore et toujours un enjeu majeur sur les plans scientifique, clinique et économique (2). L’Organisation mondiale de la Santé (OMS) estime même que la prévalence de l’obésité a atteint des proportions épidémiques à l’échelle mondiale et que celle-ci représente une menace grandissante, autant dans les populations industrialisées que dans celles en voie de développement (6). Cette problématique est loin d’être négligeable, puisqu’elle est associée à une augmentation de la mortalité, ainsi qu’à l’apparition de complications musculosquelettiques, métaboliques et psychologiques (6, 7).
L’obésité se caractérise par une accumulation excessive de tissu adipeux qui peut engendrer un risque pour la santé (1). Cette pathologie complexe et multifactorielle résulte de l’interaction de facteurs génétiques, neurocomportementaux, environnementaux, biologiques et métaboliques (8). Ces facteurs contribuent à la création d’un déséquilibre chronique entre l’apport et la dépense énergétique (9). Il existe plusieurs méthodes pour quantifier ou estimer le niveau d’adiposité et la composition corporelle, telles que l’indice de masse corporelle (IMC), la bioimpédance, la mesure des plis cutanés, la pesée hydrostatique, l’absorptiométrie aux rayons X (DEXA) et la mesure de déplacement d’air par pléthysmographie (10-12). L’IMC, qui se calcule en divisant le poids en kilogrammes par la taille en mètres élevée au carré (kg/m2), est fréquemment utilisé en clinique et
dans les études épidémiologiques afin d’examiner la relation entre le niveau d’adiposité et le risque pour la santé (1). Les lignes directrices de l’OMS définissent l’obésité par un IMC égal ou supérieur à 30 kg/m2 (6). Plusieurs études ont montré que la relation entre l’IMC et le risque relatif de
mortalité totale suit une courbe en "J", suggérant que le risque de mortalité augmente avec un poids insuffisant et un poids élevé (13, 14). Ce paradoxe d’obésité s’explique, entre autres, par le fait que l’IMC est un indicateur incomplet du niveau d’adiposité, puisqu’il ne tient pas compte de
2
l’hétérogénéité de la distribution des graisses et de la composition corporelle (15). La distribution des graisses représente l’un des déterminants les plus importants du développement des complications associées à l’obésité. La prochaine section de cette thèse fera un survol du lien entre la distribution régionale des tissus adipeux et les complications cardiométaboliques.
1.2 Distribution régionale du tissu adipeux
1.2.1 Dimorphisme sexuel
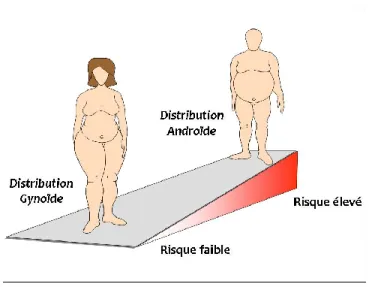
En 1947, le professeur français Jean Vague fut le premier à identifier un dimorphisme sexuel dans la distribution du tissu adipeux (16). En effet, il a classifié l’obésité en fonction de la répartition des graisses. Il a proposé le terme obésité androïde pour référer à une accumulation préférentielle de graisse au niveau du tronc et de la région abdominale et le terme obésité gynoïde pour référer à l’accumulation préférentielle de graisse au niveau des membres inférieurs et de la région glutéo-fémorale (Figure 1) (16). L’obésité de type androïde, observée plus fréquemment chez l’homme, est la plus fortement associée aux complications métaboliques, telles que le diabète de type 2 et les maladies cardiovasculaires. Le patron de distribution des graisses de type gynoïde est plus souvent observé chez la femme et est associé moins fortement aux complications cardiométaboliques. Au début des années 1980, Krotkiewski et al. (17) ont également rapporté que la morphologie corporelle et l’accumulation régionale des tissus adipeux étaient des déterminants importants du développement des complications cardiométaboliques associées à l’obésité. De plus, ce groupe a suggéré que les hormones sexuelles pouvaient expliquer ce dimorphisme (17). Kotani et al. (18) ont également observé une différence sexuelle dans la distribution des graisses et ce, dans tous les groupes d’âge. Pour une même masse grasse, les hommes sont caractérisés par une plus grande accumulation de graisse viscérale et un profil de risque cardiovasculaire plus altéré comparativement aux femmes pré-ménopausées (19). Ainsi, la tendance des hommes à accumuler du tissu adipeux au niveau abdominal semble être un facteur clé pour expliquer les différences sexuelles dans le profil de risque cardiovasculaire (20, 21). Il est important de noter que la proportion de masse grasse, ainsi que la répartition anatomique de cette graisse demeurent très différentes d’un individu obèse à un autre. En effet, l’obésité est une condition très hétérogène autant dans son étiologie que dans la manifestation de ses complications métaboliques. Pour chacun des sexes, il existe donc une importante variabilité interindividuelle dans le patron de distribution des graisses. À titre d’exemple, bien que les femmes aient généralement un patron de distribution des graisses de type gynoïde, certaines d’entre elles sont caractérisées par une importante adiposité abdominale.
3
Figure 1. Patron de distribution des graisses chez l’humain et risque cardiométabolique associé. Source- Données non-publiées, Dr André Tchernof
1.2.2 Localisation anatomique des compartiments adipeux
En raison des nombreuses études publiées depuis les années 1980 (17, 21-23), une accumulation excessive de tissu adipeux au niveau abdominal est rapidement devenue un élément important à prendre en considération en clinique pour l’évaluation du risque cardiométabolique. Chez l’humain, l’accumulation de tissu adipeux est subdivisée en deux principaux compartiments : le tissu adipeux sous-cutané et le tissu adipeux interne (24). Au niveau abdominal, le tissu adipeux sous-cutané comprend deux dépôts distincts : 1) le dépôt adipeux sous-cutané superficiel et 2) le dépôt adipeux sous-cutané profond (Figure 2). Ces deux compartiments adipeux se séparent par le fascia superficiel. Le tissu adipeux interne comprend les tissus adipeux non-viscéral et viscéral. Le compartiment non-viscéral est composé des tissus intramusculaire, intermusculaire et para-osseux, alors que le tissu adipeux viscéral est composé des tissus adipeux intra-thoracique (intra- et extra-péricardique) et intra-abdomino-pelvien (intra- et extra-péritonéal) (21, 24). Le tissu intra-péritonéal comprend la graisse localisée au niveau du grand omentum et du mésentère, alors que le tissu extra-péritonéal comprend la graisse localisée au niveau rétro-extra-péritonéal (Figure 2). D’un point de vue anatomique, le mésentère est un repli du péritoine qui relie les anses de l’intestin grêle à la paroi postérieure de l’abdomen et le grand omentum est un tablier à double feuillets qui recouvre la surface des intestins. Le tissu adipeux viscéral est donc composé des tissus adipeux omental, mésentérique et extra-péritonéale. Il est important de préciser que les tissus adipeux abdominaux sous-cutané et intra-abdominal ont des propriétés métaboliques, morphologiques et anatomiques distinctes. Ces caractéristiques seront détaillées dans les prochaines sections de cette thèse.
4
Figure 2. Localisation anatomique des principaux dépôts adipeux abdominaux-tirée de Tchernof et Després 2013 (21)
Des études épidémiologiques ont rapporté que l’obésité abdominale, mesurée à l’aide du tour de taille, est un facteur de risque important du développement des comorbidités associées à l’obésité (25, 26). En effet, le tour de taille est une mesure anthropométrique facile et rapide à utiliser en clinique pour évaluer le risque de développer des complications métaboliques. Bien que celui-ci corrèle fortement avec la quantité absolue de tissu adipeux viscéral (27), cette mesure ne permet pas de faire la distinction entre les compartiments adipeux abdominaux (28). Des techniques d’imagerie telles que la tomographie axiale et l’imagerie par résonance magnétique sont utilisées afin d’examiner la distribution des graisses au niveau abdominal (29-32). La tomographie axiale permet d’obtenir des images radiologiques transversales de l’abdomen généralement au niveau des 4e et 5e
vertèbres lombaires (L4-L5). Sachant que les propriétés d’atténuation des rayons X sont spécifiques à chaque tissu (29, 31), il est possible de distinguer le tissu adipeux des tissus musculaire et osseux. Tokunaga et al. (31) ont été les premiers à utiliser cette technique pour distinguer et estimer la taille du compartiment adipeux viscéral et celle du compartiment adipeux sous-cutané. La surface de tissu adipeux viscéral est délimitée par les muscles de la paroi abdominale et les vertèbres lombaires, alors que la surface de tissu adipeux située à l’extérieur de ces structures anatomiques représente le tissu adipeux sous-cutané abdominal. La Figure 3 illustre les aires de tissus adipeux viscéral et sous-cutané mesurées au niveau des vertèbres L4-L5 par tomographie axiale. Notre groupe de recherche s’intéresse principalement aux différences morphologiques et métaboliques entre le tissu
5
adipeux abdominal sous-cutané et le tissu adipeux intra-abdominal situé au niveau du grand omentum et du mésentère.
Figure 3. Représentation des aires de tissus adipeux viscéral et sous-cutané mesurées par tomographie axiale au niveau des vertèbres L4-L5- Source : Données non-publiées, Dr André Tchernof.
Il est actuellement bien démontré qu’une accumulation de graisse viscérale mesurée par tomographie axiale est étroitement associée aux complications métaboliques telles que la résistance à l’insuline, l’hypertriglycéridémie, l’hyperinsulinémie, un faible niveau de cholestérol-HDL (lipoprotéine de haute densité), une hypertension et un état pro-inflammatoire et pro-thrombotique (33). Ces anomalies augmentent le risque de développer le diabète de type 2 et les maladies cardiovasculaires. La prochaine section de cette thèse présente brièvement les principales anomalies métaboliques associées à l’obésité viscérale, ainsi que les principales théories proposées pour expliquer la pathogénèse de l’obésité viscérale.
1.2.3 Complications métaboliques associées à l’obésité viscérale
Résistance à l’insuline et diabète de type 2- La relation entre l’obésité intra-abdominale,
l’intolérance au glucose et la résistance à l’insuline est bien établie (34, 35). En 1987, Fujioka et al. (36) ont été les premiers à rapporter que les individus caractérisés par une obésité viscérale mesurée par tomographie axiale ont des niveaux circulants de glucose et de triglycérides à jeun plus élevés suite à un test oral de tolérance au glucose comparativement aux individus avec un IMC similaire mais qui présentent une accumulation préférentielle de tissu adipeux au niveau sous-cutané. Depuis, plusieurs études ont également démontré qu’une accumulation de graisse à l’intérieur de la cavité abdominale est associée à une intolérance au glucose et à une hyperinsulinémie et ce, indépendamment de la composition corporelle (37-39). D’autres études ont montré que les
6
individus caractérisés par une obésité viscérale ont un taux plus faible d’utilisation du glucose pendant un clamp hyperinsulinémique-euglycémique comparativement aux individus avec peu de tissu adipeux viscéral (32, 40). Une étude prospective a également démontré qu’une accumulation excessive de tissu adipeux viscéral est un prédicteur du développement du diabète de type 2 chez des Japonais-Américains, indépendamment des autres facteurs de risque traditionnels (41). Brièvement, le phénomène de résistance à l’insuline observé en présence d’obésité abdominale se traduit par une diminution de la sensibilité à l’insuline, entraînant un défaut de captage du glucose par les tissus insulino-dépendants et une augmentation de la production de glucose au foie. En réponse à cette augmentation des niveaux de glucose circulants, les cellules bêta du pancréas compensent en sécrétant plus d’insuline. Cet état d’hyperinsulinémie compensatoire permet le maintien d’une glycémie dans les valeurs normales pour une certaine période de temps (42). Effectivement, la résistance à l’insuline est une anomalie métabolique qui peut, ultérieurement, favoriser le développement du diabète de type 2. Dans ce cas, les cellules bêta du pancréas sont incapables de sécréter une quantité suffisante d’insuline pour maintenir la glycémie à des valeurs normales (43). La résistance à l’insuline chez les individus présentant une obésité viscérale est aussi reliée à une hypertriglycéridémie, à des concentrations élevées d’apolipoprotéine (Apo) B et à de faibles niveaux de cholestérol-HDL (44). L’excès d’acides gras libres libérés dans la circulation portale par le tissu adipeux viscéral pourrait être impliqué dans l’altération des voies de signalisation de l’insuline et du transport du glucose, ainsi que dans le développement du diabète de type 2 (45). La théorie de la veine porte, qui tente d’expliquer le lien entre la résistance à l’insuline et l’obésité viscérale, sera décrite à la fin de cette présente section.
Dyslipidémie athérogène- L’obésité viscérale est également associée à une altération du profil
lipidique (46). Ce dernier se caractérise par une réduction des taux plasmatiques de cholestérol-HDL, une augmentation des lipoprotéines riches en triglycérides, une augmentation de l’Apo B, ainsi qu’une augmentation de la proportion de particules LDL (lipoprotéines de faible densité) petites et denses (21, 47). En présence d’obésité abdominale, les particules HDL sont également de petite taille, un phénomène attribué à l’hypertriglycéridémie (48). Chez la majorité des individus présentant une obésité viscérale, les niveaux plasmatiques de cholestérol-LDL demeurent près du seuil normal, mais les concentrations d’Apo B augmentent, traduisant la présence de particules LDL petites et denses (44). Normalement, une hypertriglycéridémie et un faible taux de cholestérol-HDL sont les deux anomalies les plus observées avec l’obésité viscérale (21). La diminution du HDL est la principale cause de l’augmentation du ratio cholestérol total sur cholestérol-HDL, un marqueur de prédiction du risque des maladies cardiovasculaires (33, 49).
7
L’hypertriglycéridémie associée à l’obésité viscérale semble être le résultat d’une production excessive de particules VLDL (lipoprotéines de très faible densité) au niveau hépatique et d’une inhibition du catabolisme de ces lipoprotéines (50, 51). En effet, l’augmentation possible du flux d’acides gras libres vers le foie associée à l’obésité abdominale pourrait favoriser la surproduction de lipoprotéines riches en triglycérides, les VLDL. L’action de la protéine de transfert des esters de cholestérol (CETP) favorise les échanges entre les triglycérides des VLDL et les esters de cholestérol des particules HDL ou LDL. Ceci favorise la formation de particules HDL et LDL enrichies en triglycérides. Celles-ci deviennent des substrats intéressants pour la lipase hépatique, engendrant ultérieurement la formation de particules HDL et LDL petites et denses. Ce changement dans la composition des HDL favoriserait l’augmentation de leur catabolisme (52). Ce phénomène pourrait donc expliquer le faible niveau de cholestérol-HDL généralement observé chez les patients ayant une obésité viscérale (53). Le potentiel athérogène plus élevé des particules LDL petites et denses peut être expliqué par plusieurs facteurs. D’abord, les particules LDL petites et denses se lient moins efficacement aux récepteurs de LDL, réduisant ainsi leur clairance (54). Ce processus et la petite taille de ces particules favorisent leur pénétration dans l’espace sous-endothélial des vaisseaux sanguins. De plus, celles-ci présentent une plus grande susceptibilité à l’oxydation (33). Les LDL oxydés sont préférentiellement captés par les macrophages, ce qui favorise la formation de cellules spumeuses. Ainsi, l’ensemble de ces caractéristiques leur confèrent un rôle dans le développement des plaques d’athérosclérose (55).
Autres facteurs de risque de maladies cardiovasculaires- L’obésité abdominale est également
associée à une hypertension artérielle (21, 56), une dysfonction endothéliale (57-59), un état inflammatoire chronique de faible intensité (60), une plus grande susceptibilité à la thrombose (61) et par conséquent, une augmentation du risque de maladies cardiovasculaires. D’ailleurs, des études prospectives ont démontré que la déposition de graisse au niveau intra-abdominal est un facteur de risque du développement des maladies cardiovasculaires chez les hommes et les femmes, et ce indépendamment des facteurs de risque traditionnels (62-64).
Syndrome métabolique- L’ensemble des anomalies métaboliques associées à l’obésité abdominale
se regroupe sous le terme syndrome métabolique (65). Au cours des dernières années, plusieurs définitions du syndrome métabolique ont été proposées afin d’identifier les individus à haut risque de souffrir de maladies cardiovasculaires et de diabète de type 2 (33). De façon générale, ce regroupement de facteurs de risque inclut une obésité abdominale, une dyslipidémie athérogène, une hypertension artérielle, une résistance à l’insuline ou une intolérance au glucose et un état pro-inflammatoire et pro-thrombotique. Selon la définition proposée par le National Cholesterol
8
Education Program/Adult Treatment Panel III report (NCEP- ATP III) en 2001, il y a présence du syndrome métabolique lorsque trois des cinq critères suivants sont rencontrés : 1) tour de taille élevé (Hommes : >102 cm, Femmes : >88 cm), 2) triglycérides élevés (≥1.7 mmol/L), 3) cholestérol-HDL faible (Hommes : <1.0mmol/L, Femmes : <1.3mmol/L), 4) tension artérielle systolique ou diastolique élevée (≥130/85 mm Hg) et 5) glycémie à jeun élevée (>5.6 mmol/L) (66). Un consensus plus récent a également proposé une définition similaire à celle du NCEP-APT III en incluant des valeurs seuil de tour de taille adaptées à l’origine ethnique (67). De plus, la taille hypertriglycéridémiante, caractérisée par la présence simultanée d’un tour de taille élevé et de concentrations de triglycérides à jeun élevés, a également fait l’objet de plusieurs études et semble être efficace pour identifier les individus caractérisés par un profil cardiométabolique altéré (68).
Tel que décrit dans les précédents paragraphes, le lien entre l’obésité viscérale et les altérations cardiométaboliques a été confirmé à maintes reprises dans la littérature. Plusieurs théories ont été mises de l’avant afin d’expliquer la pathogénèse de l’obésité viscérale (Figure 4). Des différences morphologiques, biologiques et physiologiques ont été observées entre le tissu adipeux sous-cutané et le tissu adipeux intra-abdominal. À titre d’exemple, les lobules de gras du tissu adipeux sous-cutané sont organisés de façon régulière alors que ceux du tissu adipeux viscéral sont organisés de façon irrégulière (69). De plus, la vascularisation est différente dans les deux compartiments adipeux (70). Ainsi, ces deux dépôts adipeux semblent avoir des caractéristiques distinctes et un impact différent sur le métabolisme.
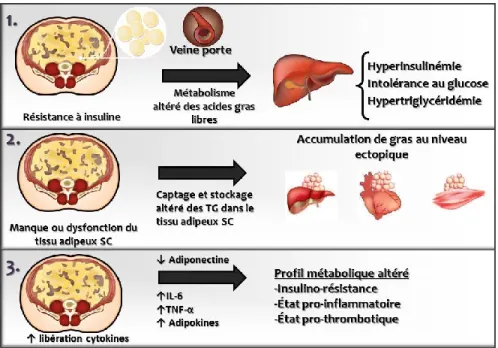
D’une part, la théorie de la veine porte a été proposée afin d’expliquer le lien entre le risque cardiométabolique augmenté et l’obésité viscérale (Figure 4). Celle-ci suggère que le site anatomique de la graisse viscérale pourrait partiellement expliquer le lien entre la déposition de masse adipeuse au niveau viscéral et le développement de complications métaboliques (71, 72). Effectivement, considérant que le dépôt sous-cutané abdominal est drainé par les veines caves inférieures et supérieures, alors que les dépôts adipeux omental et mésentérique sont drainés par la veine porte hépatique, le foie pourrait être exposé à des quantités élevées d’acides gras non-estérifiés et des concentrations élevées de cytokines sécrétées par le tissu adipeux viscéral. Cette augmentation d’acides gras non-estérifiés au niveau hépatique favoriserait l’augmentation de la production hépatique de glucose par le processus de néoglucogénèse et pourrait augmenter les concentrations d’apolipoprotéine (Apo) B et de triglycérides en circulation (33, 73, 74). Les fondements de cette théorie sont supportés par le fait que les adipocytes du tissu adipeux omental sont plus résistants à l’action anti-lipolytique de l’insuline, mais plus sensibles à l’action des agonistes β-adrénergiques que les adipocytes du dépôt sous-cutané (75-79). De plus, tel qu’elle sera
9
décrite dans la prochaine section de cette thèse, l’hypertrophie des adipocytes viscéraux pourrait être impliquée dans l’augmentation des acides gras non-estérifiés libérés par ce tissu adipeux. Toutefois, la théorie de la veine porte comme hypothèse principale pour expliquer la relation entre l’accumulation de graisse intra-abdominale et les complications métaboliques est controversée. Effectivement, des études in vivo effectuées par le groupe de Jensen ont démontré que le tissu adipeux sous-cutané est la principale source d’acides gras libres (80-84). Selon différentes conditions, le tissu adipeux sous-cutané libère plus de 85% des acides gras non-estérifiés en circulation. Chez les individus de poids santé, environ 5 à 10% des acides gras non-estérifiés libérés dans la veine porte semblent provenir de la lipolyse des adipocytes viscéraux (80). Cependant, avec l’augmentation de la taille du tissu adipeux viscéral, le flux d’acides gras non-estérifiés provenant de ce tissu peut représenter jusqu’à 50% du flux d’acides gras libres présents dans la veine porte hépatique (80). Le rôle potentiel d’une lipolyse excessive dans le développement de complications métaboliques associées à l’obésité abdominale a également été démontré dans des études avec des modèles canins (85, 86). En effet, le groupe de Bergman a démontré qu’une diète hypercalorique riche en lipides entraîne une accumulation de graisse dans les dépôts adipeux sous-cutané et viscéral et provoque une libération accrue d’acides gras non estérifiés en période nocturne, contribuant ainsi au développement de l’insulino-résistance (86). L’incapacité du tissu adipeux à entreposer l’excès de lipides alimentaires en réponse à l’insuline semble créer un débordement des acides gras non-estérifiés vers les autres organes et pourrait contribuer au développement des complications métaboliques (33, 85, 87, 88).
D’autre part, l’augmentation du risque cardiométabolique associée à l’obésité abdominale pourrait être expliquée par des différences régionales importantes dans le métabolisme et la fonction sécrétoire des tissus adipeux (89, 90) (Figure 4). Effectivement, le tissu adipeux viscéral libère plusieurs facteurs qui pourraient être impliqués dans le développement de la résistance à l’insuline observée chez les patients présentant une obésité viscérale (33, 91, 92). Bien que l’état hyperlipolytique et le profil inflammatoire de l’obésité viscérale semblent être des déterminants des altérations métaboliques, un autre mécanisme important a été proposé pour expliquer cette relation : la capacité de stockage limitée du tissu adipeux sous-cutané. Effectivement, une accumulation excessive de tissu adipeux au niveau intra-abdominal pourrait représenter un marqueur d’une capacité réduite des tissus adipeux sous-cutanés à entreposer les lipides lorsque le bilan d’énergie est positif (21, 33, 92). Ce stockage limité du tissu adipeux pourrait conduire à un débordement d’acides gras non-estérifiés au niveau ectopique et à une dysfonction métabolique sévère (93). Ainsi, la dysfonction des tissus adipeux représente un facteur central dans le développement des
10
anomalies cardiométaboliques. La fonction endocrine et la capacité d’expansion des tissus adipeux seront discutées en détail dans la deuxième section de cette thèse qui portera précisément sur la dysfonction des tissus adipeux abdominaux.
Figure 4. Mécanismes reliant l’accumulation de gras au niveau viscéral et les complications métaboliques. 1) Théorie de la veine porte, 2) Capacité réduite des tissus adipeux sous-cutanés à entreposer les lipides et 3) Libération accrue de cytokines par le dépôt adipeux viscéral - Figure adaptée de Després et al. (33, 92)
1.2.4 Variation interindividuelle
Il existe une importante variabilité interindividuelle dans la susceptibilité à accumuler préférentiellement la graisse dans le compartiment adipeux viscéral en présence d’un bilan énergétique positif. L’âge, le sexe biologique, la génétique, les hormones sexuelles et l’ethnicité sont tous des facteurs pouvant être impliqués dans l’accumulation préférentielle de tissu adipeux au niveau viscéral (21). De façon générale, le ratio entre l’aire de tissu adipeux viscéral et l’aire de tissu adipeux sous-cutané est plus élevé chez l’homme que chez la femme et augmente avec l’âge pour les deux sexes (21). Bien qu’il existe d’importantes différences ethniques au niveau de l’accumulation de tissu adipeux viscéral (21), ce phénomène est observé dans la majorité des populations. À titre d’exemple, la Figure 5 illustre cette variabilité interindividuelle dans l’accumulation de tissu adipeux viscéral. Chez les hommes et chez les femmes, l’aire de tissu adipeux viscéral mesurée par tomographie axiale varie considérablement à l’intérieur d’une même catégorie d’IMC (mince, surpoids ou obèse). Sachant qu’une accumulation de tissu adipeux au niveau viscéral est un facteur de risque indépendant des altérations cardiométaboliques (92), cette