© Pamela Nicolle, 2019
Étude des composés impliqués dans la rétention des
tanins des vins rouges de cépages hybrides
interspécifiques cultivés en climat froid
Thèse
Pamela Nicolle
Doctorat en sciences et technologie des aliments
Philosophiæ doctor (Ph. D.)
Étude des composés impliqués dans la rétention des
tanins des vins rouges de cépages hybrides
interspécifiques cultivés en climat froid
Thèse
Paméla Nicolle
Sous la direction de :
Paul Angers, directeur de recherche
Karine Pedneault, codirectrice de recherche
iii
Résumé
La vigne Vitis vinifera, appelée aussi « vigne européenne », est l’espèce la plus cultivée mondialement pour la production de vin. Dans les régions froides comme le Québec, les vins sont majoritairement produits à partir de cépages hybrides interspécifiques (CHI) qui offrent une plus grande tolérance au froid et aux maladies. Les vins rouges issus des CHI sont généralement décrits comme étant moins astringents et plus colorés que les vins rouges européens issus de V. vinifera, ce qui ne répond pas toujours aux goûts des consommateurs. Ces caractéristiques sont attribuables à des différences de composition entre les baies de CHI et de V. vinifera. Une meilleure compréhension des molécules affectant la rétention et la composition en tanins des vins de CHI rouges et des procédés de vinification affectant leurs profils pourrait permettre de modifier leur astringence et contribuer à augmenter la compétitivité des vins rouges issus de CHI sur le marché. Trois études ont été conduites sur ce thème dans le cadre de cette thèse.
La première étude avait pour but d’étudier l’impact de l’utilisation de marc de raisin blanc (MRB) en co-fermentation avec du marc de raisin rouge (MRR) sur la teneur en tanins des vins, en utilisant les CHI Frontenac et Vidal. Les résultats ont montré que les vins produits avec du MRB présentaient plus de flavan-3-ols monomériques et oligomériques et davantage de terpènes. La manipulation du ratio MRR/MRB a permis de modifier le profil en anthocyanes des vins finis, résultant dans certains cas en des vins plus clairs. L’utilisation d’un ratio MRR/MRB approprié (30% MRR/6% MRB) a permis une meilleure stabilisation de la couleur des vins sans affecter significativement la couleur. L’utilisation de MRB en co-fermentation avec du MRR s’est avérée un outil intéressant pour moduler la couleur des vins ainsi que leur composition phénolique et volatile.
La seconde étude avait pour objectif d’étudier l’impact de différents traitements seuls ou en combinaison (traitements pré-fermentaire du moût, fermentation en présence et absence de marc, addition de tanins œnologiques) sur la teneur en tanins, en protéines et en pigments des vins de Frontenac. L’élimination des protéines par chauffage du moût ou ajout de bentonite n’a pas permis une meilleure rétention des tanins dans le vin. Néanmoins, fermenter le moût sans marc de raisin a amélioré significativement leur rétention dans le vin, notamment celle des flavan-3-ols polymériques (jusqu’à 27,8%). L’addition de 3 g/L de tanins œnologiques dans les vins, fermentés en présence et
iv
absence de marc, s’est montrée nécessaire pour augmenter significativement la concentration en tanins des vins de Frontenac.
La troisième étude consistait en une étude exploratoire et comparative de la teneur et de la nature des polysaccharides des vins de CHI Frontenac et Frontenac blanc avec celles du V. vinifera Cabernet Sauvignon. Les vins de Frontenac ont montré une concentration plus élevée en polysaccharides totaux et des polysaccharides plus ramifiés que les vins de Cabernet Sauvignon. Ces différences pourraient contribuer à la faible astringence des vins rouges issus de CHI par rapport à celle des vins rouges de variété V. vinifera.
Ce projet a permis d’apporter de nouvelles connaissances sur le profil d’extraction et la rétention des tanins dans les vins de CHI cultivés au Québec. Une meilleure compréhension des facteurs impliqués dans la rétention des tanins dans ces vins a permis de fournir des pistes à envisager pour élaborer des procédés de vinification adaptés à la composition physico-chimique atypique des CHI rouges afin de produire des vins plus riches en tanins, ayant un potentiel accru de répondre aux goûts des consommateurs.
v
Abstract
Vitis vinifera is the most cultivated grapevine species for wine production, worldwide. But in cold areas such as Quebec, Canada, most wine is produced from interspecific hybrid grape varieties (CHI) that better respond to harsh growing conditions such as cold temperature and high disease pressure. Red CHI wines are generally described as less astringent and more colourful than European V. vinifera red wines, but those characteristics do not fully align with consumers taste and preferences. The low astringency of red CHI wine is largely attributable to differences between the respective chemical composition of CHI and V. vinifera berries. A better understanding of the molecules affecting tannin retention and composition of red CHI wines, and of the winemaking processes that affect their tannin profiles could provide solutions to impact their astringency and improve their competitiveness on the market. Three studies conducted on this topic as part of this thesis are presented in this manuscript.
The first study aimed at investigating the impact of the co-fermentation of white (WP) and red (RP) grape pomace on the tannin content of red wine, using the CHI varieties Frontenac and Vidal. The results showed that wines produced with WP contained higher levels of monomeric and oligomeric flavan-3-ols and terpenes than wines issued from the RP treatment. Modifying the ratio of RP to WP during alcoholic fermentation modified the anthocyanin profile of the wines, sometimes resulting in lighter coloured wines. A ratio of 30% RP to 6% WP improved colour stabilisation without significantly affecting wine colour. The use of WP in co-fermentation with RP proved to be an interesting tool to modulate wine colour as well as its phenolic and volatile composition.
The second study aimed at exploring the impact of different winemaking treatments (pre-fermentative treatment of the must, fermentation with and without pomace, addition of enological tannins), alone or in combination, on the tannin, protein and pigment content of Frontenac wines. Wine protein removal by heat or bentonite addition did not improve tannin retention in wine. In contrast, fermenting the must without pomace significantly improved tannin retention, especially for polymeric flavan-3-ols (up to 27.8%). With or without pomace, the addition of enological tannins at a minimal rate of 3 g/L, was necessary to increase tannin concentration in Frontenac wine significantly.
The third study explored the content and, to some extent, the molecular weight and structure of the polysaccharides from the CHI Frontenac and Frontenac Blanc, in comparison with wines from the V. vinifera variety Cabernet Sauvignon. Frontenac wines showed a higher concentration of total polysaccharides with more branched polysaccharides than wines from Cabernet Sauvignon. Results showed that significant differences exist between the polysaccharides content and structure of the
vi
studied CHI varieties and Cabernet Sauvignon variety. Those differences could contribute to the low astringency of CHI wines when compared with red wines from V. vinifera varieties.
This project has brought new knowledge on the tannin, protein and polysaccharide content of red CHI varieties grown in Quebec and how they impact tannin retention in CHI wines. Understanding the chemistry of phenolic compounds and macromolecules in CHI wines made possible the development of new winemaking processes adapted to the atypical biochemical composition of red CHI wine. As such, results from this study provide new venues to vary and improve the style and the quality of CHI wines and better meet consumers taste and preferences.
vii
Table des matières
Résumé... iii
Abstract ... v
Table des matières... vii
Liste des tableaux ... x
Liste des figures ... xii
Liste des annexes ... xv
Liste des abréviations, sigles et acronymes ... xvi
Remerciements ... xvii
Avant-propos ... xix
Introduction ... 1
Chapitre 1. Revue de littérature ... 5
1.1. L’industrie vinicole du Québec ... 5
1.1.1. La place de l’industrie vinicole du Québec dans le monde ... 5
1.1.2. Les cépages cultivés au Québec ... 7
1.1.2.1. La classification botanique de la vigne ... 7
1.1.2.2. Les variétés de vigne au Québec ... 7
1.1.3. Les vins québécois et l’astringence ... 12
1.2. La composition phénolique des baies de raisin ... 13
1.2.1. Les anthocyanes ... 17
1.2.2. Les flavan-3-ols et proanthocyanidines... 17
1.3. La composition macromoléculaire de la baie de raisin ... 19
1.4. Du raisin au vin ... 20
1.4.1. Le processus de vinification ... 20
1.4.2. Extraction et évolution des composés phénoliques durant la vinification ... 22
1.4.2.1. Extraction ... 22
1.4.2.2. Évolution ... 23
1.4.2.3. Interactions des tanins avec les protéines et polysaccharides ... 24
1.4.3. Impact des procédés vinicoles sur les tanins ... 25
1.5. Problématique, hypothèse et objectifs ... 26
1.5.1. Problématique ... 26
1.5.2. Hypothèse ... 28
1.5.3. Objectifs ... 28
Chapitre 2. Co-fermentation of red grapes and white pomace: a natural and economical process to modulate red hybrid wine composition ... 29
2.1. Avant-propos ... 29
2.2. Résumé ... 29
2.3. Abstract ... 30
viii
2.5. Material and Methods ... 33
2.5.1. Chemicals ... 33
2.5.2. Grape materials ... 33
2.5.3. Winemaking trials ... 34
2.5.4. Phenolic compound analysis ... 35
2.5.4.1. Phenol estimation ... 35
2.5.4.2. Anthocyanin analysis ... 35
2.5.4.3. Flavan-3-ol analysis ... 36
2.5.5. Colour analysis ... 37
2.5.6. Volatile compound analysis ... 37
2.5.7. Statistical analysis ... 38
2.6. Results and Discussion ... 39
2.6.1. Effect on phenolic compounds ... 39
2.6.1.1. Effect on flavan-3-ols ... 39
2.6.1.2. Effect on pigments ... 42
2.6.2. Effect on wine colour and colour evolution ... 48
2.6.3. Effect on the volatile composition of bottled wines ... 49
2.7. Conclusion ... 53
Chapitre 3. Pomace limits tannin retention in Frontenac wines ... 55
3.1. Avant-propos ... 55
3.2. Résumé ... 55
3.3. Abstract ... 56
3.4. Introduction ... 56
3.5. Material and Methods ... 59
3.5.1. Chemicals ... 59 3.5.2. Experimental design... 59 3.5.3. Winemaking trials ... 60 3.5.3.1. Grape material... 60 3.5.3.2. Winemaking ... 60 3.5.4. Tannin analysis ... 61 3.5.4.1. HPLC-fluorescence ... 61 3.5.4.2. Protein precipitation ... 62 3.5.5. Pigment analysis ... 63 3.5.6. Protein analysis ... 64 3.5.7. Statistical analysis ... 64
3.6. Results and discussion ... 65
3.6.1. Relevance of the method used for tannin quantification ... 65
3.6.2. Impact of winemaking processes on protein concentration ... 67
3.6.3. Impact of winemaking processes on wine polyphenol concentration ... 73
3.6.3.1. Impact on pigment concentration ... 73
3.6.3.2. Impact on tannin concentration ... 76
3.6.3.3. Relevant observations ... 80
ix
Chapitre 4. Evaluation of flavan-3-ols and polysaccharides in musts and wines from Vitis
vinifera Cabernet Sauvignon and cold-hardy Vitis sp. Frontenac ... 82
4.1. Avant-propos ... 82
4.2. Résumé ... 82
4.3. Abstract ... 83
4.4. Introduction ... 83
4.5. Material and Methods ... 85
4.5.1. Grape material ... 85
4.5.2. Winemaking trials ... 85
4.5.3. Sugars analysis ... 86
4.5.4. Flavan-3-ol analysis ... 87
4.5.5. Polysaccharide analysis ... 87
4.5.5.1. Total polysaccharide precipitation and quantification ... 87
4.5.5.2. Total polysaccharide characterisation ... 87
4.5.6. Statistical analysis ... 88
4.6. Results and discussion ... 88
4.6.1. Flavan-3-ols ... 88
4.6.2. Total polysaccharides ... 93
4.6.3. Polysaccharide profile ... 94
4.7. Conclusion ... 97
Conclusion & perspectives ... 99
Annexes... 104
x
Liste des tableaux
Tableau 1.1. Génétique (en % de chaque espèce de vigne), susceptibilité aux maladies et tolérance/résistance au froid des principaux cépages cultivés au Québec (d’après Dubé & Turcotte (2011); Pedneault & Provost (2016)). ... 11 Tableau 1.2. Composition chimique (en % du poids frais) de la pellicule, de la pulpe et des pépins de raisin (d’après Flancy (1998); Gros & Yerle (2014)). ... 14 Tableau 1.3. Teneur moyenne en anthocyanes et tanins des pellicules et pépins de baies de cépages V. vinifera et de cépages hybrides interspécifiques (en mg/kg baie). ... 19 Table 2.1. Concentration of anthocyanin compounds (mean ± standard deviation, in mg/L
cyanidin-3-glucoside, delphinidin-3-cyanidin-3-glucoside, malvidin-3-cyanidin-3-glucoside, pelargonidin-3-cyanidin-3-glucoside, and peonidin-3-glucoside equivalent depending of the aglycone) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-RP/WP-treated (23% WP) wines after 395 days of bottling and ESI-MS m/z values (molecular ion; product ions) of anthocyanins detected in red Frontenac wines. ... 45 Table 2.2. CIELab parameters (mean ± standard deviation, in CIELab unit) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines at different winemaking stages. ... 50 Table 3.1. Repeated measures analysis of variance (ANOVA) for protein, tannin, total pigment (Tpg), and co-pigmented, monomeric, and polymeric anthocyanin (CA, MA, and PP, respectively). Main effects are: must protein treatment (MT; untreated, bentonite-treated, and heat-treated must); pomace (P; must fermented with and without pomace); tannin addition (TA; 0, 1, 3, and 9 g/L); and time of maceration (TM; 0, 4, and 11 days after the end of alcoholic fermentation). 70 Table 3.2. Protein concentration (mean ± standard deviation (SD), mg/L BSA equivalent) in experimental Frontenac wines made with untreated (control), bentonite-treated, and heat-treated must, fermented with (WP) or without (WOP) pomace, and with different doses of tannin addition (0, 1, 3, and 9 g/L) at the end of alcoholic fermentation (e-AF) and on the 4th and the
11th day following the e-AF (corresponding to days 4, 8, and 15 of the winemaking process,
respectively). ... 71 Table 4.1. Composition of musts and wines made from the cold-hardy Vitis sp. Frontenac blanc, Frontenac, and V. vinifera Cabernet Sauvignon (Primary fermentable sugars, g/L; alcohol concentration, % v/v; titratable acidity, g tartaric acid eq./L; pH; primary amino nitrogen, mg/L; and ammonia, mg/L). ... 86 Table 4.2. Average molecular weight values (number average molecular weight, Mn; weight average
molecular weight, Mw; Z average molecular weight, Mz; and molecular weight polydispersity
ratio, Mw/Mn), and intrinsic viscosity (IV) for the ethanol-precipitated polysaccharide of must,
fermented must (middle of alcoholic fermentation, mid-AF), and wine made from the cold-hardy Vitis sp. Frontenac blanc, Frontenac, and V. vinifera Cabernet Sauvignon. ... 95
xi
Table S2.1. Composition (mean ± standard deviation) of the must and control wines and RP/WP- (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP) and WP-treated wines (23% WP) after 395 days of bottling. ... 106 Table S2.2. Monomeric, oligomeric (2 to 5 flavan-3-ol units), and polymeric (≥ 6 flavan-3-ol units) flavan-3-ol compound concentration (mean ± standard deviation, in mg/L epicatechin equivalent) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines at different winemaking stages. ... 107 Table S2.3. Phenol estimation (mean ± standard deviation, in absorbance unit) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines at different winemaking stages. ... 109 Table S2.4. Volatile compound parameters for GC-MS-SPME analysis. ... 111 Table S3.1. Total pigment (Tpg) and co-pigmented, monomeric, and polymeric anthocyanin (CA, MA, and PP, respectively) estimation (mean ± standard deviation (SD)) in experimental Frontenac wines made with untreated (control), bentonite-treated, and heat-treated must, fermented with (WP) and without (WOP) pomace, and with different doses of tannin addition (0, 1, 3, and 9 g/L) at 11 days after the end of alcoholic fermentation (corresponding to day 15 of the winemaking process). ... 118 Table S3.2. Kinetic of tannin concentration (mean ± standard deviation (SD), mg/L epicatechin equivalent) in experimental Frontenac wines made with untreated (control), bentonite-treated, and heat-treated must, fermented with (WP) and without (WOP) pomace, and with different doses of tannin addition (0, 1, 3, and 9 g/L) at the end of alcoholic fermentation (e-AF) and on the 4th and the 11th day after the e-AF (corresponding to days 4, 8, and 15 of the winemaking process, respectively). ... 120 Table S4.1. Monomeric, oligomeric (2-5 flavan-3-ol units), and polymeric (≥ 6 flavan-3-ol units) flavan-3-ol (mean ± standard deviation (SD), mg/L epicatechin equivalent), polysaccharide (mean ± SD, mg/L galactose equivalent), and ethanol (%, v/v) concentration during the alcoholic fermentation of V. vinifera Cabernet Sauvignon and cold-hardy Vitis sp. cultivars Frontenac and Frontenac blanc. ... 122
xii
Liste des figures
Figure 1.1. Principaux bassins viticoles dans le monde, incluant les vignobles canadiens, et les types de climats associés à ces régions (d’après Carbonneau & Escudier (2017)). ... 6 Figure 1.2. Famille des Vitacées. ... 8 Figure 1.3. Encépagement des membres du Conseil des vins du Québec de 2012 à 2017 (d’après AVQ, 2017). ... 10 Figure 1.4. Structure ((a), d'après Kennedy (2002)) et organisation tissulaire ((b), d’après
Fougère-Rifot & Cholet (1996)) d’une baie de raisin à maturité. Organisation structurale de la paroi végétale primaire ((c), d’après Koolman, Röhm, Wirth, & Robertson (2005)) et structure des principaux polysaccharides de la paroi : (d), cellulose ; (e), pectine (d’après Scheller, Jensen, Sørensen, Harholt, & Geshi (2007)) et (f), hémicellulose. ... 15 Figure 1.5. Exemple de composés phénoliques non-flavonoïdes et flavonoïdes présents dans les baies de raisin. ... 16 Figure 1.6. Schéma de vinification traditionnelle du vin en rouge (étapes détaillées en Appendix A).
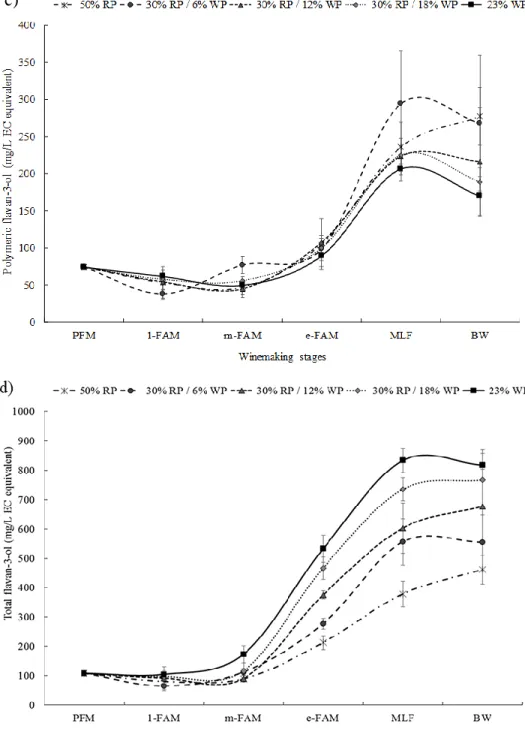
... 21 Figure 1.7. Cinétique d’extraction des anthocyanes (bleu, point carré), tanins (orange, tiret point) et polysaccharides (vert, tiret cadratin-point) du raisin lors des étapes de la vinification en rouge (Mpf, macération pré-fermentaire ; FA, fermentation alcoolique ; et MPF, macération post-fermentaire) et évolution de l’intensité colorante (noir, uni) chez Vitis vinifera (d’après Ribéreau-Gayon, Glories, et al. (2006)). ... 23 Figure 1.8. Les différents mécanismes potentiels d'interactions entre polyphénols et protéines (d’après (Le Bourvellec & Renard, 2012). ... 25 Figure 2.1. Monomeric (a), oligomeric (2-5 flavan-3-ol units) (b), polymeric ( 6 flavan-3-ol units) (c), and total (d) flavan-3-ol concentration (mean ± standard deviation, mg/L epicatechin equivalent) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines at different winemaking stages: PFM, after the pre-fermentative cold maceration; 1-FAM, m-FAM, and e-FAM, during the pre-fermentative alcoholic maceration (at days 1, 4, and 8); MLF, after the malolactic fermentation (day 45); and BW, after bottling (day 395). Means comparison using Tukey’s honest significant difference test at the 0.05 probability level is shown in Appendix B. ... 41 Figure 2.2. Phenol parameters including pigments at acidic pH (PpH < 1) (a), wine pigments corrected
(WPcor) (b), pigments resisting to sulphite bleaching (PRSO2) (c), and colour intensity corrected
(CIcor) (d) (mean ± standard deviation, absorbance unit) for control (50% RP), RP/WP-treated
(30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines at different winemaking stages: 1-FAM, m-FAM, and e-FAM, during the fermentative alcoholic maceration (at days 1, 4, and 8); MLF, after the malolactic fermentation (day 45); and BW, after bottling (day 395). Means comparison using Tukey’s honest significant difference test at the 0.05 probability level is shown in Appendix B. ... 43
xiii
Figure 2.3. Principal component analysis of flavan-3-ol and phenol (by spectrophotometry-UV) profile (a) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines after 395 days of bottling (b). Variables: PpH<1, pigments
at acidic pH; WPcor, wine pigments corrected; PRSO2, pigments resisting to sulphite bleaching;
CIcor, colour intensity corrected; H, hue... 47
Figure 2.4. Principal component analysis of the volatile compound profile (a) in control (50% RP), RP/WP-treated (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP), and WP-treated (23% WP) wines after 395 days of bottling (b). ... 52 Figure 3.1. Regression of tannin concentration of experimental Frontenac wines as measured by protein precipitation and HPLC-fluorescence. Wine samples from the end of alcoholic fermentation (e-AF) and day 11 after the e-AF (corresponding to days 0 and 15 of the winemaking process, respectively) were included in the analysis. ... 67 Figure 3.2. Heat map of the protein and tannin concentration of experimental Frontenac wines made with untreated (control, CT), bentonite-treated (BE), and heat-treated (HT) must, fermented with (WP) and without (WOP) pomace, and with different doses of tannin addition (0, 1, 3, and 9 g/L) at 0, 4, and 11 days after the end of alcoholic fermentation (e-AF). Red and blue colours represent the highest and the smallest concentration of proteins or tannins in wines. Data are ranked from the lowest to the highest protein concentration, 11 days after the e-AF (a), and from the highest to lowest tannin concentration, 11 days after the e-AF (b). ... 68 Figure 3.3. Total pigment (a) and co-pigmented (b), monomeric (c), and polymeric anthocyanin (d) estimation (in absorbance unit), in experimental Frontenac wines made with untreated (control), bentonite-treated, and heat-treated must, fermented with and without pomace, and with different doses of tannin addition (0, 1, 3, and 9 g/L) at 11 days after the end of alcoholic fermentation. 75 Figure 3.4. Oligomeric (2–5 units of flavan-3-ols) and polymeric (>5 units of flavan-3-ols) flavan-3-ol concentration (mean, mg/L epicatechin equivalent) in experimental Frontenac wines made with untreated (control, CT), bentonite-treated (BE), and heat-treated (HT) must, fermented with (WP) and without (WOP) pomace, and with different doses of tannin addition (0, 1, 3, and 9 g/L) at the end of alcoholic fermentation (e-AF; a) and on the 4th (b) and the 11th (c) day following the
e-AF (corresponding to days 4, 8, and 15 of the winemaking process, respectively). For a given combination of Dose*Treatment*Day, small letters compare the oligomeric flavan-3-ol concentration and capital letters compare the polymeric flavan-3-ol concentration of pomace treatment at the 0.05 probability level. The statistics for the other combinations are available in Appendix B. ... 78 Figure 4.1. Changes in the concentration of monomeric, oligomeric (2-5 flavan-3-ol units), and polymeric (≥ 6 flavan-3-ol units) flavan-3-ols (mean ± standard deviation, mg/L, epicatechin equivalent) and polysaccharides (mean ± standard deviation, mg/L, galactose equivalent) during the alcoholic fermentation of the cold-hardy Vitis sp. Frontenac blanc (a), Frontenac (b), and V. vinifera Cabernet Sauvignon (c). Mean comparison using Tukey’s honest significant difference test at the 0.05 probability level is shown in Appendix D. ... 90 Figure 4.2. Kinetic of fermentable sugar consumption during the fermentation of the cold-hardy Vitis sp. Frontenac blanc (a), Frontenac (b), and V. vinifera Cabernet Sauvignon (c). ... 91
xiv
Figure 4.3. Monomeric (a), oligomeric (b; 2-5 flavan-3-ol units), and polymeric (c; ≥ 6 flavan-3-ol units) flavan-3-ols (mean ± standard deviation, mg/L epicatechin equivalent) extraction as a function of increasing ethanol concentration (mean ± standard deviation; %, v/v) during the alcoholic fermentation of the cold-hardy Vitis sp. Frontenac blanc, Frontenac, and V. vinifera Cabernet Sauvignon. Mean comparison using Tukey’s honest significant difference test at the 0.05 probability level is shown in Appendix D. ... 93 Figure 4.4. Mark–Houwink–Sakurada plot for must (a) and wine (b) polysaccharide samples of the cold-hardy Vitis sp. Frontenac blanc (must, green; wine, maroon), Frontenac (must, grey; wine, blue), and V. vinifera Cabernet Sauvignon (must, orange; wine, yellow). ... 97 Figure 4.5.1. Proposition d’itinéraires technologiques adaptés à la vinification en rouge des cépages hybrides interspécifiques cultivés en climat froid. ... 103 Figure S2.1. Anthocyanin (a) (mg/L cyanidin-3-glucoside, delphinidin-3-glucoside,
malvidin-3-glucoside, pelargonidin-3-malvidin-3-glucoside, and peonidin-3-glucoside equivalent depending of the aglycone) and flavan-3-ol compound (b) (mg/L epicatechin equivalent) profiles in control wines and RP/WP- (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP) and WP-treated wines (23% WP) after 395 days of bottling. ... 112 Figure S2.2. CIELab parameters including L, lightness (a); a, red-green (b); b, blue-yellow (c); C, chroma (d); H, hue (e) (mean ± standard deviation) for control wines and RP/WP- (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP) and WP-treated wines (23% WP) at different winemaking stages: 1-FAM, m-FAM, and e-FAM, during the fermentative alcoholic maceration (day 1, 4, and 8); MLF, after the malolactic fermentation (day 45); and BW, after bottling (day 395). ... 114 Figure S2.3. Colour representation of control wines and RP/WP- (30% RP/6% WP, 30% RP/12% WP, and 30% RP/18% WP) and WP-treated wines (23% WP) from the CIELab data at different winemaking stages: 1-FAM, m-FAM, and e-FAM, during the fermentative alcoholic maceration (day 1, 4, and 8); MLF, after the malolactic fermentation (day 45); and BW, after bottling (day 395). The colour representation was obtained from the website: http://colorizer.org/. ... 115 Figure S3.1. Factorial experimental design used to produce experimental Frontenac wines, including the following factors: must protein treatment (untreated, bentonite-treated, and heat-treated must), pomace (must fermented with and without pomace), tannin addition (0, 1, 3, and 9 g/L), and time of maceration (0, 4, and 11 days after the end of alcoholic fermentation, corresponding to days 4, 8, and 15 of the winemaking process, respectively). ... 116
xv
Liste des annexes
Appendix A. Étapes de la vinification en rouge traditionnelle ... 104
Appendix B. Supplementary material - Chapter 2 ... 106
Appendix C. Supplementary material - Chapter 3 ... 116
xvi
Liste des abréviations, sigles et acronymes
AF ANOVA AOC BSA BW CHI ET FAM FD GC-MS-SPME GPC/SEC HPLC-FLD IFV IGP IV LOQ LSD LSMEAN Mn Mz Mw mDP MHS MLF MRB/MRR MRM MS OIV PCA PFM PG PP Protéine PR Rh RP/WP SAQ SO2 UPLC-MS/MS UV-Vis VQA WP/WOP Alcoholic fermentation Analysis of variance
Appellation d’origine contrôlée Bovine serum albumin Bottled wine
Cépage hybride interspécifique/Interspecific hybrid grape variety Enological tannin
Fermentative alcoholic maceration Dilution factor
Gas chromatography - mass spectrometry - solid phase microextraction Gel permeation/size exclusion chromatography
High performance liquid chromatography – fluorescence detector Institut français de la vigne et du vin
Indication géographique protégée Intrinsic viscosity
Limit of quantification Least significant difference Least-squares means
Number average molecular weight Z average molecular weight Weight average molecular weight Mean degree of polymerisation Mark-Houwink-Sakurada Malolactic fermentation Marc de raisin blanc/rouge Multiple reactions monitoring Mass spectrometry
Organisation internationale de la vigne et du vin Principal component analysis
Pre-fermentative cold maceration
Depolymerisation using phloroglucinolysis Protein precipitation
Protéine liée à la pathogenèse Hydrodynamic radius
Red/White pomace
Société des alcools du Québec Sulphur dioxide
High performance liquid chromatography - tandem mass spectrometry Ultraviolet - visible
Vintners quality alliance With/Without pomace
xvii
Remerciements
Je tiens tout d’abord à remercier mon directeur et ma codirectrice de thèse, Paul Angers et Karine Pedneault, pour m’avoir offert l’opportunité de réaliser ce doctorat. Merci de m’avoir permis de mener à bien ce projet avec une grande liberté de décision. Un merci tout particulier à Karine Pedneault pour le temps passé sur la correction des articles et son soutien durant cette dernière année de thèse difficile sur le plan émotionnel.
Je souhaite ensuite remercier pour le financement de cette thèse par l’obtention d’une bourse en milieu pratique : le Centre de développement bioalimentaire du Québec (CDBQ), le Fonds de recherche du Québec – Nature et technologies, et le Conseil de recherches en sciences naturelles et en génie du Canada. Merci également au Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec et à Agriculture and Agri-Food Canada pour le financement de ce projet. J’adresse aussi mes remerciements pour leur soutien technique à l’équipe du CDBQ (Sabrina Després, Mélissa Beaulieu, Daphné McNicoll, Réjean Deschênes, Charles Lavigne et Katy Dumont), l’équipe de la plateforme analytique de l’INAF (Pascal Dubé, Perrine Feutry et Véronique Richard), l’équipe du laboratoire de technologie alimentaire de la FSAA (Pierre Côté, Pascal Lavoie et Mélanie Martineau) et, bien évidemment, l’indispensable Diane Gagnon. Merci également à mes collègues Annabelle Veillette, Geneviève Montminy et Charlène Marcotte pour leur aide durant cette thèse. Je remercie bien évidement Jean-Louis Escudier de l’INRA de Pech Rouge pour sa disponibilité, ses conseils et son expertise de qualité dans le domaine vitivinicole. Merci également pour le temps passé à relire nos manuscrits, aux réviseurs de Food Chemistry. Nous apprécions sincèrement tous les commentaires et suggestions qui nous ont permis d’améliorer la qualité des articles.
Mes sincères remerciements à mes amis du bureau (Abdel, Agathe, Attara, Élodie, Emna, Guida, Mathilde, Ourdia, Raquel et tous les autres) d’avoir rendu mon séjour au Québec, et plus spécifiquement au pavillon Comtois, plus agréable. Merci pour votre soutien !
Enfin, mes plus gros remerciements vont à ma moitié, Mayank. Sa patience, nos discussions personnelles et scientifiques, ainsi que son amour et son soutien inconditionnel m’auront finalement permis d’achever cette thèse !
xviii
« Le vin met à jour les secrets cachés de l'âme » — Horace
xix
Avant-propos
La présente thèse a été soumise à la Faculté des études supérieures de l’Université Laval pour satisfaire aux exigences de l’obtention du grade Philosophiae Doctor (Ph.D.) en Sciences des Aliments (STA) de la Faculté des Sciences de l’Agriculture et de l’Alimentation (FSAA).
Cette thèse s’articule en quatre chapitres, précédés d’une introduction et suivis d’une conclusion. L’introduction présente le contexte global du projet et l’introduit brièvement. Le premier chapitre fait un état des lieux de la littérature pertinente en lien avec le sujet et aborde des notions qui ont été utilisées dans l’analyse des résultats. La problématique ainsi que les hypothèses et objectifs de thèse sont présentés en dernière section de ce chapitre. Les chapitres 2, 3 et 4 représentent chacun un article qui répond à un des objectifs proposés. Finalement, la thèse se termine par une conclusion générale du projet incluant des perspectives qu’il serait intéressant d’étudier.
Les chapitres 2, 3 et 4 sont présentés sous forme d’articles scientifiques et rédigés en anglais : • Une version du chapitre 2, intitulée « Co-fermentation of red grapes and white pomace: A
natural and economical process to modulate hybrid wine composition », a été publiée dans le journal Food Chemistry (https://doi.org/10.1016/j.foodchem.2017.09.053) ;
• Une version du chapitre 3, intitulée « Pomace limits tannin retention in Frontenac wines », a été publiée dans le journal Food Chemistry (https://doi.org/10.1016/j.foodchem.2018.10.116); • Et une version du chapitre 4, intitulée « Evaluation of flavan-3-ols and polysaccharides in musts and wines made from Vitis vinifera Cabernet Sauvignon and cold-hardy Vitis sp. Frontenac », sera soumise au journal Food Chemistry sous la forme d’une « short communication ».
L'implication de chacun des auteurs dans les articles cités est la suivante :
• Paméla Nicolle, Candidate au doctorat : planification et réalisation des expériences, analyses des résultats, rédaction des articles scientifiques et publication des articles scientifiques ; • Charlène Marcotte, Étudiante en 1er cycle : accompagnement ponctuel dans la préparation
xx
• Dre Kyle Williams, Applications Scientist chez Malvern Instruments Ltd : analyses chromatographiques des polysaccharides, aide dans l’interprétation des résultats, correction et révision de l’article ;
• Dre Karine Pedneault, Co-directrice de thèse : élaboration du projet de recherche, supervision de l'étudiante, correction et révision des articles scientifiques et publication des articles scientifiques ;
1
Introduction
L’intérêt des Québécois pour le vin est de plus en plus marqué. En 2017, les ventes de vin au Québec atteignaient 2,3 milliards de dollars canadiens, soit 79% des ventes d'alcool en volume, les vins rouges représentant à eux seuls 63,9% des ventes (SAQ, 2017). Malgré un regain de popularité pour les produits locaux, les vins québécois occupaient cette même année moins de 3% des parts de marché, bien moins que les vins français et italiens qui eux détenaient 54% des parts (SAQ, 2017). Ces faibles résultats peuvent s’expliquer en partie par une internationalisation de la population québécoise via l’immigration (habitude de consommation) et/ou l’accès à de nombreux vins de styles différents provenant de diverses régions du monde (concurrence directe). Mais outre le prix, la qualité et le goût sont parmi les premiers critères pris en considération par la majorité des Québécois lors de l’achat d’un vin (MAPAQ, 2016).
La qualité et le goût d’un vin rouge reposent en grande partie sur son acidité, son astringence et son degré d’alcool, qui contribuent à l’équilibre de sa structure (Blouin & Cruège, 2013). Une structure équilibrée, une belle robe ainsi qu’une harmonie des arômes au nez et en bouche sont autant de signes d’un bon vin. Parmi les nombreuses molécules qui contribuent au goût du vin, les tanins occupent une place prépondérante puisque leur concentration a été positivement corrélée avec la perception de la qualité des vins (Kassara & Kennedy, 2011; Mercurio, Dambergs, Cozzolino, Herderich, & Smith, 2010). Les tanins sont naturellement présents dans le raisin et sont cédés au vin au cours du processus de vinification, plus spécifiquement lors de l’étape de macération moût-marc, mais l’élevage en fût de chêne contribue aussi à augmenter la teneur en tanins des vins (Casassa & Harbertson, 2014; Herderich & Smith, 2005).
Par définition, les tanins sont des substances de poids moléculaire variable (300-3000 g.mol-1)
capables de former une combinaison stable avec les protéines via des interactions hydrophobes et des ponts hydrogènes (Gawel, 1998). Ils jouent conséquemment un rôle important dans la perception de l’astringence en modifiant les propriétés lubrifiantes des protéines salivaires lors de l’ingestion du vin (Soares, Brandão, Mateus, & De Freitas, 2017). L'intensité astringente augmente avec la teneur en tanins des vins et s’accroit de façon non linéaire avec le degré de polymérisation et/ou le poids moléculaire des tanins (W. Ma et al., 2014).
2
Dans les provinces de l’Est du Canada, telle que la province de Québec, la production vinicole repose essentiellement sur la culture des cépages hybrides interspécifiques (CHI) (Dubé & Pedneault, 2014). Le développement et la commercialisation de ces cépages a permis d’accroitre considérablement l’essor de l’industrie vitivinicole québécoise ces quarante dernières années (Dubé & Pedneault, 2014). Issus de croisements entre différentes espèces de vignes dont la vigne européenne Vitis vinifera et les vignes nord-américaines (ex. : V. riparia, V. labrusca), les CHI montrent une forte résistance aux conditions climatiques extrêmes et aux maladies fongiques, les rendant mieux adaptés que leurs homologues européens aux conditions environnementales limitantes de l’Est canadien (Pedneault & Provost, 2016).
La génétique distincte des CHI confère également à leurs baies une composition chimique différente de celle des cépages Vitis vinifera, ce qui a des conséquences significatives sur les qualités organoleptiques des vins qu’ils produisent. Bien que les raisins de CHI rouges permettent d’obtenir des vins présentant des arômes agréables, leur teneur élevée en acide malique accroit leur acidité tandis que leur forte teneur en anthocyanes leur donne une couleur foncée (Manns, Coquard Lenerz, & Mansfield, 2013; Pedneault, Dorais, & Angers, 2013). Par ailleurs, leur teneur réduite en tanins résulte en des vins peu astringents, présentant un manque de structure et peu de longueur en bouche (Manns et al., 2013; Pedneault et al., 2013).
Une conduite appropriée de la vigne (ex. : palissage en hauteur, éclaircissage) et de la vinification (ex. : levures désacidifiantes, désacidification microbiologique ou par procédés) et/ou l’assemblage avec d’autres cépages moins acides permettent de gérer la forte acidité des CHI et de trouver les équilibres requis (Aubry, 2018). Néanmoins, l’astringence demeure une composante encore peu maitrisée chez les vins issus de CHI rouges. Sa modulation se fait généralement de façon empirique par les vinificateurs québécois, via des tanisages soutenus.
Des résultats relativement récents sur la vinification des CHI rouges montrent une inefficacité partielle ou générale de nombreux traitements pré-fermentaires tels que l’ajout de tanins exogènes, le traitement par le froid, la thermovinification et l’enzymage pectique pour l’extraction et la rétention des tanins dans les vins de CHI (Manns et al., 2013). De fait, ceux-ci présentent en moyenne jusqu’à six fois moins de tanins que les cépages européens en dépit du fait que leurs baies en contiennent en moyenne seulement deux fois moins que les cépages européens. Les travaux de Springer &
3
Sacks (2014) ont en partie attribué ces résultats par une plus forte teneur en protéines et polysaccharides des raisins de CHI rouges.
À l’instar des tanins, d’autres molécules d’importances telles que les protéines et les polysaccharides sont relarguées à partir du raisin vers le moût/vin durant le procédé de vinification. Ces macromolécules jouent un rôle majeur dans la rétention des tanins, avec un impact significatif sur l’astringence des vins rouges. Les protéines précipitent en présence de tanins, limitant alors la rétention des tanins dans les vins de CHI rouges (Springer, Sherwood, & Sacks, 2016). Leur élimination par chauffage ou par ajout de bentonite a récemment montré des résultats positifs sur la rétention des tanins dans les vins de CHI (Springer, Chen, Stahlecker, Cousins, & Sacks, 2016). Par ailleurs, le rôle des polysaccharides sur la rétention des tanins est plus ambigu. Les polysaccharides du raisin ont montré un effet sur le comportement colloïdal des tanins et sur les interactions tanins-protéines, néanmoins, ces effets varient selon la nature et la concentration du polysaccharide (structure, taille, charge, etc.) ainsi que la force ionique et le pourcentage d’éthanol de la matrice (Hanlin, Hrmova, Harbertson, & Downey, 2010).
Les anthocyanes jouent également un rôle prépondérant sur l’astringence des vins rouges. Ces composés sont extraits lors de la pré-macération alcoolique ou tôt lors de la fermentation alcoolique (Casassa & Harbertson, 2014). Ils favorisent l’extractabilité des tanins de la pellicule en interagissant de façon concurrentielle avec les polysaccharides des parois cellulaires du raisin (Bautista-Ortín, Martínez-Hernández, Ruiz-García, Gil-Muñoz, & Gómez-Plaza, 2016). Au cours de la vinification, les anthocyanes réagissent avec les tanins et donnent naissance à des adduits anthocyane-tanin, aussi appelés « pigments polymériques » (Cheynier, Souquet, Fulcrand, Sarni, & Moutounet, 1998), stabilisant la couleur des vins d’une part, et bloquant la polymérisation des tanins et possiblement leur précipitation d’autre part (Casassa & Harbertson, 2014). Chez les CHI, la présence d’anthocyanes diglucosides en forte proportion tend à ralentir ces réactions entre tanins et anthocyanes (Burtch, Mansfield, & Manns, 2017). Pour des degrés moyens de polymérisation similaires, les pigments polymériques montrent une astringence moindre comparativement aux tanins (Vidal, Francis, et al., 2004).
Au vu des connaissances actuelles, il apparait que les constituants macromoléculaires de la paroi cellulaire végétale (protéines et polysaccharides) du raisin et les anthocyanes jouent un rôle prépondérant sur l’extraction/rétention des tanins dans les vins de CHI durant la vinification et, par
4
conséquent, influencent la concentration en tanins des vins et leur astringence. Dans cette optique, l’objectif général de cette thèse vise (1) à développer un procédé de vinification adapté à la composition physico-chimique atypique des CHI rouges afin de produire des vins plus riches en tanins, ayant un potentiel accru de satisfaire les goûts des consommateurs québécois et, conjointement, (2) à clarifier le rôle des constituants de la paroi cellulaire du raisin (polysaccharides et protéines) et des anthocyanes sur la rétention des tanins dans les vins de CHI.
Pour répondre à ces objectifs, nous avons dans un premier temps étudié l’effet du ratio moût/marc durant la fermentation alcoolique et du ratio tanins/anthocyanes dans le vin, en remplaçant partiellement ou totalement le marc de raisin de CHI rouge (pauvre en tanins et riche en anthocyanes) par du marc de raisin de CHI blanc plus riche en tanins mais pauvre en anthocyanes (chapitre 2). Cette alternative aux tanins œnologiques commerciaux s’inscrit parfaitement dans un contexte de vitiviniculture durable en réutilisant le marc, résidu majoritaire de la vinification en blanc. Cette démarche environnementale de plus en plus sollicitée par les consommateurs pourraient apporter une valeur ajoutée au produit. Dans un second temps, nous avons étudié conjointement l’impact de deux traitements pré-fermentaires du moût visant les protéines (bentonite et chaleur), de l’absence/présence de marc de raisin pendant la vinification et de l’ajout de tanins œnologiques commerciaux sur l’extraction et la rétention des tanins dans le vin (chapitre 3). Cette approche vise à garder intacte la typicité aromatique du vin. Enfin, une étude comparative des polysaccharides des vins de CHI rouges avec ceux issus de V. vinifera a été effectuée afin d’explorer l’impact potentiel de ces derniers sur la rétention des tanins et la perception d’astringence des vins rouges issus de CHI (chapitre 4). Les CHI rouges Frontenac et Marquette, ainsi que les CHI blancs Vidal et Frontenac blanc ont été utilisés au cours de ces études, étant parmi les cépages les plus cultivés au Québec.
5
Chapitre 1. Revue de littérature
1.1. L’industrie vinicole du Québec
1.1.1. La place de l’industrie vinicole du Québec dans le monde
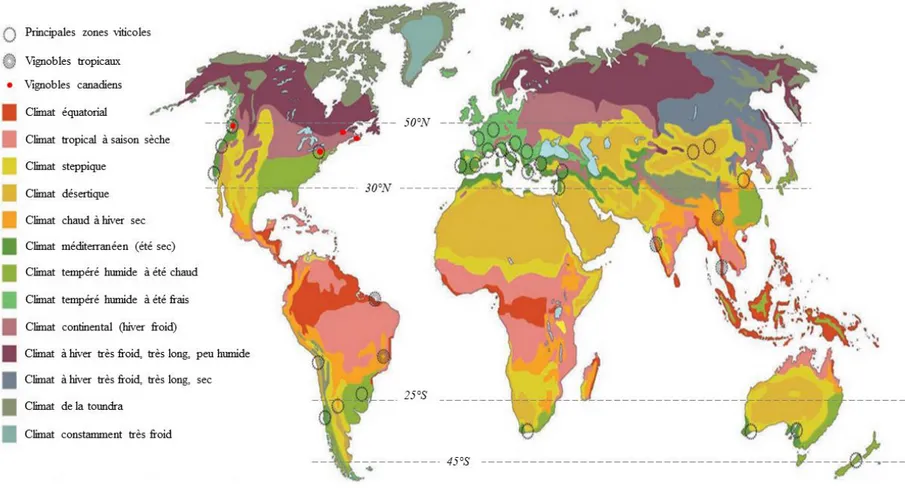
L’Organisation International de la vigne et du vin (OIV) a estimé récemment la production viticole mondiale à 7,6 millions d’hectares (ha) ; près de 45% de cette production était alors attribuable au continent européen (ex. : Espagne, 967 milliers ha ; France, 787 milliers ha ; Italie, 695 milliers ha ; Portugal, 194 ha ; OIV, 2018). Non loin de 50% des raisins cultivés sont dédiés à la production de vin, alors que le reste est utilisé pour la production de raisins de table (36%), de raisins secs (8%) et de produits dérivés (ex. : jus, vinaigre, huile de pépins) (OIV, 2017). En 2017, la production mondiale de vin était de 250 millions d’hectolitres (Miohl), la majeure partie de la production provenant de l’Italie (42,5 Miohl), de la France (36,7 Miohl) et de l’Espagne (32,1 Miohl) (OIV, 2018). Le climat méditerranéen (été chaud et sec) est propice à la culture de la vigne, toutefois, elle pousse également dans des régions plus chaudes, comme l’Australie et l’Afrique du Sud, et des régions plus froides, comme le Nord-Est et Nord-Ouest des États-Unis, le Sud-Est et Sud-Ouest du Canada, le Nord-Est de la Chine et le Japon (Fig. 1.1 ; Carbonneau & Escudier (2017)).
Depuis les années quatre-vingt, la culture de la vigne connait un essor considérable dans la province de Québec (Canada) où les conditions climatiques sont pourtant peu favorables à sa culture (hiver très froid, très long et humide) (Dubé & Pedneault, 2014). En 2017, d’après l’Association des vignerons du Québec (AVQ1), la province de Québec comptait 467 hectares de vignes en culture,
dont 377 hectares en production, soit une hausse de 12% par rapport à 2016 (AVQ, 2017). La superficie du vignoble québécois représentait alors près de 3,8% du vignoble canadien, ce qui le plaçait en troisième position derrière l’Ontario et la Colombie-Britannique (AVQ, 2017).
En 2017, 2 500 tonnes de raisins ont été foulés résultant en 2,3 millions de bouteilles de vin embouteillées. Les ventes de vin ont totalisé 24,8 M$, une croissance de 33,3% par rapport à l’année précédente (AVQ, 2017). Cependant, les vins québécois ne représentent que 3% des parts de marché, bien moins que les vins français et italiens qui eux occupent 54% des parts (SAQ, 2017).
6
Figure 1.1. Principaux bassins viticoles dans le monde, incluant les vignobles canadiens, et les types de climats associés à ces régions (d’après Carbonneau &
7 1.1.2. Les cépages cultivés au Québec
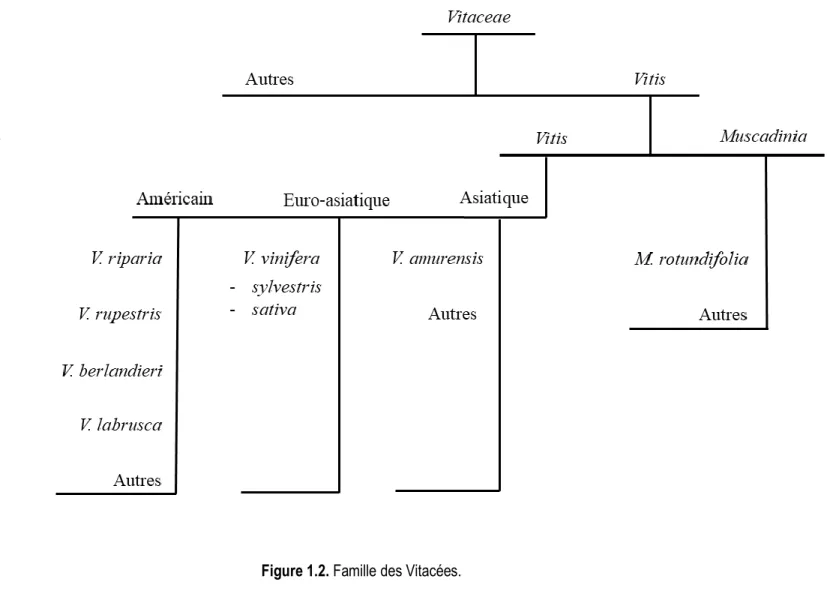
1.1.2.1. La classification botanique de la vigne
Le genre Vitis sp., est une plante grimpante de la famille des Vitacées (Fig. 1.2). Il se subdivise en deux sous-genres, Muscadinia et Vitis, qui se distinguent en fonction de leurs caractéristiques morphologiques, anatomiques et cytologiques (Mullins, Bouquet, & Williams, 1992). Le sous-genre Vitis, dont la majeure partie des vignes cultivées fait partie, comprend trois groupes de vignes qui se définissent par leur origine géographique : américaine, euro-asiatique et asiatique stricto sensus. La vigne euro-asiatique ne comprend que l’espèce V. vinifera, divisée en deux sous-espèces, la vigne sauvage V. vinifera ssp sylvestris et la vigne cultivée V. vinifera ssp sativa (This, Lacombe, & Thomas, 2006). Parmi les espèces asiatiques, V. amurensis est probablement l’espèce la plus connue, notamment pour sa très grande résistance au froid (–40°C) (L. Liu & Li, 2013; Wan et al., 2008). Les espèces américaines V. aestivalis, V. riparia, V. rupestris et V. berlandieri ont également une grande résistance aux conditions climatiques extrêmes (ex. : –36°C pour V. riparia), ainsi qu’une grande résistance aux maladies fongiques (Keller, 2015; Pedneault & Provost, 2016).
1.1.2.2. Les variétés de vigne au Québec
L’évolution du genre Vitis résulte à la fois de la sélection naturelle et de la domestication (principalement effectuée sur l’espèce V. vinifera) par l’être humain (This et al., 2006). Chez la vigne, un croisement résulte en de nombreux descendants qui sont tous, par définition, des hybrides. Lorsque les parents appartiennent à la même espèce (ex. : V. vinifera X V. vinifera), on parle d’hybrides intraspécifiques alors que lorsque les parents appartiennent à deux espèces différentes (ex. : V. vinifera X V. riparia), on parle d’hybrides interspécifiques. Dans les deux cas, chaque descendant représente une variété génétiquement spécifique (génotype). Le terme « cépage » est habituellement utilisé pour désigner les variétés sélectionnées pour leurs caractéristiques spécifiques ; un nom vernaculaire leur est alors attribué (ex. : Cabernet Sauvignon). Un cépage donné est généralement constitué d’un ensemble de clones.
8
9
Le profilage génotypique des cépages européens V. vinifera suggère qu’il en existe près de 5 000 (This et al., 2006). Ce sont les cépages les plus communément utilisés en viticulture et les plus importants sur le plan économique. Les cépages hybrides interspécifiques franco-américains sont le second groupe le plus représenté. Ils sont le résultat de croisements entre les vignes européennes V. vinifera et les vignes sauvages américaines telles que V. riparia, V. rupestris et V. labrusca. Ils sont de plus en plus utilisés en raison de leur grande tolérance aux maladies et au gel, dans les zones froides et humides comme l’Est du Canada, le Nord-Est et Centre-Ouest des États-Unis ainsi que le Nord-Est de l’Europe, mais également dans le Sud-Est des États-Unis, en raison de leur résistance à la maladie de Pierce (Ehrhardt, Arapitsas, Stefanini, Flick, & Mattivi, 2014; Kamas, Stein, & Nesbitt, 2010; J. Liu et al., 2015; Manns et al., 2013; Zhang, Petersen, Liu, & Toldam-Andersen, 2015). Les cépages V. vinifera issus de climats chauds sont généralement très sensibles aux blessures provoquées par la rudesse du climat et nécessitent pour leur culture en climat froid l’utilisation de systèmes de protection hivernale (Stafne, 2007).
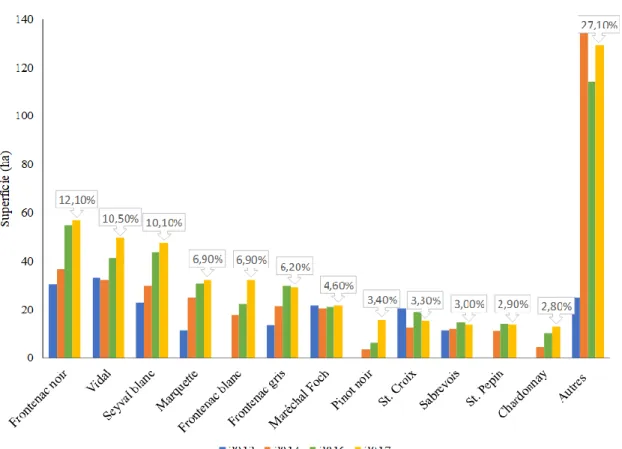
Au Québec, en 2017, on dénombrait une soixantaine de cépages cultivés, dont près de 90% de cépages hybrides interspécifiques (CHI ; AVQ, 2017). Deux cépages V. vinifera et dix CHI semi-rustiques à semi-rustiques2 représentaient près de 70% de la superficie totale cultivée : (i) les cépages V.
vinifera Pinot noir et Chardonnay (respectivement rouge et blanc) ainsi que les CHI (ii) rouges : Frontenac noir, Marquette, Maréchal Foch, St. Croix et Sabrevois ; (iii) blancs : Vidal, Seyval blanc, Frontenac blanc et St. Pépin ; et (iv) gris : Frontenac gris (Fig. 1.3). La génétique, susceptibilité aux maladies et tolérance/résistance au froid de ces CHI sont présentées Tableau 1.1.
Au Québec, les températures hivernales peuvent atteindre de –25 à –40°C. La période de
débourrement des différents cépages s’échelonne donc généralement plus tardivement entre le début et la fin du mois de mai avec des températures pouvant occasionnellement passer sous le seuil des 0ºC (gel printanier). La saison de croissance, c’est à dire le nombre de jours sans gel, est donc relativement courte, variant de 140 à 185 jours. La majorité des cépages cultivés au Québec, tels que le Maréchal Foch et le Seyval blanc, présentent une période de maturité dite hâtive (Wolf, 2008). En d’autres termes, ces cépages sont en mesure de compléter leur cycle végétatif et leur cycle reproducteur dans un laps de temps limité, coincé d’une part par les gels printaniers et d’autre
2 Par définition, la rusticité est la capacité d’une vigne en dormance à survivre aux températures hivernales et automnales
10
part par les gels d’automne. D’autres cépages tels que le Frontenac ou le Vidal blanc présentent une période de maturité intermédiaire voire tardive pouvant ainsi conduire à une maturité incomplète du fruit (Wolf, 2008).
Figure 1.3. Encépagement des membres du Conseil des vins du Québec de 2012 à 2017 (d’après AVQ,
11
Tableau 1.1. Génétique (en % de chaque espèce de vigne), susceptibilité aux maladies et tolérance/résistance au froid des principaux cépages cultivés au
Québec (d’après Dubé & Turcotte (2011); Pedneault & Provost (2016)).
Génétique Susceptibilité aux maladies et résistance au froid a
Cépage V. vi ni fer a V. ru pest ris V. ri pa ria V. la br usca V. ci ner ea V. b er lan di er i V. aes tival is Poll in isat io n lib re M ild io u de vi gn e B lan c de vi gn e Po ur rit ur e gr ise Po ur rit ur e no ire A nth racn ose B ras m or t n oi r Tu me ur d u co llet Eu typ io se To lé ran ce au fr oi d b Frontenac noir 25,4 10,2 50,4 2,3 0 7,8 2,3 0 -/+ ++ ++ ++ + ++ –29 à –34°C Marquette 63,1 7,7 19,3 4,3 0,4 0 3,4 1,6 - + + + +++ –29 à –34°C Maréchal Foch 50 25 25 0 0 0 0 0 + ++ + ++ + +++ +++ –26 à –31°C Seyval noir 54,7 31,2 0 0 0 0 14,1 0 + ++ –23 à –29°C Sabrevois 42,2 14,1 9,4 25,4 0 0 6,6 2,3 + + + + –29 à –34°C Vidal 75 15,6 0 0 0 0 9,4 0 + ++ -/+ + + + +++ + –20 à –26°C Seyval blanc 54,7 31,2 0 0 0 0 14,1 0 + +++ ++ ++ + + ++ + –23 à –29°C St. Croix 42,2 14,1 9,4 25,4 0 0 6,6 2,3 ++ ++ ++ + + –29 à –34°C St. Pepin 39,8 28,1 6,3 12,5 0 0 13,3 0 + + + + –29 à –34°C Frontenac blanc 25,4 10,2 50,4 2,3 0 7,8 2,3 0 -/+ + ++ ++ –29 à –34°C Frontenac gris 25,4 10,2 50,4 2,3 0 7,8 2,3 0 -/+ + ++ + –29 à –34°C
a Échelle de résistance et susceptibilité aux maladies : −/+, résistant et peu susceptible ; −, résistant ; +, assez susceptible ; ++, modérément susceptible ; +++, hautement
susceptible.
b Classes de rusticités des cépages : « very tender », –15 à –20°C ; « tender », –17 à –22°C ; « moderately tender », –20 à –23°C ; « moderately hardy », –23 à –26°C ; «hardy»,
12
D’un point de vue historique, les croisements interspécifiques de vignes européennes et américaines (ex. : V. riparia et V. rupestris), naturellement résistantes au phylloxéra racinaire, ont été introduits en Europe à la fin XIXème siècle afin de remédier aux pathologies et ravageurs
(ex. : oïdium, phylloxéra et pourriture noire). Originellement arrivés via l’importation des cépages américains en Europe, ces pathologies et ravageurs ont successivement affecté le vignoble européen (This et al., 2006). Fortement productifs, les CHI ont été à l’origine entre-deux-guerres d’une surproduction de vin à faible coût. Les pays environnants tels que l’Algérie et l’Espagne ont contribué également à la crise des vignobles européens en produisant de forte quantité de vins issus de cépages V. vinifera à faible coût. Une démarche de qualité (AOC, appellation d’origine contrôlée) a de ce fait été mise en place afin d’écarter entre autre les CHI qualifiés de médiocres pour la production de vin comparativement à leurs homologues européens (Trotignon, 2015). Les hybrides franco-américains ont alors été abandonnés (et même proscrits des années cinquante jusqu’à tout récemment où certains cépages ont été réintroduits dans le catalogue des variétés autorisées) au détriment du greffage de V. vinifera sur des porte-greffes de vignes nord-américaines. Cette dernière option présentait l’avantage de conserver la typicité et qualité des cépages européens tout en intégrant, via le porte-greffe nord-américain la tolérance au phylloxera. Au Québec, les hybrides furent dans les années quatre-vingt, la pierre angulaire de l’industrie vinicole québécoise, lorsque les premiers vignobles commerciaux ont été implantés.
1.1.3. Les vins québécois et l’astringence
Les vins rouges québécois issus des CHI sont généralement décrits comme des vins souples, parfois plus frais et plus colorés que leurs homologues européens ; des caractéristiques sensorielles qu’il pourrait être souhaitable de diversifier afin de contribuer à une meilleure compétitivité sur le marché. La qualité et le goût d’un vin rouge reposent en grande partie sur son acidité, son astringence et son degré d’alcool, qui contribuent à l’équilibre de sa structure (Blouin & Cruège, 2013). Parmi les nombreuses molécules qui contribuent au goût du vin, les tanins occupent une place prépondérante puisque leur concentration et leur structure ont un impact sur l’astringence des vins (Kassara & Kennedy, 2011; Mercurio, Dambergs, Cozzolino, Herderich, & Smith, 2010).
L’astringence se définit comme une sensation tactile qui se correspond à une sensation de rétrécissement, d’étirement et de plissement de l’épithélium buccal (Testing & Materials, 1978).
13
L'augmentation de la friction, la viscosité salivaire, les interactions entre les protéines salivaires et les tanins ou encore entre les récepteurs du goût acide et les petits tanins condensés seraient impliqués dans le développement de l’astringence (Bajec & Pickering, 2008).
Le mécanisme d’astringence le plus étudié est celui impliquant les interactions protéines-tanins. Il est reconnu que les interactions et/ou la précipitation des protéines salivaires (principalement celles riches en proline) avec les polyphénols du vin, majoritairement les tanins condensés, jouent un rôle important dans la perception de l’astringence des vins. Ces interactions modifient les propriétés lubrifiantes des protéines salivaires, conduisant ainsi à une sensation tactile d’astringence au niveau de la paroi buccale (sentiment de sècheresse, de rudesse ou encore de rugosité en bouche) (McRae & Kennedy, 2011; Scollary, Pásti, Kállay, Blackman, & Clark, 2012; Soares et al., 2017).
L'intensité astringente d’un vin dépend de la teneur et de la structure de ses tanins (W. Ma et al., 2014). Elle est corrélée positivement à la teneur en tanins (Harbertson, Kilmister, Kelm, & Downey, 2014; Kallithraka, Kim, Tsakiris, Paraskevopoulos, & Soleas, 2011) et croit également, sans être linéaire, avec le degré de polymérisation et/ou le poids moléculaire des tanins (Sarni-Manchado, Cheynier, & Moutounet, 1999; Sun et al., 2013). Poncet-Legrand, Cartalade, Putaux, Cheynier, & Vernhet (2003) observent que les tanins présentant un degré de polymérisation de 8 à 10, permettent une combinaison stable avec les protéines salivaires alors que les tanins ayant un degré de polymérisation supérieure à 15 présentent une meilleure solubilité (Scollary et al., 2012). Le degré de galloylation, c’est à dire la proportion d’unités flavan-3-ols portant un acide gallique estérifié au noyau flavan-3-ol, augmente l'intensité astringente (Poncet-Legrand et al., 2003). Les tanins retrouvés dans les vins proviennent en grande partie des baies de raisin ; leur concentration, de même que leur structure, varient selon les cépages.
1.2. La composition phénolique des baies de raisin
Le raisin est une baie charnue constituée de pépins et d’un péricarpe, lequel est composé d'un épicarpe (pellicule), d'un mésocarpe (pulpe) et d'un endocarpe (Fig. 1.4a) (Kennedy, 2002). La composition chimique globale des principaux constituants de la baie est présentée au Tableau 1.2. La pellicule est formée d’un cuticule riche en cires lipidiques, des cellules de l'épiderme et des cellules de l'hypoderme (Pinelo, Arnous, & Meyer, 2006) (Fig. 1.4b). Elle est le lieu de synthèse et d'accumulation de nombreux composés d'intérêt œnologique, notamment les
14
tanins et les anthocyanes (Gagné, Saucier, & Gény, 2006). La pulpe, constituée de 25 à 30 assises cellulaires à maturité, est majoritairement constituée d'eau et contient la majeure partie des sucres et des acides du raisin (Diakou & Carde, 2001). L'endocarpe contient une fine couche de cellules en contact avec les pépins. Les pépins, constitués d'un embryon, d'un albumen et d'un tégument, sont riches en tanins et en lipides (Winkler, 1974).
Tableau 1.2. Composition chimique (en % du poids frais) de la pellicule, de la pulpe et des pépins de
raisin (d’après Flancy (1998); Gros & Yerle (2014)).
Pellicule Pulpe Pépins
Eau 78 - 80% 70 - 80% 20 - 50% Sucres - 10 - 25% - Sels (hydrogénotartrate) - 1% - Matières lipidiques 1 - 2% - 10 - 20% Matières tanniques 0,4 - 3% - 7 - 8% Pigments 0 - 0,5% - - Matières acides 0,8 - 1,6% 1% 1% Matières azotées 1,5 - 2% - 5% Matières minérales 1,5 - 2% - 1 - 5% Matières hydrocarbonées - - 30-35%
Les composés phénoliques présents dans le raisin peuvent se répartir en deux classes : (i) les composés non-flavonoïdes incluant les acides phénols, divisés en acides benzoïques et hydroxycinnamiques (structure en C6-C1 et C6-C3), ainsi que d’autres dérivés phénoliques tels
que les stilbènes (structure en C6-C2-C6) et (ii) les composés flavonoïdes (structure en C6-C3
-C6) comprenant les anthocyanes, les flavonols et les flavan-3-ols (Fig. 1.5). L'espèce de vigne,
le type de cépage, le millésime (température, ensoleillement, stress hydrique ou encore le rendement de la parcelle) et la maturité déterminent en grande partie le potentiel phénolique du raisin (Del Rio & Kennedy, 2006; Kennedy, Matthews, & Waterhouse, 2000; Springer & Sacks, 2014). Outre le fait d’être impliqués dans les processus de défenses des plantes contre les UV et les attaques pathogènes, les composés phénoliques, et plus particulièrement les anthocyanes et flavan-3-ols, ont un impact majeur en œnologie puisqu’ils sont notamment responsables des différences de couleur et de saveur entre les vins (Kennedy, Saucier, & Glories, 2006; Moreno-Arribas & Polo, 2009).
15
Figure 1.4. Structure ((a), d'après Kennedy (2002)) et organisation tissulaire ((b), d’après Fougère-Rifot & Cholet (1996)) d’une baie de raisin à maturité. Organisation
structurale de la paroi végétale primaire ((c), d’après Koolman, Röhm, Wirth, & Robertson (2005)) et structure des principaux polysaccharides de la paroi : (d), cellulose ; (e), pectine (d’après Scheller, Jensen, Sørensen, Harholt, & Geshi (2007)) et (f), hémicellulose.
16
17 1.2.1. Les anthocyanes
Les anthocyanes sont les pigments rouges des raisins. Ils sont localisées dans les vacuoles des cellules épidermiques de la pellicule de raisin et, dans le cas des cépages dits ‘‘teinturiers’’, dans les cellules de la pulpe (Amrani Joutei & Glories, 1995).
Les anthocyanes sont formés d’une partie aglycone, l’anthocyanidine, attachée à un ou deux sucres, généralement un glucose (Chira, Suh, Saucier, & Teissèdre, 2008); (Ribéreau-Gayon, Glories, Maujean, & Dubordieu, 2006). Les anthocyanidines les plus couramment rencontrés chez Vitis sont la pelargonidine, la cyanidine, la delphinidine, la péonidine et la malvidine. Elles ne sont présentes en quantité significative que chez les cépages rouges ou gris.
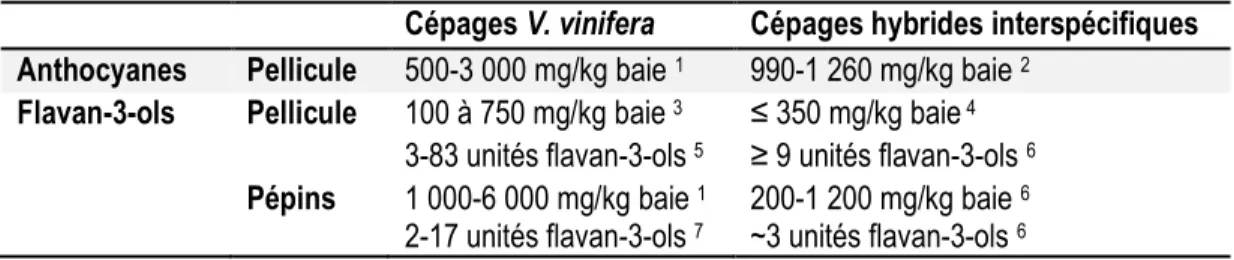
Les CHI rouges présentent des teneurs en anthocyanes généralement élevées, de l’ordre de 990 à 1 260 mg/kg baie (Sun, Sacks, Lerch, & Heuvel, 2011). Chez les V. vinifera, les teneurs peuvent être plus ou moins importantes dépendamment du cépage et varier de 500 à 3 000 mg/kg baie (Chira et al., 2008; Ribéreau-Gayon, Glories, et al., 2006). Le Tableau 1.3 reprend de façon synthétique ces données. Aussi, les CHI rouges présentent une forte proportion d’anthocyanes diglucosylées qui peuvent représenter jusqu’à 100% des anthocyanes totaux (Balík, Kumšta, & Rop, 2013; Van Buren, Bertino, Einset, Remaily, & Robinson, 1970). Chez V. vinifera, ils ne sont présents qu’à l’état de traces (Ribéreau-Gayon, Glories, et al., 2006).
1.2.2. Les flavan-3-ols et proanthocyanidines
Par définition, les tanins condensés du raisin, également appelés proanthocyanidines, sont des substances capables de former des combinaisons stables avec les protéines (Bate Smith & Swain, 1965) ou encore les polysaccharides (Riou, Vernhet, Doco, & Moutounet, 2002). Les tanins sont principalement localisés dans les pépins et la pellicule du raisin. Dans la pellicule, les tanins se trouvent sous forme libre dans les vacuoles et liés aux protéines et polysaccharides de la paroi cellulaire (Amrani & Mercierz, 1994; Gagné et al., 2006). Dans les pépins, ils sont présents dans les enveloppes internes et externes, sous la cuticule et les cellules épidermiques.
Les flavan-3-ols sont présents dans le raisin sous formes de simples monomères de (+)-catéchine et (–)-épi(+)-catéchine et aussi sous formes polymérisées (oligomères et polymères de