T
T
H
H
E
E
S
S
E
E
En vue de l'obtention du
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Immunologie
JURY
Pr.Joost Van Meerwijk Président Pr.Jacques Haiech Rapporteur Dr. Lars Rogge Rapporteur Dr.Hans Yssel Examinateur Dr. Sylvie Guerder Examinateur Dr. Lucette Pelletier Directeur de thèse
Ecole doctorale : Biologie-Santé-Biotechnologies de Toulouse Unité de recherche : INSERM U563
Directeur(s) de Thèse : Dr.Lucette Pelletier Rapporteurs :
Présentée et soutenue par Marilena DJATA CABRAL
Le 31 octobre 2008
Titre : Les récepteurs aux dihydropyridines sélectivement exprimés par les lymphocytes Th2 sont important pour leur signalisation et sont une cible dans le traitement de l’asthme
A mes parents, Ma sœur, Mes frères, Mon mari Et à toute ma famille
Merci….Obrigado !!!!!
Je tiens à remercier le Professeur Joost Van Meerwijk, le Professeur Jacques Haiech, le Docteur Lars Rogge , le Dr. Hans Yssel et le Dr. Sylvie Guerder d’avoir accepter de faire partie de mon jury.
Cela fait maintenant 4 ans que je suis dans l’équipe… Le temps passe vite…
Merci Lucette de m’avoir accueilli dans l’équipe en DEA et de m’avoir fait confiance pour la thèse (et maintenant pour un an de plus…). Ta constante disponibilité, ta gentillesse et ton enthousiasme ont été primordiaux.
Jean-Charles merci pour vos conseils scientifiques. Et de m’avoir accorder votre confiance pour l’année suplémentaire que l’on va passer ensemble..
Pep, nous avons beaucoup ri, tu m’as montré comment vendanger même au milieu des « petites bêtes ». Je n’oublierais jamais ta devise pour les manips « ceinture et bretelles » que je continue à appliquer dans tout mon travail.
Bruno, tu m’as appris à attraper les souris, faire des boulettes en papier et comment jouer au tennis avec deux morceaux de calendrier. Tu m’as aussi transmis ta rigueur dans le travail., ça a été un grand plaisir de travailler avec toi. Merci pour tout et de toute façon on garde contact.
Merci Marie-Laure pour ton aide. J’espère que je vais pouvoir continuer à te commander du miel même à l’autre bout du monde. Pascal, c’est un plaisir de t’avoir dans l’équipe ! Lise, j’ai bien aimé t’accueillir dans l’équipe pour ton stage. Tu nous a amené ta bonne humeur communicative. Etienne, tu as été mon premier stagiaire, on a beaucoup ri, c’est très agréable de travailler avec quelqu’un comme toi, merci pour tes dessins.
Je voudrais remercier le Dr. Nelly Blaes avec qui j’ai fait mon premier stage en laboratoire et qui m’a transmis sa passion. Je n’oublierais jamais votre accueil et votre gentillesse. Depuis quelques mois nous avons déménager dans les nouveaux locaux, forcément un peu perdus au début (où sont les cônes, ou est-ce qu’on range le matériel…..), merci Karine, Eliane, Cyril et Virginie de nous avoir faciliter la tâche en répondant à toutes mes questions qui certains jours étaient nombreuses.
L’étage bleu a été la première étape à mon arrivée à l’INSERM, j’y suis restée 3 ans. Merci beaucoup à tous de votre accueil, votre aide dans les nombreuses questions scientifiques. La pause café du matin très agréable pour bien démarrer la journée. Et aussi ne pas oublier les vendanges chez Pep ! Dominique, merci beuacoup pour pleins de choses…ta présence, ta disponibilité, nos discussions cinéma. C’était un plaisir de partager le bureau avec toi.
Le DEA : beaucoup de travail, des nuits courtes…mais, heureusement avec de bons amis tout devient plus facile. Du coup les souvenirs du DEA sont aussi, les apéros après une nuit blanche à finir le projet, en cas de déprime toujours quelqu’un avec qui parler pour remonter le moral….Des cultures différentes : la Saintonge, le Liban, la Réunion, Toulouse, les Landes….Olivier, nos batailles d’eau, de boulette en papier et parties de tennis restent mémorables.Ton regard sur la science permet des discussions toujours très intéressantes et constructives. Merci de m’avoir initier à la culture saintongeaise et de m’avoir permis d’adhérer à la meilleure des associations : vive la Supercagouille !!! Hicham, merci d’avoir augmenter ma culture en me racontant l’histoire de ton pays. Merci pour ton écoute. Laurence, ( rendez-vous en Australie…) Adeline, Julie et Nicolas le « beau gosse motard de la promo ». Merci à tous.
Durant ces années j’ai pu faire de nombreuses rencontres et de nouvelles amitiés : Céline C, Anne, Lucille, Julie, Christine (rendez-vous quelque part dans le monde….), Audrey, Grégoire sans vous ça n’aurait pas été pareil. Anne et Céline notre voyage à San Francisco restera un beau souvenir. L’étage vert, un moment de plaisir, au moment du café ou tout simplement de passage entre les incubations. Merci à tous pour votre bonne humeur , votre gentillesse et les discussions scientifiques.
Dans la connaissance du monde calcium il y a un long chemin à parcourir, merci Marc et Catherine d’organiser des ateliers si interessants et agréables. Je vous remercie également de votre présence et c’est tellement agréable de vous voir et travailler avec vous !
Gilles, c’est un plaisir de discuter avec toi que ce soit science, musique ou foot (d’ailleurs j’aurais apris beaucoup de choses en t’écoutant). Jérôme j’ai aimé faire ta connaissance et travailler avec toi. Bon courage pour la suite !
Un grand merci à toutes les personnes qui nous facilitent le travail au quotidien : Dominique, Aline, Joel, Marie. Votre sourire est un réel bonheur dans la journée. Fatima, c’est un plaisir de t’avoir pas très loin.
Nouveau batiment donc nouvelles habitudes, je venais déjà de temps en temps mais maintenant c’est devenu mon deuxième bureau : chez les PLB. Julie , Nabila et Stéphanie merci pour votre soutien dans les moments durs et pour les rigolades. C’est essentiel de savoir que je peux toujours rentrer dans ce bureau à tout moment. Maryse merci pour ton sourire et Sophie merci pour nos discussions autour d’un café. Merci à toute l’équipe de me laisser utiliser votre microscope !
SOMMAIRE
Introduction………12
1.Développement et fonctions des lymphocytes Th2………...15
1.1 Les sous populations de lymphocytes T CD4+………15
1.2 Gata-3, facteur de transcription caractéristique des lymphocytes Th2……….16
1.3 Facteurs influençant la différenciation des lymphocytes Th2………..19
2. Voies de signalisation calcique dans les lymphocytes T………..24
2.1 Les voies classiques………...25
2.1.2 Les canaux CRAC………26
2.1.3 Les autres canaux calciques………..28
2.1. 3.1 les canaux calciques intracellulaires………...28
2.1.3.2 Rôle des canaux TRP dans la régulation calcique dans les lymphocytes T.30 2.2 Une signature calcique spécifique d’un lignage T ?………..32
3 - Les Récepteurs aux dihydropyridines (RDHP)………...34
3.1. Les RDHP dans les cellules excitables………..34
3-2 Les RDHP dans les cellules non excitables……….37
3.2.1 Les cellules non immunitaires……….37
3.2.2 Les cellules du système immunitaire………..38
4 . La PKG : Rôle dans le système immunitaire………...43
4.1. Rôle du NO dans la réponse immunitaire ………..43
5. Asthme allergique……….51
5.1 Contrôle génétique de l'asthme allergique………..51
5.2 Modèles expérimentaux………..52
5.3 Rôle des LTh2 dans l’asthme allergique……….53
5.3.1 La réponse inflammatoire……….55
5.3.2 La physiopathologie de l’asthme chez l’homme………..56
5.3.3 La capture de l’antigène et l’induction de la réponse Th2………58
5.3.4 Cellules dendritiques et TSLP………...59
5.3.5 L’épithélium : moteur de l’entretien de la réponse allergique………..60
5.3.6 Les lymphocytes Th2 : chef d’orchestre da la réponse inflammatoire chronique…61 5.4 Traitements actuels……….62
5.5 Nouvelles stratégies………63
Objectifs………...65
Article 1 ………...68
Article 2 ………...79
Résultats non publiés ……….89
Discussion ………..90
1.Quelle fonction pour des canaux calcique dépendant du voltage de type 1 (Cav1) exprimés dans les lymphocytes Th2 ?………..91
1.1 Régulation des canaux Cav1 dans les lymphocytes T………..91
1.1.1 Structure………...91
1.1.2 Régulation par phosphorylation………...92
CONCLUSIONS ET PERSPECTIVES………96 REFERENCES………..98
RESUME
L’asthme allergique est une maladie inflammatoire chronique des voies respiratoires en forte augmentation.
Deux sous populations de lymphocytes T CD4+ , les lymphocytes Th1 et Th2, diffèrent par leur fonction. Les lymphocytes Th 1 sécrètent de l’interféron γ et les lymphocytes Th2 produisent de l’IL-4, 5 et 13. Les lymphocytes Th2 ont un rôle central dans la réaction inflammatoire caractéristique de l’asthme. Les voies de signalisation et surtout la régulation du calcium sont différentes entre les lymphocytes Th1 et Th2.
Nos résultats montrent que les lymphocytes Th2 expriment spécifiquement des canaux calciques récepteurs aux dihydropyridines et que ces canaux sont absents des lymphocytes Th1. Ces canaux sont activés après stimulation du TCR et sont important pour la signalisation calcique et la production de cytokines Th2 (IL 4,IL 5 et IL-13).
J’ai participé à montrer que la protéine kinase G est impliquée dans l‘entrée de calcium dépendante des récepteurs aux dihydropyridines. Des études in vitro et in vivo montrent que l’inactivation de ces canaux inhibent la fonction des lymphocytes Th 2 avec un effet bénéfique dans l’asthme allergique expérimentale.
Ces résultats montrent que des canaux calciques récepteur aux dihydropyridines exprimés spécifiquement par les lymphocytes Th 2 sont essentiels pour leur fonction. Cette voie pourrait être une nouvelle cible thérapeutique dans le traitement de l’asthme allergique.
ABSTRACT
Allergic asthma is a chronic inflamatory disease of the lungs which prevalence and severity are both increasing.
CD4+ T cell subsets include Th1 cells that produce interferon-γ (IFNγ) and Th2 cells that produce interleukin 4,5 and 13. Th2 cells are considered as orchestrating the inflammatory reaction characteristic of asthma. Signaling pathways and especially calcium regulation differ between Th1 and Th2 cells which could offer an opportunity for the development of new therapies targeting calcium signaling in Th2 cells.
We showed that voltage-operated calcium (Cav1) channels, that are characterised as
dihydropyridine receptors (DHPR) in excitable cells, are specifically expressed in Th2 cells and not in Th1 cells. These channels are involved in TCR-dependent calcium response and in Th2-cytokine production (IL-4, IL-5, IL-10 and IL-13).
I contributed to show that protein kinase G is implicated in calcium entry dependent on dihydropyridine receptors. In vitro and in vivo studies show that the inactivation of these channels inhibits Th2 cells functions with a beneficial effect in allergic asthma.
These results show that dihydropyridine receptors calcium channels specifically expressed by Th2 cells are essential for their function. Targeting these channels is a rationale for the development of new therapies in the treatment of allergic asthma.
ABREVIATIONS
AKAP A Kinase-anchoring protein
BCR Récepteur des lymphocytes B
CD Cellule Dendritique
CMH Complexe Majeur d’Histocompatibilité
CPA Cellule Présentatrice d’Antigène
CRAC Calcium Release Activated Calcium channel
DAG Diacylglycérol
DHP Dihydropyridine
GMPc Guanosine Monophosphate cyclique
IFNγ Interféron gamma
Ig Immunoglobuline
IL Interleukine
IP3 Inositol 1,4,5-triphosphate
LPS Lipopolysaccharide
LT Lymphocyte T
NFAT Nuclear Factor of Activated T cells
NK Natural Killer
OVA Ovalbumine
PCR Polymerase Chain Reaction
PKA Protéine kinase A
PKG Protéine kinase G
PLC Phospholipase C
PMA Phorbol Myristate Acetate
RDHP Récepteur aus Dihydropyrines
SOC Store Operated Calcium channels
TCR Récepteur des cellules T pour l’antigène
TRP Transient Receptor Potential ion channel
TIRFM Total Internal reflexion microscopy
TGF Transforming Growth Factor
LTh Lymphocyte T helper
TLR Toll-like Receptor
INTRODUCTION
Durant ma thèse je me suis intéressée à la signalisation calcique dans les lymphocytes Th2 et son implication dans le traitement de l’asthme allergique. Le groupe dans lequel j’ai travaillé a montré que les lymphocytes Th2 expriment sélectivement des canaux calciques apparentés aux récepteurs aux dihydropyridines (RDHP) classiquement spécifiques des cellules excitables. J’ai contribué à montrer que l’entrée de calcium par ces canaux suite à l’engagement du récepteur T à l’antigène (TCR) mettait en jeu une protéine kinase G dans les lymphocytes Th2. La démonstration de tels canaux dans les lymphocytes Th2 a probablement des implications potentielles dans le traitement des maladies allergiques dans lesquelles les lymphocytes Th2 ont un rôle central. En effet, j’ai montré que des inhibiteurs des RDHP, classiquement utilisés dans le traitement de maladies cardiovasculaires pouvaient être efficaces dans des modèles expérimentaux d’asthme allergique, une pathologie due à une réponse Th2 inadaptée contre des allergènes. Avant de rapporter les résultats de mes travaux, je tenterai de faire le point sur les connaissances actuelles concernant :
∗ La différenciation et les fonctions des lymphocytes Th2
∗ Les voies de signalisation activées dans les lymphocytes T en me focalisant sur les points différenciant les différentes sous populations de lymphocytes T
∗ Les RDHP dans les cellules excitables et les résultats très controversés sur l’existence de tels récepteurs dans des cellules non excitables et particulièrement les lymphocytes
∗ Le rôle de la protéine kinase G dans le système immunitaire
∗ Les connaissances actuelles sur l’asthme obtenues à partir de modèles expérimentaux et des données épidémiologiques et cliniques collectées chez les patients
∗ Les traitements classiques de l’asthme allergique et les nouvelles stratégies proposées
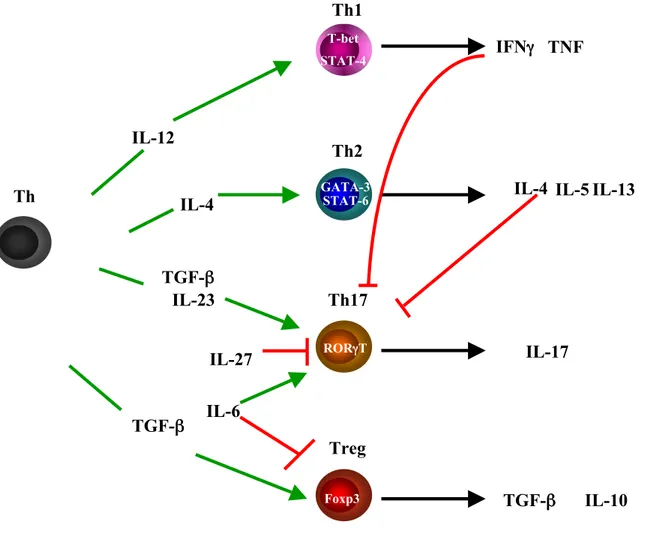
Figure 1 : Differenciation des lymphocytes T CD4+ ou T helper. Sont indiqués les facteurs de transcription spécifiques de lignage et les cytokines sécrétées spécifiques par sous population de lymphocyte T CD4+. Les flèches vertes indiquent une induction et les lignes rouges une inhibition.
IL-4 IL-12 TGF-β TNF Th2 Th1 IL-23 Treg Th17 Th IL-6 IL-27 IFNγ IL-4 IL-5 IL-17 IL-13 STAT-4 T-bet GATA-3 RORγT STAT-6 IL-10 Foxp3 TGF-β TGF-β
∗ Les résultats d’études cliniques portant sur l’effet des dihydropyridines dans l’asthme allergique chez les patients
1. Développement et fonctions des lymphocytes Th2
1.1 Les sous populations de lymphocytes T CD4+
Les lymphocytes T CD4+ T helper (Th) sont composés de différentes sous populations (figure1) qui diffèrent par leur fonction. Les lymphocytes CD4 + helper dits effecteurs comprennent :
∗ Les lymphocytes Th1 (LTh1) producteurs d’IFNγ et qui sont impliqués dans l’éradication de pathogènes intracellulaires ;
∗ Les lymphocytes Th2 (LTh2) producteurs d’interleukines (IL)-4, d’IL-5 et d’IL-13. Ils sont impliqués dans la réponse contre les pathogènes extracellulaires multicellulaires (parasites : helminthes…) et dans des maladies allergiques (dermatite atopique, asthme allergique…) ;
∗ Les lymphocytes Th17 récemment décrits qui produisent de l’IL-17 et jouent un rôle important dans plusieurs maladies auto-immunes inflammatoires.
∗ Une quatrième population de LT CD4+ sont les lymphocytes T CD4+ régulateurs, les mieux étudiés étant les LT CD4+CD25+ qui expriment le facteur de transcription Foxp3 et qui peuvent contrôler à la fois les réponses dues aux lymphocytes Th1 et Th2. Ils inhibent les lymphocytes effecteurs par le biais de contacts intercellulaires
1.2 Gata-3, un facteur de transcription caractéristique des
lymphocytes Th2
Les lymphocytes Th1 et Th2 sont souvent décrits comme des populations dont le développement est antagoniste. En effet la différenciation en LTh1 ou Th2 s'accompagne de l'inhibition précoce de l'autre voie. Des facteurs de transcription spécifiques de lignage caractérisent les LTh2 et les LTh1 : les LTh2 expriment spécifiquement GATA-3, c-Maf, NIP-45 et les LTh1 T-bet. L'expression ectopique de GATA-3 dans des LT et même dans des LTh1 suffit à induire la production de cytokines de type 2 (1) tandis que l'expression de T-bet (2) caractérise les LTh1. La différenciation en LTh1 ou en LTh2 conduit à l'inactivation de GATA-3 et de T-bet respectivement.
L'IL-4, cytokine signature des LTh2 joue un rôle-clé dans la différenciation de ce lignage. GATA-3 est induit dans les LTh2 à la fois suite à l'engagement du TCR et à la fixation de l'IL-4 sur le récepteur de type I comprenant la chaîne alpha du récepteur de l’IL-4 et la chaîne γc commune à plusieurs récepteurs de cytokines. La fixation de l’IL-4 sur son récepteur induit un changement conformationnel qui va permettre l'activation de la kinase JAK (pour janus kinase) par autophosphorylation. Cette kinase va transphosphoryler le récepteur permettant de recruter et de phosphoryler sur tyrosine STAT-6, un facteur de transcription de la famille STAT (pour "signal transducing activators of transcription"). Celui-ci, une fois phosphorylé va se dimériser et migrer dans le noyau. Des lymphocytes T de souris STAT6-/- ne prolifèrent pas en réponse à l’IL-4 et sont incapables de se différencier en LTh2 (3). Mais une étude a montré une production résiduelle d'IL-4 par les LTh2 de souris STAT-6-/-, associée à la présence d’une population exprimant GATA-3. La surexpression de GATA-3 dans les LT CD4+ STAT-6-/- restaure complètement de développement Th2, induit c-Maf et une production normale de
cytokines Th2 (4). Finkelman et al. ont conclu à une production normale d'IL-4 chez des souris STAT-6-/- lors de la réponse initiale à l'antigène. Par contre, ils observaient une faible production d'IL-4 lors d'un rappel antigénique indiquant un défaut de la réponse mémoire (5). Ces données sont à rapprocher d'un autre travail établissant que lors d’une première stimulation, les LT CD4+ STAT-6-/- sécrètent autant d'IL-4 in vitro que des LT CD4+ sauvages. En revanche, lors de la deuxième stimulation la synthèse d'IL-4 par les LT CD4+ STAT-6-/- est plus faible.
Un troisième groupe a montré que la différenciation en LTh2 était possible en absence de STAT-6. En effet ces auteurs montrent que l’absence d’un site de liaison de STAT-6 sur le locus du gène de l’il4 et l’absence d'IL-4 dans le milieu n’empêche pas la production d’IL-4 par les cellules (6). Dans des modèles de souris déficientes pour STAT-6 ou pour la chaîne alpha du récepteur à l’IL-4 une réponse Th2 se développe après infection par des helminthes mais le maintien de la réponse n’est pas observé (7). Toutes ces études laissent penser que l’activation du récepteur de l’IL-4 et de la voie STAT-6 est importante mais n’est pas essentielle pour l’induction d’une réponse Th2 alors qu'elle est requise pour le maintien d’une réponse soutenue. La cible principale de la voie STAT-6 est GATA-3 puisque la complémentation de lymphocytes T CD4+ STAT-6-/- par GATA-3 normalise la différenciation des LTh2 (4).
GATA-3 va inhiber le développement des LTh1 en désactivant l’activité de T-bet, facteur de transcription spécifique des LTh1. L’expression de GATA-3 augmente au cours de la différentiation des LTh2 et est réprimée au cours du développement des lymphocytes Th1. L’augmentation de l’expression de GATA-3 est observée en même temps que la perte d’expression de la chaîne β2 du récepteur à l’IL-12. Ceci est en accord avec le fait que le développement des lymphocytes Th1 nécessite l’IL-12 qui cause la répression de GATA-3 et de la sécrétion d’IFNγ. Cette inhibition de GATA-3 est indépendante de la production
d'IL-4. La désactivation de la voie Th1 pourrait résulter d'une interaction physique entre T-bet et GATA-3. T-T-bet est constitutivement nucléaire. La phosphorylation de la tyrosine 525 de T-bet par les tyrosine kinases de la famille Tec et surtout itk dans les LTh1 en développement permettrait l'interaction physique avec GATA-3, ce qui pourrait séquestrer GATA-3, l'empêcher d'agir sur ses cibles et inhiber la production de cytokines Th2 (8).
GATA-3 se fixe aux promoteurs des gènes de l'il5 et de l'il13, permettant leur transcription dans les LTh2 activés. La délétion de GATA-3 dans des LTh2 bien différenciés supprime la production d'IL-5 et d'IL-13 sans affecter celle de l'IL-4 suggérant que GATA-3 ne régule pas directement la transcription du gène de l'il4 (9). Un des rôles importants de GATA-3 est de remodeler la chromatine. En règle, la méthylation de sites Cp-G et la déacétylation des histones induisent la mise au silence de gènes. Au contraire, la déméthylation de motifs Cp-G et l'acétylation des histones sont associées à une forme ouverte de la chromatine. GATA-3 par exemple induit des modifications épigénétiques permissives au niveau du locus de l'il10 et de l'il4 (10) (11). De façon intéressante, des lymphocytes n'exprimant plus la DNA methyl transferase (Dnmt1) ou Mbd2 une "methyl-CpG binding protein" produisent des quantités importantes d'IL-4 même quand ils sont cultivés dans des conditions favorisant la différenciation en LTh1 (12) (13). Fields et al. ont identifié une région en 3' du gène rad50 gene se comportant comme un régulateur (LCR pour "locus control region") augmentant l'expression des gènes codant les cytokines Th2 avoisinants (14). Les auteurs ont identifié dans cette région trois sites d'hypersensibilité à la DNAse, (témoins de l'accessibilité de la chromatine) dont l'expression prédomine dans les LTh2. Le niveau d'acétylation des histones est élevé dans les LTh2. De plus, un des sites d'hypersensibilité à la DNAse (RHS7 pour "rad50 hypersensitive site 7") est déméthylé dans les LTh2 et pas dans les LTh1. 4% des allèles sont déméthylés dans les LT naïfs versus 100% dans les LTh2 bien différenciés. Plus
récemment le même groupe a montré que la signalisation via la molécule de co-stimulation CD28 (possiblement via la production d'IL-2) et la voie R-IL-4/STAT-6 sont impliquées dans cette déméthylation. La transfection de GATA-3 dans des LTh1 ne suffit pas à déméthyler complètement ce site. Par contre, STAT-6 qui a déjà été décrit comme pouvant acétyler le promoteur du gène de l'il4 pourrait être impliqué dans la déméthylation active du site RHS7 bien qu'aucun mécanisme ne soit avancé (15).
1.3 Facteurs influençant la différenciation des lymphocytes Th2
Les facteurs influençant la différenciation des LTh1 et des LTh2 incluent la nature de l'antigène, la voie d'administration de l'antigène, la nature de la cellule présentatrice de l'antigène (CPA), l'avidité du TCR pour le peptide antigénique, des facteurs génétiques et les cytokines présentes dans l'environnement, tous ces éléments étant inbriqués.
Les cellules présentatrices d’antigène (CPA) professionnelles que sont les cellules dendritiques présentent le peptide antigénique associé aux molécules de classe II du complexe majeur d'histocompatibilité (CMH) au LT CD4+ naïf, fournissent des signaux de costimulation et orientent la différenciation en particulier grâce aux cytokines produites. Par exemple le TGFβ et l’IL-6 permettent la génération de LTh17 murins alors que l'IL-23 est requise pour leur expansion. L'IL-12 produite par les CPA ayant reçu un "signal de danger" va programmer la différenciation de LTh1 qui vont orchestrer l'élimination du pathogène (activation de macrophages, de LT cytotoxiques, …). Le rôle des TLR (pour "Toll like receptor") ayant reconnu des motifs bactériens dans la signalisation conduisant à la production de cytokines proinflammatoires et de l'IL-12 est bien connu. Par contre en ce qui concerne la différenciation des LTh2, se pose un problème car l'IL-4, cytokine-signature des LTh2 joue également un rôle-clé dans la différenciation de ce lignage. La
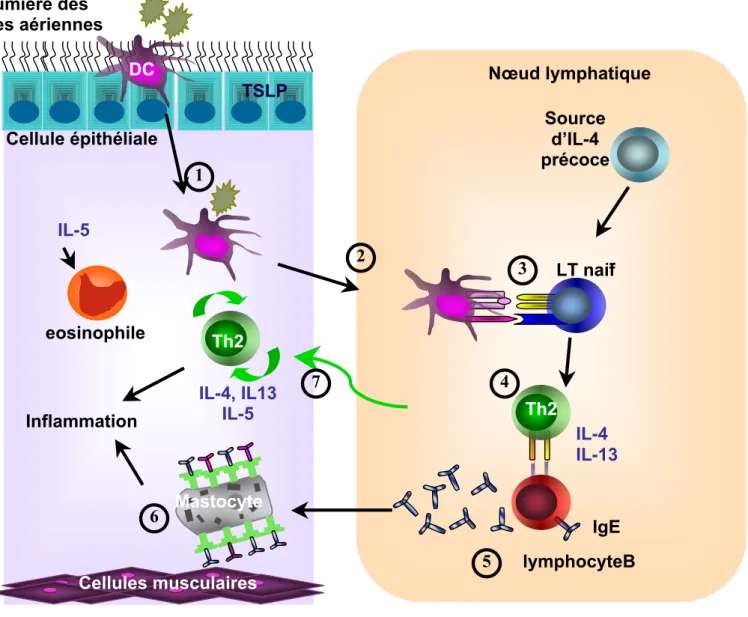
Figure 2 : La polarisation des lymphocytes Th2 par les cellules dendritiques : 3 modèles.
1/Le modèle de maturation dans lequel un stimulus Th1 va induire la différenciation des cellules dendritiques immatures en cellules dendritiques matures. Ces cellules dendritiques matures vont sécréter de l’IL-12 qui induira la différenciation des lymphocytes TCD4+ en lymphocytes Th1. En absence de ce signal, les lymphocytes T CD4+ vont se différencier en lymphocytes Th2 par défaut. 2/Le modèle de la voie alternative, met en avant la nécessité d’un signal différent, dépendant de la force du signal et la mise en jeu de différents PRR. Selon le cas, la sécrétion d’IL-12 entrainera la différenciation de lymphocytes Th2 ; la sécrétion d’IL-10 favorisera la différenciation des lymphocytes Th2.3/Le modèle d’inhibition, dans lequel les voies de signalisation s’inhiberaient mutuellement (16).
Modèle de maturation La voie alternative Le modèle d’inhibition Stimulus Th1 induit Activation de la CD Stimulus Th2 n’induit pas L’activation de la CD Stimulus Th1 Stimulus Th2 se fixe à un récepteur différent et active un autre cascade de signalisationStimulus Th1 Stimulus Th2 se fixe au même récepteur mais avec une
intensité différente
nature de la cellule qui produit initialement cette cytokine n'est pas encore complètement élucidée (LT CD4+, mastocyte ou basophile ?). De façon intéressante les cellules dendritiques de souris IL-4-/-, obtenues à partir de cellules de moelle osseuse, cultivées en présence de GM-CSF, mises en présence de l'antigène SEA (pour "soluble egg antigen") d'œufs de schistosomes et transférées chez un receveur B6 normal, sont capables d'induire une réponse Th2 chez le receveur. Ce résultat montre que la différenciation des lymphocytes Th2 dépend de la capacité de l’hôte à produire de l’IL-4. (17).
La façon dont les cellules dendritiques polarisent la différenciation en LTh1 ou Th2 n'est pas résolue. Il existe trois modèles (16) (figure 2). Dans le 1er, l'activation des cellules dendritiques via les TLR induit la production d'IL-12 et le développement de LTh1. Celui des LTh2 surviendrait par défaut en absence de signal Th1. Ceci ne tient pas compte qu'il existe des stimuli pro-Th2 comme ceux délivrés par les helminthes. Dans le second modèle, les parasites expriment des motifs reconnus par des récepteurs différents des TLR, possiblement les CLR (pour "C-type lectin receptors") qui vont signaler et conditionner la cellule dendritique à promouvoir une réponse Th2. Dans le 3ème modèle, les stimuli Th1 et Th2 se lient aux mêmes récepteurs mais la qualité ou le niveau du signal détermineront le type de réponse. Il est également probable que d'autres types cellulaires comme les cellules épithéliales influencent la cellule dendritique. Ainsi TSLP (pour "thymic stromal lymphopoietin"), produit par les cellules épithéliales lésées induirait l'expression d'OX40L par les cellules dendritiques orientant vers la différenciation en LTh2 dans les pathologies allergiques (18).
Le groupe de Flavell a montré en 2004 le rôle de la signalisation via Notch dans la génération de LTh2, indépendamment de l'IL-4. Notch est un hétérodimère comprenant une
partie extracellulaire, une partie transmembranaire et une queue intracellulaire (ICD pour "intracellular domain"). La liaison du ligand entraîne le clivage de la queue intracytoplasmique qui fixe RBPJκ convertissant ce répresseur transcriptionnel en activateur (19). Les ligands de notch : Jagged et delta sont exprimés par les CPA. L'expression de Jagged peut être induite par des stimuli qui promeuvent la différenciation des LTh2 comme la prostaglandine (PG)E2 ou la toxine cholérique et la production de jagged apparaît comme nécessaire à l'induction des LTh2 indépendamment de l'IL-4. Au contraire, les ligands de Notch delta favoriseraient la différenciation des LTh1 en inhibant celle des LTh2. Paradoxalement, même si 5 membres de la famille Notch ont été décrits, il n'existe pas à ce jour d'arguments laissant penser que des différences entre les voies de signalisation puissent expliquer les différences de comportements des LTh1 et Th2. Toutefois, la perte d'expression de RBPJκ dans les LT CD4+ se traduit par un defaut de différenciation des LTh2 sans effet sur celle des LTh1. L'addition d'IL-4 restaure la différenciation des LTh2 RBPJκ -/- suggérant que RBPJκ est en amont de la production d'IL-4. Les auteurs suggèrent fortement que RBPJκ peut induire directement l'expression de GATA-3 et celle de l'IL-4 (19). De plus des lymphocytes TCD4+ ayant une absence d’expression de Notch ont une diminution de l’expression de GATA-3. L’expression de GATA-3 peut être rétablie par l’introduction d’un allèle actif de Notch (20). Il est donc possible que l'expression de GATA-3 observée dans les LT STAT-6-/- soit due à une activation de la voie notch survenant indépendamment de la voie STAT-6. Les ligands de notch jagged pourraient être produits par les CPA stimulées par exemple par des parasites. Une telle possibilité permettrait de comprendre comment les CPA activées par certains antigènes pourraient induire des LTh2.
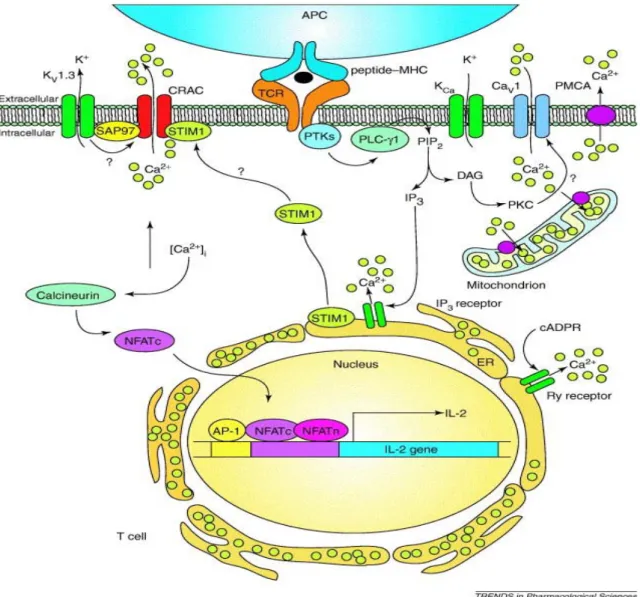
Figure 3 : Voie de signalisation schématique dans les LT. TCR : Récepteur des lymphocytes T ; PI3K : Phosphoinositide 3 kinase ; PLCg : phospholipase C g ; PKC : protéine kinase C ; IP3 : inositol triphosphate ; CRAC : Calcium released activated calcium channels ; CaMK : calmoduline kinase ; NFAT : nuclear factor of activated T cells.
DAG Src Kinases PLCγ NFAT PKC MAPK NFκB Ca2+ NFAT TCR CaM/Cn NFAT-P Remodelage de la chromatine Expression génique AP1 NFκB IP3 IP3R Ca2+ LAT, SLP76 (Adaptators) ZAP-70, Tec (Kinases) CRAC
Orai1
Kv/KC a
2. Voies de signalisation calcique dans les lymphocytes T
Le calcium joue un rôle essentiel dans l’activation, la prolifération et la différenciation des lymphocytes T. L’activation du TCR va entraîner la fixation du calcium à la calmoduline qui va à son tour activer la phosphatase calcineurine. La calcineurine va déphosphoryler le facteur de transcription NFAT (Nuclear Factor of Activated T cells) qui va pouvoir être transloqué au noyau et permettre la transcription des gènes cibles comme les gènes des cytokines. Le calcium joue un rôle important dans la régulation de l’expression de nombreux gènes importants pour la différenciation des lymphocytes T (figure 3). La comparaison de lymphocytes T de patients SCID qui ont un défaut de signalisation calcique et un défaut de translocation de NFAT nucléaire avec ceux de sujets sains, a montré que 75% des gènes modulés au cours de l’activation des lymphocytes T étaient dépendants du calcium (21). Le calcium peut être considéré comme un second messager. La régulation de l’homéostasie calcique permet la régulation des fonctions cellulaires.
Plusieurs réponses cellulaires différentes vont dépendre du calcium. Il existe plusieurs canaux, récepteurs, pompes au niveau de la membrane plasmique et à la membrane des organelles dans le cytosol ; plusieurs kinases et phosphatases vont être impliquées ; tous ces éléments participant à la mise en place de la réponse calcique font partie d’une « boite à outil du calcium » (22). Les réponses cellulaires spécifiques sont vraisemblablement dues à des signaux calciques bien précis. Les signaux calciques sont caractérisés par l’amplitude et la fréquence des variations de concentration calcique et leur localisation spatio temporelle. L’activation de NFAT nécessite une réponse calcique faible et soutenue dans le temps, alors que l’activation de NFkB nécessite une réponse forte et transitoire (23) (24).
2.1 Les voies classiques
La phospholipase C γ (PLC γ) activée permet la synthèse d’inositol triphosphate (IP3)
et de diacylglycérol (DAG) par le clivage du phosphatidyl inositol biphosphate. (PiP2). L’IP3 en se fixant sur son récepteur à la surface du réticulum endoplasmique, va permettre le relargage du calcium par les canaux récepteur à l’IP 3 et ainsi libérer les stocks intracellulaires de calcium. Dans les lymphocytes T (LT), cette libération de calcium va permettre l’ouverture d’un canal de la famille des SOC (Store operated calcium channels), le canal CRAC (calcium released activated calcium channels).
L’activation va permettre l’entrée de calcium extracellulaire dans la cellule. L’augmentation de la concentration du calcium intracellulaire va induire l’activation de la calcineurine, une phosphatase, qui en déphosphorylant le facteur de transcription NFAT va permettre sa translocation au noyau et induire la transcription de plusieurs gènes codants pour des interleukines importantes pour la différenciation et la fonction des lymphocytes T. Le DAG va activer les protéines kinases C (PKC), mais peut aussi augmenter l’activité de la PLCγ et la production de l’IP3 déclenchant des oscillations de la concentration calcique dans certains types cellulaires, comme par exemple les astrocytes (25).
Src Kinases
PL PKC
NFκB MAPK
AP-1 NFκB
2.1.2 Les canaux CRAC
Les canaux CRAC dans les lymphocytes T sont les canaux de type SOC les mieux caractérisés. Ce sont des canaux très sélectifs pour le calcium. Les courants délivrés par ces canaux sont inactivés par le calcium, selon deux mécanismes. Une inactivation très rapide, de l’ordre de la milliseconde, est causée par les ions calcium entrant. Le deuxième mécanisme est plus lent mais implique aussi les ions calcium d’une part et la restauration des réserves intracellulaires par la pompe calcium/ATPase SERCA d’autre part.
L’activation des CRAC a été décrite comme étant le résultat de la déplétion des stocks intracellulaires de calcium du réticulum endoplasmique. Le mode d’activation des canaux CRAC a été difficile à mettre en évidence du fait de l’absence de la connaissance de leur identité moléculaire.
Stim-1 est une protéine transmembranaire de la membrane du RE qui possède un domaine de fixation au calcium situé dans sa partie N-terminale dans la lumière du réticulum endoplasmique (26), ce domaine sensible au calcium est un motif EF-hand. Il existe deux formes de Stim, Stim 1 et Stim2. En 2005, Stim1 a été identifié par RNAinterférence et il a été montré que l’inactivation de Stim 1 altérait l’entrée de calcium induite par la déplétion des stocks intracellulaires de calcium. L’inactivation de Stim1 dans des cellules S2 de drosophiles, dans des lymphocytes T humains Jurkat, dans des cellules HEK293 (cellules embryonnaires de rein) ou dans des cellules SHSY5Y (neuroblastome humain) supprime le courant des canaux SOC et diminue le flux de calcium (27). Un autre groupe a confirmé ces résultats en transfectant des cellules Hela avec des siRNA spécifiques de plusieurs protéines humaines et a observé une altération du signal calcique des canaux SOC lors de l’inactivation de Stim1 et Stim2 (26). La déplétion des stocks intracellulaires de calcium va entraîner une relocalisation de stim1 très près de la membrane et ainsi permettre l’activation des canaux SOC au niveau de la membrane. Une mutation dans le motif EF-hand de Stim1 va entraîner
une relocalisation prématurée de stim1 près de la membrane et induire une activation constitutive des canaux, ceci va entraîner une forte augmentation du calcium intracellulaire, sans changement du contenu des stocks (26) (28). Le motif Ef-hand est essentiel pour l’activation des CRAC en réponse à la déplétion des stocks, Stim 1 est un « senseur » de la déplétion des stocks. Stim 1 est essentiel pour l’activation des canaux SOC à la membrane, le rôle de Stim2 dans l’activation des canaux est plus controversé, mais récemment il été montré que l’absence de Stim1 dans les lymphocytes T entraînait une inhibition du flux calcique alors que l’absence de Stim 2 n’a aucun effet. Mais une absence de Stim1 ou de Stim2 entraîne une diminution de la sécrétion de cytokines et un défaut dans la translocation de NFAT dans les lymphocytes TCD4+. L’analyse des lymphocytes T régulateurs montre également la diminution des fonctions de ces cellules en absence de stim1 et stim2(29). Tous ces résultats indiquent que Stim1 et Stim2 participent à l’entrée de calcium par les CRAC dans les lymphocytes T.
L’identification d’une mutation sur une protéine de lymphocytes T de patients ayant une immunodéficience liée à un défaut d’activation des canaux CRAC a permis d’identifier la protéine Orai1 comme un composant essentiel ou un régulateur du complexe CRAC (30). Depuis, plusieurs groupes ont confirmé le rôle de cette protéine dans le fonctionnement des CRAC. La transfection de cellules HEK et Jurkat a permis de montrer que les protéines Orai 1 et Stim1 interagissent et que l’activation des canaux CRAC nécessite la présence de ces deux protéines (31). Cette étude a montré le rôle essentiel d’Orai 1 comme constituant des CRAC. Orai 1 est une protéine transmembranaire de la membrane plasmique dont la mutation entraîne une diminution du signal calcique et un changement de perméabilité du canal, ce qui permet de définir Orai 1 comme la protéine constituant le pore d’entrée du calcium du canal CRAC (32). La protéine Orai possède trois isoformes codées par des gènes différents Orai1, Orai2 et Orai3. L’activation du lymphocyte T entraîne l’augmentation de l’expression de
Stim1, d’Orai1, d’Orai2 et d’Orai3 (33), mais la plupart des études se sont intéressées au rôle d’Orai1 dans l’activation des CRAC. Lors de la déplétion des stocks intracellulaires de calcium Stim1 va se localiser par clusters très près de la membrane (26) ou être transloquée à la membrane pour interagir avec Orai1 et permettre l’activation des canaux CRAC. Suite à la stimulation du TCR, Stim 1 et Orai 1 vont être recrutés au niveau de la synapse immunologique et induire une augmentation du flux calcique au point de contact entre le lymphocyte T et la cellule présentatrice d’antigène (33).
2.1.3 Les autres canaux calciques
2.1. 3.1 les canaux calciques intracellulaires
Les canaux calciques intracellulaires incluent les trois isoformes des récepteurs à l’IP3 et les trois récepteurs à la ryanodine. L’augmentation de calcium dans le cytoplasme dépend de la fixation de l’IP3 sur son récepteur et de son activité coordonnée avec les récepteurs à la ryanodine.
L’augmentation de la concentration de calcium cytoplasmique globale nécessaire à l’activation des lymphocytes T est précédée de signaux calciques localisés dans le cytoplasme près de la membrane. L’analyse de ces signaux calciques subcellulaires dans les cellules Jurkat et des lymphocytes humains du sang périphérique montre, en effet la présence de signaux calciques près de la membrane qui sont indépendants du calcium extracellulaire. Ces signaux sont dûs à un relargage de calcium par les récepteurs à l’IP3 et à la ryanodine (34). La fixation de l’IP3 sur son récepteur, à la surface du réticulum endoplasmique, va permettre les premiers relargages de calcium intracellulaire, après stimulation du TCR. La production d’IP3, nécessite l’interaction de la coronine avec la phospholipase Cγ (35). L’activation du
récepteur à l’IP3 de type 1 majoritaire dans les lymphocytes T nécessite sa phosphorylation sur la tyrosine 353. Cette phosphorylation est dépendante de p59fyn et de LAT. Le récepteur à l’IP3 de type 1 va se lier à LAT, après phosphorylation de LAT par Zap70. Ce rapprochement de LAT conduit à la co-localisation avec le TCR pendant l’activation, ce qui va permettre une phosphorylation stable. Ceci va rendre le canal plus sensible à l’IP3 et moins sensible à son inhibition dépendante de l’augmentation de concentration de calcium (36) (37).
Les récepteurs à la ryanodine sont des canaux calciques situés à la membrane du réticulum endoplasmique. Ces canaux jouent un rôle important dans la régulation de la dynamique du calcium intracellulaire. Ces canaux sont activés par la phosphorylation sur tyrosine par p59fyn après stimulation du TCR (38), ce qui permet la liaison de l’ADP-ribose cyclique. La production de ADP- ribose cyclique augmente moins vite que l’IP3, ce qui explique l’effet décalé des deux récepteurs. La stimulation du complexe TCR/CD3 dans des lignées de lymphocytes T humain Jurkat ou des lymphocytes T humains du sang périphérique montre des signaux pacemakers de calcium dans une zone ciblée du cytoplasme. Ces signaux calciques sont indépendants de la présence de calcium dans le milieu extracellulaire et sont composés du relargage de calcium des récepteurs à l’IP3 et à la ryanodine (34).
L’inhibition des récepteurs à l’IP3 et/ou des récepteurs à la ryanodine diminue l’augmentation de calcium après stimulation du TCR, la prolifération et la production d’IL2 dans des cellules Jurkat (39).
Le NAADP (Nicotinic Acid Adenine Dinucleotide Phosphate), synthétisé à partir de NADP par l’ADP-ribosyl cyclase, est essentiel pour la signalisation calcique suite à la stimulation du TCR. Le NAADP permettrait la sensibilisation des récepteurs à l’IP3 et à la ryanodine. L’inhibition de NAADP empêche totalement la signalisation induite par le complexe TCR/CD3 (40). Pendant longtemps la cible du NAADP était sujet à controverse deux hypothèses se dégageaient : la cible subcellulaire du NAADP était dans des organelles
comme les lysosomes (41) ou le réticulum endoplasmique. Récemment Steen M. et al ont montré que la cible du NAADP se situait dans le réticulum endoplasmique en excluant totalement la place du lysosome dans cette signalisation (42). Des études montrent que l’inhibition des récepteurs à la ryanodine, soit par inhibition pharmacologique ou par transfection d’un plasmide codant pour un antisens, abolit complètement la signalisation induite par le NAADP (43). Avec les mêmes techniques il a été montré que le récepteur à la ryanodine de type 3 est la cible du NAADP dans des clones de lymphocytes T (44).
2.1.3.2 Rôle des canaux TRP dans la régulation calcique dans les lymphocytes T
Il existe trois familles de canaux TRP : Les TRPC (canonical transient receptor potential) qui fonctionnerait comme homo ou heterotétramères; les TRPM (melastatin related TRP) et TRPV (vanilloïd receptor related TRP). Les TRPV5 et TRPV6 sont les canaux les plus sélectifs au calcium dans la famille des TRP (45).
De nombreuses études sur la régulation des TRPC montrent des résultats différents. Selon les études les canaux TRPC sont régulés soit par la PLC via le diacylglycérol soit par la déplétion des stocks intracellulaire de calcium (46). Cette deuxième caractéristique a fait que pendant longtemps les canaux TRP ont été décrits comme faisant partie des CRAC. Le canal le plus étudié est le TRPC3. La génération de différents mutants de lymphocytes Jurkat a permis la caratérisation de lymphocytes T Jurkat ayant un défaut pour le courant calcique via les CRAC (47). Ces cellules ont été utilisées dans une autre étude, qui a conclu qu’une mutation de TRPC3 serait responsable de ce défaut (48). En effet, lorsque ces cellules sont transfectées avec une forme sauvage de TRPC3, la signalisation calcique induite par le TCR est restaurée.
Bien que le rôle des canaux TRP comme canal activés par la déplétion des stocks soit tombé dans l’oubli suite à la découverte des protéines Orai et Stim, il est tout à fait possible
que ces canaux participent activement au contrôle de la régulation calcique dans les lymphocytes T au repos et stimulés.
TRPC3 possède un site de fixation au complexe Ca2+/calmoduline et le complexe est fixé dans les conditions de repos. Le récepteur à l’IP3 de type 3 (IP3R3) est capable de se fixer à TRPC3 et activer celui-ci. Les sites de fixation du complexe Ca2+/Calmoduline et celui de du récepteur à l’IP3 de type 3 sont les mêmes. De façon intéressante il a été montré que lors de l’activation de TRPC3 le récepteur à l’IP3 de type 3 va se fixer sur TRPC3, enpêchant la fixation du complexe Ca2+/Calmoduline et permettre ainsi l’activation de TRPC3 (49).
TRPM4 a été décrit comme important dans la signalisation des lymphocytes T. L’inhibition moléculaire de TRPM4 endogène dans les lymphocytes T conduit à une augmentation soutenue du calcium à la place des oscillations. TRPM4 agirait en concert avec les canaux CRAC, Kv1.3 et IKca pour contrôler les oscillations de calcium dans les lymphocytes. TRPM4 permettrait, dans les cellules non excitables, de maintenir une force électromotrice réduite afin de permettre l’entrée de calcium par les canaux CRAC (50).
TRPV6 a été décrit comme pouvant être inactivé par l’augmentation de la concentration de calcium cytoplasmique. Le flux calcique de TRPV6 active la PLC ce qui résulte dans la formation de IP3 et l’inactivation de TRPV6. TRPV6 agirait comme un senseur au calcium quand la concentration de calcium est faible le canal sera ouvert et permet une entrée de calcium, le canal va se fermer lorsque la concentration est élevée de façon à limiter l’entrée de calcium (51).
2.2 La signature calcique est-elle spécifique de lignage T ?
Les lymphocytes CD4+ se différencient en lymphocytes Th1, Th2 et récemment il a été montré qu’une troisième population, les Th17 existe, comme décrit précédemment. Ces trois sous-populations diffèrent dans leur fonction et leur profil cytokinique.
La différence de signalisation calcique entre les lymphocytes Th1 et Th2 a été bien étudiée. Au repos la concentration calcique est plus élévée dans les lymphocytes Th2 que dans les lymphocytes Th1. L’augmentation de la concentration intracytoplasmique de calcium suite à la déplétion des stocks est plus faible dans les lymphocytes Th2 que dans les lymphocytes Th1, mais la mesure des courants des canaux CRAC et des courants des canaux potassiques ne montre pas de différence entre les deux types cellulaires. La différence est observée lors de la clairance du calcium du cytosol et la mesure des courants potassiques dépendant du calcium (KCA). En effet, Les lymphocytes Th2 ont des courants KCA plus faibles mais une clairance du calcium du cytosl plus rapide que les lymphocytes Th1. Ceci explique une augmentation de la concentration calcique plus faible dans les lymphocytes Th2 (52). Weber et al viennent de montrer que les lymphocytes Th17 ont également une signature calcique propre. En effet les lymphocytes Th17 murins ont une concentration de calcium plus élevée que les lymphocytes Th2 et inférieure à celle dans les lymphocytes Th1, lorsque les lymphocytes sont activés par des cellules présentatricesd’antigène chargées avec un peptide spécifique (53). On observe des oscillations similaires à celles trouvées dans les lymphocytes Th2. Cette différence de signalisation calcique entraine aussi une différence de localisation de NFAT dans le noyau,qui est plus importante dans les lymphocytes Th17 par rapport aux lymphocytes Th2 et similaire à celle observée dans les lymphocytes Th1. Cette étude montre donc que la signature calcique est un paramètre entrainant une différence de fonction entre les différentes sous-populations de lymphocytes TCD4+ (54).
Figure 4 : Les différentes voies de signalisation calcique induite par la stimulation du TCR dans les lymphocytes T. Suite à la stimulation du TCR par le complexe CMH/peptide, des protéines kinases à proximité du TCR vont activer la PLCγ1. La PLCγ1 va cliver le phosphatidylinositol (4,5)-biphosphate (PiP2) ceci va permettre la génération d’Ins(1,4,5)P3 (IP3) et de diacylglycérol (DAG). L’IP3 va induire la libération de calcium via le récepteur à l’ IP3 (IP3R) à la membrane du réticulum endoplasmique (RE). La stimulation du TCR permet aussi l’induction de cADPR, qui se fixe aux canaux calciques récepteurs à la ryanodine et permet leur ouverture, conduisant à un relargage de calcium. Le relargage de calcium du RE induit une augmentation de la concentration cytosolique de calcium, soutenue, qui permet l’activation des CRAC à la membrane plasmique. D’après plusieurs études il semblerait que l’activation du TCR va aussi permettre l’ouverture de canaux Cav1, qui pourrait être régulés par la phosphorylation d’une protéine kinase C. L’augmentation de calcium
intracellulaire va permettre l’activation de la phosphatase calcineurine qui va déphosphoryler NFATc. NFAT déphosphorylé va pouvoir être transloqué au noyau afin de réguler la transcription de nombreux gènes. La régulation de la transcription se fait en associant avec AP-1. (55)
3 - Les Récepteurs aux dihydropyridines
Les canaux calciques voltage dépendant de type 1 (Cav1) sont caractérisés comme
étant des récepteurs aux dihydropyridines (RDHP). Ces canaux sont des complexes multi protéiques constitués d’une sous unité alpha1 qui forme le pore d’entrée du calcium et de 3 sous unités auxiliaires α2δ, β et γ qui modulent l’activité et le transport de la sous unité αà la membrane.
La sous unité alpha 1 est codée par quatre gènes qui confèrent la spécificité d’expression tissulaire. On trouve Cav1.1 dans le muscle strié (56), Cav1.2 dans les neurones, cœur et muscles lisses, Cav1.3 dans le système neuroendocrine et Cav1.4 dans la rétine. La structure primaire de alpha 1 est constituée de quatre éléments répétés et chaque élément est constitué de six segments transmembranaires (S1 à S6). Le segment S4 possède des acides aminés chargés positivement qui constituent les senseurs au voltage.
Ces canaux sont des canaux activables par une forte dépolarisation de la membrane, ils ont été premièrement décrits dans les cellules excitables. Mais on verra par la suite que ces canaux peuvent aussi être exprimés par des cellules non excitables dans lesquelles ils ne sont pas activés par le voltage.
3.1. Les RDHP dans les cellules excitables
3.1.1 Sructure
Ces canaux calciques sont activés par la dépolarisation de la membrane , ils permettent la génération d’un flux calcique entrant en réponse au potentiel d’action. Le calcium entrant dans la cellule est considéré comme un second messager permettant l’initiation de plusieurs évènements cellulaires.
Ces canaux calciques récepteurs aux dihydropyridines sont définis comme des canaux calciques dépendant du voltage de type 1 (Cav1). Il existe 4 isoformes de Cav1. Cav1.1 présent
dans le muscle squelettique est nécessaire pour la contraction, l’homéostasie calcique ainsi que pour la régulation de l’expression génique. Cav1.2 exprimé dans le muscle cardiaque, des
cellules endocrines et les neurones a comme fonction la contraction, la sécretion hormonale et la régulation de l’expression génique, respectivement. Cav1. 3 dans les cellules endocrines et
les neurones permet la sécrétion hormonale et la régulation des génes. Enfin Cav1.4 exprimé
dans la rétine permet le relargage de neurotransmetteurs. (57).
Le canal calcique est caractérisé par la nécessité d’une forte dépolarisation de la membrane pour son activation, une large conductance, une inactivation lente dépendante du voltage, la régulation par phosphorylation dont celle dépendante de la PKA et une inhibition spécifique par des antagonistes du signal calcique tels que les dihydropyridines, les phénylalkylamines et les benzothiazépines.
La fonction et l’adressage à la membrane de la sous-unité alpha 1 sont régulés par la présence de 3 sous-unités auxiliaires qui interagissent directement avec α1 par une association stable, ont une capacité à moduler les propriétés biophysiques et/ou l’adressage à la membrane de la sous-unité alpha1 ; α-2 δ, βet γ :
- α-2-δ: il existe 4 sous-unités génétiquement distinctes alpha-delta 1 à α-2-δ 4 qui sont exprimées différemment selon les tissus. α2 δ1 est l’association la plus répandue. La sous unité α2δ est le produit d’un seul gène qui subit un clivage post-translationnel en deux peptides α2 et δ qui sont ensuite liés par un pont disulfide. α2 est entièrement extracellulaire alors que delta a une portion transmembranaire et une partie intracellulaire qui permet l’ancrage de la protéine à la membrane. α2 est la partie qui interagit avec la sous unité α1 et cette interaction est extracellulaire. L’association d’α2δ à la sous unité α 1 permet l’augmentation de l’adressage de la sous unité α1 à la membrane.
- β : Les sous unités beta sont codées par 4 gènes, de β1 à β 4. La sous-unité beta est la seule sous unité du canal qui est entièrement cytosolique. Le domaine BID ( Beta Interaction Domain) interagit avec le domaine AID (Alpha Interaction Domain) de la sous-unité alpha1. Cette sous unité est importante pour l’adressage de la sous unité α1 à la membrane ainsi que pour les propriétés biophysiques du canal.
- γ : L’expression des différentes sous-unités γ (γ 1 à γ8) montre une large distribution tissulaire. La présence de la sous unité γ, n’affecte pas le nombre de canaux présents à la membrane. (58).
3.1.2 Régulations par phosphorylation
Ces canaux calciques sensibles aux dihydropyridines possèdent des sites de régulation par des kinases.
La régulation des canaux Cav1 par la protéine kinase A (PKA) est une des caractéristiques de
ces canaux. La spécificité de la phosphorylation des canaux Cav1 par la PKA nécéssite la
présence des AKAPs (A kinase-anchoring proteins) (59). Les AKAPs vont lier les substrats de la PKA et ainsi réguler leur phosphorylation. Une étude montre qu’AKAP15 coimmunoprécipite avec Cav1.2 purifié à partir d’extraits membranaires de cœur de rat ou de
cellules transfectées. AKAP15 colocalise avec PKA et Cav1.2 dans les tubules transverses
des myocytes ventriculaires. Une étude par mutagénèse drigée montre qu’AKAP15 interagit directement avec la partie c-terminale de Cav1.2. L’inhibition de la fixation de PKA à Cav1.2
via AKAP15 avec des peptides compétiteurs diminue la régulation beta-adrénergique par la voie PKA dans les myocytes ventriculaires. (60).
Les protéines kinases C (PKC) alpha, beta et gamma peuvent se lier de façon directe avec Cav1.2 et phosphoryler des régions différentes selon la PKC impliquée.Ceci laisse penser que
ont montré que dans des cellules musculaires lisses artériolaires il existait des canaux Cav1.2
constitutivement actifs car liés à une PKC. Dans ces conditions, ces canaux ont une forte probabilité d’ouverture, même au potentiel de repos de la cellule. Ce groupe a utilisé la technique de TIRFM (Total internal reflexion microscopy) qui permet d’observer des mouvements de calcium très proche de la membrane (62).
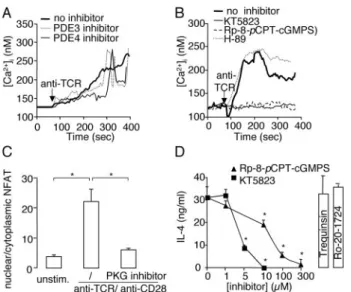
Une autre kinase, la Protéine kinase G peut aussi phosphoryler Cav1.2. Dans des cellules HEK
transfectées avec les sous-unités alpha1c et beta2a, l’activation de la PKG abolit le courant par Cav1.2. La modification du site de phosphorylation de la PKG diminue l’inhibition de
Cav1.2 par la PKG (61).
3-2 Les RDHP dans les cellules non excitables
3.2.1 Les cellules non immunitaires
Cav1.2 est exprimé dans les cellules β-pancréatiques et est important pour l’exocytose
de l’insuline. Le glucose en enrant dans les cellules β-pancréatique est métabolisé générant de l’ATP qui cause la fermeture de canaux potassiques dépendant de l’ATP d’où une dépolarisation de la membrane et l’activation de canaux calciques Cav1.2 et Cav1.3.
Initialement le rôle de canaux Cav1.3 dans la libération de l’insuline a été souligné
particulièrement parce que ces canaux s’activent à des potentiels plus négatifs que les canaux Cav1.2 (63). Néanmoins les souris déficientes pour Cav1.2 présentent une intolérance au
glucose (64) et il a été suggéré que 50% de la régulation du calcium dans les cellules b-pancréatiques revient aux canaux Cav1.2.
La présence de canaux Cav1 a également été décrite dans les cellules épithéliales
une inhibition partielle de la concentration calcique. De plus Cav1.2 est associé à la sous-unité
β3. L’inhibition de β3 par des oligonucléotides antisens empêche l’augmentation de la concentration calcique (65)
Dans les cellules épithéliales rétiniennes les canaux Cav1 peuvent être stimulés par
dépolarisation dans des expériences de patch clamp. Par contre, l’épithélium ne se dépolarise pas dans les conditions physiologiques et les canaux semblent être régulés par phosphorylation vraisemblablement par une PKC (66) ; (67).
3.2.2 Les cellules du système immunitaire
• Les cellules dendritiques
Poggi et al ont montré que les cellules dendritiques humaines expriment des canaux Cav1
récepteurs aux dihydropyridines. L’augmentation de concentration du calcium intracellulaire est nécessaire à l’endocytose et à la production d’IL-12 essentielles à la fonction des cellules dendritiques. Cette augmentation de concentration de calcium est due en partie à la présence des canaux calciques sensibles aux dihydropyridines. L’endocytose des corps apoptotiques ,ainsi que la production d’IL-12, sont inhibées par des antagonistes de ces canaux. L’utilisation d’une dihydropyridine fluorescente montre sa fixation à la membrane des cellules dendritiques, de plus la sous unité bêta 1 est présente dans des lysats de cellules dendritiques. Dans cette étude il a aussi été montré que le canal Cav1 détecté dans les cellules
dendritiques est indépendant du voltage (68).
• Les cellules natural killer (cellules NK)
Les canaux calciques récepteurs aux dihydropyridines présents dans les cellules NK sont importants pour leur cytotoxicité. En effet, l’utilisation d’antagonistes des récepteurs aux
dihydropyridines empêche le relargage des sérines estérases, responsables de la cytotoxicité, par les cellules NK. Mais, l’inhibition des canaux n’a aucun effet sur la fixation des cellules NK à leur cible. Dans cette étude, les auteurs montrent un rôle de la protéine Tat de HIV dans l’inhibition des canaux calciques récepteurs aux dihydropyridines. Ceci pourrait expliquer l’inhibition de la réponse immunitaire au cours de l’infection par HIV, puisque d’autres cellules du système immunitaire, comme les cellules dendritiques, les lymphoytes T et B, expriment ce canaux. (69).
• Les lymphocytes B
Une analyse des lymphocytes B de rat a montré la présence de canaux calciques ayant les mêmes caractéristiques pharmacologiques et sérologiques que les canaux calciques trouvés dans les cellules excitables. Ils sont sensibles aux dihydropyridines, sont reconnus par un anticorps spécifique de la sous unité alpha1 des canaux Cav1.3, mais sont insensibles à une
dépolarisation de la membrane. La régulation de ce canal met en jeu le GMPcyclique. Dans cette étude l’anticorps anti-α1 utilisé n’a pas permis de mettre en évidence le canal dans les lymphocytes T (70). Les auteurs proposent que le canal dans les lymphocytes B est dans état « préactivé » comme celui présent dans les neurones soumis à une dépolarisation membranaire.
Une autre équipe suggère l’éxistence de formes tronquées de canaux L à la surface des lymphocytes B. La liaison du récepteur des lymphocytes B (BCR), d’une lignée de lymphome B, induit une augmentation de concentration de calcium qui est abolie par un antagoniste des canaux calciques sensibles aux dihydropyridines. Les résultats d’une analyse de Western blotting de Cav1.2 réalisés avec des anticorps ant-Cav1.2 montrent une bande à 210 Kda et une
bande à 82 Kda pour des lysats de cœurs de rat. Par contre la taille des bandes est différente quand les lysats proviennent des cellules B (119, 112 et 82 Kda). Les lymphocytes B
expriment également la sous-unité beta 1 (observée par western blot et obtenue à la taille attendue), ce qui laisse penser à une localisation membranaire du canal. Ceci a été confirmé par un marquage de la partie extracellulaire de Cav1.2 qui montre effectivement un marquage
membranaire (71).
• Les lymphocytes T
La première étude suggérant un rôle des récepteurs aux dihydropyridines dans les lymphocytes T a montré que l’utilisation de plusieurs antagonistes de ces canaux (verapamil, diltiazem et nifedipine) étaient des puissants suppresseurs de la prolifération des lymphocytes T humains (72). Ce résultat a été la base pour le début de la recherche de la présence et la fonction de tels canaux dans les lymphocytes T.
Plusieurs arguments expérimentaux indiquent que des canaux apparentés aux canaux Cav1 exprimés dans les cellules excitables sont exprimés par les lymphocytes T humains et murins. D’après plusieurs études les canaux exprimés par les lymphocytes ne nécessiteraient pas la dépolarisation de la membrane pour leur activation. Toutefois, le type de régulation n’est toujours pas connu.
Des études sur les cellules Jurkat et dans des cultures primaires de lymphocytes T humains ont montré qu’un agoniste de ces canaux, le BayK 8644 augmente la concentration de calcium intracellulaire de façon dose dépendante. Cet effet n’est pas observé en présence d’un antagoniste, la nifedipine (73). L’administration de 10 mg de nifedipine à des patients sains induit une diminution de la prolifération des lymphocytes T purifiées du sang périphérique 30 min après le traitement, que les cellules soient stimulées en présence de cellules présentatrices d’antigène ou par une activation anti-CD3/anti-CD28. Cette diminution de la prolifération est associée à la diminution de production d’IL-2. L’ajout d’IL-2 dans la culture restaure les fonctions des lymphocytes T. Il est à noter que 4 heures après le traitement
on n’observe plus aucun effet sur les lymphocytes T (74). Kotturi et al ont observé ces mêmes résultats avec des lymphocytes T humains purifiés à partir du sang et avec des cellules Jurkat. Ces molécules modulent l’influx calcique mais également les évènements précoces et tardifs dépendant du calcium comme l’activité du facteur de transcription NFAT et la sécrétion d’IL-2. De plus, chez des souris traitées avec la nifedipine une diminution de la prolifération des lymphocytes T in vivo a été observée (75).
L’effet observé des dérivés de dihydropyridines est dû à la présence de canaux de type Cav1, récepteur aux dihydropyridines dans les lymphocytes T. En effet plusieurs équipes ont
observé l’expression de ces canaux par RT-PCR. Ces résultats ne sont pas homogènes : Kotturi et al ont observé l’expression de Cav1.4 dans les lymphocytes T CD4+ et CD8+
humains (75), Stokes et al les formes Cav1.2 et Cav1.3 dans les lymphocytes T humains (76),
l’équipe de JP Kinet Cav1.1 et Cav1.3 dans les lymphocytes T humains et les Jurkat (JP Kinet
Brevet). Les cellules murines montrent aussi des différences de résultats selon les équipes : L’expression de canaux Cav1.2 et Cav1.3 a été observée dans des hybridomes T producteurs
de IL-4 et dans des lymphocytes Th2 (77) (et ésultats non montrés), l’équipe de Flavell RA montre l’expression des formes Cav1.1, Cav1.2 et Cav1.4( cf. discussion).
La régulation de ces canaux dans les lymphocytes T n’a pas encore été élucidée, mais plusieurs études y ont été consacrées.
Badou et al ont montré que l’expression d’IL-4 induite par HgCl2 dans un hybridome T (1H11.3) nécessite l’activation d’une voie dépendante de la PKC et met en jeu les canaux calciques sensibles aux dihydropyridines (78). L’expression de canaux Cav1 a été observée
par RT-PCR à l’aide de primers consensuels pour tous les types de sous-unités alpha 1 des canaux Cav1. Des produits de PCR de la taille attendue ont été obtenus à partir de cDNA
d’hybridomes T et leur séquences correspondait à Cav12 et Cav1.3. L’activation des 2G12.1
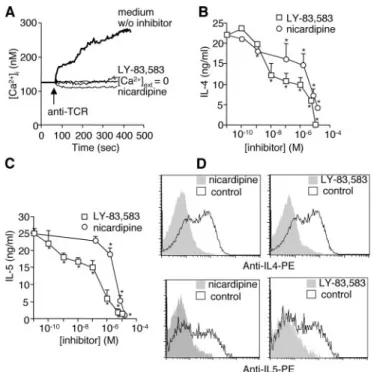
être abolie par le traitemant des cellules à l’aide d’un antagoniste du récepteur des dihydropyridines (77). Suite à cette étude montrant le rôle des canaux Cav1 dans l’expression du gène de l’Il-4, il a été montré que l’expression de ces canaux était spécifique aux lymphocytes Th2 murins, producteurs d’IL-4, et absente des lymphocytes Th1, producteurs d’IFNγ. Cette étude montre que l’activation des canaux Cav1 suite à la stimulation du TCR
peut être abolie par l’ajout d’antagoniste des canaux. Ceci n’est observé que chez les lymphocytes Th2. Le traitement in vivo de rats permet l’inhibition d’une réponse Th2. Cette étude décrit une nouvelle voie spécifique aux lymphocytes Th2 qui pourrait être une cible thérapeutique dans des pathologies Th2 (79). Toutes ce études montrent un rôle important des canaux calciques sensibles aux dihydropyridines dans la signalisation des lymphocytes T, mettant en jeu une PKC pour leur régulation.
La présence des sous unités bêta semble aussi être importante pour la fonction des canaux dans les lymphocytes T CD4+ murins. La réponse calcique induite par la stimulation du TCR est très diminuée dans des lymphocytes T de souris invalidées pour les gènes codant les sous-unités beta4 et beta3 (80). Y sont associés un défaut de translocation de NFAT et une inhibition de la sécrétion de cytokines. Pourtant, les lymphocytes T de ces souris KO prolifèrent normalement. Dans cette étude la taille des bandes de RT-PCR et Western blot obtenues n’est pas indiquée. Il faut noter que l’activation du canal ne nécessite pas de dépolarisation de la membrane contrairement à la régulation trouvée dans les cellules excitables (80).
Le même groupe a récemment montré que l’activation des fonctions des lymphocytes TCD4+ mettait en jeu une protéine géante de la famille des AHNAK. Dune étude dans les cardiomyocytes montre que la protéine AHNAK1 s’associe à la sous-unité beta de Cav1 et serait impliquée dans la régulation du canal Cav1 (81) . Matza et al ont mis en évidence que
Cav1. Des souris déficientes pour AHNAK1 ont une réponse immune déficiente et les lymphocytes T CD4+ présentent un défaut d’activation de la voie calcique (82).
4 . La PKG : Rôle dans le système immunitaire
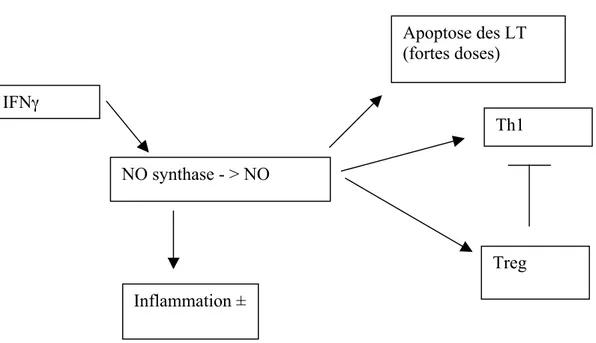
4.1. Rôle du NO dans la réponse immunitaire
Le NO qui a été identifié initialement comme l'"endothelium derived relaxing factor" (EDRF) agit comme un messager inter et intracellulaire. Il joue un rôle important dans le système cardio-vasculaire, dans le fonctionnement neuronal (contrôle de l'équilibre prolifération/survie/différenciation, activité synaptique …), et dans les processus inflammatoires. Dans de multiples types cellulaires le NO a une action anti-proliférative.
Les deux modes d'action documentés du NO sont les modifications post-traductionnelles de protéines par nitration ou S-nitrosylation et l'activation de guanylates cyclases qui vont générer du GMPc. Le NO augmente la concentration de GMPc en activant des guanylate cyclases solubles (sGC) (83). Le GMPc peut aussi être généré par des guanylate cyclases membranaires (GC-A, GC-B et GC-C). Les GC-A et GC-B sont activés par les peptides natriurétiques relargués par le système cardiovasculaire tandis que GC-C est activé par la guanyline, un peptide intestinal impliqué dans la régulation des fluides intestinaux. Le GMPc est connu pour réguler positivement ou négativement des phosphodiestérases, ce qui module les concentrations d'AMPc et donc les voies de signalisation dépendant de ce nucléotide, y compris la voie de la PKA. Le GMPc peut activer des canaux cationiques (CNG pour "cGMP nucleotide gated channel"). Bien que plus perméables pour les cations monovalents, ils peuvent laisser passer des cations divalents comme le Ca2+ et le Mg2+. Ils