Effets de médicaments gonadiques pour la neuroprotection
du cerveau chez un modèle animal de la maladie de
Parkinson
Thèse
Ahmed Nadhir Litim
Doctorat en sciences pharmaceutiques
Effets de médicaments gonadiques pour la neuroprotection
du cerveau chez un modèle animal de la maladie de
Parkinson
Thèse
Ahmed Nadhir Litim
Sous la direction de :
Résumé
La maladie de Parkinson (MP) est le trouble neurodégénératif de la fonction motrice le plus fréquent qui est susceptible d'augmenter en raison du vieillissement de la population. Il n'existe pas de remède pour cette maladie et aucun médicament modifiant la progression de la maladie n’est disponible. Une incidence plus élevée de la MP est observée chez les hommes suggérant un possible effet neuroprotecteur des stéroïdes sexuels féminins. Dans des modèles animaux de la MP, des effets protecteurs bénéfiques des estrogènes et de la progestérone, ont été rapportés tandis que les stéroïdes gonadiques androgènes ont montré peu ou pas d’activité neuroprotectrice. Nous avons donc exploré l'activité neuroprotectrice des médicaments agissant sur la synthèse des stéroïdes. Le dutasteride et le finasteride sont des inhibiteurs de l'enzyme 5α-réductase utilisés chez l'homme pour traiter divers troubles endocriniens. Dans le modèle murin de la MP lésé au 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP), nous avons démontré que le dutasteride, mais pas le finasteride, présente une activité de neuroprotection de marqueurs associés à la neurotransmission de la dopamine (DA) du cerveau. Les mécanismes d'action des effets neuroprotecteurs de dutasteride ont été étudiés chez les souris intactes et lésées au MPTP. L'analyse du comportement moteur de ces souris a montré que les traitements avec le MPTP et MPTP + dutasteride n'ont pas affecté la fonction motrice comme prévu à l'aide d'une faible dose de MPTP induisant une lésion modérée modélisant les stades précoces de la maladie. Nos résultats suggèrent que le dutasteride présente des effets neuroprotecteurs sur les neurones dopaminergiques et des propriétés anti-inflammatoires au niveau du cerveau. Ces résultats proposent le dutasteride comme médicament thérapeutique prometteur pour la neuroprotection dans un contexte de MP durant les premiers
les souris mâles via notamment l’atténuation de la neuroinflammation et l’induction du BDNF.
Ces données mettent en évidence la nécessité de développer des thérapies modifiant la maladie mais aussi de fournir des traitements personnalisés selon le sexe. Ainsi, les options de traitement spécifiques à chaque sexe peuvent être imaginées telles que l'utilisation du dutasteride chez les hommes et des thérapies à base de médicaments comme la progestérone pour les deux sexes. Cependant, des études supplémentaires sont nécessaires pour optimiser ces thérapies afin d’obtenir des traitements sûrs personnalisés selon le sexe et qui permettrait de retarder, prévenir ou traiter la maladie.
Abstract
Parkinson’s disease (PD) is the most common neurodegenerative movement disorder and is likely to increase due to the aging population. There is no cure for PD and no disease-modifying drug available. A higher incidence of this disease is observed in men suggesting a possible neuroprotective effect of female sex steroids. In animal models of PD, beneficial protective effects of estrogen and progesterone have been reported while the androgenic gonadal steroids showed little or no neuroprotective activity. We explored the neuroprotective activity of drugs acting on the synthesis of steroids. Dutasteride and finasteride are inhibitors of 5α-reductase enzyme used in humans to treat various endocrine disorders. In the mouse model of PD injured with 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP), we found that dutasteride but not finasteride exhibits neuroprotective activity on dopamine (DA) neurotransmission of the brain. The mechanisms implicated in the neuroprotective effects of dutasteride have been further studied in intact and MPTP-lesioned mice. The analysis of motor behavior of these mice showed that treatment with MPTP, MPTP + dutasteride did not affect the motor behavior as expected with a low dose of MPTP to induce moderate injury modeling early stages of the disease. Our results suggest that dutasteride has neuroprotective effects on dopaminergic neurons and anti-inflammatory properties in the brain. These results suggest dutasteride as promising therapeutic drug for PD neuroprotection in the early stages of the disease.
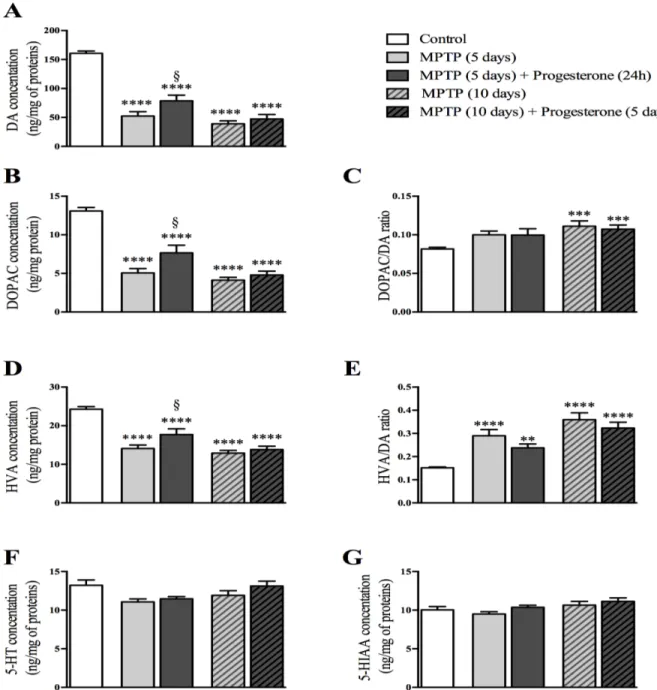
We have previously reported neuroprotection by progesterone on striatal DA in MPTP mice when administered before or 1 hour after the toxin. The results presented here suggest that progesterone can promote recovery of dopaminergic neurons when administered at an early stage (24h) but not at a late stage (5 days)
needed to optimize these therapies to get safer personalized treatments that would delay, prevent or treat PD.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des figures ... x
Liste des abréviations ... xii
Remerciements ... xiv
Avant-propos ... xv
Introduction ... 1
Chapitre 1: La transmission dopaminergique ... 1
1.1. Dopamine: Biosynthèse et métabolisme ... 1
1.2. Transport de la dopamine ... 2
1.3. Organisation fonctionnelle des ganglions de la base ... 5
1.4. Contrôle des mouvements moteurs volontaires ... 6
Chapitre 2 : La maladie de Parkinson ... 8
2.1. La maladie de Parkinson et son étiologie ... 8
2.1.1. Facteurs génétiques ... 9
2.1.2. Facteurs environnementaux ou non génétiques ... 10
2.2. Pathophysiologie de la maladie de Parkinson ... 11
2.2.1. Transmission dopaminergique ... 11
2.2.2. Transmission glutamatergique ... 12
2.2.3 Autres neurotransmetteurs impliqués ... 13
Chapitre 3 : Modèles animaux du Parkinson ... 15
3.1 Modèles génétiques ... 15
3.2. Modèles induits par des toxines ... 16
3.2.1. 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP) ... 16
3.2.2. Le modèle 6-Hydroxydopamine (6-OHDA) ... 18
3.2.3. Les modèles induits par des toxines environnementales ... 18
Chapitre 4 : Les traitements de la maladie de Parkinson ... 20
4.1. Traitements médicamenteux ... 20
4.2. Autres traitements ... 21
Chapitre 5 : Les stéroïdes neuroactifs et la MP ... 23
5.1. Les facteurs liés au sexe et les différences entre les sexes dans la MP ... 23
5.2. Stéroïdes neuroactifs dans la MP ... 24
5.3. L’enzyme 5α-réductase : Un candidat potentiel pour une thérapie multi-cible .... 28
7.2.3. Preparation of brain tissue and assay of biogenic amines concentrations in
brain tissue ... 42
7.2.4. DAT and VMAT2 autoradiography ... 42
7.2.5. Western blots ... 43
7.2.6. Statistical analysis ... 44
7.3. Results ... 44
7.3.1. Biogenic amines assay ... 44
7.3.2 Autoradiography of DAT and VMAT2 ... 44
7.3.3. Western blots ... 45 7.4. Discussion ... 46 6.5. Conclusion ... 51 Acknowledgements ... 51 References ... 52 Figure Captions ... 57
Chapitre 8: The 5α-reductase inhibitor Dutasteride but not Finasteride protects dopamine neurons in the MPTP mouse model of Parkinson's disease. ... 62
Résumé ... 63
Abstract ... 64
8.1. Introduction ... 65
8.2. Materials and Methods ... 67
8.2.1 Animals ... 67
8.2.2 Drugs administration ... 67
8.2.3 Preparation of brain tissue and assay of biogenic amines concentrations in brain tissue ... 68
8.2.4 DAT and VMAT2 autoradiography ... 68
8.2.5 In Situ hybridization of TH ... 69
8.2.6 Steroids assay ... 69
8.2.7 Statistical analysis ... 69
8.3. Results ... 70
8.3.1 Biogenic amines assay ... 70
8.3.2 Autoradiography of DAT and VMAT2 ... 71
8.3.3 In Situ hybridization of TH ... 71
8.3.4 Steroids plasma concentrations ... 71
8.4. Discussion ... 71
Acknowledgements ... 77
References ... 78
Figure Captions ... 83
Chapitre 9 : Effect of the 5α-reductase enzyme inhibitor dutasteride in the brain of intact and parkinsonian mice ... 89
Résumé ... 90
Abstract ... 91
9.1. Introduction ... 92
9.2. Materials and Methods ... 93
9.2.1. Animals ... 93
9.2.2. Pre-treatment experiment ... 94
9.2.3. Motor behavior experiment ... 94
9.2.5. Preparation of brain tissue and assay of biogenic amines contents in brain
tissue ... 95
9.2.6. DAT, VMAT2, D1 and D2 receptors autoradiography ... 95
9.2.7. Substantia nigra in situ hybridization of dopamine transporter (DAT) ... 96
9.2.8. Quantification of neuroactive steroids in plasma and brain ... 96
9.2.9. Western blots ... 97
9.2.10. Statistical analysis ... 98
9.3. Results ... 98
9.3.1. Motor behavior is not altered by a low dose MPTP regimen or by dutasteride98 9.3.2. Pre-treatment with dutasteride prevents striatal DA depletion ... 98
9.3.3. Pre-treatment with dutasteride prevents nigrostriatal DAT and VMAT2 loss 99 9.3.4. Pre-treatment with dutasteride affects nigrostriatal DAT expression and glycosylation ... 100
9.3.5. Pre-treatment with dutasteride leaves unchanged striatal D1 receptors and prevents D2 receptor loss ... 101
9.3.6. Effect of lesion and dutasteride treatment on steroid levels ... 101
9.3.7. Dutasteride neuroprotection reduced GFAP increases without effecting Akt/GSK3β and ERK1/2 ... 103
9.3.8. No effect of dutasteride administered after MPTP on striatal DA and metabolites contents ... 103 9.4. Discussion ... 103 9.5. Conclusion ... 109 Acknowledgements ... 109 References ... 110 Figures legends ... 119 Chapitre 10 : Discussion ... 131 Chapitre 11: Conclusion ... 144 11.2. Perspectives ... 145 Références ... 148 Annexe 1 : ... 169 Annexe 2 : ... 183
Liste des figures
Figure 1.1 Synthèse de la dopamine à partir de la L-DOPA au niveau des terminaisons nerveuses dopaminergiques. ... 2 Figure 1.2. Les modèles de fonctionnement des transporteurs DAT et VMAT2. ... 5 Figure 1.3. Les circuits moteurs des noyaux gris centraux dans des conditions
normales (Gauche) et le parkinsonisme (droit). ... 7 Figure 3.1. Représentation schématique du métabolisme du MPTP et les voies
intracellulaires affectées au sein des neurones dopaminergiques. ... 18 Figure 5.1. Schématisation des réactions enzymatiques intervenant dans la
stéroïdogénèse. ... 27 Figure 5.2. Schéma de la réaction catalysée par les 5α-réductases (5α-Rs). ... 30 Figure 5.3. Structure des dérivés 4-azastéroïdes finasteride (ProscarTM et
PropeciaTM) et dutasteride (AvodartTM et JalynTM)……… ... 32 Figure 7.1. The time-line of the experiment is showing administration of (A) vehicle
(saline), (B, C) 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP), and (D, E) MPTP + progesterone (8 mg/kg). ... 58 Figure 7.2. Effects of MPTP and progesterone treatments on striatal (A, E) dopamine (DA) contents and its metabolites ... 59 Figure 7.3. Effects of MPTP and progesterone treatments on (A,B) [125I]-RTI-121
dopamine (DA) transporter (DAT) and (C, D) [3H]-dihydrotetrabenazine (TBZ-OH)
vesicular monoamine transporter 2 (VMAT2) specific binding. ... 60 Figure 7.4. Correlation between (A) striatal [125I]-RTI-121 specific binding and striatal
dopamine (DA), (B) [3H]-TBZ-OH specific binding and striatal dopamine (DA) as
well as (C) correlations between DAT with VMAT2 specific binding in C57Bl/6 progesterone and saline-treated MPTP mice as well as in intact mice. ... 61 Figure 7.5. Effects of MPTP and progesterone treatments on striatal (A) pAkt/Akt, (B) pGSK3β/GSK3β, (C) BDNF, (D) pERK1/ERK1, (E) pERK2/ERK2 and (F) GFAP levels of male C57Bl/6 mice compared to intact mice. ... 62 Figure 8.1. Schematic experimental design for administration of MPTP, vehicle,
Finasteride (5 or 12.5 mg/kg) or Dutasteride (5 or 12.5 mg/kg) . ... 86 Figure 8.2. Effects of a chronic treatment with Finasteride and Dutasteride on striatal
dopamine (DA) concentrations and its metabolites ... 87 Figure 8.3. Effects of a chronic treatment with Finasteride and Dutasteride on [125
I]-RTI-121 dopamine (DA) transporter (DAT) and [3H]-dihydrotetrabenazine (TBZ-OH)
vesicular monoamine transporter 2 (VMAT2) specific binding ... 88 Figure 8.4. Correlation between striatal dopamine (DA) concentrations with striatal
[125I]-RTI-121 specific binding to dopamine transporter (DAT) and [3H]-TBZ-OH
specific binding to vesicular monoamine transporter (VMAT2). ... 89 Figure 8.5. Effects of a chronic treatment with Finasteride and Dutasteride on Tyrosine Hydroxylase mRNA levels in the SNpc ... 90 Figure 8.6. Effects of a chronic treatment with Finasteride and Dutasteride on plasma levels of testosterone and dihydrotestosterone ... 91 Figure 9.1. Schematic time line of experimental treatments ... 122 Figure 9.2. Behavioral effect of MPTP and dutasteride compared to striatal dopamine content. ... 123
Figure 9.3. Effect of MPTP and dutasteride on striatal dopamine and metabolites content ... 124 Figure 9.4. Effect of MPTP and dutasteride on striatal serotonin and metabolites co..125 Figure 9.5. Effect of MPTP and dutasteride on brain DAT and VMAT2 specific bind .. 126 Figure 9.6. Correlations of striatal DAT, VMAT2 specific binding with dopamine co ... 127 Figure 9.7. Effect of MPTP and dutasteride on brain DAT mRNA as well as glyco-DAT and non glyco-DAT levels ... 128 Figure 9.8. Effect of MPTP and dutasteride on striatal D1 and D2 specific binding .... 129 Figure 9.9. Effect of MPTP and dutasteride on plasma and brain androgens and
metabolites levels ... 130 Figure 9.10. Effect of MPTP and dutasteride on plasma and brain progesterone
precursor and metabolites levels ... 131 Figure 9.11. Effect of MPTP and dutasteride striatal GFAP levels levels ... 132 Figure 9.12. Effect of treatment with dutasteride post-MPTP lesion on striatal biogenic amines contents…..………133
Liste des abréviations 17β-E : 17β-œstradiol
17β-HSD : 17β-hydroxystéroïde déshydrogénase 3-MT : 3-méthoxytyramine
3α-diol : 5α-androstane-3α,17β-diol
3α-HSOR : 3α- hydroxystéroïde oxydoréductase 3β-diol : 5α-androstane-3β,17β-diol
3β-HSD : 3β-hydrostéroïde déshydrogénase 3β-HSOR : 3β-hydroxystéroïde oxydoréductase 5-HT : 5-hydroxytryptamine
5α-R : 5α-réductase
6-OHDA : 6-Hydroxydopamine
AMPA : Récepteur α-amino-3-hydroxy-5-méthylisoazol-4-propionate ARO : Aromatase
BDNF : Brain-derived neurotrophic factor COMT : Catéchol-O-méthyltransférase D1-5 : Récepteurs dopaminergiques 1-5 DA : Dopamine
DAT : Transporteur de la dopamine DBS : Deep Brain Stimulation DHEA : Déhydroépiandrostérone DHP : Dihydroprogestérone DHT : Dihydrotestostérone
DIL : Dyskinésies induites par la L-DOPA DOPAC : Acide dihydroxyphénylacétique FDA : Food and Drug Administration GABA : Acide γ-aminobutyrique GPe : Globus pallidus externe GPi : Globus pallidus interne
HBP : Hyperplasie bénigne de la prostate HVA : Acide homovanillique
iGluR : Récepteurs glutamatergiques ionotropiques L-DOPA : L-dihydroxyphénylalanine
LRRK2 : Leucine-riche repeat kinase 2 MAO-B : Monoamine oxydase de type B
mGluR : Récepteurs glutamatergiques métabotropiques MP : Maladie de Parkinson
MPP+ : 1-méthyl-4-phénylpyridinium
MPTP : 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine NAM : Modulateur allostérique négatif
NMDA : Récepteur N-méthyl-D-aspartate NST : Noyau sous-thalamique
P450scc : Enzyme de clivage de la chaîne latérale du cholestérol PAM : Modulateur allostérique positif
PR : Récepteurs classiques de progestérone PREG : Pregnenolone
PROG : Progestérone
ROS : Espèces réactives de l'oxygène SBAU : Symptômes du bas appareil urinaire SNC : Système nerveux central
SNpc : Substantia Nigra pars compacta SNr : Substantia Nigra pars reticulata SLC : Solute carrier
StAR : Steroidogenic acute regulatory protein T : Testostérone
TECR : Trans-2,3-enoyl-CoA réductase TH : Tyrosine hydroxylase
THP : Tétrahydroprogestérone TSPO : Translocase de 18 kDa
Remerciements
Je tiens à remercier avant tout ma directrice de recherche, la Dre Di Paolo pour sa grande disponibilité, son intérêt, son soutien et ses nombreux conseils durant le doctorat et la rédaction de ma thèse. Je lui suis reconnaissant de m’avoir accepté au sein de son équipe, de m’avoir fait bénéficier tout au long de ce travail de son expérience et de sa rigueur.
Ce travail n’aurait pas été possible sans le soutien de la Société Parkinson Canada qui m’a permis, grâce à son aide financière, de me consacrer sereinement à mes projets de doctorat.
Je remercie chaleureusement toutes les personnes qui m’ont aidé pendant mon doctorat notamment Sara Al Sweidi et Mélanie Bourque qui n’ont pas hésité à me consacrer du temps et faire preuve de pédagogie pour me former et à répondre à mes questions. J’ai été très heureux d’avoir travaillé avec vous.
Je tiens à remercier Marc Morissette pour sa grande disponibilité, sa bonne humeur et ses maints conseils précieux qui m’ont permis de progresser durant les moments difficiles. J’ai été extrêmement touché par ses qualités humaines d’écoute et de compassion. Ce fût un énorme privilège que de travailler avec toi. J’ai apprécié ton humour et le bel esprit qui ont toujours rendu les moments difficiles plus agréables.
Je voudrais également remercier Laurent Grégoire d’avoir partagé ses nombreuses connaissances lors de nombreuses discussions. Merci pour ta générosité, tes commentaires judicieux et les bons conseils à l’égard de ma recherche qui m’ont permis de raffiner certains points d’analyse et d’interprétation des données.
À mes collègues Nicolas, Vincent, Edith et Andrée-Anne; j’ai beaucoup apprécié travailler à vos côtés et je garde toujours beaucoup de plaisir à discuter avec vous. À titre plus personnel je tiens à remercier chaleureusement Martine Tranchant pour son amitié infaillible et son encouragement. C’est toujours un plaisir de passer du temps avec toi.
Finalement je remercie ma famille pour son soutien qui m’a été fort utile durant ce travail. Merci pour votre patience, votre gentillesse et vos précieux conseils
Avant-propos
Les projets menés durant mon doctorat ont abouti à l’élaboration de trois articles dont je suis premier auteur. Le premier article intitulé « The 5α-reductase inhibitor
Dutasteride but not Finasteride protects dopamine neurons in the MPTP mouse model of Parkinson's disease» qui fait l’objet du chapitre 8 a été publié dans la
revue Neuropharmacology en 2015. Les deux autres articles intitulés « Effects of
progesterone administered after MPTP on dopaminergic neurons of male mice » et
« Effect of the 5α-reductase enzyme inhibitor dutasteride in the brain of intact and
parkinsonian mice », présentés aux chapitres 7 et 9, ont été soumis pour
publication.
J’ai participé, comme premier auteur ou co-auteur, à l’élaboration de deux revues de la littérature et un chapitre de livre :
N. Litim, M. Morissette et T. Di Paolo Neuroactive gonadal drugs for neuroprotection in male and female models of Parkinson's disease. Neurosci Biobehav Rev. 2016 Aug;67:79-88.
Cette revue a été ajoutée en annexe.
M. Morissette, N. Litim et T. Di Paolo Natural Products as alternative
neuroprotective agents for Parkinson’s Disease.
N. Litim, M. Morissette et T. Di Paolo. Metabotropic glutamate receptors as therapeutic targets in Parkinson's disease: An update from the last 5 years of
1 Introduction
Chapitre 1: La transmission dopaminergique 1.1. Dopamine: Biosynthèse et métabolisme
La Dopamine (DA) est un neurotransmetteur monoamine impliqué dans le contrôle des mouvements volontaires (Sano et coll., 1959). La signalisation et la distribution de la DA sont finement régulées par plusieurs facteurs, y compris le transport dans le cytoplasme et dans les vésicules synaptiques via le transporteur de la DA (DAT) et le transporteur vésiculaire des monoamines (VMAT) -2, respectivement (German et coll., 2015). La perturbation de la fonction du DAT ou du VMAT2 modifie profondément les concentrations de DA intra et extracellulaire. Le dérèglement de la fonction neuronale dopaminergique peut, à son tour, contribuer à plusieurs troubles du système nerveux central (SNC), y compris la maladie de Parkinson (MP) (Seeman et Niznik, 1990).
La DA est synthétisée à partir de la L-tyrosine qui, après hydroxylation par la tyrosine hydroxylase (TH), est convertie en L-dihydroxyphénylalanine (L-DOPA). L’action de la TH est considérée comme l'étape limitante dans la synthèse de la DA (Daubner et coll., 2011). La L-DOPA est rapidement métabolisée en DA par l'enzyme décarboxylase des acides aminés aromatiques (figure 1.1).
Les paramètres nécessaires sont manquants ou erronés.
Figure 1.1 Synthèse de la dopamine à partir de la L-DOPA au niveau des terminaisons nerveuses dopaminergiques. DCAA, décarboxylase d'acides aminés aromatiques; DAT, transporteur de la dopamine, TH, Tyrosine hydroxylase; D1, récepteur de la dopamine D1-like; D2, récepteur de la dopamine D2-like. Schéma tiré de (Bravo, 2014).
Plusieurs mécanismes endogènes ont été identifiés dans la régulation de la synthèse de la DA. La DA peut agir comme inhibiteur compétitif de la TH en bloquant la liaison du cofacteur (Daubner et coll., 2011). Les récepteurs dopaminergiques modulent également l'activité de la TH (Daubner et coll., 2011). Ces autorécepteurs sont activés par la DA libérée à partir des terminaisons nerveuses, ce qui entraîne l'inhibition de synthèse de DA par rétroaction. L’activité de la TH est régulée par son état de phosphorylation et cet état de phosphorylation est stimulé par le potentiel d’action (Daubner et coll., 2011).
Après avoir exercé sa fonction, la DA peut être soit convertie en métabolites au niveau de la fente synaptique ou être recyclée dans la terminaison présynaptique. Après sa recapture dans les terminaisons nerveuses, la DA est inactivée par conversion en acide dihydroxyphénylacétique (DOPAC) par l'action de la monoamine oxydase de type B (MAO-B), située au niveau des mitochondries. La DA libérée qui diffuse hors de la synapse est convertie en acide homovanillique (HVA) en dehors du neurone par l’action de la catéchol-O-méthyltransférase (COMT) et la MAO-B; les deux enzymes se trouvent principalement au niveau des cellules gliales (Youdim et coll., 2006).
La signalisation dopaminergique au cerveau est médiée par une famille de récepteurs couplés aux protéines G. Ces récepteurs sont regroupées en deux classes sur la base des protéines G à laquelle ils sont couplés: Les récepteurs dopaminergiques D1-like représentés par les récepteurs D1 et D5 stimulent l'adénylate cyclase, tandis que les récepteurs D2-like représentés par les récepteurs D2, D3 et D4 sont couplés négativement à l'adénylate cyclase (Missale et coll., 1998)(figure 1). Le striatum est la région du cerveau qui présente la plus forte densité des récepteurs D1- et D2-like (Missale et coll., 1998). Chez les rongeurs, ces deux récepteurs sont séparés selon les voies de sortie du striatum avec les récepteurs D1 exprimés au niveau de la voie directe et les récepteurs D2 au niveau de la voie indirecte (Smith et Bolam, 1990). Les récepteurs D1 sont localisés sur les neurones épineux de projection GABAergique post-synaptique, tandis que les récepteurs D2 sont exprimés à la fois en présynaptique sur les terminaisons nigro-striées et sur les neurones épineux de projection GABAergique post-synaptique (Smith et Bolam, 1990).
(Johnson et coll., 1981; Knoth et coll., 1981) (Figure 1.2). La présence de fortes concentrations intravésiculaires de H+ est due à l’activité de la H+-ATPase sur laquelle l’activité du VMAT2 dépend pour emmagasiner la DA dans les vésicules (Eiden et coll., 2004). Les vésicules chargées en DA sont alors transportées à la membrane plasmique où elles interagissent avec différents complexes protéiques qui vont ensuite amorcer la fusion des vésicules à la membrane (Li et Chin, 2003). La libération de DA à partir des
vésicules synaptiques dans les terminaux se produit par un mécanisme Ca2+
-dépendant. Suite à un potentiel d’action, un influx de Ca2+ intracellulaire conduit à la fusion des vésicules avec la membrane plasmique et la libération de DA (Jackson et Chapman, 2006). La DA libérée dans la fente synaptique se lie et active à la fois des récepteurs DA présynpatiques et postsynaptiques. La DA libéré dans la fente synaptique est inactivée principalement par dégradation en 3-méthoxytyramine (3-MT) par la COMT (Mannisto et coll., 1992), ou par recapture par les terminaisons dopaminergiques via le DAT (Chen et Reith, 2000). La DA sera alors reconditionnée dans les vésicules synaptiques ou dégradées.
Figure 1.2. Les modèles de fonctionnement des transporteurs DAT et VMAT2. (A) Le mouvement de DA de l'espace extracellulaire vers le cytoplasme via la transition du DAT d’une orientation vers l'extérieur (outward-facing) à l'état orienté vers l'intérieur (inward-facing). (B) Le transport de DA dans des vésicules synaptiques de l'espace cytoplasmique par VMAT2, facilité par la fonction H + ATPase. Schéma tiré de (German et coll., 2015).
Le DAT est aussi un membre de la famille des SLC constitué de douze domaines transmembranaires et est hautement conservé parmi les humains et d'autres mammifères, y compris les rats et les souris (Giros et coll., 1992). Les domaines
préférentiellement endocyté, et devient inefficace dans le transport de la DA par rapport au DAT complètement glycosylé (Li et coll., 2004).
Le DAT peut être indirectement influencé par le VMAT2 grâce à l'interaction avec la protéine de vésicules synaptiques Synaptogyrin-3 (Egana et coll., 2009) qui lie le VMAT2 au DAT, facilitant la recapture de la DA immédiatement dans les vésicules synaptiques après le transport par le DAT (Egana et coll., 2009).
1.3. Organisation fonctionnelle des ganglions de la base
Les ganglions de la base sont un réseau de noyaux sous-corticaux interconnectés impliqués dans le contrôle des mouvements volontaires (Obeso et coll., 2008). Les noyaux des ganglions de la base sont le striatum (caudé et putamen), les globus pallidus externe (GPe) et interne (GPi), le noyau sous-thalamique (NST), la substantia nigra pars compacta (SNpc) et pars reticulata (SNr) (Obeso et coll., 2008). Un modèle simplifié de fonctionnement des ganglions de la base est exposé ici pour tenter d’expliquer le contrôle des mouvements (Albin et coll., 1989). Ce modèle décrit deux voies de signalisation: La voie directe et la voie indirecte. La voie directe relie les aires corticales motrices d’entrée des ganglions de la base, le striatum avant de projeter vers les noyaux de sortie, le GPi et la SNr, pour ensuite projeter vers le thalamus et le cortex. La voie indirecte relie le striatum, le GPe et le NST avant de projeter vers le GPi et la SNr, le thalamus et le cortex (Figure 1.3).
Figure 1.3. Les circuits moteurs des noyaux gris centraux dans des conditions normales (Gauche) et le parkinsonisme (droit). GPe, globus pallidus externe; GPi, globus pallidus interne; STN, noyau sous-thalamique; SNr, substantia nigra pars reticulata; Snc, substantia nigra pars compacta, D1 et D2, récepteurs dopaminergiques D1 et D2. Les têtes de flèches noires sont excitatrices, les têtes de flèches blanches sont inhibitrices. Schéma tiré de (Yelnik, 2006).
1.4. Contrôle des mouvements moteurs volontaires
Dans un état normal de fonctionnement, la voie directe est principalement activatrice, elle facilite le mouvement (Albin et coll., 1989). La DA libérée au niveau du striatum va induire l’activation de la voie directe ce qui induit une inhibition des noyaux de sortie et
des épines dendritiques et qui reçoivent des afférences corticales et thalamiques glutamatergiques excitatrices et des projections dopaminergiques en provenance de la
SNpc (Prensa et coll., 2000; Smith et Bolam, 1990). Les synapses dopaminergiques
sont positionnées à la base des épines leurs donnant ainsi la capacité de moduler l’effet des afférences corticales (Prensa et coll., 2000; Smith et Bolam, 1990). Les neurones de la voie directe expriment les récepteur dopaminergiques D1 ainsi que les neuropeptides substance P et dynorphine (Steiner et Gerfen, 1998). Ces neurones établissent directement une connexion inhibitrice sur les neurones GABAergiques du GPi et de la SNr. L’activation de cette voie résulte en une inhibition des noyaux de sortie, une désinhibition du thalamus et un transfert de l’information jusqu’au cortex. La voie directe facilite donc le mouvement.
À l’inverse, les neurones GABAergiques de la voie indirecte expriment les récepteurs D2 ainsi que le neuropeptide enképhaline (Steiner et Gerfen, 1998). Ces neurones projettent directement sur les neurones GABAergiques du GPe qui projettent vers le GPi et la SNr et indirectement à travers le NST qui envoie des projections glutamatergiques vers le GPi et la SNr mais aussi vers le GPe (Prensa et coll., 2000; Smith et Bolam, 1990). Cela résulte en une stimulation des noyaux de sortie soit par une désinhibition du NST soit par inhibition du GPe, une inhibition du thalamus, et donc une inhibition du transfert de l’information jusqu’au cortex. La voie indirecte inhibe donc les mouvements. Les voies directe et indirectes sont plus ségrégées chez le rongeur que le primate; la locomotion chez le rongeur est contrôlée d'une manière différente de celle des primates. Chez le rat, les neurones projetant vers l’aire striatale motrice résident dans des régions distinctes, tandis que chez les primates ils sont disposés en faisceaux entrecroisés (Meredith et Kang, 2006). Chez le rat, les zones terminales des projections provenant du striatum moteur et associatif sont largement séparées, alors qu’elles ne le sont pas chez les primates. Par ailleurs, chez le rat, les cellules dopaminergiques sont organisées de façon spatiale, morphologique, histochimique en deux aires ventrale et dorsale distinctes, tandis que chez les primates il n'y a pas de telle division du système dopaminergique qui se traduit par deux zones qui ont toutes les caractéristiques des deux aires chez les rats (Meredith et Kang, 2006).
Chapitre 2 : La maladie de Parkinson
2.1. La maladie de Parkinson et son étiologie
La maladie de Parkinson (MP) est le trouble moteur le plus courant et, après la maladie d'Alzheimer, la deuxième maladie neurodégénérative progressive la plus fréquente (Lee et Liu, 2008). La prévalence de la MP varie dans le monde de 0,5 à 4% chez les personnes âgées de 65 ans ou plus et ce chiffre devrait augmenter de manière significative avec le vieillissement de la population (de Lau et Breteler, 2006). En fait, il a été prédit que d'ici 2030, le nombre de patients atteints du Parkinson atteindra 9,3 millions (Dorsey et coll., 2007). La MP est une maladie débilitante avec des différences de dégénérescence dans les systèmes dopaminergiques et non dopaminergiques (Braak et coll., 2004). Les principaux symptômes de la MP comprennent la rigidité musculaire, les tremblements au repos, la bradykinésie ou akinésie, et une altération des réflexes posturaux (Jankovic, 2008). La MP se distingue des autres formes de parkinsonisme par la présence de corps de Lewy et neurites de Lewy, qui sont des agrégats de protéines α-synucléine et ubiquitine (Shults, 2006). L'étiologie de la MP chez la plupart des patients reste inconnue. On suppose que des facteurs génétiques et environnementaux avec des interactions complexes sont responsables du développement et de la progression de la maladie (Logroscino, 2005). La pathogenèse et la mort sélective des neurones dopaminergiques dans la SNpc reste à clarifier (Kazantsev et Kolchinsky, 2008). Différents mécanismes pathogènes ont été proposés par lesquels les neurones dopaminergiques peuvent être endommagées dans la MP. Ceux-ci incluent une altération de la fonction de la chaîne respiratoire mitochondriale (Fukae et coll., 2007), l'apoptose (Hartmann et Hirsch, 2001), l'accumulation de métaux lourds (Barnham et Bush, 2008), le stress oxydatif (Friedman et Galazka-Friedman,
les symptômes ne se manifestent pas jusqu'à ce que 50-80% des neurones dopaminergiques soient morts. Par conséquent, il est peu surprenant que le diagnostic durant les stades précoces de la maladie soit plutôt rare (Jankovic, 2008).
Etiologie de la MP
Un grand nombre de preuves indiquent que, de façon similaire à d'autres conditions neurodégénératives, la MP soit une maladie multifactorielle influencée par de multiples facteurs génétiques et environnementaux (Gao et Hong, 2011).
2.1.1. Facteurs génétiques
Les études épidémiologiques ont révélé qu’environ 10 % des cas de la MP sont héréditaires associés à une mutation ou une variation de nombre de copies d’un des gènes identifiés chez les familles présentant des cas de MP héréditaires (Thomas et Beal, 2007).
Jusqu’à présent, 24 loci (PARK 1-24) ont été mise en évidence et plusieurs gènes responsables de la MP ont été identifiés (Nalls et coll., 2014) : Les gènes SNCA (PARK1) codant pour l’α-synucléine et LRRK2 (PARK8) qui code pour la Leucine-riche repeat kinase 2 (LRRK2) pour les formes autosomiques dominantes, les gènes Parkin (PARK2) codant pour la Parkin, PINK1 (PARK6) qui code pour PTEN-induced putative kinase 1 (PINK1) et DJ-1 (PARK7) qui code pour DJ-1 pour les formes autosomiques récessives. Les autres loci moins bien connus ont été impliqués dans des formes familiales de la MP ; ils nécessitent donc une enquête plus approfondie pour déterminer
l'étendue de leur contribution dans la MP. Les mutations génétiques dans les cas
familiaux de MP sont associées avec des altérations de la fonction mitochondriale (Winklhofer et Haass, 2010), le dysfonctionnement de la voie ubiquitine-protéasome (Betarbet et coll., 2005), et des altérations de formation de radicaux libres avec un stress oxydatif accru (Dias et coll., 2013).
2.1.2. Facteurs environnementaux ou non génétiques
Une exposition chronique à des toxines et des métaux lourds serait un facteur de risque
de développer la MP (Gao et Hong, 2011). L’exposition accidentelle d’un groupe de personnes au 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP) a conduit à un syndrome parkinsonien qui est indiscernable de la MP (Langston et Ballard, 1983). Cette observation a mené à la découverte que le MPTP induit de façon sélective des lésions des neuronaux dopaminergiques de la SNpc. Cette découverte a pavé le chemin pour la recherche de facteurs environnementaux comme causes potentielles de MP. Depuis, un certain nombre d’études ont rapporté qu’une exposition à des produits chimiques agricoles (le pesticide roténone et l’herbicide paraquat) serait associée à un risque accrue de développer la MP puisque ces produits auraient des effets néfastes sur les neurones dopaminergiques (Brown et coll., 2006; Dhillon et coll., 2008). Par ailleurs, une exposition à des métaux lourds comme le manganèse, le zinc, le cuivre et le fer augmenteraient le stress oxydatif ce qui induirait des dommages au niveau des neurones dopaminergiques de la SNpc et donc augmenterait le risque de développer la MP (Lai et coll., 2002). Cependant, les preuves épidémiologiques restent insuffisantes pour établir une association spécifique entre une exposition à des substances toxiques et un risque accru de MP.
Le dysfonctionnement mitochondrial corrélé avec une augmentation du stress oxydatif
observés dans les tissus des patients serait impliqué dans la pathogénèse de la MP (Mizuno et coll., 1989; Schapira et coll., 1989). Une augmentation des taux d’oxydation des lipides, des protéines et de l’ADN ainsi qu’une réduction des mécanismes antioxydants ont été observées au niveau de la SN en post-mortem (Dexter et coll., 1989; Zhang et coll., 1999). La DA peut également subir une auto-oxydation pour former
passerait de 0,3 % dans la population générale à 2% chez les personnes âgés de plus de 65 ans (de Rijk et coll., 1997).
La prolifération et l’activation de la microglie et des astrocytes ainsi qu’une augmentation des taux de cytokines pro-inflammatoires ont été rapportées dans des analyses post mortem chez des patients atteints de MP (Damier et coll., 1993; Imamura et coll., 2003; McGeer et coll., 1988; Mogi et coll., 1994a; Mogi et coll., 1994b) ce qui suggère que l’activation de mécanismes inflammatoires serait impliquée dans la pathogénèse de la MP.
Les facteurs environnementaux comme la consommation de café et de tabac ont été associés à un risque réduit de développer la MP (Hernan et coll., 2002). Les effets de la consommation de thé sur le risque de développer la MP font actuellement l'objet d’intenses investigations puisque les polyphénols, les principes actifs du thé, ont été démontrés comme neuroprotecteurs dans la MP en réduisant la neuroinflammation et le stress oxydatif ce qui réduit les dommages sur les neurones dopaminergiques (Caruana et Vassallo, 2015).
2.2. Pathophysiologie de la maladie de Parkinson 2.2.1. Transmission dopaminergique
Le déficit en DA striatale joue un rôle majeur dans le développement des symptômes moteurs de la MP. Cela résulte en un débalancement entre l’effet activateur de la voie directe et l’effet inhibiteur de la voie indirecte (Figure 1.3). Le déséquilibre de ces deux voies résulte en une augmentation de l’activité inhibitrice des noyaux de sortie, le GPi et la SNr, vers le thalamus ; l’activation des aires corticales motrices est alors perturbée (Hirsch, 2000). Les symptômes moteurs de la MP, l’akinésie, la rigidité et les tremblements au repos, deviennent apparents lorsque la perte neuronale atteint un seuil critique de 50-60% et une déplétion de la DA striatale de 70-80% (Bernheimer et coll., 1973). Le degré de perte neuronale dans la SN corrèle avec la perte d'activité de la TH (Riederer et coll., 1978) et sa localisation dans les neurones de catécholamines en fait un excellent marqueur spécifique des neurones dopaminergiques. Il a été proposé que
des mécanismes compensatoires peuvent retarder l'apparition des symptômes cliniques de la MP (Zigmond, 1997; Zigmond et coll., 1990). Ces mécanismes incluent une augmentation de l’activité neuronale au niveau de la SNc conduisant à une augmentation de libération et de recyclage de la DA; une réduction de l’expression du transporteur DAT pour augmenter la disponibilité synaptique de la DA ainsi qu’une augmentation de sensibilité des récepteurs de la DA.
On observe également une diminution des métabolites de la DA (DOPAC et HVA) au niveau de la SN et le striatum (Bernheimer et coll., 1973; Bokobza et coll., 1984). Cependant, ils sont réduits à un degré moindre que la DA (Bernheimer et coll., 1973). Le rapport des concentrations en HVA et en DA (HVA/DA) peut être utilisé comme indice de l'activité des neurones dopaminergiques présynaptiques survivants.
Bien que la perte neuronale dans la MP touche essentiellement le système dopaminergique, d’autres systèmes de neurotransmission sont affectés tels que les systèmes glutamatergique, GABAergique, cholinergique, sérotoninergique et noradrénergique (Barone, 2010).
2.2.2. Transmission glutamatergique
La perte de neurones dopaminergiques induirait également une augmentation de l'activité glutamatergique dans les noyaux gris centraux (Blandini et coll., 1996; DeLong et Wichmann, 2015). Le glutamate, qui est le neurotransmetteur excitateur le plus abondant dans le SNC, active des récepteurs ionotropiques (iGluR) et métabotropiques (mGluR) (Finlay et Duty, 2014). Les iGluRs tels que les récepteurs α-amino-3-hydroxy-5-méthylisoazol-4-propionate (AMPA), récepteurs à l’acide kaïnique ainsi que les récepteurs N-méthyl-D-aspartate (NMDA) sont exprimés essentiellement en
post-dyskinésies induites par la L-DOPA (DIL) (Duty, 2012). Une récente revue publiée par notre équipe et ajoutée en annexe décrit les avancées concernant la modulation allostérique des récepteurs glutamatergiques métabotropiques dans la MP et les DIL. Ainsi l’inhibition par des modulateurs allostériques négatifs (NAMs) des mGluRs 1 et 5 ainsi que l’activation des mGluRs 2, 3, 4, 7 et 8 avec des modulateurs allostériques positifs (PAMs) et des agonistes orthostériques ont montré un potentiel neuroprotecteur contre la dégénérescence neuronale ainsi que des effets bénéfiques contre les DIL (Litim et coll., 2016).
2.2.3 Autres neurotransmetteurs impliqués
La diminution des niveaux de DA striatale est corrélée avec une augmentation de concentration en GABA qui est le principal neurotransmetteur inhibiteur dans le système nerveux central (Kish et coll., 1986).
Chez les singes traités avec le MPTP, la dégénérescence des neurones dopaminergiques de la voie nigrostriée se traduit par une augmentation généralisée de l'activité GABAergique dans tous les neurones GABAergiques du striatum et cet effet est partiellement inversé par un traitement à la L-DOPA (Levy et coll., 1995). Chez les patients parkinsoniens qui avaient été traités de manière chronique avec la L-DOPA, l'activité GABAergique a été diminué de manière significative dans tous les neurones GABAergiques (Levy et coll., 1995).
Des déficits dans le système cholinergique ont été proposés comme jouant un rôle dans l'étiologie des troubles cognitifs et la démence dans la MP (Williams-Gray et coll., 2006). Une perte neuronale cholinergique au niveau du noyau basal de Meynert a été associée avec un déclin cognitif chez des patients atteints de la MP (Perry et coll., 1985).
Par ailleurs, des données à partir d'études animales, post-mortem ainsi qu’in vivo chez des patients parkinsoniens ont démontré la perte de marqueurs sérotoninergique striataux et extra-striataux (Kerenyi et coll., 2003; Kish et coll., 2008; Politis et Niccolini, 2015; Tohgi et coll., 1993). Par ailleurs, dans le stade deux de l’évolution de la MP selon Braak et coll., les corps et neurites de Lewy sont observés au niveau des noyaux du
(Braak et coll., 2003) indiquant que le système sérotoninergique serait affecté dans la
MP. Un certain nombre d'études suggèrent également que la dégénérescence
progressive des terminaisons sérotoninergiques contribuerait au développement de symptômes allant des DIL et des tremblements à la dépression et les hallucinations visuelles (Politis et Niccolini, 2015).
Des perturbations des systèmes noradrénergiques centraux sont associées à l'apparition de l'anxiété, bien que les interactions avec d'autres neurotransmetteurs, comme la sérotonine (5-hydroxytryptamine ; 5-HT) et DA, peuvent également être impliqués (Richard, 2005).
Des niveaux plasmatiques réduits de noradrénaline ont été observés chez des patients atteints de MP (Barbic et coll., 2007). La perte de noradrénaline dans le locus coeruleus, qui se produit à un stade précoce de la maladie serait impliquée dans la progression de la maladie (Fornai et coll., 2007) ainsi que dans l'apparition de LID (Colosimo et Craus, 2003). Par ailleurs, il a été observé que la stimulation adrénergique induirait une atténuation des symptômes non moteurs tels que l’anxiété et la dépression (Barone, 2010).
Chapitre 3 : Modèles animaux du Parkinson
L’intérêt de l'utilisation de modèles animaux pour reproduire différents aspects de la MP réside dans le fait que ce sont des outils nécessaires afin d'étudier la pathologie de la maladie et de développer des stratégies thérapeutiques. Bien qu'aucun des modèles actuellement disponibles ne reproduit complètement le phénotype parkinsonien, ils ont cependant contribué à une meilleure compréhension de la maladie. Jusqu'à présent, les modèles expérimentaux ont été différenciés selon deux catégories: des modèles génétiques et des modèles induits par des toxines.
3.1 Modèles génétiques
Pour modéliser la MP, différents organismes, tels que la souris, la drosophile et le ver C. elegans ont été utilisés avec une surexpression transgénique ou invalidation de gènes mutés pour les gènes autosomiques dominantes (SNCA et LRRK2) ou invalidation génique/invalidation génique transitoire de gènes autosomiques récessifs (Parkin, DJ-1, et PINK1) (Gao et Hong, 2011). Ces modèles sont très précieux dans la compréhension des mécanismes de dysfonctionnement neuronal causé par les mutations génétiques mais apportent également de nouvelles perspectives concernant l’étiologie des cas sporadiques de la MP.
Les animaux transgéniques qui surexpriment la protéine α-synucléine ou la forme mutée A53T ont été utilisés pour étudier le rôle de cette protéine dans la dégénérescence dopaminergique (Daher et coll., 2012). Bien que certaines souris transgéniques exprimant la protéine mutée affichaient des altérations dans le comportement moteur, ces souris ne présentent de mort des neurones dopaminergiques telle qu’observée chez les patients parkinsoniens (Maries et coll., 2003).
Des souris invalidées pour la LRRK2 affichent une agrégation et une accumulation anormales de protéines telles que la α-synucléine, sans perte de neurones de la voie nigrostriée (Li et coll., 2007; Li et coll., 2009; Melrose et coll., 2010; Tsika et coll., 2014). La plupart des souris transgéniques pour la parkin ne présentent pas de perte de neurones dopaminergiques au niveau de la SNpc (Goldberg et coll., 2003; Itier et coll.,
2003; Lu et coll., 2009). Plusieurs souris invalidées pour la parkin ont été générées et présentent une modeste perturbation de libération de la DA sans dysfonctionnement moteur lié à la perte neuronale (Dave et coll., 2014; Kitada et coll., 2009).
Des souris invalidées pour DJ-1 manifestent une perturbation de la libération de DA au niveau du striatum mais ont peu de phénotype et ne développent pas de perte de neurones dopaminergiques dans la voie SNc (Andres-Mateos et coll., 2007; Chandran et coll., 2008; Goldberg et coll., 2005). Un modèle de rat invalidé pour DJ-1 a été développé qui manifeste une perte de neurones dopaminergiques associée à un déficit moteur (Dave et coll., 2014).
Étant donné les similarités de fonctions entre PINK1 et Parkin (Pickrell et Youle, 2015), les phénotypes des souris invalidées pour l’un des deux gènes sont similaires. Pas de perte neuronale ni de corps de Lewy n’ont été rapportés chez les souris invalidées pour PINK1 mais des perturbations du fonctionnement mitochondrial et une sensibilité accrue au stress oxydatif ont été observées (Kim et coll., 2005; Kitada et coll., 2007). Un modèle de rat invalidé pour PINK1 a été généré présentant un phénotype assez semblable au phénotype parkinsonien avec une perte de DA (Dave et coll., 2014).
3.2. Modèles induits par des toxines
3.2.1. 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP)
Le MPTP est une substance hautement lipophile qui traverse facilement la barrière hémato-encéphalique après quoi le MPTP est métabolisé en 1-méthyl-4-phénylpyridinium (MPP+) par l'enzyme MAO-B des cellules gliales (Singer et coll., 1987) puis transporté par le DAT à l'intérieur des neurones dopaminergiques (Javitch et coll.,
déficits comportementaux moteurs très semblables au syndrome parkinsonien observé chez les patients (Jenner et coll., 1984; Langston et coll., 1984).
Les paramètres nécessaires sont manquants ou erronés.
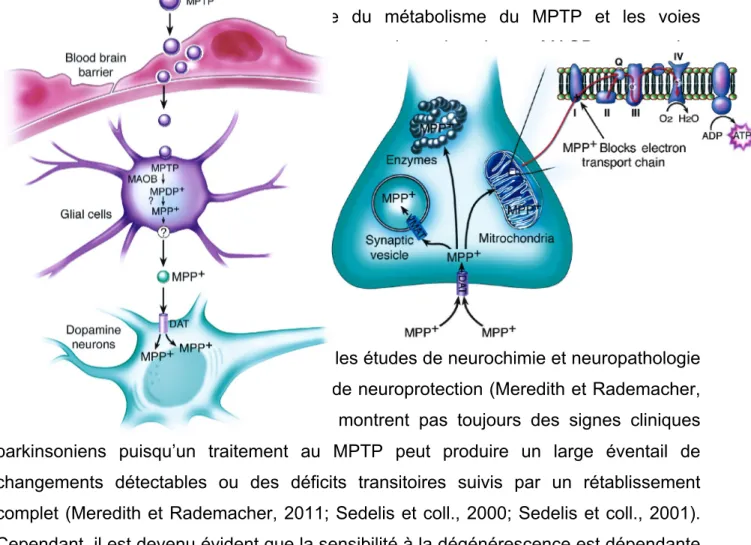
Figure 3.1. Représentation schématique du métabolisme du MPTP et les voies intracellulaires affectées au sein des neurones dopaminergiques. MAOB, monoamine oxydase de type B ; MPTP, méthyl-4-phényl-1,2,3,6-tétrahydropyridine ;MPP+, 1-méthyl-4-phénylpyridinium ; DAT, transporteur de la dopamine. Schémas tirés de (Dauer et Przedborski, 2003).
Le MPTP peut également être administré chez les rongeurs notamment la souris. Les rats présentent cependant une résistance au MPP+ sauf si la toxine est injectée directement au niveau de la SNpc (Sedelis et coll., 2000; Yazdani et coll., 2006). Les différences dans l'activité de la MAO ont été proposées comme la raison de leur faible susceptibilité (Sedelis et coll., 2000). L'utilisation répandue chez la souris reste de loin le modèle de prédilection en particulier dans les études de neurochimie et neuropathologie ainsi que pour l'évaluation des stratégies de neuroprotection (Meredith et Rademacher, 2011). Les souris traitées au MPTP ne montrent pas toujours des signes cliniques parkinsoniens puisqu’un traitement au MPTP peut produire un large éventail de changements détectables ou des déficits transitoires suivis par un rétablissement complet (Meredith et Rademacher, 2011; Sedelis et coll., 2000; Sedelis et coll., 2001). Cependant, il est devenu évident que la sensibilité à la dégénérescence est dépendante de l'âge, du sexe et de la souche de souris utilisée (Jackson-Lewis et Przedborski, 2007). De nombreux protocoles d’intoxication et d’administration sont utilisés chez les souris (Jackson-Lewis et Przedborski, 2007) et les primates (Porras et coll., 2012).
L'un des principaux obstacles chez le modèle murin est la perte de la DA qui est rapide et réversible ce qui est très différent de ce qui est observé chez les humains (Meredith et Kang, 2006). Par ailleurs, l'étendue des dommages de la voie nigrostriée diminue également avec le temps dans des modèles chroniques MPTP (Kurz et coll., 2007; Meredith et coll., 2008).
Par ailleurs, les souris traitées avec le MPTP ne présentent pas les symptômes cliniques typiques du syndrome parkinsonien, même si des altérations sont rapportées lorsqu’une importante déplétion de DA est induite (Jackson-Lewis et Przedborski, 2007). Alors que l’utilisation du MPTP chez les primates permet d’obtenir de meilleurs résultats incluant la présence des corps de Lewy (Kowall et coll., 2000), l’absence de corps de Lewy chez les souris en fait une autre faiblesse du modèle murin (Shimoji et coll., 2005).
3.2.2. Le modèle 6-Hydroxydopamine (6-OHDA)
La 6-OHDA est une neurotoxine sélective qui induit chez le rat et la souris des lésions de la voie dopaminergique nigrostriée (Thiele et coll., 2012; Ungerstedt, 1968). De par son caractère hydrophile, la toxine ne traverse pas la barrière hémato-encéphalique, ce qui nécessite l'injection locale (généralement sous forme d'injection unilatérale) de préférence dans le faisceau médian du prosencéphale, dans le striatum ou la SNc et provoque une grande neurodégénérescence antérograde de la voie nigrostriée (Ungerstedt, 1968). La 6-OHDA s’accumule dans le cytosol et induit un stress oxydatif via la formation de dérivés réactifs de l’oxygène et des quinines par auto-oxydation (Cohen, 1984). Les doses utilisées permettent d’obtenir un degré de neurodégénérescence allant de modérée à massif, fournissant ainsi des paradigmes appropriés pour l’étude de marqueurs moléculaires voire la modélisation des symptômes moteurs de la MP (Simola et coll., 2007). À l’instar du modèle MPTP, la 6-OHDA n’induit pas la formation de corps de Lewy dans la voie nigro-striée. L’évaluation des altérations comportementales motrices se fait par des tests utilisant des drogues induisant des rotations comme les amphétamines (Dunnett et Lelos, 2010). Les altérations motrices sont dues à l’altération des membres controlatéraux à l’hémisphère
motrices ainsi que la présence d’inclusions intracellulaires immunoréactives pour la α-synucléine et l’ubiquitine comme les corps de Lewy (Betarbet et coll., 2000; Sherer et coll., 2003). Cependant ce modèle présente une haute mortalité chez les rats lésés et ils souffrent d’une forte variabilité dans la réponse interindividuelle (Blandini et Armentero, 2012).
Par ailleurs, le paraquat un herbicide structurellement similaire au MPP+ provoque un stress oxydatif massif via la formation de ROS (Drechsel et Patel, 2009). Cette substance génère une perte de neurones dopaminergiques de la voie nigrostriée et induit la formation de corps de Lewy chez la souris et le rat (Cicchetti et coll., 2005; Manning-Bog et coll., 2002; McCormack et coll., 2002). Comme pour la roténone, l’utilisation du paraquat donne des résultats difficilement reproductible avec une mort cellulaire et une perte de la DA striatale très variables (Miller, 2007).
Chapitre 4 : Les traitements de la maladie de Parkinson 4.1. Traitements médicamenteux
Bien qu'il existe un certain nombre de traitements disponibles pour les patients parkinsoniens, ils sont symptomatiques. La thérapie à la L-DOPA reste la thérapie symptomatique la plus efficace dans le traitement de la MP; elle est co-administrée avec des inhibiteurs de décarboxylase périphérique (Clarke et Moore, 2007). Des inhibiteurs de COMT et MAO-B qui inhibent les voies principales responsables de dégradation de la DA sont également utilisés dans le but d'étendre la demi-vie plasmatique de la DA (Hickey et Stacy, 2011). Cette stratégie permet une réduction de la dose de L-DOPA ainsi qu'une libération plus continue de L-DOPA dans le cerveau (Stocchi, 2005). Durant les premiers stades de la maladie, les symptômes parkinsoniens sont bien contrôlés, les neurones dopaminergiques sont encore fonctionnels et capables de stocker et libérer la DA, évitant ainsi les fluctuations dans la concentration plasmatique de la L-DOPA. En raison de la progression de la maladie et la perte des neurones dopaminergiques, les niveaux de DA striatale deviennent dépendants de la disponibilité de la L-DOPA administrée via voie périphérique (Olanow et coll., 2006). L'utilisation à long terme de la L-DOPA est caractérisée par un changement de réponse des patients aux médicaments. La durée de l'effet antiparkinsonien de la L-DOPA devient progressivement plus court ce qui mène aux fluctuations des fonctions motrices, y compris la détérioration de fin de dose, alternant entre les périodes «on» et «off» et des mouvements involontaires comme les dyskinésies et les dystonies (Stacy et Galbreath, 2008). Bien que l'étiologie des complications motrices n’est pas entièrement comprise, plusieurs études suggèrent qu'ils soient liés en partie à la stimulation dopaminergique pulsatile anormale (Bastide et coll., 2015).
motrices sont moins fréquentes avec ces agonistes (Hauser et coll., 2007; Parkinson Study Group, 2009).
Les inhibiteurs de la MAO-B ont suscité un intérêt en tant que médicaments
modificateurs d’évolution de la maladie en lien avec leur capacité à ralentir le métabolisme de la DA striatale (Stocchi et coll., 2008). Les inhibiteurs sélectifs de MAO-B sélégiline et rasagiline ont été rapportés comme présentant des effets neuroprotecteurs dans des études in vitro et in vivo (Jenner, 2004).
En plus de médicaments dopaminergiques, des médicaments anticholinergiques et l'amantadine qui est un antagoniste non compétitif des récepteurs NMDA sont utilisés pour le traitement de la MP (Connolly et Lang, 2014); ces thérapies ne sont que symptomatiques sans effet prouvé sur la progression de la maladie principalement à cause des effets secondaires intolérables (Pahwa et Lyons, 2010).
4.2. Autres traitements
Traitements chirurgicaux : La stimulation cérébrale profonde ou DBS est une technique
chirurgicale pour traiter des patients à un stade avancé de la maladie et est utilisée pour traiter l’handicap moteur et améliorer la qualité de vie chez les patients parkinsoniens avec des fluctuations motrices (Weaver et coll., 2009). La cible la plus commune pour la DBS est le NST qui l’inactive ce qui résulte en une réduction de l’hyperactivité des noyaux de sortie GPi et SNr libérant ainsi le thalamus et le cortex ce qui permet l’exécution du mouvement (Hickey et Stacy, 2011). Un certain nombre d'études précliniques ont rapporté un effet neuroprotecteur par la stimulation cérébrale profonde du NST contre la dégénérescence des neurones dopaminergiques de la SN dans des modèles expérimentaux de la MP (Harnack et coll., 2008; Maesawa et coll., 2004; Spieles-Engemann et coll., 2010; Temel et coll., 2006). Cet effet neuroprotecteur serait dû à une augmentation possible d’expression de BDNF associée à la DBS (Spieles-Engemann et coll., 2010).
La thérapie de cellules souches consiste à remplacer la perte de neurones
dopaminergiques par de nouvelles cellules prélevées à partir du tissu mésencéphalique de fétus humains (Wijeyekoon et Barker, 2009). Cependant, les essais cliniques ont eu moins de succès, et donc cette technique doit encore être développée avant qu'elle puisse être considérée comme appropriée pour une utilisation chez les patients (Brundin et coll., 2010). En outre, la principale préoccupation dans ce contexte est en effet les aspects éthiques de l'utilisation de tissus fœtaux humains.
Chapitre 5 : Les stéroïdes neuroactifs et la MP
5.1. Les facteurs liés au sexe et les différences entre les sexes dans la MP
Un des facteurs de risque les plus documentés dans la MP est l'existence de disparités entre les sexes dans l'incidence de la MP; l'incidence de la maladie étant plus élevées chez les hommes que chez les femmes (Pringsheim et coll., 2014; Wooten et coll., 2004). Bien que les mécanismes exacts impliqués dans ce phénomène restent inconnus, de nombreuses études suggèrent que cette différence entre les sexes pourrait être dues à des effets neuroprotecteurs des hormones sexuelles circulantes. Cette hypothèse est supportée par plusieurs rapports cliniques indiquant un effet neuroprotecteur des œstrogènes endogènes ou exogènes sur le risque et la progression de la MP (Benedetti et coll., 2001; Currie et coll., 2004; Marder et coll., 1998; Popat et coll., 2005; Ragonese et coll., 2004). Une relation entre la durée de l'exposition aux œstrogènes endogènes et la susceptibilité de développer la MP et dans la sévérité des symptômes peut exister chez les femmes (Cereda et coll., 2013; Haaxma et coll., 2007; Nitkowska et coll., 2014; Ragonese et coll., 2004). Les thérapies de substitution d'œstrogènes post-ménopausiques peuvent également diminuer le risque de développer la MP chez les femmes seulement lorsqu'elles sont administrées dans les premiers stades de la maladie (Currie et coll., 2004). Rocca et coll. ont suggéré que le risque accru de la MP associée à ovariectomie (Benedetti et coll., 2001; Rocca et coll., 2008) pourrait en partie être expliqué par un déficit en progestérone (PROG) et en testostérone (T) plutôt que de l'œstrogène, bien que les effets neuroprotecteurs possibles de PROG et T sur le risque de PD restent inexplorées (Rocca et coll., 2008). Il a été clairement démontré dans le modèle animal MPTP que l'estrogène naturelle et la PROG sont neuroprotectrices contre la neurotoxicité du MPTP (Callier et coll., 2001), tandis que certains progestatifs de synthèse ne présentent pas d’effets bénéfiques et peuvent même atténuer les effets neuroprotecteurs associés aux œstrogènes seuls (Singh, 2005). En plus des différences dans la prévalence et la susceptibilité de développer la MP chez les hommes et les femmes, des différences liées au sexe ont également été signalées dans la progression de la maladie avec une apparition tardive des symptômes moteurs chez les femmes (Alves et coll., 2009; Haaxma et coll., 2007) avec une progression plus lente de la maladie chez les femmes que chez les hommes
(Haaxma et coll., 2007). Une amélioration de la capacité motrice a été rapportée lorsque la thérapie de remplacement hormonal post-ménopausique est administrée dans les premiers stades de la maladie (Benedetti et coll., 2001; Saunders-Pullman et coll., 1999). Une étude a également rapporté que la sévérité des symptômes pourrait être conditionnée par les variations du profil hormonal durant le cycle menstruel (Quinn et Marsden, 1986).
Collectivement, ces données suggèrent une influence bénéfique des œstrogènes dans le développement et la progression de la maladie, mais les mécanismes exacts par lesquels ces hormones agissent sur les systèmes dopaminergiques restent à être caractérisés.
5.2. Stéroïdes neuroactifs dans la MP
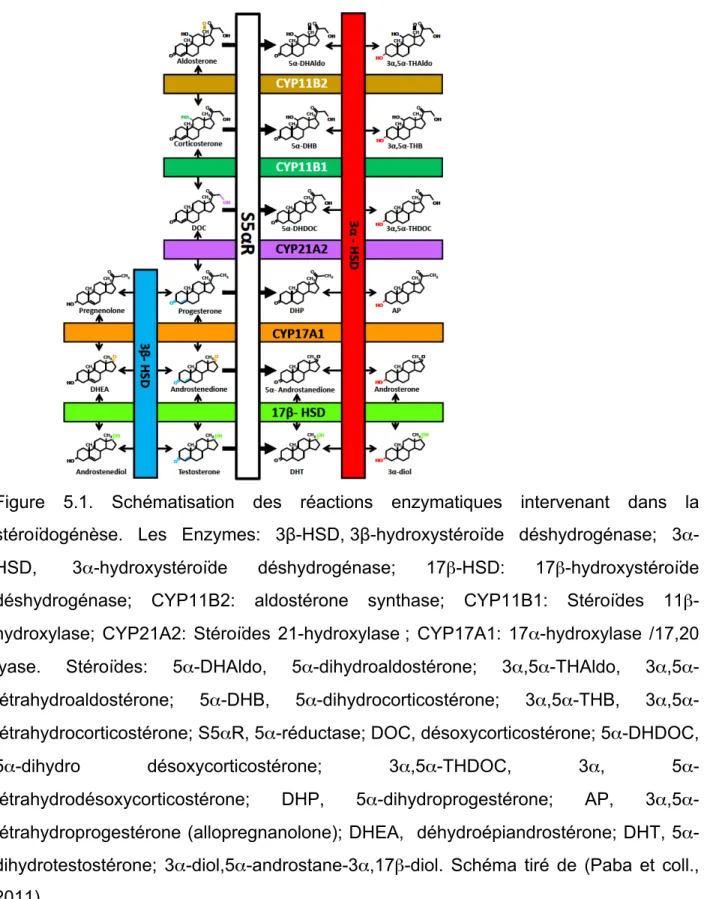
Le terme « stéroïdes neuroactifs » englobe les hormones stéroïdiennes synthétisées en périphérie et les neurostéroïdes synthétisés au niveau du système nerveux (Giatti et coll., 2015; Melcangi et coll., 2008). En effet, de nombreuses études ont démontré que les hormones stéroïdiennes peuvent être synthétisées et métabolisées au niveau du système nerveux humain (Melcangi et coll., 2008; Schumacher et coll., 2003). Les neurones et les cellules gliales expriment des molécules impliquées dans le transport du cholestérol dans les mitochondries, comme la Steroidogenic acute regulatory protein (StAR) et la translocase de 18 kDa (TSPO), ainsi que des enzymes impliquées dans la stéroïdogénèse, comme l’enzyme de clivage de la chaîne latérale du cholestérol (P450scc), la 3β-hydrostéroïde déshydrogénase (3β-HSD), le cytochrome P450c17, la 17β-hydroxystéroïde déshydrogénase et l’aromatase (ARO) (Melcangi et coll., 2008; Schumacher et coll., 2003). Le cytochrome P450scc catalyse la conversion du
dihydroprogestérone (DHP) et dihydrotestostérone (DHT), respectivement. Ces stéroïdes neuroactifs sont ensuite convertis par l'action de 3α- (3α-HSOR) ou 3β-hydroxystéroïde oxydoréductase (3β-HSOR) en d'autres métabolites. En particulier la DHP est convertie en tétrahydroprogestérone (THP) et en isopregnanolone alors que la DHT est convertie en 5α-androstane-3α,17β-diol (3α-diol) ou 5α-androstane-3β,17β-diol (3β-5α-androstane-3β,17β-diol) (Melcangi et coll., 2008). (Figure 5.1). Cette notion de synthèse locale au niveau du système nerveux a été corroborée par des études montrant clairement que les niveaux des stéroïdes neuroactifs n’étaient généralement pas affectés par l’ablation des organes périphériques producteurs d’hormones stéroïdiennes et ces niveaux hormonaux persistaient au niveau du cerveau sur le long terme après ablation (Caruso et coll., 2010).
Ces stéroïdes neuroactifs exercent une pléthore d’effets au niveau du système nerveux central via l’activation d’une multitude de récepteurs (Melcangi et coll., 2008). Alors que les précurseurs de ces stéroïdes exercent leurs effets via l’activation des récepteurs classiques des stéroïdes, leurs métabolites vont activer une toute autre classe de récepteurs. Par exemple, alors que la PROG et son métabolite agissent via l’activation des récepteurs classiques de progestérone (PR), ses métabolites THP et isopregnanolone exercent leurs effets via le récepteur GABA-A (Melcangi et coll., 2008). Il est de plus en plus évident que les stéroïdes neuroactifs ont des effets modulateurs sur la transmission dopaminergique via des actions directes sur la libération de DA striatale (Nuwayhid et Werling, 2003; Whittaker et coll., 2008). Alors que l’administration de PROG induisait une augmentation de libération de DA striatale (Di Paolo et coll., 1986; Petitclerc et coll., 1995), ses métabolites peuvent agir via l’activation du système GABAergique. Ainsi, il a été rapporté que l’administration de THP induisait une diminution du métabolisme de la DA striatale (Czlonkowska et coll., 2001) et que ces actions étaient dose-dépendants (Rouge-Pont et coll., 2002) ; augmentant la libération de DA à faible dose et la diminuant à forte dose.
Figure 5.1. Schématisation des réactions enzymatiques intervenant dans la stéroïdogénèse. Les Enzymes: 3β-HSD, 3β-hydroxystéroïde déshydrogénase;
3α-HSD, 3α-hydroxystéroïde déshydrogénase; 17β-HSD: 17β-hydroxystéroïde
déshydrogénase; CYP11B2: aldostérone synthase; CYP11B1: Stéroïdes 11β-hydroxylase; CYP21A2: Stéroïdes 21-hydroxylase ; CYP17A1: 17α-hydroxylase /17,20 lyase. Stéroïdes: 5α-DHAldo, 5α-dihydroaldostérone; THAldo, tétrahydroaldostérone; 5α-DHB, 5α-dihydrocorticostérone; THB, 3α,5α-tétrahydrocorticostérone; S5αR, 5α-réductase; DOC, désoxycorticostérone; 5α-DHDOC, dihydro désoxycorticostérone; 3α,THDOC, 3α,
5α-Par ailleurs, des perturbations de la synthèse des stéroïdes neuroactifs pourraient contribuer au déséquilibre de la neurotransmission au niveau des ganglions de la base. Des altérations des niveaux des stéroïdes neuroactifs ont été rapportées chez des patients parkinsoniens ainsi que chez le modèle animal 6-OHDA (di Michele et coll., 2003; Melcangi et coll., 2012). Des perturbations de l ‘expression des enzymes de la stéroïdogénèse telles que la 5α-R et la 3α-HSOR ont également été rapportées chez des patients parkinsoniens (Luchetti et coll., 2010; Luchetti et coll., 2006) ce qui pourrait induire une diminution de synthèse de stéroïdes neuroactifs. De plus, la SN chez l’humain est une région qui exprime de fortes concentrations d’allopregnanolone qui agit comme modulateur de la transmission GABAergique et de DHP qui agit au niveau génomique (Bixo et coll., 1997). Ces résultats suggèrent un rôle potentiel des stéroïdes neuroactifs dans les processus physiopathologiques de cette région.
Des effets neuroprotecteurs des stéroïdes neuroactifs ont également été observés chez différents modèles animaux de la MP (Adeosun et coll., 2012; Bourque et coll., 2009; Bourque et coll., 2016; Callier et coll., 2001; di Michele et coll., 2013). Ces effets neuroprotecteurs sont induits via la régulation de l’expression des protéines pro et anti-apoptotiques ainsi que la diminution du stress oxydatif (Melcangi et coll., 2016). De plus, il est maintenant bien admis que la progestérone induit l’expression de facteurs neurotrophiques comme le brain-derived neurotrophic factor (BDNF) qui agirait comme acteur crucial dans l’effet neuroprotecteur de la PROG (Gonzalez et coll., 2004; Jodhka et coll., 2009; Jones et coll., 2005; Su et coll., 2012). Ainsi, une diminution de synthèse de stéroïdes neuroactifs se traduirait par une perturbation de l’expression de facteurs neurotrophiques ce qui contribuerait à la dégénérescence des neurones dopaminergiques. Il a été proposé que les effets neuroprotecteurs des stéroïdes neuroactifs pourraient également être médiés via la régulation de la neuroinflammation puisqu’il a été rapporté que la PROG, ses métabolites ainsi que la 17β-E réduisaient l’activation des cellules immunitaires et la libération d’agents pro-inflammatoire (Arevalo et coll., 2013).
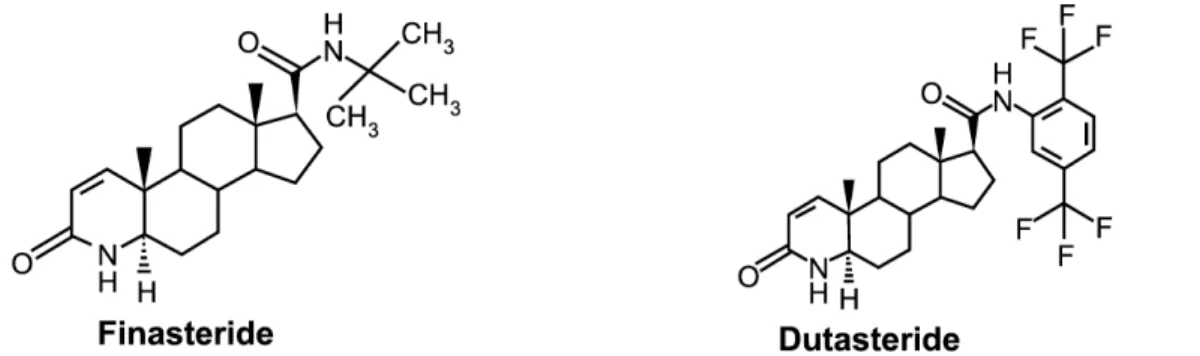
5.3. L’enzyme 5α-réductase : Un candidat potentiel pour une thérapie multi-cible Les stéroïdes ovariens (17β-E et PROG) sont protecteurs pour les neurones dopaminergiques contre la toxicité du MPTP (Bourque et coll., 2009) alors que ces effets sont absents lors de l’utilisation des stéroïdes etrogènes tels que la T ou la DHT (Dluzen, 1996; Ekue et coll., 2002). Chez des souris intoxiquées au MPTP, les etrogènes ont été associés à une plus importante altération de la concentration dopaminergique striatale et ces résultats ont été confirmés chez un autre modèle animal de la MP impliquant une intoxication à la méthamphétamine (Bourque et coll., 2009). Dans le cadre de ce projet, nous nous sommes intéressés aux inhibiteurs de la 5α-réductase, finasteride et dutasteride, d’ores et déjà utilisés dans le traitement de l’hyperplasie bénigne de la prostate et de l’alopécie etrogénique (Azzouni et coll., 2013; Kumar et Wahane, 2008). Comme décrit dans les sections précédentes, la 5-αR est une enzyme qui convertit la T en DHT et métabolise la progestérone. La T est aromatisée en 17β-E (Finn et coll., 2006). Alors que le finasteride inhibe l’isoforme II de la 5α-réductase, le dutasteride présente une activité inhibitrice plus puissante des deux isoformes I et II de la 5-αR (Clark et coll., 2004; Nickel et coll., 2011).
Rôle des 5α-réductases dans la stéroïdogénèse
Ces dernières décennies, des recherches ont permis de mettre en évidence l’existence de possibles altérations dans la stéroïdogénèse au niveau du CNS et plus particulièrement au niveau du cerveau dans différentes pathologies telles que la maladie d'Alzheimer, la MP, la chorée de Huntington, la sclérose en plaques et les lésions cérébrales traumatiques (Melcangi et coll., 2016). Comme décrit dans les sections
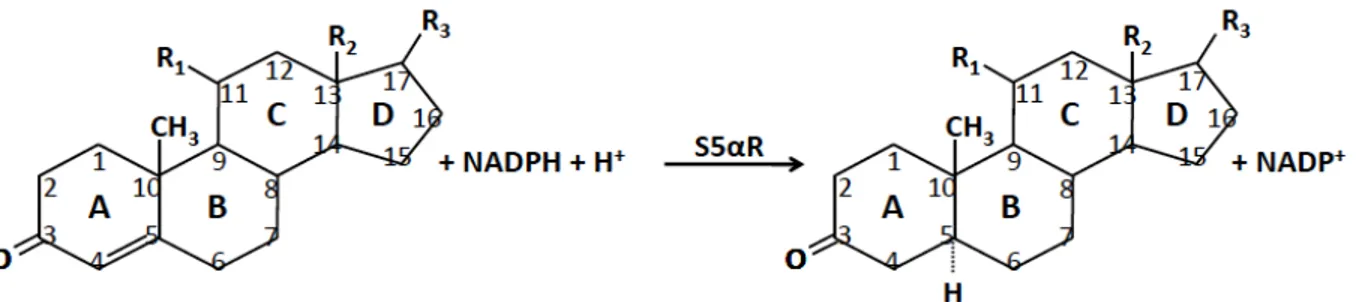
((Russell et Wilson, 1994) ; figure 5.2). Cette réaction irréversible est l’étape limitante dans la synthèse des stéroïdes neuroactifs (Russell et Wilson, 1994).
Figure 5.2. Schéma de la réaction catalysée par les 5α-réductases (S5α-R). NADP+/NADPH : nicotinamide adénine dinucléotide phosphate (Les formes réduite et oxydée). Les carbones des quatre cycles A, B, C et D du noyau cyclopentanoperhydrophénanthrène sont identifiés de C1 à C17. Schéma tiré de (Paba et coll., 2011).
La famille des 5α-Rs est constituée de cinq membres codés par cinq gènes homologues : les trois isoformes principales 5α-RI, II et III, et les deux enzymes trans-2,3-enoyl-CoA réductase (TECR et TECR-like) (Paba et coll., 2011). Parmi les cinq membres identifiés jusqu’à présent, seulement les isoformes I et II jouent un rôle central dans la stéroïdogénèse et induisent des réactions en partie redondantes (Russell et Wilson, 1994). À noter que malgré l’appellation de 5α-R III, l’isoforme III n’est pas impliquée dans la réduction des stéroïdes mais joue un rôle crucial dans la glycosylation des protéines (Cantagrel et coll., 2010). Les TECR et TECR-like participent aux réactions d’élongation des acides gras (Moon et Horton, 2003).
Les isoformes I et II sont abondamment exprimées dans plusieurs tissus périphériques et la 5α-R de type I est la forme la plus abondante dans les cerveaux adultes de rat, de souris et d’humain (Melcangi et coll., 1998; Russell et Wilson, 1994; Stoffel-Wagner, 2003; Thigpen et coll., 1993; Torres et Ortega, 2003). Leurs patrons d’expression semblent cependant être distinctivement différents.



![Fig. 7.3. Effects of MPTP and progesterone treatments on (A, B) [125I]-RTI-121 dopamine (DA) transporter (DAT) and (C, D) [3H]-dihydrotetrabenazine (TBZ-OH) vesicular monoamine transporter 2 (VMAT2) specific binding in striatum and SNpc of male C57Bl/6](https://thumb-eu.123doks.com/thumbv2/123doknet/6268922.163526/74.918.115.815.127.809/progesterone-treatments-transporter-dihydrotetrabenazine-vesicular-monoamine-transporter-striatum.webp)
![Fig. 7.4. Correlation between (A) striatal [ 125 I]-RTI-121 specific binding and striatal dopamine (DA), (B) [ 3 H]-TBZ-OH specific binding and striatal dopamine (DA), as well as (C) correlations between DAT with VMAT2 specific binding in C57Bl/6 progest](https://thumb-eu.123doks.com/thumbv2/123doknet/6268922.163526/75.918.112.670.113.638/correlation-striatal-specific-striatal-dopamine-specific-correlations-specific.webp)