HAL Id: dumas-02114637
https://dumas.ccsd.cnrs.fr/dumas-02114637
Submitted on 26 Aug 2019HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Protocole de mise en charge immédiate en implantologie
à l’aide du flux numérique
Fabien Amram
To cite this version:
Fabien Amram. Protocole de mise en charge immédiate en implantologie à l’aide du flux numérique. Médecine humaine et pathologie. 2019. �dumas-02114637�
UNIVERSITÉ NICE-SOPHIA ANTIPOLIS FACULTÉ DE CHIRURGIE DENTAIRE 24 Avenue des Diables Bleus, 06357 Nice Cedex 04
PROTOCOLE DE MISE EN CHARGE
IMMEDIATE EN IMPLANTOLOGIE A
L’AIDE DU FLUX NUMERIQUE
Année 2019 Thèse n°42-57-19-11
THÈSE
Présentée et publiquement soutenue devant
la Faculté de Chirurgie Dentaire de Nice
Le 09/04/2019 Par
Monsieur Fabien AMRAM
Né(e) le 15 11 1993 à Nice
Pour obtenir le grade de :
DOCTEUR EN CHIRURGIE DENTAIRE (Diplôme d’
É
tat)
Examinateurs :Monsieur le Professeur P. MAHLER Président du jury Monsieur le Docteur G. BORIE Directeur de thèse
Monsieur le Docteur Y. ALLARD Assesseur
Madame le Docteur V.POUYSSEGUR Assesseur
Monsieur le Docteur A. DISS Membre invité
REMERCIEMENTS
A Monsieur le Professeur Patrick MAHLER
Docteur en Chirurgie Dentaire - Docteur de l’Université Nice Sophia-Antipolis Professeur des universités – Praticien Hospitalier Je vous remercie de l’honneur que vous me faites en présidant ce jury de thèse. Je vous remercie pour votre accessibilité et votre disponibilité à mon égard. J’ai pris plaisir à vous assister et apprendre à vos côtés. Veuillez trouver ici l’expression de ma haute estime et de tous mes remerciements.A Monsieur le Docteur Gwenaël BORIE
Docteur en Chirurgie Dentaire - Docteur de l’Université Nice Sophia-Antipolis Assistant Hospitalier Universitaire Je vous remercie chaleureusement pour m’avoir suivi dans l’élaboration de ce travail. Je vous suis particulièrement reconnaissante de m’avoir conseillé, encouragé avec grande patience, humour et compétence tout au long de cette thèse. Je vous remercie de la confiance que vous m’avez accordée lorsqu’il était venu le temps pour moi de prendre la main lors d’une chirurgie implantaire. Veuillez trouver ici le témoignage de toute la gratitude et de l’amitié que je porte à votre égard.A Monsieur le Docteur Yves ALLARD
Docteur en Chirurgie Dentaire - Docteur de l’Université de Nice Sophia-Antipolis Maitre de Conférence des Universités Je vous remercie d’avoir spontanément accepté l’invitation à siéger parmi mon jury de thèse. Ces trois années au centre de soin à vos côtés ont été́ des moments forts et enrichissants. Vous avez toujours été disponible et à mon écoute. Veuillez trouver ici l’expression de ma sincère reconnaissance et de mon profond respectA Madame le Docteur Valérie POUYSSEGUR
Docteur en Chirurgie dentaire - Docteur de l’Université de Nice Sophia-Antipolis Maitre de Conférence des Universités Je vous remercie d’avoir tout de suite accepté mon invitation à siéger parmi mon jury de thèse. Au cours de mes années cliniques et universitaires j’ai pu bénéficier de votre gentillesse et de votre savoir qui m’ont été d’une grande aide. Veuillez trouver ici l’expression de mes sentiments respectueux et de ma grande sympathie à votre égard.A Monsieur le Docteur Antoine DISS
Docteur en Chirurgie dentaire - Docteur de l’Université de Nice Sophia-Antipolis Ancien Assistant Hospitalier Universitaire Je tiens à vous remercier pour votre participation à ce jury de thèse. Vous m’avez appris ce qu’est l’implantologie orale et je vous remercie de m’avoir donné goût à la dentisterie numérique. Je vous prie de trouver ici le témoignage de mon profond respect et l’expression d’une très grande admiration.A mes parents
Je tenais à vous remercier sincèrement pour l’amour et l’éducation que vous m’avez donnés. Vous avez toujours été là pour moi et vous m’avez toujours donnés les moyens pour faire ce que je souhaitais dans la vie. C’est vous que je dois remercier pour ce que je suis devenu aujourd’hui. Je suis fier de vous avoir à mes côtés à chaque grande étape de ma vie.A mon frère et ma sœur
Je vous remercie d’être là pour moi, je suis fier de la relation que nous avons tissés tous les 3 et je suis fier de ce que vous êtes devenus.A ma famille
Je remercie l’ensemble de ma famille, mes tantes et oncles, mes cousins et cousines, pour leur soutien et leur amour qui me permette de m’ épanouir jour après jour.
A mes amis
Merci à vous qui formez un pilier dans ma vie. Merci pour ces moments simples qui sont devenus inoubliables grâce à vous.SOMMAIRE INTRODUCTION ... 7 1 PHASE PRE IMPLANTAIRE ... 8 1.1 EXAMEN CLINIQUE ...8 1.1.1 Anamnèse ... 8 1.1.2 Consentement libre et éclairé ... 9 1.1.3 Examen clinique exobuccal ... 9 1.1.4 Examen clinique endobuccal... 10 1.2 EXAMEN RADIOGRAPHIQUE ... 13 1.2.1 Panoramique :... 13 1.2.2 Cone Beam : ... 14 1.2.2.1 Principes de la tomographie à faisceau conique ou Cone Beam (CBCT) ... 14 1.2.2.2 Importance de l’examen radiologique dans la planification implantaire ... 14 1.2.2.3 Buts de l’imagerie lors de la planification implantaire ... 15 1.2.2.4 Localisation des obstacles anatomiques critiques ... 17 1.3 EMPREINTE OPTIQUE ... 18 1.3.1 La méthode directe : caméra intra orale ... 18 1.3.2 La méthode indirecte : scanner optique ... 19 1.4 GUIDE RADIOLOGIQUE ... 22 1.4.1 Le guide radiologique... 22 1.4.2 Le guide numérique ... 22 2 PHASE PROTETHIQUE ... 24
2.1 MISE EN CHARGE IMMEDIATE ... 24
2.1.1 Définition ... 24
2.1.2 Stabilité primaire ... 24
2.1.3 État de surface implantaire ... 24
2.1.4 Intérêts de la MCI ... 25
2.1.5 Principes cliniques ... 26
2.2 CONCEPTION ASSISTEE PAR ORDINATEUR : WAX UP VIRTUEL... 27
2.3 FABRICATION ASSITEE PAR ORDINATEUR... 28
2.3.1 Principe de fabrication : l’usinage ... 28 2.3.2 Différents matériaux usinables ... 29 3 PHASE CHIRURGICALE ... 30 3.1 PLANIFICATION IMPLANTAIRE... 30 3.1.1 Principaux logiciels de planification ... 30 3.1.1.1 NobelClinician ... 30 3.1.1.2 Simplant ... 31 3.1.1.3 CoDiagnostiX ... 32 3.1.2 Étapes de la planification implantaire ... 33 3.2 GUIDES CHIRURGICAUX ... 41 3.2.1 Cahier des charges ... 41 3.2.2 Différents types de guides en fonction de la surface d’appui ... 42 3.2.2.1 Guide chirurgical à appui dentaire ... 42 3.2.2.2 Guide chirurgical à appui muqueux ... 43 3.2.2.3 Guide chirurgical à appui osseux ... 44 3.2.3 Principe de fabrication ... 45 3.2.4 Différents types de guides en fonction du système de guidage ... 47 3.2.4.1 Les guides à douille pilote ... 47 3.2.4.2 Les guides « douille dans douille » ... 47 3.2.4.3 Les guides à trousse spécifique ... 48
3.3 PROTOCOLE OPERATOIRE CHIRURGICAL ... 48
3.3.1 Trousse chirurgical... 48
3.3.2 Step by step ... 51
4.1 APPORT DE L’IMPLANTOLOGIE ASSITEE PAR ORDINATEUR ... 57 4.1.1 A propos de la technique d’imagerie pré implantaire... 57 4.1.2 A propos de l’empreinte optique ... 57 4.1.3 A propos de la planification implantaire ... 58 4.1.4 A propos de la chirurgie guidée ... 59 4.1.5 A propos de la CAD/CAM ... 61 4.2 COUT ... 63 4.3 INTERETS... 65 4.3.1 Conservation des données ... 65 4.3.2 Praticien débutant ... 66 4.3.3 Protocole moins operateur dépendant... 66 4.3.4 Outil de communication ... 67 4.3.5 Suites opératoires... 67 4.3.6 Gain de temps ... 68 4.4 LIMITES ET PERSPECTIVES ... 68 4.5 COMPLICATIONS... 69 CONCLUSION ... 71 BIBLIOGRAPHIE ... 72 TABLE DES ILLUSTRATIONS... 79
1 PHASE PRE IMPLANTAIRE
1.1 EXAMEN CLINIQUE
1.1.1 Anamnèse Motif de la consultation et profil psychologique Cette première étape est essentielle car il faut avant tout bien comprendre et cerner les attentes du patient, pour répondre au mieux à ses besoins. On évalue d’abord la demande: est-elle purement fonctionnel (“je veux pouvoir manger”) ou présente-t-elle aussi une composante esthétique (“je veux pouvoir sourire”) ? A cette demande esthétique sera ajoutée la notion de faisabilité́ : est-ce une demande réalisable ? Bilan médical général La première rencontre avec le patient est l’occasion de remplir son questionnaire médical. Le patient va alors faire état de différents éléments, parmi lesquels : antécédents médico-chirurgicaux, antécédents familiaux, traitement médicamenteux en cours, allergies, hygiène bucco-dentaire et tabagisme. L’analyse de ces éléments doit nous permettre de déceler les contre-indications à l’utilisation de l’implant comme thérapeutique. Ces dernières peuvent être absolues ou relatives :
Contre-indications
absolues Les patients à haut risque d’endocardite infectieuse (EI) : • Antécédents d’EI,
• Prothèses valvulaires (mécaniques ou biologiques), • Cardiopathies congénitales cyanogènes (CCC). L’infarctus du myocarde récent (moins de 6 mois) L’AVC récent (moins de 6 mois) La radiothérapie en phase active de traitement, (dose supérieure à 50 Gy) lors d’une radiothérapie cervico-faciale La chimiothérapie en phase active de traitement Les biphosphonates par voie intraveineuse. Contre-indications
relatives Générales Fort tabagisme Locales
Grossesse Diabète non équilibré L’âge : minimum à la fin de la croissance des maxillaires1 Pharmacodépendance (toxicomanie, alcoolisme). Pathologies du sinus Mauvaise hygiène bucco-dentaire Parodontopathie non traitée Certaines affections dermatologiques de la cavité buccale. Tableau 1: Les contre-indications en implantologie
Dans le cas d’un patient présentant une contre-indication relative, la décision de recourir à l’implant sera faite via une démarche réfléchie et documentée : estimation du rapport bénéfice/risque, discussion avec les médecins spécialistes, examens complémentaires. Ces contre-indications sont amenées à évoluer à mesure que des études sont réalisées. CAS CLINIQUE : Tout au long de notre travail, nous nous appuierons sur le cas de Mme C. âgée de 21 ans. Le succès d’un traitement prothétique commence donc par l’identification de la demande du patient. Mme C. consulte pour compenser l’édentement dû à une agénésie des incisives latérales maxillaires (12,22). Sa demande est donc esthétique, elle souhaite retrouver un sourire harmonieux. La patiente souffre d’une hypercholestérolémie traitée par son médecin généraliste. Elle ne présente aucune contre-indication à l’implantologie, ne souffre d’aucune allergie et ne présente aucun antécédent chirurgical.
1.1.2 Consentement libre et éclairé
Le consentement doit être libre, c’est-à-dire ne pas avoir été obtenu sous la contrainte. Éclairé suppose de s’être fait comprendre du patient en adaptant son vocabulaire car l’information doit être intelligible, simple2. En effet, avant de commencer la thérapeutique implantaire, il est une obligation : celle de l’information préalable aux traitements implantaires. Cette dernière doit être exhaustive, et contenir certains éléments parmi lesquels : l’explication des différentes alternatives thérapeutiques possibles (l’information ne doit pas se limiter à l’option implantaire), les risques inhérents aux interventions chirurgicales, le suivi post-opératoire (ses conditions, les risques d’échec) ainsi que la maintenance et les visites de contrôles3. Cette information, délivrée de manière orale au cours d’un entretien, doit aboutir à un document écrit qui sera signé par le patient avant de commencer le traitement4.
1.1.3 Examen clinique exobuccal
Évaluation de l’ouverture buccale
Lors de l’étape chirurgicale de pose implantaire, le praticien sera amené à travailler avec différents forets de différentes longueurs. L’évaluation de l’ouverture buccale lors de l’examen clinique va être primordiale pour vérifier qu’une bonne insertion de ces derniers soit réalisable, notamment au niveau des secteurs postérieurs5. Il est communément admis qu’une ouverture buccale normale correspond à une valeur comprise entre 40 et 60 mm Cette fourchette doit par contre être adaptée en fonction de la marque avec laquelle le praticien travaille6.
Examen de la dimension verticale (DV) La DV correspond à la hauteur de l’étage inférieur de la face. Une diminution de cette valeur s’accompagne généralement d’une perte de l’équilibre général de la face : équilibre occlusal, articulaire, esthétique, neuromusculaire. Ne pas rétablir une bonne DV chez un patient nous expose donc à un échec thérapeutique potentiel. Pour savoir si la DV est normale ou modifiée, trois examens peuvent être réalisés : par ordre d’importance on réalisera des tests phonétiques et de déglutitions, une analyse cutanée, et enfin une analyse des indices céphalométriques par une téléradiographie de profil. Examen du profil La valeur de l’angle naso-labial peut nous permettre d’apprécier la résorption osseuse chez les patients édentés. Un angle ouvert peut marquer une résorption du secteur antérieur maxillaire.
Examen des parties molles
Toute adénopathie ou induration des ganglions sera recherchée par un examen visuel et par une palpation du cou, de l’étage inférieur de la mandibule ainsi que de la région parotidienne. Les muscles masticateurs, les glandes salivaires et leur ostium doivent également être appréciés à l’issue de cet examen.
CAS CLINIQUE :
Notre patient présente une ouverture buccale de 3 doigts, une dimension verticale normale, une bonne symétrie faciale et aucune adénopathie détectée.
1.1.4 Examen clinique endobuccal
Examen dentaire
Un examen de l’hygiène bucco-dentaire doit être réalisé : on ne peut pas commencer une chirurgie implantaire chez un patient qui ne présente pas un contrôle de plaque rigoureux. Le brossage : combien de fois par jour, avec quel type de brosse à dents ? De plus, c’est au cours de cette première approche endobuccale que l’on va s’intéresser aux dents non conservables quelle que soit la thérapeutique envisagée. Vient enfin un examen minutieux de chacune des dents. Examen parodontal
L’examen parodontal, outre son rôle dans le dépistage des maladies parodontales, va permettre d’évaluer l’état des tissus de soutien des dents présentes : inflammation et volume des papilles et de la gencive libre, hauteur et consistance de la gencive attachée, présence de poches et importance de l’alvéolyse près du site implantaire.
Examen occlusal Les rapports entre les dents maxillaires et mandibulaires vont être objectivés par deux types d’examens : statique et dynamique. L’examen statique de l’occlusion en OIM va nous informer sur la répartition des contacts, sur la valeur du surplomb et sur la celle du recouvrement. L’examen de relation centrée (ORC) nous donnera la présence de prématurités, d’interférences travaillantes et non travaillantes. L’examen dynamique quant à lui sera réalisé par la propulsion et par les diductions à droite / gauche. Ces deux mouvements mandibulaires doivent nous donner l’aspect du guide antérieur (interférences ?) ainsi qu’un examen du guidage latéral (fonction canine, fonction groupe, partielle ou totale).
L’analyse de l’occlusion passe aussi par l’étude des facettes d’usure : ces dernières peuvent indiquer une parafonction (bruxisme, clenching, mauvaises habitudes).
Examen du sourire
La ligne du sourire est dite normale, basse, ou haute (sourire “gingival”). Cet examen va être capital en cas d’édentement intéressant le secteur antérieur, et va orienter notre décision quant au choix de l’option thérapeutique, à savoir l’utilisation ou non d’artifices prothétiques (fausse gencive en résine ou en céramique). Il parait alors intéressant de réaliser une iconographie (photographies, schémas) lors de la consultation. CAS CLINIQUE :
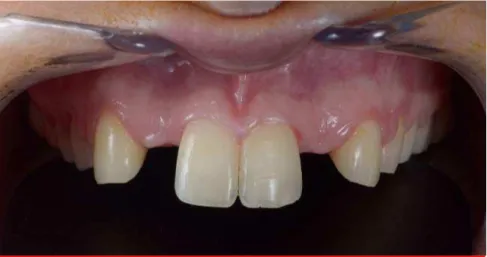
Le jour de la première consultation notre patiente a un appareil orthodontique pour aménager de l’espace aux implants au niveau des deux incisives latérales maxillaires. Mme C. présente une bonne hygiène bucco-dentaire. Toutes les dents sont présentes mise à part les incisives latérales maxillaire. Aucun autre soin n’est à réaliser. A l’examen parodontal, aucune inflammation, poche ou récession n’est détectée.
A l’examen occlusal, notre patiente ne présente pas de surplomb, la répartition des contacts est uniforme et le milieu inter incisif est en bonne position par rapport au philtre. Aucune facette d’usure n’est détectée.
La ligne du sourire est normale.
Figure 2: État initial après dépose de l'appareil orthodontique vue de face Figure 3: État initial vue du côté droit et gauche
Figure 4: État initial en occlusion vue de face
Quelles implications cliniques ?
La densité osseuse influe sur la séquence de forage ainsi que sur le choix du design implantaire14. L’évaluation de la qualité osseuse est importante afin de réaliser un acte chirurgical atraumatique tout en optimisant l’ancrage primaire de l’implant, garant de son ostéointégration15. Le choix du protocole chirurgical, de l’état de surface ainsi que de l’anatomie implantaire dépend directement de la densité́ osseuse, son analyse radiologique constitue donc un élément capital lors de la planification implantaire.
àL’imagerie tridimensionnelle est le meilleur examen radiologique pour réaliser une analyse morphologique et qualitative de l’os résiduel16. Volume osseux minimal et règles de positionnement tridimensionnel L’imagerie pré-implantaire doit également être capable de renseigner de façon précise le volume osseux résiduel. En effet, un volume minimum est nécessaire dans les 3 plans de l’espace afin de pouvoir mettre en place un ou plusieurs implants sans endommager les structures anatomiques adjacentes17.
Ce volume découle des règles de positionnement implantaire, que nous rappellerons brièvement :
1. Dans le sens vestibulo/lingual : des lamelles osseuses d’au moins 1 mm doivent être présentes de part et d’autre de l’implant (on passe à 2 mm en secteur esthétique) ;
2. Dans le sens vertical : le col de l’implant doit se trouver entre 1 et 3 mm apicalement au collet des dents adjacentes. De plus, il est nécessaire de respecter une marge de sécurité́ de 2 mm par rapport aux obstacles anatomiques. 3. Dans le sens mésio/distal : une distance de 1,5 à 2 mm entre dent et implant est nécessaire, elle est d’au moins 3 mm entre 2 implants contigus. àSi la quantité d’os n’est pas suffisante, il faut s’orienter vers des aménagements osseux préalables.
Cette analyse initiale est capitale puisque ce sont ces informations qualitatives et quantitatives qui vont permettre de poser l’indication de la technique chirurgicale pouvant être utilisée (deux temps chirurgicaux, un temps chirurgical, mise en charge immédiate) ainsi que des moyens chirurgicaux à mettre en œuvre pour permettre son succès (sous-dimensionnement des puits de forage, ancrage bicortical, taraudage)18. Intérêts de l’implantologie assistée par ordinateur (IAO) dans cette application Les logiciels d’IAO permettent de déterminer la densité osseuse péri-implantaire et de ce fait d’optimiser le positionnement implantaire tridimensionnel par simulation en fonction de cette donnée précieuse.
D’autre part, lorsque le volume osseux est insuffisant ou mal situé par rapport aux exigences prothétiques, il est nécessaire de recourir à des greffes osseuses19. Ce type d’intervention plus ou moins lourd et invasif rallonge considérablement la durée globale du traitement et va de pair avec une augmentation non négligeable du coût de la réhabilitation20.
Nous verrons que l’IAO s’impose aujourd’hui comme une alternative à ces augmentations osseuses en optimisant le volume osseux disponible au niveau du site implantaire grâce à une analyse fine et précise des bases osseuses.
1.2.2.4 Localisation des obstacles anatomiques critiques
L’imagerie consacre par ailleurs un intérêt particulier à la localisation précise de certaines structures anatomiques dites « à risque » afin de conserver une marge de sécurité par rapport à celles-ci au cours de la chirurgie. Les logiciels de simulation apportent une aide complémentaire en autorisant la mise en évidence de ces obstacles anatomiques21. Il conviendra de rappeler brièvement les principales structures anatomiques à identifier au stade de la planification, sous peine de les endommager durant la chirurgie implantaire22.
• Le sinus maxillaire
L’imagerie doit pouvoir renseigner l’anatomie sinusienne ainsi que ses particularités, avec notamment :
1. La présence de septa, correspondant à des cloisons osseuses dont la présence peut modifier le protocole chirurgical car impliquant un risque majoré de perforation de la membrane sinusienne23;
2. L’état de la membrane de Schneider ainsi que la perméabilité de l’ostium24 ; 3. La présence d’une pathologie sinusienne, notamment si une greffe de sinus est
envisagée ; 4. La position de l’artère alvéolo-antrale également dans le cas d’une greffe par voie d’abord vestibulaire. • Le canal dentaire inferieur Principal obstacle anatomique à la mandibule, la lésion de son paquet vasculo-nerveux induit un risque neurologique majeur. C’est la raison pour laquelle une marge de sécurité de 2 mm doit impérativement être respectée vis à vis de celui-ci afin de préserver les petites ramifications nerveuses pouvant être comprimées lors de la chirurgie25. • Le foramen mentonnier L’émergence du nerf mentonnier présente parfois une boucle antérieure qu’il convient de détecter radiologiquement étant donné que son anatomie est inconstante. Une distance de sécurité́ de 2 mm doit également être préservée ici. • Vaisseaux et risque hémorragique
Lors d’une chirurgie implantaire intéressant la zone postérieure mandibulaire, l’application d’un axe ou d’une profondeur de forage ne tenant pas compte du relief mandibulaire peut conduire à une perforation de la corticale interne, associée à un risque d’atteinte du réseau vasculaire à l’origine d’hémorragies sous-mylohyoidiennes26. Il convient donc de repérer la présence de concavités linguales à la mandibule, impliquant
un risque de lésion des artères submentale et sublinguale ou encore d’atteinte du nerf lingual27. àRemarque : Deux points importants se dégagent ici : 1. L’importance de disposer d’une technique d’imagerie de qualité alliant fiabilité, précision et permettant de localiser rigoureusement ces obstacles anatomiques à risque : intérêt de l’imagerie sectionnelle. 2. La nécessité d’intégrer ces informations cruciales lors de la phase chirurgicale : intérêt des guides chirurgicaux et de la chirurgie assistée par ordinateur. L’IAO s’impose alors comme un outil de choix dans ces 2 applications majeures. CAS CLINIQUE : Mme C. ne présente aucune image péri apicale à la radio et aucune restaurations sur les dents présentes. Elle présente un bon niveau osseux et assez d’espace dans la région des incisives latérales maxillaire. Aucune greffe osseuse n’est nécessaire. Les sites d’implantations sont à distance des zones anatomiques critiques.
1.3 EMPREINTE OPTIQUE
Il existe deux méthodes pour obtenir le modèle virtuel :1.3.1 La méthode directe : caméra intra orale
La méthode directe (ou empreinte optique) se fait à l’aide d’une caméra intraorale. Elle a l’avantage d’être en couleur et d’apporter des informations sur les tissus mous (ligne muco-gingivale, aspect de la gencive, biotype parodontal) qu’il est impossible d’avoir sur un modèle en plâtre.
La prise d’empreinte avec une caméra intraorale est une numérisation optique sans contact des surfaces dentaires et des tissus mous adjacents par balayage d’un faisceau lumineux. Les technologies des caméras varient sensiblement les unes par rapport aux autres, et l’acquisition des points se fait soit par triangulation, soit par projection de franges de lumière, soit par imagerie parallèle confocale, soit par vidéo stéréophotogrammétrique. Dans tous les cas, le rayon incident est réfléchi par la surface scannée. Mais la qualité du rayon réfléchi dépend de la réflectivité des surfaces à numériser, c’est à dire de la capacité des surfaces à retourner le signal lumineux émis vers le capteur.
Or, nous sommes confrontés à un grand nombre de matières différentes (email, céramique, métal, tissus mous, etc.) dont la réflectivité est variable mais peut être améliorée et uniformisée par poudrage de dioxyde de titane, en prenant garde de ne pas introduire des erreurs d’acquisition à cause d’une épaisseur de poudre trop importante qui fausserait l’enregistrement tridimensionnel des surfaces. Le retour de ce rayon va être enregistré par le capteur photographique de la camera.
1.4 GUIDE RADIOLOGIQUE
1.4.1 Le guide radiologique
Le guide radiologique est le maillon indispensable pour transférer le projet prothétique sur l’imagerie numérique 3D. Il est le reflet exact du projet prothétique. Ce guide est utilisé lors de la prise du scanner afin de visualiser la future prothèse par rapport aux structures osseuses et dentaires. Les objectifs du guide sont multiples32 : • Faire apparaitre sur l’imagerie 3D les dents à remplacer. Déterminer leurs contours ainsi que leurs axes. • Différencier le masque des dents du masque de la base. • Déterminer le volume de muqueuse sous le guide. • Évaluer la proximité entre les dents et les structures anatomiques. • Évaluer le volume manquant dans les zones édentées. • Être stable et bloquer les arcades lors de la prise du scanner.
Il existe plusieurs types de guides radiologiques. Ils sont généralement fais de résine acrylique ou d’une plaque thermoformée avec des repères radioopaques de différentes formes, ou des dents barythées visibles sur l’imagerie 3D. Les guides radiologiques les plus simples sont des prothèses dans lesquelles des repères radioopaques (gutta-percha, billes métalliques, cylindre de titane) ont été insérés. On trouve aussi des guides barythés entièrement radioopaques : une plaque de résine thermoformée contenant des sels radioopaques et des dents barythées forment un guide modélisant la future prothèse. La réussite du traitement est à ce stade dépendante de la stabilité du guide et de la position de celui-ci lors de la prise du scanner. L’examen radiologique doit alors être réalisé avec le guide en bouche. Les données ainsi recueillies ne seront exploitables que si le guide est bien plaqué contre la muqueuse et dans une position stable et reproductible lors de l’acquisition. Cependant, la réalisation d’un guide radiologique pose plusieurs limites. Elle nécessite au moins un rendez-vous supplémentaire avec le patient pour essayer le guide. Et elle ne peut être mise en œuvre dans le cas d’extraction/implantation immédiate33. 1.4.2 Le guide numérique A l’opposé du guide radiologique, le guide numérique : sa réalisation est extrêmement attirante puisqu’elle se fait entièrement de manière numérique, du projet prothétique à la planification implantaire. En effet, aucune plaque à mordre ne sera nécessaire, aucun modèle en plâtre ne sera à couler et aucune cire de diagnostic ne sera à réaliser.
Un scan optique de la surface externe de l’arcade concernée et un balayage radio- graphique tridimensionnel suffisent pour commencer la planification.
Si le praticien ne possède pas de caméra intra orale pour la réalisation de l’empreinte numérique celui-ci aura la possibilité d’envoyer un modèle en plâtre au laboratoire qui se chargera de le scanner et le superposer à la radiographie 3D.
La précision et la fiabilité du guide découlent directement de ces deux données. En effet, le laboratoire va se baser uniquement sur celles-ci pour concevoir un guide qui viendra prendre appui sur des dents. L’enregistrement de ces dents doit donc être le plus exempt d’artefacts que possible. Plus on enregistre une grande partie de l’arc, plus on augmente les chances d’avoir le plus de dents sans artefacts.
On observe que l’on peut résoudre ce problème lié aux artefacts métalliques en transmettant un modèle coulé en plâtre (issu d’une empreinte classique), qui sera ensuite scanné par le laboratoire pour coupler les données optiques à la radiographie 3D.
Les avantages du guide radiologique numérique34:
• Une économie de temps : on ne perd pas une séance, en l’occurrence à réaliser l’empreinte, pour que le prothésiste fabrique un guide radiologique dont l’ajustage et la stabilité devront être contrôlées, et le cas échéant renvoyées pour des corrections. En effet, on réalise le guide radiologique numérique dans la même séance que l’acquisition 3D (Cone Beam)
• Une économie en termes d’argent : il n’y a pas de guide radiologique à facturer. L’économie peut par exemple être d’une cinquantaine d’euros en moyenne (40 euros le guide, 15 euros de frais de livraison)
• L’absence d’erreurs dues à un mauvais positionnement du guide lors de
l’acquisition 3D.
• Une proposition prothétique est rapidement disponible, et surtout visible, permettant, pour le praticien d’avoir une excellente base pour discuter avec le patient, et pour ce dernier d’augmenter sa compréhension du futur traitement ainsi que sa motivation.
• Le « wax-up numérique » laisse la possibilité de supprimer ou d’ajouter le guide numérique sur le scanner lors de la planification. Il est également possible de supprimer sélectivement les dents et/ou les tissus mous, permettant par exemple une bonne vision du travail à effectuer en termes de gestion des tissus mous.
• Même s’il n’a pas été prévu initialement de faire une chirurgie guidée, le fait de disposer d’une empreinte optique et d’une simulation numérique laisse une certaine souplesse au praticien qui peut finalement opter pour la commande d’un guide chirurgical pour sécuriser son geste. Les inconvénients du guide radiologique numérique : • Cette technologie n’est pas utilisable si beaucoup d’artefacts dus à des éléments métalliques sont à attendre. • Technique utilisable uniquement pour des cas intéressant des édentements de faible étendue.
2 PHASE PROTETHIQUE
2.1 MISE EN CHARGE IMMEDIATE
2.1.1 Définition La définition exacte de ce qu’est une mise en charge immédiate a été largement débattue. Certains en ont une vision contraignante. Ils considèrent qu’on ne peut parler de mise en charge immédiate que si la prothèse est immédiatement mise en occlusion (Cooper et coll. 2002)35. Pour d’autres, le fait de reconstruire une prothèse même si elle est laissée en sous-occlusion constitue déjà une mise en charge (Szmukler-Moncler et coll. 1998)36.
La définition exacte de la mise en charge immédiate quant à l’intervalle de temps qui peut s’écouler entre la pose et la mise en charge a aussi été l’objet de discussions. Les conceptions sont plus ou moins étroites. Certains considèrent qu’on ne peut parler de mise en charge immédiate que si la prothèse est délivrée lors de la même séance (Cooper et coll. 2002)37, d’autres le même jour (Aparicio et coll. 2002)38, dans les 48 heures (Cochran et coll. 2004)39, dans les 78 heures (Szmukler-Moncler et coll. 1998)40 ou même durant la première semaine (Glauser et coll. 2001)41. L’exacte définition importe peu au clinicien, sa pertinence n’est qu’académique car elle ne repose pas sur des bases biologiques en rapport avec des réponses osseuses distinctes. Le praticien désire simplement connaître la viabilité et la reproductibilité de toutes les situations prothétiques, en occlusion ou en sous-occlusion, réhabilitées dans la même séance ou au terme d’une semaine. D’un point de vue sémantique, nombreux sont ceux qui préfèrent parler de temporisation immédiate lorsque la prothèse implanto-portée est en sous-occlusion et de mise en charge immédiate lorsqu’elle est mise en occlusion42. 2.1.2 Stabilité primaire L’obtention de l’ostéointégration repose sur l’absence de mouvement de l’implant dans l’os durant la phase de cicatrisation. Lors de la pose d’un implant dentaire, un défaut osseux est réalisé lors du forage, l’implant est ensuite vissé dans son emplacement. La stabilité primaire de l’implant est définie comme la stabilité mécanique de celui-ci juste après son insertion. Le protocole de MCI repose sur une excellente stabilité primaire. Elle est donnée par le contact que l’implant a avec l’os environnant et va dépendre de la qualité du forage, de la qualité de l’os et de la forme de l’implant. Pour augmenter la stabilité primaire, on pourra : • adapter la technique de forage dans un os peu dense en réduisant la longueur et le diamètre des forages, ou en utilisant des impacteurs afin de condenser l’os environnant43.
• utiliser des implants présentant une certaine conicité44.
2.1.3 État de surface implantaire
Jusqu’ici, les implants utilisés présentaient une surface machinée, c'est-à-dire, dont la surface possède une légère rugosité due à l’usinage de la pièce (Fig. 4). Cette surface a
• dans le cas de sites post-extractionnels, de mieux maintenir le capital osseux de l’alvéole et de préserver au mieux le volume de la gencive marginale et des papilles de la dent fraichement extraite (Esposito et coll. 2010 ; Sanz et coll. 2012)50 51; • d’exercer sur les implants des contraintes mieux définies que celles exercées par une prothèse de temporisation amovible mal ajustée, surtout chez l’édenté total. Pour le praticien, ce protocole permet :
• de palier l’inconfort prothétique, esthétique et fonctionnel, des solutions amovibles de temporisation;
• de diminuer le temps total du traitement, c’est-à-dire éviter les nombreuses séances d’ajustements et de rebasage à la résine molle 2.1.5 Principes cliniques Pour obtenir l’ostéointégration en dépit des forces exercées sur l’implant, il est nécessaire de maintenir les micromouvements en deçà du seuil de tolérance de l’implant considéré entre 30 et 150 micromètres selon les états de surface (Szmukler-Moncler et coll. 1998, 2000)52 53. Pour ce faire, les contraintes exercées à l’interface os-implant doivent être optimisées. Elles sont la résultante de l’expression des facteurs relatifs à l’implant, à l’hôte et aux forces exercées sur l’implant. Pour optimiser cette résultante, il est simultanément nécessaire de : 1. Optimiser la stabilité primaire à l’aide des facteurs suivants : • Bonne qualité osseuse • Morphologie implantaire appropriée • Sous préparation du lit implantaire • Forage apicale de l’alvéole d’extraction (3-5 mm)
2. Minimiser les contraintes exercées à l’interface os-implant à l’aide des facteurs suivants : • Solidariser les implants • Augmenter le nombre d’implants • Mieux distribuer les implants • Mettre en sous occlusion • Orienter les forces dans l’axe implantaire • Utiliser un implant à surface rugueuse
Cependant, le praticien possède la liberté de jouer avec ces facteurs. Par exemple : solidariser des implants permet d’augmenter les forces tout en maintenant le niveau des contraintes à un niveau tolérable, une prothèse en occlusion est alors envisageable ; maintenir en sous-occlusion un implant non solidarisé permet d’envisager un meilleur pronostic54.
2.3.2 Différents matériaux usinables PMMA (Polyméthacrylate de Méthyle) : Les dents provisoires implanto-portées peuvent alors être usinées dans des disques de résine PMMA (Polyméthacrylate de Méthyle) de teinte variables ou dans un seul disque multicouches en dégradé de teintes, puis collées sur des piliers temporaires en titane. Les machines peuvent usinées d’autres matériaux selon les indications : • CHROME COBALT : pour les chapes ou armatures • TITANE : piliers ou armatures • ZIRCONE : piliers, infrastructure, couronne monobloc… • CERAMIQUE : inlay, onlay, couronne… • CIRE : montage directeur, essayage esthétique…
• PEEK (PolyEtherEtherKetone) : essayage esthétique, validation de projet prothétique… Figure 17: Différents disques d’usinage, de gauche à droite : PMMA, Zircone, Titane Figure 18: Prothèse provisoire en PMMA de 12 et 22 de Mme C.
3.1.1.3 CoDiagnostiX
Ce logiciel est actuellement commercialisé par Dental Wings (Canada). Sa bibliothèque implantaire est entièrement ouverte.
C’est ce logiciel dont nous avons choisis de développer la séquence car il permet la continuité du flux numérique au sein du cabinet.
Figure 21: Capture d’écran du logiciel CoDiagnostiX
Il est possible d’importer des éléments prothétiques depuis DWOS (logiciel de Dental Wings vus précédemment) vers coDiagnostiX afin de prendre en compte la forme de la couronne, par exemple, pour un positionnement optimal de l’implant. Cette intégration des différents types d’information améliore l’ajustement de la restauration et du coup, la qualité du traitement offert au patient.
coDiagnostiX permet aussi d’exporter les données de planification préopératoire vers toute solution de CFAO ouverte afin d’intégrer au processus la conception et la fabrication des piliers de cicatrisation et des prothèses provisoires.
DWOS intègre coDiagnostiX grâce à DWOS Synergy. Cet outil de communication synchronise la planification et la conception entre les 2 stations. Avec l’aide de cette nouvelle technologie, les prothésistes dentaires et les dentistes peuvent travailler ensemble en temps réel pour déterminer la position optimale permettant d’atteindre le résultat escompté et pour concevoir les prothèses le plus adaptés à la situation clinique du patient. Ce flux de travail numérique facilite la collaboration entre les spécialistes dentaires et améliore la qualité des traitements59.
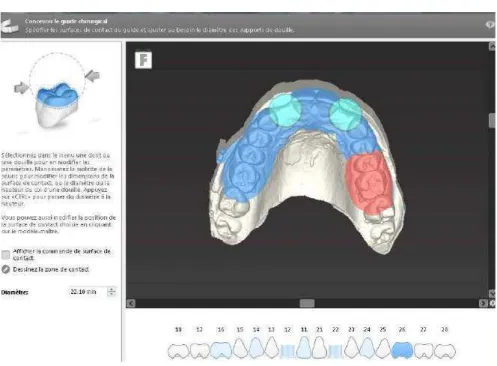
• Conception du guide chirurgical
Cette étape permet la conception du guide de forage numérique. D’abord, on détermine les surfaces d’appuis du guide. Ensuite, on peut modifier l’épaisseur du guide ainsi que le décalage entre le guide et les surfaces de contact afin d’augmenter sa stabilité. Enfin, on ajoute les fenêtres de contrôle visuel d’insertion du guide en bouche, à distance des douilles. On peut également personnalisé la surface externe du guide en y ajoutant le nom du patient par exemple pour facilement l’identifier après la stérilisation. A la fin de cette étape, la planification est terminée. Figure 33: Fenêtre de détermination des surfaces d’appuis du guide Figure 34: Fenêtre de visualisation du guide avant impression
3.2 GUIDES CHIRURGICAUX
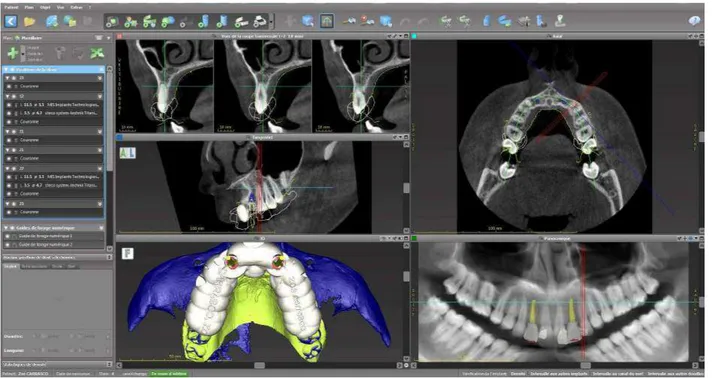
L’un des principaux intérêts de l’IAO est la chirurgie guidée lors de la pose d’implants. Pour ce faire, il a fallu mettre au point des artifices capables d’effectuer le transfert fiable et précis des données de la planification implantaire virtuelle réalisée sur les logiciels dédiés au niveau du site chirurgical61. Ce transfert intéressant à la fois le volet prothétique et chirurgical est aujourd’hui possible par l’intermédiaire de guides chirurgicauxréalisés par CFAO62. La position optimale de l’implant d’un point de vue prothétique et anatomique est à ce stade connue. La dernière étape de la planification implantaire consiste en la réalisation d’un guide chirurgical, il permet de transposer la simulation réalisée au préalable avec la cavité buccale du patient. Ils se composent d’une base en résine percée de trous dont le rôle va être de guider les instruments de forage permettant de réaliser le forage préalable à la pose de l’implant. Si les premières chirurgies guidées étaient conçues pour être utilisées selon une séquence ordonnée de plusieurs guides (chacun présentant des cylindres de guidage de taille croissante), aujourd’hui la procédure est grandement simplifiée : un seul et unique guide sert à l’ensemble de l’acte Plusieurs types de guides existent et sont notamment caractérisés par le procédé mis en jeu lors de leur fabrication ainsi que le type d’appui qu’ils présentent. Indépendamment de cela, leurs objectifs sont les mêmes : ils doivent être capables d’intégrer les différents paramètres déterminés lors de la planification rigoureuse ayant précédé leur élaboration, autorisant ensuite son transfert précis et le moins invasif possible au niveau du site implantaire retenu.
3.2.1 Cahier des charges
Le guide chirurgical idéal doit satisfaire un cahier des charges63 :
• Il est stable, le plus immobile possible en fonction de son support
• Il est rigide, le moins de déformation possible pour avoir une précision chirurgicale • Son positionnement est reproductible, des fenêtres au niveau des dents seront planifiées avant l’impression du guide afin de vérifier son enfoncement • Sa mise en place ainsi que sa dépose est facile • Il permet un contrôle tridimensionnel du positionnement implantaire • Il n’interfère pas avec le geste chirurgical et les tissus mous environnants
• Il est le moins encombrant possible et doit tenir compte de l’ouverture buccale du patient lors de la séquence de forage • Il est adapté au type d’édentement (appui dentaire, muqueux, osseux) • Il est stérilisable
3.2.2 Différents types de guides en fonction de la surface d’appui
Les guides chirurgicaux réalisés par CFAO peuvent présenter 3 types d’appuis : dentaire, muqueux ou osseux64.
3.2.2.1 Guide chirurgical à appui dentaire
Ce guide comme son nom l’indique a pour appui les dents résiduelles qui bordent l’édentement. Les Indications Ce guide est indiqué dans les cas d’édentement partiel antérieur ou postérieur encastré et particulièrement pour les édentements unitaires antérieurs. Il est aussi indiqué dans les édentements terminaux ou distaux, mais la zone édentée doit être inférieure à 30mm. Il permet d’effectuer des chirurgies avec ou sans lambeau. Les Caractéristiques C’est le guide le plus facile à réaliser, le plus simple à mettre en place et à manipuler. Il est également le plus précis de tous les guides chirurgicaux, surtout quand il s’agit d’un édentement encastré. Les dents sont indéformables, le guide chirurgical qui s’encastre dessus doit être le plus précis possible et ne doit subir aucune approximation. Pour ce type de guide, il est nécessaire de passer par un modèle en plâtre ou par une empreinte à partir de laquelle on va générer un fichier STL pour la superposition aux informations obtenues grâce à l’examen radiographique. Stabilité et précision
Le guide doit être maintenu au contact des dents tout au long de la chirurgie de façon ferme. Toutefois une pression trop exagérée pourrait déformer le ligament alvéolo-dentaire des dents d’appuis qui risquent alors de s’enfoncer. Cela pourrait par conséquent compromettre la précision du transfert des points de repère et donc celle du forage. Le guide chirurgical à appui dentaire utilisé dans le cas d’édentement encastré est le plus stable.
Par ailleurs, dans un cas d’édentement terminal (postérieur), il faut veiller à bien maintenir le guide au niveau des dents sans exercer de pression sur sa partie postérieure, comportant les douilles de forage, et dont l’appui est muqueux.
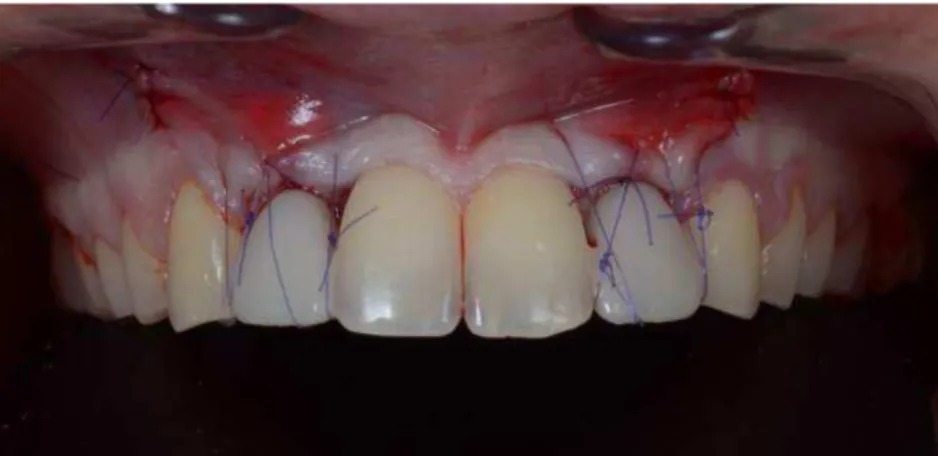
• Vissage de la prothèse fixée immédiate
Les prothèses provisoires sont vissées, des plots de composites sont réalisés afin de pouvoir tracter la gencive coronairement à l’aide des sutures. Figure 57: Vue de face à la fin de la chirurgie
Figure 58: Vue de droite à la fin de la chirurgie
Figure 59: Vue de gauche à la fin de la chirurgie
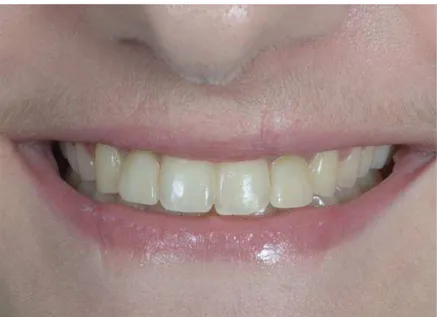
• Contrôle à 3 mois Figure 60: Cicatrisation avec prothèses provisoires, vue de face Figure 61: Cicatrisation avec prothèses provisoires, vue du côté droit et gauche Figure 62: Ligne du sourire avec prothèses provisoires le jour du contrôle
4 DISCUSSION
4.1 APPORT DE L’IMPLANTOLOGIE ASSITEE PAR ORDINATEUR
4.1.1 A propos de la technique d’imagerie pré implantaire
L’imagerie tridimensionnelle revêt aujourd’hui un véritable intérêt lors du diagnostic pré- implantaire malgré les doses d’irradiation supérieures qu’elle délivre par rapport à l’imagerie classique. Elle permet en effet de collecter des informations fines et précises qui vont orienter le plan de traitement, notamment dans la prise en charge de cas complexes pour lesquels elle apparaît aujourd’hui comme incontournable.
Elle est de ce fait justifiée à chaque fois qu’elle apporte une sécurité accrue au bon cheminement de la thérapeutique implantaire après avoir pesé la balance bénéfice/coût + irradiation.
L’IAO fait donc intervenir une imagerie volumique apparaissant comme le gold standard au stade de la planification implantaire. Ce concept présente également l’avantage de réaliser un seul cliché servant de base à la planification implantaire d’emblée et évite de ce fait la multiplication d’acquisitions radiologiques souvent inutiles (RA, panoramique puis scanner si nécessaire). Quelle précision attendre de l’imagerie tridimensionnelle ? Qu’il s’agisse du scanner ou bien du Cone Beam, un logiciel informatique reconstitue le volume analysé après l’acquisition puis segmente ce dernier afin d’obtenir des images de coupes. La précision de la segmentation du Cone Beam est de 95% (Loubele et coll. 2008). L’étude de ces auteurs, réalisée avec 5 Cone Beam différents, a montré une corrélation de 95% entre les mesures réelles et celles obtenues sur les images volumiques70. De plus, quelle que soit la technique radiologique utilisée (Cone Beam ou scanner), la précision de mesure est de l'ordre de 0,25mm, ce qui peut donc mener à des sur ou sous-estimations en terme de volume osseux disponible71.
4.1.2 A propos de l’empreinte optique
L’empreinte optique en amont de la chirurgie mais aussi lors de la phase prothétique final présente de nombreux avantages : • Précision : bien supérieur comparé à l’empreinte conventionnelle en évitant les problèmes de stabilité des matériaux par élimination de l’utilisation des matériaux à empreinte et du plâtre72.
• Gain de temps : au fauteuil et au laboratoire (pas de coulée en plâtre et de technique de cire perdue). Le temps est réduit d’environ 70%. Lorsqu’une zone est mal enregistrée, en numérique, seule la zone mal définie est à nouveau enregistrée contrairement à l’empreinte classique, laquelle doit être refaite entièrement73. • Coût des composants : aucun achat des transferts d’empreinte, porte-empreinte,
analogues d’implant et matériaux d’empreinte. Seulement les scan body (réutilisables) pour la prothèse définitive.
• Confort des patients : on évite d’activer le réflexe nauséeux chez certains patients, l’attente au fauteuil est moins longue, la bouche reste peu de temps ouverte. • Technique facile mais nécessite une courbe d’apprentissage.
• Nombre de séances cliniques réduites : on n’a besoin que de deux rendez-vous. Un pour l’empreinte optique et le Cone Beam, l’autre pour la chirurgie et la pose de la prothèse provisoire.
• Respect des tissus mous : pas de compression de la gencive lors de la prise d’empreinte. Mais cette technique présente aussi ses limites : • L’expérience : cette technique demande une certaine expérience en CFAO pour pouvoir entreprendre l’empreinte dans des brefs délais. • Coût : les coûts sont élevés au démarrage pour l’achat des scanners intra- oraux et peuvent limiter leur utilisation. • Accès aux parties postérieures : dans certaines situation le balayage des parties postérieures sont difficiles voire impossibles comme pour les patients ayant une ouverture buccale limitée. • La présence de salive : peut perturber la précision de l’empreinte optique. Mais on retrouve ce problème également pour les techniques d’empreintes conventionnelles74.
• L’utilisation de la poudre : pour certaines caméras, l’épaisseur de la poudre peut compromettre la précision des empreintes. Cependant, une étude a montré qu’il n’y avait pas d’écart de précision d’empreinte entre l’empreinte utilisant de la poudre et l’empreinte extra-orale non poudrée sur un modèle en plâtre d’un même patient75.
4.1.3 A propos de la planification implantaire
Il s’agit alors d’une planification implantaire à la fois prothétique et chirurgicale, didactique et interactive, qui permet de visualiser correctement le projet implantaire. L’utilisation de ces programmes de simulation implantaire apporte un réel plus dans la planification des cas complexes et ce, sans étape clinique supplémentaire. La réalisation d’une telle planification permet en effet la visualisation d’un plus grand nombre d’éléments anatomiques, chirurgicaux et prothétiques. Elle est par ailleurs précise et transposable de façon fiable à la phase chirurgicale. Pour Jacobs, la prédictibilité de ce type de simulation est bien réelle puisque, comparée à une étude pré-implantaire sans l’utilisation de guide chirurgical spécifique, elle retrouve :
• Une meilleure concordance entre le site implantaire retenu lors de la simulation et le site implanté ;
• Une meilleure prédictibilité quant au choix de la taille et du diamètre implantaire ;
• Une meilleure prévisibilité des complications anatomiques76. : dans les situations de volume osseux réduit ou de proximité d’obstacles anatomiques, l’implantation guidée semble permettre une sécurité accrue, du moins par rapport à la méthode conventionnelle.
Ces avantages permettent la réalisation d'une prothèse transitoire avant même la pose des implants : une mise en charge immédiate peut être ainsi plus facilement réalisée si l'indication est posée77.
4.1.4 A propos de la chirurgie guidée Selon Behneke et coll. (2012), la chirurgie guidée consiste en un protocole qui aboutit à l'élaboration d'un guide chirurgical. Ce dernier permet la mise en place des implants dans la position prédéfinie par le projet prothétique. Son autre rôle est le respect à la fois des structures anatomiques, du point d'émergence, de l'axe de forage et du forage lui-même78. La chirurgie guidée comporte de nombreuses étapes. En conséquence, cette technologie n'est pas exempte d'erreurs et, souvent, c'est l'accumulation de celles-ci qui induit un manque de précision. Nous verrons donc dans ce chapitre les avantages et inconvénients de cette technique ainsi que son degré de précision. Avantages Avec l'essor rapide de cette technologie, l’ITI s'est réuni en 2009 avec pour objectif de prouver la valeur clinique et les avantages de l'implantologie assistée par ordinateur79. Les spécialistes présents lors de l’ITI 2009 sont parvenus à définir les aspects suivants : • Cette technologie est suffisamment précise pour justifier son utilité ;
• Elle réduit la probabilité d'endommager une structure anatomique importante (sinus maxillaire, nerf alvéolaire inférieur, fenestration osseuse) ; • Elle peut permettre de réaliser des forages sans lambeau ; • Elle peut entrainer une réduction du stress pour l'équipe chirurgicale ; • Elle peut être utilisée comme outil pédagogique ; • Elle peut être utile en cas d'anatomie complexe et de chirurgie mini-invasive ; • Elle peut être utile en cas de chirurgie critique (en termes de temps, en relation avec un traumatisme antérieur par exemple) avec mise en charge immédiate. Inconvénients
Les auteurs de ce consensus émettent des réserves sur certains points lors de la réalisation d'une chirurgie guidée :
• Il faut prêter attention à la courbe d'apprentissage, les principales erreurs rapportées étaient dues à un mauvais positionnement du guide chirurgical en bouche. De grandes précautions doivent donc être prises dans les premiers stades d'acquisition de ces compétences ;
• Les attentes des praticiens et les démarches commerciales faites par les différentes marques sont parfois trop éloignées de la réalité tant au niveau de l'efficacité que de la facilité d'utilisation. De plus, le développement très rapide de cette technologie ne laisse pas assez de temps pour que des études soient publiées sur le sujet, pour contredire ou approuver les dires des entreprises qui commercialisent cette technologie. Cette technique présente également certaines sources d’erreurs, que nous exposons dans la partie suivante.
En ce qui concerne les pièces supra-implantaires (piliers, couronnes), l’utilisation de ce procédé présente trois mérites : la précision, la durabilité, et la simplicité de fabrication87. Cependant, l’idée que les éléments produits en CAD/CAM sont plus précis que ceux produits par la méthode de cire perdue/coulage n’est basée que sur le fait que le premier procédé s’affranchit d’étapes, et donc d’erreurs potentielles, liées à l’intervention de l’homme (empreinte, coulée, etc.).
Boitelle et al. (Nov. 2014)88 ont publié une revue systématique portant sur l’évaluation de l’adaptation de couronnes réalisées en CAD/CAM. Il ressort de l’analyse de la littérature (90 études retenues pour 142 exclues) qu’il est possible d’atteindre un joint dent/prothèse inférieur à 80μm, concluant que la CAD/CAM tendait à améliorer la qualité moyenne de l’adaptation des prothèses, en comparaison avec celles obtenues de manière conventionnelle. Au total, 26 systèmes ont été inclus dans cette étude.
Ces remarques s’appliquent au domaine de la prothèse supra-implantaire : les étapes éliminées par la CAD/CAM permettent la simplification du protocole et une baisse du nombre de matériaux à manipuler.
Une étude de Parpaiola et al. (2013)89 montre déjà que les pièces supra-implantaires personnalisées issues de la CAD/CAM possèdent en commun la grande majorité des avantages des pièces supra- implantaires coulées ou standard (non personnalisées), qu’elles aient été créées via un « wax-up » numérique ou par empreinte d’un « wax-up » conventionnel. L’un des grands avantages de cette technique est que tous les paramètres sont personnalisables, que ce soit par exemple l’épaisseur, la hauteur ou le profil d’émergence.
La réalisation du « design » des pièces nécessite néanmoins le suivi d’une courbe d’apprentissage, même si les logiciels de CAD/CAM deviennent de plus en plus per- formants et ergonomiques dans la modélisation au fur et à mesure de leurs mises à jour et de leur développement.
Si sa conception est bonne, et si les différentes valeurs définissant les caractéristiques de la prothèse (intensité des points de contact, intensité des contacts occlusaux, épaisseurs de matériaux, etc.) sont bien choisies, le praticien ou le prothésiste va alors rarement avoir besoin d’effectuer des retouches sur l’élément usiné, réduisant par conséquence le temps clinique correspondant à sa phase d’essayage. Certains auteurs ont même proposé de se passer de cette phase90. En ce qui concerne la précision de l’accastillage et des couronnes supra-implantaires, une première revue systématique publiée en 2011 par Abduo et al. précisait que la méthode CAD/CAM était celle ayant le potentiel d’obtenir les résultats les plus constants en terme de précision d’adaptation91. Depuis, les études montrent de manière constante que l’adaptation des pièces issues de la CAD/CAM est meilleure ou au moins équivalente à celle des pièces issues des méthodes conventionnelles92 93 .
Une publication récente de Ng et al. (2015) vient apporter quant à elle une précision intéressante en ce qui concerne le « tout numérique ». Cette étude a montré que les couronnes produites en CAD/CAM de manière entièrement numérique (empreinte optique, wax-up numérique) et produites à l’aide d’une usineuse à 5 axes, en disilicate de lithium présentaient une meilleure adaptation marginale que les couronnes issues de la méthode conventionnelle94.
En outre, il est à noter qu’étudier la précision d’adaptation au niveau implantaire met en jeu la notion de passivité d’adaptation, qui suppose, lorsqu’elle est totale, une absence de lacune entre l’implant et l’élément supra-implantaire, ainsi qu’une absence de tension développée à l’insertion de cette pièce supra-implantaire avant sa mise en charge fonctionnelle95.
En fait, cette adaptation passive n’existe pas réellement et n’est pour le moment pas possible avec les techniques de production actuelles96. Ce léger manque de passivité observé, qui est compensé par différents mécanismes physiologiques, n’est cependant pas corrélé à une augmentation de la survenue de complications telles que la perte d’ostéointégration97.
Pour conclure sur la CAD/CAM, certains auteurs98 rappellent de manière prudente que « le nombre limité d’études et la trop grande diversité des résultats et des protocoles ne permettent pas encore de tirer des conclusions définitives quant à la supériorité des prothèses issues de la CAD/CAM sur celles issues des méthodes conventionnelles », malgré la publication de nombreuses études allant dans ce sens.
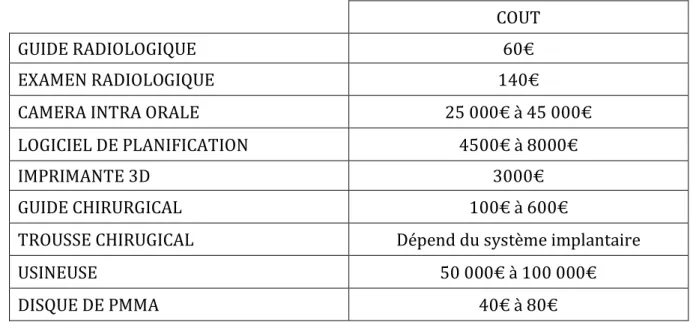
4.2 COUT
Nous avons vu l’importance de chaque étape nécessaire à la réalisation d’un bon guide chirurgical et d’une prothèse provisoire. Une partie de ces étapes s’accompagne d’un coût supplémentaire. Nous allons à présent aborder en différents points les aspects financiers qu’elle requiert99. • Le guide radiologique : La première étape spécifique de l’implantologie assistée par ordinateur est la réalisation d’un guide radiologique (dans le cas d’un édentement étendu). Le laboratoire doit donc confectionner une cire diagnostique pour commencer puis le guide radiologique. Ce guide est réalisé avec une résine chargée d’un matériau radio-opaque. Le coût d’un guide radiologique est d’environ60 €.
• L’examen radiologique : Cette étape n’est pas particulière à l’implantologie assistée par ordinateur et elle représente une obligation médico-légale. Elle permet l’étude des volumes osseux et des structures anatomiques environnantes. Son coût s’élève à 140 € en moyenne. • La caméra intra orale : de nombreuses offres sont disponible sur le marché avec un tarif allant de 25 000 € (Condor Scan de Biotech, DWIO de Dental Wings) à 45 000 € (3Shape de Trios, CS3600 de Carestream) avec pour certaines une licence à payer chaque année entre 2000 € et 3000 €. • Le logiciel de simulation implantaire : Hormis l’investissement que représente le logiciel, soit un tarif allant de 4500 € à 8000 €, l’abonnement à la hot line coûte 1000 € par an.
• L’imprimante 3D : Dans le cadre de l’intégration du « tout numérique » directement au cabinet. Le tarif moyen d’une imprimante 3D est de 3000 € en moyenne (Formlabs Form 2). Ce cout varie en fonction de la technologie et du volume de production. • Le guide chirurgical : Le coût de fabrication d’un guide chirurgical est variable : de 100 € (couronne unitaire) à 600 € (prothèse complète). Ce coût varie légèrement en fonction du nombre d’implant planifié et en fonction de la production du guide au cabinet ou en passant par l’envoi à un laboratoire. • La trousse chirurgicale : Chaque système implantaire requiert sa propre boîte d’instruments avec ses propres forets. • L’usineuse : de nombreuses offres sont également disponible sur le marché en fonction du type d’usineuse (nombres d’axes, sec ou humide, disque ou bloc, matières à usiner, etc.) avec un tarif allant de 50 000 à plus de 100 000 €. • Disque de PMMA : en plus de l’usineuse, il faut acheter des disques de PMMA pour les provisoires. Le prix est variable en fonction de l’épaisseur du disque, du nombre de couche et de la teinte. Cela varie de 40€ à 80€ par disque. Sachant que l’on peut usiner une trentaine d’éléments sur un seul disque. COUT GUIDE RADIOLOGIQUE 60€ EXAMEN RADIOLOGIQUE 140€ CAMERA INTRA ORALE 25 000€ à 45 000€ LOGICIEL DE PLANIFICATION 4500€ à 8000€ IMPRIMANTE 3D 3000€ GUIDE CHIRURGICAL 100€ à 600€ TROUSSE CHIRUGICAL Dépend du système implantaire USINEUSE 50 000€ à 100 000€ DISQUE DE PMMA 40€ à 80€ Tableau 3: Tableau récapitulatif du cout de l’intégration d’un flux numérique total dans un cabinet dentaire.
Le recours à l’IAO implique donc un investissement initial relativement lourd pour le praticien qui s’équipe de cette nouvelle technologie (logiciel, accastillage spécifique, etc.)100. Ces systèmes d’aide semblent de ce fait actuellement plus accessibles et destinés aux cabinets dentaires particulièrement orientés vers la pratique clinique quotidienne de l’implantologie, notamment dans la gestion de cas complexes faisant intervenir des enjeux esthétiques et de confort majeurs101.