© Myriam Cadotte, 2018
La mycophagie par le cerf de Virginie à l'Île d'Anticosti
Mémoire
Myriam Cadotte
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
iii
RÉSUMÉ
Les champignons représentent une ressource alimentaire peu connue, mais de bonne qualité nutritive pour les herbivores en raison de leur teneur élevée en protéines. L'objectif principal de notre étude était de déterminer quelles espèces de champignons sont
consommées par les cerfs de Virginie à l'île d'Anticosti, Québec, Canada. Pour ce faire, nous avons échantillonné les fèces de 114 cerfs récoltés en 2014 et 2015 sur l'île
d'Anticosti. Nous avons extrait l'ADN fongique des fèces et l'avons amplifié à l'aide d'une réaction en chaîne par polymérase (PCR). L'ADN fongique amplifié a été séquencé par la méthode Illumina pour identifier les espèces de champignons consommées. Nos résultats démontrent que les cerfs échantillonnés semblent avoir consommé de manière directe plus de 580 espèces de champignons présentes sur l’île. Les adultes consomment une plus grande diversité de champignons que les juvéniles et la diversité de champignons
consommée par les cerfs varie beaucoup d'une année à l'autre. Les résultats de cette étude permettent de mieux comprendre les besoins alimentaires du cerf de Virginie et le rôle des champignons dans leur alimentation.
iv
ABSTRACT
Mushrooms represent a little known source of food for herbivores despite their high quality provided by their high protein content. The main objective of this study was to determine which mushroom species were consumed by white-tailed deer on Anticosti Island (Québec, Canada). To do this, we collected 114 fecal samples from deer harvested in 2014 and 2015 on Anticosti Island. Fungi DNA was extracted from feces and amplified via polymerase chain reaction (PCR). Amplified fungi DNA was then sequenced with the method Illumina to identify mushroom species consumed by deer. Deer harvested appear to have consumed more than 580 mushroom species directly. We showed that adults
consumed a higher mushroom diversity than juveniles and mushroom diversity consumed by deer varied greatly annually. Our results help understanding white-tailed deer food requirements and the role of mushrooms in their diet.
v
TABLE DES MATIÈRES
RÉSUMÉ ...iii
ABSTRACT ... iv
LISTE DES TABLEAUX ... viii
LISTE DES FIGURES ... ix
REMERCIEMENTS ... x
AVANT-PROPOS ... xii
INTRODUCTION GÉNÉRALE ... 1
Nutrition des ruminants... 1
Avantages directs de la mycophagie pour les cervidés ... 2
Consommation de champignons par le cerf de Virginie ... 3
Le rôle de la mycophagie du cerf de Virginie dans l'écosystème forestier ... 4
Facteurs qui influencent la consommation de champignons par les cerfs ... 5
Le sexe ... 5
L'âge ... 6
La condition corporelle ... 6
L'habitat ... 7
La période de l'année ... 8
Le cerf de Virginie sur l'île d'Anticosti ... 9
Aire d'étude ... 10
Objectifs du projet de l'équipe FRQNT ... 10
Objectifs de cette étude ... 11
Hypothèses et prédictions ... 11
Approche méthodologique ... 13
vi
Séquençage et précision du nombre de reads ... 14
Les effets des variables extrinsèques et intrinsèques sur la diversité de champignons consommés par les cerfs ... 15
Mycophagy of white-tailed deer in the boreal forest ... 16
RÉSUMÉ ... 17
ABSTRACT ... 18
INTRODUCTION ... 19
MATERIAL AND METHODS ... 22
Study area ... 22
Data collection... 23
DNA extraction and sequencing ... 25
Bioinformatic analysis... 27
Statistical analyses... 29
RESULTS ... 31
Variation in the number of reads ... 31
Consumed mushroom species ... 31
Effects of intrinsic and extrinsic variables on the diversity of mushrooms in deer diet 34 Diversity of mushrooms ... 34
Diversity and proportion of armillaroids ... 35
Diversity and proportion of polypores... 35
Diversity and proportion of lichens ... 36
Diversity and proportion of hypogeous fungi... 37
Diversity and proportion of boletoids ... 38
DISCUSSION ... 39
Consumed mushroom species ... 39
Effects of intrinsic and extrinsic variables on the diversity of mushrooms in deer diet 41 CONCLUSION ... 43
ACKNOWLEDGMENTS ... 44
REFERENCES ... 44
vii
BIBLIOGRAPHIE GÉNÉRALE ... 54
APPENDICES ... 58
Appendix 1 ... 58 Appendix 2 ... 61 Appendix 3 ... 62 Appendix 4 ... 63 Appendix 5 ... 65 Appendix 6 ... 71 Appendix 7 ... 71 Appendix 8 ... 72 Appendix 9 ... 73 Appendix 10 ... 74 Appendix 11 ... 75 Appendix 12 ... 76 Appendix 13 ... 77 Appendix 14 ... 78 Appendix 15 ... 79 Appendix 16 ... 80 Appendix 17 ... 81 Appendix 18 ... 82 Appendix 19 ... 83 Appendix 20 ... 84 Appendix 21 ... 85 Appendix 22 ... 85viii
LISTE DES TABLEAUX
Table 1: The total number of reads for the 15 macroscopic mushroom species (a) and
groups (b) most commonly consumed by white-tailed deer on Anticosti Island (Quebec, Canada) in 2014 and 2015...33
Table 2: The effect of age, lactation status and year on the diversity of mushroom
consumed by white tailed deer on Anticosti Island (Québec, Canada). The explanatory variable (category), estimate (β), standard error (SE), t-value (t) and p-value (P) of the male and female samples (a) and female only samples (b) best models (∆AIC<2 and ∆AICc < ) are shown. Intercept categories are adult, female and 2014...37
Table 3: The effect of body condition and year on the diversity of hypogeous mushroom
consumed by white tailed deer on Anticosti Island (Québec, Canada). The explanatory variable (category), estimate (β), standard error (SE), t-value (t) and p-value (P) of the male and female samples (a) and female only sample (b) best models (∆AIC<2 and ∆AICc
< ) are shown. Intercept category is 2014...38
Table 4: The effect of age, sex, lactation status and year on the diversity of Boletoids
consumed by white tailed deer on Anticosti Island (Québec, Canada). The explanatory variable (category), estimate (β), standard error (SE), t-value (t) and p-value (P) of the male and female samples (a) and female only samples (b) best models (∆AIC<2 and ∆AICc < ) are shown. Intercept categories are female, adult and 2014...39
ix
LISTE DES FIGURES
Figure 1: Location of the different outfitters and the five hunting zones (RESIDENTS,
Northern-End, Geneviève lake, Mcdonald and Chaloupe) where white-tailed deer feces were collected from deer harvested on Anticosti Island in 2014 and 2015...23
Figure 2: Cumulative number of macroscopic mushroom species consumed by white-tailed
deer on Anticosti Island (Quebec, Canada) according to the number of fecal samples in 2014 (light gray) and 2015 (dark gray) Uncommon species and species with less than 500 reads included...34
x
REMERCIEMENTS
J'aimerais, en premier lieu, remercier Steeve Côté et Jean Bérubé pour m'avoir donné l'opportunité de faire ce projet si inspirant. Vous m'avez énormément appris durant ce parcours académique. Je suis chanceuse d'être tombée sur un directeur et codirecteur qui était aussi présents tout au cours de mon projet et toujours prêts à m'aider quand j'en avais de besoin. Merci à Steeve pour m'avoir fourni une aide précieuse durant la récolte de données, la rédaction, les présentations orales et les analyses statistiques. J'ai beaucoup appris sur l'écologie des cervidés et sur la recherche scientifique grâce à toi. Merci Jean pour ton aide qui m'a permis de passer à travers des travaux de laboratoire pas toujours faciles, pour m'avoir appris tant de choses sur les champignons et pour avoir eu la brillante idée de faire un inventaire de champignons sur l'île, ce qui a été une très belle expérience. J'aimerais aussi remercier André Desrochers pour non seulement le financement FRQNT équipe de mon projet et l'aide que tu m'as apportée pour réaliser ce projet, mais surtout pour les belles expériences que j'ai pu avoir à la forêt Montmorency grâce à toi. Mon parcours n'aurait pas été le même sans les sorties de pistage l'hiver et les inventaires d'oiseaux l'été dans la forêt Montmorency.
Ce projet n'aurait pas pu avoir lieu sans les données récoltées sur le terrain à l'île d'Anticosti par Aimée Benoist-Chénier, Nicolas Houde, Alexandre Lottinville et Jérémie Fuller. Donc un gros merci à vous tous. Merci aussi à Sonia de Bellefeuille d’avoir organisé la récolte de données et les inventaires de champignons sur l'île d'Anticosti. J'ai aussi
obtenu une aide précieuse de Mathieu Paradis, Patrick Gagné, Chantal Côté, Julie Dubé et Serge Sokolski pour réaliser les travaux de laboratoire en génomique, ce que je n'avais
xi
jamais fait auparavant et c'est pourquoi leur aide a été si précieuse. J'aimerais aussi remercier spécialement Patrick Gagné pour avoir fait toute la bioinformatique pour mon projet et me l'avoir expliquée par après. Puis Stéphane Dubois pour avoir fait le séquençage d'ADN.
J'ai aussi été chanceuse de tomber sur une aussi belle gang de laboratoire remplie de gens tout aussi généreux et sympathiques les uns que les autres. Tout le monde dans le laboratoire sans exception m'a aidé durant mon projet. J'ai vraiment adoré l'ambiance qui régnait dans le laboratoire et qui rendait les lab-meeting, midi discussions et autres activités toujours aussi le fun.
J'ai eu beaucoup d'aide de la part de plusieurs membres du laboratoire et personnes de l'extérieur pour réaliser les nombreuses analyses statistiques. Donc un gros merci à Émilie Champagne, Mael LeCorre, Marc Mazerolle, Pier-Olivier Tremblay, Aurélien Nicosia et Gaétan Daigle pour m'avoir aidé à faire toutes ces analyses et pour m'avoir appris tant de choses sur le sujet. J'ai aussi eu une aide précieuse de plusieurs personnes pour la rédaction de ce mémoire. Merci énormément à Sonia de Bellefeuille, Michaël Bonin, Pierre-Luc Chagnon, Julien Hénault Richard et Mael LeCorre pour vos
commentaires et vos conseils.
Pour finir, j'aimerais remercier ma famille et mes amis qui m'ont encouragé tout au long de cette aventure et qui m'ont permis de passer à travers les épreuves plus difficiles. Merci particulièrement à mon amoureux Maxime Castonguay qui m'a supportée,
encouragée et aidée jour après jour durant tout ce parcours, peu importe la distance qui pouvait nous séparer par moments. Merci pour tous ces fous rires et beaux moments qui illuminaient mes journées.
xii
AVANT-PROPOS
Ce mémoire comporte 6 grandes parties: l'introduction générale (français), l'introduction (anglais), les méthodes (anglais), les résultats (anglais), la discussion (anglais), la conclusion (anglais) et la conclusion générale (français).
J'ai participé à l'élaboration des hypothèses et prédictions, à la récolte de données, aux manipulations en laboratoire, à la compilation des données, aux analyses statistiques et à la rédaction de ce mémoire. Steeve Côté a participé à la conception du projet, la mise en place du projet, le financement du projet, l'élaboration des hypothèses et prédictions, les analyses statistiques et la rédaction. Jean Bérubé a participé à la conception du projet, la mise en place du projet, le financement du projet, l'élaboration des hypothèses et
prédictions, des protocoles de laboratoire, des analyses bioinformatiques, à la compilation des données et à la rédaction. André Desrochers a participé à la conception du projet, la rédaction et a dirigé l'équipe FRQNT qui a permis le financement du projet.
1
INTRODUCTION GÉNÉRALE
Nutrition des ruminants
Les herbivores ont développé différentes adaptations morphologiques, physiologiques et comportementales afin de sélectionner efficacement les plantes selon leurs besoins nutritifs et d’en extraire l’énergie digestible (Van Soest 1996). Le développement des stratégies digestives, tant inter- qu’intraspécifiques, observées chez les ruminants reflète leurs interactions avec les plantes dont ils se nourrissent (Van Soest 1996). Ces stratégies digestives varient d'une espèce à l'autre puisque chaque espèce est adaptée à son régime alimentaire, mais aussi d'un individu à l'autre puisque certaines composantes comme la masse, le sexe, l'âge, l'habitat et bien d'autres peuvent influencer la plasticité digestive au niveau de l'individu (Hewitt 2011). Par exemple, la masse corporelle influence l'approvisionnement et la digestion d'un ruminant (Van Soest 1996). Les individus plus petits ont un métabolisme plus élevé et doivent donc s’approvisionner à un rythme plus fréquent afin de soutenir un apport élevé en ressources de qualité nutritive élevée (Barboza et al. 2009). Les individus avec une plus grande masse corporelle possèdent un ratio surface-volume digestif plus élevé et un temps de passage plus lent, ce qui leur permet d'acquérir les nutriments à partir d'une nourriture de plus faible qualité (Demment & Van Soest 1985).
Une autre contrainte pour les ruminants est que la disponibilité de la nourriture varie temporellement et spatialement. La productivité des ressources végétales consommées par les herbivores est en partie limitée par les précipitations et la température qui varient elles-mêmes selon la latitude, l'altitude et la topographie (Ternouth & Hacker 1987). Les
2
individus doivent donc s'ajuster en changeant leur approvisionnement selon les fluctuations saisonnières (Danell 2006) et selon l'habitat dans lequel ils se trouvent. Leur alimentation contient donc des espèces de plantes dont l'abondance varie en fonction des saisons. Les champignons sont peu connus, mais font partie de ces éléments dans l’alimentation des ruminants qui fluctuent d’une saison à l’autre. Ils sont aussi d’une grande importance pour les ruminants en raison de leur teneur élevée en protéines (Maser et al. 2008), et sont consommés durant l’automne. La plupart des ruminants sont des mycophages (i.e. consommateurs de champignons) opportunistes, i.e., ils consomment des champignons lorsqu'ils en trouvent lors de leur recherche alimentaire (Launchbaugh & Urness 1992, Maser et al. 2008).
Avantages directs de la mycophagie pour les cervidés
Plusieurs cervidés consomment des champignons lorsque ceux-ci sont disponibles. À la fin de l'été, les champignons peuvent constituer jusqu’à 12% du volume d’aliments consommés par le cerf mulet (Odocoileus hemionus) (Lovaas 1958) et pour le wapiti (Cervus canadensis) les champignons peuvent constituer jusqu’à 75% de leur régime alimentaire (Collins et al. 1978). La teneur moyenne en protéines des champignons varie entre 19 et 35 % de la masse sèche, ce qui en fait un des aliments qui contient le plus de protéines (Chang & Miles 2004) (voir Annexe 2). Ils sont aussi une bonne source d'eau (80-90% de la masse non-sèche), d'énergie (300 à 400 kcal/100 g), de phosphore et de sélénium (Launchbaugh & Urness 1992, Maser et al. 2008). Puisque les champignons sont riches en protéines et en phosphore, lorsqu'ils constituent une partie majeure de l'alimentation des ruminants, ces derniers produiraient une grande quantité d'acides gras volatiles dans leur
3
système digestif (Short 1971). Ces conditions amélioreraient la digestion des plantes par les micro-organismes symbiotiques du rumen (Rice et al. 1962, Crawford 1982). Les cervidés n'ont pas d'enzymes pour métaboliser et digérer les plantes, c'est plutôt des
micro-organismes symbiotiques comme des bactéries qui les digèrent dans leur rumen (Van Soest 1996).
Consommation de champignons par le cerf de Virginie
Il y a peu d'information dans la littérature sur les espèces de champignons
consommées par le cerf de Virginie. Jusqu'à présent, seulement environ une cinquantaine d'espèces et genres ont été identifiés dans l'alimentation des cerfs, parmi lesquels environ une dizaine d’espèces ont été identifiées dans l'alimentation du cerf de Virginie (Atwood 1941, Cowan 1945, Lovaas 1958, Gillis 1959, Miller & Halls 1969, Hungerford 1970, Skinner & Telfer 1974, Pokorny et al. 2004, Ashkannejhad & Horton 2006) (voir Annexe 3).
Parmi les champignons identifiés comme étant consommés par le cerf de Virginie figurent des champignons épigés, hypogés et du lichen (Atwood 1941, Cowan 1945, Lovaas 1958, Gillis 1959, Miller & Halls 1969, Hungerford 1970, Skinner & Telfer 1974, Pokorny et al. 2004, Ashkannejhad & Horton 2006). La majorité de ces champignons hypogés et épigés vivent en une symbiose mycorhizienne avec leur plante hôte. Ces champignons se retrouvent sur et dans les radicelles de leur plante hôte (Cairney & Chambers 1999). Les champignons épigés ont leur fructification à la surface du sol. La fructification des champignons hypogés se fait sous le sol et les spores sont contenues dans les fructifications (Trappe et al. 2009). Cependant, d'autres champignons sont présents
4
accidentellement dans l’alimentation des cerfs puisqu'ils croissent eux aussi dans leur plante hôte, dans tous les tissus de la plante comme le feuillage et les rameaux (Carroll 1988); ce sont les champignons endophytes. Puisqu’une composante majeure de l'alimentation des cerfs de Virginie, particulièrement en hiver, est les ramilles d'arbres (Hewitt 2011), ceux-ci devraient consommer en grande quantité les champignons endophytes associés aux espèces d'arbres qu'ils consomment. Le lichen, qui est aussi consommé par le cerf de Virginie (Huot 1982), est le résultat d'une symbiose entre un champignon et des algues ou cyanobactéries photosynthétiques (Kaasalainen et al. 2012).
Le rôle de la mycophagie du cerf de Virginie dans l'écosystème forestier
La mycophagie est une composante très peu connue des milieux forestiers, mais non sans importance. Elle fait partie des multiples interactions qui permettent le fonctionnement des écosystèmes forestiers (Maser et al. 2008). La quasi totalité des espèces de plantes dépend des champignons mycorhiziens pour l'acquisition des ressources (Maser et al. 2008). Donc la dispersion des spores de ces champignons par le cerf de Virginie influence probablement la dynamique de population des plantes présentes dans son habitat en
favorisant certaines espèces par rapport à d’autres (Maser et al. 2008). Il est donc important de comprendre la mycophagie du cerf de Virginie pour identifier ses besoins alimentaires et les variations à travers les saisons, mais aussi pour évaluer les modifications qu'il peut apporter à son habitat par la dispersion des spores de champignons qu'il a consommés.
5
Facteurs qui influencent la consommation de champignons par les cerfs
Le sexe
La quantité de nutriments nécessaires pour le métabolisme du cerf varie en fonction de la saison, de l'âge et du sexe (Hewitt 2011). La consommation de champignons par les cerfs devrait donc aussi varier en fonction de ces facteurs. De manière générale, les femelles et les faons devraient consommer une moins grande quantité de nourriture, mais sélectionner une nourriture de meilleure qualité tandis que les mâles devraient consommer une grande quantité de nourriture, sans qu’elle soit obligatoirement de bonne qualité (Barboza & Bowyer 2000). Cette différence de stratégie d'approvisionnement est principalement due au fait que les individus avec une plus grande masse corporelle comme les mâles possèdent un ratio surface-volume digestif plus élevé et un temps de passage plus lent, ce qui leur permet d'acquérir les nutriments à partir d'une nourriture de plus faible qualité. Les juvéniles et femelles ont une masse corporelle plus faible et possèdent donc un ratio surface-volume digestif plus faible et un temps de passage plus rapide, ce qui les obligent à avoir une alimentation de meilleure qualité (Demment & Van Soest 1985). Un régime alimentaire plus diversifié serait de meilleure qualité car en consommant une plus grande variété d'aliments, les individus peuvent avoir accès à plus de nutriments pour combler leurs besoins (Provenza et al. 2003). On s’attend donc à ce que les femelles et les faons consomment une plus grande diversité de champignons que les mâles adultes. Les mâles adultes devraient être moins sélectifs et consommer plus de champignons de manière opportuniste. Ils devraient donc consommer une plus grande proportion de champignons qui ont des fructifications faciles à trouver et à consommer comme des armillaires,
6
hypholomes et pholiotes qui constituent le groupe des armillaroïdes pour les fins de cette étude (McNeil 2006).
L'âge
La demande en nutriments nécessaires au maintien des besoins des individus varie également en fonction de l'âge. Les besoins en protéines, par exemple, sont plus élevés au début de la vie, car les juvéniles ont besoin de plus de protéines pour leur croissance, mais ce besoin diminue graduellement avec l’atteinte de la taille adulte (Holter et al. 1979). Les juvéniles pourraient donc consommer une plus grande proportion de champignons gros et charnus qui ont une haute teneur en protéines comme les bolets pour combler leurs besoins en protéines (Chang & Miles 2004) (voir Annexe 2).
La condition corporelle
La condition corporelle peut aussi affecter les stratégies d'approvisionnement des cerfs. Il est possible que les cerfs en moins bonne condition corporelle et les femelles lactantes, qui sont elles aussi en moins bonne condition corporelle jusqu'au milieu de l'automne (Simard et al. 2014b), recherchent des aliments qui leur permettront de combler leurs réserves corporelles plus rapidement. Par exemple, en recherchant des aliments avec une plus grande proportion de protéines comme les champignons, et plus précisément les bolets.
7
L'habitat
La consommation de champignons par le cerf de Virginie devrait varier d'un habitat à l'autre, en partie car certaines conditions sont plus favorables à la production de
fructifications par les champignons dans certains habitats que dans d'autres. Par exemple, la diversité de champignons devrait être plus grande dans les peuplements forestiers de classes d'âge plus élevées (Twieg et al. 2007). La disponibilité des espèces de plantes hôtes ainsi que les conditions environnementales influencent également la variabilité des champignons disponibles pour le cerf de Virginie d'un habitat à l'autre (Boulet et al. 2003). Par exemple, les peuplements de conifères seraient reconnus pour avoir une plus grande diversité de champignons (McNeil 2006). Il est donc possible que les cerfs de Virginie dont le domaine vital comporte un grand pourcentage de recouvrement de peuplements de conifères
consomment une plus grande diversité de champignons. Cependant, les épinettes noires (Picea mariana) sont reconnues pour pousser sur des sols pauvres en nutriments et dans des milieux extrêmes, soit humides ou très secs (Kelty et al. 1992). Elles sont donc adaptées pour survivre dans des conditions extrêmes contrairement à la plupart des plantes et c'est pourquoi les pessières noires ont généralement une moins grande diversité de plantes que la plupart des autres peuplements de conifères (Kelty et al. 1992, Wang & Chen 2010). Plus la diversité des plantes est élevée, plus il pourrait y avoir une grande diversité de
champignons associés à ces plantes et donc un peuplement avec une faible diversité de plantes pourrait contenir une plus faible diversité de champignons (Villeneuve et al. 1989). Les pessières noires devraient donc avoir une moins grande diversité de champignons que les autres peuplements de conifères. Les cerfs de Virginie dont le domaine vital comporte une grande proportion de peuplements de conifères devraient aussi consommer une plus
8
grande diversité et proportion de lichens, car ces organismes sont particulièrement présents dans ces peuplements (Nash 1996).
La période de l'année
Les champignons atteignent leur maturité lorsque les spores sont prêtes à disperser. Pour les champignons épigés, c'est au moment de leur maturité que les fructifications sont à leur grosseur maximale (Chang & Miles 2004), alors que pour les champignons hypogés c'est à ce moment qu'ils commencent à émettre une odeur pour attirer les animaux (Maser et al. 2008). Pour ces derniers, c'est donc surtout lorsqu'ils ont atteint leur maturité qu'ils sont probablement consommés par les cerfs. Dans les forêts de conifères du Québec, c'est d'août à octobre qu'il y a la plus grande diversité de fructifications de champignons (McNeil 2007).
La maturité des champignons n'a pas lieu à une date précise chaque année et varie selon les facteurs environnementaux tels que l'humidité, la température, la lumière et les concentrations de gaz atmosphériques (Chang & Miles 2004). Les valeurs optimales de chacun de ces facteurs pour la fructification varient d'une espèce à l'autre (Chang & Miles 2004). Par exemple, les fructifications des bolets et armillaroïdes (voir Annexe 2) sont plus fréquentes en septembre, tandis que pour les champignons hypogés c'est plutôt en octobre et novembre (Phillips et al. 2002). Au Québec, la surface du sol gèle plus vite que le sol lui-même, il est donc logique que les fructifications des champignons épigés gèlent plus vite que celles des champignons hypogés. Elles seraient donc moins disponibles pour les cerfs vers la fin de l'automne. Il est donc possible que les cerfs consomment une plus grande proportion de champignons hypogés après les gelées, en novembre. Il y a aussi des
9
champignons qui sont disponibles à longueur d'année pour les cerfs comme les lichens et les polypores (Hudson 1986, Nash 1996). Par contre, ces champignons ont, pour la plupart, une faible teneur en protéines (Parker et al. 2005, Cohen et al. 2014) et sont donc moins nutritifs pour les cerfs. Ils devraient donc être consommés en plus faible proportion et diversité par les cerfs lorsque les autres champignons sont disponibles.
Le cerf de Virginie sur l'île d'Anticosti
En 1896, environ 200 cerfs de Virginie provenant principalement de la région de l'Islet, Québec ont été introduits sur l'île d'Anticosti (Newsom 1937). Même si la forêt sur l'île était de type boréal, ce qui n'est pas l'habitat de prédilection du cerf de Virginie (MFFP 2013), la population de cerfs s’y est rapidement établie et a rapidement atteint des densités de >20 cerfs/km2 (Côté et al. 2008). Parmi les principales espèces de brout ligneux pour le cerf de Virginie sur l'île d'Anticosti, on retrouve Abies balsamea, Betula papyrifera, Rubus sp., Populus sp. et Salix sp. (Huot 1982, Tremblay et al. 2006). Les espèces d'arbres feuillus ont nettement diminué suite au sur-broutement des cerfs de Virginie à forte densité
(Tremblay et al. 2005). C'est pourquoi ils ont du se tourner vers le sapin baumier (Abies balsamea) même si celui-ci n'est pas leur aliment de prédilection (Sauvé & Côté 2007).
Le lichen représente aussi une partie importante de l'alimentation hivernale du cerf de Virginie sur l'île d'Anticosti (environ 13 %) (Huot 1982, Lefort et al. 2007). Les autres composantes de l'alimentation des cerfs sur l'île d'Anticosti sont les champignons, les prêles, les fougères, les mousses et les algues (Huot 1982). Les champignons sont consommés durant toute l'année, mais surtout vers la fin de l'été (environ 2 % de son alimentation) et durant l'automne (environ 3 %) (Huot 1982). Ces données ont été estimées
10
à partir de rumens provenant de carcasses de cerfs de Virginie abattus à la chasse sportive (Huot 1982). Selon la littérature, le seul inventaire de champignons fait sur l'île date de 1907 par Joseph Schmitt (Schmitt 1904). Selon cet ouvrage et des observations faites par Danièle Morin (comm. pers., MFFP 2015), il y aurait 102 espèces fongiques et lichens dont 54 genres fongiques et 23 genres de lichens qui ont été identifiés sur l'île d'Anticosti (voir Annexe 1).
Aire d'étude
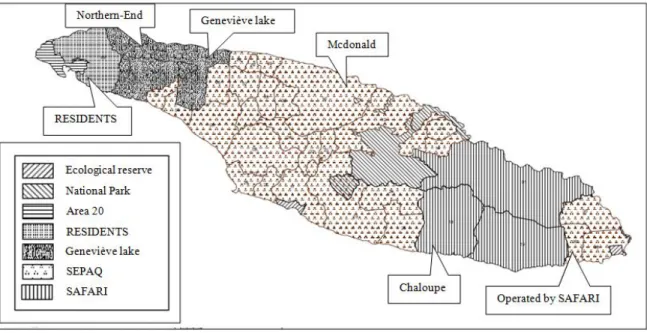
L'île d'Anticosti est localisée dans le golfe du Saint-Laurent (Québec, Canada) (49°N, 62°W) et a une superficie de 7943 km2 (Côté et al. 2008). Elle appartient au domaine bioclimatique de la sapinière à bouleau blanc (Ministère des Forêts 2015) et les espèces d'arbres les plus communes sont l'épinette blanche (Picea glauca), le sapin baumier et l'épinette noire. Elle contient 4 territoires de chasse au cerf de Virginie (figure 1):
RÉSIDANTS, Lac Geneviève, SÉPAQ et SAFARI. Les peuplements varient beaucoup à l'intérieur de chaque territoire de chasse, mais en général, il y a plus de peuplements de sapin baumier et de pessières dans les secteurs RÉSIDANTS, Lac Geneviève et SÉPAQ (Simard et al. 2014b). Dans la pourvoirie SAFARI, il y a plus de tourbières (Simard et al. 2014b).
Objectifs du projet de l'équipe FRQNT
Mon projet de maitrise s'inscrit dans le cadre des travaux d’une équipe du FRQNT dont les principaux objectifs sont de dresser à l’échelle du Québec la distribution et la richesse spécifique des champignons hypogés et de comprendre leur consommation par les
11
mammifères forestiers. Les champignons hypogés sont peu étudiés, car ils sont très
difficiles à trouver en raison de leurs fructifications souterraines les rendant moins visibles. De plus, lorsque leurs spores atteignent la maturité ils émettent une forte odeur qui attire plusieurs mammifères qui les consomment alors rapidement (Maser et al. 2008). Parmi ce type de champignons, plusieurs sont des truffes (Tuber sp.) qui pourraient représenter un potentiel de nouveaux produits de valeur commerciale pour le Québec.
Objectifs de cette étude
Objectif principal: Déterminer quelles espèces de champignons sont présentes dans l'alimentation du cerf de Virginie à l'île d'Anticosti.
Objectifs spécifiques
1- Déterminer les effets de l'âge, du sexe, de la condition corporelle, de la lactation, de l'habitat, de la classe d'âge de l'habitat, du mois durant l'automne et de l'année sur a) la diversité de champignons, b) la diversité et la proportion de groupes de champignons ayant une teneur en protéines plus élevée (hypogés, armillaires et bolets) et c) la diversité et la proportion de groupes de champignons ayant une plus faible teneur en protéines (polypores et lichens) dans l'alimentation des cerfs de Virginie à l'île d'Anticosti.
2-Déterminer l'importance (diversité et proportion) des champignons hypogés dans l'alimentation des cerfs de Virginie à l'île d'Anticosti.
Hypothèses et prédictions
Hypothèse 1: Les cerfs de Virginie juvéniles et les femelles adultes recherchent davantage
12
contiennent plus de protéines que la plupart des plantes; 2) les juvéniles et les femelles ont besoin d'une alimentation de meilleure qualité que les mâles adultes.
Prédiction 1.1: Les juvéniles consomment une plus grande diversité de champignons que
les adultes.
Prédiction 1.2: Les femelles consomment une plus grande diversité de champignons que
les mâles.
Hypothèse 2: La diversité de champignons consommée par les cerfs dépend de l’habitat
principal utilisé par les individus, car certains habitats ont des conditions plus favorables à la croissance des champignons.
Prédiction 2.1: Les cerfs dont le principal habitat est un peuplement d'une classe d'âge
élevée consomment une plus grande diversité de champignons, car ces peuplements contiennent une plus grande diversité de champignons que les jeunes peuplements.
Prédiction 2.2: Les cerfs dont le principal habitat est un peuplement de conifères
consomment une plus grande diversité de champignons, car ces peuplements contiennent une plus grande diversité de champignons que les peuplements de feuillus et les tourbières.
Hypothèse 3: La diversité de champignons dans les fèces de cerfs dépend de la date durant
l'automne, car les conditions favorables à la croissance des fructifications de champignons varient durant l'automne.
Prédiction 3.1: Les cerfs vont consommer une plus grande diversité de champignons aux
mois de septembre et octobre que durant le mois de novembre, car au mois de novembre la plupart des fructifications de champignons sont gelées et ne sont donc pas propices à la consommation.
13 Hypothèse 4: Les cerfs de Virginie en moins bonne condition corporelle ont des besoins en
protéines plus élevés et consomment plus d'aliments riches en protéines comme les champignons que ceux en bonne condition corporelle.
Prédiction 4.1: Les cerfs en moins bonne condition corporelle consomment une plus
grande diversité de champignons que les cerfs en meilleure condition corporelle.
Prédiction 4.2: Les femelles lactantes consomment une plus grande diversité de
champignons que les femelles non-lactantes en septembre et octobre, car les femelles lactantes sont en moins bonne condition corporelle que les non-lactantes durant cette période.
Approche méthodologique
Échantillons de fèces et données sur les cerfs
Nous avons récolté les fèces de 114 cerfs (73 femelles, 36 mâles et 5 dont le sexe est inconnu) abattus en 2014 et 2015 sur l'île d'Anticosti. Les fèces ont été prises
directement dans l'intestin des cerfs et congelées la journée même. Plusieurs données ont été prises sur les carcasses de cerfs dont: l'âge, le sexe, l'épaisseur du gras sous-cutané, la masse de la carcasse éviscérée, la masse du muscle péronier, la présence de lait ou non chez les femelles (Simard et al. 2014a). De plus la date d’abattage de chaque cerf ainsi que les coordonnées géographiques du site d’abattage ont été notées (Simard et al. 2014a). L'épaisseur de gras sous-cutané, la masse de la carcasse éviscérée et la masse du muscle péronier ont été utilisés pour déterminer un indice de la condition corporelle des cerfs
14
(Simard et al. 2014a). La localisation du site d’abattage nous a permis d'estimer le type de peuplement et la classe d'âge du peuplement dans lequel le cerf a pu s'alimenter (Simard et al. 2014a).
Séquençage et précision du nombre de reads
Afin d'identifier les espèces de champignons dans les fèces de cerfs nous avons séquencé l'ADN ribosomique de celles-ci. Cette technique a plusieurs avantages puisqu'elle permet l'identification de presque toutes les espèces de champignons et ne nécessite pas un spécialiste pour le faire, contrairement à l'identification morphologique des spores dans les fèces et le contenu de rumen. Elle présente aussi moins de biais que l'identification
morphologique parce qu'avec cette méthode même les espèces partiellement digérées et donc impossible à identifier morphologiquement peuvent être identifiées car leur ADN demeure intact (Gales & Cheal 1992).
Nous avons broyé et lyophilisé les fèces. Puis trois sous-échantillons de 15mg pour chaque échantillon de fèces ont été prélevés pour en extraire l'ADN fongique. Cet ADN a été amplifié par PCR et a ensuite été séquencé par la méthode Illumina pour identifier quelles espèces de champignons ont été consommées par les cerfs. Donc, pour chaque cerf dont les fèces ont été récoltées, nous avons obtenu les espèces de champignons qu'il a consommé et qui sont présentes dans son rumen, ainsi que le nombre de fois que la séquence d'ADN des espèces a été lue lors du séquençage de l'ADN (nombre de reads) provenant des fèces de celui-ci. Ce nombre de reads nous donne une estimation de la fréquence de chaque espèce de champignons dans son régime alimentaire. Nous avons évalué la précision de la détection du nombre de reads à l'aide des trois sous-échantillons
15
par échantillon de fèces. Nous avons vérifié si la variation intra-cerf (entre les trois sous-échantillons d'un même cerf) était significativement plus petite que celle inter-cerfs (entre les échantillons provenant de différents cerfs).
Les effets des variables extrinsèques et intrinsèques sur la diversité de champignons consommés par les cerfs
La diversité de champignons consommés par les cerfs a été calculée en comptant le nombre d'espèces de champignons macroscopiques ayant plus de 500 reads présentes dans les fèces des cerfs. Les champignons microscopiques sont consommés au passage avec les plantes ou encore sont déjà présents dans le rumen et ne sont donc pas pris en compte. La proportion de certains groupes de champignons consommés par les cerfs a été calculée en divisant le nombre d'espèces de ce groupe de champignons présentes dans les fèces des cerfs par la diversité totale de champignons consommée par les cerfs. Par la suite, nous avons testé les effets des différentes variables sur la diversité et la proportion de
champignons et de groupes spécifiques de champignons consommés à l'aide d'une sélection de modèles linéaires. Les variables explicatives étaient les suivantes: l'âge, le sexe, la condition corporelle, le statut de lactation des femelles, l'habitat, la classe d'âge de l'habitat, le mois et l'année à laquelle le cerf a été abattu. Les variables réponses étaient les suivantes: la diversité de champignons consommés, la diversité de champignons hypogés, de bolets, d'armillaires, de polypores et de lichens consommés et la proportion de champignons hypogés, de bolets, d'armillaires, de polypores et de lichens consommés.
16
Mycophagy of white-tailed deer in the boreal forest
Myriam Cadotte1, Jean Bérubé2 and Steeve D. Côté1
1
17
RÉSUMÉ
Il y a peu d'information dans la littérature sur les espèces de champignons consommées par les grands herbivores. Jusqu'à présent, seulement environ une cinquantaine d'espèces et genres ont été identifiés dans l'alimentation des cerfs.Les champignons sont une donc ressource alimentaire peu connue pour les cerfs, mais de très bonne qualité nutritive en raison de leur teneur élevée en protéines. L'objectif principal de notre étude était de déterminer quelles espèces de champignons sont consommées par les cerfs de Virginie à l'île d'Anticosti (Québec, Canada). Pour ce faire, nous avons échantillonné les fèces de 114 cerfs récoltés en 2014 et 2015 sur l'île. Nous avons extrait l'ADN total des fèces et avons amplifié l'ADN fongique à l'aide d'une réaction en chaîne par polymérase (PCR). L'ADN fongique amplifié a été séquencé par la méthode Illumina pour identifier les espèces de champignons consommées. Nos résultats démontrent que l’ensemble des cerfs
échantillonnés avaient consommé 4979 espèces de champignons présentes sur l’île dont 580 qui semblent avoir été consommées de manière directe. Nous avons démontré que les adultes consomment une plus grande diversité de champignons que les juvéniles. Les cerfs ont consommé une plus grande diversité de champignons en 2015 qu'en 2014. De plus, les cerfs en moins bonne condition corporelle ont consommé une plus grande diversité de champignons hypogés (des champignons ayant une haute teneur en protéines) que ceux qui sont en meilleure condition corporelle. Les résultats de cette étude permettent de mieux comprendre le rôle des champignons et leur très grande diversité dans l'alimentation des cerfs de Virginie.
18
ABSTRACT
Little is known about mycophagy in large herbivores. Approximately fifty epigeous and hypogeous mushroom and lichen species have been identified in deer diet. Therefore, mushrooms are a little known source of food for deer, but are of high quality because of their high protein content. Our main objective was to determine which mushroom species are consumed by white-tailed deer on Anticosti Island (Québec, Canada). To do this, we collected 114 fecal samples from deer harvested in 2014 and 2015 on the island. Total DNA was extracted from feces and fungal DNA was amplified via polymerase chain reaction (PCR). Amplified fungi DNA was then sequenced with the Illumina method to identify mushroom species consumed by deer. Our results showed that deer harvested consumed 4979 fungal species, including 580 mushroom species that appeared to be consumed directly. Adults consumed a higher mushroom diversity than juveniles, and mushroom diversity consumed by deer was much higher in 2015 than 2014. Deer in lower body condition consumed a higher diversity of hypogeous fungi (mushrooms with a high protein content) than deer in higher body condition. Our results contribute to the
19
INTRODUCTION
High quality food resources for herbivores are generally characterized by high digestibility related to low fiber and secondary compounds, and high protein contents (Van Soest et al. 1991). Proteins are required by herbivores for biological processes involving growth and reproduction (Robbins 1993, Simard et al. 2014a). Although their quantity is limited in plants (Robbins 1993), proteins are one of the most influential component of herbivores’ food selection (Berteaux et al. 1998).
Mushrooms contain more crude proteins (19 to 35% dry weight) (Appendix 2) than most plants (Chang & Miles 2004) and could thus be considered a high quality resource for herbivores. They are also a good source of water (80-90% of fresh weight), energy (300 to 400 kcal/100 g), phosphorus and selenium (Launchbaugh & Urness 1992, Maser et al. 2008). Many cervids consume mushrooms in high quantity when they are available. During autumn, around 12% of mule deer (Odocoileus hemionus) diet is composed of mushrooms (Lovaas 1958), while for elk (Cervus canadensis) it could be as high as 75% (Collins et al. 1978).
Nevertheless, little is known about deer mycophagy. Deer appear to be opportunistic mycophages, i.e. they eat mushrooms when they encounter them while searching for other food resources or when their preferred food sources are not available, most likely due to their reduced availability (Maser et al. 2008). Approximately fifty epigeous and hypogeous mushroom and lichen species have been identified in their diet (Appendix 3) (Atwood 1941, Cowan 1945, Lovaas 1958, Gillis 1959, Miller & Halls 1969, Hungerford 1970, Skinner & Telfer 1974, Pokorny et al. 2004, Ashkannejhad & Horton 2006). Epigeous and
20
hypogeous mushrooms are mostly mycorrhizae fungi (Smith et al. 2002) growing in a symbiosis relationship with their host plant (Cairney & Chambers 1999). Deer also indirectly consume fungal endophyte and plant pathogen fungi present in plant tissues (Atwood 1941, Carroll 1988, Boulet et al. 2003). By consuming mushrooms, deer may disperse mushroom spores and thus influence communities by enhancing the development of certain species (Maser et al. 2008).
Deer mycophagy may be influenced by intrinsic factors such as age, sex, body condition and female lactation status, and by extrinsic factors such as habitat, season and year. Juveniles and adult females have a smaller digestive system than adult males and therefore a smaller surface to absorb nutrients (Demment & Van Soest 1985). Therefore, compared to males, juveniles and females need a higher quality diet containing more nutrients to fulfill their nutrient requirements (Demment & Van Soest 1985). A more diversified diet could also be of higher quality because deer can better fulfill their nutrient requirements when they eat a variety of foods containing diverse nutrients (Provenza et al. 2003). As such we could expect that adult females and juveniles consume a higher diversity of mushrooms than males. Moreover, juveniles and deer in poor condition generally seek resources with high protein contents, and mushrooms could provide a high source of proteins. Juveniles need more proteins than adults to complete their growth (Holter et al. 1977) and deer in poor condition to rebuild their body reserves (Simard et al. 2014a). Therefore, deer in poor condition and juveniles may consume a higher proportion of mushrooms with high proteins content like Boletoids, for example (Kalač 2009, 2013, Wang et al. 2014). As lactation represents a high energy cost (Hudson & White 1985), lactating females may also consume a higher proportion of mushrooms with high protein contents than non-lactating females.
21
The diversity of mushrooms consumed by deer is expected to vary according to the habitat where they forage because some habitats are more favorable for mushroom
fructifications. Old forests are expected to contain a higher diversity of mushrooms than young forests (Twieg et al. 2007). Generally, conifer stands contain a higher diversity of mushrooms than hardwood stands (McNeil 2006), but diversity depends on the conifer species present. For example, black spruces (Picea mariana) grow on poor nutrient soils, thus plant/mushroom diversity in black spruce stands is generally smaller than in other coniferous stands (Kelty et al. 1992, Wang & Chen 2010). Conifer stands also provide a high diversity and abundance of lichens (Nash 1996). Most lichens are poor in proteins (Parker et al. 2005), but deer are expected to eat some as frost sets in, when other mushrooms are less available (Lefort et al. 2007).
As such, mushroom availability varies throughout the year because fructification does not occur at the same time of the year or under the same environmental factors (e.g. humidity, temperature and light) depending on the species (Chang & Miles 2004). For example, hypogeous mushrooms can grow until November, but not other species such as boletoids and armillaroids (Phillips et al. 2002, McNeil 2007). Lichens and most polypores, on the other hand, are available throughout the year (Nash 1996, McNeil 2006). Therefore, deer have access to variable mushroom species and diversity according to the period of the year.
Our main objective was to identify mushroom species consumed by white-tailed deer in boreal forest. To achieve this, we relied on DNA barcoding, an emerging technique in the identification of food items in wildlife diet (Thomas et al. 2014). This technique consists of amplifying DNA via polymerase chain reaction (PCR) using fungal specific universal primers (Gardes & Bruns 1993), followed by next generation sequencing
22
methods. DNA barcoding has multiple advantages as it can identify mushroom species without relying on the identification of mushroom spores. It is also less biased than morphological identification because intact DNA can be identified without having to find recognizable structures or spores remaining in fecal samples (Gales & Cheal 1992). To our knowledge, this technique has never been used to identify mushroom species in deer diet, thus we began by testing its precision in yielding a repeatable number of reads (number of times a DNA sequence was read during sequencing) in the same sample. We then tested the effect of intrinsic (age, sex, body condition and female lactation status) and extrinsic
variables (habitat, stand age class, month and year) on the diversity of mushrooms consumed by white-tailed deer in the boreal forest. More specifically, we aimed at determining the effects of these variables on the diversity and proportion of hypogeous mushrooms, boletoids, armillaroids, polypores and lichens consumed by white-tailed deer.
MATERIAL AND METHODS
Study area
We studied deer mycophagy on Anticosti Island located in the Gulf of St-Lawrence, Québec, Canada (49°28’ N, 63°00’ W) and covering 7 943 km2 (Côté et al. 2008). In 1896-1897, approximately 220 deer were introduced on the island. The population rapidly increased due to the absence of predators and, nowadays, the deer density is >20 deer/km2 (Côté et al. 2008). The island belongs to the balsam fir-white birch bioclimatic region (Ministère des Forêts 2015).
23
After many years of deer overbrowsing, the vegetal cover of the island has changed and dominant tree species are now white spruce (Picea glauca), balsam fir (Abies balsamea) and black spruce (Potvin et al. 2000). Samples were collected in five hunting zones (RESIDENTS, Northern-End, Geneviève lake, McDonald and Chaloupe) distributed in four outfitters (RÉSIDANTS, Lac Geneviève, SÉPAQ and SAFARI) across the island (Figure 1).
Figure 1: Location of the different outfitters and the five hunting zones (RESIDENTS,
Northern-End, Geneviève lake, Mcdonald and Chaloupe) where white-tailed deer feces were collected from deer harvested on Anticosti Island in 2014 and 2015.
Data collection
We collected pellet samples from 114 deer harvested by sport hunters during the 2014 and 2015 hunting seasons from September to November. Feces were kept frozen at -20°C the day they were collected directly from the gut. Deer age (adult or juvenile:4 to
6-24
month-old), sex, dressed body mass (kg), rump fat thickness (cm) and peroneus muscle mass (g) were collected from carcasses (Simard et al. 2014a). We also evaluated the lactation status of females by looking for the presence of milk in the udder.
Eviscerated body mass was measured using a spring scale (± 0.25 kg). Rump fat thickness, a proxy of fat reserves (Cook et al. 2001), was measured using a ruler (± 0.2 cm) inserted into the fat layer at 5 and 10 cm from the base of the tail at an angle of 45° with the spine (Leader-Williams & Ricketts 1982). The peroneus muscle mass was measured by extracting the muscle from the lower leg and weighting it with a Pesola scale (± 0.5 g). Each of these metrics have been used in the past to evaluate a different component of body condition. Body mass is considered the most appropriate measure to estimate body
condition fluctuations in cervids (Hewison et al. 1996, Taillon et al. 2011). Rump fat thickness is known to be a good proxy of fat reserves in elk (Cervus canadensis) (Cook et al. 2001). The peroneus muscle mass is correlated with protein reserves in cervids
(Chanmcleod et al. 1995, Taillon et al. 2011). We combined these three condition metrics using a principal component analysis to compute a global body condition index. The first three axes respectively explained 82.7%, 14.5% and 2.8% of the variation. We determined the number of significant axes with the broken-stick criterion (Cangelosi & Goriely 2007), which indicated that only the first axis was significant. A score based on this axis was then assigned to each sampled deer to represent its body condition index. A higher body
condition index represents better body condition.
Hunters provided geographic coordinates of harvest sites based on hunting zone maps. Map scale varied among hunting zones but precision averaged ca. 2 km2/cm2. Coordinates were then used to determine the average habitat where deer had likely foraged. Feces collected at harvest should reflect deer consumption in the previous 24 to 48 hours
25
(Mautz & Petrides 1971). Because deer home ranges on Anticosti Island are <1km2 (Massé & Coté 2013), we used a 1 km2 buffer around each harvest location to determine the habitat associated with the fecal sample (Simard et al. 2014a). We then determined the type and age of the most abundant stand in each buffer based on an ecoforestry map (Ministère des Forêts 2011) generated in 2011 with aerial photographs taken in 2009 and providing a 30 m resolution. We reassigned the 61 stands obtained in our data base in 6 stand types: white spruce, black spruce, balsam fir, larch stands, bog and undetermined conifers to limit the number of stand types. We used two stand age classes: young stands (10 to 75 years) and old stands (75 to 120 years) to obtain two balanced age classes.
DNA extraction and sequencing
We lyophilized and grounded fecal samples with a 3383-L20 Thomas-Wiley Intermediate Mill grinder (Arthur H. Thomas Company, Philadelphia PA 19105, USA) using a 20µm sieve. We prepared each sample in triplicates (three 15 mg subsamples). DNA extraction was done following the Dneasy Plant kit (Qiagen) manufacturer's
instructions. Briefly, each subsample was suspended in 180 µl of lysing buffer, then it was disrupted with a 3-mm tungsten bead, in a MixerMill 300 for two 90 second (s) periods at 30 Hz. DNA was then extracted according to the manufacturer’s instructions.
The eluted DNA (gDNA) was used as template for Polymerase Chain Reaction (PCR). ITS regions of the ribosomal DNA fragment (ITS1-5.8S) were first amplified in PCR-1 using the Illumina Fusion Primers 1 and 2 (see Appendix 4 for fusion primer constructs). The Illumina DNA sequencer tends to be overwhelmed when the entire DNA sequences to be read start with the same DNA base. To avoid that, the ITS specific primers
26
of PCR 1 were staggered (Appendix 4) and used in corresponding pairs. One quarter of the samples were amplified using Primer forward A with Reverse primer H, then the next quarter with primers B and G, next quarter with primers C and F and final quarter with primer D and E. Amplicons obtained were then reamplified in PCR 2 with Illumina Universal Indexed primer 1 and Illumina Indexed Primer 2. These primers contained an index sequence to tag every sequence to a sample. Fifteen forward indexed sequences were used in combination with 15 reverse indexed sequences to provide 225 indexed combinations (Appendix 5).
Each reaction PCR 1 contained 3 µL of genomic DNA diluted 1/10, 2.5 µL of PCR buffer 10X (Invitrogen, Carlsbad, CA, USA), 50 mM MgCl2, 10 µM of each dNTPs, 1 ng
BSA, 25 µM of each of the Illumina Fusion Primer 1 and 2, and 0.2 µL of Platinum ® Taq DNA Polymerase (Invitrogen, Carlsbad, CA, USA). The final volume was adjusted to 25 µL using 15.6 µL of Ultrapure Water (Invitrogen, Carlsbad, CA, USA). The PCR cycle parameters consisted of an initial denaturation at 95°C for 2 min, followed by 35 cycles of denaturation at 94°C for 45 s, annealing at 48°C for 45 s and extension at 72°C for 45 s, and a final extension step at 72°C for 10 min. The target PCR product (~450 bp) was verified for each PCR reaction on a 1.5% agarose gel.
Each reaction PCR 2 contained 1 µL of PCR1 amplicons diluted 1/50, 2 µL of PCR buffer 10X (Invitrogen, Carlsbad, CA, USA), 50 mM MgCl2, 10 µM of each dNTPs, 25
µM of each of the Illumina Universal Primer 1 and 2, and 0.2 µL of Platinum ® Taq DNA Polymerase (Invitrogen, Carlsbad, CA, USA). The final volume was adjusted to 23 µL using 12.6 µL of Ultrapure Water (Invitrogen, Carlsbad, CA, USA). The PCR cycle parameters consisted of an initial denaturation at 95°C for 10 min, followed by 15 cycles of
27
denaturation at 95°C for 15 s, annealing at 60°C for 30 s and extension at 72°C for 60 s, and a final extension step at 72°C for 3 min.
Amplicons were then purified using an Agencourt ® AMPure ® XP (Beckman Coulter, Brea, CA, USA) magnetic PCR clean-up system to eliminate fragments smaller than 200 bp (ratio 0.7:1). The clean PCR amplicons were then quantified with Quant-iT ™ Picogreen ® ds DNA Assay kit (Invitrogen, Eugene, OR, USA). DNA concentrations were measured with a Fluoroskan Ascent Labsystem (Thermo Electron Corporation, Vantaa, Finland) with an excitation wavelength of 486 nm and emission wavelength of 585 nm.
We were not successful in amplifying fungal DNA from every fecal samples and for some of them we could only amplify fungal DNA for one or two subsamples. In the end, we obtained amplicons from 238 out of 432 subsamples, each tagged with differing indexes which we then pooled in equimolar amounts. Final quantification of pool, verification of primer artifact removals and amplicon quality check were done with the Agilent 2100 BioAnalyzer (Agilent Technologies, Santa Clara, CA, USA). Seventy-five ng of pooled DNA samples were sent to the Genomic Sequencing and Genotyping Platform of the Centre Hospitalier de l’Université Laval Research Centre (RCCHUL, Québec, QC, Canada) which performed the Illumina paired-end 300 Illumina sequencing.
Bioinformatic analysis
A stringent treatment of Illumina DNA sequences was executed to prevent formation of a disproportionate number of fictitious Operational Taxonomic Units (OTU), our proxies for fungal species, and to produce a credible and biologically relevant number of OTU (Huse et al. 2010, Kunin et al. 2010). Analyses were performed by using
28
MOTHUR v.1.28.0 (Schloss et al. 2009). Ideal flowgrams were generated via the implementation of PYRONOISE and SEQNOISE in MOTHUR (Quince et al. 2009, Quince et al. 2011) (minflows and maxflows were set to 250 and 720 respectively, and other parameters set to default). Denoised sequences were then filtered and trimmed (reads shorter than 120 bp, after removal of barcodes, tags and primers, were discarded; unambiguous positions and a maximum homopolymer length of 9 bp were tolerated).
Dereplication on the full length of the set of sequences was performed before construction of clusters with USEARCH v.6.0.307 (Edgar 2010). The chimera checker UCHIME v.4.2 (Edgar et al. 2011) was used on subsequent de novo and database mode with chimera-free reference fungal database (EmerenciaID available at http://www.emerencia.org/fungalitspipeline.html) (Nilsson et al. 2009) under default parameters to detect and discard potential chimeric sequences from the dataset. Representative sequences, which are the most frequent sequence in each OTU, were extracted and then screened against relevant databases using local BLAST v.2.2.28+ or the boosted translated BLAST program USEARCH v.6.0.307 (Altschul et al. 1990, Camacho et al. 2009, Edgar 2010). Twenty-five top best BLAST hits were sought in databases by a BLASTn or USEARCH search, setting the minimum identity and query coverage parameters to 80% and 70%, respectively.
The output file was then trimmed to remove OTUs with less than 10 reads and OTUs with the same Genbank reference numbers were fused. All OTUs that were microfungi (including endophytes and epiphytes), coprohilous fungi and rumen anaerobic fungi were removed from the list as they were not the object of this study. Remaining OTUs were classified as epigeous fungi, hypogeous fungi, polypores or lichens. Finally, we
29
had samples from a total of 75 deer from which we had all the necessary data for statistical analyses.
Statistical analyses
To verify the precision in the number of sequence reads revealed by DNA barcoding we compared intra-deer versus inter-deer variations in the number of reads for each
mushroom species found in 2015. Intra-deer variation represented the variation in the number of reads among each triplicate, that we quantified with confidence intervals, while inter-deer variation represented the variation in the number of reads among subsamples of all deer. If intra-deer variation was significantly (α=0.05) smaller than inter-deer variation, the number of reads was considered precise for this mushroom species. We divided
mushroom species in three groups: common, intermediate and uncommon species. To test the precision of the number of reads for each group, we randomly selected five mushroom species in each group for which we determined whether intra-deer variation was
significantly smaller than inter-deer variation. This comparison was repeated 1000 times for each group. We also did a species accumulation curve to ensure we had enough samples to capture mushroom diversity.
In order to minimize fungal contamination by spores and to make sure we were only considering mushroom species that appear to be directly consumed by white-tailed deer, we only kept mushrooms species with more than 500 reads in total for statistical analyses. The mushroom diversity of each sample was thus defined as the number of macroscopic
mushroom species with more than 500 reads. We also determined the diversity of different groups of mushrooms: hypogeous mushrooms, boletoids, polypores, lichens and
30
armillaroids which includes Armillaria, Hypholoma and Pholiota species. We chose these groups for several reasons. Hypogeous mushrooms have their fructification in the soil which means that deer have to dig to eat them. Because these mushrooms are difficult to find, their presence in the samples would indicate a certain selection for them. Boletoids are larger mushrooms with a higher protein content than most mushrooms (Kalač 2009, 2013, Wang et al. 2014) and, like Armillaroids, are easy to find for deer because of the size of their fruiting bodies. Polypores and lichens, on the other hand, are less attractive for deer because they have a lower protein content than most mushrooms (Parker et al. 2005, Cohen et al. 2014), but are available year round (Hudson 1986, Nash 1996). To evaluate the proportion of each mushroom groups in each sample, we divided the number of species belonging to each mushroom group by the total number of mushroom species found in the sample.
We tested for the effect of deer age, sex, lactation status, body condition index and habitat (type and age of stands) characteristics, as well as timing (month and year of harvest) on the diversity of mushroom species consumed by deer (number of mushroom species present in deer's diet). We also tested for the effect of these same variables on the diversity and proportion of the different mushroom groups (hypogeous mushrooms, Boletoids, polypores, Armillaroids and lichens). We began by listing all biologically relevant linear models avoiding combining correlated variables (r’s>0.7). We then used Akaike Information criterion to select the best models (∆AICc<2 and ∆AICc < )
(Burnham & Anderson 2002). Because lactation status is only relevant for females we used two series of models and performed two model selection processes, one considering only females and another considering males and females. We present the results based on the explanatory variables included (i.e. CI excluding 0) in the best models.
31
RESULTS
Variation in the number of reads
Intra-deer variation in the number of reads was significantly smaller than inter-deer variation 91 % ( ± 29) of the time in common mushroom species. For mushroom species of intermediate abundance, intra-deer variation was significantly smaller than inter-deer variation 72 % (± 29) of the time, for this reason we did not consider uncommon mushroom species in most analyses. We indicate when analyses included uncommon mushroom species or mushroom species with less than 500 reads.
Consumed mushroom species
We obtained >26 million mushroom DNA sequence reads which clustered in 4979 OTUs, our proxy for mushroom species. Fifty percent of these species were microscopic (46% endophytes and 4% coprophilous species), reflecting indirect consumption by white-tailed deer, and 50% were macroscopic, reflecting direct and indirect consumption (spores for example).
In total, deer consumed 2184 macroscopic mushroom species, 580 of which had more than 500 reads and 93 were in the intermediate and common classes, and were thus kept for the analyses (Appendices 6 and 7). The two most commonly consumed species were Cantharellus lutescens and Lactarius deliciosus (Table 1). The two most consumed genera/groups were the Cortinarius and armillaroids (Armillaria, Pholiota and Hypholoma) (Table 1).
32
The species accumulation curve (Figure 2) revealed that ca. 40 fecal samples were required to determine the diversity of mushroom species in the diet of white-tailed deer in our study area. In addition, deer sampled in 2015 consumed a higher mushroom diversity (424 species) than deer sampled in 2014 (342 species).
33 Table 1: Total number of reads for the 15 macroscopic mushroom species (a) and groups
(b) most commonly consumed by white-tailed deer on Anticosti Island (Quebec, Canada) in 2014 and 2015. a) Species Reads Cantharellus lutescens 953 476 Lactarius deliciosus 613 710 Hypholoma capnoides 361 877 Armillarias gallica 331 324 Russula nauseosa 304 270 Cortinarius alboviolaceus 679 708 Paxillus involutus 259 158 Suillus luteus 290 256 Suillus pictus 201 406 Craterellus tubaeformis 209 088 Chalciporus piperatus 255 827 Suillus grevillei 194 289 Suillus bresadolae 565 439 Cortinarius ferrugineovelatus 167 054 Cortinarius paleaceus2012 158 786 b) Groups Reads Cortinarius (539) 3 458 240 Armillaroids (39) 1 633 309 Lactarius (124) 1 486 246 Boletoids (52) 1 358 012 Chanterelles (8) 1 095 727 Russula (142) 937 847 Polypores (210) 495 926 Puffballs (14) 472 242 Hebeloma (55) 320 451 Paxillus (3) 259 158 Entoloma (60) 189 031 Hypogeous (71) 161 482 Cystoderma (5) 159 932 Lichens (172) 157 116 Coprinus (7) 116 409
34 Figure 2: Cumulative number of macroscopic mushroom species consumed by white-tailed
deer on Anticosti Island (Quebec, Canada) according to the number of fecal samples in 2014 (light gray) and 2015 (dark gray). Uncommon species and species with less than 500 reads included.
Effects of intrinsic and extrinsic variables on the diversity of mushrooms in
deer diet
Diversity of mushrooms
Adults consumed a higher diversity of mushrooms (mean ± SD = 30.7 ± 0.9) than juveniles (21.1 ± 6.6, Table 2, Appendices 8 and 9) and sampled deer consumed a higher diversity of mushrooms in 2015 (40.9 ± 1.5, Table 2, Appendices 8 and 9) than in 2014
35
(10.6 ± 1.7). Although lactation was retained in the best model evaluating mushroom diversity in female diet, it was not significant (Table 2).
We obtained similar results when also considering uncommon species, results were in the same direction for age ( = -50.2 ± 11.1, Appendices 10, 11 and 12) and year ( = 31.5 ± 5.5, Appendices 10, 11 and 12), but there was also a significant effect of condition and lactation. Deer in poor body condition consumed a higher diversity of mushrooms (56.1 ± 5.1; = -5.0 ± 2.1, Appendices 10, 11 and 12) than deer in good condition. In addition, lactating females consumed a higher mushroom diversity (90.2 ± 4.9; = 18.0 ± 8.3, Appendices 10, 11 and 12) than non-lactating females (72.2 ± 6.8).
Diversity and proportion of armillaroids
Deer consumed a higher diversity of armillaroids in 2015 (2.6 ± 0.1; =1.4 ± 0.2) than in 2014 (1.2 ± 0.1). Deer also consumed a higher diversity and proportion of
armillaroids in October (diversity: 2.3 ± 0.2; =0.7 ± 0.2; proportion: 0.11 ± 0.01; =0.04 ± 0.01) than in September (diversity: 1.6 ± 0.1; proportion: 0.073 ± 0.007). An interaction between sex and age ( =-1.2 ± 0.5) on the diversity of armillaroids in the
model Sex + Age + Sex:Age + Month + Year, but the most parsimonious model within a AICc<2 was Month + Year. Thus, we only kept this one. Juveniles consumed a higher proportion of armillaroids (0.12 ± 0.01; =0.05 ± 0.01) than adults (0.069 ± 0.005).
Diversity and proportion of polypores
Deer consumed a higher diversity of polypores in 2015 (1.23 ± 0.06; =-0.4 ± 0.1) than in 2014 (0.87 ± 0.06). They also consumed a higher diversity of polypores in October (1.27 ±
36
0.07; =0.15 ± 0.07) than in November (0.99 ± 0.09; =-0.1 ± 0.1). There was no effect of any variables on the proportion of polypores.
Diversity and proportion of lichens
All lichen species were considered uncommon species, thus we included all uncommon species in the analyses for lichens. Unlike other groups of mushrooms, deer consumed a higher diversity of lichens in 2014 (2.07 ± 0.09) than in 2015 (1.6 ± 0.1;
=-0.5 ± 0.1). Deer also consumed a higher diversity of lichens in November (2.4 ±
0.2; =0.9 ± 0.2) than in September (1.47 ± 0.08) and October (1.6 ± 0.1; =0.1 ± 0.1). There was also a significant effect of an interaction between lactation and month
( =-1.1 ± 0.5). Lactating females consumed a higher diversity of lichens in October (2.3 ± 0.3) than in September (1.5 ± 0.1) and November (2.0 ± 0.3), but non-lactating females consumed a higher diversity of lichens in November (3.0 ± 0.4), than in October (1.4 ± 0.3) and September (1.3 ± 0.1).
37 Table 2: The effect of age, lactation status and year on the diversity of mushrooms
consumed by white-tailed deer on Anticosti Island (Québec, Canada). The explanatory variable (category), estimate (β), standard error (SE), t-value (t) and p-value (P) of the male and female samples (a) and female only samples (b) for the best models (∆AIC<2 and ∆AICc < ) are shown. Intercept categories are adult, females and 2014.
Model
Explanatory variable
Β SE t P
a)
Age+Year Age (juvenile) -9.7 2.8 -3.5 0.0008 Year (2015) 30.3 1.7 17.8 <0.0001 b) Lactation+Year Lactation (lactating) 3.4 2.4 1.4 0.2 Year (2015) 31.5 2.3 13.7 <0.0001
Diversity and proportion of hypogeous fungi
Deer in better body condition consumed a smaller diversity of hypogeous fungi than deer in poorer body condition (0.96 ± 0.032, Table 3, Appendices 13 and 14). Also, deer consumed a higher diversity of hypogeous fungi in 2015 (diversity: 1.01 ± 0.04, Table 3, Appendices 13 and 14) than in 2014 (diversity: 0.90 ± 0.04). There was no effect of any variables on the proportion of hypogeous fungi (Appendices 15 and 16).