© Catherine Lalande, 2020
Intégrité de la muqueuse intestinale en présence
d'obésité, de résistance à l'insuline et de dyslipidémie
Mémoire
Catherine Lalande
Maîtrise en nutrition - avec mémoire
Maître ès sciences (M. Sc.)
Intégrité de la muqueuse intestinale en présence
d’obésité, de résistance à l’insuline et de
dyslipidémie
Mémoire
Catherine Lalande
Sous la direction de :
Alain Veilleux, directeur de recherche
Patrick Couture, codirecteur de recherche
iii
Résumé
Plusieurs études ont démontré des altérations de la muqueuse intestinale en contexte d’altérations métaboliques reliées à l’obésité chez des modèles animaux, et, plus récem-ment, des sujets humains. Toutefois, l’acquisition d’échantillons, effectuée par biopsies, est limitée par son caractère invasif. L’emploi de biomarqueurs sanguins de la fonction-nalité et de l’intégrité de l’intestin grêle permettrait d’augmenter le nombre de partici-pants humains, mais également d’inclure des participartici-pants en santé ne présentant pas de pathologies intestinales. L’objectif de cette étude est d’évaluer le potentiel de la citrulline et de la protéine de liaison aux acides gras spécifique à l’intestin (I-FABP) à percevoir les changements fonctionnels et morphologiques de la muqueuse intestinale de participants présentant un large éventail d’adiposité et de sensibilité à l’insuline. Nous avons démon-tré que les taux plasmatiques de citrulline, marqueur de la masse et de la fonctionnalité entérocytaire, étaient diminués en présence d’obésité, de résistance à l’insuline (RI) et de diabète de type 2. L’I-FABP, marqueur de l’apoptose entérocytaire est, quant à elle, aug-mentée chez les diabétiques de type 2 (DT2), principalement ceux dont le diabète n’était pas contrôlé. Le ratio I-FABP/citrulline, marqueur du renouvellement cellulaire, était plus élevé à la fois chez les hommes RI et DT2. Nos résultats démontrent la présence de chan-gements au niveau de la masse et de la fonctionnalité de la muqueuse intestinale en contexte d’altérations métaboliques associées à l’obésité, en particulier celles affectant l’homéostasie du glucose. L’utilisation de biopsies ou encore des méthodes d’imagerie par des études ultérieures serait bénéfique à la validation des changements morphologi-ques observés. Une meilleure connaissance de l’intestin grêle est essentielle afin de mieux comprendre son impact sur les maladies métaboliques ainsi que ses interactions avec le microbiote.
iv
Abstract
Several studies have shown small intestinal adaptations in obesity-related metabolic al-terations in both animal and human models. However, access to sample is impeded by the invasive procedure it requires. Using plasma biomarkers to assess small intestinal integ-rity and functionality could improve the sample size of studies, and also to include healthy subjects without enteropathies. Our goal is to evaluate citrulline and intestinal-specific fatty-acid binding protein (I-FABP) ability to assess functional and morphologi-cal changes in the small mucosa of men with a wide range of adiposity and insulin sensi-tivity. In our study, citrulline, a marker of enterocyte mass and function, was lower in subjects with obesity, insulin resistance and type 2 diabetes. I-FABP, an apoptosis marker, was higher in type 2 diabetic (T2D) men, especially those with uncontrolled T2D. I-FABP/citrulline ratio, a marker of enterocyte turnover, was higher in both T2D and insulin resistant (IR) men. In conclusion, alterations in small intestinal mucosa mass and integrity were observed in obesity-related metabolic alterations, especially those re-lated to glucose homeostasis. To assess morphological changes, biopsies or imagery should be included in future studies. A better understanding of the small intestine is cru-cial to understand its impacts on metabolic alteration and its interactions with the micro-biota.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations et des sigles ... ix
Remerciements ... xi
Avant-propos ... xii
Introduction ... 1
L’intestin grêle ... 1
Anatomie ... 1
Fonctions de la muqueuse intestinale ... 2
Homéostasie intestinale ... 5
Entéropathies ... 10
Obésité et diabète de type 2 ... 11
Obésité ... 11
Diabète de type 2 ... 12
Résistance à l’insuline ... 12
Impacts sur l’intestin grêle ... 16
Limites à l’étude de l’intestin grêle ... 18
Marqueurs de l’intégrité intestinale ... 19
Citrulline ... 19 I-FABP... 24 Objectifs ... 27 Objectif général ... 27 Hypothèses ... 28 Hypothèse générale ... 28 Hypothèses spécifiques... 28 Méthodologie ... 29 Population ... 29 Mesures en laboratoire ... 29 Analyses statistiques ... 30
Chapitre 1 : Biomarqueurs plasmatiques des adaptations de l’intestin grêle en contexte d’altérations métaboliques associées à l’obésité chez l’humain ... 31
Résumé ... 32 Abstract ... 33 Background ... 34 Methods ... 36 Results ... 38 Discussion ... 43 Conclusion ... 46 Tables ... 47
vi
Figures ... 50
Declarations ... 53
References ... 54
Discussion générale et conclusion ... 59
vii
Liste des tableaux
Introduction
Tableau 1 : Modulateurs de la prolifération intestinale ... 9
Chapitre 1
Table 1: Physical and metabolic characteristics of the study sample (n=221 men). ... 47 Table 2:Plasma amino acid profile in men (n=221) ... 48 Table 3: Linear regression analyses predicting plasma biomarkers in men. ... 49
viii
Liste des figures
Introduction
Figure 1 : Absorption des macronutriments au niveau de la lumière intestinale ... 3
Figure 2 : Modulation de la prolifération et de la différenciation des cellules épithéliales de l’intestin. ... 6
Figure 3:Organisation cellulaire des cryptes et villosités intestinales. ... 7
Figure 4 : Complications associées à l’obésité. ... 11
Figure 5 : Altérations morphologiques de la muqueuse intestinale en contexte d’obésité. ... 18
Figure 6 : Cycle de l’urée. ... 20
Figure 7 : Synthèse de la citrulline entérocytaire ... 21
Figure 8 : Cycle de l’oxyde nitrique. ... 22
Chapitre 1 Figure 1: Plasma citrulline levels associations with anthropometric and metabolic parameters in men. ... 50
Figure 2: Plasma I-FABP levels associations with anthropometric and metabolic parameters in men. ... 51
Figure 3: Plasma I-FABP-to-citrulline ratio associations with anthropometric and metabolic parameters in men. ... 52
ix
Liste des abréviations et des sigles
AAA: Acides aminés aromatiques (Aromatic amino acids) AGCC: Acides gras à courte chaîne
AGLC: Acides gras à longue chaîne Apo B-48 : Apoprotéine B-48
Arg : Arginine
ASA : Acide arginosuccinique ASL: Arginosuccinate lyase ASS: Arginosuccinate synthase AT: Amplificatrice transitoire
BCAA: Acide aminé à chaîne ramifiée (Branched-chain amino acids) BMI: Indice de masse corporelle (Body mass index)
CCK: Cholécystokinine
CPSI: Carbamylphosphate synthétase I
CRP: Protéine C-réactive (C-reactive protein) DT2 : Diabétiques de type 2
FABP: Protéine de liaison des acides gras (Fatty acid-binding protein) GALT: Tissu lymphoïde associé à l’intestin (Gut-associated lymphoid tissue) GFR: Débit de filtration glomérulaire (Glomerular filtration rate)
GIP : Peptide insulinotrope dépendant du glucose (Gastric inhibitory polypep-tide)
Gln: Glutamine
GLP-1 : Peptide-1 similaire au glucagon (Glucagon-like peptide-1) Glu : Glutamate
HbA1c : Hémoglobine glyquée
HDL-c: Lipoprotéine de haute densité (High-density Lipoprotein Cholesterol) HOMA-IR: Index de résistance à l’insuline (Homeostatic Model Assessment of
Insu-lin Resistance)
HTW: Taille hypertriglycéridémiante (Hypertriglyceridemic waist)
I-FABP: Protéine de liaison des acides gras spécifique à l’intestin (Intestinal fatty acid-binding protein)
x
IR: Résistant à l’insuline (Insulin resistant) IS: Sensible à l’insuline (Insulin sensitive)
LDL-c: Lipoprotéine de basse densité (Low-density lipoprotein cholesterol) L-FABP: Protéine de liaison des acides gras spécifiques au foie (Liver fatty
acid-binding protein)
LOD: Limite de détection (Limit of detection)
LOQ: Limite de quantification (Limit of quantification) NO: Oxyde nitrique (Nitric oxyde)
NOS : Oxyde nitrique synthase (Nitric oxyde synthase) OAT: Ornithine aminotransférase
OCT : Ornithine carbamoyltransférase Orn: Ornithine
Pro : Proline
RI : Résistants à l’insuline SI : Sensibles à l’insuline
T2D : Diabétiques de type 2 (Type 2 diabetics) TG: Triglycérides (Triglycerides)
UHPLC-MS: Chromatographie liquide à haute performance couplée à la spectromé-trie de masse (Ultra-high performance liquid chromatography tandem mass spectrometry)
VLDL: Lipoprotéines de très faible densité (Very low density lipoprotein) Δl-P5C : Δl-pyrroline-5-carboxylate
xi
Remerciements
Avant tout, je désire exprimer ma gratitude, qui va bien au-delà des mots, à ceux qui ont contribué à rendre cette expérience inoubliable. Je remercie mon directeur, Alain Veil-leux, pour sa patience, ses conseils et ses encouragements à pousser plus loin mes ré-flexions. Je remercie les membres de mon équipe pour leur générosité tant au niveau de leur temps qu’au niveau du partage de leurs connaissances. Je remercie également mon codirecteur, le Dr Couture, ainsi que son équipe sans qui ce projet n’aurait pas été le mê-me. À mes collègues de l’INAF, merci pour cette ambiance de travail unique. À mes amis, ma famille et ma tendre moitié, merci pour vos encouragements.
xii
Avant-propos
Les résultats présentés constituent le fruit de mon projet de maîtrise entrepris en janvier 2016 sous la direction du Dr Alain Veilleux. Les résultats qui en découlent ont été pré-sentés sous forme d’affiche aux congrès de la Société québécoise de lipidologie, de nutri-tion et de métabolisme (SQLNM) et de Digestive Disease Week (DDW) en 2017.
L’article inséré au second chapitre, dont je suis la première auteure, a été publié dans la revue Diabetology & Metabolic Syndrome. Mes principaux rôles du présent projet de recherche ont été la sélection des participants, l’optimisation des protocoles de dosage, le dosage des échantillons, la compilation et l’analyse des données, la présentation des ré-sultats lors de congrès ainsi que la rédaction de l’article.
Il m’est impossible de présenter ce projet sans mentionner la contribution de mes coau-teurs qui m’ont permis de le raffiner et d’en avoir fait ce qu’il est aujourd’hui. Je désire également souligner la contribution de l’équipe de la plate-forme analytique de l’INAF à la mise sur pied et à l’optimisation du protocole de dosage des acides aminés ainsi qu’à leur dosage. Je remercie également le Fonds de la recherche en santé du Québec, le Fonds de recherche du Québec - Nature et technologies, la Chaire de Nutrition de l’Université Laval ainsi que Diabète Québec pour leur soutien financier.
1
Introduction
L’intestin grêle
Anatomie
L’intestin grêle, communément appelé petit intestin, est la portion du système digestif reliant l’estomac et le côlon. De forme tubulaire, il mesure environ 3 mètres de long chez une personne vivante et peut atteinte jusqu’à 6,5 m après la mort suite au relâchement des muscles lisses1. Il est composé de trois segments distincts : le duodénum, le jéjunum et l’iléon. Le premier, d’une longueur de 25 cm, est directement rattaché au sphincter pylo-rique de l’estomac et est le lieu de rencontre entre le chyme alimentaire provenant de l’estomac et les sécrétions biliopancréatiques1.Le second, débutant au niveau du ligament de Treitz, mesure approximativement 1 mètre et est responsable de la majorité de l’absorption au niveau de l’intestin grêle1. Le troisième segment, d’une longueur d’environ 2 m, est également un lieu d’absorption et se termine au niveau de la valvule iléo-cæcale1.
L’intestin grêle est composé de 4 tissus distincts. Le premier, la séreuse, enveloppe la majorité de l’intestin grêle d’un mince tissu conjonctif, à l’exception d’un segment du duodénum. À l’intérieur de cette dernière se trouve la musculeuse, un tissu principale-ment composé de muscles lisses, qui est impliquée dans le péristaltisme et le brassage du chyme alimentaire. La couche suivante, composée de tissu conjonctif lâche, est la sous-muqueuse. Les vaisseaux sanguins et chylifères présents à ce niveau permettent le trans-port des nutriments absorbés. La sous-muqueuse permet également de fixer la dernière couche de tissu, la muqueuse intestinale.
La muqueuse intestinale est elle-même constituée de 3 tissus : la musculaire muqueuse, le chorion et l’épithélium. La première sous-couche comporte des cellules musculaires dont la contraction produit divers types de mouvements, comme la segmentation et le com-plexe de motilité migrante, qui favorisent à la fois la progression du chyme intestinal dans l’intestin grêle en plus de sa mise en contact avec la paroi intestinale. La seconde sous-couche est composée de tissu conjonctif lâche contenant des vaisseaux sanguins et
chyli-2
fères, des terminaisons nerveuses et du tissu lymphoïde. Sur ce tissu conjonctif repose l’épithélium qui forme une barrière semi-perméable entre la lumière intestinale et l’hôte. L’épithélium comporte plusieurs types cellulaires dont les entérocytes, les plus nom-breux, sont des cellules polarisées de forme allongée munies de microvillosités. Ces pro-jections cytoplasmiques ont pour fonction de faciliter l’absorption des nutriments en augmentant la surface de contact avec la lumière intestinale. Les entérocytes contribuent également au processus de digestion grâce aux enzymes situées dans la membrane plas-mique de leurs microvillosités. L’épithélium intestinal comporte également des cellules caliciformes, qui produisent du mucus, et des cellules de Paneth, qui sécrètent des pepti-des antimicrobiens. La muqueuse intestinale contient également pepti-des cellules entéroendo-crines libérant une variété de polypeptides qui permettent la régulation de la digestion au niveau intestinal. La combinaison de ces types cellulaires est essentielle à l’accomplissement des différents rôles de la muqueuse intestinale.
Fonctions de la muqueuse intestinale
Digestion, absorption et métabolisme
Le temps de transit des aliments dans l’intestin grêle varie entre 4 h et 8 h. La régulation de la digestion au niveau intestinal est effectuée par les cellules entéroendocrines qui sont responsables, entre autres, de la libération des sécrétions digestives dans la lumière intes-tinale. Les entérocytes contribuent également au processus de digestion en produisant des enzymes qui sont sécrétées dans la lumière ou intégrées à la bordure en brosse. C’est éga-lement à partir de ce point que les enzymes pancréatiques et les sels biliaires se mélan-gent au chyme. Un processus de digestion mécanique, la segmentation, est également présent à ce niveau.
L’intestin grêle est responsable de l’absorption d’environ 90 % des nutriments1. Cette dernière est facilitée par la présence de diverses structures qui permettent d’augmenter la surface de contact entre le chyme alimentaire et la muqueuse intestinale. Les plis circulai-res, situés au niveau de la sous-muqueuse, sont composés de crêtes faisant en tout ou en partie la circonférence intérieure de l’intestin grêle. Ces structures entraînent la
progres-sion du chyme en spirale plutôt qu’en ligne droite. L augmentée par les villosités, des rep
précédemment, les microvillosités présentes à la surface apicale des entérocytes contr buent également à maximiser la surface de contact avec le chyme intestinal.
de l’intestin grêle est composée
L’absorption des macronutriments par les entérocytes peut s’effectuer transport actif.
Suite à leur digestion, les macronutriments sont absorbés sous des formes plus simples. Les glucides sont absorbés sous forme de monosaccharides, les protéines sous forme d’acides aminés, de dipeptides et de tripeptides tandis que les
forme d’acides gras et de monoacylglycérol.
gnent la circulation sanguine par diffusion facilitée alors que les acides gras à chaîne courte (AGCC) l’atteignent par diffusion simple.
les acides gras à longue chaîne (AGLC) et les monoacylglycérols, des protéines de liaisons aux acides gras spécifiques au foie (L
Figure 1 : Absorption des macronutriments au niveau de la
3
sion du chyme en spirale plutôt qu’en ligne droite. La surface de contact est également augmentée par les villosités, des replis de la muqueuse intestinale. Comme
précédemment, les microvillosités présentes à la surface apicale des entérocytes contr buent également à maximiser la surface de contact avec le chyme intestinal.
sée d’entérocytes dont le rôle est l’absorption des nutriments. L’absorption des macronutriments par les entérocytes peut s’effectuer par diffusion ou
digestion, les macronutriments sont absorbés sous des formes plus simples. Les glucides sont absorbés sous forme de monosaccharides, les protéines sous forme d’acides aminés, de dipeptides et de tripeptides tandis que les lipides sont absorbés sous forme d’acides gras et de monoacylglycérol. Les monosaccharides et les peptides atte gnent la circulation sanguine par diffusion facilitée alors que les acides gras à chaîne courte (AGCC) l’atteignent par diffusion simple. Les particules lipidiques
les acides gras à longue chaîne (AGLC) et les monoacylglycérols, dépendent quant à elles des protéines de liaisons aux acides gras spécifiques au foie (L-FABP) et à l’intestin pour
Absorption des macronutriments au niveau de la lumière intestinale a surface de contact est également
intestinale. Comme mentionné précédemment, les microvillosités présentes à la surface apicale des entérocytes contri-buent également à maximiser la surface de contact avec le chyme intestinal. La majorité
st l’absorption des nutriments. par diffusion ou
digestion, les macronutriments sont absorbés sous des formes plus simples. Les glucides sont absorbés sous forme de monosaccharides, les protéines sous forme lipides sont absorbés sous Les monosaccharides et les peptides attei-gnent la circulation sanguine par diffusion facilitée alors que les acides gras à chaîne
rticules lipidiques non polaires, dépendent quant à elles FABP) et à l’intestin pour
4
leur transport cytosolique. Une fois les monoacylglycérols et les acides gras à chaîne lon-gue absorbés, ils sont réassemblés en triacylglycérols. Ces derniers sont alors intégrés aux chylomicrons qui vont être libérés par exocytose au niveau basolatéral des entérocytes pour rejoindre la circulation lymphatique. Il est à noter qu’une partie des glucides et des acides aminés absorbés est directement utilisée par les entérocytes. Ces derniers servent à combler leurs besoins énergétiques ou encore, dans le cas des acides aminés, à la synthè-se de protéines ou d’autres composés azotés.
Synthèse et sécrétions d’hormones
La coordination des processus digestifs de l’ingestion à l’élimination est régulée à la fois par le système nerveux et les hormones gastro-intestinales. Ces dernières, de nature poly-peptidique, permettent la gestion de la motilité intestinale et de la sécrétion d’une quantité suffisante d’enzymes afin d’optimiser le processus de digestion et d’absorption. La sécré-tion des enzymes pancréatiques et de la bile dans l’intestin grêle dépend de la cholécysto-kinine (CCK), la sécrétine et la somatostatine. Les deux premières la stimulent alors que la dernière l’inhibe. La régulation de la motilité gastro-intestinale, quant à elle, dépend de la CCK, la somatostatine, l’entéroglucagon, la sécrétine et du glucagon-like peptide-1 (GLP-1). Certaines hormones gastro-intestinales ont également des actions endocrines. La GLP-1, la CCK et le peptide insulinotrope dépendant du glucose (GIP) contribuent à la réduction de la prise alimentaire. La GLP-1, l’entéroglucagon et le GIP contribuent également au métabolisme du glucose en stimulant la sécrétion d’insuline par le pancréas. Contribution au système immunitaire
L’intestin grêle constitue une séparation entre le milieu extérieur et intérieur. La barrière intestinale est de nature à la fois chimique et mécanique. La barrière mécanique est assu-rée par un épithélium simple prismatique au renouvellement rapide ainsi que par la pré-sence de jonctions serrées qui comble l’espace entre les cellules. La barrière chimique est assurée par les cellules caliciformes et des cellules de Paneth, qui servent respectivement à limiter les contacts et la prolifération excessive des microorganismes présents à ce ni-veau. L’intestin grêle comporte également du tissu lymphoïde associé à l’intestin (GALT) ainsi que du tissu lymphoïde associé aux muqueuses. Le GALT est composé non
seule-5
ment de tissu lymphoïde diffus, mais également d’agrégats de follicules lymphatiques appelés plaques de Peyer. La présence de tissus lymphoïdes assure la protection de l’intestin grêle en permettant le stockage des cellules immunitaires (lymphocytes, leuco-cytes et macrophages) ainsi que l’induction de la réponse immunitaire. Les plasmoleuco-cytes et les lymphocytes B différenciés permettent, entre autres, l’inhibition de la translocation bactérienne et la croissance des bactéries pathogènes en produisant des anticorps de type IgA. Les cellules M sont situées au niveau des plaques de Peyer ou encore au niveau des villosités intestinales2. Elles participent à la surveillance immunitaire en fournissant des échantillons du contenu luminal de l’intestin grêle aux cellules immunitaires localisées à proximité de leur membrane basolatérale. Il a été démontré que cette tâche était égale-ment effectuée par les cellules caliciformes3.
Homéostasie intestinale
Renouvellement de la muqueuse intestinale
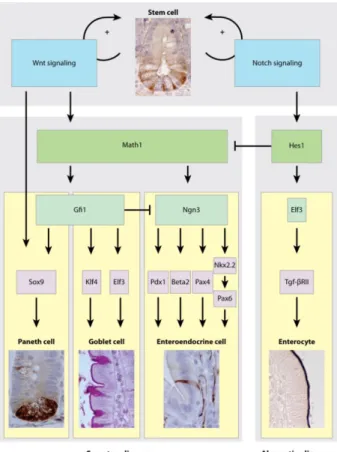
La vitesse moyenne de renouvellement de l’épithélium intestinal varie entre trois et cinq jours. La prolifération et le renouvellement cellulaire au niveau de la muqueuse intestina-le dépendent principaintestina-lement de la coordination des voies Wnt et Notch. La voie Wnt est essentielle à la polarisation, la prolifération, la migration et la différenciation des cellules en plus de moduler leur sensibilité à l’insuline. L’activation de la voie Wnt s’effectue lorsqu’une protéine wnt, une glycoprotéine modifiée localisée au niveau extracellulaire, se lie à une protéine de la famille Frizzled et à une protéine apparentée au récepteur de lipoprotéine de faible densité qui sont situées au niveau de la membrane cellulaire. Cela permet l’accumulation cytoplasmique de la β-caténine, et sa translocation vers le noyau. À ce niveau, la β-caténine se lie à d’autres facteurs de transcription et favorise l’expression génique. Tout comme la voie Wnt, la voie Notch est impliquée dans la proli-fération, la polarité ainsi que la différenciation cellulaire en plus de participer au maintien de la population des cellules souches4. Son activation s’effectue lorsqu’un récepteur pro-téique transmembranaire Notch se fixe à son ligand situé sur une cellule adjacente. Cette liaison entraîne le clivage des portions intra et extracellulaires du récepteur Notch. La
6
portion intracellulaire libérée est alors en mesure de se rendre au noyau où elle s’associe à des facteurs de transcription et favorise l’expression de certains gènes (Figure 2).
Les cellules épithéliales de l’intestin grêle proviennent des cellules souches situées au niveau des cryptes intestinales. Le résultat de la division des cellules souches dépend des voies métaboliques employées. Une division symétrique, favorisée par la voie Wnt, don-ne naissance à deux cellules souches ou deux cellules amplificatrice transitoire (AT) alors qu’une division asymétrique, impliquant la voie Notch, donne naissance à une cellule souche et une cellule AT. Les cellules AT vont par la suite effectuer quatre à cinq divi-sions avant de se spécialiser en cellules matures en fonction de la présence de divers fac-teurs de transcription.
Figure 2 : Modulation de la prolifération et de la différenciation des cellules épithéliales de l’intestin.
7
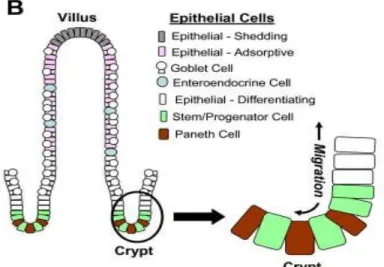
La première étape de la différenciation des cellules AT détermine si ces dernières appar-tiendront à la lignée absorptive ou sécrétrice. La première requiert l’activation de la voie Notch alors que la seconde requiert celle de la voie Wnt. Parallèlement à cette différen-ciation s’effectue un processus de migration. Excepté pour les cellules de Paneth qui mi-grent vers les cryptes intestinales, les cellules matures vont migrer vers l’extrémité des villosités intestinales (Figure 3). Une fois à proximité du sommet, les cellules matures entament un processus d’apoptose et se détachent de la muqueuse par desquamation6.
Figure 3:Organisation cellulaire des cryptes et villosités intestinales. Figure tirée de George et al.7
Adaptations physiologiques
L’intestin grêle possède une excellente capacité d’adaptation. Il est en mesure d’adapter sa masse, sa composition et sa fonctionnalité selon son environnement. Ces changements peuvent se produire par l’augmentation de la masse cellulaire, par la prolifération, ou encore par la modification de structures et fonctions existantes, comme des modifications de la perméabilité intestinale. Tel que démontré au tableau 1, une variété de modulateurs sont en mesure d’induire des adaptations morphologiques et fonctionnelles au niveau de l’intestin. De manière générale, une stimulation insuffisante de la muqueuse intestinale
8
par les différents modulateurs précédemment présentés entraîne son atrophie. Sa masse totale, tout comme son contenu en protéines et en ADN, diminue8. Sa fonction de barrière peut également être compromise étant donné l’augmentation de sa perméabilité8–10. Cette stimulation insuffisante peut être observée, entre autres, en contexte de jeûne.
Une étude effectuée chez des humains en santé a démontré que malgré sa capacité à com-bler les besoins protéino-énergétiques des participants, la nutrition parentérale (i.e. l’alimentation intraveineuse) entraînait la réduction de la longueur et la densité des villo-sités intestinales sans affecter significativement la perméabilité intestinale11. Toutefois, comme démontré par une étude animale, si l’exclusion est limitée à une section de l’intestin grêle, c’est plutôt une hypertrophie des segments restants qui est observée12.
Tout comme l’exclusion de nutriments, leur présence en quantité insuffisante entraîne des altérations au niveau de la muqueuse intestinale. Une étude évaluant l’effet de la propor-tion de la réducpropor-tion des apports caloriques chez des souris a démontré qu’une restricpropor-tion de 25 % durant une période de 2 jours était suffisante pour induire une diminution de la prolifération des cellules intestinales, mais que seules les souris à jeun depuis cette même période présentaient une diminution du nombre de villosités et une augmentation de l’apoptose13. Une autre étude, cette fois-ci chez des patients en soins aigus, a permis de constater l’augmentation de la perméabilité de la muqueuse intestinale en contexte de dénutrition9.
Les altérations morphologiques et fonctionnelles de l’intestin varient considérablement en fonction des dispositifs expérimentaux, mais également selon le type de sujets employés et de leur état de santé initial. Ces études mettent en relief la complexité de la réponse de l’intestin grêle aux stimuli du milieu externe et interne. Ses mécanismes d’adaptations sont essentiels afin de répondre de manière appropriée aux variations de son environne-ment.
9
Tableau 1 : Modulateurs de la prolifération intestinale
Stimuli Masse intestinale Prolifération cellulaire Longueur villosités Profondeur cryptes Apoptose Hormones Bombésine ↗ 14,15 Cholécystokinine ↗16 Gastrine ↗ 17 Glucagon ↗16 Glucagon-like peptide-2 ↗ 18 ↗18 ↗18 Insuline ↗19 Neurotensine ↗ 15,20 Peptide YY ↗21 Somatotrophine ↗19 Transforming growth factor-α ↗ 22 ↗22 ↗22
Cytokines Facteur de croissance
analogue à l’insuline ↗19 ↗23 ↗23
Facteur de croissance
dérivé des plaquettes α ↗24 ↗24 ↗24
Facteur de croissance des fibroblastes ↗22 Facteur de croissance des kératinocytes ↗25 Facteur de croissance épidermique ↗26 Interleukine-11 ↗27
Forces mécaniques Déformation ↗28
Sécrétions digestives Sécrétions pancréatico-
biliaires ↗29 Nutriments Butyrate ↗ 30 ↗30 ↗30 ↗30 Amines et polyamines ↗ 31 Arginine (Arg) ↗32 ↗32 ↗32 ↗32 ↘32 Disaccharides ↗33 Fibres ↗ 34 ↗34 ↗34 Fructooligosaccharides à chaînes courtes ↗35 ↗35 ↗35 ↘35 Glucose ↗ 36 ↗37 Glutamine ↗38,39
10
Entéropathies
La présence de pathologies intestinales est un élément perturbateur du maintien de l’homéostasie de l’intestin grêle. Ces dernières, selon leur gravité, entraînent d’ailleurs une variété d’altérations morphologiques et fonctionnelles. La maladie de Crohn fait par-tie des maladies inflammatoires de l’intestin et peut affecter à la fois l’intestin grêle et le côlon. D’étiologie inconnue, elle est caractérisée par une réaction inappropriée du systè-me immunitaire localisée à une section restreinte de l’intestin. La partie touchée présente une perméabilité accrue de la muqueuse qui entraîne à terme une augmentation de la mor-talité des cellules intestinales.
Une autre pathologie affectant l’intestin grêle est la maladie cœliaque. Causée par une allergie à la gliadine, une protéine présente dans plusieurs céréales, elle entraîne une hy-perplasie des cryptes intestinales, l’atrophie des villosités ainsi que des changements morphologiques et fonctionnels au niveau des entérocytes40. Si les biopsies et les endos-copies sont obligatoires afin de mener à leur diagnostic, le suivi de leur progression, comme l’état inflammatoire, l’apoptose cellulaire et les changements de perméabilité de la muqueuse, peut s’effectuer à partir de marqueurs sérologiques. D’étiologies diverses, la maladie de Crohn et la maladie cœliaque comportent toutes deux un élément inflamma-toire induisant l’augmentation de la mortalité cellulaire.
En plus de cette perte d’intégrité, ces pathologies causent des altérations fonctionnelles au niveau de la muqueuse intestinale. La réduction de la masse entérocytaire entraîne la di-minution de l’absorption des nutriments en plus de limiter la digestion de certains, com-me le lactose, dont la digestion dépend des enzycom-mes de la bordure en brosse. La mortalité cellulaire excessive a également pour effet d’affaiblir la barrière intestinale. Le renouvel-lement cellulaire insuffisant ainsi que la dénaturation des jonctions serrées entraînent l’augmentation de la perméabilité intestinale, exacerbant ainsi la réaction inflammatoire. Ce lien entre les altérations de la muqueuse intestinale et des composantes inflammatoires a également été exploré en contexte de maladies systémiques, telles que l’obésité et le diabète de type 2, qui ne sont traditionnellement pas associées à l’intestin.
11
Obésité et diabète de type 2
Obésité
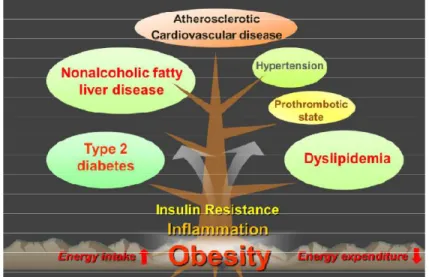
Selon l’Organisation mondiale de la Santé, l’obésité se définit par une masse adipeuse excessive représentant un risque pour la santé étant donné que les altérations systémiques qui en découlent augmentent la susceptibilité à d’autres pathologies chroniques (Figu-re 4)41. Elle correspond à un indice de masse corporelle supérieur à 30 kg/m2. D’étiologie multiple, cette masse adipeuse est le résultat d’un apport énergétique supérieur aux be-soins.
Organes affectés
Le stockage des nutriments énergétiques se fait principalement au niveau du tissu adi-peux. Ces derniers sont convertis en acides gras et stockés au niveau des adipocytes. Afin de s’adapter aux besoins de stockage, les adipocytes peuvent s’hypertrophier ou prolifé-rer. Toutefois, ce procédé comporte des limites. Lorsque les capacités de stockage du tissu adipeux sont atteintes, les acides gras excédentaires s’accumulent au niveau ectopi-que (i.e. abdominal, omental, péricardiectopi-que, périrénal et rétropéritonéal) et intracellulaire (i.e. au niveau du foie, du muscle squelettique, du cœur, du pancréas, du rein)43.
Cepen-Figure 4 : Complications associées à l’obésité. Figure tirée de Jung et al.42
12
dant, puisque ces organes ne sont pas adaptés à cette charge lipidique supplémentaire, leur fonction s’en trouve perturbée. Les adaptations inadéquates du tissu adipeux à des apports énergétiques excédant les besoins incluent l’augmentation excessive de la taille et du nombre de cellules adipeuses, la vascularisation insuffisante du tissu adipeux ainsi que son infiltration par les cellules immunitaires43–45. Ces dernières, avec l’altération de la sécrétion d’adipokines et de cytokines par les adipocytes et les cellules immunitaires in-filtrées, contribuent à l’inflammation systémique chronique de faible intensité 42–44.
Diabète de type 2
Le diabète de type 2 est une hyperglycémie chronique se développant suite à l’incapacité du pancréas à sécréter suffisamment d’insuline afin de réguler la glycémie. Représentant 90 % des cas de diabète, il est principalement causé par une surcharge pondérale et l’inactivité physique46.Tout comme l’obésité, cette pathologie est à l’origine d’autres changements métaboliques qui peuvent exacerber les problèmes métaboliques préexis-tants.
Résistance à l’insuline
L’insuline est une hormone anabolique sécrétée par les cellules β du pancréas. La liaison de l’insuline à son récepteur, présent sur la face extracellulaire des cellules du rein, du muscle squelettique et cardiaque ainsi que du foie, déclenche une cascade de réactions stimulant, entre autres, l’absorption du glucose sanguin47. La résistance à l’insuline se définit comme étant une diminution de son efficacité à déclencher cette cascade. Elle constitue une réaction physiologique normale à la grossesse, la puberté, au vieillissement ainsi qu’en réaction au stress et à l’augmentation du poids corporel. Elle se manifeste également en contexte pathologique en présence d’un surplus de poids, d’obésité, d’utilisation excessive de glucocorticoïdes, de lipodystrophie ou encore de réactions auto-immunes aux cellules β du pancréas ou aux récepteurs de l’insuline. Pour compenser cet-te résistance, le pancréas va sécrécet-ter davantage d’insuline. À cet-terme, les complications de l’obésité combinée à la résistance à l’insuline, incluant l’accumulation d’acides gras dans les cellules B, vont entraîner la dysfonction de ces cellules sécrétrices d’insuline et l’installation du diabète de type 2.Étant donné le rôle anabolique de cette hormone,
13
l’installation de la résistance à l’insuline entraîne des altérations significatives au niveau du métabolisme des macronutriments.
Impact sur le métabolisme du glucose
Comme mentionné précédemment, l’insuline est indispensable au contrôle de la glycé-mie. Lorsque cette dernière s’élève, par exemple à la suite d’un repas, l’insuline sécrétée stimule l’absorption des glucides au niveau du muscle lisse, du tissu adipeux et du foie. Elle est également impliquée dans la mise en réserve de ces glucides sous forme de gly-cogène au niveau du foie et du muscle en plus de limiter leur catabolisme par la gluco-néogenèse et la glycogénolyse. L’altération de la sensibilité à l’insuline en contexte d’obésité ou de diabète de type 2 contribue à l’altération de ces mécanismes. Il a été dé-montré que l’efficacité de l’inhibition de la gluconéogenèse ainsi que de la contribution de la glycolyse à la glycémie était diminuée en présence d’obésité48. D’autres altérations telles que la réduction de la synthèse de glycogène sont également observées49.
Impact sur le métabolisme des lipides
L’insuline joue également un rôle au niveau de l’homéostasie des lipides. Au niveau du tissu adipeux, elle stimule l’activité de la lipoprotéine lipase, dont le rôle consiste à ex-traire les acides gras libres des lipoprotéines de très faible densité (VLDL), en plus de limiter la libération en circulation de glycérol et d’acides gras libres par lipolyse50. Au niveau du foie, cette hormone limite la production de l’apoprotéine B, et indirectement de la synthèse de VLDL, en réduisant la disponibilité des lipides sanguins50. En présence de résistance à l’insuline, l’efficacité de ces mécanismes est compromise. Cette augmenta-tion de la lipogenèse hépatique en contexte de résistance à l’insuline est d’ailleurs en par-tie responsable du développement de la stéatose hépatique. Comparativement aux indivi-dus sensibles à l’insuline (SI), les taux plasmatiques d’acides gras libres postprandiaux sont plus élevés chez les individus RI et DT251,52. Une étude cinétique évaluant la synthè-se et la composition des lipoprotéines chez des individus d’IMC normal et obèsynthè-ses avec et sans diabète de type 2 a également souligné plusieurs différences entre ces groupes. L’activité de la lipoprotéine lipase adipeuse était réduite chez les sujets obèses et DT2 comparativement aux deux autres groupes53. Ces derniers présentaient également une aire
14
sous la courbe des triglycérides (TG) plasmatiques postprandiaux plus grande53. La com-position des VLDL de haute densité (60-400 S) différait également entre les groupes. Comparativement aux individus de poids normal, l’augmentation de l’aire sous la courbe des TG et du cholestérol contenu dans les VLDL de haute densité était plus élevée chez les sujets obèses, qu’ils soient ou non diabétiques, que chez les sujets de poids normal en période postprandiale53. En ce qui a trait aux taux plasmatiques de l’apoprotéine B-100, ceux-ci étaient plus élevés chez les sujets RI autant à jeun qu’en période postprandiale53. Au niveau du muscle, une autre étude a démontré une altération de l’oxydation des acides gras en présence de résistance à l’insuline54. La présence d’acides gras libres en circula-tion peut également exacerber la résistance à l’insuline et affecter le métabolisme du glu-cose.
Impact sur le métabolisme des acides aminés plasmatiques
Les taux plasmatiques des acides aminés dépendent de l’apport alimentaire, de leur capa-cité d’absorption par le foie au niveau de la veine porte hépatique, du catabolisme protéi-que endogène, de la conversion de substrats non protéiprotéi-ques (tel protéi-que le glucose en alanine) et de la conversion en un autre acide aminé au niveau d’un organe (comme la production de glutamine et d’alanine à partir d’acides aminés à chaîne ramifiée (BCAA) au niveau du muscle squelettique).L’homéostasie des acides aminés est influencée par l’insuline puisque cette dernière favorise l’absorption des acides aminés alimentaires ainsi que la synthèse protéique au niveau du muscle squelettique en plus de bloquer la protéolyse et la néoglucogenèse. Une étude effectuée chez des individus obèses hyperinsulinémiques a démontré que la synthèse protéique, suite à l’infusion d’insuline, était moins stimulée dans ce groupe que chez les sujets de poids normal, mais que l’inhibition du catabolisme protéique était équivalente48. De plus, une contribution plus élevée de la néoglucogenèse à la glycémie a également été observée pour ce groupe48.
Au niveau du profil des acides aminés plasmatiques, plusieurs études ont relevé des diffé-rences entre les individus DT2 et les non-diabétiques, mais également entre les sujets obèses et ceux de poids normal. Des associations entre le degré et le type d’obésité ont mis en relief des différences au niveau des acides aminés à chaîne ramifiée, la citrulline,
15
la cystine, la glutamine, le glutamate, la glycine et le tryptophane55. L’accumulation de glutamate a également été associée à la présence d’obésité viscérale56. Au niveau des associations entre la résistance à l’insuline, mesurée par l’index de résistance à l’insuline (HOMA-IR), elles ont été observées au niveau de la citrulline, la glutamine, du glutama-te, la glycine, la tyrosine ainsi que de la valine55. Il a également été démontré que les ef-fets négatifs de l’obésité et du diabète de type 2 sur le profil des acides aminés plasmati-ques étaient cumulatifs57.
Les principaux acides aminés étudiés en lien avec l’obésité et le diabète sont les BCAA et les acides aminés aromatiques (AAA). Les niveaux de BCAA musculaires et plasmati-ques sont augmentés en contexte d’obésité, dans certaines études indépendamment de la sensibilité à l’insuline et de diabète de type 254,56,58,59. Cette accumulation de BCAA sem-ble être due à la réduction de l’expression de la 3-méthyl-2-oxobutanoate déshydrogéna-se, l’enzyme essentielle au catabolisme de ces acides aminés58,60. Certaines études tentent également de déterminer si l’élévation des taux de BCAA pourrait exacerber la résistance à l’insuline étant donné sa participation à l’inactivation du substrat du récepteur à l’insuline de type 161–63. En présence de surpoids et d’obésité, une augmentation des AAA a également été observée59. En quantité excessive, le produit de leur métabolisme, les catécholamines, peuvent causer des d’altérations de la fonction hépatique qui, à leur tour, entraînent l’exacerbation de l’hyperinsulinémie et de la dyslipidémie61.
Étant donné la diminution de la synthèse d’oxyde nitrique en contexte d’obésité et de diabète de type 2, la variation des taux plasmatiques des acides aminés impliqués dans sa synthèse, soit la citrulline et l’Arg a également été étudiée64,65. Les associations récurren-tes entre le profil des acides aminés plasmatiques avec l’obésité et le diabète de type 2 évoquent la possibilité d’utiliser ce dernier comme outil d’évaluation de la santé métabo-lique. Les BCAA, les AAA ainsi que d’autres aminés et métabolites ont d’ailleurs déjà été utilisés comme marqueurs du développement et de la progression de résistance à l’insuline, du diabète, du syndrome métabolique et de l’hypertension54,61,63,66,67.
16
Impacts sur l’intestin grêle
Traditionnellement, l’intestin grêle est considéré comme un organe du système digestif dont la seule fonction est l’absorption. Donc, à l’exception des entéropathies, qui en af-fectent directement la structure, l’étude de cet organe au niveau de l’homéostasie corpo-relle est restreinte. Comme mentionné précédemment, l’obésité et le diabète de type 2 affectent de nombreux organes, notamment le foie, le tissu adipeux et les muscles. Toute-fois, selon la littérature, l’intestin grêle devrait également être ajouté à cette liste.
Altérations métaboliques
Tel que démontré par la présence d’inflammation jéjunale chez des sujets obèses, l’état inflammatoire observé en contexte d’obésité touche également l’intestin grêle68. La mu-queuse intestinale de cette population présente également une susceptibilité accrue à in-flammation chronique de faible niveau ainsi que la présence de stress oxydatif en contex-te de résistance à l’insuline69. L’obésité induite par la diète ainsi que la présence de diabè-te de type 2 peut également causer l’augmentation de la perméabilité indiabè-testinale70,71.
Quelques études ont suggéré que l’intestin grêle, comme le muscle, le foie et le tissu adi-peux peut développer une résistance à l’insuline locale68,69,72. Tout comme au niveau des autres organes métaboliques, cette dernière serait responsable des changements au niveau du métabolisme des macronutriments. La résistance à l’insuline locale contribuerait à l’augmentation de l’efficacité du transport et de l’absorption du glucose. En effet, l’activité de la sucrase est augmentée et la présence des transporteurs de glucose GLUT 2 à la surface apicale des entérocytes, qui est habituellement confiné à la surface basolaté-rale, a été observée68,72–74. Une étude chez le rat a également démontré la présence de néoglucogenèse intestinale à partir de glutamine et de glycérol suite à une insulinopénie causée par un jeûne de 48 h ou par un diabète induit par la streptozocine75.
Tout comme au niveau du foie, l’insuline a également un impact sur le transport et l’absorption des lipides. La résistance à l’insuline est associée à une lipogenèse intestinale de novo augmentée69. Elle est également associée au métabolisme de l’apoprotéine B-48 (apo B-48), essentielle à l’assemblage des chylomicrons. En contexte de résistance à
17
l’insuline et de DT2, une production accrue de celle-ci par l’intestin grêle a été obser-vée51,53,69,76. Une étude de cinétique a aussi démontré la capacité de l’insuline à inhiber, lors d’un clamp hyperinsulinémique, la synthèse de l’apoprotéine B-48chez des sujets en santé77. Toutefois, aucun effet inhibiteur de l’insuline sur la production de chylomicrons n’a été observé chez des individus DT2 et obèses RI78,79. Il est également pertinent de mentionner que les chylomicrons produits par les sujets RI sont plus riches en TG compa-rativement à ceux de sujets SI53,69.
Altérations morphologiques
L’obésité et le diabète de type 2 induisent des altérations au niveau de la prolifération et du renouvellement cellulaire. En effet, il a été constaté, avec divers modèles animaux, que la prolifération cellulaire était augmentée en contexte d’obésité induite par la diète ou de diabète induit par steptozocine74,80–84. L’étude de ce phénomène chez des souris avec un diabète induit par steptozocine a permis de souligner l’impact de la progression de l’hyperglycémie sur l’altération de la voie Notch, qui est à l’origine de cette différencia-tion anormale des cellules souches82. Au niveau des études chez l’humain, les résultats varient selon le devis de l’étude et du type d’échantillon sélectionné. Comparativement aux sujets minces, les sujets obèses avec et sans diabète de type 2 présentent une prolifé-ration cellulaire plus importante68. L’utilisation exclusive de sujets présentant une obésité morbide a également permis de démontrer que la prolifération cellulaire était plus impor-tante en présence d’hyperglycémie chronique, mais inchangée en présence de résistance à l’insuline sans hyperglycémie69,85. La mortalité cellulaire est également affectée par ces deux conditions. L’apoptose des cellules épithéliales intestinales est diminuée chez les individus obèses, mais augmentée chez les DT268,86. Cette augmentation de la proliféra-tion cellulaire, et de la réducproliféra-tion de la mortalité cellulaire dans le cas de l’obésité, est à l’origine de l’augmentation de la taille des villosités et des cryptes jéjunales observées en présence de ces pathologies68,74,87. Ce phénomène contribue à l’augmentation du volume total, et donc de la surface de contact avec la lumière intestinale68,72.
En contexte d’apports énergétiques supérieurs aux besoins, davantage de nutriments sont présents au niveau de la lumière intestinale. Ces derniers sont en partie responsables de
18
l’augmentation de la prolifération cellulaire ayant pour conséquence l’augmentation de la longueur et du poids de l’intestin grêle74. Il a également été démontré que cette proliféra-tion accrue et l’augmentaproliféra-tion du poids total de l’intestin sont normalisées suite à une res-triction calorique74. Ces résultats soulignent à la fois l’impact des nutriments sur la mor-phologie intestinale, mais également la plasticité de cet organe.
Figure 5 : Altérations morphologiques de la muqueuse intestinale en contexte d’obésité. Figure tirée de Dailey37
En plus de modifier la masse intestinale totale, l’obésité et le diabète affectent également le processus de différenciation cellulaire. Il en résulte que la proportion des types de cel-lules épithéliales matures est modifiée. Une augmentation du nombre d’entérocytes et de cellules caliciformes a été observée chez des individus obèses morbides en présence d’hyperglycémie ou de résistance à l’insuline85,88. Toutefois, la taille des cellules gobelet et entérocytes demeure inchangée68. Une réduction du nombre de cellules entéroendocri-nes a également été observée au niveau du duodénum de ces sujets88. Il est également possible que, dans certaines situations, le diabète de type 2 entraîne plutôt l’atrophie de la muqueuse intestinale et la diminution du volume des villosités89.
Limites à l’étude de l’intestin grêle
Tout comme en contexte de pathologies intestinales, les altérations morphologiques et métaboliques existent conjointement au niveau de l’intestin grêle en contexte d’obésité et de diabète de type 2. Toutefois, l’étude de l’intestin grêle en absence d’entéropathies ou
19
de cancer est limitée chez l’humain. En effet, l’obtention d’échantillons requiert une biopsie, une méthode invasive généralement réservée à des cas d’entéropathie confirmée ou encore à certaines chirurgies abdominales. Il en résulte que dans certaines études, le groupe contrôle est constitué d’individus présentant un cancer, une entéropathie en phase de rémission ou encore d’autres pathologies, qui sont connues pour altérer le métabolisme global, plutôt que des individus en santé. Malgré la pertinence de ces études, ces derniè-res sont difficilement applicables à une population plus générale. De plus, cette derniè-restriction de l’accès aux biopsies constitue une barrière à l’étude de la progression des altérations de la fonctionnalité et de l’intégrité de la muqueuse intestinale au fil de la dégradation de la condition métabolique des individus. Quelques études ont employé une gastroentéros-copie afin de prélever des échantillons de la muqueuse intestinale, mais leur nombre de participants était restreint51,90–93. L’utilisation de biomarqueurs sanguins de l’intégrité intestinale tels que la citrulline et l’I-FABP permettrait d’étudier ces altérations sur un plus grand nombre d’individus ayant des profils métaboliques variés.
Marqueurs de l’intégrité intestinale
Citrulline
La citrulline est un acide aminé hydrosoluble non essentiel. Elle est présente en faible quantité dans plusieurs cucurbitacées (courges), mais ses niveaux plasmatiques sont prin-cipalement influencés par sa synthèse endogène via les cycles de l’urée et de l’oxyde ni-trique. Elle est considérée comme nonprotéinogène puisqu’il n’existe pas de codon pour cet acide aminé chez l’humain. Toutefois, il arrive qu’elle soit intégrée à des protéines suite à des modifications post-traductionnelles.
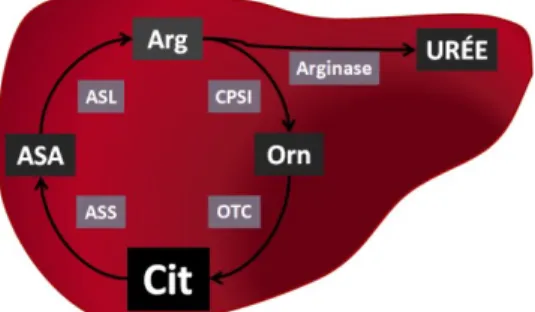
Cycle de l’urée
La citrulline constitue un intermédiaire de cette réaction effectuée principalement au ni-veau du foie par les hépatocytes. Le cycle de l’urée permet la conversion de l’ammoniac (NH4+) produit par le métabolisme protéique en urée selon l’équation suivante :
20
Comparativement à l’ammoniac, l’urée est moins toxique et plus facilement éliminée étant donné sa solubilité plus élevée.
Figure 6 : Cycle de l’urée.
Le cycle de l’urée débute au niveau mitochondrial où la carbamylphosphate synthétase I (CPSI) utilise 2 ATP et du CO2 afin de transformer l’ammoniac en carbamylphosphate.
Le produit de cette réaction, ainsi que l’ornithine présente au niveau de la mitochondrie, sont par la suite utilisés comme substrats par l’ornithine carbamoyltransférase(OCT) afin de synthétiser de la citrulline. Le cycle de l’urée se poursuit dans le cytosol où arrive la citrulline par diffusion facilitée. Cette dernière, avec l’aspartate et l’ATP, sont utilisées par l’arginosuccinate synthase (ASS) afin de produire l’acide arginosuccinique (ASA), lui-même transformé en arginine (Arg) et en fumarate par l’arginosuccinate lyase (ASL). La dernière étape de ce cycle est le métabolisme de l’Arg par l’arginase qui permet la synthèse d’ornithine, qui peut être utilisée pour recommencer le cycle, et d’urée.
Au niveau des entérocytes, ce cycle est incomplet étant donné l’absence d’ASS et d’ASL cytosoliques94. La citrulline synthétisée par les entérocytes n’est donc pas métabo-lisée, mais plutôt libérée en circulation. C’est lors de son passage au niveau du rein que la citrulline est métabolisée en Arg grâce à l’ASS et l’ASL qui y sont présentes. L’action conjointe de l’intestin grêle et du rein a pour principale fonction la synthèse endogène d’Arg. La contribution de la citrulline au taux plasmatique d’Arg a été estimée à 11 % 95.
21
Figure 7 : Synthèse de la citrulline entérocytaire
Au niveau de l’intestin, la proline, la glutamine, le glutamate et l’Arg peuvent servir de précurseurs de la citrulline par leur transformation en ornithine au niveau de la mitochon-drie. Leur contribution respective varie avec l’âge et l’espèce des sujets étudiés96–101. À l’exception de l’Arg et la glutamine qui peuvent également provenir de la circulation, ces précurseurs sont d’origine alimentaire98,100–106. La transformation de la proline en ornithi-ne débute par sa conversion en Δl-pyrroline-5-carboxylate (Δl-P5C) par la proline oxyda-se. La Δl-P5C est ensuite convertie en ornithine par l’ornithine aminotransférase (OAT). La glutamine, pour sa part, est d’abord transformée en glutamate par la glutaminase. Le glutamate ainsi produit en plus de celui provenant de la lumière intestinale peuvent ensui-te être convertis en Δl-P5C par la Δl-P5C synthase puis en ornithine par l’OAT. L’Arg est convertie en ornithine via l’action de l’arginase de type 299,101,107.
Cycle de l’oxyde nitrique
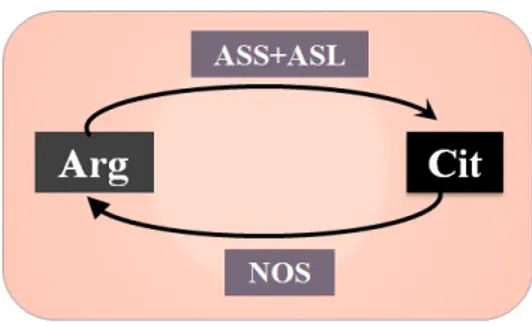
La citrulline est également un produit secondaire du cycle de l’oxyde nitrique (NO). La production de NO s’effectue à partir d’Arg via l’oxyde nitrique synthase (NOS) selon l’équation suivante108 :
22
Figure 8 : Cycle de l’oxyde nitrique.
Au total environ 1.2 % du flux d’Arg contribue à la synthèse de NO95. La NOS est com-posée de trois familles : la forme neuronale, inductible et endothéliale. Le NO joue un rôle-clé dans la transmission des influx nerveux, la défense contre les pathogènes comme les bactéries, la dilatation des vaisseaux sanguins et la relaxation des muscles lisses. Les cellules en produisant, soit les neurones, les macrophages et les cellules endothéliales, produisent également de l’ASL et de l’ASS. Ces enzymes permettent de recycler la majo-rité de la citrulline produite localement en Arg via le cycle citrulline-NO109.
Applications
La citrulline est considérée par certains auteurs comme une forme masquée de l’Arg puisque contrairement à cette dernière, elle peut contribuer au pool plasmatique d’Arg sans être métabolisée par le foie. De façon générale, la synthèse entérocytaire de la citrul-line est considérée comme une méthode d’épargne d’azote chez les omnivores, car elle limite le catabolisme protéique excessif au niveau du foie110–112. La citrulline intrahépati-que, contrairement à la citrulline d’origine entérocytaire, ne participe pas au pool plasma-tique de citrulline étant donné qu’elle est métabolisée au fur et à mesure qu’elle est pro-duite. Pour cette raison, l’intestin grêle est considéré comme le principal contributeur des niveaux plasmatiques de citrulline94,113. Cette caractéristique de la citrulline a permis son utilisation comme marqueur de la masse intestinale dans plusieurs études113,114.
La citrulline plasmatique ne permet pas d’identifier le segment intestinal réséqué115. Tou-tefois, puisque sa synthèse est proportionnelle à la masse entérocytaire, il a été possible
23
d’évaluer la longueur fonctionnelle de l’intestin restante suite à une résection en plus de pouvoir prédire la réversibilité du syndrome de l’intestin court et le rejet d’une gref-fe intestinale115–119. Elle a été utilisée comme marqueur non invasif de la dysfonction in-testinale chez des modèles animaux de sepsis, mais également pour des humains aux soins intensifs120,121. Une étude démontrant la normalisation de la citrullinémie suite au traitement approprié des infections intestinales et des entéropathies chez patients porteurs du VIH contribue également à souligner le lien entre cet acide aminé et l’intégrité de la muqueuse intestinale122.
En présence du syndrome de l’intestin court, de la maladie cœliaque et de la maladie de Crohn, cet acide aminé a été employé afin d’évaluer la sévérité de l’atrophie des villosi-tés intestinales123,124. Des études ont démontré le potentiel de la citrulline comme mar-queur de la fonctionnalité entérocytaire116,122,125. Deux d’entre elles ont démontré que la citrullinémie postabsorptive était corrélée avec la digestion nette des lipides et qu’elle peut être utilisée pour déterminer la pertinence de l’utilisation de la nutri-tion parentérale116,122. La citrulline a été utilisée dans diverses études de pathologies avec une composante inflammatoire, comme la pancréatite et le sepsis, afin de mesurer l’activité de l’oxyde nitrique107,126,127.
Cet acide aminé ainsi que les autres intermédiaires du cycle de l’oxyde nitrique ont aussi été mesurés dans des cohortes humaines chez des sujets obèses et DT2. Les dosages avaient pour principaux objectifs la mesure de la biodisponibilité de l’Arg et de l’activité de la NOS ainsi que leurs liens avec des facteurs de la santé métabolique tels que le ris-que de syndrome métaboliris-que, l’inflammation et/ou la résistance à l’insuline65,128–130. La citrulline est également incluse dans des études centrées sur la comparaison des profils des acides aminés plasmatiques de sujets de poids normal ou obèses55,57,131. Cependant, contrairement aux études centrées sur les pathologies intestinales, celles effectuées avec des cohortes d’individus obèses ou présentant des altérations de l’homéostasie du glucose n’ont pas autant approfondi les causes et les implications des fluctuations des niveaux plasmatiques de la citrulline.
24
I-FABP
Description et synthèse
La famille des protéines de liaison des acides gras (FABP) se compose d’une douzaine de protéines de 14-15 kD chacune codée par un gène distinct. Comme leur nom l’indique, les FABP sont des protéines impliquées dans le transport intracellulaire des AGCL. De-puis quelques années, les FABP suscitent un intérêt grandissant étant donné leur potentiel de marqueur précoce de dommages cellulaires. En effet, leur faible poids moléculaire est à l’origine de leur libération rapide en circulation suite à l’apoptose. Il est également im-portant de mentionner que puisque leurs taux plasmatiques sont presque nuls en condition normale, leur apparition est facilement mesurable en condition pathologique. Cet avanta-ge a déjà été démontré dans le cas de la FABP spécifique au cœur qui permet le diagnos-tic d’infarctus du myocarde aigu aussi efficacement que la myoglobine, mais de manière plus précoce132. Au niveau de l’intestin grêle, trois FABP sont exprimées : la L-FABP, spécifique au foie, l’Il-FABP, spécifique à l’iléon et l’I-FABP, spécifique à l’intestin. La L-FABP est codée par le gène FABP1 situé sur le chromosome 2. Initialement décou-verte au niveau du foie, elle est également présente au niveau de l’intestin et du rein. Au niveau de l’intestin grêle, la L-FABP est principalement exprimée dans les entérocy-tes matures133. Elle a pour principale fonction la formation de phospholipides, la synthèse des chylomicrons, la protection de la muqueuse intestinale ainsi que la régulation de cer-tains gènes134,135. Contrairement à la majorité des FABP qui possèdent un unique site de liaison, cette dernière en possède deux. Son potentiel d’utilisation en tant que marqueur unique de dommages à la muqueuse intestinale est limité étant donné que la L-FABP est présente dans de multiples tissus136.
L’I-FABP est codée par le gène FABP2 situé sur le chromosome 4. Spécifique à l’intestin, elle est surtout présente au niveau de l’intestin grêle, avec une expression plus élevée dans le jéjunum, mais également en très faible quantité au niveau du côlon137. L’I-FABP est présente tout au long de l’axe crypte villosité, mais c’est à l’extrémité des vil-losités que sa concentration est la plus élevée133,136. Tel que mentionné précédemment, son principal rôle est le transport des AGLC134,135. Chez les individus en santé, l’I-FABP
25
est présente en très faible quantité dans la circulation suite au renouvellement des entéro-cytes dont la durée de vie varie entre 3 et 5 jours. Elle peut, dans ce contexte, servir de marqueur du renouvellement cellulaire étant donné que la masse cellulaire demeure cons-tante dans cette population. En contexte pathologique, sa spécificité et l’augmentation rapide de ses taux plasmatiques suite à la présence de dommages cellulaires peuvent en faire un marqueur de la mortalité cellulaire. De plus, il a été démontré, tout comme pour d’autres membres de la famille des FABP, que l’augmentation de ses taux sanguins est proportionnelle à l’étendue des dommages138,139. Ces caractéristiques ont mené à son uti-lisation comme marqueur de la présence de dommages à la muqueuse intestinale en contexte d’entéropathies. Dans le cas de la maladie cœliaque, il a été démontré qu’en plus d’en faciliter le diagnostic, l’I-FABP permettait également d’en suivre l’évolution. En effet, il a été démontré que l’adhésion à la diète sans gluten permet à court terme de ré-duire ses taux plasmatiques et à long terme, de les normaliser86,136,140. Elle a également été utilisée avec succès chez des nouveau-nés comme marqueur d’entérocolite nécrosante141.De plus, l’utilisation de l’I-FABP avec des modèles animaux et des biopsies humaines en contexte d’ischémie intestinale a permis d’évaluer la réversi-bilité et l’étendue des dommages à la muqueuse intestinale121,125,139. Elle a été utilisée chez des patients avec des douleurs abdominales en contexte d’ischémie intestinale pour différents objectifs dont sa détection (en absence ou en présence d’obstruction intestinale) ainsi que son origine (vasculaire ou non vasculaire)132,142–144. L’I-FABP a également été utilisée en absence de pathologies intestinales comme marqueur de l’intégrité intestinale en contexte de pancréatites ou de situations requérant une admission aux soins intensifs138,145.
La littérature concernant l’utilisation de l’I-FABP en contexte d’obésité est limitée étant donné la difficulté à isoler son effet de ceux des altérations morphologiques et métaboli-ques qui en découlent. Une étude chez des rats a démontré qu’une diète riche en lipides entraîne une diminution des taux plasmatiques de I-FABP, mais l’augmentation de son expression au niveau du jéjunum146. Toutefois, il n’est pas mentionné dans l’étude si ces changements sont dus à la diète, à l’obésité en tant que telle ou encore à l’inflammation.
26
En contexte de diabète, l’I-FABP a été utilisée pour évaluer la présence de dommages et de changements de perméabilité de la muqueuse intestinale. Une étude a démontré que, tout comme les personnes atteintes de la maladie cœliaque, les diabétiques de type 1 et 2 présentent davantage de dommages au niveau de la muqueuse intestinale comparative-ment à un groupe contrôle86. Une étude employant l’I-FABP comme marqueur de dom-mages à la muqueuse intestinale dans une cohorte humaine composée d’individus d’obèses a permis de souligner la présence de dommages accrus en présence d’hyperglycémie chronique85. Les conclusions de cette seconde étude suggèrent l’existence d’un lien entre l’homéostasie du glucose ainsi que l’intégrité de la muqueuse intestinale.
27
Objectifs
Objectif général
Évaluer le potentiel de la concentration plasmatique de citrulline et d’I-FABP à identifier les changements morphologiques de la muqueuse intestinale en contexte d’obésité, de résistance à l’insuline et de diabète de type 2 en étudiant leurs relations avec l’adiposité, l’homéostasie du glucose et le profil lipidique chez des participants sans entéropathies.
28
Hypothèses
Hypothèse générale
Les concentrations plasmatiques de citrulline et d’I-FABP sont modifiées suite à des alté-rations métaboliques indiquant ainsi un changement de la morphologie intestinale en contexte d’obésité et de diabète.
Hypothèses spécifiques
1. La concentration plasmatique de citrulline est plus élevée chez les individus obè-ses, principalement ceux présentant une résistance à l’insuline ou un diabète de type 2, suggérant la présence d’hypertrophie au niveau de la muqueuse intestinale. 2. Indépendamment de l’obésité, la concentration plasmatique d’I-FABP est plus
élevée en présence de résistance à l’insuline et de diabète de type 2, suggérant une augmentation de taux de mortalité entérocytaire en présence d’altérations métabo-liques.
3. Le ratio des concentrations plasmatiques de I-FABP/citrulline est plus élevé en présence de résistance à l’insuline et de diabète de type 2, indépendamment de l’adiposité, ce qui indiquerait une augmentation du taux de renouvellement cellu-laire en présence d’altérations métaboliques.
29
Méthodologie
Population
La cohorte est composée de 221 hommes ayant participé à divers projets de recherche effectués à l’unité clinique de l’Institut sur la nutrition et les aliments fonctionnels de l’Université Laval (INAF) par le Dr Patrick Couture51,90–93,147–152. Ces projets de recher-che ont été approuvés par le Comité d’éthique de la rerecher-cherrecher-che de l’Université Laval. Les principaux facteurs d’exclusion aux divers projets de recherche sont le tabagisme, un his-torique de maladie cardiovasculaire ou cancer, des altérations de la fonction endocrine ou hépatique, une entéropathie, une infection au VIH, de l’alcoolisme ou une dyslipidémie monogénique. Au total, 154 hommes nondiabétiques, dont 47 présentaient une sensibilité à l’insuline relativement élevée (HOMA-IR<2,5), et 67 hommes DT2ont été recrutés. Les échantillons de plasma sélectionnés pour cette étude ont été prélevés avant les interven-tions effectuées au cours des différents projets de recherche.
Mesures en laboratoire
Les données du bilan sanguin ainsi que les mesures anthropométriques des participants étaient déjà disponibles étant donné qu’elles avaient été mesurées lors d’études antérieu-res. En ce qui concerne les dosages des concentrations plasmatiques de citrulline et d’I-FABP, ils ont été effectués selon des protocoles auxquels j’ai participé à l’élaboration et à la mise au point pendant mes études de maîtrise. La mise au point du protocole du dosage des acides aminés plasmatiques, son optimisation ainsi que le dosage des échantillons, ont été effectués en collaboration avec la plate-forme analytique de l’INAF. Mes rôles dans cette collaboration ont été la préparation des échantillons ainsi que l’optimisation du protocole principalement en faisant le suivi de la répétabilité des résultats. En ce qui concerne le dosage de l’I-FABP, mon implication a été plus importante. J’ai été impli-quée dans le choix du kit de dosage, l’optimisation du protocole de base fourni par la compagnie, le dosage des échantillons ainsi que l’analyse des résultats.
30
Analyses statistiques
Les comparaisons entre les groupes ont été effectuées à l’aide de tests t de Student et par analyse de variance (ANOVA) tandis que les associations entre les profils anthropométri-ques et métabolianthropométri-ques ont été établies au moyen de corrélations de Pearson. L’identification des facteurs confondants a été réalisée avec des modèles linéaires généra-lisés. Les transformations Box Cox et Su de Johnson ont permis la normalisation des données ne présentant pas une distribution normale. Les analyses statistiques ont été exé-cutées avec le logiciel JPM Pro 12 (SAS, Cary, NC).