UNIVERSITÉ MOHAMMED V – AGDAL FACULTÉ DES SCIENCES
RABAT N° d’ordre : 2547 THÈSE DE DOCTORAT Présentée par Sanaâ SAOIABI Discipline : Chimie
Spécialité : Matériaux et Environnement
Matériaux fonctionnels à base de phosphate de calcium
à applications environnementales
Soutenue le 28 Octobre 2011 Devant le jury :
Président :
A. ZRINEH, Professeur à la Faculté des Sciences, Rabat Maroc
Examinateurs :
T. CORADIN, Directeur de recherche, CNRS- Paris, France, M. HAMAD, Professeur à la Faculté des Sciences, Rabat, Maroc
J. NAJA, Professeur et Vice Doyen de la Faculté des Sciences et Technique, Settat Maroc J. L. ACKERMAN, Professeur à Harvard Medical School, Boston, MA USA
P. BARBOUX, Professeur à l’Ecole Nationale Supérieure de Chimie de Paris, France A. LAGHZIZIL, Professeur à la Faculté des Sciences, Rabat- Maroc
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 5 37 77 18 34/35/38, Fax : +212 (0) 5 37 77 42 61, http://www.fsr.ac.ma
AVANT PROPOS
Les travaux présentés dans cette thèse ont été réalisés au sein du Laboratoire de Chimie Physique Générale à la Faculté des Sciences de Rabat (FSR) - Université Mohammed V-Agdal–Rabat, sous la direction du Professeur Abdelaziz LAGHZIZIL, qui a agréablement assuré l’encadrement de cette thèse avec beaucoup d'intérêt et d'optimisme tout en me laissant une large marge de liberté pour mener à bien ce travail. Je tiens à lui exprimer ma gratitude pour son suivi, sa disponibilité, sa compréhension, son respect des engagements et pour ses encouragements continus. Je le remercie aussi pour sa patience et son sérieux dont il a fait preuve lors des multiples discussions et pour l’intérêt constant qu’il a manifesté pour mes recherches et ses conseils éclairés au cours du développement de ce travail. Sa passion pour la recherche, son esprit innovateur et son dynamisme perpétuel sont exemplaires. Etre son étudiante fut un grand honneur pour moi.
Ce travail est réalisé dans le cadre d’une collaboration avec 3 laboratoires :
- Le Laboratoire de “Biomaterials Laboratory, Martinos Center, Massachusetts General Hospital and Harvard Medical School Boston, MA, USA”.
- Le Laboratoire de Chimie de la Matière Condensée - Collège de France, Université Pierre et Marie Curie, Paris VI, France.
- Le Laboratoire de Physique de la Matière Condensée (PMC), Ecole Polytechnique, France.
En tant que lauréat Fulbright, je tiens à exprimer mes vifs remerciements et toute ma reconnaissance à tous les membres de la Commission Maroco-Américaine (MACECE) « The Moroccan-American Commission for Educational and Cultural Exchange » et AMIDEAST avec le Fulbright Scholarship Program, pour le support financier, le suivi et leur soutien le long de mes séjours aux USA dans le cadre de la préparation de cette thèse.
Je suis particulièrement reconnaissante à Monsieur Jerome L. ACKERMAN Director of Biomaterials Laboratory, Martinos Center, Massachusetts General Hospital and Professor of Radiology at Harvard Medical School in USA, de m’avoir gentiment accueilli parmi son équipe. Je le remercie d’avoir cru à mon projet et d’avoir mis à ma disposition tous les moyens nécessaires pour le mener.
Milles merci à Mr Thibaud Coradin, Directeur de recherche au CNRS, et à Mme Sylvie Masse chargée de recherche scientifique au Laboratoire de Chimie de la Matière Condensée de Paris Université Pierre et marie Curie Paris VI- France, pour leur collaboration et l’accueil chaleureux qu’ils m’ont réservé durant mes séjours à Paris. Qu’ils trouvent ici l’expression de ma respectueuse gratitude pour leurs précieux conseils et leurs discussions fructueuses.
Un grand merci au Dr. Khalid LAHLIL de l’Ecole Polytechniques de Paris – France pour sa collaboration scientifique, pour l'aide apportée durant mes expériences et pour l’intérêt constant qu’il a porté à ce travail.
Mes remerciements les plus sincères s’adressent au président du jury Monsieur le Professeur Abdallah ZRINEH de la Faculté des Sciences, Rabat – Maroc de m’avoir fait l’honneur de présider le jury de cette thèse. Ses discutions scientifiques intéressantes dans le suivi et la réalisation de mes travaux de recherche ont été d’une qualité supérieure.
Je suis sensible à l’honneur que me fait Monsieur Jamal NAJA, Professeur et Vice Doyen à la Faculté des Sciences et Techniques de Settat (FSTS), en acceptant d’être rapporteur de ce travail et de faire partie du jury. Qu’il trouve ici l’expression de ma respectueuse gratitude.
Mes remerciements s’adressent à Monsieur Mohamed HAMAD, Professeur à la Faculté des Sciences, Rabat – Maroc autant que rapporteur de cette thèse et pour sa présence parmi les membres du jury, afin de juger le contenu de ce travail.
Je suis honoré que Monsieur Thibaud. CORADIN, Directeur de recherche au CNRS et responsable de l’équipe de recherche « Biomatériaux et environnement » au Laboratoire de Chimie de la Matière Condensée de Paris – France, ait accepté d’être rapporteur et membre du jury de ce travail. Qu’il trouve ici l’expression de ma respectueuse gratitude.
Mes remerciements s’adressent à Monsieur Jerome L. ACKERMAN, Director of Biomaterials Laboratory, Martinos Center, Massachusetts General Hospital and Professor of Radiology at Harvard Medical School in USA d’avoir aimablement accepté de se déplacer pour juger ce travail malgré tous ses engagements et ses nombreuses occupations.
Je tiens à remercier Monsieur Philippe BARBOUX, Professeur et responsable des relations industrielles à l’Ecole Nationale Supérieure de Chimie de Paris- France, pour le grand honneur qu’il m’a fait en acceptant d’être membre du jury de cette thèse.
Mes remerciements s’adressent à Monsieur Abdelaziz LAGHZIZIL pour l’attention constante avec laquelle il a suivi mes travaux de recherche et pour ses précieuses discussions scientifiques, qu’il soit également très vivement remercié d’avoir accepté d’être membre du jury.
De l’autre bout de la terre, mes meilleurs sentiments d’amitié s’adressent :
- A tous les membres du Laboratoire de Chimie de la Matière Condensée (LCMC), Paris VI, Jussieu France, et en particulier, G. Laurent, I. Genois, N. Abdoul-Aribi, M. Selmane et L. G. Patrick, qui ont été toujours là pour m'aider au cours de mes stages à l’Université Pierre et Marie Curie, Paris VI France.
- A tout le personnel de Martinos Center et Harvard Medical School Boston - USA, et en particulier, Messieurs Wu, Yaotang, Choukri Mekkaoui, David Alcanta, Dionyssios Mintzopoulos et Mme Haihui Cao.
- Aux responsables du « Fulbright Student Exchange Program » à Washington DC - USA, notamment, Mme Stephanie Whitlatch et Mme Elisa O’Keefe pour leur politique de proximité et leur compétence.
Je tiens à remercier les membres de l’UATRS-CNRST, en particulier Messieurs B. Jaber, K. Anouar, M. Benissa et Mlle H. Oauddari, pour leur aide technique à la caractérisation et à l’analyse chimiques de quelques produits présentés dans ce travail.
Je souhaite associer à ces remerciements tous ceux qui ont contribué à la réalisation de ce travail en particulier à tous mes compatriotes et mes amis qui ont rendu mes séjours en Amérique et en France si agréables, plein d’encouragement, d’espoir et de compréhensions, aux enseignants-chercheurs et tous mes ami(e)s et collègues du Laboratoire de Chimie Physique Générale et du Département de Chimie de la Faculté des Sciences de Rabat - Maroc,
de Martinos Center, MGH et Harvard Medical School de Boston - USA et de LCMC et UPMC de Paris - France.
Je désire terminer en remerciant mes sources de joie, de bonheur et de force à mes parents, ma sœur Sarah, mon frère Yahya et mes deux sœurs jumelles Sawsane et Fadwa qui ont joué évidemment un très grand rôle dans cette thèse. Leur soutien moral et matériel m’a été indispensable tout au long de ces années. J’espère que ce travail leur témoigne toute ma reconnaissance et mon estime à leurs égards. Merci de m’avoir soutenue et encouragé pendant les moments de doutes.
Sommaire
Introduction générale ……….. 1
Partie I : Généralités sur la gestion des métaux lourds et leur élimination par des solides poreux et fonctionnalisés ……… 5
Chapitre I : Comportement physico-chimique des métaux dans l’environnement …. 7 Introduction ……….. 8
I. Toxicité des métaux et leurs conséquences sur les écosystèmes……… 8
II. Sources et devenir des contaminants métalliques dans l’environnement…………. 9
II.1. Milieu aquatique……… 9
II.2. Contamination des sols par les métaux lourds et remédiation………. 10
III. Physico-chimiques des réactions à l’interface solide – liquide……….. 11
III.1. Hydrolyse du métal : cas des ions Pb2+ et Zn2+……….. 11
III.2. Complexation des ions métalliques aqueux………... 13
III.3. Interactions avec les carbonates et les phosphates………. 14.
III.4. Interactions avec les amines et carboxylates……….. 14
III.5. Immobilisation des cations métalliques par une surface……… 15
III. 6. Mécanismes d’interaction solide – métal………. 16
III.6.1. Adsorption ……… 16
III.6.1. 1.Adsorption non spécifique……… 16
III.6.1.2. Adsorption spécifique………. 17
III.6.2. Echange ionique………. 18
III.6.3. Précipitation à la surface……….. 18
IV. Elimination des métaux lourds par les solides poreux ……….. 19
IV.1. Les argiles……….. 19
IV.2. Les charbons actifs……… 19
IV.3. La silice poreuse et ses dérivées………. 20
IV.4. Les phosphates de calcium………. 20
Chapitre II : Structure des apatites et fonctionnalisation de leur surface……
Introduction ………
23
24
I. Rappel sur les propriétés structurales des apatites ……… 24
I.1. Structure des apatites ………. 24
I.2. Substitutions dans le réseau de l’apatite……… 25
I.3. Méthodes d’élaboration des apatites……… 26
II. Modification des surfaces des apatites ……… 27
II.1. Apatite à caractère médical……… 27
II.2. Apatite à plusieurs vocations……….. 30
II.2.1. Action des organophosphonates……… 31
II.2.2. Action d’oxydes mésoporeux : ZrO2, Al2O3, SiO2, TiO2……….. 34
III. Applications environnementales : Apatite hybrides comme agents de dépollution des métaux………. 35
Conclusion……… 36
Partie II : Fonctionnalisation de la surface des apatites à application environnementale……… 38
Chapitre III : Synthèse et caractérisation des matériaux à surfaces nanostructurées fonctionnalisées par l’aminotriméthylenphosphonate……….. 39
Introduction……… 40
I. Caractéristiques structurales et texturales du phosphate naturel de Benguérir ……. 41
I.1. Echantillonnage ………... 41
I.2. Caractérisation du phosphate naturel ………. 41
I.2.1. Examen par diffraction des rayons X………... 41
I.2.2. Examen par spectroscopie d’absorption IR………... 43
I.2.3. Analyses chimiques ……… 44
I.3. Propriétés texturales………... 46
I.3.1. Mesure de la surface spécifique du phosphate naturel par la méthode BET …. 46 I.3.2. Morphologie de l’apatite naturelle par MEB………. 46
II. Modification de la surface de l’hydroxyapatite par greffage de
l’aminotriméthylenphosphonate………. 47
II.1. Données physico-chimiques de l’acide aminotriméthylenphosphonique (AMP).. 48
II.2.Préparation des apatites hybrides à partir du phosphate naturel ……… 48
II.2.1 L’apatite de référence PNM……… 48
II.2.2 Les apatites hybrides AMP-PNM……… 50
II.3. Préparation des apatites hybrides à partir des précurseurs commerciaux ……… 50
II.3.1. L’apatite de référence (HAp)………... 50
II.3.2. Les apatites greffées (AMP-HAp) ……… 51
II.4. Caractérisation des précipités préparés……… 52
II.4.1. Examen par diffraction aux rayons X ……….. 52
II.4.2. Examen par spectroscopie infrarouge IR………. 58
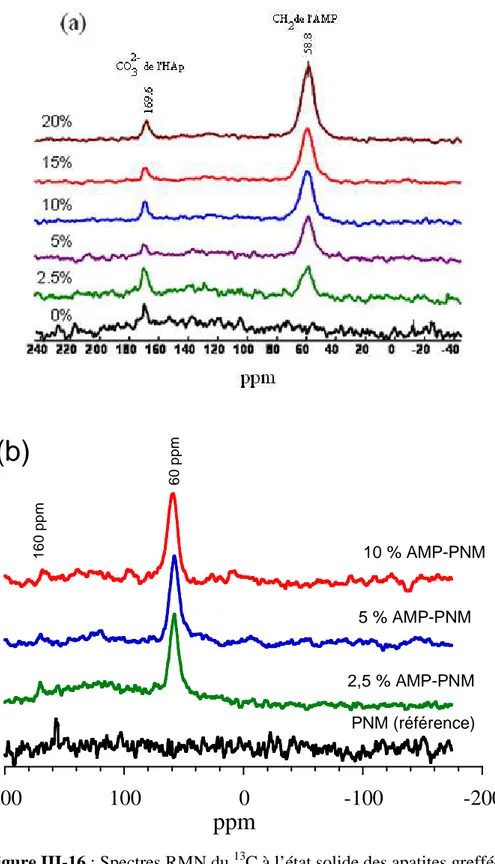
II.4.3. Examen par spectroscopie RMN- MAS du 31P et du 13C à l’état solide…… 60
II.4.4.Analyses thermiques (ATG/ATD) des apatites greffées………. 63
II.4.5. Analyses chimiques………. 64
III. Analyse volumétrique des apatites greffées……….. 65
III.1. Mesure de la surface spécifique………... 65
III.2. Analyse par microscopie électronique à transmission………. 69
Conclusion……… 71
Chapitre IV : Synthèse et caractérisation des composites du système mixte TiO2-apatite……….……… …………. 73
Introduction……… 74
I. Généralités sur le photoactif TiO2 et le contexte de son association avec l’apatite… 74 II. Procédure expérimentale……….. 75
II.1. Principe général du procédé sol gel ………. 75
II.2. Préparation des composite TiO2-HAp ………. 76
II.2.1. Cas de l’hydroxyapatite HAp………... 76
II.2.2. Cas de la préparation de TiO2 par procédé sol-gel ……… 76
II.2.3. Préparation des composites du système mixte TiO2-HAp…………... 76
III. Résultats et discussions………... 77
III.2.Examen par spectroscopie RMN- MAS du 31P et 13C à l’état solide…………. 81
III.3.Microscopie électronique à transmission………. 83
III.4. Mesure de la surface spécifique ………. 84
Conclusion………... 88
Partie III : Contribution à l’étude des mécanismes de sorption aux interfaces apatite- soluté……… 89
Chapitre V : Etude de la sorption d'ions métalliques aqueux par des surfaces des apatites fonctionnalisées par l’aminophosphonate ………. 91
Introduction ……… 92
I. Procédure d’adsorption………... 92
II. Sorption des métaux par le phosphate naturel ………... 93
III. Immobilisation des ions Pb2+ et Zn2+ par les apatites hybrides ……….. III.1. Propriétés acido-basiques des solutions durant le processus d’adsorption des ions métalliques par les apatites hybrides……… 93 93 III.2.Origine de la charge de la surface de l’apatite hybride……… 97
III.3. Etudes cinétiques des phénomènes d’adsorption des ions métalliques sur les apatites hybrides………. 97
III.4. Etude des isothermes d’adsorption………... 99
IV. Partie Théorique……… 104
IV.1. Modèles cinétiques de l’adsorption………. 104
a. Modèle cinétique du premier ordre ………. 104
b. Modèle cinétique du pseudo second ordre………. 104
IV.2. Modèles d’isothermes d’adsorption………... 106
a. Modèle de Langmuir………... 106
b. Isotherme de Dubinin-Radushkevich (D-R). ……… 108
c. Modèle de Freundlich……… 109
V. Mécanismes de sorption ……….. 113
Chapitre VI : Adsorption des métalloporphyrines hydrosolubles sur les
hydroxyapatites poreuses……….
117
Introduction……… 118
I- Généralités sur les porphyrines et les métalloporphyrines ……… 118
II. Préparation des porphyrines [T(p-SO3NH4)PP]M (M=Zn et Pb)………. 119
II.1. Cas de la tétraphénylporphyrine (TPP)H2 : ………... 119
II.2. Cas de la mésotétraparasulfophénylammoniumporphyrine [T(p-SO3NH4)PP]H2 119
II.3 Cas de la porphyrine [T(p-SO3NH4)PP]Zn (ZnP)……….. 121
II.4 Cas de [T(p-SO3NH4)PP]Pb (PbP)……… 122
III. Caractéristiques des apatites utilisées ……….. 124
IV. Processus d’adsorption des métalloporphyrines sur l’hydroxyapatite…... 125
IV.1. Conditions expérimentales ……… 125
IV.2. Etude cinétique d’adsorption des porphyrines ZnP et de PbP sur les hydroxyapatites w-HAp et e-HAp………. 125
IV.3. Isothermes d’adsorption……….. 128
IV.4. Mécanismes d’adsorption ……….. 131
IV.4.1. Variation du pH durant le processus d’adsorption………. 131
IV.4.2. Analyse des solides après adsorption par spectroscopie UV- visible du solide 133 CONCLUSION GENERALE ……….. 135
INTRODUCTION GENERALE
Au Maroc comme ailleurs, les sources de la pollution des milieux aqueux ou poreux sont généralement d'origine industrielle et agricole. Le choix d’un matériau présentant de bonnes caractéristiques physico-chimiques et l'élimination des métaux lourds et des macromolécules nocives par les processus d’adsorption et photochimique sont parmi les thèmes de recherche d’actualité, intéressés par plusieurs chercheurs dans le monde notamment les industriels. En effet, l’élaboration de nouveaux matériaux de forte porosité permet d’avoir des propriétés physiques intéressantes. Les nanomatériaux sont souvent utilisés dans de nombreux domaines en particulier dans les domaines de la biotechnologie et de la protection de l’environnement.
Les apatites présentent des propriétés structurales, d’adsorption et d’échange ionique, qui peuvent contribuer à leur valorisation, elles peuvent être utilisées comme biomatériaux et adsorbants. De nombreuses études sont réalisées pour remédier la pollution qu’ils engendrent. Elles portent, soit sur le remplacement dès l'origine du procédé industriel des métaux toxiques par ceux non toxiques, soit sur leur piégeage in situ. En ce qui concerne ce dernier point, les entités chimiques piégées peuvent également être stabilisées en vu de leur stockage. Cette étape permet de réduire leur biodisponibilité et par conséquent leur toxicité.
Depuis plusieurs années, le conditionnement dans les phosphates apatitiques est étudié comme méthode de décontamination des effluents liquides pollués par les éléments de traces. Les apatites sont également envisagées comme matrices de conditionnement des déchets radioactifs, ou encore comme additifs des barrières ouvragées assurant le confinement de ces déchets. Les apatites naturelles ou synthétiques présentent, en effet, l’avantage d’être stables thermiquement, peu solubles et acceptent de nombreux ions ou groupements ioniques dans leur structure. De multiples substitutions sont ainsi possibles sur les sites cationiques, notamment par les cations métalliques. Les métaux lourds sont des éléments naturels, présents dans tous les compartiments de notre environnement : l'air, l'eau et les sols. Malheureusement, l’activité de l’homme a changé leur répartition, leur concentration, et leur spéciation en les rendant ainsi potentiellement dangereux. De plus, les apatites peuvent fixer ou interagir avec les espèces organiques. De nombreux travaux de recherche ont été réalisés dans le but
d’éliminer les espèces organiques toxiques (pesticides, colorants, phénol, pyridine, etc…). Par conséquent, les apatites ont l’avantage d’être un bon adsorbant des substances nocives que ce soient organiques ou inorganiques. Cependant, plusieurs matériaux fonctionnalisés et poreux ont déjà fait preuves pour la sorption des entités polluantes. Le greffage des molécules organiques sur la surface des apatites peut améliorer leur propriétés physico-chimiques notamment l’adsorption. Par cette méthode, les apatites hybrides ont l’avantage de complexer les métaux lourds, les colorants, les porphyrines, les pesticides et d’autres molécules organiques toxiques. Grâce à l’activation de leur surface, les apatites présentent aussi des propriétés catalytiques.
L’utilisation des hydroxyapatites comme matériaux de décontamination dépend de leur capacité de fixation des ions métalliques, et du mode de piégeage de ces éléments toxiques. Ainsi, il est primordial de définir avec précision le mécanisme de fixation des ions métalliques par les apatites greffées. Ce manuscrit décrit en partie et de façon rigoureuse l’ensemble des processus d’incorporation des ions Pb2+ et Zn2+ par les particules d’hydroxyapatite phosphocalcique fonctionnalisées par l’aminophosphonate. Généralement, les procédés de synthèse des apatites phosphocalciques stéochiométriques sont nombreux et largement étudiés. Il est donc souhaitable de chercher un procédé de production économique d’une part, et d’aboutir à des matériaux de grandes surfaces spécifiques d’autre part. Pour cela, deux voies de synthèse ont été envisagées dans ce travail. La première est basée sur l’utilisation du phosphate naturel marocain, et la deuxième voie de synthèse repose sur l’emploie des précurseurs commerciaux (Ca(OH)2 et NH4H2PO4).
Par ailleurs, l’oxyde de titane est bien connu par sa spécificité dans le domaine des réactions de la photodégradation de la matière organique. Son association avec l’apatite poreuse pourra contribuer à l’amélioration de la qualité du procédé de dépollution des eaux usées. En effet, la bonne qualité photochimique de TiO2 et la réactivité de surface de l’apatite
avec les substances organiques toxiques activent la dégradation de ces dernières et l’adsorption de leurs métabolites sur la surface poreuse de l’apatite. Dans ce contexte, nous avons préparé et caractérisé différents composites du système mixte « TiO2-apatite » en
utilisant un procédé d’élaboration économique et original.
travaux de recherche sur les propriétés physico-chimiques des apatites, et plus particulièrement celles des apatites fonctionnalisées. Elle présente également les réactions chimiques pouvant avoir lieu entre une suspension de particules solides et des espèces organiques et inorganiques, pour conclure que les interactions entre les apatites fonctionnalisées et des cations divalents sont favorisées. Le premier chapitre contient un rappel détaillé sur le devenir des ions métalliques dans les écosystèmes et les procédés d’élimination de ces ions, en particulier par les apatites. Dans le second chapitre de cette partie, nous rappelons les caractéristiques structurales des apatites et les différentes possibilités de substitution ainsi que la modification de leur surface.
La deuxième partie de ce manuscrit constitue la première partie expérimentale de ce travail sur la fonctionnalisation de la surface des apatites à application environnementale. Elle est subdivisée en deux chapitres : le chapitre III est consacré à la préparation et la caractérisation des matériaux à surfaces nanostructurées fonctionnalisées par l’aminotriméthylenphosphonate. Nous avons préparé les apatites hybrides organiques -inorganiques par deux voies de synthèse basées sur des précurseurs naturels et commerciaux. Les matériaux hybrides ainsi synthétisés ont été caractérisés par différentes techniques physico-chimiques adéquates à savoir, la diffraction des rayons X, l’infrarouge, l’analyse thermique (ATG/ATD), l’analyse chimique et élémentaire, la mesure de la surface spécifique (BET), la RMN de 31P et 13C à l’état solide et la microscopie électronique à transmission (MET). L’association de l’apatite avec l’oxyde de titane pour former des composites du système mixte TiO2-Apatite est décrite dans le quatrième chapitre de ce mémoire, montrant la
modification des surfaces des matériaux préparés par le procédé sol-gel.
Nous avons ensuite cherché à déterminer le pouvoir adsorbant des apatites naturelles et synthétiques fonctionnalisées par l’aminophosphonate. En effet, la troisième partie de ce travail est consacrée d’une part à l’immobilisation des ions métalliques contenus dans des solutions aqueuses et d’autre part à l’étude de l’adsorption des porphyrines hydrosolubles par des apatites poreuses. L’étude relative à l’élimination des ions Pb2+ et Zn2+ par des surfaces des apatites hybrides fait l’objet du cinquième chapitre de ce manuscrit. Les propriétés d’adsorption des porphyrines hydrosolubles sur les apatites poreuses préparées en milieux aqueux et éthanol - eau et l’étude de leurs isothermes d’adsorption sont décrites dans le sixième chapitre de ce travail.
Enfin, notre mémoire se termine par une conclusion générale dans laquelle nous soulignons la performance des matériaux préparés vis-à-vis de la fixation des substances nocives contenues dans des solutions aqueuses.
Partie I
Généralités sur la gestion des métaux lourds et leur élimination
par des solides poreux et fonctionnalisés
Les métaux lourds sont des micropolluants à l'origine de nuisances même quand ils sont rejetés en quantités très faibles. Leur toxicité se développe par bioaccumulation. L'industrie est responsable de la quasi-totalité des rejets de métaux lourds dans l'eau. La nécessité de réduire ces rejets n'est plus discutée. Leur impact environnemental dépend des réactions chimiques dans le milieu aquatique (réactions liées à l'acidité, l'alcalinité, la température, l'oxygénation...). On distingue une variété de procédés d'élimination des métaux lourds des solutions aqueuses tels que la précipitation, la filtration, l’échange ionique et l’adsorption. Parmi ces procédés, l'adsorption est un traitement efficace par l’utilisation des systèmes poreux et fonctionnalisés. Les apatites sont, en particulier, des systèmes complexes et ont donné preuve à l’élimination des ions métalliques, tels que les Pb2+, des solutions aqueuse. Ainsi dans cette partie, nous rappelons le comportement physico-chimique de l’ion métallique (soluté) dans la solution aqueuse et ses conséquences environnementales ainsi les caractéristiques physiques, structurales et texturales des adsorbants pour interpréter l’immobilisation des polluants à la surface d’un adsorbant.
Après avoir passé en revue le comportement des métaux dans le milieu aquatique et leurs conséquences sur la santé humaine, les différentes possibilités de modification chimique des apatites seront exposées dans cette partie. A partir de cet état de l’art, les problématiques soulevées par cette thèse seront énoncées.
Chapitre I
Comportement physico-chimique des métaux
dans l’environnement
Introduction
Le renforcement des normes de qualité de l’eau entraîne le développement de nouveaux procédés de son traitement. Les ions métalliques peuvent être naturellement en concentration très supérieure à la norme. Pour chacun de ces éléments, les procédés de traitement diffèrent selon la nature de l’eau usée traitée. L’utilisation d’un tel procédé de traitement est basée sur sa fiche technique, caractérisant ses avantages et ses inconvénients. Les procédés peuvent être classiques, membranaires, biologiques ou encore basés sur l’échange ionique ou l’adsorption sélective. Les alternatives en l’absence de traitement sont la recherche de nouveaux matériaux et le développement de nouvelles techniques de traitement. Plusieurs aspects des procédés ont été décrits dans ce travail, qui s’inscrit dans le cadre de cette problématique. Il repose sur des études expérimentales et modélisation de transfert des métaux dans les matrices récepteurs. Dans cette étude biobibliographique, nous identifions les réactions de transferts des ions métalliques dans les solides poreux et évoquer les mécanismes physico-chimiques globaux capables de décrire les phénomènes d’élimination des ions métalliques des solutions aqueuses. Depuis quelques années, les apatites sont notamment étudiées en tant que matrices de conditionnement pour stabiliser les déchets radioactifs [1], ou agent de dépollution des eaux et des sols contaminés par les métaux lourds [2-3].
I. Toxicité des métaux et leurs conséquences sur les écosystèmes
Bien qu’ils soient des oligo-éléments grâce au rôle important qu’ils jouent dans les différents systèmes biologiques, les métaux tels Zn, Mn, Cu, Ni et Fe peuvent engendrer des effets toxiques lorsqu’ils sont présents en grandes quantités. Cependant, les ions Pb2+, Cd2+, Cr6+ et Hg2+ sont très toxiques même à l’état de traces [3]. Par conséquent, il est indispensable d’éliminer totalement ces ions présents dans les effluents industriels ou de réduire leur quantité au dessous de leurs normes dans différentes eaux (potable, irrigation, piscine, ….).
Comme pour d’autres éléments, la toxicité d’un métal dépend étroitement de sa forme physico-chimique et donc de son environnement chimique. A titre d’exemple, le plomb se diffuse rapidement vers les différents organes comme le cerveau, les dents et les os par la circulation sanguine. La demi-vie du plomb dans les tissus mous et dans le sang est de 30 jours environ, mais elle passe de 1 à 10 ans dans les os [4-5]. En général, le plomb dans le corps humain se répartit comme suit :
-1 à 2 % dans le sang
-5 à 10 % dans les tissus mous (rein, foie, rate) -Plus de 90 % est fixé sur les os.
Le plomb a de nombreux effets toxiques sur la santé, qui sont basés sur sa concentration dans le sang ou plombémie sanguine. En effet, ce métal est responsable du saturnisme en cas d’exposition chronique. Il peut provoquer une grande fatigue, des troubles du comportement, de la mémoire, du sommeil, des systèmes immunitaires et reproducteurs, mais ses principaux organes cibles sont le système nerveux, les reins et le sang. En bloquant plusieurs enzymes nécessaires à la synthèse de l’hémoglobine, il entraîne une diminution du nombre de globules rouges en provoquant une anémie. De plus, le plomb passe facilement la barrière placentaire par diffusion, d’où le risque d’exposition prénatale.
II. Sources et devenir des contaminants métalliques dans l’environnement II.1. Milieu aquatique
Après leur rejet et leur transport jusqu’au milieu aquatique, les ions métalliques vont se distribuer entre les différentes formes dissoutes, complexées ou associées. L’association des métaux avec les systèmes poreux joue un rôle prépondérant dans leur mobilité et leur biodisponibilité via des mécanismes très complexes intervenant dans la mobilisation et la rétention de ces contaminants. La qualité des eaux reste malgré tout le reflet de l’intense activité anthropique et une part importante des cours d’eau, notamment à proximité des agglomérations, risque de ne pas atteindre le bon état écologique prévu par les organismes environnementaux. Les impératifs économiques de productivité et de rentabilité soumis aux industries d'extraction et de transformation des minerais en produits à plus haute valeur ajoutée sont le reflet de pollutions importantes par les métaux lourds, qui sont omniprésents dans notre société moderne [6]. Leur développement a contribué à rendre la vie plus facile par le biais de différentes technologies, mais les dangers afférents et encourus par l'humain et les récepteurs écologiques sont importants.
Les concentrations en métaux dans les eaux usées sont très variables et dépendent des activités humaines. Il convient de distinguer les concentrations totales en métaux et les concentrations dissoutes, dont le majeur problème est rencontré dans le cas des ions métalliques libres Men+. La plupart des techniques classiques de traitement des eaux usées reposent sur les principes de précipitation, d’adsorption et d’échange ionique. L’étude du transfert des ions métalliques dans un système poreux nécessite la bonne connaissance de leur géochimie. Les phénomènes de précipitation - dissolution et d’adsorption - désorption exerce une influence déterminante sur la spéciation des métaux et leur mobilité vers la phase solide.
II.2. Contamination des sols par les métaux lourds et remédiation
Le sol se définit selon le domaine d'intérêt ; c’est une entité bien définie et caractérisée aux plans morphologique, hydrique, minéralogique et biologique alors que le géologue le prend comme tout ce qui recouvre la roche mère [7]. L'approche environnementale décrit le sol à partir des interactions entre ses différents constituants, qu'ils soient inertes (eau, air, minéraux, etc.) ou sous formes d'êtres vivants, végétaux ou animaux.
L'étude des sites et sols contaminés par les métaux est un des thématiques de recherche prioritaires. Aujourd'hui, la qualité des sols est soumise d'année en année à des règles plus strictes. La politique de décontamination des terrains fatigués a été instaurée dans divers pays. Les méthodes utilisées pour stabiliser les métaux lourds dans le sol se traduisent par plusieurs phénomènes, dont la majorité se déroule à l'interface adsorbant - espèce chimique susceptible d'être adsorbée. Ce phénomène mis enjeu à la dite interface est connu sous le nom d'adsorption. Les techniques biologiques semblent toutefois les plus prometteuses dans la mesure où elles ne nécessitent pas une excavation lourde (phytoremédiation), parce qu’elles ne nécessitent pas d’injecter dans le sol des solutions qui peuvent avoir un impact négatif sur la flore, les micro-organismes ou l’acidité du sol.
De même, parmi les méthodes de stabilisation in situ des ions métallique dans le sol, l’utilisation des phosphates de calcium (apatites) est une méthode courante pour réduire la mobilité des métaux lourds dans les sols contaminés [8-11]. Elle est notamment considérée comme une méthode peu chère et très efficace pour le traitement des sols. L’ajout d’apatites permet la précipitation de certains ions pour former des phases solides phosphato-métalliques peu solubles et géochimiquement stables. A titre d’exemple, l’importante différence de solubilité entre les phases Ca10(PO4)6(OH)2 (Ks=6,62 10-126) [12] et Pb10(PO4)6(OH)2
(Ks=3,98 10-153) [13] sert de force motrice de la dissolution de l’hydroxyapatite. Les
phosphates libérés se combinent alors instantanément avec les cations Pb2+ pour former une pyromorphite moins soluble. Il est évident que les phénomènes de complexation et de précipitation sont les majeures réactions de remédiation in situ des sols contaminés par les métaux lourds.
La décontamination des sols est un problème très complexe. Chaque technique dispose des avantages et des inconvénients en termes de temps, de coût, de préparation du sol, de
combinaison de ces méthodes en tenant compte des caractéristiques physico-chimiques, biologiques et hydrogéologiques du sol.
III. Physico-chimiques des réactions à l’interface solide - liquide
Les propriétés les plus importantes intervenant dans les réactions de précipitation, de complexation et d’échange ionique sont essentiellement la valence, la configuration électronique, le rayon ionique du cation ainsi que l’aptitude à être ionisé dans la solution. Par exemple, le cation Pb2+ est un acide au sens de Lewis, c'est-à-dire qu’il est susceptible d’accepter un doublet d’électrons provenant d’une base, pour former une liaison covalente. Mais c’est également une espèce chargée susceptible de réagir électrostatiquement avec des ions de signes opposés pour former une liaison ionique [14]. Le type de liaison est important car il permet de juger la stabilité du complexe fixé à une surface donnée.
Le mode de fixation sur une surface poreuse est la création de liaisons covalentes entre le matériau et les ions métalliques. Le couplage covalent se fait généralement avec un matériau fonctionnalisé insoluble dans l’eau capable de complexer ou de précipiter les espèces métalliques en solution. Lorsque le matériau est fonctionnalisé par des substances complexantes, l’interaction solide- métal implique des sites favorisant la complexation avec la surface fonctionnalisée qui résulte de deux étapes. Elle consiste en l’activation de la surface peu active du matériau, afin de lui donner une nouvelle réactivité chimique pour retenir une bonne quantité du métal. La nature exacte des réactions chimiques impliquées dépend fortement du type de surface. Par analogie avec les surfaces de silice, les surfaces des apatites possèdent plusieurs sites actifs. Cette partie sera traitée en détail dans le second chapitre de cette partie.
III.1. Hydrolyse du métal : cas des ions Pb2+ et Zn2+
En milieux aqueux, les cations métalliques existent sous une forme hydratée. L’attraction et l’organisation des molécules d’eau autour des ions sous l’effet des interactions dipolaires s’exercent sur plusieurs couches. Cependant, il convient de distinguer la première sphère d’hydratation, comprenant les molécules d’eau au contact du cation et des couches les plus éloignées. Par conséquent, l’écriture Me2+ est une simplification pour l’ion divalent hydraté ou complexé [Me(OH2)n]2+ [15]. Dans le cas du plomb, le nombre de coordination n
vaut 6, ce qui permet de parler de complexe hexa-aquo [Pb(OH2)6]2+ de symétrie octaédrique.
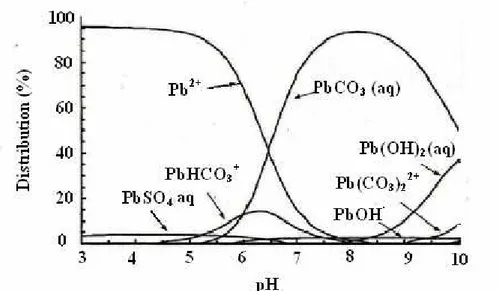
rivières montrent que des complexes carbonatés apparaissent prédominants pour des valeurs de pH supérieures à 6,5 et que pour des valeurs de pH inferieures à 6, l’espèce libre Pb2+ devient dominante [16]. Les molécules de la sphère d’hydratation peuvent perdre des protons et laisser place à des oxy et hydroxycomplexes. La réaction s’écrit alors pour un cation divalent Me2+ et de nombre de coordination « n » :
Me(H2O)n+2 → MeOH(H2O) (n-1)+ + H+
La réaction est écrite plus simplement :
Me2+ + H2O → MeOH+ + H+
Quelques valeurs de pK de métaux sont présentées dans le tableau I-1.
Tableau I-1: Constante de première hydrolyse de quelques cations (pK)
Cation Pb2+ Zn2+ Cu2+ Ni2+ Cd2+
pK 7,7 9,0 7,7 9,7 10,1
Les réactions de déprotonation s’opèrent successivement jusqu’à ce qu’il n’y ait plus de molécules d’eau dans la sphère d’hydratation. En écriture simplifiée, on a donc une série d’équilibres du type [17]:
Me2+ + H2O → MeOH+ + H+
MeOH+ + H2O → Me(OH)2 + H+
Me(OH)2 + H2O → Me(OH)3- + H+
D’après ces réactions, il apparaît un lien entre le pH et le degré d’hydrolyse du métal. La figure I-1 présente les courbes de distribution de plusieurs espèces Pb2+ hydroxylées en fonction du pH.
Figure I-1 : Courbe de distribution des espèces Pb2+ hydroxylées en fonction du pH d’après les travaux de S. Montinaro et coll. [7].
III.2. Complexation des ions métalliques aqueux
Les cations métalliques peuvent réagir avec des ligands présents dans la phase aqueuse pour former des complexes [18-20]. Les ligands sont des atomes possédant une paire d’électrons libres, généralement des éléments non métalliques et électronégatifs donneurs d’électrons comme O, N, et S. Les réactions de complexation entre un métal divalent et un ligand sont de la forme :
Me2+ + L- → L - Me+
Celles-ci sont décrites par la constante de formation KMeL, elle-même définie par
rapport aux activités des ions en solution :
] ][L [Me ] [MeL KMeL 2+ -+ =
Cette constante de formation, donnée par Ringbom [21], est une mesure de la stabilité du complexe. Le taux de complexation dépend donc de la concentration en métal et en ligand. Deux types de complexes sont distingués :
- Le complexe de sphère interne, si le ligand est en contact direct avec le métal ; - Le complexe de sphère externe, si une ou plusieurs molécules d’eau sont interposées entre le métal et le ligand.
La détermination de la spéciation des métaux en phase soluble est particulièrement importante car les espèces complexées ainsi formées peuvent à leur tour réagir ou non avec les solides [22]. Par exemple les hydroxy-complexes de métaux s’adsorbent plus fortement
que les ions libres [23], alors que les complexes formés avec les ions chlorures s’adsorbent moins que les ions libres [24].
III.3. Interactions avec les carbonates et les phosphates
L’ensemble des associations se produit le plus souvent lorsque les métaux quittent la solution aqueuse pour interagir avec les groupements présents en solution ou ceux de la surface d’un système poreux [25-27]. Les carbonates et les phosphates jouent un rôle important dont leur surface est le siège de phénomènes de sorption des ions métalliques [28-30]. Leur présence dans le système liquide-solide contrôle particulièrement le pH. Cependant, au-delà de l’adsorption à la surface, il peut aussi se produire une précipitation des cations métalliques Me2+ avec les carbonates CO32- [31-33]. Des études ont ainsi montré que le plomb
était capable de s’adsorber à la surface de la calcite et d’occuper les sites du calcium, malgré les différences de rayons ioniques entre le plomb et le calcium.
D’autres associations sont possibles avec les phosphates. J. O. Nriagu et coll. [34] ont démontré qu’un phosphate de calcium est un minéral stable très peu soluble, et qu’il est capable de fixer les métaux dans les sols selon plusieurs mécanismes. D’autres chercheurs comme G. Sarret et coll. [35] ont étudié la solubilité des phosphates et montré que la formation de certains minéraux affecte non seulement la mobilité du métal, mais également sa phytodisponibilité.
III.4. Interactions avec les amines et carboxylates
De nombreux travaux de recherche ont permis de mettre en évidence l’affinité des espèces organiques pour complexer les ions métalliques [36-39]. Les métaux se complexent à des matières organiques de poids moléculaires variables. Les interactions entre les cations métalliques et des groupements fonctionnels tels que -COOH (carboxyles), -NH2 (amines),
-C=O (carbonyles) et -N-H (imines).
Le plomb réagirait avec les acides organiques selon les réactions suivantes : R-COOH + Pb2+ → R-COOPb+ + H+
ou
R-OH + Pb2+ → R-OPb+ + H+
D’autres fonctions peuvent fixer des métaux, telles que des acides organiques de faible poids moléculaire (acide acétique, oxalique..), des sucres, des protéines, des phosphates et des phosphonates.
III.5. Immobilisation des cations métalliques par une surface
D’après B.J. Alloway [40], les cations métalliques et les groupes fonctionnels de la surface solide peuvent interagir selon trois modes pour former (Figure I-2) :
* un complexe de surface de sphère interne : l’ion ou la molécule adsorbé est en contact direct avec les groupes fonctionnels de surfaces ;
* un complexe de surface de sphère externe : une ou plusieurs molécules d’eau s’interposent entre l’ion et les groupes fonctionnels ;
* une nuée d’ions diffus : l’ion hydraté ne forme pas de complexe avec un groupement fonctionnel de la surface chargée, mais neutralise une charge de signe opposé appartenant à la surface adsorbante.
Figure I-2 : Modèle d’interface solide-soluté. PIH et PEH désignant respectivement le plan interne et le plan externe de Helmotz.
Les complexes de sphère externe et la nuée d’ions diffus sont généralement liés par des forces électrostatiques. Ils sont moins stables que les complexes de sphère interne qui font intervenir des liaisons de type chimique. La charge électrique totale d’un minéral peut se décomposer en deux termes, la charge intrinsèque et la charge de surface variable. Dans le
premier cas, la charge est conditionnée par la structure et plus particulièrement par les substitutions isomorphes dans le réseau cristallin. Cette charge est fixée et indépendante de la composition de la solution. Dans le deuxième cas, la charge créée par la protonation ou la déprotonation des sites fonctionnels est différente de celle causée par les réactions chimiques entre les groupes fonctionnels de surface et les ions présents dans la solution. Les ions adsorbés peuvent être des ions constitutifs de la structure du solide ou des ions spécifiques. Ces derniers possèdent une affinité pour la surface de nature chimique et non électrostatique. Ils peuvent s’adsorber sur une surface non chargée ou de signe opposé. Cette interaction dépend de la nature de l’ion adsorbé.
III.6. Mécanismes d’interaction solide - métal
Plusieurs phénomènes physico-chimiques interviennent au cours des transferts du soluté vers la phase solide ou inversement, en particulier l’adsorption, l’échange ionique, la complexation et la précipitation. Ces processus physico-chimiques peuvent intervenir simultanément, avec plus ou moins une grande importance sur l’interaction totale entre les cations métalliques et la phase solide.
III.6.1. Adsorption
D’une manière générale, l’adsorption se définit comme un processus résultant en une accumulation nette d’une substance à l’interface entre deux phases, selon un arrangement en deux dimensions. Selon les liaisons chimiques mises en jeu, deux types d’adsorptions peuvent être distingués : l’adsorption spécifique et non spécifique.
III.6.1.1. Adsorption non spécifique
L’adsorption physique non spécifique, correspond à la compensation de la charge de surface du solide par des ions hydratés (contre-ions) situés dans la couche diffuse. Ces derniers ne forment pas de complexes avec les groupes fonctionnels de surface et sont généralement désignés comme des ions indifférents. Cette interaction est conditionnée uniquement par la valence du cation métallique et la charge surfacique de la particule solide. Les liaisons mises en jeu sont faibles et du type électrostatique. Ce mécanisme dépend du pH qui contrôle la valeur et la densité des charges de surface et détermine l’activité des protons qui peuvent entrer en compétition avec les cations métalliques pour accéder aux sites de surface.
III.6.1.2. Adsorption spécifique
L’adsorption spécifique est assimilable à la formation d’un complexe de sphère interne, c'est à dire que le soluté et les sites de surface sont en contact direct. Elle correspond à la mise en place d’une liaison chimique entre les atomes donneurs d’électrons de la surface (ligands de surface) et les solutés accepteurs d’électrons (ions spécifiques); ce qui indique alors la chimisorption. Les trois principaux types de liaisons chimiques entre atomes sont :
* Ionique : un transfert d’électrons s’opère entre les atomes, l’attraction électrostatique de ces ions de charges opposées assure la liaison du composé.
* Covalente : partage plus ou moins égal d’électrons.
* Covalente de coordination : les électrons partagés proviennent d’un seul des atomes partenaires.
Compte tenu de la nature des liaisons mises en jeu, les complexes formés sont très stables, rendant les cations difficilement échangeables. Ce type de réaction est donc largement conditionné par la structure électronique du cation métallique et celle des groupes fonctionnels de surface.
L’adsorption spécifique est fortement dépendante du pH et reliée à l’hydrolyse des ions métalliques. Les métaux particulièrement capables de former des hydroxy-complexes sont plus spécifiquement adsorbés sur les surfaces déprotonées chargées négativement. Selon Valsami-Jones et col. [41], les cations aisément hydrolysables tels que Pb2+, Zn2+ et Cd2+ peuvent s’adsorber sur les apatites à pH acide. Le processus peut alors procéder par l’adsorption de complexes hydrolysés par la surface :
≡S-OH + [M(OH2)6]z+ → ≡S(-O)n-M(OH2)6-n(z-n)+ + n H3O+
La libération des entités acides a été largement mise en jeu par le suivi du pH au cours du processus d’adsorption sur des surfaces hydroxylées. Ces auteurs ont montré qu’il y a une compétition ente les protons des groupements P-OH situés à la surface des apatites naturelles et synthétiques et les ions métalliques en solution.
III.6.2. Echange ionique
L’échange ionique constitue une étape particulière après l’adsorption. Une réaction d’échange ionique est le remplacement d’un ion adsorbé par un ion de la solution. Elle peut être schématisée par l’équilibre suivant :
≡S-(M2+) + (Me2+)solution → ≡S-(Me2+) + (M2+)solution
Avec
* ≡S-(M2+) et S-(Me2+)surface sont respectivement les ions M2+ et Me2+ retenus à la surface
≡S du solide avant et après le processus d’échange ionique. * (Me2+)solution et (M2+)solution sont les ions en solution.
L’échange ionique est un phénomène de surface qui est par nature stœchiométrique, isoionique ou hétéro-ionique, et pouvant impliquer des réactions de physisorption mais également de chimisorption. Ce processus est largement rencontré lors la rétention des métaux lourds par les apatites qu’elles soient naturelles ou synthétiques [42]. En effet, la libération des ions Ca2+ de la surface de l’apatite vers la solution et la fixation du métal nocif indique la contribution des réactions d’échanges ioniques. Plusieurs facteurs peuvent avoir une influence sur le rendement des réactions d’échanges ioniques en particulier la nature du métal et de la surface de l’adsorbant. En effet, la rétention des ions Zn2+et Cu2+ sur l’hydroxyapatite ne libère pas assez d’ions Ca2+ comparés au cas de l’adsorption du plomb. De même, la fixation des ions métalliques par des surfaces fonctionnalisées par des amines ne favorise pas le processus d’échange ionique.
III.6.3. Précipitation à la surface
La précipitation est considérée comme le phénomène le plus important, après l’adsorption, parmi l’ensemble des processus de rétention des métaux lourds par les particules solides. Elle conduit à la formation d’une nouvelle phase. La précipitation, généralement après dissolution, correspond au passage d’une espèce de l’état dissous à l’état solide selon l’équilibre général :
nMem+(aq) + m Ln-(aq) → MnLm(s)
qui correspond à la formation du noyau en solution, et la nucléation hétérogène où le noyau germe sur la surface des particules minérales [43-44].
IV. Elimination des métaux lourds par les solides poreux
L’intérêt porté à la contamination des eaux souterraines, des nappes phréatiques et des sols par les métaux lourds et les molécules nocives provenant des déchets industriels est de plus en plus accru, à cause de l’effet indésirable de ces entités chimiques sur la santé des êtres vivants, et sur le déséquilibre des écosystèmes. C’est pourquoi leur élimination s’avère de plus en plus primordiale afin de préserver notre environnement. Il existe plusieurs adsorbants déjà utilisés dans le but d’éliminer les substances nocives issues des effluents industriels. Parmi eux on distingue les argiles, les charbons actifs, la silice poreuse et ses dérivées et les phosphates de calcium.
IV.1. Les argiles
L’argile est une roche sédimentaire riche en feldspath, composée par une diversité de minéraux spécifiques. Ses composants majeurs sont l’oxyde d’aluminium (environ 40%), l’oxyde de silice (environ 46%) et l’eau (environ 14%). Leur structure feuilletée est sous forme des phylosilicates d’aluminium constitués de couches d’octaèdres Al(OH)6 et de
couches de tétraèdres SiO4. Les argiles ont la propriété d’adsorber certains anions et cations
échange ionique [45-46]. De nombreux travaux ont montré que les cations s’apprêtent plus que les anions à cet échange ce qui prouve la prédominance des charges négatives sur la surface des particules argileuses. La capacité d’échange cationique dépend de la liaison adsorbat- adsorbant, du temps de contact et surtout de la surface développée. Grâce à leurs propriétés d’adsorption et leur capacité d’échange cationique intéressante, plusieurs types d’argiles sont utilisés dans l’épuration des effluents industriels tels que la montmorillonite, la bentonite et la kaolinite.
IV.2. Les charbons actifs
Le charbon actif est une poudre noire constituée essentiellement de matière carbonée à structure microporeuse. Le charbon actif fait parti d’une gamme de solides présentant une très grande porosité et une surface spécifique importante variant de 500 à 1500 m2/g. Il peut être obtenu à partir d’un grand nombre de matériaux carbonylés (bois, charbon, noix coco, résidus pétroliers, etc…) suite à des processus de carbonisation suivis des processus d’activation dûment contrôlés.
Des études sur la capacité d’adsorption du charbon actif vis-à-vis des métaux lourds [47-48], ont montré que le charbon actif sous ses diverses formes, peut adsorber des métaux lourds ayant une concentration initiale inférieure à 10 mg/L. En raison de son coût qui reste relativement élevé, les industriels ont des réserves sur son emploi comme produit pour le traitement de leurs effluents inorganiques ouvrant ainsi la voie à la découverte d’autres adsorbants dérivant de plusieurs sources telles que les déchets agroalimentaires et les phosphates naturelles et synthétiques. L’adsorption sur le charbon actif est actuellement l’un des procédés les plus utilisés pour éliminer les composés organiques ainsi que quelques métaux lourds.
IV.3. La silice poreuse et ses dérivées
La silice de formule chimique SiO2, peut provenir naturellement de l’écorce terrestre
où peut être synthétisée, sous différentes formes, comme décrit dans la littérature. L’une des caractéristiques les plus importantes de la silice est surtout sa porosité. Cette dernière caractéristique a surtout lieu quand les particules discrètes formant la silice sont compactées et cimentées entre elles, laissant des espaces vides et des interstices, connus comme étant les espaces poreux. De nombreuses études ont été réalisées sur l’élimination des métaux lourds par des silices modifiées [49].
IV.4. Les phosphates de calcium
De nombreuses études ont été réalisées pour évaluer le pouvoir de rétention des phosphates naturels et les apatites synthétiques vis-à-vis des métaux lourds contenus dans les sols et les eaux. Les propriétés de rétention de ces phosphates de calcium dépendent de leurs caractéristiques physico - chimiques, en particulier le rapport molaire Ca/P, de la structure cristallographique et de la surface spécifique. Ainsi, en fonction du rapport molaire Ca/P, nous pouvons définir plusieurs familles d’orthophosphate de calcium.
L’hydroxyapatite Ca10(PO)6(OH)2 de rapport atomique Ca/P égale à 1,67 a été
largement étudiée grâce de ses propriétés physico-chimiques intéressantes, notamment la capacité d’adsorption et l’échange ionique. Elles sont capables d’immobiliser différentes espèces inorganiques et organiques [2, 28, 42, 50].
Le processus de rétention des métaux nocifs par les apatites qu’elles soient naturelles ou synthétiques fait intervenir les mécanismes suivants :
- Le processus d’échange ionique à la surface,
- La complexation des ions à la surface en faisant intervenir les groupements P-OH, - La précipitation de quelques composés amorphes métal-phosphate.
La détermination d’un tel mécanisme responsable de la rétention est encore difficile, mais il apparaît qu’une combinaison de plusieurs mécanismes peut avoir lieu simultanément. L’étude de la rétention des ions métalliques sur les apatites est conditionnée par plusieurs paramètres à savoir le pH, la température, la concentration initiale du métal, le temps de contact, les rapports molaires métal/Ca et P/métal et la surface spécifique de l’adsorbant.
Au cours de cette partie consacrée à la description des méthodes physico-chimiques les plus répondues pour le traitement des substances nocives, nous rappelons que chacune de ces techniques possède ses avantages et ses inconvénients, et qu’elles n’existent pas de techniques universelles permettant de piéger tous les métaux lourds présents dans un effluent industriel. Le choix d’une technique reste lié au coût du processus qui ne doit pas être onéreux. D’ailleurs, les techniques de traitement par adsorption sont avérées les meilleures à adopter puisqu’elles mettent en jeu pour la plupart du temps des produits naturels ou des sous–produits émanant des industries agricoles et agroalimentaires. La disponibilité et l’abondance locale de l’adsorbant sont aussi des facteurs déterminants pour le choix d’une telle application.
Différentes matrices sont actuellement utilisées ou en cours du développement du processus de son utilisation, pour stabiliser des déchets provenant de diverses origines : cations métalliques et substances organiques. Parmi celles-ci, les hydroxyapatites sont couramment étudiées pour piéger et stocker les métaux lourds contenus dans les effluents liquides. Notons que les propriétés d’adsorption sont liées aux propriétés structurales. Dans cet aperçu bibliographique, nous présentons ainsi la structure de l’apatite et les substitutions possibles.
Conclusion
Les études menées jusqu’à présent sur le piégeage des ions métalliques fournissent énormément d’hypothèses, très peu d’entre elles prennent en compte les propriétés
particulières des techniques de traitement. En fait, les difficultés rencontrées par les auteurs pour déterminer le mécanisme de fixation des ions métalliques par la plupart des adsorbants sont certainement liées à leur manque de connaissance du système solide/solution. Ainsi, la réactivité de la surface des minéraux est très souvent confondue avec celle des sites cristallographiques. Enfin, la plupart des auteurs ont utilisé la technique d’adsorption en colonne ou en batch pour étudier certaines interactions chimiques soluté - solide.
La détermination du mécanisme de piégeage des cations métalliques par un système poreux passe nécessairement par la maîtrise de chacun des composants du système, et plus particulièrement l’activation et la caractérisation de la surface du matériau à étudier. La synthèse et la caractérisation fine de nouvelles apatites fonctionnalisées ou hybrides constituent donc une étape essentielle de nos travaux de recherche.
Chapitre II
Structure des apatites et fonctionnalisation
de leur surface
Introduction
Les phosphates apatitiques appartiennent à une vaste famille de biomatériaux appliqués en odontologie, oto-rhino-laryngologie, revêtements de prothèses et l’élaboration de substituts osseux. Ils possèdent des propriétés d’adsorption vis-à-vis des composés organiques (acides aminés, protéines, pesticides,…) et inorganiques (métaux lourds, fluorures,…). Ils sont utilisés comme support pour la chromatographie en phase liquide de haute performance (CLHP) lors de la séparation de divers composés biologiques (ADN, ARN). L’ensemble de ces applications peut être en relation avec la réactivité des ions constitutifs du réseau apatitique et les propriétés de surface. Le contrôle de leur surface apparaît très utile afin de maîtriser leurs propriétés d’adsorption qui dépendent essentiellement des sites actifs à la surface du solide.
Les traitements de surface, par adhésion ou greffage in situ des molécules, sont des traitements ayant pour but de modifier les propriétés physiques et/ou chimiques des matériaux (Biomatériaux ou Adsorbants), qui engendrent des réactions chimiques à la surface des dits matériaux. Ces modifications chimiques de la surface permettent d’obtenir des propriétés modifiées et souvent améliorées. Parmi celles ci, nous pouvons noter la solubilité du matériau fonctionnalisé, l’accroissement de la charge à la surface, les fortes interactions des molécules surface-liquide, le caractère l’hydrophile/ hydrophobe d’une surface ou d’une entité adsorbée à cette surface, morphologie et homogénéité de la surface modifiée. Dans ce chapitre, nous nous sommes intéressés plus particulièrement à l’adsorption des espèces organiques et inorganiques sur des surfaces modifiées d’apatites. Cependant, il est très utile de donner un bref rappel relatif à la structure des apatites et les substitutions possibles dans le réseau apatitique. L’adhésion et le greffage des molécules organiques à la surface des hydroxyapatites sont aussi discutés dans ce chapitre.
I. Rappel sur les propriétés structurales des apatites I.1. Structure des apatites
L'apatite cristallise dans le système hexagonal du groupe spatial P /m
3
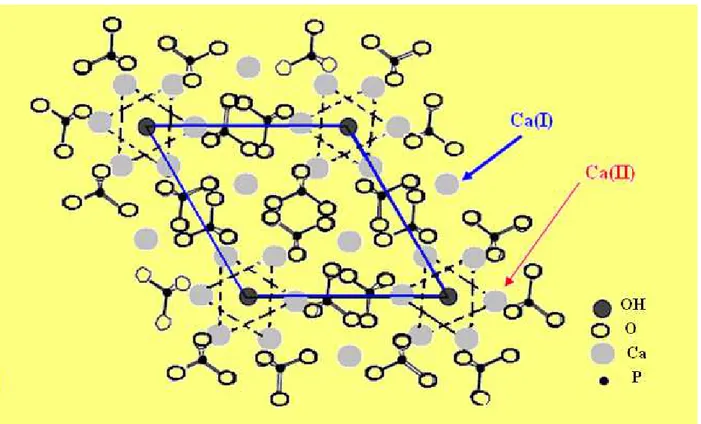
6 [51-52], caractérisé par un empilement quasi compact des groupements phosphates, qui forme deux types de tunnels parallèles à l'axe c. Le premier coïncide avec l’axe ternaire de la structure. Ces tunnels sont occupés par des ions calcium notés Ca(I). Le second type de tunnel, dont
l’axe coïncide avec l’axe sénaire hélicoïdal du réseau, est bordé par les atomes des autres ions calcium, notés Ca(II), et occupé par les ions OH-. La taille de ce dernier tunnel (3 Å pour l’hydroxyapatite phosphocalcique, notée HAp) confère aux apatites des propriétés d’échangeurs d’ions. Ces substitutions engendrent des variations de cristallinité, de stabilité thermique et de solubilité. En tenant compte des deux sites cristallographiques des atomes de calcium Ca(I) et Ca(II), on peut donc représenter l’hydroxyapatite phosphocalcique par la formule suivante : [CaI]4[CaII]6(PO4)6(OH)2.
Figure II-1 : Projection de la structure de l’hydroxyapatite phosphocalcique sur le plan de base (001), illustrant l’environnement des atomes Ca(I) et Ca(II) dans la pseudo maille de
l’apatite.
I.2. Substitutions dans le réseau de l’apatite
La principale caractéristique de la structure apatitique est d’admettre un grand nombre de substitutions, qui laissent inchangé la structure cristallographique, mais lui confère des propriétés physico-chimiques intéressantes [53-54]. Des substitutions les plus simples et les mieux connues dans le cas de l’apatite concernent les ions OH-, qui peuvent être remplacés, partiellement ou totalement par des ions F- et Cl- pour former respectivement la fluorapatite et la chloroapatite. L’hydroxyde OH peut être remplacé par d’autres groupements bivalents (O2-, S2-, CO32-) ou par des lacunes. La formation de lacunes dans les sites OH peut être très
d’adsorption. Les sites cationiques acceptent de multiples substitutions allant de l’élément monovalent au trivalent avec différentes tailles cationiques. Plusieurs séries d’apatites ont été préparées en particulier la pyromorphite Pb10(PO4)6X2, (X=F, OH, Cl..) [54] et une variété de
composés des solutions solides Ca10-xMx(PO4)6(OH)2 (M= Pb, Zn, Cu, Ni… ). La présence des
tunnels dans la structure de l’apatite donne à ce matériau des propriétés d’échanges d’ions et d’adsorption.
Exemples de substitutions dans la structure apatitique
I.3. Méthodes d’élaboration des apatites
En raison de nombreuses applications de l’hydroxyapatite, que se soit dans le domaine médical comme substituts osseux ou dans le domaine environnemental comme adsorbant de métaux toxiques, plusieurs méthodes de synthèse ont été mises en œuvre [55-59]. Les synthèses de l’hydroxyapatite s’opèrent soit par voie sèche où les précurseurs sont mélangés à l’état solide ou en milieu humide en utilisant des réactifs en solution. La synthèse chimique par voie humide est la méthode la plus utilisée. Elle regroupe plusieurs techniques, nous ne citons que celles les plus répondues dans la littérature à savoir la double décomposition, la neutralisation, l’hydrothermale et le sol gel.
Ces méthodes de synthèse des apatites sont bien décrites dans le mémoire de thèse de S. El Asri [50]. De nombreux paramètres tels que, la température de la réaction de synthèse, le pH de la solution, le temps de maturation doivent être parfaitement contrôlés afin de maîtriser la stœchiométrie des poudres synthétisées.
Par ailleurs, la plupart de ces apatites sont parfois modifiées selon leurs applications visées. Néanmoins, la fabrication des apatites mésoporeuses à vocation environnementale
nécessite l’utilisation d’un protocole expérimental spécial afin d’introduire des modificateurs de surface organiques ou inorganiques. Dans ce contexte, plusieurs études se sont intéressées à la modification de la surface des apatites afin d’améliorer plus particulièrement leurs propriétés d’adsorption et d’échanges ioniques.
II. Modification des surfaces des apatites II.1. Apatite à caractère médical
Les hydroxyapatites phosphocalciques, utilisées comme biomatériaux, doivent posséder à la fois des propriétés structurales adaptées à la fonction attendue et des propriétés superficielles garantissant l'instauration de relations positives à l'interface implant - tissus. Il faut signaler, tout particulièrement, que l'hydroxyapatite (HAp) présente l'avantage d'être ostéo-conducteur. Elle favorise la repousse osseuse au contact et la colonisation par l'os, mais dont l'agencement spatial en diffère notablement puisque des cristaux d'hydroxyapatite y sont accolés à des fibres de collagène. En outre, les hydroxyapatites poreuses sont biorésorbables. Le principal problème rencontré avec l'HAp est de pouvoir synthétiser une HAp ayant juste la taille de pores idéale pour qu’une bonne colonisation se fasse. On peut greffer dans leur matrice des espèces chimiques ou biologiques capables d’interagir avec le tissu vivant. Nous donnons à titre d’exemple des protéines, des peptides, des polymères ou des cellules, qui peuvent avoir un effet positif en surface. La figure II-2 schématise l’échange des espèces qui peut avoir lieu au contact apatite-solution. Dans le domaine médical, cet échange favorise certaines réactions chimiques au niveau de l’interface « os-implant ».
De nombreuses études ont été axées sur la biocompatibilité et la biofonctionnalité des hydroxyapatites pour adapter chimiquement les surfaces de celles-ci et répondre aux contraintes biochimiques et biomécaniques qui reposent sur des réactions cellulaires ou tissulaires au contact quasichimique avec le tissu osseux. Okazaki et col. [60] ont étudié l’adhésion des substances de l’acide désoxyribonucléique ADN sur une surface d’HAp comme le montre la figure II-3. Le biomatériau ainsi obtenu présente une bonne réactivité entre les ions Ca2+ présents à la surface de l’HAp et les espèces ADN, qui se fixent sous forme d’arbre dendritique.
Figure II-3 : Schéma représentatif de l’adhésion des molécules d’ADN à la surface de l’hydroxyapatite phosphocalcique.
Une autre étude consacrée à l’adsorption des peptides sur les apatites a pu montrer la modification de la surface de l’apatite par les groupements petitidiques [61-62]. Achokan et col [63] ont aussi préparé selon différentes étapes des nanoapatites avec des surfaces greffées par des molécules combinées par l’acide folique, un acide aminé et un polymère (Figure II-4).