HAL Id: tel-02518996
https://tel.archives-ouvertes.fr/tel-02518996
Submitted on 25 Mar 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
dystrophique récessive
Clarisse Ganier
To cite this version:
Clarisse Ganier. Potentiel thérapeutique des cellules stromales mésenchymateuses dans l’épidermolyse bulleuse dystrophique récessive. Génétique humaine. Université Sorbonne Paris Cité, 2018. Français. �NNT : 2018USPCB185�. �tel-02518996�
École Doctorale 562 : BIO SORBONNE PARIS CITÉ (BIOSPC)
Laboratoire des ‘Maladies génétiques cutanées : des mécanismes
pathologiques aux traitements’ ; INSERM UMR 1163, 75015 Paris
Potentiel Thérapeutique des Cellules Stromales
Mésenchymateuses dans l’Épidermolyse
Bulleuse Dystrophique Récessive
Par Clarisse GANIER
Thèse de doctorat de Génétique
Dirigée par le Professeur Alain HOVNANIAN
Présentée et soutenue publiquement le 26 novembre 2018, devant un jury composé de :
Pr. Martine BAGOT
Présidente du jury
Pr. Onnik AGBULUT
Rapporteur
Pr. Francis PALISSON
Rapporteur
Pr. David WOODLEY
Examinateur
Dr. Sonia GAUCHER
Membre invité
Dr. Matthias TITEUX
Membre invité
Pr. Alain HOVNANIAN
Directeur de thèse
L’épidermolyse bulleuse dystrophique récessive (EBDR) est une maladie génétique cutanée due à des mutations de perte de fonction du gène COL7A1 codant pour le collagène VII. Le collagène VII forme les fibres d’ancrage, structures essentielles pour l'adhésion de l’épiderme au derme sous-jacent. Les patients EBDR développent dès la naissance, des décollements bulleux de la peau et des muqueuses responsables de plaies chroniques et de graves complications locales et systémiques. La survenue de carcinomes épidermoïdes cutanés agressifs reste la première cause de décès. Il n’existe pas de traitement à ce jour. Les cellules stromales mésenchymateuses (CSM) sont des cellules multipotentes, isolées à partir de tissus adultes (moelle osseuse, tissu adipeux) ou de tissus périnataux (cordon ombilical). Des travaux antérieurs ont montré que les injections locales et systémiques de CSM issues de la moelle osseuse (CSM-MO) allogéniques ont un potentiel pour réduire l'inflammation cutanée et améliorer la cicatrisation des plaies chez les patients EBDR. Ces améliorations cliniques sont cependant transitoires et les mécanismes d'action des CSM-MO dans l’EBDR ainsi que leur durée de vie après injection sont mal connus. Les CSM-MO pourraient agir via leurs propriétés immunomodulatrices, anti-fibrotiques, pro-angiogéniques, par un effet paracrine permettant l'expression de collagène VII endogène et/ou la sécrétion de collagène VII par les CSM-MO injectées.
L’objectif de ma thèse a été d’étudier le potentiel thérapeutique des CSM dans des modèles précliniques de l’EBDR.
Nous avons tout d’abord montré que les CSM-MO humaines expriment une quantité d’ARNm de
COL7A1 et de collagène VII comparable aux fibroblastes humains dermiques sains en culture. Nous
avons ensuite évalué la capacité des CSM-MO humaines à survivre et produire du collagène VII à la jonction dermo-épidermique (JDE) à long terme après une injection locale dans des peaux équivalentes humaines EBDR greffées sur souris nude. L'injection intradermique (ID) de CSM-MO in vivo a permis de restaurer l’expression du collagène VII ainsi que la formation de fibres d’ancrage à la JDE jusqu'à 6 mois après l'injection. Les CSM-MO sont retrouvées dans la peau équivalente jusqu'à 4 mois après l'injection. Ces résultats montrent qu’une injection ID unique de CSM-MO in vivo permet de rétablir une production prolongée de collagène VII synthétisé par les cellules injectées et d'améliorer l'adhésion dermo-épidermique de la peau équivalente EBDR.
Nous avons ensuite comparé l’efficacité des CSM issues de la gelée de Wharton de cordon ombilicaux (CSM-CO) humains aux CSM-MO humaines suivant la même méthodologie que précédemment. Les CSM-CO expriment en culture une quantité d’ARNm de COL7A1 et de collagène VII supérieures aux CSM-MO et fibroblastes dermiques sains. Une injection unique ID de CSM-CO dans la peau EBDR équivalente greffée permet de rétablir une faible expression de collagène VII jusqu'à 4 mois après l'injection. Les CSM-CO sont détectées dans la peau équivalente jusqu'à 2 mois après l'injection. Ces données montrent que les CSM-CO ont une capacité moindre à restaurer l’expression du collagène VII à la JDE comparativement aux CSM-MO injectées dans le même modèle de xénogreffes EBDR. Ces résultats ouvrent la perspective d’une thérapie génique ex vivo utilisant des CSM-MO murines
Col7a1-/-. Les souris Col7a1-/- reproduisent les lésions cutanées et muqueuses observées chez les patients
EBDR. L’espérance de vie de ces animaux est très réduite. Les CSM-MO murines Col7a1-/-transduites
en culture à l’aide d’un vecteur rétroviral SIN exprimant COL7A1 produisent en moyenne 30 fois plus de collagène VII que les CSM-MO murines WT. Des expériences in vivo sont nécessaires pour déterminer si l’injection de CSM-MO génétiquement corrigées a le potentiel de traiter des lésions cutanées et muqueuses et également de définir la dose optimale et la durée de l’effet chez l’animal. Ceci constituerait une étape importante vers la clinique.
Recessive dystrophic epidermolysis bullosa (RDEB) is a severe skin disease caused by loss-of-function mutations in COL7A1 encoding type VII collagen. Type VII collagen forms anchoring fibrils which are essential structures for dermal-epidermal adherence. Patients with RDEB suffer since birth from skin and mucosal blistering and develop severe complications. The development of aggressive squamous cell carcinomas is the first cause of demise of these young patients. To date, there is no treatment. Mesenchymal stromal cells (MSC) are multipotent cells, isolated from adult tissue (bone marrow, adipose tissue) or perinatal tissue (umbilical cord). Previous works have shown that local and systemic injections of allogeneic bone marrow-derived MSC (BM-MSC) have a potential to reduce skin inflammation and to improve wound healing in RDEB patients. However, clinical improvement was transient and the mechanisms of action of BM-MSC in RDEB and also their survival after injection are still poorly understood. BM-MSC could act through immunomodulation, anti-fibrotic and angiogenic proprieties, paracrine effects leading to type VII collagen production in the host tissues and/or type VII collagen secretion by injected BM-MSC.
The aim of our work was to study the therapeutic potential of MSC for RDEB in preclinical models. We first showed that human BM-MSC produce COL7A1 mRNA and type VII collagen levels comparable to human healthy dermal fibroblasts in culture. We then assessed the long-term capacity of human BM-MSC to survive, produce and deposit type VII collagen at the dermal-epidermal junction (DEJ) after local injection in human RDEB skin equivalents transplanted onto nude mice. In vivo intradermal (ID) injection of a single dose of human BM-MSC led to the production and deposition of human type VII collagen at the DEJ and allowed anchoring fibrils formation for at least six months post-injection. Injected human BM-MSC were found in the skin at least four months post-post-injection. These data show that intradermally injected human BM-MSC have the potential to improve dermal-epidermal adhesion of RDEB skin equivalents through sustained deposit of type VII collagen molecules and subsequent anchoring fibrils formation.
We then compared the efficacy of human Umbilical Cord Wharton’s Jelly-MSC (UC-MSC) with human BM-MSC using the same methodology as previously described. UC-MSC showed in vitro a significantly higher amount of COL7A1 mRNA and type VII collagen compared to BM-MSC and healthy dermal fibroblasts in culture. ID injection of a single dose of UC-MSC in vivo led to the production and deposition of low levels of human type VII collagen at the DEJ for four months post-injection. Injected human UC-MSC were found in the skin two months post-post-injection. These data disclosed a lower efficacy of UC-MSC to restore collagen VII at the DEJ compared to BM-MSC injected in the same xenograft RDEB model.
These data open the perspective of using gene-corrected BM-MSC from a Col7a1-/- RDEB murine model
to restore normal dermal-epidermal adhesion. Col7a1-/- mice reproduce cutaneous and mucosal lesions
observed in RDEB patients. The life expectancy of these animals is very short. We could show that transduction of Col7a1-/- murine BM-MSC in culture using a COL7A1-expressing SIN retroviral vector
led to type VII collagen expression levels which were 30-fold higher on average than in BM-MSC from WT mice. In vivo data are required to determine whether the injection of gene-corrected BM-MSC has the potential to treat skin and mucosal lesions in RDEB mice and to define the optimal dose and duration of the effect in vivo. Restoration of type VII collagen expression and anchoring fibril formation in
3
Remerciements
Je tenais à exprimer mes plus sincères remerciements,
A Mme le Professeur Martine Bagot, pour m’avoir fait le grand honneur d’accepter de présider mon jury de thèse.
A M. le Professeur Francis Palisson et M. le Professeur Onnik Agbulut, pour avoir accepté d’évaluer mon travail de thèse en tant que rapporteurs.
A M. le Professeur David Woodley, pour avoir accepté d’être examinateur dans mon jury de thèse et également pour toutes les discussions scientifiques passionnantes que nous avons eues. A M. le Professeur Alain Hovnanian, mon directeur de thèse, qui m’a donné la chance d’effectuer mon stage de Master 2 puis qui m’a fait confiance pour réaliser une thèse de science dans son laboratoire. Je vous remercie également pour toutes les fabuleuses opportunités que j’ai eues durant ma thèse grâce à votre soutien. Un grand merci aussi pour la transmission de vos connaissances, vos conseils avisés et votre rigueur scientifique dont j’ai énormément appris. A Sonia Gaucher, pour son implication et son soutien sans faille dans mon travail de thèse. Merci également de ta gentillesse et ta bienveillance, tu es un très bel exemple de femme persévérante et talentueuse à suivre.
A Matthias Titeux, pour m’avoir guidé dans mes débuts avec patience et rigueur, merci pour tous tes conseils scientifiques et techniques tout au long de ma thèse. Tu es un véritable puits de connaissance avec qui il est toujours possible de discuter et d’apprendre sur tous les sujets. A Araksya Izmiryan, pour tous les merveilleux moments que nous avons passés ensemble tant sérieux qu’hilarants, en congrès ou dans notre bureau. Tu es une personne formidable et brillante, j’ai adoré travailler et discuter avec toi. Je te remercie pour toute l’aide que tu m’as apportée, tes réponses à toutes mes questions et tes bons conseils tout au long de ma thèse. A Soizic Portier et Soeli Charbonnier, mes premières collègues de bureau avec qui la bonne humeur était toujours présente. Mon Master 2 et mon début de thèse n’auraient pas été pareils sans vous deux.
A Mathilde Bonnet des Claustres, pour ton aide et ton soutien dans les derniers moments. Merci de me donner la certitude que le projet que j’ai commencé est maintenant entre de bonnes mains.
A Valérie Kayser-Guélin, pour son aide, sa bonne humeur et toutes nos discussions toujours très plaisantes.
A tous mes autres très chers collègues que j’ai pu avoir tout au long de cette thèse et avec qui j’ai passée de très bons moments amicaux et scientifiques: Camille Berthault, Claire
Barbieux, Evgeniya Petrova, Florent Leturcq, Hélène Ragot, Hervé Bachelez, Joanna Jackow, Jonathan Bonnefoy, Juliette Ly, Justine Berthet, Laetitia Furio, Laure Levenez, Leslie Marel, Lorenzo Tala, Lucas Brusselle, Maya Kaga, Nathalie Pironon, Olivier
A mes collaborateurs qui ont rendu ce travail possible :
A Mmele Professeur Akemi Ishida-Yamamoto, pour son expertise sur les fibres d’ancrages. A M. le Professeur Jean-Jacques Lataillade et Mme le docteur Juliette Peltzer, pour l’accès aux cellules stromales mésenchymateuses et à toutes leurs connaissances sur le sujet, spécialement à Juliette qui a toujours été là pour répondre à toutes mes questions.
A Mme le docteur Valérie Malan et M. Marc Le Lorc’h, qui m’ont permis d’apprendre le FISH et permis de faire mes expériences dans leur laboratoire.
A M. le Professeur Katsuto Tamai et son équipe pour m’avoir accueillie pour une formation de deux mois à Osaka au Japon, ce fut une formidable expérience. Je remercie également la Fondation René Touraine pour m’avoir permis de réaliser ce voyage.
A toute la grande famille de l’Institut Imagine dirigé par M. le professeur Stanislas Lyonnet, que je remercie également. Ce fut un réel plaisir de travailler dans un environnement scientifique et social aussi stimulant et dynamique. Un grand merci également à toutes les plateformes de l’Institut Imagine notamment celles de Microscopie et l’Animalerie LEAT. Merci également à la plateforme de Microscopie Electronique de Cochin dirigée par M. le docteur Alain Schmitt.
A l’association YR2I pour m’avoir élue présidente deux années de suite et avec qui j’ai organisé de fabuleux évènements dont deux congrès scientifiques inoubliables à l’institut Imagine. J’ai adoré travailler avec vous : Anaïs Julien, Carolina Uggenti, Claire Leveau,
Cyril Longé, Diana Dinca, Flavia Guilem, Gwen Le Meur, Hicham Lamrini, Isabelle Munoz, Lara De Tomasi, Magda Cannata Serio, Marie Dupont, Marie-Louise Frémond, Mathilda Bedin, Moussab Tafti, Simon Nicoletti, Sophie Ramadier.
A mes grands-parents, mes parents, mes sœurs et mes beaux-parents pour leur soutien tout au long de ma thèse. Spécialement à Carole qui m’a si souvent écoutée pendant mes répétitions. A tous mes très chers amis, qui ont tous au moins une fois entendu parler d’épidermolyse bulleuse et de cellules stromales mésenchymateuses et qui m’ont toujours soutenue.
A mon très cher Nicolas, pour son soutien démesuré et inconditionnel durant toutes ces années. Toujours prêt à m’aider, me faire répéter et vouloir en savoir plus sur mes expériences et mes recherches. Merci d’avoir été à mes côtés.
A toutes les personnes que j’ai pu côtoyer de loin ou de près pendant ma thèse et qui ont permis de rendre ces 3 années de doctorat inoubliables.
Liste des Abréviations ... 9
Liste des Figures ... 11
Liste des Tableaux ... 12
INTRODUCTION ... 13
PARTIE I – LA PEAU HUMAINE SAINE ... 15
I.1 – GENERALITES ... 15
I.2 – L’EPIDERME ... 16
I.2.1 – Organisation ... 16
I.2.2 – Les différentes couches de l’épiderme ... 17
I.2.2.1 – La couche basale (stratum basale ou germinativum) ... 17
I.2.2.2 – La couche épineuse (stratum spinosum) ... 17
I.2.2.3 – La couche granuleuse (stratum granulosum) ... 18
I.2.2.4 – La couche cornée (stratum corneum) ... 18
I.2.3 – Les cellules de l’épiderme ... 20
I.2.3.1 – Les kératinocytes ... 20
I.2.3.2 – Les cellules de Langerhans ... 20
I.2.3.3 – Les mélanocytes ... 21
I.2.3.4 – Les cellules de Merkel ... 21
I.3 – LA JONCTION DERMO-EPIDERMIQUE ... 22
I.3.1 – La membrane plasmique ... 23
I.3.2 – La lamina lucida ... 23
I.3.3 – La lamina densa ... 24
I.3.4 – La zone fibrillaire du derme papillaire ... 24
I.4 – LE DERME ... 25
I.4.1 – Les différentes couches du derme ... 26
I.4.1.1 – Le derme papillaire ... 26
I.4.1.2 – Le derme réticulaire ... 26
I.4.2 – Les différents types cellulaires constitutifs du derme ... 27
I.4.2.1 – Les fibroblastes dermiques ... 27
6
I.4.3 – La matrice extracellulaire ... 29
I.4.3.1 – Les fibres ... 29
I.4.3.2 – La substance fondamentale ... 30
I.5 – L’HYPODERME ... 30
PARTIE II – LES EPIDERMOLYSES BULLEUSES ... 31
II.1 – GENERALITES ... 31
II.2 – LES DIFFERENTES FORMES D’EPIDERMOLYSES BULLEUSES HEREDITAIRES ... 32
II.2.1 – L’épidermolyse bulleuse simple ... 32
II.2.2 – L’épidermolyse bulleuse dystrophique ... 33
II.2.3 – L’épidermolyse bulleuse jonctionnelle ... 33
II.2.4 – Le Syndrome de Kindler ... 34
II.3 – PHYSIOPATHOLOGIE DES EPIDERMOLYSES BULLEUSES DYSTROPHIQUES ... 35
II.3.1 – Aspect génétique de la maladie ... 35
II.3.2 – Structure du collagène VII ... 36
II.3.3 – Formation des fibres d’ancrage et leurs interactions ... 37
II.4 – DESCRIPTION DES EPIDERMOLYSES BULLEUSES DYSTROPHIQUES ... 40
II.4.1 – Présentation clinique des épidermolyses bulleuses dystrophiques ... 40
II.4.2 – Histopathologie des épidermolyses bulleuses dystrophiques ... 42
II.4.3 – Corrélations génotype-phénotype ... 44
II.5 – MODELES PRECLINIQUES EBDR ... 44
II.5.1 – Le modèle murin de xénogreffe EBDR ... 44
II.5.2 – Le modèle murin Col7a1-/-... 45
II.5.3 – Le modèle murin hypomorphe EBDR ... 46
II.5.4 – Autre modèle murin EBDR ... 47
II.6 - STRATEGIES THERAPEUTIQUES DES EBDR ... 49
II.6.1 – Thérapie génique ... 49
II.6.1.1 – Correction génique par addition de l’ADNc de COL7A1 à l’aide de vecteurs viraux ... 49
II.6.1.2 – Correction génique par édition du génome ... 51
II.6.1.3 – Correction génique par modulation de l’épissage des ARN pré-messagers ... 53
II.6.2 – Thérapie protéique ... 54
II.6.3 – Thérapie pharmacologique ... 55
II.6.4 – Thérapie cellulaire ... 57
PARTIE III – LES CELLULES STROMALES MESENCHYMATEUSES ... 59
III.1 – GENERALITES ... 59
III.2 – HISTORIQUE, DEFINITION ET CARACTERISATION IN VITRO ... 60
III.3 – SOURCES DE CSM ... 63
III.3.1 – Les CSM de moelle osseuse ... 64
III.3.2 – Les CSM du tissu adipeux ... 65
III.3.3 – Les CSM de la gelée de Wharton du cordon ombilical ... 66
III.4 – PROPRIETES DES CSM EN THERAPIE CELLULAIRE ... 67
III.4.1 – Propriétés de différenciation ... 67
III.4.2 – Activité paracrine ... 68
III.4.2.1 – Effets immuno-modulateurs ... 69
III.4.2.2 – Effets trophiques des CSM ... 70
III.4.2.2.1 – Effets stromacytaires ... 70
III.4.2.2.2 – Effets anti-apoptotiques ... 71
III.4.2.2.3 – Stimulation de l’angiogenèse ... 71
III.4.2.2.4 – Effets anti-fibrosants... 72
III.4.3 – Homing lésionnel ... 73
III.4.4 – L’utilisation des vésicules extracellulaires dérivées de CSM ... 75
III.5 – CSMETEBDR ... 77
III.5.1 – Greffe de moelle osseuse ... 77
III.5.2 – Thérapie à l’aide du peptide HMGB1 ... 79
III.5.3 – Injections de cellules stromales mésenchymateuses ... 79
III.5.4 – Injections de vésicules extracellulaires dérivées de CSM ... 81
OBJECTIFS DE LA THESE ... 83
RÉSULTATS ... 87
PARTIE I – ARTICLE 1: INTRADERMAL INJECTION OFBONEMARROW-MSCSCORRECTS RECESSIVE DYSTROPHIC EPIDERMOLYSIS BULLOSA INA XENOGRAFT MODEL... 89
PARTIE II – ARTICLE 2: INTRADERMAL INJECTION HUMAN OFUMBILICAL CORD-MSCS SHOWS LESS EFFICACY THAN BONEMARROW-MSCSTOCORRECT RECESSIVE DYSTROPHIC
EPIDERMOLYSIS BULLOSA INA XENOGRAFT MODEL... 117
II.1 – INTRODUCTION ... 117
II.2 – RESULTATS OBTENUS ... 119
II.3 – DISCUSSION ... 120
PARTIE III – EVALUATION D’UNETHERAPIE GENIQUE ET CELLULAIRE EX-VIVO AUTOLOGUE UTILISANT DES CSM-MO MURINES GENETIQUEMENT CORRIGEES ... 139
III.1 – INTRODUCTION ... 139
III.2 – RESULTATS PRELIMINAIRES ... 139
DISCUSSION ... 145
I – POTENTIEL THERAPEUTIQUE DES CSM DANS LE MODELE MURIN DE XENOGREFFE EBDR ... 147
II – STABILITE ET FONCTIONNALITE DU COLLAGENE VII ... 148
III – AMELIORATION DE L’IMPLANTATION CELLULAIRE APRES INJECTION ... 150
III.1 – BIO-DISTRIBUTION DES CSM APRES INJECTION ... 150
III.2 – PRE-CONDITIONNEMENT ET CONDITIONNEMENT DES CSM INJECTEES ... 151
IV – COMPARAISON DES ETUDES DE THERAPIE CELLULAIRE POUR L’EBDR ... 153
IV.1 – LA GREFFE DE MOELLE OSSEUSE VERSUS LES CSM ISOLEES ... 153
IV.2 – L’INJECTION DE FIBROBLASTES DERMIQUES VERSUS CSM ... 155
V – LES DIFFERENTES SOURCES DE CSM ... 156
VI – APPROCHE ALLOGENIQUE OU AUTOLOGUE GENETIQUEMENT CORRIGEE ... 157
CONCLUSION / PERSPECTIVES ... 161
REFERENCES ... 165
ADN Acide DésoxyriboNucléique
ADNc Acide DésoxyriboNucléique complémentaire
ARNm Acide RiboNucléique messager
BP180 Bullous Pemphigoid 180
BP230 Bullous Pemphigoid 230
BPAg1 Bullous Pemphigoid Antigen 1
BPAg2 Bullous Pemphigoid Antigen 2
CCL27 Chemokine (C-C motif) Ligand 27
CCR10 Chemokine (C-C motif) Receptor 10
CFU-F fibroblast colony forming-units
CHO Chinese Hamster Ovary
CMH I Complexe Majeur d'Histocompatibilité de type I
CMH II Complexe Majeur d'Histocompatibilité de type II
CO Cordon ombilical
COL7A1 Collagène, type VII, alpha 1
CRISPR clustered, regularly interspaced, short palindromic repeat
CSM Cellules stromales mésenchymateuses
CSM-CO Cellules stromales mésenchymateuses issues de cordon ombilical
CSM-MO Cellules stromales mésenchymateuses issues de la moelle osseuse
CSM-TA Cellules stromales mésenchymateuses issues du tissu adipeux
CXCR-4 C-X-C chemokine receptor type 4
EB Epidermolyse Bulleuse
EBD Epidermolyse Bulleuse Dystrophique
EBDD Epidermolyse Bulleuse Dystrophique Dominante
EBDR Epidermolyse Bulleuse Dystrophique Récessive
EBJ Epidermolyse Bulleuse Jonctionnelle
EBS Epidermolyse Bulleuse Simple
EF1α Elongation Factor 1α
FERMT1 Fermitin family homolog 1
FISH Fluorescence In Situ Hybridization
FLP Flippase
FRT FLP recombinase target
GAG Glycosaminoglycanes
GFP Green Fluorescent Protein
GMP Good Manufacturing Practice
HB-EGF Heparin Binding-Epidermal Growth Factor-like Growth Factor
HGF Hepatocytes Growth Factor
HLA Human Leukocyte Antigen
HLA-DR Human leukocyte antigen-DR
HMGB-1 High mobility group box-1
ID Intradermique ou Intradermal
IDO Indoleamin 2,3-DiOxygenase
IV Intraveineuse ou Intravenous
J Jours
KO Knock-out
KRT14 Keratin 14
KRT5 Keratin 5
LAMA3 Laminin, alpha 3
LAMB3 Laminin, beta 3
LAMC2 Laminin, gamma 2
LTR Long Terminal Repeats
LV LentiVirus
ME Microscopie Electronique
MEC Matrice ExtraCellulaire
MMF Mycophenolate Mofetil
MMP Matrix MetalloProteinases
MO Moelle Osseuse
MSC Mesenchymal Stromal Cells
NHEJ Non-Homologous End Joining
NOD Non-Obese Diabetic
NSG NOD Scid Gamma
O2 Oxygène
PCR Polymerase Chain Reaction
PGK Phosphoglycerine Kinase
pH Potentiel Hydrogène
PRR Pathogen Recognition Receptor
PTC Premature Termination Codon
RT-PCR Reverse Transcription-Polymerase Chain Reaction
RV RétroVirus
SCID Severe Combined ImmunoDeficiency
SDF-1 Stromal-Derived Factor 1
SIN Self Inactivating
SVF Sérum de veau fœtal
TA Tissu Adipeux
TALENs transcription activator-like effector nucleases
TGF-β Transforming growth factor beta
TIMP Tissue Inhibitors of MetalloProteinases
UV Ultraviolets
VE Vésicules Extracellulaires
VEGF Vascular Endothelial Growth Factor
WT Wild-Type
Figure 1 - Structure générale de la peau humaine saine ... 16
Figure 2 - Stratification de l’épiderme ... 19
Figure 3 - Ultrastructure en microcopie électronique de la jonction dermo-épidermique ... 22
Figure 4 - Les principaux composants de la jonction dermo-épidermique ... 25
Figure 5- Coupe histologique d’une peau humaine ... 27
Figure 6 - Classification des EB héréditaires en fonction du niveau de clivage à la jonction dermo-épidermique ... 32
Figure 7 - Représentation schématique de l’organisation de l’ARNm de COL7A1 ... 35
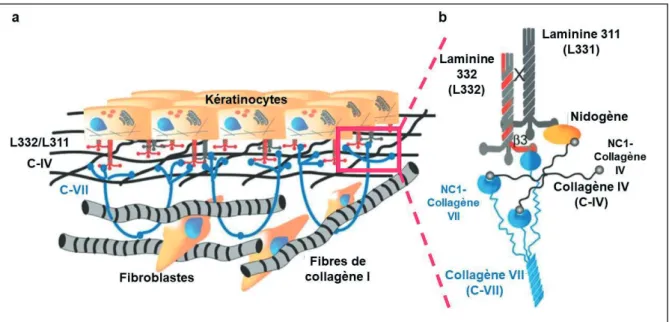
Figure 8 - Les différentes étapes de formation des fibres d’ancrage constitué du collagène VII ... 38
Figure 9 - Représentation schématique de la jonction dermo-épidermique décrivant les interactions des fibres d’ancrages de collagène VII avec les autres acteurs de la jonction dermo-épidermique. ... 39
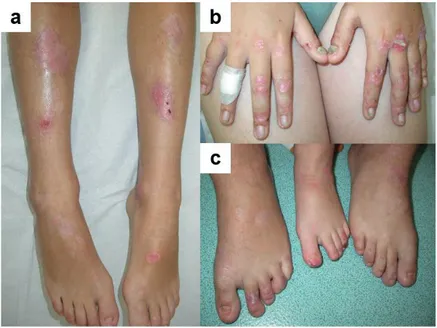
Figure 10 - Photos de patients atteints d’EBDD ... 40
Figure 11 - Photos de patients atteints d’EBDR généralisée sévère ... 41
Figure 12 - Photos d’un patient atteint d’EBDR généralisée intermédiaire ... 42
Figure 13 – L’histopathologie des différentes formes de sévérité de l’EBDR ... 43
Figure 14 - Les principaux modèles murins EBDR rapportés dans la littérature ... 48
Figure 15 - La capacité de différenciation in vitro des CSM en ostéoblastes, chondroblastes et adipocytes dans des milieux de cultures appropriées ... 62
Figure 16 - Les différentes sources de CSM et leurs marqueurs de surfaces ... 64
Figure 17 - La diversité de source des CSM issues de tissus périnataux ... 67
Figure 18 - Les effets paracrines des CSM ... 73
Figure 19 - Les vésicules extracellulaires de CSM, un outil modulable pour la thérapie acellulaire ... 77
Figure 20 - Le modèle murin Col7a1-/-comparé aux souris WT... 140
Figure 21- Isolement et culture des CSM-MO murines de nouveau-nés sains et Col7a1-/- et adultes ... 142
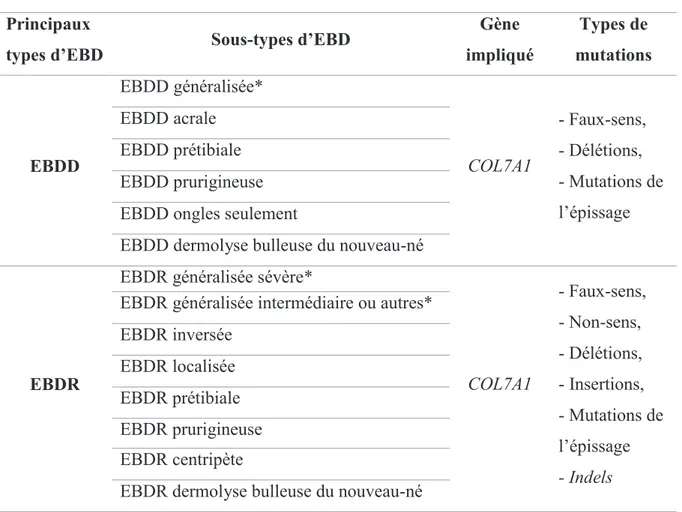
Tableau 1 - Les différents types et sous-types d’EBD ... 36 Tableau 2 - Critères de Potten et Loffler pour l’identification des cellules souches tissulaires ... 61
P
ARTIE
I – L
A PEAU HUMAINE SAINE
I.1 – Généralités
La peau est l'organe le plus étendu et le plus lourd du corps humain, avec une surface de près de 2 m². Elle constitue l’enveloppe du corps humain et se prolonge par les muqueuses au niveau des cavités naturelles de l’organisme. Son épaisseur n’est pas uniforme, variant en fonction du sexe, de l’âge et de la localisation anatomique.
Par sa solidité, son élasticité et sa cohésion, la peau remplit de nombreuses fonctions, la première étant celle de barrière. En contact direct avec l’environnement extérieur, la peau constitue une frontière dynamique qui régule le passage de l’eau, des électrolytes, et de diverses substances entre l’intérieur et l’extérieur de notre corps. Elle nous protège contre la pénétration de microorganismes, d’agents toxiques et des rayonnements ultraviolets (UV) ainsi que des agressions mécaniques. Richement vascularisée, la peau permet la régulation thermique du corps. Dotée de fibres nerveuses associées à des mécanorécepteurs, c’est un organe sensoriel qui transmet des informations au système nerveux central sur notre environnement.
La peau est un organe complexe à la fois souple et résistant, d’un point de vue structural, elle est composée de trois compartiments à la fois distincts et étroitement liés entre eux (Figure 1), qui sont, de la superficie à la profondeur :
- l’épiderme, - le derme, - l’hypoderme.
La peau comporte des annexes cutanées, qui sont les glandes cutanées (glandes sébacées, glandes sudoripares et canaux excréteurs), et les phanères (cheveux, duvets, poils, et ongles). Dans ce chapitre, la description de la peau saine est axée sur l’épiderme et le derme, et plus particulièrement sur la jonction dermo-épidermique et le collagène VII, une protéine essentielle dans l’adhésion dermo-épidermique sur laquelle a porté mon travail de thèse.
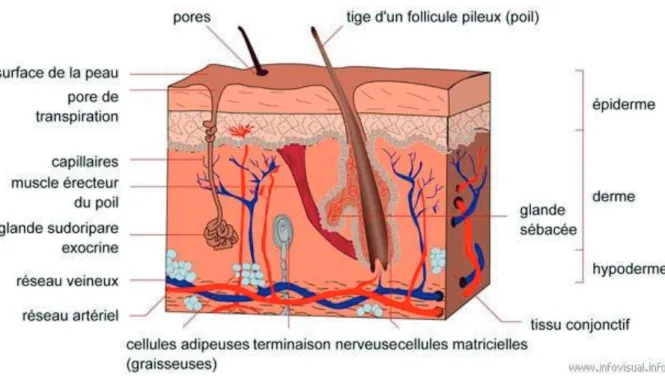
Figure 1 - Structure générale de la peau humaine saine
La peau est composée de trois couches superposées, avec de la superficie à la profondeur, l’épiderme, le derme et l’hypoderme. La peau est richement vascularisée et les annexes cutanées contribuent à ses différentes fonctions.
D’après le site : www.infovisual.info
I.2 – L’épiderme
I.2.1 – Organisation
L’épiderme, d’origine ectodermique, est un épithélium squameux, pluristratifié, kératinisé, innervé et non vascularisé, dont l’épaisseur varie en fonction de sa localisation anatomique (Prost-Squarcioni, 2006).
En superficie, il présente de nombreux orifices correspondant aux poils, aux pores sudoraux et sébacées, qui permettent d’évacuer le sébum et la sueur produits respectivement par les glandes sébacées et les glandes sudoripares (ou sudorales). En profondeur, il présente des invaginations appelées crêtes épidermiques qui se prolongent dans le derme en s’imbriquant dans les papilles dermiques. Quatre types cellulaires composent l’épiderme : les kératinocytes (population majoritaire), les cellules de Langerhans, les mélanocytes et les cellules de Merkel. La structure pluristratifiée de l’épiderme est liée à la différenciation cellulaire progressive des kératinocytes de la couche basale de l’épiderme, de la profondeur à la superficie, en trois à quatre semaines,
ainsi qu’à l’activation de programmes transcriptionnels spécifiques. Ce processus fait de la peau une structure dynamique qui se renouvelle continuellement.
Quatre couches forment l’épiderme qui sont de la profondeur à la superficie, la couche basale, la couche épineuse, la couche granuleuse et la couche cornée (Figure 2, page 19).
I.2.2 – Les différentes couches de l’épiderme
I.2.2.1 – La couche basale (stratum basale ou germinativum)
La couche basale, encore appelée couche germinative, est composée d’une seule assise de kératinocytes de forme pavimenteuse. Cette couche présente de nombreux kératinocytes souches dont la division asymétrique permet à la fois leur renouvellement dans les couches suprabasales et le maintien de kératinocytes indifférenciés dans la couche basale (Blanpain and Fuchs, 2009). Les kératinocytes basaux expriment les kératines 5 et 14 (Haines and Lane, 2012). La couche basale comporte également des mélanocytes et des cellules de Merkel.
I.2.2.2 – La couche épineuse (stratum spinosum)
La couche épineuse qui est essentiellement constituée de cinq à dix strates de kératinocytes selon la localisation anatomique, contient également des mélanocytes, des terminaisons nerveuses (sensation du toucher) et des cellules de Langerhans.
Les kératinocytes de cette couche ne se divisent plus mais subissent des changements morphologiques et biochimiques. Au fur et à mesure de leur différenciation, les kératinocytes acquièrent une morphologie de plus en plus aplatie, et l’expression des kératines 1 et 10 vient en remplacement de celle des kératines 5 et 14 (Fuchs and Green, 1980, Haines and Lane, 2012). L’involucrine, marqueur précoce de la différenciation des kératinocytes, apparaît dans les strates supérieures de cette couche.
Cette couche doit son nom à son aspect épineux sur coupe histologique en microscopie optique, lié au grand nombre de jonctions intercellulaires telles que les desmosomes qui confèrent une grande résistance mécanique à l’épiderme à ce niveau.
I.2.2.3 – La couche granuleuse (stratum granulosum)
La couche granuleuse est la dernière couche nucléée de l’épiderme. Elle est composée d’une à quatre strates de kératinocytes aplatis, parallèlement disposés sur la couche épineuse.
Cette couche tire son nom de son aspect granuleux lié aux nombreux grains de kératohyaline présents dans le cytoplasme des kératinocytes. La kératohyaline est impliquée dans l'aplatissement des cellules kératinisées et dans la formation du réseau de kératine. Ses grains sont constitués de protéines telles que la loricrine, l’involucrine et la profilaggrine. Ces protéines sont des marqueurs des kératinocytes qui sont parvenus au stade terminal de leur différenciation. Cette couche présente également en grand nombre des corps lamellaires contenant différentes enzymes dont des protéases et des anti-protéases, ou encore des lipides tels que les phospholipides, le cholestérol et les glucosylcéramides. Ces corps lamellaires fusionnent avec la membrane plasmique et déversent leur contenu dans les espaces entre les cornéocytes pour former un ciment intercornéocytaire.
Dans les strates les plus superficielles de la couche granuleuse, le processus de cornification (Eckhart et al., 2013) débute pour donner naissance à la couche suivante, la couche cornée.
I.2.2.4 – La couche cornée (stratum corneum)
La couche cornée se compose de cinq à dix assises de cellules énucléées mortes appelées cornéocytes. Le processus de cornification permet la dissolution des noyaux et des organites, et conduit à la création d’un solide squelette de kératines au sein des cornéocytes. Libérée des grains de kératohyaline, la profilaggine se clive en filaggrine pour agréger les filaments intermédiaires de kératines en un réseau dense et former la matrice fibreuse intracellulaire des cornéocytes. La filaggrine est ensuite protéolysée pour générer les facteurs hydratants naturels à la surface de la couche cornée, la maintenant ainsi à un niveau d’hydratation suffisant pour lui donner sa souplesse (Harding et al., 2013). Les transglutaminases, libérées lors de la dissolution des organites, contribuent à la formation de l’enveloppe cornée, macrostructure très solide située le long de la face interne de la membrane des cornéocytes, composée de protéines telles que l’involucrine et la loricrine.
Entre les cornéocytes se trouve le ciment intercornéocytaire constitué de lamelles lipidiques provenant des kératinocytes de la couche granuleuse. Le ciment forme un manteau lipidique qui
confère à la couche cornée son imperméabilité. De plus, les cornéocytes sont liés entre eux par des jonctions spécifiques de la couche cornée apparentées aux desmosomes, les cornéodesmosomes.
La dernière étape de la différenciation des kératinocytes correspond à la desquamation, c'est-à-dire à l’élimination d'amas cornéocytaires visibles macroscopiquement appelés « squames ». Ce phénomène est dû à la dégradation des jonctions qui relient les cornéocytes entre eux par les protéases libérées par les corps lamellaires sous le contrôle d’inhibiteurs (antiprotéases) influencés par le pH de la couche cornée (Deraison et al., 2007, Kitajima, 2013).
L’intégrité de la couche cornée est le point majeur qui permet à la peau d’être une barrière protectrice et semi-perméable empêchant la perte hydrique.
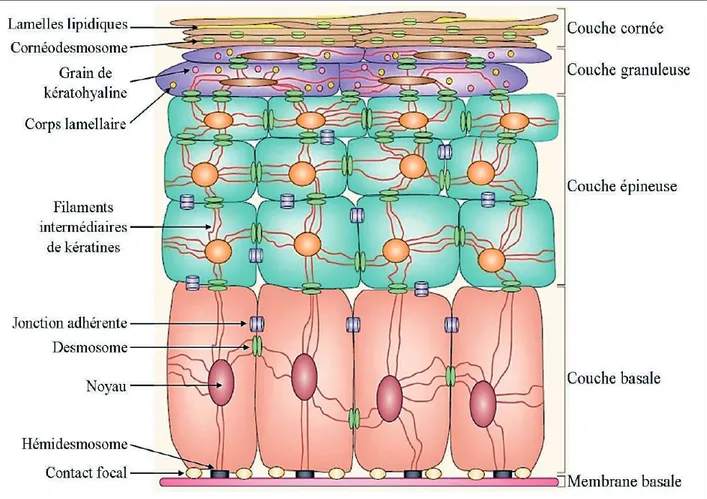
Figure 2 - Stratification de l’épiderme
La stratification de l’épiderme en quatre couches est liée au programme de différenciation des kératinocytes qui changent de morphologie, de composants biochimiques et d’éléments structuraux au cours de leur progression de la couche basale vers la couche cornée.
I.2.3 – Les cellules de l’épiderme
I.2.3.1 – Les kératinocytes
Les kératinocytes, d’origine ectodermique, représentent la population majoritaire des cellules épidermiques (90%). Ils ont pour rôle de synthétiser les kératines ainsi que de nombreux composants de la jonction dermo-épidermique dont le collagène VII.
Les kératines sont des protéines fibreuses qui constituent le cytosquelette des kératinocytes. Elles sont organisées en filaments intermédiaires appelés tonofilaments, résistants et insolubles dans l’eau. Les tonofilaments sont essentiels à la cohésion des kératinocytes entre eux et à la matrice extracellulaire (MEC). Ils s’associent d’une part avec les desmosomes joignant les kératinocytes entre eux, et d’autre part avec les hémidesmosomes de la couche basale reliant les kératinocytes à la MEC du derme sous-jacent, participant ainsi à la cohésion de l’épiderme au derme, et plus généralement à la solidité de la peau (Haines and Lane, 2012)
Les kératines jouent un rôle dans l’évolution de la morphologie des kératinocytes en fonction de leur stade de différenciation au cours de leur migration de la couche basale à la couche cornée (Houben et al., 2007). Durant cette migration, les modifications morphologiques des kératinocytes s’accompagnent de modifications biochimiques. Le nombre de desmosomes augmente, et de nouvelles protéines comme l’involucrine, la filaggrine et la loricrine apparaissent. Les kératinocytes prennent progressivement une forme aplatie. Puis ils perdent leurs noyaux et sont alors appelés cornéocytes. Tandis qu’une partie des kératinocytes de la couche basale, les kératinocytes souches, continuent à proliférer pour contribuer au renouvellement cellulaire, ceux de la couche cornée meurent et se détachent, c’est la desquamation.
I.2.3.2 – Les cellules de Langerhans
Les cellules de Langerhans, d’origine mésoblastique, représentent 3 à 5 % des cellules épidermiques (Katz et al., 1979). Elles possèdent des dendrites (ou prolongements cytoplasmiques) et sont principalement situées entre les kératinocytes des couches suprabasales de l’épiderme.
Ce sont des cellules immunitaires qui résident dans l’épiderme et qui peuvent également migrer vers les ganglions lymphatiques. Elles jouent le rôle de cellules phagocytaires et de cellules
présentatrice d’antigènes. Elles se comportent comme de véritables sentinelles de l’épiderme et phagocytent les antigènes exogènes. Une fois l’agent pathogène internalisé, elles migrent vers les organes lymphoïdes drainants de la peau et présentent les antigènes aux lymphocytes T via le complexe majeur d’histocompatibilité de classe II (CMH II), dans le but de déclencher une réponse immune adaptée.
I.2.3.3 – Les mélanocytes
Les mélanocytes, d’origine ectodermique, dérivent de la crête neurale. Ce sont des cellules dendritiques de forme étoilée qui entrent en contact avec les kératinocytes des couches basale et épineuse, et qui sont spécialisées dans la synthèse de mélanines dans des organites appelés mélanosomes. Deux types de mélanines sont synthétisés : l’eumélanine, pigment brun noirâtre, et la phéomélanine, pigment jaune orangé. Les mélanosomes sont ensuite transférés aux kératinocytes environnants, un mélanocyte pouvant atteindre jusqu’à trente-six kératinocytes avoisinants (Seiberg, 2001). La pigmentation de la peau est donc liée à la quantité et aux types de mélanines produits, le nombre de mélanocytes dans la peau étant constant indépendamment de la couleur de peau.
Les mélanocytes ont également un rôle protecteur vis-à-vis des rayonnements UV. En effet, les mélanosomes transférés dans les kératinocytes se répartissent de façon stratégique autour des noyaux afin de protéger leur ADN des effets délétères mutagènes (Lin and Fisher, 2007).
I.2.3.4 – Les cellules de Merkel
Les cellules de Merkel, d’origine ectodermique, dérivent de la crête neurale. Elles sont localisées dans la couche basale et possèdent également des dendrites qui leur permettent de communiquer avec les kératinocytes et les cellules de Langerhans. Elles appartiennent au système neuroendocrinien et se regroupent pour former l'organe de Merkel, un mécanorécepteur sensible à la déformation tissulaire localisée. Leur répartition n’est pas uniforme sur tout le corps, elles sont en plus grand nombre au niveau des lèvres, des mains et des pieds. En réponse à une stimulation, elles transmettent des signaux aux fibres nerveuses grâce à la formation de synapses chimiques et à la libération de neurotransmetteurs, participant ainsi au sens du toucher.
I.3 – La jonction dermo-épidermique
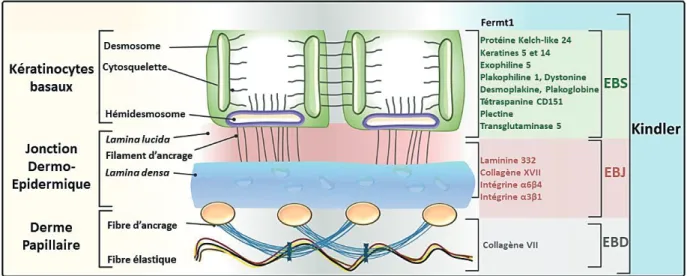
La jonction dermo-épidermique également nommée membrane basale épidermique est une région située entre l’épiderme et le derme sous-jacent. Elle a un rôle primordial dans l’adhésion dermo-épidermique de la peau et des muqueuses. Elle fait également office de filtre de diffusion des échanges moléculaires entre l’épiderme et le derme, permettant ainsi de maintenir l’architecture tissulaire (Simpson et al., 2011). La jonction dermo-épidermique résulte de l’assemblage complexe de molécules, toutes secrétées par les cellules de l’épiderme et du derme et jouant un rôle différent dans l’adhésion dermo-épidermique. L’observation de la jonction dermo-épidermique en microscopie électronique (ME) permet de distinguer quatre zones distinctes qui sont, de l’épiderme vers le derme, la membrane plasmique, la lamina lucida, la
lamina densa et la zone fibrillaire (Figure 3).
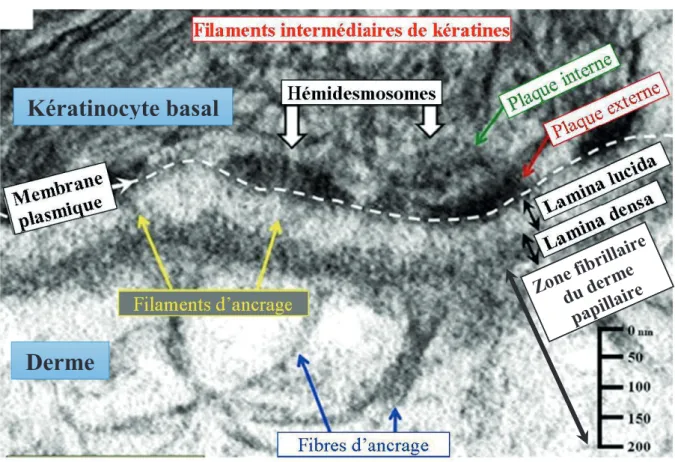
Figure 3 - Ultrastructure en microcopie électronique de la jonction dermo-épidermique
L’observation en ME de la jonction dermo-épidermique montre une architecture complexe qui relie les filaments intermédiaires de kératines aux composants de la matrice extracellulaire du derme. On distingue plusieurs éléments : la membrane plasmique des kératinocytes basaux avec la présence de structures d’attachement comme les hémidesmosomes, la lamina lucida reliée à la lamina densa via les filaments d’ancrage de laminines 332 et 331, puis les fibres d’ancrage de collagène VII reliant la lamina
densa à la zone fibrillaire du derme papillaire. Modifié d’après (Shinkuma et al., 2011).
Kératinocyte basal
I.3.1 – La membrane plasmique
Cette première zone se nomme ainsi car elle est constituée par la membrane plasmique des kératinocytes basaux de l’épiderme. On y retrouve des hémidesmosomes, qui contribuent à l’ancrage des kératinocytes à la lamina lucida. Les hémidesmosomes sont des structures d’attachement constituées de filaments intermédiaires de kératines 5 et 14 associées à deux protéines, la plectine et BPAG1 (cette dernière portant également les noms de BP230, de dystonine ou d’antigène majeur de la pemphigoïde bulleuse). La plectine et BPAG1 permettent la liaison aux protéines transmembranaires : l’intégrine α6β4 et BPAG2 (aussi connue sous les noms de collagène XVII, BP180, ou antigène mineur de la pemphigoïde bulleuse) (Figure 4,
page 25).
Les kératinocytes basaux de l’épiderme peuvent être également attachés via des points de contact focaux qui relient les microfilaments d’actine à la MEC du derme par le même type d’architecture. L’intégrine α6β4 est alors remplacée par l’intégrine α3β1 et d’autres protéines intracytoplasmiques viennent se substituer à celles des hémidesmosomes (Tsuruta et al., 2011). Il semble que les contacts focaux aient plus un rôle de communication et de transduction de signaux entre l’épiderme et la MEC du derme, qu’un rôle d’attachement.
I.3.2 – La lamina lucida
Sous la membrane plasmique, on observe en ME une zone de 20 à 40 nm d’épaisseur, qui a la particularité d’être claire aux électrons d’où son nom de « lamina lucida ». Elle est traversée par des filaments d’ancrage de 5 à 7 nm de diamètre, riches en laminine 332 (aussi appelée laminine 5) et laminine 311 (aussi appelée laminine 6), et qui se lient à la portion extracellulaire de l’intégrine α6β4 à la surface des kératinocytes pour former un complexe d’adhésion avec les hémidesmosomes. Entre les hémidesmosomes, les filaments d’ancrage sont moins abondants et leur composition est différente : l’intégrine α3β1 est associée aux laminines 332-laminines 311 (ou 321).
I.3.3 – La lamina densa
Ainsi appelée parce qu’elle est dense aux électrons, cette zone a une épaisseur qui varie avec l’âge (de 30 à 60 nm). Majoritairement composée de collagène IV, elle est également constituée des laminines 511 et 321 ainsi que des portions amino-terminales des fibres d’ancrage de collagène VII présentes au niveau de la lamina densa (Masunaga et al., 1997, McMillan et al., 2003).
Elle constitue une zone d’ancrage intermédiaire pour les filaments d’ancrage de laminines 332 et 311 issus de la membrane plasmique des kératinocytes se prolongeant dans la lamina lucida et les fibres d’ancrage constituées de collagène VII issues de la zone fibrillaire du derme superficiel ou papillaire.
I.3.4 – La zone fibrillaire du derme papillaire
La zone fibrillaire du derme papillaire comprend des fibres d’ancrage constituées de collagène VII, qui s’élargissent à leur extrémité et qui présentent sur leur partie médiane des bandes de périodicité irrégulière, soit denses et épaisses, soit claires et fines. Ces fibres d’ancrage sont essentielles pour l’adhésion dermo-épidermique : elles font le lien entre la lamina densa et le derme papillaire formant des boucles enchevêtrées joignant deux parties de la lamina densa.
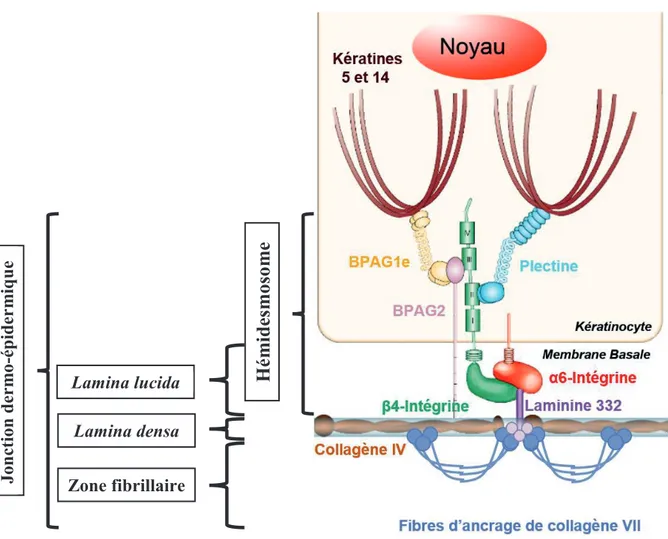
Figure 4 - Les principaux composants de la jonction dermo-épidermique
Des études en immunomicroscopie électronique ont permis de positionner les différents composants de la jonction dermo-épidermique. Ce schéma représente l’adhésion d’un kératinocyte basal au derme papillaire via un hémidesmosome.
Modifié d’après (Fuchs and Raghavan, 2002)
I.4 – Le derme
Le derme est un tissu conjonctif de soutien élastique d’origine mésodermique, constitué de deux couches, le derme papillaire et le derme réticulaire sous-jacent (Figure 5, page 27). Son épaisseur varie selon sa localisation anatomique : il est plus fin au niveau des paupières et plus épais au niveau des paumes des mains et de la plante des pieds. Il est majoritairement composé de fibroblastes et d’une MEC contenant des fibres de collagènes et des fibres élastiques qui confèrent à la peau résistance et élasticité. Il contient également les glandes cutanées (glandes sébacées, glandes sudoripares et canaux excréteurs), et les follicules pileux. Grâce à sa riche
Hé
m
ides
moso
m
e
Lamina lucida Lamina densa Zone fibrillaire Jon ction d erm o-ép id er m iq u evascularisation, le derme assure un rôle nourricier à l’épiderme et participe à la thermorégulation du corps.
I.4.1 – Les différentes couches du derme
I.4.1.1 – Le derme papillaire
Le derme papillaire ou superficiel, est la plus fine partie du derme et la plus proche de la jonction dermo-épidermique. C’est un tissu conjonctif lâche qui forme les papilles dermiques entre les crêtes épidermiques. Il est constitué de fibres de collagènes I et III orientées obliquement ou perpendiculairement à la membrane basale, et de fibres élastiques oxytalanes. Cette partie du derme est également la plus riche en fibroblastes et en mastocytes. On y trouve des récepteurs sensoriels, et des terminaisons nerveuses qui viennent se projeter vers les mécanorécepteurs épidermiques (cellules de Merkel). Les anses capillaires lymphatiques prennent également naissance à ce niveau du derme.
I.4.1.2 – Le derme réticulaire
Le derme réticulaire ou profond correspond à un tissu conjonctif dense. Il est essentiellement constitué de faisceaux de fibres de collagènes denses et de fibres élastiques matures qui s’entrecroisent dans toutes les directions dans des plans grossièrement parallèles à la surface cutanée. Il contient également des récepteurs sensitifs, ainsi que, dans sa partie la plus profonde, les fibres nerveuses du système nerveux autonome qui innervent les vaisseaux lymphatiques et sanguins, les muscles érecteurs des poils (muscles lisses responsables de la « chair de poule ») et les différentes glandes sébacées et sudoripares qui y siègent.
Figure 5- Coupe histologique d’une peau humaine
La coloration à l’hématoxyline et à l’éosine révèle les trois compartiments de la peau : l’épiderme, le derme et l’hypoderme. Le derme est composé de deux couches : le derme papillaire en surface et le derme réticulaire en profondeur.
Modifié d’après le site :www.magscope.com
I.4.2 – Les différents types cellulaires constitutifs du derme
I.4.2.1 – Les fibroblastes dermiques
Les fibroblastes dermiques sont des cellules de soutien fusiformes, d’origine mésenchymateuse. Ce sont les cellules les plus abondantes du derme dont elles assurent la cohérence et la souplesse. Leur observation en ME permet de mettre en évidence un réticulum endoplasmique rugueux abondant ainsi qu’un appareil de Golgi développé qui rendent compte de leur forte activité. Les fibroblastes sécrètent des facteurs de croissance et des cytokines ainsi que des constituants biochimiques de la jonction dermo-épidermique, dont le collagène VII. Ils sont également impliqués dans le renouvellement et l’organisation de la MEC. Ils synthétisent les collagènes dermiques, l’élastine ainsi que les glycoprotéines de structure et les protéoglycanes de la MEC. Ils produisent la majorité des enzymes de la famille des métalloprotéases matricielles (Matrix MetalloProteinases ou MMP), qui sont chargées de la dégradation de la
Hypoderme Derme reticulaire Derme papilaire Epiderme
MEC, et dont l’activité est régulée par des inhibiteurs de la famille de TIMP (Tissue Inhibitors
of MetalloProteinases), également synthétisés par les fibroblastes. Les kératinocytes produisent
également des MMP, mais en quantité moins abondante. Ainsi, l’équilibre permanent entre synthèse et dégradation de la MEC est en grande partie géré par les fibroblastes dermiques. Ils sont également impliqués dans la réparation cutanée et le processus de fibrose.
La définition classique et historique des fibroblastes ne permet pas de mettre en évidence qu’il existe plusieurs sous populations de fibroblastes dans le derme, ces fibroblastes ayant des localisations et des fonctions distinctes (Driskell and Watt, 2015). En effet, deux populations principales de fibroblastes ont été décrites : les fibroblastes du derme papillaire et des papilles dermiques qui seraient plus spécialisés dans la morphogenèse du follicule pileux et la coordination des cycles pilaires, alors que les fibroblastes du derme réticulaire seraient plus impliqués dans la synthèse des fibres de la MEC. Cette distinction explique en partie la présence de cicatrice qui survient après la cicatrisation d’une plaie profonde. En effet, lors de la cicatrisation d’une plaie profonde, ce sont les fibroblastes réticulaires qui sont mobilisées et synthétisent ainsi de la MEC à l’origine de l’aspect fibreux d’une cicatrice et de l’absence de poils liées à l’absence de fibroblastes du derme papillaire et des et des papilles dermiques (Driskell et al., 2013).
I.4.2.2 – Les cellules du système immunitaire du derme
Le derme contient des cellules d’origine hématopoïétique impliquées dans le système immunitaire, qui sont les cellules sentinelles du derme : les mastocytes, les dendrocytes, et les macrophages.
Les mastocytes qui représentent la deuxième population cellulaire résidente du derme après les fibroblastes, se localisent préférentiellement autour des vaisseaux sanguins. Ils interviennent notamment dans le déclenchement de réactions allergiques et dans l’inflammation. En effet, les mastocytes reconnaissent les pathogènes présents dans le derme via leurs récepteurs de surface les PRR (Pathogen Recognition Receptor). A leur contact, ils libèrent de l’histamine contenue dans les granules de leur cytoplasme. Celle-ci va agir sur la paroi des vaisseaux sanguins entrainant la vasodilatation, nécessaire à la libération des globules blancs, les granulocytes, qui agissent en renfort des cellules résidentes immunitaires du derme.
Les dendrocytes, également appelées cellules dendritiques dermiques, se localisent dans le derme réticulaire. Ils possèdent des prolongements fins et agissent comme des cellules
présentatrices d’antigènes capables d’apprêter et de présenter des peptides antigéniques via les molécules du CMH de classe II exprimées à leur surface. Les dendrocytes possèdent également à leur surface les récepteurs PRR, qui permettent de reconnaitre les pathogènes. Après la reconnaissance de pathogènes, les dendrocytes libèrent des cytokines pro-inflammatoires capables également de mobiliser des granulocytes sur le site de l’infection.
Les macrophages, quant à eux sont des cellules phagocytaires de pathogènes dans le derme. Les macrophages contiennent des vésicules remplies d’enzymes digestives qui leur permettent de digérer les pathogènes phagocytés. De plus, ils ont une action anti-inflammatoire et contribuent à l'homéostasie cutanée et la réparation des plaies.
I.4.3 – La matrice extracellulaire
La matrice extracellulaire (MEC) comporte des fibres de collagène, des fibres élastiques et des fibres de réticuline, noyées dans de la substance fondamentale amorphe.
I.4.3.1 – Les fibres
Le premier type de fibres majoritaires dans le derme sont les fibres de collagène. Les collagènes sont de loin les protéines les plus abondantes de la peau humaine, constituant 77% de son poids sec (Hussain et al., 2013). Les fibres de collagène les plus abondantes sont celles de collagène I (60 % à 80 %) et de collagène III (15 % à 25 %), qui appartiennent au sous-groupe des collagènes fibrillaires à striation périodique (Prost-Squarcioni, 2006). Ces fibres de collagènes I et III s’auto-assemblent en un réseau tridimensionnel. D’une longueur variable et d’un diamètre de 0,5 à 40 microns, les fibres les plus fines sont localisées dans le derme papillaire, et les plus épaisses dans le derme réticulaire. D’autres types de collagène sont également présents dans le derme papillaire, dont les collagènes V et VI qui s’agencent en microfibrilles de soutien des fibres de collagène de type I et III (Mak et al., 2016).
Les fibres de réticuline sont également disposées au niveau de la jonction dermo-épidermique et des lames basales des vaisseaux, des nerfs et des adipocytes ; elles correspondent à des fibres isolées de collagène III à striation périodique (Prost-Squarcioni, 2006).
Le deuxième type de fibres majoritaires dans le derme sont les fibres élastiques dont la fonction principale est de donner au derme, et donc à la peau, son élasticité. L’élastine représente 4% du poids sec de la peau (Hussain et al., 2013). Il en existe trois sortes : les fibres d’élaunine
(immatures), les fibres oxytalanes (immatures), et les fibres élastiques proprement dites (matures). Les fibres d’élaunine et les fibres élastiques apparaissent comme des plages amorphes formées d’élastine et entourées de fibres oxytalanes, formées exclusivement de microfibrilles de fibrilline. La fibrilline est le principal composant des microfibrilles de la MEC du derme, et est secrété par les fibroblastes. Les fibres d’élaunine forment un plexus orienté parallèlement à la jonction dermo-épidermique et anastomosé avec les fibres oxytalanes. Les fibres oxytalanes forment de fines arborisations perpendiculaires à la jonction dermo-épidermique. Les fibres élastiques matures se situent dans le derme réticulaire, sous forme de faisceaux ondulés, formant un réseau entre les fibres de collagène du derme (Prost-Squarcioni, 2006).
Les propriétés biomécaniques de la peau dépendent de la consistance, du nombre et de l’organisation de ces différentes fibres dans le derme. Ainsi, le réseau complexe de fibres des différents collagènes donne à la peau sa résistance aux forces de traction, tandis que les fibres élastiques lui confèrent son élasticité.
I.4.3.2 – La substance fondamentale
La substance fondamentale est constituée d’un mélange de glycoprotéines, de protéoglycanes, et d’eau dans lequel baignent les fibres et les cellules de la MEC. Les glycoprotéines et les protéoglycanes résultent de la combinaison de protéines avec respectivement des groupements oligosaccharidiques et des glycosaminoglycanes (GAG). Les glycoprotéines et les protéoglycanes forment un gel aqueux qui permet la diffusion efficace des nutriments, des métabolites et des déchets hydrosolubles, ainsi que l’adhésion et la migration des cellules au travers du tissu conjonctif.
I.5 – L’hypoderme
L'hypoderme est la couche la plus profonde de la peau. C’est un tissu conjonctif d’origine mésodermique, richement vascularisé et innervé, situé sous le derme réticulaire, auquel il est rattaché par les fibres de collagène et les fibres élastiques. Son épaisseur varie en fonction des zones du corps et du sexe des individus. Il est essentiellement constitué d'un seul type de cellules, les adipocytes, spécialisés dans l'accumulation et le stockage des graisses.
P
ARTIE
II – L
ES
E
PIDERMOLYSES
B
ULLEUSES
II.1 – Généralités
La jonction dermo-épidermique est le complexe hautement spécialisé qui permet la forte adhésion entre l’épiderme et le derme sous-jacent. Elle confère à la peau et aux muqueuses une importante résistance, maintient leurs architectures structurales, et régule les interactions entre l’épiderme et le derme.
Les mutations dans les gènes codant pour les composants de la jonction dermo-épidermique sont associées à des maladies génétiques cutanées du groupe des épidermolyses bulleuses (EB) (Bruckner-Tuderman and Has, 2014) pour lesquelles on connait à ce jour vingt gènes mutés (Uitto et al., 2018).
Les EB héréditaires constituent un groupe de génodermatoses transmises selon un mode autosomique dominant ou autosomique récessif. Elles sont caractérisées par une extrême fragilité de la peau et des muqueuses, qui conduit, dès la naissance, de façon spontanée ou après un traumatisme minime, à la formation de décollements bulleux responsables de plaies cutanées et muqueuses. A ces décollements peuvent s’associer des complications systémiques (inflammation sévère, dénutrition, anémie), des atteintes de la cornée (symblépharon), des hypoplasies de l'émail dentaire, des alopécies cicatricielles du cuir chevelu, des pseudo-syndactylies, des érosions de l’épithélium trachéal, des sténoses œsophagiennes, une atrésie congénitale du pylore et une dystrophie musculaire tardive (Mellerio et al., 2007, Pulkkinen and Uitto, 1999).
Les EB héréditaires sont classiquement divisées en trois sous-types en fonction du niveau de clivage au sein de la jonction dermo-épidermique (Figure 6). Le diagnostic repose donc à la fois sur la détermination du niveau de clivage sur la base de l’observation phénotypique et sur les analyses immuno-histologiques, ultrastructurales en ME et moléculaires réalisées sur des biopsies cutanées. Les épidermolyses bulleuses simples (EBS) se distinguent par un clivage dans l’épiderme, les épidermolyses bulleuses jonctionnelles (EBJ) par un clivage au niveau de la lumina lucida et les épidermolyses bulleuses dystrophiques (EBD) par un clivage sous la
lamina densa. (Fine et al., 2014). Récemment, un 4ème sous-type d’EB a été mis en évidence : il s’agit du Syndrome de Kindler qui peut présenter un clivage à n’importe quel niveau de la jonction dermo-épidermique (Has et al., 2018).
Par ailleurs, il existe des EB dites acquises (EBA) caractérisées par un clivage sous la lamina
densa d'origine auto-immune. Les EBA sont caractérisés par la présence d’anticorps dirigés
contre le collagène VII des fibres d’ancrage localisées dans la jonction dermo-épidermique. Les EBA classiques ont donc une présentation clinique très proches des EBD (Prost-Squarcioni et al., 2017).
Figure 6 - Classification des EB héréditaires en fonction du niveau de clivage à la jonction dermo-épidermique
La jonction dermo-épidermique présente différentes structures d’attachements telles que les hémidesmosomes, les filaments d’ancrage et les fibres d’ancrage qui assurent un attachement stable entre les kératinocytes basaux et la membrane plasmique, et entre la lamina densa et le derme papillaire. Des mutations des gènes codant pour les différents éléments structuraux de la jonction dermo-épidermique peuvent être à l’origine de niveaux de clivage différents conduisant à l’un des quatre sous-types d’EB indiqués sur ce schéma.
Modifié d’après (Has et al., 2018).
II.2 – Les différentes formes d’épidermolyses bulleuses
héréditaires
II.2.1 – L’épidermolyse bulleuse simple
L’épidermolyse bulleuse simple (EBS) est la forme la moins sévère et la plus fréquente des EB. Les données provenant des registres américains indiquent une prévalence de 6/1 000 000 naissances (Fine, 2016). Cette forme est caractérisée par des décollements bulleux cutanés qui surviennent après des traumatismes légers. L’EBS est principalement autosomique dominante, quelques rares formes autosomiques récessives ayant cependant été décrites (Garcia et al., 2011,
Titeux et al., 2011). Il existe au total douze sous-types d’EBS dont les trois principaux sont la forme EBS généralisée sévère, la forme EBS généralisée intermédiaire, et la forme EBS localisée avec des lésions limitées aux pieds et aux mains (Fine et al., 2014). Ces trois sous-types d’EBS sont causés dans 75% des cas par des mutations dans les gènes KRT5, codant pour la kératine 5, et KRT14, codant pour la kératine 14 (Bolling et al., 2011). Ces mutations conduisent à la formation d’un réseau défectueux de filaments intermédiaires de kératine anormaux dans les kératinocytes basaux qui entraine des clivages au sein de leur cytoplasme (Coulombe et al., 2009).
II.2.2 – L’épidermolyse bulleuse dystrophique
L’épidermolyse bulleuse dystrophique (EBD) est la deuxième forme la plus courante des EB. Les données provenant des registres américains indiquent une prévalence à 2/1 000 000 naissances (Fine, 2016). L’EBD se caractérise dès la naissance par la formation de décollements cutanés et de bulles spontanées ou secondaires à des traumatismes minimes, qui vont évoluer en plaies chroniques et étendues. Toutes les muqueuses (orale, œsophagienne, oculaire, anale) peuvent être également atteintes. Les patients souffrent à la fois de complications systémiques (dénutrition, anémie) et de complications locales (pseudosyndactylies, rétractions articulaires). La survenue de cancers agressifs de la peau (carcinome épidermoïde cutané) sur les plaies chroniques est la première cause de décès (Cho et al., 2018, Fine et al., 2009).
L’EBD est due à une perte de l’adhésion entre l’épiderme et le derme sous-jacent liée à des mutations du gène COL7A1 (Hilal et al., 1993, Hovnanian et al., 1992). Ce gène code le collagène VII qui est secrété localement par les kératinocytes et les fibroblastes dermiques. Il est le composant principal des fibres d’ancrage, qui sont des structures essentielles à l'adhésion dermo-épidermique. La sévérité est très variable en fonction du sous-type.
Les parties II-3 et II-4 détaillent les EBD qui sont l’objet de cette thèse (page 35 à page 44).
II.2.3 – L’épidermolyse bulleuse jonctionnelle
L’épidermolyse bulleuse jonctionnelle (EBJ) est la forme la moins fréquente des EB. Les données provenant des registres américains indiquent une prévalence inférieure à 1/1 000 000 naissances vivantes (Fine, 2016). Cette forme est associée à une mortalité précoce avec plus de
40% des patients qui décèdent avant l’adolescence. Elle est caractérisée par des décollements bulleux de la peau et des muqueuses conduisant à de multiples plaies chroniques et étendues. Des dystrophies et/ou pertes d’ongles ainsi que des problèmes de formation d’émail dentaire peuvent être associés (Bruckner-Tuderman and Has, 2014). Les patients présentent une prédisposition aux cancers cutanés (Fine et al., 2009). L’EBJ est principalement autosomique récessive mais quelques rares formes dominantes ont été rapportées (Almaani et al., 2009). Les mutations impliquent des gènes codant pour des composants des hémidesmosomes tels que le collagène XVII (ou BP180 ou BPAg2 ou antigène mineur de la pemphigoïde bulleuse) et l’intégrine α6β4, mais aussi des points de contact focaux comme la laminine 332 et l’intégrine α3β1. Il existe huit sous-types d’EBJ (Fine et al., 2014), le plus sévère étant l’EBJ généralisée sévère causée par des mutations nulles dans les gènes LAMA3, LAMC2 ou LAMB3 (Fuentes et al., 2017) conduisant à une absence de laminine 332 au niveau de la lumina lucida et à une diminution importante du nombre d’hémidesmosomes observé en ME. En 2015, la greffe de feuillets épithéliaux autologues génétiquement corrigés couvrant 80% de la surface du corps d’un enfant atteint d’EBJ généralisé sévère a permis de restaurer la laminine 332 β3 déficiente (Hirsch et al., 2017).
II.2.4 – Le Syndrome de Kindler
Le syndrome de Kindler est une forme d’EB héréditaire de découverte récente (Has et al., 2018). La prévalence de ce syndrome n’est pas encore connue. Cette forme est causée par des mutations dans le gène FERMT1 codant pour la kindline-1, qui est une protéine composant les points de contact focaux des kératinocytes basaux. Le mode de transmission connu est autosomique récessif. Les niveaux de clivage sont multiples : intra-épidermique, dans la lamina
densa ou sous cette dernière (Fine et al., 2008). Les patients présentent des décollements de
l’épiderme à l’origine de la formation de bulles, associés à une photosensibilité et une poïkilodermie (atrophie de l’épiderme, dyschromie de la peau et dilatation des vaisseaux superficiels du derme). Dans la période néo-natale, le syndrome de Kindler peut mimer les formes sévères d’EBJ et d’EBD, mais avec l’âge, le phénotype s’atténue. Une prédisposition aux cancers cutanés à l’âge adulte existe (Bruckner-Tuderman and Has, 2014).