HAL Id: dumas-01740333
https://dumas.ccsd.cnrs.fr/dumas-01740333
Submitted on 21 Mar 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Abcès du foie en transplantation hépatique
Emmanuel Lafont
To cite this version:
Emmanuel Lafont. Abcès du foie en transplantation hépatique. Médecine humaine et pathologie. 2017. �dumas-01740333�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 82
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Abcès du foie en transplantation hépatique
Présentée et soutenue publiquement
le 7 juin 2017
Par
Emmanuel LAFONT
Né le 10 décembre 1987 à Paris (75)
Dirigée par Mme Le Professeur Agnès Lefort, PU-PH
Jury :
M. Le Professeur Olivier Lortholary, PU-PH ………..……….. Président M. Le Professeur Bruno Fantin, PU-PH
M. Le Docteur David Lebeaux, CCA M. Le Docteur Matthieu Lafaurie, PH
3
Remerciements
A Constance que j’aime depuis 6 ans, merci pour tout le bonheur que tu m’apportes chaque jour. Tu es la plus belle chose qui me soit arrivé. Un gros chips aux futures années qui arrivent !
A Agnès, merci d’avoir accepté de diriger ma thèse, merci pour ta patience, ton humour, et ton entrain, ta bonne humeur permanente.
A monsieur Lortholary, monsieur Fantin, David, Matthieu, merci de me faire l’honneur d’être ici aujourd’hui dans mon jury de thèse. Je suis heureux et fier d’avoir été formé par 5 médecins aussi humains, humbles, compétents et drôles (parce que ça aussi c’est important !) que vous. Vous resterez toujours un exemple pour moi.
A Maman et Papa, qui me portent depuis 30 ans, merci de votre exemple, merci de votre amour, de votre joie de vivre, sans vous je ne serais jamais arrivé jusque là.
A Gab, Lalo, Narda, mes chères molasses de sœurs qui me supportent depuis 30 ans
A Bonne maman, grand père, Grané et Kakou, merci d’aussi bien veiller sur vos petits enfants, puissiez-vous continuer encore à nous guider pendant de longues années
A Edouard Veronique Henri et Marie, merci de votre acceuil dans cette si belle famille. Maintenant je me sens de le dire : « Allez l’OL ! »
A Manach, Garbold, Gouez, et Michaud, dédicace à la plus belle sous-colle de noirs. Que de souvenirs inoubliables avec vous. Un gros Chèvre pour vous .
A Tib et sa calvitie, Dim et son bide, Flo et sa bosse, merci pour votre soutien, votre amitié, et votre compréhension durant ces dures années d’étude de médecine
A Jeannot et Charlot, compère de toujours, vous êtes comme des frères pour moi. Au Jack Bourdin et particulièrement à Ghislain, et à nos trente ans d’amitiés A Aurian, Alex et Clem, mes chers cousins.
A Théo et Chalapon, compagnons de toutes les conneries
A la « fafa », Cam, Cam, Flo, Titou, Brenda, Ali, Jouls, Didi, Nico, Elise, Bruno, Fourmi, Madelon, merci pour votre acceuil à Lyon depuis 6 ans
4
Table des figures
Figure 1 : Activité de recensement et de prélèvement des sujets en état de mort encéphalique Figure 2 : Critères du King’s College Hospital
Figure 3 : Indication des transplantations hépatiques en France en 2014 Figure 4 : Anastomose porto-cave temporaire
Figure 5 : Anastomose cavo-cave selon la technique de « piggy-back » Figure 6 : Le T-tube
Figure 7 : Phases chirurgicales de la transplantation hépatique Figure 8 : Survie du receveur selon la période de greffe
Figure 9 : Complications infectieuses post transplantation d’organe solide Figure 10 : Sténose biliaire anastomotique mise en évidence lors d’une CPRE Figure 11 : Vascularisation artérielle hépatique classique
Figure 12 : Courbe de survie de patients avec TH +/- TAH Figure 13 : Abcès hépatique compliquant une prothèse biliaire Figure 14 : Abcès hépatique compliquant une colite droite Figure 15 : Abcès hépatique par perforation duodénale
Figure 16 : Abcès hépatique compliquant une chimioembolisation hépatique Figure 17 : Mécanismes de formation des abcès hépatiques
5
Table des tableaux
Tableau 1 : Indication de transplantation hépatique
Tableau 2 : Facteurs prédictifs de mortalité à 3 et 12 mois de TH Tableau 3 : Cause de mortalité à 3 et 12 mois post TH
Tableau 4 : Complication post TH selon la période (1984-2001) et (2002-2012) Tableau 5 : Thrombose de l’artère hépatique : facteurs de risque
Tableau 6 : Données microbiologiques d’une cohorte française de 209 AH
Tableau 7 : Proposition de traitement médical des AH selon le type de micro-organismes Tableau 8 : Abcès hépatique et TH (données de la littérature) : Aspects épidémiologiques Tableau 9 : Abcès hépatique et TH (données de la littérature) : Aspects diagnostiques Tableau 10 : Abcès hépatique et TH (données de la littérature) : Transplantation hépatique Tableau 11a : Abcès hépatique et TH (données de la littérature) : Aspects microbiologiques Tableau 11b : Abcès hépatique et TH (données de la littérature) : Aspects microbiologiques Tableau 12 : Abcès hépatique et TH (données de la littérature) : Traitement et devenir Tableau 13 : Caractéristiques générales des 14 patients avec AH et TH
Tableau 14 : Spécificités de la transplantation chez les patients avec AH et TH Tableau 14 : Spécificités de la transplantation chez les patients avec AH et TH Tableau 15 : Caractéristiques microbiologiques des AH-TH primaires et récurrents Tableau 16 : Comparaison, chez les patients AH-TH, survivants et décédés
Tableau 17 : Comparaison des patients avec AH-TH primaires et récidivants Tableau 18 : Comparaison des patients AH-TH avec AH-C
6
Liste des abréviations
ABM : Agence de la Biomédecine AH : abcès hépatique
AMX : amoxicilline
AMC : amoxicilline+clavulanate AHP : artère hépatique propre AGD : artère gastro-duodénale BGN : bacille gram négatif
BLSE : bétalactamase à spectre élargi BMR : bactérie multi-résistante BHR : bactérie hautement résistante B. fragilis : Bacteroïdes fragilis CAZ : ceftazidime
CTX : cefotaxime CEF : ceftriaxone CIP : ciprofloxacine
C. glabrata : Candida glabrata CGP : cocci à Gram positif
CHC : Carcinome hépato-cellulaire CHS : candidose hépato-splénique
CPRE : cholangio-pancréatographie rétrograde endoscopique DPC : duodéno-pancréatectomie céphalique
E. faecium : Enterococcus faecium E. faecalis : Enterococcus faecalis
ERV : Enterococcus résistant à la vancomycine ERT : ertapeneme
H. parainfluenzae : haemophilus parainfluenzae IFI : infection fongique invasive
IMI : imipeneme IV : intra-veineux
K. pneumoniae : Klebsiella pneumoniae LZD : linezolide
MELD : Model for End-Stage Liver Disease MTR : métronidazole
NS : non significatif OFL : ofloxacine
P. vulgaris : Proteus vulgaris
P. aeruginosa : Pseudomonas aeruginosa PKHR : polykystose hépato-rénale
SAH : sténose de l’artère hépatique
SAB : sténose de l’anastomose bilio-biliaire
SASM : Staphylococcus aureus sensible à la méticilline SARM : Staphylococcus aureus résistant à la méticilline SIDA : syndrome d’immunodéficience acquise
7 TAH : Thrombose de l’artère hépatique
TAZ : tazocilline TC : tronc coeliaque
TH : Transplantation hépatique
THDV : Transplantation hépatique issue de donneur vivant THDD : Transplantation hépatique issue de donneur décédés TOS : transplanté d’organe solide
UNOS : United Network for Organ Sharing score VHB, VHC, VHD : Virus de l’hépatite B, C, D VAN : vancomycine
VCI : veine cave inférieure
VIH : virus de l’immunodéficience humaine VP : veine porte
8
Table des matières
REMERCIEMENTS………...3
TABLES DES FIGURES ………..…3
TABLES DES TABLEAUX………..4
LISTE DES ABREVIATIONS………...8
PARTIE 1 : TRANSPLANTATION HEPATIQUE (TH)………..9
CHAPITRE 1:HISTOIRE DE LA TRANSPLANTATION HEPATIQUE ... 9
CHAPITRE 2:DONNEES EPIDEMIOLOGIQUES FRANÇAISES ... 9
CHAPITRE 3:ASPECTS MEDICAUX-CHIRURGICAUX SPECIFIQUES ... 15
CHAPITRE 4:EVOLUTION POST TRANSPLANTATION HEPATIQUE ... 24
PARTIE 2 : ABCES DU FOIE DANS LA POPULATION GENERALE………...90
CHAPITRE 1:EPIDEMIOLOGIE ... 40
CHAPITRE 2:MECANISMES PHYSIOPATHOLOGIQUES ... 41
CHAPITRE 3:DONNEES MICROBIOLOGIQUES ... 46
CHAPITRE 4:DEMARCHE DIAGNOSTIQUE ... 50
CHAPITRE 5:DEMARCHE THERAPEUTIQUE ... 53
PARTIE 3 : ABCES DU FOIE EN TH : REVUE DE LA LITTERATURE ………..………57
CHAPITRE 1:DONNEES EPIDEMIOLOGIQUES ... 57
CHAPITRE 2:ASPECTS DIAGNOSTICS CLINICO-RADIO-BIOLOGIQUES ... 58
CHAPITRE 3:SPECIFICITES DES TRANSPLANTATIONS HEPATIQUES………....108
CHAPITRE 4:ASPECTS MICROBIOLOGIQUES ... 60
CHAPITRE 5:ASPECTS THERAPEUTIQUES ET DEVENIR ... 61
PARTIE 4 : ABCES DU FOIE EN TH : ETUDE RETROSPECTIVE………...…63
CHAPITRE 1:PATIENTS ET METHODES ... 64
CHAPITRE 2:RESULTATS ... 66
CHAPITRE 3:DISCUSSION ... 77
CONCLUSION………...82
9
Introduction
L’abcès hépatique est une pathologie rare mais grave dans la population générale. Schématiquement, il existe deux principaux mécanismes à l’origine de la formation de l’abcès : l’obstacle à l’écoulement biliaire d’origine lithiasique ou néoplasique, et le foyer infectieux à distance responsable d’une bactériémie avec métastase septique hépatique.
La transplantation hépatique connaît un essor ces dernières années avec notamment le perfectionnement des techniques chirurgicales et d’immunosuppression1. De fait, les
indications de greffe s’élargissent actuellement à une population plus âgée avec plus de comorbidités2.
Une des principales causes de morbi-mortalité en transplantation hépatique est la pathologie des voies biliaires dans les suites de la greffe : soit la fistule, soit la sténose anastomotique, soit la cholangite ischémique. Ces trois pathologies se compliquent parfois d’abcès du greffon et sont responsables d’une franche baisse du taux de survie du patient et du greffon 3.
L’abcès du foie du patient transplanté hépatique est une pathologie peu décrite à ce jour.
Après avoir introduit les principales caractéristiques de la transplantation hépatique et expliqué les données épidémiologiques des abcès hépatiques en population générale, nous détaillerons les données publiées à ce jour dans la littérature à propos des abcès du foie chez le patient transplanté hépatique.
Enfin, nous exposerons les résultats d’une étude descriptive rétrospective s’intéressant aux abcès hépatiques survenant chez les patients transplantés du foie de 2009 à 2015 à l’hôpital Beaujon (Clichy).
10
Partie 1 : Transplantation hépatique
Chapitre 1 : Histoire de la transplantation hépatique
La France va se distinguer en 1952 avec la première tentative de greffe de rein à partir de donneur vivant. L’opération, réalisée à l’hôpital Necker par l’équipe du Professeur Jean Hamburger, est un succès, mais 21 jours après sa greffe, le jeune homme décède.
La première transplantation hépatique (TH) a été tentée par Thomas Starzl en 1963 à Denver4.
A l’époque, la survie à 1 an était de 20% environ. Les principales complications étaient l’infection, le rejet, les complications biliaires et hémorragiques. L’amélioration des techniques anesthésiques et chirurgicales, l’arrivée des immunosuppresseurs (ciclosporine dans les années 1980, puis tacrolimus dans les années 1990) et la meilleure compréhension des complications post-transplantation ont permis progressivement d’améliorer la survie des patients, avec actuellement une survie à 1 an d’environ 90%.
La technique du « split » a été inventée à l’hôpital Paul Brousse par Henri Bismuth en 1980 devant la présence au même moment de 2 enfants en insuffisance hépatique aiguë et la disponibilité d'un seul foie entier.
Chapitre 2 : Données épidémiologiques françaises
2.1 La transplantation d’organe solide en France
De plus en plus de personnes vivent avec une greffe (tous les organes confondus), avec, en 2014, en France, 54659 personnes porteuses d’un greffon fonctionnel1.
Le nombre de patients sur liste d’attente (tous les organes confondus) a presque doublé en 10 ans : 6991 en 2006, et 14500 en 20161. En revanche, le nombre de donneur en état de mort encéphalique est stable depuis 2005. Cinquante pour cent des patients en état de mort encéphalique sont prélevés. Les principales causes de non prélèvement sont l’opposition (32,5%), les antécédents du patient (10,3%), les obstacles médicaux (7,5%). Le nombre moyen d’organes prélevés par donneur est de 3,33 en 20151.
11
Figure 1 : Evolution de l'activité de recensement et de prélèvement des sujets en état de mort
encéphalique1
a) La transplantation hépatique en France
Le foie est le deuxième organe le plus greffé en France, après le rein. Le nombre de patients inscrit sur liste d’attente de transplantation hépatique a triplé en 10 ans (486 en 2006, 1265 en 2016), alors que le nombre de transplantations hépatiques réalisées a augmenté de seulement 30% (1037 en 2006, 1355 en 2015). Le nombre estimé de malades porteurs d’un greffon hépatique fonctionnel en France au 31 décembre 2014 est de 12 181.
Beaujon est l’un des trois principaux centres français à réaliser des TH, avec en 2014, 99 greffes de foie réalisées, soit 24% de l’activité de l’activité de transplantation hépatique de l’Assistance Publique des Hôpitaux de Paris (APHP).
b) L’évolution du profil des donneurs et des receveurs
L’efficacité du prélèvement hépatique (nombre de donneurs prélevés d’au moins un foie sur le nombre de donneurs prélevés d’au moins un organe) augmente progressivement sur la dernière décennie. Elle est de 78,6% en 20141. Cet essor est principalement dû au prélèvement
hépatique de donneurs plus âgés. En effet, le progrès des techniques médicales et chirurgicales a permis d’élargir les profils, ainsi, l’âge des donneurs et des receveurs ont augmenté. En 2015, respectivement 46% et 35% des donneurs et des receveurs avaient plus de 60 ans1.
12 En 2015, il existe une progression de 5,8% en 1 an du nombre de greffes hépatiques, grâce à la hausse de 6,9% du taux de prélèvement des donneurs en état de mort encéphalique1.
En 2015, l’Agence de la Biomédecine (ABM) note une baisse du nombre de nouveaux inscrits sur liste d’attente de TH (de 3,6% en 2 ans) avec une chute importante des inscriptions pour cirrhose virale C, et pour cirrhose isolée. En revanche, les inscriptions pour CHC, sont en hausse globale depuis 2 ans (38-39% des inscrits). Il n’existe pas de baisse de la survie post greffe immédiate malgré la tendance engagée depuis 2010 de greffer des malades plus graves, et le recours à des greffons prélevés sur des donneurs plus âgés.
2.2 Attribution des greffons hépatiques en France
a) Indications à la TH
Les indications de greffe hépatique sont listées dans le tableau 1 et la figure 3. La cirrhose est l’indication la plus fréquente de TH. La TH est alors indiquée en cas d’insuffisance hépatique non réversible (Taux de prothrombine inférieur à 50%) associée à une complication grave (encéphalopathie hépatique chronique, ascite réfractaire, hémorragie digestive récidivante, infection du liquide d’ascite)2.
En cas de cirrhose alcoolique, en dehors du CHC, l’indication de la TH reste limitée aux cirrhoses compliquées (classe C de Child-Pugh). Elle n’est pas recommandée en cas de classe B de Child-Pugh. Le sevrage est indispensable et la période pré-greffe doit être utilisée pour forger la motivation à l’arrêt de l’alcool. La durée de 6 mois d’abstinence avant TH ne doit plus être une règle intangible et ne doit pas être considérée comme une condition à elle seule de l’accès à la TH. L’indication « cirrhose alcoolique » qui avait nettement progressé entre 2008 et 2013, possiblement du fait d’un élargissement des indications vers des malades plus graves, a reculé en 2016 de 8,5%.
En cas de cirrhose virale C, la TH est indiquée même chez les sujets qui restent virémiques après antiviraux. Mais, les malades qui ont une charge virale supérieure à 106 copies/ml ont une survie du greffon et une survie propre inférieures comparativement à ceux qui ont une charge virale inférieure à 106 copies/ml. En cas de cirrhose B, si la virémie est égale à 105 copies/ml, la TH est à discuter.
13 Les inscriptions sur liste de TH pour cirrhose virale C ont baissé depuis 2010 et représentent 4,8% des inscriptions en 2015 contre 10% en 20101. Cette baisse est attribuée à l’avènement
des anti-viraux, et à une prise en charge plus précoce de ces patients.
Le carcinome hépato-cellulaire (CHC) est la tumeur primitive du foie la plus fréquente. Etant souvent associé à la présence d’une cirrhose, la TH est un bon traitement de ces deux pathologies. La TH n’est envisageable qu’en présence d’un nodule de moins de 5 cm ou de trois nodules maximum de moins de 3 cm (« critères de Milan »)5. En cas de nodule de petite taille, l’hépatectomie partielle est une alternative. Cependant, le foie reste cirrhotique, et la récidive à 5 ans est de 80% 6. En revanche, les mauvais résultats des TH pour métastases de cancer colorectal, tumeur endocrine pancréatique, cholangiocarcinome, contre-indiquent ces indications.
L’insuffisance hépatique aiguë grave est caractérisée par une diminution progressive des facteurs de coagulation suivie par l’apparition d’une encéphalopathie hépatique puis d’un oedème cérébral associé à une hypertension intracrânienne responsable du décès par anoxie cérébrale et/ou engagement. Les étiologies de défaillance hépatiques aigües, étaient autrefois hépatites virales A, B et C, et sont aujourd’hui les intoxications au paracétamol. L’indication de TH en cas d’intoxication au paracétamol est posée par les critères du King’s College Hospital7 (Figure 2).
Figure 2 : Critères du King’s College Hospital 7
Les principales indications de transplantation hépatique sont résumées dans te tableau 1 et la figure 3. Ces chiffres doivent être interprétés avec précaution car l’indication principale de greffe n’est pas toujours aisée à déterminer selon la présentation terminale de la maladie hépatique (cirrhose, hépatite fulminante, carcinome hépatocellulaire ou encore récidive virale sur le premier greffon), dans un contexte souvent multifactoriel (alcool, infection par le virus de l’hépatite B et/ou C, intoxication médicamenteuse…).
14
Cirrhose Alcool
VHC, VHB, VHD Stéatose non alcoolique Cirrhose auto-immune Maladie de Wilson
Déficit en alpha1 anti trypsine
Hémochromatose
Tumeur maligne Carcinome hépato-cellulaire
Cholangiocarcinome
Métastase hépatique secondaire
Insuffisance hépatique aigüe Médicamenteuse (paracétamol)
Virale (VHA, VHB, VHE, VZV) Maladie de Wilson
Syndrome de Reye
Pathologie métabolique-génétique Polykystose hépato-rénale
Hyperoxalurie primitive Maladie de Rendu-Osler
Pathologie biliaire primitives Atrésie des voies biliaires
Cirrhose biliaire primitive Cholangite sclérosante primitive
Retransplantation Retransplantation en urgence (non fonction
primaire du greffon)
Retransplantation élective (rejet chronique, thrombose de l’artère hépatique)
15 Tumeur hépatique 29% Cirrhose alcoolique 27% Cirrhose virale 9% Retransplantation 9% Pathologie biliaire primitive 8% Autre pathologie 6% Autre Cirrhose 5% Insuffisance hépatique aigüe 4% Pathologie métabolique 3%
Figure 3 : Indication des transplantations hépatiques en France en 20141
b) Utilisation des scores dans le contexte de transplantation hépatique
Le score MELD (Model for End Stage Liver Disease) est un bon marqueur du risque de décès à 3 mois chez les patients cirrhotiques8. Il compte 3 variables (bilirubinémie, INR, créatininémie) pondérées par un coefficient correspondant à son influence propre sur le pronostic. Ce score varie de 6 à 40 points. Les malades dont le score est le plus élevé (supérieur à 35) tirent le bénéfice le plus important de la transplantation, contrairement à ceux ayant un score faible (inférieur à 12), où la TH comporte un risque plus élevé que le traitement médical. Il s’agit donc d’un outil de prédiction du risque de décès en liste d’attente9, 8. L’accès inégal à la transplantation hépatique dans les différentes régions de
France a été la principale justification d’une réforme du système d’attribution des donneurs. Depuis mars 2007, l’allocation des greffons hépatiques se fait via le « score foie »1. Cinq
variables sont prises en compte dans ce nouveau score : l’existence d’un carcinome hépatocellulaire (CHC), une maladie métabolique comme indication de la transplantation, la retransplantation, la durée d’attente et la distance géographique entre le donneur et le
16 receveur. Si 2 malades ont un score foie équivalent, le donneur sera attribué en priorité au receveur qui est le plus proche centre où a lieu le prélèvement d’organes.
c) Attribution des greffons en super urgence
Les malades dont le pronostic vital est engagé à très court terme (hépatite fulminante, transplantation jugée nécessaire dans les 8 jours suivant la transplantation précédente), sont prioritaires à l’échelon national, et sont inscrits sur liste de « super-urgence » (SU). En cas d’afflux massif d’inscriptions sur cette liste, d’absence de proposition de greffon après 48 heures d’inscription sur cette liste chez un patient qui s’aggrave, un greffon peut être proposé à un receveur en incompatibilité de groupe sanguin ABO, soit 26% des patients inscrits sur liste de « super-urgence » en 20141. Le nombre de demandes de SU pour les receveurs adultes et pédiatriques accordées par le collège d’experts baisse depuis 2006. En 2014, le pourcentage de malades dont la demande de SU a été accordée s’élève à 4% des inscrits adultes1. Cette
diminution sensible du recours à la SU pour les receveurs adultes est liée d’une part à une relative stabilité de l’incidence des défaillances hépatiques aigues et d’autre part à une baisse des demandes pour retransplantation précoce après non fonction primaire. Les malades faisant l’objet d’une demande de SU sont plus jeunes que l’ensemble des patients inscrits sur liste d’attente. Pour les malades en grande défaillance hépatique, l’accès à des greffons dans des délais très courts s’est nettement amélioré depuis la mise en place du score foie en mars 2007.
Chapitre 3 : Aspects médico-chirurgicaux spécifiques
3.1 Techniques chirurgicales en transplantation hépatique
a) Les différents types de transplantation hépatique
- La transplantation orthotopique
Il s’agit de la transplantation hépatique la plus souvent réalisée en France10. Cette technique
consiste à transplanter un foie entier provenant d'un donneur en mort encéphalique, après l'ablation du foie natif, en lieu et place du foie malade11.
17 - La transplantation de foie partiel ou « split »
Un foie entier prélevé, s'il est suffisamment volumineux, peut être divisé pour deux receveurs. Dans l'immense majorité des cas, ce « split » est fait pour permettre une transplantation hépatique chez un enfant (foie gauche) et un adulte (foie droit). Exceptionnellement, il est possible de partager un foie pour transplanter 2 adultes de petites tailles12.
-
- La transplantation partielle à donneur vivant
La transplantation hépatique à donneur vivant consiste à prélever une partie du foie chez un membre de la famille pour en réaliser la transplantation chez le patient en attente de greffe hépatique. En Asie, où le don d'organe après le décès est quasi-inexistant pour des raisons religieuses, il s’agit de la méthode majoritaire. En revanche, elle est utilisée dans moins de 5% des transplantations réalisées en Europe. Le principal frein au développement de la transplantation à donneur vivant est lié aux risques de l'hépatectomie qu'impose la réalisation du prélèvement chez le donneur sain13.
Le risque de l'hépatectomie chez le donneur dépend des possibilités de régénération et de compliance du foie. La régénération hépatique permet de retrouver en une semaine une fonction hépatique nécessaire à une vie normale. Elle est dépendante de la compliance du foie, c’est-à-dire sa capacité du foie à absorber à volume sanguin constant un plus fort débit. Ainsi, l'hépatectomie chez le donneur ne doit pas emporter plus de 60% du volume du foie total. Ce volume de foie chez le receveur doit correspondre au minimum à 0.8% du poids corporel afin de permettre, là-aussi, une régénération hépatique14.
- La transplantation hépatique auxiliaire
Les patients atteints d’hépatite fulminante, mais ayant un espoir de guérison de leur foie natif, peuvent bénéficier d’une transplantation hépatique auxiliaire. Un greffon (entier ou partiel) est mis en place tout en conservant tout ou partie du foie natif. L'objectif à terme est de retirer le foie greffé si le foie natif guérit, afin d'arrêter les traitements immunosuppresseurs11.
- La transplantation hépatique "Domino"
Certains patients nécessitent une transplantation hépatique pour une neuropathie amyloïde, maladie neurologique liée au foie, et ne se déclarant qu'après plusieurs décennies. Leur foie, même s'il a été responsable de l'apparition de la maladie neurologique, est tout à fait fonctionnel11.
18 Ainsi, un receveur ayant besoin d’une transplantation hépatique en urgence, peut recevoir le foie issu d’un patient avec neuropathie amyloïde. En effet, si cette maladie apparaît chez le receveur, elle mettra aussi plusieurs années à devenir active, celui-ci pourra alors bénéficier d’une nouvelle transplantation.
b) Type de greffons
- Le prélèvement à cœur battant
En transplantation d’organe solide, la durée d’ischémie chaude est l’intervalle de temps entre l’interruption du flux circulatoire dans l’organe prélevé et le conditionnement de celui-ci par la perfusion du liquide de conservation, et la durée d’ischémie froide est la durée de conservation de l’organe entre son conditionnement par le liquide de conservation et la reperfusion artérielle lors de la transplantation chez le receveur.
Classiquement, les transplantations hépatiques sont faites à partir de foies de donneurs en état de mort encéphalique. Ainsi, les réanimateurs peuvent maintenir une hémodynamique correcte afin de diminuer la durée d’ischémie chaude, et les risques de non fonction primaire du greffon.
Il existe des TH avec greffons entiers, et des TH avec hémi-greffons (split ou donneur vivant). Contrairement aux TH avec greffons entier, les TH avec hémi-greffons sont grevés d’une importante morbi-mortalité, en raison de faibles calibres des vaisseaux/canaux biliaires, de la présence d’une tranche de section hépatique, et d’un petit volume qui conditionne le risque de dysfonction primaire du greffon.
- Le prélèvement à cœur arrêté
Le concept s’oppose au prélèvement à cœur battant chez le patient en état de mort cérébrale. La période obligée d’ischémie chaude cumulée aux effets de l’ischémie froide, augmente le risque de dysfonction primaire du greffon hépatique et de cholangite ischémique15.
Le prélèvement à cœur arrêté représente 4 à 10% des prélèvements dans les centres pratiquant ce type de transplantation16.
Une période maximale d’ischémie chaude de 15 minutes, d’ischémie froide de huit à dix heures, un âge du donneur limité à 40—50 ans, l’élimination des greffons avec une stéatose modérée limiteraient le risque de non fonction primaire du greffon17.
19 Comparés à des patients avec prélèvements cadavériques en mort encéphalique, les patients avec prélèvements à cœur arrêté ont une incidence de non fonction primaire et de retransplantation significativement plus élevée, mais la survie des greffons ne différe plus à trois ans18.
c) Temps chirurgicaux
Les différentes phases de la transplantation hépatique sont indiquées figure 7.
- Prélèvement du greffon
Une fois le greffon prélevé, celui-ci est placé dans un liquide de conservation, afin de diminuer au maximum les lésions liées à l’ischémie. Le greffon est ensuite préparé au bloc opératoire pendant l’exérèse du foie natif du receveur. Cette étape vise à préparer les sites d’anastomose du greffon : veine cave inférieure, veine porte, artère hépatique, voie biliaire.
- Exérèse du foie natif
Durant l’exérèse du foie natif, le chirurgien explore la cavité abdominale à la recherche d’une contre-indication à la poursuite de la TH (carcinose péritonéale…).
- Phase anhépatique
Une fois le foie natif retiré de la cavité abdominale du receveur, débute la phase anhépatique. Le clampage des veines porte et cave du receveur se complique d’une chute du débit cardiaque par baisse de la précharge, d’une anurie, d’un syndrome de reperfusion majeur au déclampage lié à une pullulation microbienne par stagnation veineuse dans le territoire splanchnique. Pour éviter toutes ces complications, le chirurgien réalise, avant l’exérèse du foie natif, une anastomose porto-cave temporaire19 (voir figure 4).
Le greffon est ensuite placé dans la cavité abdominale du receveur. L’ischémie froide est l’intervalle de temps entre l’extraction du greffon de l’abdomen du donneur et l’introduction du greffon dans l’abdomen du receveur. Cet intervalle est d’en moyenne 12 heures et ne doit pas dépasser 20 heures.
20
Figure 4 : Anastomose porto-cave temporaire (Photographie empruntée au Dr Dokmak)
VP : veine porte ; VCI : veine cave inférieure
- Anastomoses veineuses
D’abord les anastomoses veineuses sont réalisées.
L’anastomose portale classiquement réalisée est une anastomose porto-portale termino-terminale. Pour prévenir la sténose et la thrombose portale, il est nécessaire de clamper la veine porte du donneur le moins longtemps possible20.
Concernant l’anastomose cavo-cave, la principale technique utilisée à ce jour est celle du « piggy-back » (voir figure 5). Elle s'effectue le plus souvent sous couvert d'une anastomose porto-cave temporaire. Les veines caves inférieures du donneur et du receveur sont conservées, et une anastomose cavo-cave termino-latérale est réalisée. Elle permet d’éviter une anastomose plus difficile entre veines sus-hépatiques et veine cave inférieure. Le moignon cave inférieur du donneur doit être le plus court possible21.
VP VCI
21
Figure 5 : Anastomose cavo-cave selon la technique de « piggy-back »10
- Anastomose artérielle
Enfin sera réalisée l’anastomose artérielle, classiquement termino-terminale entre les artères hépatiques (AH) du donneur et du receveur. Pour diminuer l’incidence des thromboses de l’artère hépatique (TAH), l’anastomose se fait au niveau des bifurcations artérielles des donneurs et des receveurs (bifurcation entre l’AH propre et l’artère gastro-duodénale, voir figure 11). Même en absence de preuves solides ou d’études randomisées, un traitement antiaggrégant plaquettaire est débuté pendant l’intervention pour réduire le risque de thrombose22.
Il est recommandé de réaliser les anastomoses artérielles selon les techniques de microchirurgie, avec la meilleure congruence possible des anastomoses23. Au mieux, l’anastomose est réalisée sous microscope13, 24.
Suite au déclampage artériel, dans environ un quart des cas, est observé un syndrome de reperfusion. Ce syndrome est lié au relargage de cytokines pro-inflammatoires produites pendant la phase d’ischémie du greffon. Il se manifeste par une hypotension artérielle. Les facteurs de risque de survenu d’un syndrome de reperfusion sont une longue ischémie froide et l’absence d’anastomose porto-cave temporaire25, 26, 27.
- Anastomose biliaire
Finalement sera réalisé l’anastomose bilio-biliaire termino-terminale.
L’anastomose biliaire est le talon d’Achille de la TH, car les complications biliaires sont les principales sources de morbi-mortalité chez ces patients.
donneur
22 Si les voies biliaires du receveur sont normales, l’anastomose bilio-biliaire termino-terminale est préférable, car la préservation du sphincter d’Oddi empêche la contamination des voies biliaires par le tube digestif 28, 29.
En cas de voies biliaires pathologiques chez le receveur (cholangite sclérosante primitive, atrésie des voies biliaires) ou en cas de donneur vivant, les deux types d’anastomoses bilio-digestives utilisées en routine sont l’anastomose cholédocho-jéjunale ou hépatico-jéjunale avec anse en Y (Roux-en-Y).
Par rapport à l’anastomose bilio-biliaire, ces techniques se compliquent de plus de cholangite bactérienne, fongique, de sténose et de fistule biliaire 30, 31.
Afin de prévenir les complications biliaires, la vascularisation artérielle des voies biliaires doit être préservée au maximum. Le T-tube est un drain biliaire interne-externe en forme de T (voir figure 6). Plusieurs études ont montré que la protection de l’anastomose par un T-tube se compliquait plus souvent de complications biliaires et septiques qu’en l’absence de drain. Malgré cela, un T-tube est posé pour la majorité des TH, et pour une durée de 6 à 12 semaines
32, 33, 34.
Figure 6 : Le T-tube35 T-tube
23
Figure 7 : Phases de la transplantation hépatique
3.2 L’immunosuppression en transplantation hépatique
Le foie est un organe moins immunogène que le cœur, le poumon ou le rein, et nécessite donc des schémas immunosupresseurs moins lourds.
Autrefois, l’immunosuppression reposait sur l’association de corticoïdes et d’azathioprine. Ce schéma peu immunosuppresseur nécessitait de très fortes doses de corticoïdes, facteur de risque majeur d’infection.
L’avènement des anticalcineurines (ciclosporine dans les années 1980 et tacrolimus dans les années 1990), a été une avancée majeure dans la greffe de manière générale. Une immunosuppression associant corticoïdes et un anticalcineurine permettait de baisser la dose des corticoïdes, et ainsi de diminuer le risque septique, mais également la fréquence et la sévérité du rejet de greffe.
Le schéma immunosuppresseur utilisé actuellement en TH associe corticoïdes, mycophénolate-mofétil et un anticalcineurine. Les corticoïdes sont habituellement arrêtés au sixième mois post greffe, sauf chez les patients transplantés pour cirrhose auto-immune 36.
24 Ces traitements ont un profil de toxicité voisin, et altère au long terme la qualité du greffon via l’insuffisance rénale chronique, l’hypertension artérielle, le diabète, et l’augmentation globale du risque cardiovasculaire 37, 38.
Pour limiter cette toxicité, il faudrait diminuer l’exposition aux anticalcineurines. L’insuffisance rénale étant le facteur prédictif de mortalité tardive le plus fort après transplantation hépatique, les protocoles d’immunosuppression ont pour objectif de baisser au maximum l’exposition aux anticalcineurines 39.
Les anticorps antirécepteurs de l’interleukine 2 (basiliximab, Daclizumab) permettent de réduire l’incidence du rejet aigu, de réduire rapidement les corticoïdes, et d’introduire les anticalcineurines de façon retardée (utile en cas d’insuffisance rénale). Cette stratégie a récemment montré qu’elle diminuait l’incidence d’insuffisance rénale chronique 40, 41, 42.
Le bélatacept, protéine de fusion CTLA4-Immunogloguline, a une forte affinité pour CD80 et CD86 (récepteurs situés sur le lymphocyte T CD4), et permet d’inhiber fortement l’activation lymphocytaire T 43. Il est utilisé en pratique courante en tranplantation rénale chez les patients avec insuffisance rénale 44. En transplantation hépatique, le belatacept a été évalué, et les résultats ont montré, chez les patients sous belatacept, qu’à 12 mois de la greffe, la mortalité, la proportion de perte de greffon, et de rejet aigu étaient plus élevées. En revanche, les patients traités par belatacept avaient moins d’insuffisance rénale à 12 mois que ceux traités par tacrolimus45. En pratique, il est assez peu utilisé en transplantation hépatique.
Les inhibiteurs de mTOR comme le sirolimus (Rapamune®) ou l’évérolimus (Certican®), sont déjà utilisés en greffe rénale. En greffe hépatique, de nombreux essais ont comparé des schémas d’immunosuppression avec inhibiteur de mTOR et anticalcineurines. Les résultats sont variables selon les études. Finalement une méta-analyse récente conclue à une absence de bénéfice des inhibiteurs de mTOR comparés aux anticalcineurines concernant la mortalité, la perte de greffon, et la fonction rénale 46, 47, 48, 40.
De tous les organes greffés, le foie est le plus tolérogène. En effet dans une étude randomisée récente, 40% des patients avec TH vont développer une tolérance vis-à-vis du greffon. C’est-à-dire qu’ils ne développeront pas de rejet malgré l’arrêt total de l’immunosuppression 49. Cette même équipe a comparé les profils moléculaires de patients avec TH, ayant eu un arrêt de l’immunosuppression sans rejet, d’autres chez lesquels l’interruption avait été suivie d’un rejet et de sujets témoins. Cette approche a permis l’identification de plusieurs signatures génétiques à partir d’un petit nombre de gènes, capables de séparer avec précision les greffés tolérants et non tolérants. Cet état de tolérance serait favorisé par l’émergence de lymphocytes T régulateurs. La confirmation indépendante de la validité de ces marqueurs devrait ouvrir la
25 voie à des études prospectives d’interruption de l’immunosuppression, en ciblant dans un premier temps la population de greffés ayant des effets secondaires significatifs de l’immunosuppression.
Chapitre 4 : Evolution post transplantation hépatique
4.1 Survie post transplantation hépatique
Les progrès en tous points (techniques chirurgicales, anesthésiques, immunosuppressives, suivi) depuis la première transplantation hépatique ont permis une amélioration de la survie des greffons et des greffés à court, moyen et long terme.
Les données de l’Agence de Biomédecine, sur la cohorte de 17451 patients transplantés hépatiques de 1993 à 2014, montrent que les survies à 1 mois, 1 ans, 5 ans, 10 ans sont respectivement de 93,4%, 84,7%, 73,2%, 62,4% 1.
Les facteurs de bon pronostic en cas de TH sont une indication biliaire versus tumorale de la TH, l’âge du receveur (survie à 1 an significativement supérieure pour les receveurs âgés de 18 à 54 ans comparée aux receveurs pédiatriques et aux receveurs âgés), l’âge du donneur et le degré d'urgence. La survie après retransplantation est significativement meilleure s’il s’agit d’une retransplantation à plus de 3 mois après la greffe initiale comparé à une retransplantation dans les 3 mois de la greffe initiale (respectivement 52,2% et 43% de survie patients à 5 ans)1. La survie est dépendante de la période de greffe jusqu’à environ 10 ans de greffe, au-delà, les courbes de survie se superposent (voir figure 8). Par exemple, les patients transplantés hépatiques entre 1990 et 1994 et entre 2011 et 2014 avaient un taux de survie respectifs à 1 an de 78,5% et 86,9%.
26
Figure 8 : Survie du receveur selon la période de greffe1
Quelle que soit l’indication et la période de la greffe hépatique, la courbe de survie est marquée par un infléchissement dans les 3 premiers mois, ce qui correspond à la mortalité post opératoire immédiate. Au-delà de 6 mois, les courbes tendent à s’horizontaliser.
La survie après retransplantation est meilleure s’il s’agit d’une retransplantation tardive (plus de 3 mois après la greffe initiale). La retransplantation précoce (moins de 3 mois après la greffe initiale) a des résultats de survie post greffe plus bas (52,2% et 43% de survie patients à 5 ans) 1.
Une cohorte américaine de 54697 transplantés hépatiques, de 2002 à 2012 a été analysée. Le taux de mortalité à 30 jours était de 2,9%. Les causes de mortalité à 30 jours étaient cardiovasculaires (42,1%), infectieuses (27,9%), et liés à une dysfonction du greffon (12,2%)50.
La cohorte européenne présentée par Burroughs et al. compte 34 664 transplantés hépatiques de 1988 à 2003. Les taux de mortalité à 3 et 12 mois étaient respectivement de 12% et 18%. Dans cette étude, les facteurs associés à la mortalité, semblables à 3 et 12 mois de la greffe, étaient une incompatibilité ABO, la présence d’un greffon réduit ou split, une insuffisance hépatique aigüe comme pathologie initiale, une durée de l’ischémie totale supérieure à 13 heures, les âges du donneur et du receveur supérieurs à 60 ans 3. Ces facteurs sont listés dans le tableau 2.
27
Facteurs associés à la mortalité 3 mois, OR (IC) 12 mois, OR (IC)
Incompatibilité ABO 2,07 (1,47–2,91) 2,47 (1,76–3,48)
Greffon réduit ou split 1,96 (1,61–2,35) 1,57 (1,30–1,89)
TH pour insuffisance hépatique aigüe 1,61 (1,34–1,93) 1,30 (1,09–1,56)
Durée d’ischémie totale > 13h 1,95 (1,68–2,27) 1,67 (1,46–1,92)
Age du donneur > 60 ans 1,16 (0,99–1,36) 1,21 (1,06–1,37)
Age receveur > 5 ans de l’âge du donneur 1,12 (1,10–1,14) 1,14 (1,12–1,16)
Tableau 2 : Facteurs prédictifs de mortalité à 3 et 12 mois de TH3
OR : odd ratio ; IC : intervalle de confiance
En revanche, les facteurs associés à une meilleure survie étaient la TH pour cirrhose avec carcinome hépato-cellulaire, cirrhose d’origine alcoolique, d’origine virale C, d’origine virale B, la cirrhose biliaire primitive, l’âge du donneur inférieur à 40 ans, la TH faite dans un centre réalisant plus de 70 TH par an. La principale cause de mortalité à 3 et 12 mois est la cause infectieuse (un tiers des cas). Les causes de mortalité sont détaillées dans le tableau 3.
Agopian et al. ont analysé rétrospectivement le devenir post TH de 5347 patients, en
comparant les époques pré MELD (1984–2001) et post MELD (2002–2012) 51, et ces données
sont résumées dans le tableau 4. Malgré le fait de réaliser des TH à des patients plus fragiles, la mortalité à 30 jours a diminué respectivement de 9,8% à 5,7%. Au cours du temps la plupart des complications diminuent en fréquence, hormis les infections et les complications biliaires qui augmentent. Le fait de transplanter des patients avec plus de comorbidités, et de faire des transplantations hépatiques issues de donneurs vivants (THDV) pourraient expliquer en parti l’évolution défavorable de ces deux paramètres. Les facteurs de risque de mortalité sur terrain de TH, après analyse multivariée, sont l’âge du donneur et/ou du receveur de plus de 55 ans, une cause néoplasique hépato-biliaire responsable de l’indication de TH, un score de MELD supérieur à 34 le jour de la greffe, une durée d’ischémie totale de plus de 9 heures, une transplantation d’organe solide antérieure.
28
Causes de mortalité à 3 et 12 mois
3 mois post TH (%)
12 mois post TH (%)
Infections 27 26
Défaillance rénale, pulmonaire, hématologique 11 10
Causes cardio-vasculaires 8 7
Complications techniques 8 6
Complications cérébro-vasculaires 7 6
Décès per opératoire 7 5
Non fonction primaire du greffon 6 4
Récidive tumorale 1 8
Récidive de la maladie initiale 1 4
Rejet 3 4
Causes gastro-intestinales 3 3
Causes hépatiques autres 2 2
Causes indéterminées 16 15
Tableau 3 : Cause de mortalité à 3 et 12 mois post TH3
Complications post TH 1984-2001 (%) 2002-2012 (%) p Infections 33 49 < 0,05 Rejet aigü 25 16 < 0,05 Retransplantation 24 10 < 0,05 Complications biliaires 13 21 < 0,05 Mortalité à 30 jours 9,8 5,7 < 0,05
Non fonction primaire du greffon 9 6 < 0,05
Thromboses de l’artère hépatique 3,7 4,2 NS
Thromboses porte 1 1,3 NS
29
4.2 Complications infectieuses post transplantation hépatique
a) Complications infectieuses en fonction du délai post-transplantation
Les complications infectieuses représentent la première cause de morbi-mortalité après TH 3,
52, et sont résumées figure 9. Les facteurs de risque d’infection post TH retenu sont : l’âge du
receveur inférieur à 20 ans, l’atrésie des voies biliaires, l’hypoalbuminémie préopératoire, les complications post-opératoires (complications vasculaires, le recours à l’hémodialyse, un séjour prolongé en soins intensifs) 53. C’est durant le premier mois post greffe que le patient est le plus immunodéprimé. Les éléments favorisant l’immunodépression sont le lourd protocole d’induction de la greffe (avec parfois déplétion lymphocytaire), le statut post-opératoire (au moins 6 heures de chirurgie avec transfusions multiples), et les nombreuses comorbidités des patients en attente de greffe hépatique (dénutrition, alcoolisme, néoplasie). Au cours du premier mois post greffe, les infections les plus fréquentes sont liées aux soins : infection du site opératoire, bactériémie sur infection de cathéter, pneumonie acquise sous ventilation mécanique, colite à Clostridium difficile. Elles sont plus souvent attribuées à des germes multi-résistants : Staphylococcus aureus résistant à la méticilline, entérobactéries BLSE, Enterococcus sp. résistant à la vancomycine. Plus rarement, il s’agit de la période durant laquelle le receveur peut développer des infections transmises par le greffon (infection fongique invasive, tuberculose, primo-infection CMV…). La survenue d’infection opportuniste est rare durant ce premier mois54.
Du premier au sixième mois post TH, en l’absence de prophylaxie, les infections les plus fréquemment observées sont les infections à germes opportunistes (pneumocystose, et plus rarement cryptococcose, nocardiose), les réactivations d’infections latentes (maladie à CMV, récidive d’hépatite B ou C sur le greffon, tuberculose)54.
Au-delà de 6 mois, en l’absence de rejet, le niveau d’immunosuppression diminue. Les prophylaxies sont rarement maintenues au-delà de cette période. Les patients développent le plus souvent des infections communautaires (grippe, infections à pneumocoque) 54.
30
Figure 9 : Complications infectieuses post transplantation d’organe solide54
b) Complications infectieuses en fonction du germe
- Principales infections bactériennes post TH
Les infections bactériennes constituent la première cause de morbi-mortalité chez les patients transplantés hépatiques. La plupart surviennent dans trois premiers mois post greffe.
Les bactériémies représentent 20 à 30% des infections après transplantation hépatique. La plupart des bactériémies sont dues à des bacilles à gram négatif. La mortalité à 30 jours liée aux bactériémies chez les patients greffés du foie est d’environ 30%55. Parmi 704 patients
transplantés du foie à l’hôpital Beaujon, Bert et al. ont observé la survenue de 259 épisodes de bactériémies durant la première année post greffe, soit une incidence de 37%. La plupart de ces infections sont survenues dans les 30 premiers jours post greffe (68%). Les 5 principaux pathogènes retrouvés étaient des entérobactéries (41%), S. aureus (20%) dont 50% étaient résistants à la méticilline, Enterococcus sp. (13%) dont 2,7% étaient résistants à la vancomycine, Pseudomonas aeruginosa (9%), Candida sp. (7%). La mortalité à 15 jours était de 16%. Les mortalités à 1 an de la greffe pour les patients avec et sans bactériemies étaient respectivement de 28% et 17%56. Dans une autre série de 320 patients greffés du foie à
31 l’hôpital Beaujon, 12,5% ont développé une bactériémie à entérobactérie. Les 3 germes les plus fréquents étaient Escherichia coli (42%), Klebsiella pneumoniae (17%), et Enterobacter cloacae (17%). La bactériémie était d’origine intra-abdominale dans 30% des cas. Dans deux tiers des cas, l’infection survenait dans le premier mois post greffe. La mortalité était de 35%. Les facteurs de risque de mortalité étaient un score de MELD >20 le jour de la TH, une TH pour VHB ou VHC, une reprise chirurgicale, une culture biliaire positive, une cirrhose 57. Dans une cohorte de 53 patients avec bactériémie à E. coli faisant suite à une transplantation hépatique réalisée à l’hôpital Beaujon, la mortalité intra-hospitalière était de 20%. Les facteurs de risque de mortalité étaient la survenue de l’infection dans les 30 jours post TH, et une origine de la bactériémie autre que cutanée et urinaire 58
Les patients transplantés hépatiques développent de plus en plus d’infections à bactéries multi-résistantes (BMR) et à bactéries hautement résistantes (BHR).
Bert et al. ont montré qu’au sein d’une cohorte de 710 patients greffé du foie à l’hôpital Beaujon, 4,1% avaient un dépistage rectal positif à BLSE en pré-opératoire, et 5,5% ont eu une infection à BLSE dans les 4 mois suivant la TH. Les facteurs de risque d’infection à BLSE en post TH étaient le portage rectal en pré opératoire, un score de MELD > 25 le jour de la TH, et une reprise chirurgicale 59.
Les mêmes auteurs ont analysé les facteurs de risque de portage rectal BLSE en pré TH. Parmi 317 patients, 16% avaient un dépistage rectal BLSE positif. Les facteurs de risque identifiés étaient une péritonite bactérienne spontanée, et la prise d’une bétalactamines dans le mois pré TH 57, 60.
Dans un centre universitaire new-yorkais, Kalpoe et al. ont observé la survenue de 91 infections bactériennes en 1 an parmi 175 patients greffés hépatiques soit une incidence de 52%. La mortalité à 1 an de la TH était de 18%. Les infections étaient principalement dues à Enterococcus (43%) et à K. pneumoniae (37%). Onze pour cent des infections étaient dues à K. pneumoniae résistante aux carbapénèmes. La médiane de survenue de ces infections à BHR était de 12 jours post TH. Les deux facteurs associés à la mortalité dans cette cohorte étaient un score de MELD > 30 le jour de la TH , et la survenue d’une infection à K. pneumoniae résistante aux carbapénèmes 61.
Bert et al. ont montré qu’un portage nasal positif à S. aureus en pré opératoire de TH, était associé à un risque accru d’infection à ce germe. Ce risque était d’autant plus important que S. aureus était résistant à la méticilline : 87,5% des porteurs de SARM ont développé une infection à SARM en post opératoire, contre 12,5% chez les porteurs de SASM 62.
32 La prévalence d’infection et de colonisation à Enterococcus résistant à la vancomycine (ERV) est plus fréquente aux Etats-Unis qu’en Europe, et est en augmentation, notamment chez les patients immunodéprimés. Une équipe américaine a montré qu’en pré opératoire de TH, 44% de leurs patients étaient colonisés à ERV 63.
L’épidémiologie des infections à ERV a été étudié par Bucheli et al. au sein d’une cohorte suisse de 1234 patients transplantés d’organe solide. Le taux le plus important d’infection à ERV était celui des patients avec TH (0,24 patient/année). Soixante pour cent des ERV étaient des Enterococcus faecium. Les facteurs de risque d’infection à ERV étaient une prophylaxie par bétalactamines, une TH, et un âge de plus de 55 ans 64.
- Principales infections fongiques post TH
Les infections fongiques invasives (IFI) sont relativement fréquentes chez les patients transplantés hépatiques, avec un taux d’infection variant de 8 à 17% dans les récentes études épidémiologiques. La candidose invasive représente 80% des IFI chez les TH 65. Les facteurs de risque d’IFI chez les patients avec TH comprennent la retransplantation, des transfusions massives de culots globulaires, une insuffisance rénale pré et post TH, un score de MELD élevé le jour de la TH 66, 67, 68.
La cohorte TRANSNET rassemble 23 centres de transplantation d’organe solide (TOS) américains. Entre 2001 et 2006, 1208 IFI ont été diagnostiquées chez 1063 patients avec TOS. Les patients avec TH étaient ceux ayant développé le plus d’IFI. Parmi les 378 IFI diagnostiquées chez des patients avec TH, 68% étaient des candidoses invasives, 11% des aspergilloses invasives, 6% de cryptococcoses, 2% de mucormycoses 69, 65.
La mortalité associée aux IFI chez les patients avec TH varie de 25 à 90%. C’est pourquoi la prophylaxie antifongique ciblant Candida et Aspergillus est une démarche rationnelle mis en place chez les patients transplantés hépatiques. Les recommandations américaines privilégient une prophylaxie ciblée sur les populations à risque, en séparant 3 groupes de patients70.
- Les patients sans facteur de risque d’IFI ne recevront pas de prophylaxie antifongique systématique.
- Les patients colonisés à Candida dans les 3 mois précédents la transplantation, ou ayant eu une chirurgie de TH compliquée (c’est-à-dire plus de 11h de chirurgie, ou plus de 40 culots globulaires transfusés), ou une anastomose bilio-digestive recevront en post opératoire une prophylaxie contre Candida. Le fluconazole sera privilégié pendant la durée de séjour en réanimation dans les suites de la TH.
33 - Les patients retransplantés, ou avec une insuffisance rénale post TH nécessitant une dialyse ou une transplantation rénale, ou les patients bénéficiant d’une reprise chirurgicale dans le mois suivant la TH recevront une prophylaxie contre Candida et Aspergillus. Le voriconazole sera privilégié pendant les 30 jours suivant la TH.
Ces données sont issues de l’IDSA (Infectious Disease Society of America) et de l’AST (American Society of Transplantation) 70,71, 72, 73.
Un travail récent a montré la non-infériorité de la micafungine comparé aux shémas standards (fluconazole, amphotéricine B liposomal, caspofungine) en prophylaxie post TH chez les patients à haut risque d’IFI 74.
c) Complications infectieuses en fonction de l’organe atteint
La bactériémie est la première cause d’infection chez le patient transplanté hépatique. Dans une série de 259 bactériémies post TH, les principaux foyers infectieux étaient intra-abdominaux (28%), les infections de cathéter (15%), urinaires (13%), pulmonaires (9%), biliaires (8%), et cutané (3%). Les bactériémies du premier mois provenaient principalement d’infections de cathéter (15%), de pneumopathies (20%) et d’infections intra-abdominales (35%). En revanche, au-delà de 3 mois post TH, la principale source de bactériémie était biliaire (30% )56.
La pneumonie associée aux soins est une autre cause majeure d’infection bactérienne post TH. Weiss et al. ont observé, parmi 148 patients transplantés du foie, la survenue d’une pneumonie nosocomiale précoce (dans la première semaine post TH) chez 15,5% des patients. Soixante pour cent de ces pneumopathies étaient dues à des bacilles gram négatif. Comparée aux patients non infectés, la mortalité entre les 2 groupes était comparable 75.
L’infection de liquide de transport de greffon est plus rare mais potentiellement très grave. Janny et al. ont analysé les dossiers de 477 patients TH, et ont observé 45 cultures de liquide de transport positives (9.5%), dont 8 (18%) responsables d’un sepsis. Les germes responsables étaient des entérobactéries, Candida, E. faecium. Une culture positive de liquide de greffon sans infection associée n’était pas responsable d’une plus grande mortalité, en revanche, en cas de sepsis associé, la mortalité était de 50% (contre 8%) 76.
34
4.3 Complications mécaniques post transplantation hépatique
a) Complications biliaires
La complication biliaire est la première cause de morbi-mortalité chez les patients avec TH. Son incidence globale varie de 10% à 40%. Elle est plus fréquente chez les patients avec TH issue de donneur vivant (THDV) que chez les patients avec TH issue de donneur décédé (THDD). Dans une méta-analyse récente, respectivement 17% et 28% des patients avec THDD et THDV développaient des complications biliaires en post TH. Gomez et al. ont analysé rétrospectivement des dossiers de 30 patients avec THDV et 357 patients avec THDD ayant eu une CPRE. Respectivement 33% et 9,5% ont présenté des anomalies biliaires à la CPRE (p < 0,05) 77.
Les deux complications majeures biliaires sont la fistule et la sténose. Les autres complications biliaires plus rares chez un patient avec TH sont l’hémobilie, la lithiase biliaire, la dysfonction du sphincter d’Oddi.
La fistule survient dans la majorité des cas dans les 3 mois post opératoire, au site d’insertion du T-Tube (voir figure 6).
La sténose biliaire est une complication plus tardive dans les suites de la TH. Elle est localisée au niveau de l’anastomose biliaire dans 80% des cas 78. Les sténoses biliaires non
anastomotiques sont évocatrices de cholangite ischémique. Le type d’anastomose (latéro-latérale ou termino-terminale) ne constitue pas un facteur de risque de sténose 79,80, 78. Le risque de sténose biliaire augmente avec le temps chez le patient TH. En effet Verdonk et al. ont montré qu’à 1, 5, et 10 ans de la TH, le risque cumulé de développer une sténose biliaire anastomotique était de 6.6%, 10.6%, et 12.3% respectivement. Les facteurs de risque de développer une sténose biliaire anastomotique dans les suites de la TH étaient, en analyse multivariée, la fistule biliaire, et la combinaison « donneuse – receveur ».
35
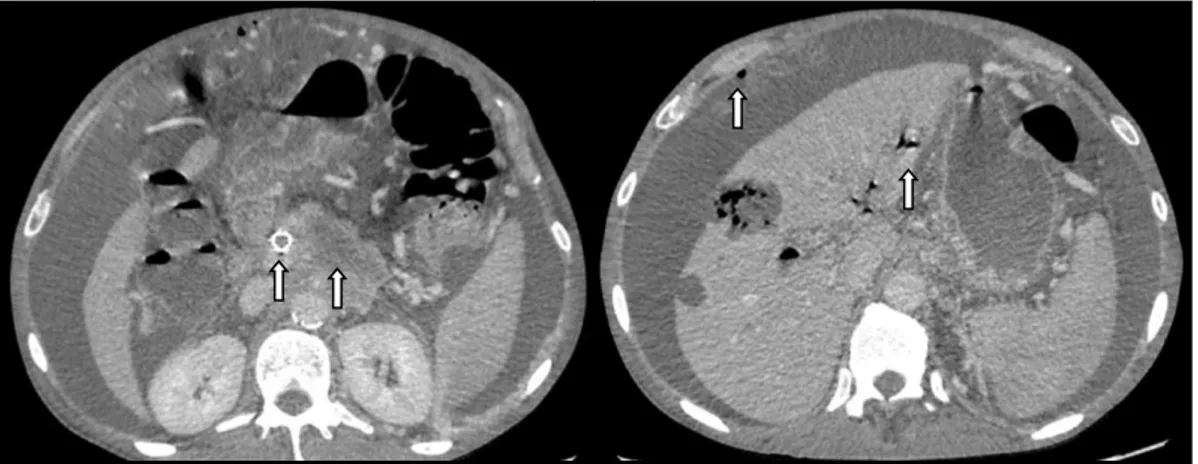
Figure 10 : Sténose biliaire anastomotique mise en évidence lors d’une CPRE (photographie
empruntée au Dr Ronot)
Les facteurs de risque connus de complications biliaires dans les suite de TH sont l’âge avancé du donneur, les greffons provenant de donneur décédé à cœur arrêté, la maladie à CMV, la stéatose du greffon, une durée d’ischémie totale du greffon >13 heures, une thrombose de l’artère hépatique, l’utilisation d’un T-Tube 81.
Chez les patients avec THDD, les complications biliaires tardives (au-delà de 3 mois post TH) sont en rapport dans 85% des cas avec une thrombose de l’artère hépatique 82.
Zimmerman et al. ont montré, chez 530 patients transplantés hépatiques (1/3 issus de donneurs décédés, et 2/3 issus de donneurs vivants), que 40% des patients avec THDV et 25%
des patients avec THDD ont développé des complications biliaires83. Pour mieux comprendre
pourquoi les THDV développent presque le double de complications biliaires, les auteurs soulignent qu’en cas de THDV, la technique de split est utilisée. Ainsi, les durées opératoires, le nombre d’anastomoses biliaires, et le pourcentage de patients avec anastomose bilio-digestive sont plus élevés qu’en cas de TH orthotopique standard.
En revanche, le risque de perte du greffon, et de décès post complication biliaire était deux fois plus élevé chez les THDD que chez les THDV 83, 84.
Le traitement des complications biliaires (fistule ou sténose) est avant tout endoscopique. En cas d’échec, le traitement est l’anastomose bilio-digestive 85, 86.
Dans la série de sténose biliaire anastomotique de Verdonk et al. , deux tiers des patients étaient traités avec succès par un traitement endoscopique seul, et le tiers des patients restants a bénéficié d’un traitement chirurgical complémentaire78.
36 Gomez et al. ont analysé les données de 387 patients avec TH. En comparant les patients avec THDV et THDD, le traitement endoscopique était efficace respectivement dans 40% et 100% des cas de sténose biliaire (p < 0,05), et dans 75% et 83% des cas de fistule biliaire (NS) 77.
En revanche, ni sténose, ni fistule biliaire n’affectent la survie des patients et des greffons hépatiques.
b) Complications vasculaires
- Complications artérielles
L’artère hépatique propre naît de la bifurcation du tronc cœliaque (TC), après la naissance de l’artère gastroduodénale (AGD), et se divise au hile en une branche pour le foie droit et une branche pour le foie gauche (figure 11).
Figure 11 : Vascularisation artérielle hépatique classique (image empruntée au Dr Dokmak)
AHP : artère hépatique propre ; AGD : artère gastro-duodénale ; TC : tronc coeliaque .
La sténose de l’artère hépatique (SAH) est la complication vasculaire la plus fréquente dans
les suites de la TH. Elle peut se compliquer de thrombose de l’artère hépatique (TAH), de complication biliaire et de perte de greffon. Son incidence après TH varie de 2% à 15% 87. Les facteurs de risques identifiés de SAH sont les différences de calibre vasculaire entre donneur et receveur (en particulier la combinaison « donneur adulte - receveur enfant »), le rejet, les lésions d’ischémie froide, l’utilisation prolongée de clamps vasculaires 87.
Kim est al. ont montré qu’un débit artériel hépatique faible (< 400 ml/min) était associé à une plus grande incidence de sténose biliaire chez les patients avec THDD 88.
L’équipe de chirurgie hépato-biliaire de l’hôpital Beaujon a analysé les dossiers des 941 patient transplantés hépatique de 1998 à 2010. Quarante-huit patients ont développé une SAH
TC
AGD AHP
37 (5%) avec une médiane de survenue post greffe de 2 mois. Trente-sept (77%) ont bénéficié d’un traitement par radiologie interventionnelle (pose de stent sur l’artère hépatique). Trois patients (8%) ont eu des complications sévères (hématome, dissection artérielle). Vingt-cinq pour cent ont récidivé la SAH après angioplastie. Après cinq ans de suivi, les taux survies globaux des patients et des greffons ayant développé une SAH étaient respectivement de 88% et 82% 89.
La thrombose de l’artère hépatique (TAH) est la deuxième complication vasculaire la plus
fréquente post TH.La TAH survient dans 1,6% à 17% des cas de TH adulte, et se complique
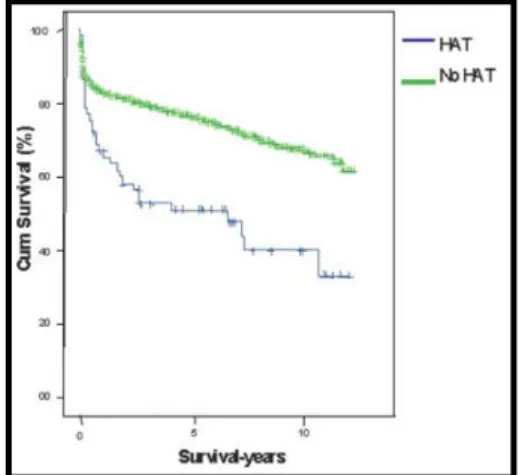
de 13% à 58% de mortalité selon les séries 90, 91, 92, 93, 94. Une courbe de survie des patients avec transplantation hépatique et TAH est illustrée dans la figure 12. Les facteurs de risques de TAH sont résumés dans le tableau 5. Il existe schématiquement deux types de TAH : les TAH précoces et tardives.
La TAH précoce (survenant dans les 30 jours suivants la TH) est le plus souvent due à un problème technique au niveau de l’artère hépatique ou de son anastomose. Les facteurs de risque de TAH précoces identifiés dans la littérature sont une dissection de la paroi de l’artère hépatique, une sténose du tronc cœliaque ou de l’artère hépatique, la présence d’un ligament arqué, une anomalie anatomique artérielle nécessitant une reconstruction complexe, un greffon aortique, un split cadavérique, un donneur vivant, un ratio poids du receveur/ poids du donneur > 1,25, une anastomose artérielle chez un patient ayant déjà eu une greffe hépatique précédente, un rejet au cours de la première semaine post greffe.
Dans ce type de TAH, la révision chirurgicale est envisageable. Le facteur de risque le plus important est la présence d’une anomalie anatomique de l’artère hépatique nécessitant une anastomose complexe de type « bench arterial reconstruction » 95.
Une équipe espagnole a observé, parmi 325 patients avec TH, des variations anatomiques de l’artère hépatique dans 32% des cas de TH, dont un tiers chez le donneur, et deux tiers chez le receveur. Les anomalies les plus fréquemment observées, chez le donneur et le receveur, étaient une artère hépatique droite provenant de l’artère mésentérique, et une artère hépatique gauche provenant de l’artère gastrique gauche. En présence d’une de ces anomalies, les patients augmentaient leur risque de développer une TAH 96, 97.
La TAH tardive (survenant à plus de 30 jours post TH) est souvent en lien avec des des problèmes non techniques : maladie à CMV, transfusion massive, syndrome sévère d’ischémie reperfusion, rejet. En cas de TAH tardives, les complications biliaires sont