HAL Id: hal-02787236
https://hal.inrae.fr/hal-02787236
Submitted on 5 Jun 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Identification des déterminants environnementaux de la
distribution spatiale des bactéries glaçogènes et impacts
sur les risques de dommages gélifs des plantes
Marie Fontenelle
To cite this version:
Marie Fontenelle. Identification des déterminants environnementaux de la distribution spatiale des bactéries glaçogènes et impacts sur les risques de dommages gélifs des plantes. [Stage] France. Institut Universitaire de Technologie de Lyon (IUT Lyon), FRA. 2019, 26 p. �hal-02787236�
FONTENELLE Marie
2ème année de DUT Génie Biologique Option Industries Alimentaires et Biologiques
IUT Lyon 1 Département Génie Biologique 71 Rue Peter Fink
01000 Bourg-en-Bresse
Période du lundi 8 avril 2019 au vendredi 21 juin 2019
Sujet :
Identification des déterminants environnementaux de la distribution
spatiale des bactéries glaçogènes et impacts sur les risques de
dommages gélifs des plantes
Tuteurs de stage :
Pierre AMATO Guillaume CHARRIER
Campus Universitaire des Cézeaux INRA Site de Crouël 24, Avenue Blaise Pascal 5 chemin de Beaulieu 63178 AUBIERE 63000 Clermont-Ferrand
Remerciement
Tout d’abord j’adresse mes remerciements aux membres de l’équipe du PIAF de l’INRA de Clermont-Ferrand mais aussi aux membres de l’équipe de l’ICCF d’Aubière, pour m’avoir permis de réaliser ce stage dans un cadre d’entraide et de bienveillance
Je remercie également mes maîtres de stage Guillaume CHARRIER et Pierre AMATO pour leur accueil chaleureux, leur aide durant les manipulations mais aussi durant la rédaction du rapport de stage. Je les remercie aussi pour les conseils qu’ils m’ont apportés et le temps qu’ils m’ont consacré.
Merci à Ludovic MARTIN pour son aide sur les statistiques et sa bonne humeur.
Résumé
Les arbres, organismes sessiles, subissent de manière permanente les variations de leur environnement immédiat, ce qui peut parfois entrainer des dommages. Ainsi, les dommages générés par le gel figurent parmi, les premières causes de perte économique en agriculture. Afin de prédire le risque de dommage gélifs sur les organes sensibles (tels que les bourgeons), il faut évaluer trois facteurs :
- L’aléa, qui correspond à la température du milieu environnant,
- La vulnérabilité de l’organe, qui correspond à la température de résistance physiologique au gel,
- L’exposition de l’organe, qui correspond à la température de l’organe et la transition entre eau liquide et solide.
A la fin de l’hiver, les tissus végétaux se gorgent d’eau, ils sont par conséquent plus sensibles. Ils sont également plus susceptibles de faire entrer de la glace dans leurs cellules, ce qui leur créé de lourds dommages. Certaines bactéries, les bactéries dites glaçogènes sont capable de créer des noyaux glaçogènes à des températures proches de -2°C, par conséquent la plante qui est déjà fragilisée, peut geler et donc être endommagées à des températures plus hautes qu’en période de gel.
Le but de ce sujet, est par conséquent de chercher les facteurs qui influences la dispersion des bactéries glaçogènes. Les différents facteurs testés sont des facteurs environnementaux biotiques comme l’espèce, la variété ou la phénologie des bourgeons, ou encore des facteurs liés à l’environnement abiotique comme l’altitude. Pour cela, différents paramètre sont analysés comme la quantité de noyaux glaçogènes ou l’activité des noyaux glaçogènes à l’aide d’une machine appelée LED-based Ice Nucleation Detection Apparatus (LINDA). Cette machine calcul la quantité de noyaux glaçogènes en utilisant la diffraction de la lumière dû à de la glace.
Cette étude est réalisée dans le but de prédire la dispersion des bactéries glaçogènes afin de pouvoir mieux contrer ce phénomène. Il est très difficile de séparer les facteurs pour en étudier qu’un seul à la fois. Nous avons remarqué que l’espèce mais aussi le changement de milieu avait un impact sur les bactéries glaçogènes. De plus, plus la quantité de noyaux glaçogènes est élevée plus l’activité de ces noyaux est forte.
Par la suite, il faudra refaire des manipulations en faisant plus attention à certains
paramètres comme le paramètre date (le temps écoulé entre les prélèvements), cependant cette étude donne des axes à plus approfondir
Table des matières
INTRODUCTION ... 1
STRUCTURE D’ACCUEIL ... 1
OBJECTIFS ET CONTEXTE DU STAGE ... 2
SYNTHESE BIBLIOGRAPHIQUE ... 4
IMPACT DU GEL SUR LES PLANTES ... 4
VULNERABILITE DES VEGETAUX FACE AU GEL ... 4
INFORMATIONS GENERALES SUR LES BACTERIES GLAÇOGENES ... 5
LES BACTERIES GLAÇOGENES SUR LES PLANTES ... 5
LUTTE CONTRE LES BACTERIES GLAÇOGENES ... 6
DES DEFAUTS MAIS AUSSI DES QUALITES ... 6
MATERIELS ET METHODES ... 8
SITES EXPERIMENTAUX ... 8
MATERIEL VEGETAL ET PRELEVEMENT ... 8
METHODE DE LA FUITE DES ELECTROLYTES (LT50) ... 10
PREPARATION DU MATERIEL DE MICROBIOLOGIE ... 12
CYTOMETRIE EN FLUX (CMF) ET CULTURE BACTERIENNE ... 12
LED-BASED ICE NUCLEATION DETECTION APPARATUS (LINDA) ... 13
ANALYSES STATISTIQUES ... 15
RESULTATS ET INTERPRETATIONS ... 17
ANALYSE MULTIVARIEE ... 17
VARIABILITES LIEES A L’ENVIRONNEMENT BIOTIQUE ... 19
Comparaison entre espèces ... 19
Comparaison entre variétés ... 19
Comparaison entre stades phénologiques ... 21
VARIABILITES LIEES A L’ENVIRONNEMENT ABIOTIQUE ... 21
Comparaison entre altitudes ... 21
COMPARAISON ENTRE CONTEXTE OUVERT/FERME ... 22
CONCLUSION ET DISCUSSION ... 24
1
Introduction
Structure d’accueil
Ma période de stage s’est déroulée du 8 avril 2019 au 21 juin 2019 à CLERMONT-FERRAND, au sein des deux instituts de recherche suivants : l’Institut National de la Recherche Agronomique (I.N.R.A.) et l’Institut de Chimie de Clermont-Ferrand (I.C.C.F.).
L’I.N.R.A. est le premier institut national de la recherche agronomique en Europe. Il a été créé en 1946 et est actuellement dirigé par Philippe MAUGUIN. Son objectif est d’effectuer
des recherches pour promouvoir une alimentation saine, une agriculture durable et un environnement préservé et valorisé. Il existe dix-sept centres de recherche en France au sein desquels travaillent des chercheurs, des ingénieurs, des cadres, des techniciens, des stagiaires et du personnel administratif.
Durant mon stage j’ai travaillé dans l’Unité Mixte de Recherche (U.M.R.) de Physique et Physiologie Intégratives de l’Arbre en environnement Fluctuant (P.I.A.F) situé à
CLERMONT-FERRAND. L’U.M.R. P.I.A.F. a été fondé en 1990. C’est une unité mixte car elle combine deux entités administratives, l’I.N.R.A. et l’Université Clermont Auvergne (U.C.A). Il est situé sur deux sites : à Crouël et le deuxième à l’Université Clermont Auvergne (campus des Cézeaux). J’ai travaillé sur les deux sites. Le P.I.A.F. regroupe des chercheurs provenant de différentes disciplines telles que des agronomes, des bio-climatologues, des physiologistes, des biochimistes, des physiciens … Leur objet d’étude est l’arbre en général, notamment les arbres forestiers, fruitiers, urbains… Ces chercheurs associent leurs
connaissances en physique et en biologie pour améliorer les connaissances en science végétale. Leurs recherches se focalisent sur l’effet des différents facteurs physiques de l’environnement (température, sécheresse, vent) sur le fonctionnement des arbres et des plantes en général.
Le P.I.A.F. est constitué de quatre équipes : l’équipe d’éco-génomique fonctionnelle du transport de l'eau dans la feuille en régime hydrique fluctuant (F.O.L.E.A.U.), l’équipe de sûreté hydraulique et résistance à la sécheresse des arbres (S.U.R.E.A.U.), l’équipe de BioMÉCAnique intégrative de l'arbre (M.E.C.A.) et l’équipe du Micro Environnement et Arbres (M.E.A.), dont je fais partie. L’équipe M.E.A. est dirigée par Marc SAUDREAU. Cette équipe étudie les interactions entre le fonctionnement de l’arbre et l’environnement (thermique, minéral ou lumineux).
L’I.C.C.F. est dirigé par Fabrice LEROUX. Il est composé de 120 permanents. Cet institut travaille sur différents axes : chimie et matériaux, chimie pour le vivant et chimie et environnement. Au sein du premier axe, les scientifiques étudient l’élaboration de matériaux innovants en examinant leur performance et leur durabilité. Le deuxième axe cible la conception et l’étude du potentiel biologique de molécules du niveau enzymatique et cellulaire jusqu’à l’organisme entier (animal humain). Le dernier axe, au sein duquel j’ai contribué, consiste à observer le devenir des polluants chimiques dans des compartiments divers tels que l’eau, la végétation, les nuages ou le sol. Cela inclus aussi des recherches sur des procédés de production et des traitements éco-compatibles. L’I.C.C.F. est composé de 6 équipes : l’équipe de Chimie Organique et Médicinale (C.O.M.), l’équipe de Matériaux Inorganiques (M.I.), l’équipe de Matériaux pour la Santé (M.P.S.), l’équipe de Photochimie, l’équipe de Thermodynamique des Interactions moléculaires (T.I.M.), et l’équipe de
2
BIOcatalyse et METAbolisme (B.IO.M.E.T.A.), dont j’ai fait partie, dirigée par Thierry GEFFLAUT.
L’équipe BIOMETA étudie la chimie au niveau environnemental. Elle étudie et utilise les enzymes en s’appuyant sur certains outils tels que la microbiologie ou la chimie analytique.
Objectifs et contexte du stage
Ce stage est une étude expérimentale financée par la Fédération des Recherches en Environnement (F.R.E.) de l’U.C.A.. Ce projet exploratoire mêle les disciplines d’écophysiologie végétale et de microbiologie.
Les arbres, organismes sessiles, subissent de manière permanente les variations de leur environnement immédiat, ce qui peut parfois entrainer des dommages. Ainsi, les dommages générés par le gel figurent parmi, les premières causes de perte économique en agriculture (Synder 2005) et délimitent également la distribution des espèces en hautes altitude ou latitude. Afin de prédire le risque de dommage gélifs sur les organes sensibles (tels que les bourgeons), il faut évaluer trois facteurs :
- L’aléa, qui correspond à la température du milieu environnant,
- La vulnérabilité de l’organe, qui correspond à la température de résistance physiologique au gel,
- L’exposition de l’organe, qui correspond à la température de l’organe et la transition entre eau liquide et solide.
Ainsi, les végétaux sont capables de résister à des gelées très intenses en plein hiver (e.g. -20°C) alors que des gelées printanières (e.g. -5°C) peuvent être extrêmement dommageables. Une des variables physiologiques critiques est l’état d’hydratation des tissus végétaux. Les tissus gorgés d’eau vont en effet être plus susceptibles de former de la glace les rendant plus vulnérables. Néanmoins, même si la température diminue et atteint des valeurs négatives, l’eau peut rester dans un état liquide : un état physique méta-stable dit de surfusion. Cet état se maintient jusqu’à ce que les molécules d’eau s’agrègent de manière ordonnée autour d’un noyau de nucléation. Cette rupture de l’état de surfusion initie la formation et la propagation de la glace, engendrant une cascade de désordres pour les tissus végétaux.
Certaines bactéries, appelées bactéries glaçogènes, peuvent permettre la formation de glace à des températures relativement chaudes (c’est-à-dire à partir de -2°C). Ces bactéries glaçogènes peuvent se retrouver dans l’eau libre et aussi sur la végétation, contribuant ainsi à l’exposition des arbres au gel. Ces bactéries sont présentes en quantité variable selon les espèces : très répandues sur les espèces herbacées ou les arbres fruitiers et absentes sur les conifères.
Jusqu’à présent, les études sur les dommages gélifs ne se sont focalisées que sur une seule des composantes du risque (aléa, vulnérabilité ou exposition) mais aucune étude n’a cherché à les mesurer en parallèle. Au cours de mon stage, j’ai donc cherché à caractériser la distribution spatiale des bactéries glaçogènes en relation avec différents facteurs relatifs au milieu (biotique : végétal support, stade de développement et abiotique : climatique). J’ai porté mon attention sur l’effet de l’environnement thermique de l’arbre sur ces bactéries. Nous avons émis l’hypothèse que différents facteurs pouvaient influencer la quantité, la dispersion ou l’activité des bactéries glaçogènes. Des facteurs environnementaux biotiques comme l’espèce, la variété ou la phénologie des bourgeons, ou encore lié à l’environnement abiotique comme l’altitude. Un autre facteur fait intervenir les deux environnements biotique et abiotique ; le contexte local (fermé : avec des arbres autour, sans contact direct avec le soleil, ou ouvert : sans arbres autour, exposé au soleil). Enfin nous cherchions à mettre ces résultats en
3
perspective avec un autre composant du risque gélif : la vulnérabilité. Pour répondre à ces questions nous avons étudié un des organes fragiles de l’arbre, le bourgeon, et nous avons essayé d’étudier chacun des facteurs séparément.
Pour réaliser cette étude il a fallu allier différentes disciplines : biologie végétale, écophysiologie des arbres et microbiologie en déterminant le nombre de bactéries glaçogènes sur des bourgeons d’arbres en différents contextes. Nous savions que les méthodes d’analyses microbiologiques et végétales fonctionnaient indépendamment, mais n’avaient jamais été entreprises sur les mêmes échantillons. De plus nous avons travaillé sur des bourgeons clos (dormant) et en cours de débourrement car c’est au cours de cette transition que ces organes sont les plus vulnérables.
Afin de répondre à ces questionnements, j’ai dans un premier temps réalisé une analyse bibliographique. Dans un deuxième temps, j’ai réalisé des expériences en allant prélever des bourgeons sur le terrain et en mesurant la présence de noyaux glaçogènes et de la phyllosphère microbienne (partie des plantes située au-dessus du niveau du sol, sert d’habitat pour les micro-organismes). Enfin j’ai analysé les résultats obtenus et les ai replacés dans le contexte de l’étude.
4
Synthèse bibliographique
Impact du gel sur les plantes
Les plantes sont ancrées dans leur milieu, elles ne peuvent pas se déplacer par conséquent, elles ont dû développer des stratégies pour survivre aux aléas de la nature, comme le gel par exemple. Le gel est un stress d’origine abiotique infligé à la plante. Il se caractérise par l’effet du froid, qui va diminuer la vitesse des réactions enzymatiques et affecter les composants internes de la plante. Les basses températures affectent la fluidité de la membrane plasmique, qui deviennent plus rigides et visqueuses ce qui limite les échanges membranaires entre cellules (Lyons, 1973, Lee 1975). De plus, cela ralentit la photosynthèse. Lorsque la température descend en deçà de 0°C, l’eau contenue dans la plante et la sève brute (permettant d’apporter les éléments nutritifs nécessaires pour la croissance de la plante) peuvent geler. L’eau gelée occupe un plus grand volume et donc, une congélation intra cellulaire fait éclater les cellules. Le gel est également capable de créer des blessures indirectes aux plantes en déshydratant fortement les cellules. Cependant ces blessures ne mènent pas toujours à la mort cellulaire.
Vulnérabilité des végétaux face au gel
Afin de se protéger du gel, les plantes ont trouvé de nombreuses techniques pour minimiser les dégâts. Par exemple, les arbres caducifoliés perdent leurs feuilles pour ne pas exposer ces organes au gel (stratégie d’évitement). En état dormant, leur besoin en eau diminue. Puisqu’il y a moins d’eau, cela limite le risque de gels dans l’eau des cellules (stratégie de tolérance). Les plantes utilisent ainsi diverses stratégies pour tolérer le froid. Ces stratégies peuvent être transitoires afin de diminuer la vulnérabilité au gel lors de période de fort aléa (on parle d’acclimatation au gel).
L’acclimatation au gel des végétaux dépend de nombreux facteurs. Notamment, il existe une plasticité phénotypique des végétaux (Sultan. 2000). C’est-à-dire qu’au sein d’une même espèce ou d’une même variété (même patrimoine génétique), suivant ses conditions de croissance et son environnement thermique (haute altitude ou basse altitude ou dans un milieu plus ouvert ou fermé), la plante ne s’acclimate pas de la même manière. Pour cela, les végétaux ajustent leur métabolisme et ils s’acclimatent aux basses températures pour survivre. Finalement il existe de nombreux mécanismes qui pilotent la vulnérabilité au gel. Après l’hiver, lorsque les températures remontent, il y a un afflux de sève vers les bourgeons et permettre l’élongation cellulaire par augmentation de la pression de turgescence des cellules des bourgeons. Ces bourgeons vont alors gonfler, perdre leurs écailles et s’ouvrir. Il s’agit du stade le plus vulnérable dans la vie de l’arbre. Cependant, il ne s’agit pas de l’unique facteur contrôlant les risques de gel car il est tout d’abord nécessaire que l’eau cristallise.
L’eau pure peut rester en surfusion jusqu’à une température de -38.5°C. La surfusion est un état liquide métastable où l’eau reste liquide au lieu d’être solide à de basses températures. Cependant, dans la nature l’eau n’est pas pure, elle est en contact avec de nombreuses particules dont des noyaux de cristallisations (appelés aussi les noyaux glaçogènes). Ces noyaux provoquent la rupture de surfusion de l’eau en initiant la formation du premier cristal de glace. Ces noyaux peuvent être des poussières ou des particules minérales (e.g. silice) mais ces particules ne sont actives qu’à partir de -10°C. Néanmoins, l’eau peut geler à des températures plus élevées (approchant les -2°C). Les noyaux impliqués à ces températures proviennent du monde biologique tels que des débris cellulaires de plantes ou des bactéries glaçogènes. Ces bactéries sont en effet d’excellents initiateurs de prise en glace à partir de -2°C (Gurian-Sherman & Lindow, 1993 ; Wolber, 1993) ce qui constituent les noyaux de cristallisation les plus efficaces observés dans la nature (hormis la glace elle-même).
5
Informations générales sur les bactéries glaçogènes
Les bactéries glaçogènes appartiennent à différents genres de Gammaproteobactéries :
Pseudomonas, Erwinia ou encore Xanthomonas. L’espèce la plus connue s’appelle Pseudomonas syringae découverte dans les années 1970. Elles se développent isolées ou en
amas. Nous retrouvons ces bactéries sur les plantes, dans l’atmosphère ou encore dans l’eau. Ces bactéries sont épiphytes c’est-à-dire qu’elles se développent à la surface des plantes. Elles sont aussi phytopathogènes classifiées dans la catégorie des bio-agresseurs (Hirano & Upper, 1990). Ce sont des organismes vivants qui peuvent infecter les végétaux et les endommager. Elles attaquent les plantes cultivées et peuvent ainsi causer des pertes économiques. Cependant elles ne sont pas pathogènes pour l’Homme.
Sur gélose nutritive, les colonies de bactéries du genre Pseudomonas sont rondes, blanches, lisses et convexes avec des reflets bleus, (Prévot ,1961). Les Pseudomonas syringae sont aérobies strictes, c’est-à-dire qu’elles ont besoin d’oxygène pour survivre. Elles sont souvent cultivées sur le milieu KingB (King et al., 1954) car, dans ce milieu, elles produisent un pigment hydrosoluble jaune-vert (la pyoverdine), fluorescent sous UV. Les capacités de ces bactéries à se développer dépendent des combinaisons du climat, du sol, des espèces hôtes mais aussi des méthodes culturales.
Les bactéries glaçogènes possèdent un chromosome bactérien appelé “ice”. Ce chromosome code pour des protéines de la membrane externe de la paroi de la bactérie. Ces protéines se lient aux molécules d’eau selon un agencement similaire à la structure de la glace (Lindow et al., 1978 ; 1982). Ces bactéries peuvent être placées dans différents groupes suivant le niveau de leur pouvoir glaçogène. Dans le premier groupe, les bactéries glaçogènes sont actives entre -2°C et -4°C ; dans le deuxième groupe, elles sont actives entre -5°C et -7°C enfin dans le troisième groupe, elles sont actives entre -8°C et -10°C.
Ces bactéries participent au cycle de l’eau (Morris, 2014). Elles sont présentes dans les nuages où l’on suppose qu’elles jouent le rôle de noyau sur lequel les molécules d’eau vont s’agréger sous forme de glace, favorisant ainsi la précipitation d’eau. Les bactéries sont donc piégées dans les cristaux, par conséquent elles tombent avec les précipitations (neiges ou pluie) sur les végétaux, les sols et s’infiltrent dans les nappes phréatiques.
Les bactéries glaçogènes sur les plantes
Sur les plantes, les bactéries glaçogènes constituent des biofilms au niveau des limbes (partie étalée de la feuille, au bout, des nervures ou des stomates. Epiphytes, elles peuvent coloniser la surface des organes aériens des plantes. Elles peuvent se déposer puis se multiplier sur la plante. D’après Bradbury (1986) retrouve le genre Pseudomonas syringae sur près de 400 espèces végétales. La répartition de ces bactéries n’est ni homogène sur les feuilles, ni homogène sur les organes de la plante. En effet, les gouttes de pluies contenant des bactéries vont se déposer sur les feuilles aléatoirement. On retrouve ces micro-organismes sur la plupart des arbres fruitiers. Les conifères, eux, ne portent pas ces bactéries.
Certaines souches de bactéries glaçogènes possèdent un pouvoir pathogène. Cela dépend de divers facteurs tels que la quantité et la qualité de l'inoculum mais aussi le niveau de sensibilité de la plante. Les bactéries peuvent pénétrer dans les tissus végétaux de diverses manières par des voies naturelles (stomates, trichromes cassés, ...) mais aussi par des lésions ou des blessures (qui peuvent être dues à la pluie, aux gelés, aux insectes, …). On peut donc
6
noter l’intérêt de provoquer des lésions par l’intermédiaire de la formation de glace sur des tissus vulnérables.
Les tissus contaminés vont être altérés par ces bactéries et vont brunir très rapidement car elles peuvent contenir un agent nécrogène provocant la destruction des tissus parenchymateux. Les dégâts peuvent être observés sur les fleurs (Monsvelt et Hattingh 1987b ; 1989), les fruits (Luisetti, 1978) mais aussi les feuilles. Les tissus nécrosés peuvent pourrir et tomber de ces végétaux. Par conséquent, la plante peut dépérir partiellement ou entièrement. Les plantes ne meurent pas toujours, elles peuvent aussi avoir une diminution de la croissance et une diminution des qualités dans les récoltes. Ces bactéries s’installent pendant la formation des bourgeons. Elles restent dans les bourgeons durant l’hiver, ce qui peut entraîner la nécrose mais aussi l’absence de développement de certains bourgeons.
Lorsque les bactéries glaçogènes interviennent dans la formation de glace, la cristallisation commence à la surface du végétal et colonise l’intérieur des tissus par les stomates ou/et les blessures. Une surface humectée est donc favorable à l’initiation de la cristallisation. Et la rupture de la surfusion se fait à une température plus élevée que sur feuille sèche. Le dégât dû au gel est plus intense quand le nombre de bactéries augmente. Des cycles gel / dégel vont intensifier ces dégâts car il y a un afflux d’eau dans les espaces intracellulaires ce qui favorise la pénétration et le développement de l’infection. L’intensité de l’infection est ainsi déterminée par le stade phénologique de la plante.
Certains facteurs abiotiques (physico-chimiques) peuvent aussi influencer la quantité de bactéries. Par exemple, les bactéries vont se développer plus facilement avec un sol acide. Une forte humidité et une température élevée jouent un rôle sur la multiplication des bactéries. D’après Henis et Bashon (1986), les rayons UV et la dessiccation (l’élimination de l’eau) éliminent probablement les bactéries. Cependant ces bactéries survivent car en période chaude et sèche, elles peuvent migrer dans les chambres sous-stomatiques.
Lutte contre les bactéries glaçogènes
Il existe des moyens pour lutter contre ces bactéries. Nous pouvons utiliser une lutte préventive, telle que la lutte chimique, avec du sel de cuivre pour abaisser la population bactérienne en-dessous d’un seuil de nuisibilité. Cependant il faut que les bactéries soient accessibles, il ne faut pas qu’elles se cachent à l’intérieur de la plante. Une alternative est l’utilisation d’antibiotiques. Cependant il y a un problème de sélection des bactéries et un risque de transfert de plasmides de résistance de bactéries à bactéries par simple conjugaison. Enfin nous pouvons utiliser la lutte biologique, pour cela nous pouvons utiliser une bactérie antagoniste (qui fait appelle à une force opposée aux bactéries glaçogènes) ou une levure antagoniste qui permet de réduire l’intensité des dégâts liés au gel.
Au final nous pouvons utiliser un antibactérien pour réduire le nombre de la population bactérienne, cela pourrait compléter les moyens classiques utilisés pour la lutte antigel. L’inconvénient de cette méthode, c’est qu’elle ne fonctionne pas sur toutes les plantes, il faut donc la tester pour chaque plante. Toutes ces méthodes ne sont pas encore abouties car nous ne connaissons pas encore assez les bactéries glaçogènes.
7
Même si les bactéries glaçogènes ne sont pas pathogènes pour l’Homme, elles peuvent être dangereuses pour les végétaux. Elles augmentent la sensibilité des plantes au température de gel. Des cristaux de glace se forment autour de la bactérie, il y a donc des lésions fatales pour les cellules végétales et cela permet à d’autres bactéries phytopathogènes d’entrer et d’infecter la plante. Cela peut conduire à la mort du végétal. De plus, quand des insectes mangent des feuilles infectées, ils peuvent eux aussi mourir.
Nous pouvons les utiliser dans divers domaines. Le pouvoir glaçogène a déjà été utilisé dans des essais pour le déclenchement ou la formation de la pluie, mais aussi pour congeler des produits alimentaires et fabriquer de la neige artificielle. Nous n’avons pas encore assez de recul pour pouvoir nous servir des bactéries glaçogènes dans la vie quotidienne. Cependant, elles pourraient donc être par exemple utiles en agroalimentaire. Pour l’agriculture, elles permettraient la bio précipitation car ces bactéries ont un rôle dans la précipitation de l’eau. Par conséquent, nous pourrions essayer, grâce à ces bactéries, de faire tomber de la pluie sur certaines parcelles de terre sélectionnées.
8
Matériels et méthodes
Sites expérimentaux
Les prélèvements ont été effectué dans deux sites : Crouël (45.77N, 3.15 à une altitude de 337 m) et Theix (45.71N, 3.03 à une altitude de 826 m). Sur une dizaine d’année, la température à Theix, en moyenne, s’élève à 9.74°C et à Crouël elle s’élève à 12.19°C
Matériel végétal et prélèvement
Les prélèvements ont eu lieu entre le 17 avril et le 27 mai. Le tableau suivant détaille les conditions caractéristiques des différents prélèvements.
Espèce et variété Morphologi e Lieu Nombre de répétition s Date de prélèvement s Stade phénologiqu e Conditions environnemental es Noyer Serr Arbre Crouë l 3 17/04 et 18/04 Bourgeons en cours de débourreme nt Verger Noyer Franquett e Arbre Crouë l 4 18/04 Bourgeons dormants Verger 3 07/05 3 14/05 Bourgeons en cours de débourreme nt Theix 3 13/05 Bourgeons dormants 3 20/05 Bourgeons en cours de débourreme nt 3 23/05 Noyer Franquett e Jeune Arbre Crouë l 3 21/05 Bourgeons en cours de débourreme nt Sous couvert fermé 3 En champs ouvert 3 27/05 Sous couvert fermé 3 En champs ouvert
Noisetier Arbuste Theix 3 23/04 Bourgeons
en cours de débourreme nt Haies Eglantier Arbuste 2 23/04 Prunellier Arbuste 2 23/04 Erable Arbre 2 23/04 Aulne Arbuste 3 29/04
9
Afin de comparer la variabilité des plantes, des espèces, des variétés et enfin un stade phénologique différent, ont été comparé. Pour les espèces ; l’aulne, le noisetier, le prunellier, l’églantier, l’érable et le noyer ont été comparés alors que leurs bourgeons étaient tous en cours de débourrement et ces arbres étaient présents sur le site de Theix. De plus, des bourgeons débourrés de deux variétés de noyer, du Serr et de la Franquette présents à Crouël ont été analysés. Afin d’observer l’impact de la phénologie des bourgeons, l’échantillon analysé fut de la Franquette présente à Crouël. Pour analyser les facteurs environnementaux ; l’altitude fut représentée par la Franquette étudiée à Theix et à Crouël, avec des bourgeons débourrés mais aussi clos. Enfin la Franquette présente à Crouël cependant, cette fois-ci, en pot et non dans un verger, a servi à observer les influences d’un milieu ouvert et fermé.
Tous mes prélèvements ont été réalisés en conditions stériles afin de ne pas contaminer les échantillons. Ce sont les bourgeons terminaux des arbres qui ont été prélevés car les bourgeons sont les organes de l’arbre les plus fragiles pendant cette période de débourrement. Deux protocoles ont été envisagés, le premier étant de couper des branches et de les faire tomber sur un sac déplié (Fig. 1), pour ensuite prélever les bourgeons stérilement. Mais l’extérieur des sacs n’étant pas stérile, il risquait de contaminer les échantillons.
L’alternative consistait à couper le bout de branche portant le
bourgeon, sans que le bourgeon ne touche ni le sol, ni un autre élément pouvant le contaminer. Néanmoins pour cette méthode il fallait uniquement des bourgeons proches de notre hauteur pour ne pas utiliser d’échelle. La méthode alternative a été sélectionnée pour prévenir des contaminations des échantillons. Pour prélever les bourgeons sur les arbres, nous étions deux personnes. Il fallait porter des gants stérilisés. Mon collègue se chargeait de tenir un sac stérile sous le bourgeon à prélever, tout en tenant les branches sans toucher les échantillons afin d’éviter une contamination. Pendant ce temps, j’ai utilisé un outil (soit une paire de ciseau, soit un scalpel) et une pince à épiler pour prélever les bourgeons. La pince à épiler m’a servi à tenir le bourgeon pour limiter le risque de chute du bourgeon, puis j’ai utilisé les ciseaux ou le scalpel afin de couper la base du bourgeon. Une fois le bourgeon coupé, il tombait dans le sac. Si un échantillon était souillé il n’était pas conservé. De plus, si les outils utilisés touchaient les branches, ils pouvaient augmenter le nombre de microorganismes sur l’échantillon. C’est pourquoi, à chaque prélèvement, j’utilisais une lame stérile. Nous ne changions pas de gants au cours d’un prélèvement d’échantillon car les gants n’étaient pas en contact avec les bourgeons ou les branches. A la fin de l’échantillonnage, le sac était fermé et le placé dans une chambre froide à 4°C pendant quelques heures à deux jours maximums pour minimiser le développement bactérien. A la fin du prélèvement, le matériel était emballé dans du papier aluminium puis placé dans un autoclave (appareil permettant de détruire les microorganismes, 3 min à 134°C et 1bar afin qu’il soit stérilisé. Au cours d’un des échantillonnages,
un morceau de branche est tombé dans le sac de prélèvement. Il a été immédiatement retiré, cependant les analyses ont été réalisées sur cet échantillon pour valider la pertinence du protocole de prélèvement. D’après le graphique ci-dessous, la branche qui portait
Figure 1 Sac déplié pour les prélèvements
Figure 2 Quantité des noyaux glaçogènes rapportée à la masse fraîche de la Franquette
10
elle aussi une quantité spécifique de bactéries glaçogènes n’a pas contaminé les bourgeons puisque l’échantillon du bourgeon contaminé contient en moyenne moins de noyaux glaçogènes que les autres échantillons (la quantité de noyaux glaçogènes en moyenne est de 196.94 IN.g-1 et pour la Franquette contaminée elle est de 70.98 IN.g-1 Fig. 2).
Par conséquent, un accident de prélèvement comme celui-ci, si la branche est retirée
directement du sac, n’a pas d’impact sur les résultats. De plus cela signifierait que la stratégie d’échantillonnage est efficace car….
Plusieurs bourgeons d’un même arbre étaient regroupés et constituaient un échantillon. Il fallait donc en prélever une quantité suffisante afin de quantifier les noyaux glaçogènes sur une quantité suffisante de matériel végétal. J’ai donc prélevé un nombre plus important de bourgeons dormants (Fig. 3) que de bourgeons en court de débourrement afin d’avoir une biomasse comparable. Les bourgeons débourrés (Fig. 4) possédaient une surface plus importante par conséquent un outil plus imprécis que le scalpel suffisait pour prélever ceux-ci. En revanche, l’utilisation des scalpels pour les bourgeons clos était nécessaire afin de ne pas les écraser avec les ciseaux.
Une fois les échantillons prélevés, ils étaient pesés, ce qui donne la masse fraiche de l’échantillon. Puis les échantillons étaient placés dans une étuve réglée à 60°C afin de les déshydrater afin de mesurer la masse sèche.
A partir des masses fraiches et sèches, nous avons calculé l’humidité pondérale selon la formule suivante : 𝑚𝑎𝑠𝑠𝑒 𝑓𝑟𝑎𝑖𝑐ℎ𝑒−𝑚𝑎𝑠𝑠𝑒 𝑠è𝑐ℎ𝑒
𝑚𝑎𝑠𝑠𝑒 𝑠è𝑐ℎ𝑒 .
Méthode de la fuite des électrolytes (LT50)
Lorsque le tissu végétal est endommagé par le gel, les membranes de ses cellules sont rompues et vont donc libérer leur cytosol, contenant notamment des électrolytes (ion en solution). Par conséquent pour évaluer les dommages du gel, une méthode consiste en la mesure de la conductivité électrique (en µS.cm-1) de tissus immergés.
Pour réaliser cette mesure, les échantillons de branches et/ou de bourgeons d’arbre sont découpés en morceaux. Ces morceaux sont ensuite placés dans six enceintes de conditionnement différentes appelées des Freezebox afin de les exposer à différentes températures : 5, -5, 10, - 15, -20, et -80°C. Les échantillons subiront donc une diminution de température de 5°C par heure pour atteindre la température visée. Une fois que la température a été atteinte, elle est maintenue pendant une heure. Une remontée jusqu’à 5°C est effectuée à la même vitesse en attendant que les échantillons soient récupérés pour la mesure des électrolytes. Ensuite, ces échantillons sont découpés en deux dans le sens longitudinal avec une lame de rasoir. Ils sont par la suite placés dans des tubes qui contiennent 15mL l’eau ultra-pure pour laisser diffuser les électrolytes des cellules endommagées. Les tubes sont ensuite placés sur une table oscillante pour être agités en permanence dans l’eau avec un
Figure 3 Photographie d'un bourgeons clos
11
allé/retour par seconde, pendant 24h, dans une chambre froide à 5°C, pour permettre la diffusion des électrolytes dans la solution tout en évitant le développement bactérien. Les tubes sont placés au froid car cela fige l’état physiologique des échantillons, en évitant les métabolisations, pour que la plante ne continue pas à se dégrader.
Après 24h, les tubes sont placés à température ambiante afin de permettre un ajustement plus rapide de la valeur donnée par le conductimètre. La conductivité électrique (C1) de la solution contenue dans les tubes est mesurée dans un premier temps. Dans un deuxième temps, les tubes sont placés dans l’autoclave pendant 25 min à une température de 120°C et une pression de 1 bar. La mesure de la seconde conductivité (C2) des tubes est effectuée. Cette étape nous permet de normaliser la conductivité C1 par la quantité totale de cellules puisque l’autoclavage a détruit toutes les cellules.
Afin d’obtenir le pourcentage de dégâts liés uniquement au gel d’un tube on calcule l’indice de mortalité (REL ; Flint et al, 1967 ; Pearce, 1980 ; Zhang et Willison, 1967) ainsi :
𝑅𝐸𝐿 =𝐶1
𝐶2∗ 100 FER = Fuite des Electrolytes Relative
C1 = conductivité des cellules endommagées par le gel C2 = conductivité maximale des cellules endommagées
Plus l’échantillon a été endommagé, plus la concentration en ions est importante et donc sa conductivité élevée. La conductivité mesurée sur l’échantillon traité à +5°C sert de référence car l’échantillon n’étant pas endommagé par le gel, cela nous indique le pourcentage de cellules endommagées par le prétraitement (coupe des rondelles). De la même manière, la conductivité mesurée sur l’échantillon traité à -80°C sert de référence de dommages
maximum car l’étape d’autoclave libère une quantité plus importante d’électrolytes contenus dans les parois par exemple. Les données d’indice de mortalité en fonction de la température sont ajustées selon une fonction sigmoïde grâce à la méthode des moindres carrés (Fig. 5).
𝑅𝐸𝐿 = 𝑎
1 + 𝑒(𝑏∗(𝑇−𝑐))+ 𝑑
Avec a étendue ((donnée par différence entre REL à +-80 et REL à 5°C) b = pente au point d’inflexion
c = LT50 température à 50% de lyse des cellules. d = asymptote basse (donnée par REL à +5°C)
La LT50 est un indice de résistance au gel correspondant à la température générant 50% de lyse des cellules.
Figure 5 ajustement des températures générant 50% de lyse des cellules d'un échantillon de bourgeons de Franquette
12
Cette manipulation nécessite trois jours de travail. Etant donné que je me suis concentrée sur l’analyse des noyaux glaçogènes, je n’ai pas pu réaliser l’ensemble du protocole par conséquent nous nous sommes réparti le travail au sein de l’équipe qui travaillait sur la résistance des arbres au gel.
Préparation du matériel de microbiologie
Pour les manipulations réalisées, j’ai préparé mon propre matériel. Dans un premier temps, il a fallu préparer du NaCl à 0.8% (m/v), en diluant du NaCl en poudre dans de l’eau distillée. Ensuite il fallait aussi préparer du milieu King B pour réaliser des boîtes de pétri. Ce milieu ne permet que le développement des bactéries du genre Pseudomonas. Pour 50 boîtes, il fallait environ 1.5L de milieu. Pour le préparer, 2.25g de K2HPO4, 2.25g de MgSO4, 22.5g de
proteose de peptone et15mL de glycérol ont été mélangé. Ensuite, 1.35L d’eau distillée a été ajouté puis ce mélange a été agité à l’aide d’un agitateur et d’un barreau aimanté. Il fallait ensuite peser 16g d’agar-agar et verser dans cinq bouteilles. L’agar ne se mélange pas directement avec toutes les substances citées ci -dessus, car il est très difficile à homogénéiser avec le reste. Par conséquent, il aurait été difficile de le répartir dans les cinq bouteilles. Par la suite le mélange des substances est réparti dans les bouteilles, puis ces bouteilles sont placées dans le micro-onde afin de faire fondre et d’homogénéiser l’agar avec le reste des produits. Il fallait aussi préparer une bouteille de 2.25g d’H3BO3 dans 150mL d’eau distillée à côté car on
ne mélange pas ce produit aux autres puisqu’il peut favoriser une précipitation dans le mélange. Etant donné que ces éléments ne se préparent pas sous un Poste de Sécurité Microbiologique (P.S.M.), les bouteilles sont placées dans l’autoclave pour être stérilisées. Une fois ces éléments stérilisés, d’H3BO3 est réparti dans les bouteilles sous le P.S.M. Une
fois de plus, sous le P.S.M., il faut ajouter de la cycloheximide avec une seringue et un filtre car comme le produit ne passe pas dans l’autoclave, le filtre fixé sur la seringue est nécessaire pour empêcher les contaminations du milieu. Une fois le milieu prêt, il suffisait de le verser dans des boîtes de pétri, de laisser sécher les boîtes de pétri (pour obtenir la gélose qui provient d’un milieu liquide), puis de ranger les boîtes.
Cytométrie en flux (CMF) et culture bactérienne
Pour la culture bactérienne j’ai réalisé des triplicats pour les boîtes (Fig. 6), c’est-à-dire que, pour un échantillon, j’ai ensemencé trois boîtes avec les
mêmes dilutions. Il fallait aller jusqu’à 10-5, c’est-à-dire que
l’échantillon a été dilué cinq fois. Pour ensemencer les boîtes il fallait aller sous le P.S.M., et tracer sur le fond de la boîte quatre cadrans, puis avec une micropipette et des cônes il fallait déposer 25 µL de la dilution 102 à 105. Ensuite, les
inoculums ont été étalés à l’aide d’oeses (fil en plastique,
stérile, contenant une boucle à la fin permettant d’ensemencer des géloses). Les boîtes ont été incubées à température ambiante (la température du laboratoire) pendant une semaine.
Durant les manipulations, il a fallu adapter les dilutions car
avec une dilution de 105 les bactéries ne se développaient pas car c’était trop dilué. Finalement il a suffi de s’arrêter quand la solution originale était diluée 4 fois).
Figure 6 Photographie d'une boîte ensemencée à partir d'un échantillon de Franquette
13
La CMF est une méthode qui permet d’étudier de nombreux paramètres sur la cellule comme sa morphologie par exemple (sa taille ou sa forme). Cette technique permet une caractérisation individuelle, quantitative et qualitative des cellules. Les cellules circulent dans un fluide qui contient du SYBR-green. Le SYBR-green qui est un marqueur d’ADN va se fixer sur l’ADN, il marque les cellules mortes et vivantes. C’est un fluorochrome, un indicateur fluorescent, qui va absorber l’énergie du laser et qui va l’émettre à une longueur d’onde plus élevée, ce qui va nous permettre de dénombrer le nombre de bactéries. Les cellules se déplacent à grande vitesse devant un faisceau de laser une à une ce qui permet de mieux les distinguer. La cellule émet alors des signaux optiques qui sont analysés
Une fois mes échantillons prélevés et placés dans 25mL de NaCl à 0.8%, cette solution a été prélevée et placée dans un tube Eppendorf. Par la suite, il fallait ajouter glutaraldehyde à 1% dans ces tubes. Le glutaraldehyde est utilisé comme fixateur car il ne change pas la forme des cellules et permet de minimiser les pertes de cellules. Enfin SYBR-green été inséré dans les tubes. Trois tubes par échantillon ont été réalisés pour obtenir une répétabilité correcte. Les analyses ont donné le nombre de bactéries dans l’échantillon (et non celui des champignons car, les cellules des champignons sont plus grandes.) (Fig. 7)
LED-based Ice Nucleation Detection Apparatus (LINDA)
LINDA est un appareil permettant de nous donner le nombre de noyaux glaçogènes par millilitre d’échantillon en fonction de différentes températures. En effet, des tubes contenant les échantillons sont placés sur une plaque avec des sondes de température. Cette plaque est placée sur un dispositif diffusant des lumières rouges (qui proviennent des diodes électroluminescentes (LED)) dans un bain-marie, ce qui lui permet de faire diminuer la température des tubes (Fig. 8). Quand les tubes diminuent en température, la solution gèle, ce qui modifie la réfraction de la lumière au sein des tubes. Par conséquent, cela bloque d’un coup les lumières infrarouges car la glace est opaque. Le dispositif est relié à une caméra et à un logiciel. La caméra va prendre des images toutes les trois secondes. Si la caméra observe que des tubes ne sont plus éclairés, le logiciel considère que les tubes ont gelé. Dans ce cas, le logiciel indique que le tube contenait des noyaux glaçogènes. Nous recevons dans un dossier, sur un ordinateur, un fichier Excel avec tous les résultats des tubes qui ont gelé ou non mais aussi les photos des tubes. Les photos nous montrent l’évolution des tubes qui gèlent petit à petit.
Tubes sur la plaque, au-dessus des DEL
Figure 8 Photographie du dispositif de LINDA Figure 7 CMF de l'échantillon de bourgeons de Franquette
14
Dans un premier temps, j’ai préparé mes échantillons. Pour cela
il fallait les placer dans du NaCl à 0.8% (m/v) puis je les mettre à agiter pendant une trentaine de minutes dans une chambre froide à 4°C. Cette manipulation sert à mettre en solution les bactéries présentes dans les bourgeons dans le NaCl. Au bout de trente minutes, mon échantillon était dilué une ou deux fois dans le but de réaliser deux mesures. Enfin les échantillons étaient placés dans un bac de glaçons afin de limiter le développement bactérien car avec la chaleur, les bactéries se développent plus rapidement.
Dans un deuxième temps, il fallait préparer le bain-marie qui contenait du liquide de refroidissement pour faire tomber l’eau en température. De plus il fallait préparer l’ordinateur en ouvrant le logiciel et en indiquant les dossiers où devraient aller les résultats (les images et le fichier Excel).
Dans un troisième temps, à l’aide d’une pipette automatique et d’une seringue, 400 µL de l’échantillon pur était déposé dans 24 tubes, puis dans 24 autres tubes de l’échantillon dilué. Ensuite la plaque destinée à aller dans le bain- marie est remplie. Pour cela, les 48 tubes sont disposés sur la plaque en laissant les extrémités pour placer les quatre sondes de température (Fig. 9).
Les sondes de température sont par la suite placées dans les extrémités, puis il faut immerger la plaque dans le bain- marie sur les LED rouges. Enfin j’ai recouvert le tout avec un cache
dans le but de ne pas avoir de variations de lumière provenant de l’extérieur (ce qui pourrait fausser mes résultats).
Dans un quatrième temps, sur l’ordinateur, les réglages de la caméra sur le logiciel ont été effectué. Afin de créer un fichier Excel, où les informations de température et les résultats seront inscrits, il fallait régler un « masque » (Fig. 10) qui permettait au logiciel de repérer l’emplacement exact des tubes. J’ai donc réglé ce masque au-dessus des tubes.
Enfin il faut diminuer la température du bain thermostaté à -12.5 °C afin que les tubes puissent geler, la température diminue d’environ 0.3°C/min.
Pour vérifier cette méthode, un témoin négatif a d’abord été réalisé, en plaçant dans les tubes du NaCl à 0.8%. Aucun tube n’a gelé ce qui est normal car ils ne contenaient pas de bactéries
Sondes de
température Caméra, reliée à l’ordinateur
Bain
thermostaté
Figure 9 Photographie de la plaque contenant les tubes
15
glaçogènes. Un témoin positif est aussi réalisé, en plaçant des bactéries glaçogènes dans les tubes. Tous les tubes ont gelé. Cet outil est par conséquent efficace pour dénombrer le nombre de bactéries glaçogènes. Enfin avec l’aide de monsieur Amato, nous avons vérifié les sondes de températures en les plaçant dans de la glace fondue. Nous avons constaté qu’une des sondes de température mesurait une température trop élevée. Je n’ai donc pas pris en compte les résultats qu’elle indiquait.
Une fois la manipulation réalisée, nous avons obtenu un fichier Excel. Une plaque nous donne un fichier j’ai donc séparé les fichiers en deux. Le premier nous donne les résultats concernant l’échantillon pur, le deuxième ceux pour l’échantillon dilué. Le fichier est constitué de quatre parties :
-Une partie de résultats bruts
-Une partie appelée « Freeze point detection » qui nous donne différentes informations, telles que la température à laquelle chaque tube a gelé, mais aussi le nombre d’images où nous avons observé le gel des tubes. Il faut légèrement modifier cette partie car de temps en temps nous obtenons deux températures de gel, or cela est impossible puisque les tubes ne peuvent geler qu’une seule fois.
- Une partie appelée « Tuber Holder Filling » (Fig. 11) : elle nous donne une image de la plaque des tubes gelés. J’ai donc comparé l’image à la dernière image donnée par LINDA pour vérifier s’il n’y avait pas de faux positif ou de faux négatif.
- Et enfin la dernière partie appelée « Summary » (Fig. 12) : elle nous donne la concentration des bactéries glaçogènes pour chaque température.
Analyses statistiques
Une fois les manipulations terminées, tous les résultats ont été inscrit dans un tableau Excel et l’analyse a commencé. Le tableau contient deux types de valeurs, des valeurs quantitatives et qualitatives. Dans les valeurs qualitatives nous retrouvons ; la date de l’échantillonnage, l’espèce, la variété, la phénologie du bourgeon, le lieu du prélèvement et le contexte environnemental. Dans les valeurs quantitatives nous retrouvons ; le temps qui s’est écoulé entre l’échantillonnage et les dernières pluies de 5mm et de10 à 15 mm, la température moyenne de la semaine qui a précédé le jour du prélèvement, l’humidité du jour du prélèvement, le délai entre les derniers gels de 0°C, -2°C et -3°C, la masse fraiche et sèche, la Figure 11 Partie du logiciel "Tuber Holder Filling" Figure 12 Partie du logiciel "Summary"
16
moyenne des fuites des électrolytes et la pente au point d’inflexion de la courbe de celle-ci, la température de l’apparition des premiers noyaux glaçogènes, la température du treizième tube gelé qui représente l’activité des noyaux glaçogènes aux dilutions 100
et 101, la quantité de noyaux glaçogènes à -8°C et à -7°C, par rapport à la masse sèche et à la masse fraiche mais aussi les ratios de la quantité de noyaux glaçogènes par rapport à la quantité de Pseudomonas par gramme de masse fraiche et sèche, enfin les ratios de la quantité de noyaux glaçogènes par rapport à la population bactérienne par gramme de masse sèche et fraiche.
Si une manipulation n’a pas fonctionné, il est inscrit « NA » pour indiquer que la valeur nous était inconnue. Concernant la quantité de noyaux glaçogène par rapport à la masse, s’il n’y avait pas de valeur dû à un problème de manipulation, et si la valeur du degrés Celsius en dessous de -7°C était connue, cette valeur a été prise pour la quantité de noyaux glaçogènes à -7°C. De plus si des tubes ont gelé, mais que 13 tubes n’ont pas gelé pour l’activité des noyaux glaçogènes, nous avons considéré que -12°C pouvait remplacer la valeur inconnue car il y a une très grande probabilité que dans la nature ces tubes à -12°C auraient dû être gelés. Pour les ratios des quantités de noyaux glaçogènes par rapport aux Pseudomonas, s’il n’y avait pas eu de développement de Pseudomonas sur les boites de pétri, cela voulait dire qu’il y avait une infinité de noyaux glaçogènes. Nous avons par conséquent posé une valeur arbitraire de 1, qui est plus grande au niveau d’ordre de grandeur que les ratios habituels. Pour l’analyse, dans un premier temps des corrélations entre différents facteurs ont essayées d’être réalisés. Ensuite il fallait sélectionner des données pour alléger les statistiques, nous avons par conséquent comparer les variances et avons choisis les variances les plus élevées, puisque cela permettait une plus grande dispersion des valeurs, pour pouvoir vérifier si un des facteurs était très important.
La dernière étape était de tracer des graphiques, des histogrammes ou des nuages de points pour observer l’impact des facteurs.
17
Figure 11 Quantité de noyaux glaçogènes détectés à -8°C normalisée par la masse fraiche en fonction de la quantité de noyaux glaçogènes normalisée par la masse sèche. Les deux axes sont exprimés en échelle logarithmique
Résultats et interprétations
Pour explorer l’influence des facteurs environnementaux sur la distribution des bactéries glaçogènes sur les bourgeons d’arbres, nous avons examiné les corrélations entre différents facteurs environnementaux et bactéries glaçogènes. Cinq variables caractéristiques du potentiel glaçogène ont été retenues : la quantité de noyaux glaçogènes (rapportés à la biomasse végétale), la température à laquelle se forment les premiers cristaux de glace en conditions contrôlées, l’activité des noyaux glaçogènes (c’est-à-dire température à laquelle 50% des tubes sont gelés), la proportion de noyaux glaçogènes au sein de la population microbienne en général et au sein des
Pseudomonas sp en particulier et enfin la
température à laquelle les bourgeons sont endommagés.
La corrélation entre les noyaux glaçogènes normalisés par la masse fraiche et par la masse sèche est forte (R² = 0.916 ; Fig. 13), suggérant que ces masses sont liées. Par conséquent, pour simplifier la présentation des résultats, la quantité de noyaux glaçogènes sera uniquement exprimée après normalisation par la masse fraiche de l’échantillon dans la suite du rapport.
Analyse multivariée
Une analyse multivariée (Analyse en Composantes Principales A.C.P.) a été effectuée sur l’ensemble de nos données, dans le but de caractériser la source de variabilité. Une a été réalisée. La première étape sur l’ensemble des
données (Fig. 15) a montré que l’échantillon numéro 1, qui représente des bourgeons débourrés de Noyer, de la variété Serr peut être considéré comme une valeur extrême (un outlyer) car très éloigné des autres points. Par conséquent il a été retiré des analyses ultérieures. L’ACP permet de représenter 41% de la variance sur les deux premiers axes (Fig 6A) et 50%avec l’axe 3 (non représenté).
Figure 15 ACP de l'ensemble des échantillons
y = 2.608x R² = 0.916 1 10 100 1000 10000 1 10 100 1000 10000 N o y a u x g la ç o g è n e s r a p p o rt é s à l a m a s s e f ra îc h e ( IN .g -1)
Noyaux glaçogènes rapportés à la masse sèche (IN.g-1)
18
On peut observer que les échantillons se répartissent selon quatre groupes de données (cluster ; Fig. 16A). Un groupe correspond aux échantillons provenant d’arbustes : églantier (points 10 et 11), noisetier (points 12,13 et 14), aulne (points 17, 18, 19) et prunellier (points 8 et 9) se démarquent de l’érable (points 15 et 16) et du noyer (reste des points). Cette différenciation semble plutôt pilotée par des variables physiologiques de la plante (matière fraîche MF et sèche MS et résistance au gel LT50 ; Fig. 16B).
L’ACP met aussi en évidence un regroupement des bourgeons dormants (par rapport aux bourgeons débourrés) dans le premier cadrant supérieur gauche. Cette différenciation semble plutôt pilotée par des variables climatiques (température et humidité moyenne de l’air, date du dernier gel ; Fig. 16B).
Enfin les échantillons des jeunes arbres en pot placés dans des contextes environnementaux différents se différencient entre conditions initiales (points 21, 22 et 23) et post-traitement. Néanmoins l’effet induit par le traitement ne semble pas détectable en l’état entre milieu ouvert (points 35, 36, et 37) et milieu fermé (33, 34, 32). Cet effet semble également lié aux conditions climatiques (températures de gel à 0°C et à -2°C, humidité relative ou température moyenne). La différence de couvert ne semble donc pas être une variable critique dans l’établissement d’une population glaçogène particulière (cf ci-dessous).
Finalement l’ACP a permis de distinguer trois grands effets liés aux dommages dû au gel des échantillons ; un effet phyllosphère (qui est relié au facteur de physiologie), un effet climatique (qui est relié au facteur de l’aléa) et un effet de physiologie de la plante (qui est relié à la vulnérabilité.) La phyllosphère contient les résultats des bactéries (trouvée à partir des boites de pétri et de la CMF) mais aussi le dénombrement des noyaux glaçogènes, elle pourrait expliquer l’impact du gel avec la dormance des bourgeons et l’effet des arbustes. Le climat lui pourrait expliquer le contexte environnemental mais aussi l’altitude face aux dommages dû au gel.
Figure 16B Cercle des corrélations de l’ACP des échantillons en retirant l’échantillon 1
Figure 16A ACP de l'ensemble des échantillons en retirant l’échantillon1
19
Variabilités liées à l’environnement biotique
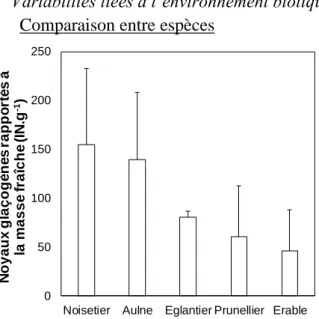
Comparaison entre espèces
Suite à des problèmes techniques, les mesures sur échantillon de noyer n’ont pas été concluantes dans deux cas sur trois. Par conséquent, seul l’aulne, l’églantier, le prunellier et l’érable, ont été intégré à cette analyse. Il ressort de cette analyse que l’aulne et le noisetier possèdent plus de noyaux glaçogènes (139.2 et 154.5 IN.g-1 pour l’aulne et le noisetier, respectivement ; Fig. 17) que les 3 autres espèces (46.4, 60.7, 80.6 pour l’érable, le prunellier et l’églantier, respectivement ; Fig. 17). Cependant la forte variabilité, indiquée par les écarts types, indiquent qu’au sein de même espèce, la quantité de noyaux glaçogènes est variable. L’activité des noyaux glaçogènes semble toutefois significativement liée à leur quantité (R² = 0.881 Fig. 17B). Cela semble logique car plus il y aurait de noyaux glaçogènes plus il y aurait de probabilité de gel. En effet, comme l’ACP l’avait décrit, l’érable qui est un arbre possède un nombre de glaçogène moins important que les autres espèces (43.40 IN.g-1)
Comparaison entre variétés
Les résultats obtenus indiquent que la variété Serr contient plus de noyaux glaçogènes (689.2 et 60.3 IN.g-1 pour le Serr et la Franquette, respectivement ; Fig. 18). Néanmoins, aucune souche de Pseudomonas n’a été retrouvées sur Serr ce qui semblerait indiquer que ces noyaux sont d’une autre nature, alors que le ratio de la quantité de noyaux glaçogènes par la quantité de
Pseudomonas de la Franquette est d’environ 0.006, il
semblerait qu’une infime partie des noyaux glaçogènes provienne des Pseudomonas. Toutefois, la phyllosphère contenant un nombre similaire de cellules (73250 ± vs 97500 ± chez Serr et Franquette respectivement), le ratio plus important chez Serr, indiquerait une plus forte présence de bactéries glaçogènes chez cette variété.
0 50 100 150 200 250
Noisetier Aulne Eglantier Prunellier Erable
N o y a u x g la ç o g è n e s r a p p o rt é s à la m a s s e f ra îc h e ( IN .g -1)
Figure 17B Quantité de noyaux glaçogènes à -8°C de différentes espèces normalisée par la masse fraiche en fonction de la température de prise en glace de 50% des tubes.
y = 25 069.118e0.705x R² = 0.881 0 100 200 300 400 -15 -10 -5 0 N o y a u x g la ç o g è n e s r a p p o rt é s à la m a s s e fr a îc h e ( IN .g -1 )
Température de prise en glace de 50% des tubes ( C)
Figure 17 Quantité de noyaux glaçogènes à -8°C, de différentes espèces, normalisée par la masse fraiche. Les traits noirs représentent les écarts types des échantillons.
Figure 18 Quantité de noyaux glaçogènes à -8°C, de la variété Serr et la variété Franquette du noyer, normalisée par la masse fraîche. Les traits noirs représentent les écarts types
20
La variété Franquette montre un départ d’activité glaçogène et une activité moyenne à plus forte température que Serr (concernant le départ d’activité glaçogène, -4 et -3.5 °C pour Serr et Franquette respectivement et concernant l’activité moyenne de glaçogène, -7°C et -6°C pour Serr et Franquette respectivement ; Fig. 19). Cependant, Franquette, même si elle subit la formation de glace à plus haute température, peut mieux résister au gel que Serr car 50% de ses cellules végétales sont lysées à une température plus basse que celles de Serr (-5.6°C et -8.9°C pour Serr et Franquette respectivement ; Fig. 19).
Les noyaux glaçogènes présents sur les bourgeons de la variété Serr sont plus nombreux mais leur activité semble plus faible comparé à la variété Franquette. Cette relation est inverse à la relation trouvée concernant les espèces, car pour les espèces, plus il y avait de noyaux glaçogènes plus leur activité était forte. Ils pourraient tout de même avoir un impact potentiel sur les dommages générés
sur les bourgeons. Il faut prendre du recul face à ce résultat car la température de la résistance au gel pour la Franquette est plus basse qu’en temps normal pour un bourgeon débourré. Lors de cette manipulation, la quantité des bourgeons a pu être trop faible pour un résultat satisfaisant concernant la fuite des électrons ou il y a pu avoir un problème de surfusion, (l’eau n’a peut-être pas gelé alors qu’elle aurait dû, cela aurait pû avoir pour conséquence de ne pas créer de dommages aux bourgeons alors qu’à cette température il y aurait dû en avoir).
Nous pouvons en déduire que la variété pourrait avoir une influence sur le nombre de bactéries glaçogènes. Cependant ces prélèvements ont été effectués à un mois d’intervalle (du fait d’un décalage de phénologie des arbres) suggère que cette différence pourrait être liée au délai écoulé entre les échantillonnages (1 mois).
Figure 19 Température de gel quand 50% des cellules sont lysées (°C), température de l’apparition des premiers noyaux glaçogènes (°C) et température de prise en glace de 50% des tubes (°C) données concernant la Franquette et le Serr (variétés du noyer). Les traits noirs représentent les écarts types
21
Figure 20 Quantité de noyaux glaçogènes normalisée par la masse fraîche et la masse pondérée à -8°C et température de prise en glace de 50% des tubes des bourgeons dormants et débourrés. Les traits noirs représentent les écarts types Comparaison entre stades phénologiques
Les résultats des bourgeons prélevés à Theix n’étant pas exploitables nous allons nous pencher uniquement sur les mesures effectuées à Crouël.
La quantité de noyaux glaçogènes par rapport à la masse fraîche est plus importante pour les bourgeons dormants par rapport aux bourgeons débourrés (166.95 contre 60.26 IN.g-1 normalisée par la masse fraîche pour les bourgeons dormants et débourrés, respectivement mais aussi 285.23 contre 87.68 IN.g-1 normalisée par la masse pondérée pour les bourgeons dormants et débourrés, respectivement ; Fig. 20). En effet, lors du débourrement, les organes se développent en augmentant notamment leur teneur en eau. Au cours de l’hiver les bactéries glaçogènes sont présente à la surface des bourgeons dormants et, lors du débourrement, la biomasse des bourgeons augmente très rapidement par l’intermédiaire notamment d’une accumulation d’eau dans les tissus. Les noyaux glaçogènes sont donc dilués. Enfin, les bourgeons débourrés
possèdent des noyaux glaçogènes plus actifs que les bourgeons dormants (7.3°C contre -6.0°C pour les bourgeons dormants et débourrés, respectivement). Cependant, cette conclusion n’est pas certaine, car il nous manquait la température d’activité d’un des échantillons.
Variabilités liées à l’environnement abiotique
Comparaison entre altitudes
Suite à des problèmes techniques, les mesures sur échantillon de bourgeons débourrés à Theix n’ont pas été concluantes dans deux cas sur trois. Par conséquent, seul les bourgeons clos sont conservés pour cette analyse.
A Crouël, site de faible altitude (337 m), la quantité de noyaux glaçogènes est plus forte qu‘en conditions de moyenne montagne (826 m) à Theix (166.95 et 49.65 IN.g-1 pour les bourgeons prélevés à Crouël et à Theix, respectivement ; Fig. 21 ). De plus les
bourgeons de Crouël obtiennent un ratio de noyaux glaçogènes par Pseudomonas de 0.0002 contre 0.00005 pour les bourgeons de Theix.
En plus, en basse altitude, les températures sont plus élevées (à Crouël sur dix ans la
Figure 21 Quantité de noyaux glaçogènes rapportés par la masse fraîche à -8°C, température d'apparition des premiers noyaux glaçogènes et température de prise en glace de 50% des tubes des bourgeons présents à Theix et à Crouël. Les traits noirs représentent les écarts types
22
température de moyenne a été de 12.2°C et à Theix de 9.7°C), cela favorise le développement microbien. De plus les noyaux glaçogènes peuvent aussi provenir de la pollution urbaine. Crouël est un endroit proche d’une autoroute, d’un aéroport mais aussi d’un incinérateur, ce qui peut influencer l’apparition de noyaux glaçogène avec par exemple des particules fines comme des particules de plaquettes de frein ou encore des résidus de fumée plus ou moins toxiques pour l’environnement.
De plus l’activité des noyaux glaçogènes présents dans les bourgeons de Crouël, qui est de -8.5°C, est plus importante à des températures plus hautes, que celle de Theix qui est de -10.5°C. Cependant nous n’avons pas eu de résultats pour tous les échantillons, nous avons par conséquent considéré que la plus grande activité de ces noyaux glaçogènes commençait à -12°C (température à laquelle l’eau pure gèle). Ces résultats sont par conséquent imprécis.
L’apparition des premiers noyaux glaçogènes ne nous donne pas d’informations supplémentaires puisque l’incertitude (donnée par les traits noirs) est trop élevée.
Pour ces trois résultats, il se pourrait aussi qu’il y ait eu un effet provenant du temps qui s’est écoulé entre les deux prélèvements, car il s’est passé un mois.
Comparaison entre contexte ouvert/fermé
D’après la figure 22, au temps 0, la quantité de noyaux glaçogènes est relativement élevée puis qu’au temps 1, que ce soit dans le milieu ouvert ou fermé, la quantité de noyaux glaçogènes diminue. Enfin, au temps 2 concernant le milieu ouvert, la quantité de noyaux glaçogènes augmente de nouveau alors que celle du milieu fermé diminue encore légèrement. Ce phénomène suggère que les arbres possèdent la même microflore, puis une fois séparés et placé dans des milieux différents, la population bactérienne est remplacée par une autre population bactérienne (d’où une diminution de noyaux glaçogènes au second prélèvement). De plus les arbres présents dans le milieu ouvert sont entourés de graminées, or les bactéries glaçogènes sont très nombreuses sur les graminées. Par conséquent, l’augmentation des noyaux glaçogènes des bourgeons présents dans le milieu ouvert pourraient être lié à cela. Nous observons aussi que les bourgeons du milieu fermé obtiennent une plus forte quantité de noyaux glaçogènes. En effet contrairement aux bourgeons présents dans le milieu ouvert, ils sont protégés des UV, alors que les bactéries glaçogènes sont sensibles aux rayons UV.
Figure 22 Quantité de noyaux glaçogènes rapportés par la masse fraîche à -8°C et température de prise en glace de 50% des tubes des bourgeons de Crouël aux temps 0, 1 et 2