UNIVERSITÉ MOHAMMED V – AGDAL
FACULTÉ DES SCIENCES
Rabat
N° d’ordre 2340
THESE DE DOCTORAT D’ETAT
Présentée par
Abdelmoussehel ERROUGANI
Discipline : PHYSIQUE
Spécialité : ENERGETIQUE
FABRICATION ET EXPERIMENTATION D’UN REFRIGERATEUR SOLAIRE
A ADSORPTION UTILISANT LE COUPLE CHARBON ACTIF- METHANOL
DANS LE SITE DE RABAT
Soutenue le 23 Juin 2007 devant le jury composé de:
Président :
Mr A.
LFERDE
Professeur à la Faculté des Sciences de Rabat
Examinateurs :
Mr M.
BOUKALOUCH Professeur à la Faculté des Sciences de Rabat
Mr M.
BOUSMINA
Directeur de recherche à l'université Laval, Canada
Mr S.
KARBAL
Professeur à l’Ecole Normale Supérieure de Rabat
Mme F.
LEMMINI
Professeur à la Faculté des Sciences de Rabat
Mr A.
MIMET
Professeur à la Faculté des Sciences de Tétouan
A la mémoire de mon père
A ma mère
A ma femme, mes filles : Ilham et Ines
pour leur patience, leur encouragement et
leur soutient affectif sans lequel ce travail
n’aurait pu être mené à bien
Remerciements
Ce travail a été réalisé au laboratoire d’Energie Solaire de la Faculté des Sciences de Rabat sous la direction de Madame Le Professeur F. LEMMINI.
C’est avec le plus grand plaisir que je veux exprimer ma profonde gratitude à Madame F. LEMMINI, Professeur à la Faculté des Sciences de Rabat, pour le dévouement et le dynamisme avec lequel elle a suivi et guidé ce travail. Dans des conditions de travail parfois délicates, son efficacité, sa disponibilité constante, ses encouragements dans des moments difficiles qui ne manquaient pas, ses conseils et les discussions scientifiques fructueuses ont constitué un apport considérable dans la réalisation et l’aboutissement de ce travail. Je tiens à lui exprimer ici toute ma reconnaissance.
Monsieur le Professeur M. LFERDE, Chef du département de Physique de la Faculté des Sciences de Rabat, a accepté de présider le Jury. Qu’il soit assuré de ma profonde reconnaissance.
Je tiens à exprimer mes vifs remerciements à Messieurs les Professeurs M. BOUKALOUCH, Directeur du Laboratoire de Thermodynamique- Energétique de la Faculté des Sciences de Rabat, M. BOUSMINA, Directeur de recherche à l'université Laval, Canada et S. KARBAL, de l’Ecole Normale Supérieure de Rabat, de l’intérêt qu’ils ont porté à mon travail et de l’honneur qu’ils m’ont fait d’accepter de participer au jury.
J’adresse mes sincères remerciements à Monsieur, A. MIMET, Professeur à la Faculté des Sciences de Tétouan et à Monsieur M. TAHIRI, Professeur et Directeur adjoint à l’Ecole Mohammadia d’Ingénieurs de Rabat, d’avoir accepté de juger ce travail et faire partie du jury.
Ce travail a bénéficié du financement du projet PARS (Programme d’Appui à la Recherche Scientifique) du Ministère de l'Enseignement Supérieur sous la coordination de Monsieur le Professeur S. BELCADI, Directeur du Centre National pour la Recherche Scientifique et Technique (CNRST). Qu’il en soit vivement remercié
Je remercie également Monsieur K. El MEDIOURI, Directeur général du CNESTEN, de nous avoir donner la permission de nous approvisionner en azote liquide.
Je remercie très chaleureusement Monsieur le Professeur M. PONS, Chargé de Recherche CNRS et Responsable du Groupe Transferts Solide-
Fluide au Laboratoire d’adsorption du LIMSI à Orsay, pour les multiples et fructueuses conversations et conseils lors de la réalisation de ce travail.
J’exprime mes remerciements à Monsieur le Professeur P. Dind et à Madame C. Hildbrand, de l’Ecole d’Ingénieurs du Canton de Vaud de Suisse (EIVD) de nous avoir aidé à l’octroi de matériel de rechange (vannes, flexibles, joints).
Je n’oublie pas de remercier l’Académie des Sciences pour les Pays du Tiers Monde (TWAS), de nous avoir accordé un don de recherche qui nous a permis lors de la fabrication de l’unité expérimentale, d’acheter des éléments de liaison.
Mes remerciements vont également à Madame R. CHERKAOUI EL MOURSLI, responsable du Laboratoire Physique Nucléaire, et à Monsieur A. HAKAM, Professeur à la Faculté des Sciences de Rabat, de nous avoir confié l’utilisation de la pompe à vide.
Je n’oublierai pas d’associer dans mes remerciements mes collègues, les chercheurs et les techniciens du Laboratoire d’Energie Solaire, et Messieurs A. MOKHLI, BOUBKR et BOUCHAIB de leur coopération constante.
SOMMAIRE
NOMENCLATURE
INTRODUCTION GENERALE………...
1
CHAPITRE I
THEORIES DU PHENOMENE D’ADSORPTION
I. 1 Principe de l’adsorption………4
I.2 Adsorbants utilisés dans le domaine de la réfrigération………..
5
I .2. 1 Mise en forme des adsorbants………..
5
I .2. 2 Mode de transfert de masse dans un lit d’adsorbant……….
6
I .2. 3 Caractérisation des adsorbants……….
7
I .2. 4 Les adsorbants………
8
I .2. 5 Les réfrigérants………
12
I. 3 Critères de sélection du couple pour la production de froid par adsorption………
13
I. 4 Cycle frigorifique intermittent à adsorption……….
15
I. 4. 1 Principe du cycle……….
15
I. 4. 2 Principe de fonctionnement du cycle idéal……….
17
I. 5 Définition des coefficients de performance d’une machine frigorifique solaire à adsorption………
20
I. 6 Isothermes d’adsorption
……….
21
I. 6. 1 Le modèle de Langmuir………
23
I. 7 Isostères d’adsorption
………
32
CHAPITRE II
EXEMPLES DE PROTOTYPES DE REFRIGERATEURS SOLAIRES A
ADSORPTION
II. 1. Prototype utilisant le couple zéolithe- eau……….……….35
II. 2. Prototype utilisant le couple charbon actif – méthanol………..
37
II.3. Prototype utilisant le couple gel de silice –eau……….…….
39
II. 4. Prototype utilisant le couple charbon actif- ammoniac……….
39
CHAPITRE III
DESCRIPTION DE L’INSTALLATION EXPERIMENTALE
III.1 Composants de la machine frigorifique solaire à adsorption…………..43
III.1. 1. Le capteur plan…………..…………..…………..…………..………
43
III .1.2. Le condenseur à air…………..…………..……….
47
III. 1. 3. L’évaporateur et la chambre froide…………..…………..………..
48
III.2 Fabrication et soudure des différents éléments de l’installation…………..…………..…………..…………..………
50
III.2.1. Expérience avec un capteur plan de 1 m2…………..…………..…
50
III.3 Préparation préliminaire et dégazage de l’installation………
51
III. 3. 1 Vérification de l’étanchéité de chaque élément de l’installation…………..…………..…………..…………
51
III. 3. 2 Vérification de l’étanchéité de l’installation sans méthanol…………..…………..…………..………
52
III. 3. 3 Dégazage de la machine frigorifique solaire
à adsorption contenant le méthanol…………..…………..………..
53
CHAPITRE IV
EXPERIMENTATION DU REFRIGERATEUR SOLAIRE A
ADSORPTION
IV.1 Interventions manuelles quotidiennes appliquées au réfrigérateur……….55
IV. 2 Influence des volets d’isolation………..
58
IV. 3 Influence de la présence d’air dans l’installation……….
58
IV. 4 Résultats expérimentaux……….
61
IV. 4. 1 Fonctionnement typique………..
61
IV. 4. 2 Analyse des résultats……….
68
IV 4. 3 Cycles expérimentaux et calcul des performances………...
76
IV 4. 3 .1 Cycles expérimentaux………
76
IV 4. 3 .2 Coefficients de Performances………
82
IV 4. 3 .3 Pertes frigorifiques de la chambre froide………..
83
IV 4.3 .4 Calcul de la résistance thermique journalière au transfert de la chaleur entre l’ambiance et la chambre froide………
89
IV. 4. 4 Masse adsorbée………...
94
CONCLUSION……….……….
96
ANNEXE A1 Eléments de liaison et instruments de mesure.……….
99
ANNEXE A2 Méthode de dégazage.………...………
103
ANNEXE A3 Cycles réels …………..……..……...………..
106
ANNEXE A4 Equation d’état ...………...………
121
ANNEXE A5 Equation d’état ...………...………
122
NOMENCLATURE
Aav : surface de la face avant du capteur (m2) b : constante de Langmuir
COPsol : coefficient de performance solaire COPth : coefficient de performance thermique
CPcu
: chaleur spécifique du cuivre (J kg
-1K
-1)
CPmeth: chaleur spécifique du méthanol (J kg
-1K
-1)
E : irradiation solaire (kJ m-2)
Eu : énergie utile pour chauffer le capteur et provoquer la désorption (kJ m-2) I : irradiance reçue par la face avant du capteur (W m-2)
L : chaleur latente d’évaporation du réfrigérant [J kg-1]
ma : masse du réfrigérant adsorbée par kg d’adsorbant (kg kg-1) Ma : masse de réfrigérant adsorbée [kg]
Mcu : masse de cuivre [kg]
md : masse de réfrigérant désorbée par kg d’adsorbant (kg kg-1) Md : masse de réfrigérant désorbée [kg]
Mmeth : masse de méthanol [kg] P : pression (mbar)
P
: pourcentage de perte de la chambre froide (%) Pc : pression du condenseur (mbar)Pe : pression de l’évaporateur (mbar) q : fraction adsorbée
Qs : chaleur sensible (kJ)
R : résistance au transfert de chaleur par convection et par conduction (KW-1) r : coefficient de corrélation
t : durée de production de froid (s) Ta : température ambiante (°C)
Tads : température pendant l’adsorption (°C) Taj : température ambiante du jour (°C) Tan : température ambiante de la nuit (°C)
Tar : température de la face arrière du capteur (°C) Tav : température de la face avant du capteur (°C) Tc : température du condenseur (°C)
TCA : température du charbon actif (°C) TCF : température de la chambre froide (°C) Tdes : température pendant la désorption (°C) Te : température de l’évaporateur (°C) V : vitesse du vent (ms-1)
Vj : vitesse moyenne du vent pendant le jour (ms-1) Vn : vitesse moyenne du vent pendant la nuit (ms-1)
W : volume adsorbé du réfrigérant par kg d’adsorbant (m3 kg-1)
INTRODUCTION
Le Maroc est doté d’un potentiel solaire important. L’ensoleillement annuel est toujours supérieur à 20 000 kJ par m2 de surface de captation. Il est donc important d’exploiter ce gisement, gratuit et non polluant, dans le domaine de la production de froid, notamment dans les zones rurales isolées.
Pour les pays en voie de développement, doté d’un ensoleillement favorable, en particulier dans les zones hors d’atteintes du réseau électrique, les machines de réfrigération solaire à adsorption semblent une voie prometteuse pour l’amélioration des conditions de vie dans ces zones du point de vue sanitaire et économique tels que :
-La diminution du gaspillage important des ressources alimentaires. En effet, les denrées alimentaires (viande, lait, œufs,…) et les récoltes pourrissent sur les lieux, à cause de l’insuffisance des équipements frigorifiques ;
-L’amélioration d’exploitation du poisson pour les zones rurales côtières isolées ;
-La conservation des produits pharmaceutiques.
Les unités de réfrigération solaire à adsorption sont donc les plus adaptées car : - Elles opèrent sans aucune pièce mobile, avec une absence de nuisance sonore ;
- Elles utilisent des réfrigérants (que ce soit l’ammoniac, l’eau ou les alcools) qui sont bénins pour l’environnement ;
- Leur entretien est facile ;
Dans ce travail, nous proposons un réfrigérateur solaire à charbon actif -méthanol, fabriqué, pour la première fois au Maroc, entièrement avec des matériaux locaux, au Laboratoire d’Energie Solaire et testé sur sa terrasse dans des conditions climatiques réelles.
Cette étude est structurée de la manière suivante :
Le premier chapitre contient un rappel des connaissances du processus d’adsorption, du point de vue thermodynamique. Les principaux adsorbants et réfrigérants utilisés dans le domaine de la réfrigération solaire sont cités ainsi que leurs caractéristiques. Une description et une analyse détaillée de la question du choix du couple adsorbant – réfrigérant pour la production du froid est donnée dans ce chapitre. Le mode de fonctionnement du réfrigérateur solaire à adsorption ainsi que les différentes approches descriptives du phénomène d’adsorption sont traités.
Au chapitre II, nous donnons des exemples de prototypes de réfrigérateurs solaires à adsorption testés expérimentalement. Nous nous sommes intéressés aux principaux couples utilisés dans ce domaine : Zéolithe- eau, charbon actif- méthanol, gel de silice- eau et charbon actif- ammoniac.
La description du prototype de réfrigérateur solaire utilisant le couple AC35-méthanol que nous avons fabriqué au Laboratoire est représentée dans le
troisième chapitre de ce manuscrit. Nous accordons une attention particulière à la fabrication et à la soudure des différents éléments car le réfrigérateur, fonctionnant à des pressions inférieures à la pression atmosphérique, doit être parfaitement étanche. Les étapes de vérification de l’étanchéité du réfrigérateur et la réalisation du vide, qui sont très utiles pour le bon fonctionnement de l’unité, sont traitées à la fin de ce chapitre.
Le quatrième chapitre présente le mode opératoire et les résultats expérimentaux du réfrigérateur solaire à adsorption. Au début de ce chapitre, nous donnons les interventions manuelles quotidiennes appliquées au réfrigérateur. L’impact des volets d’isolation du capteur sur les performances de
l’influence de la présence de l’air dans l’installation. Le fonctionnement typique du réfrigérateur est donné pour quatre jours de conditions climatiques différentes car, comme ces unités solaires fonctionnent en plein air, les conditions météorologiques influencent les performances de l’unité.
Au chapitre IV, l’étude des performances de l’unité, en fonctionnement continu, est faite pour deux séquences de jours contenant des journées de conditions climatiques différentes. Les cycles expérimentaux sont tracés dans le diagramme de Clapeyron et les coefficients de performances journaliers sont calculés. Une attention particulière est donnée à la chambre froide, élément du réfrigérateur, où est produit et conservé le froid. En effet, cet élément, exposé à des conditions météorologiques variables d’une journée à l’autre, subit des pertes frigorifiques variables qui sont estimées dans ce chapitre. Une corrélation, permettant de prédire les performances de ce réfrigérateur dans d’autres climats, est établie entre la masse adsorbée, l’ensoleillement et la température ambiante.
Enfin des annexes contenant des détails complémentaires ont été ajoutées afin de faciliter la lecture.
CHAPITRE
I
:THEORIES DU PHENOMENE D’ADSORPTION
I. 1 Principe de l’adsorption
L’adsorption est le processus au cours duquel les molécules d’un fluide (gaz ou liquide), appelé adsorbat dans le cas général ou réfrigérant dans les procédés de production de froid, se fixent sur la surface d’un solide appelé un adsorbant.
Le terme surface du solide correspond à la totalité des surfaces externes et internes engendrées par le réseau de pores et cavités à l’intérieur de l’adsorbant. Quand une molécule s’approche d’une surface solide, elle peut se fixer de deux manières:
Îsoit par l’adsorption chimique ou chimisorption correspondant à des liaisons chimiques fortes dont l’énergie de liaison est assez grande de l’ordre de 50 à 400 kJ/mole [1] se traduisant par une réaction chimique entre les molécules du fluide « adsorbat » et la surface du solide « adsorbant », c’est un phénomène irréversible.
Îsoit par l’adsorption physique ou physisorption correspondant à des liaisons physique plus faible, avec des énergies d‘interactions de l’ordre 20 kJ/mole [1], qui ne modifie pas la nature chimique de la molécule de l’adsorbant. Cette fixation des molécules du fluide sur la surface du solide se fait essentiellement par les forces de Van der Waals et les forces dues aux interactions électrostatiques de polarisation, dipôle et quadripôle pour les adsorbants ayant une structure ionique. Cette liaison faible de molécules d’adsorbat sur le solide n’entraîne aucune modification de la structure moléculaire du solide mais une simple variation de sa masse. Ainsi, l’adsorption physique est parfaitement réversible c'est-à-dire que les molécules adsorbées peuvent être facilement désorbées en augmentant la température. Les procédés d’adsorption industriels notamment la réfrigération font intervenir
généralement les propriétés de la réversibilité de l’adsorption physique. Par conséquent seule l’adsorption physique sera abordée dans ce travail.
Du point de vue thermodynamique, l’adsorption physique est considérée comme une transformation d’état du fluide d’une phase gazeuse à une phase adsorbée. Cette transformation s’effectue à pression et température constantes. Elle s’accompagne toujours d’un effet thermique dû à la chaleur isostérique d’adsorption, ce qui peut conduire à un échauffement du solide et à une réduction des quantités adsorbées.
L’exothermicité d’un système d’adsorption est caractérisée par les chaleurs d’adsorption qui peuvent être mesurées par des techniques calorimétriques ou estimées à partir des isothermes d’adsorption à différentes températures.
I.2
Adsorbants utilisés dans le domaine de la réfrigérationGénéralement, tous les solides sont des adsorbants. Mais seuls les adsorbants ayant une surface spécifique suffisante au-delà de 100 m2/g peuvent avoir des intérêts pratiques dans le domaine industriel notamment dans la production du froid. Ces adsorbants sont nécessairement microporeux avec des tailles de pores inférieures à 2nm ou mésoporeux avec des tailles de pores comprises entre 2 nm et 50 nm (selon la classification de l’ International Union of Pure and Applied Chemistry (IUPAC).
I .2.1 Mise en forme des adsorbants
Généralement, les adsorbants doivent d’abord être agglomérés à l’aide de liant pour obtenir des grains de dimensions convenables (de l’ordre du millimètre), de bonne porosité et de résistance mécanique suffisante. Ces grains peuvent être cylindriques (obtenus par extrusion) ou sphériques (obtenus par granulation).
La mise en forme des grains d’adsorbant donne naissance à une structure à double porosité avec deux types de pores (figure I. 1) de natures très différentes :
¾ Les micropores, contenus dans les cristaux ou les microparticules,
" sites actifs " où s’effectue l’adsorption ;
¾ Les macropores, formés entres les cristaux, sont appelés pores de transport. Surface interne Matrice solide Macropore Micropore Surface externe
Figure I.1 :Représentation d’une microstructure d’un adsorbant microporeux
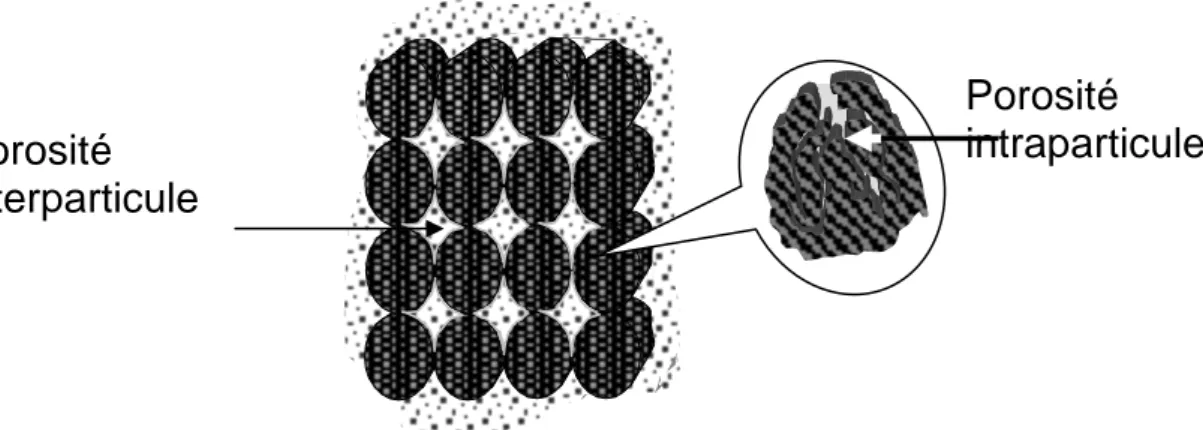
I .2.2 Mode de transfert de masse dans un lit d’adsorbant
Le processus dynamique de l’adsorption (figureI.2) s’effectue de la façon suivante :
Le gaz est convecté aux travers des espaces intergranulaires, ensuite, il est diffusé dans les macropores et enfin dans les micropores où a lieu le changement de phase responsable de l’adsorption.
Porosité
intraparticule
Porosité
interparticule
Figure I. 2 : Porosité d’un assemblage de particule poreux
La porosité interne favorise non seulement la pénétration du gaz adsorbable dans le solide, mais surtout sa condensation dans les micropores. Cette condensation se traduit par une capacité importante d’adsorption du gaz dont la fixation de ses molécules est dûe aux micropores qui permettent soit de fixer une quantité considérable de vapeur (puit de vapeur), soit de générer une grande quantité de vapeur (source de vapeur). C’est ces phénomènes qui conférent à ces adsorbants des propriétés remaquables utilisées dans les procédés industriels.
I .2.3 Caractérisation des adsorbants
Elle est basée sur la détermination du volume poreux et de la distribution de la taille des pores. Expérimentalement le volume poreux est déterminé en utilisant de l’hélium et du mercure :
En effet, l’hélium pénètre dans tous les pores sans être adsorbé et donne le volume poreux total alors que le mercure ne pénètre pas dans les pores et de ce fait ne donne que le volume interparticulaire. La technique de porosimétrie à mercure (qui consiste à faire pénétrer sous pression contrôlée le mercure dans les pores) permet de mesurer la distribution des pores supérieurs à 100Å alors que l’adsorption de l’azote permet de déterminer la distribution des pores entre 10 et 25 Å. La figure I.3 donne la distribution de la taille des micropores pour différents adsorbants utilisés dans le domaine de la réfrigération.
100 f 10000 g 1000 100 50 1 e a 10 c b 5 Pourcen tag e des pores 50 0 Diamètre du pore (
Å
)Figure I. 3: Distribution de la taille des micropores pour différents adsorbants :
(a) zéolithe 3A, (b) 4A, (c) 5A, (d) 10X, (e) 13X, (f) MSC, (b), (g) charbon actif
I .2. 4 Les adsorbants
Parmi les principaux adsorbants utilisés dans le domaine de la réfrigération à adsorption, on peut citer :
Î Les charbons actifs
Le charbon actif est le premier matériau adsorbant utilisé. De par ses propriétés médicinales, il était déjà employé en Egypte antique. Les charbons actifs sont des carbones que l’on a préparés afin d’accroître leur pouvoir adsorbant. En effet ils sont fabriqués à partir de matériaux de bases telles que le bois, le charbon, la noix de coco, etc.…; ces derniers subissent, après un traitement initial, des processus :
¾ d’agglomération ;
¾ de premier traitement thermique de 400 à 500°C afin d’éliminer les éléments volatils produisant ainsi de grands pores ;
¾ de second traitement thermique de 800 à 1000°C pour créer la microporosité.
Des traitements ultérieurs de surface permettent de modifier de façon importante la capacité d’adsorption. Ces procédés créent à l’intérieur de l’adsorbant des pores de diamètres inférieurs à 20 Å " micropores" et supérieurs à 500 Å " macropores" donnant ainsi une très grande surface spécifique interne de l’ordre 2000 m2 par gramme d’adsorbant, la plus grande parmi les adsorbants, donnant ainsi une grande capacité d’adsorption.
La structure interne du composé ainsi obtenu est constituée d’un assemblage aléatoire de cristallites élémentaires de graphite. L’espace entre ces cristallites constitue la microporosité du charbon, et l’aspect aléatoire de la distribution de taille de pores rend la sélectivité du matériau très faible. La surface des charbons actifs est essentiellement non polaire, même si une légère polarité peut se produire par une oxydation de surface.
Les applications du charbon actif dans les procédés industriels sont nombreuses, et vont du traitement des eaux à la décoloration de liquides organiques (sucres,..) en passant par la purification de l’air et la production du froid. Les principales propriétés physiques des charbons actifs sont données dans le tableau I.1.
Adsorbant Surface spécifique
(m2.g-1)
Taille des pores (nm) Porosité interne Charbons actifs 400 à 2 000 1.0 à 4.0 0.4 à 0.8 Tamis moléculaire carbonés 300 à 600 0.3 à 0.8 0.35 à 0.5 Zéolites 500 à 800 0.3 à 0.8 0.3 à 0.4 Gels de silice 600 à 800 2.0 à 5.0 0.4 à 0.5 Alumines activées 200 à 400 1.0 à 6.0 0.3 à 0.6
Î Molecular Sieve Carbon (MSC) " Tamis Moléculaires carbonés"
Du fait de leur distribution assez large des tailles de pores, les charbons actifs ont des sélectivités plutôt faibles pour l’adsorption des molécules de tailles différentes. Pour augmenter les sélectivités, il est possible de préparer des charbons actifs avec une distribution de pores très étroite par des processus d’activation spécifiques, en utilisant par exemple un post-traitement des charbons actifs par le craquage ou la polymérisation de certaines espèces comme le benzène ou l’acétylène sur la surface. Les charbons actifs ainsi obtenus sont appelés tamis moléculaires carbonés. C’est ce type de charbons actifs qui est utilisé pour la production de N2 à partir de l’air avec un procédé
de séparation basé sur des sélectivités cinétiques.
Ces charbons présentent une distribution de tailles de pores beaucoup moins étalée que celle des charbons actifs (figure I. 3) dont les principales propriétés physiques sont données dans le tableau I. 1.
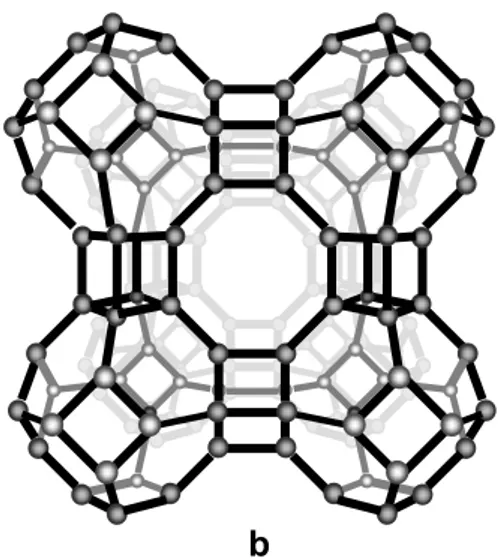
Î Les zéolithes ou tamis moléculaires
Les zéolithes qui existent à l’état naturel sont des minéraux. Ce sont des assemblages de cages aluminosilicates cristallisées comprenant des cations alcalins tels que le sodium, le potassium, le calcium etc.… Ces cations jouent un rôle majeur dans de nombreuses applications de la zéolithe, ce sont notamment eux qui attirent les molécules polaires (l’eau en particulier). Structurellement, une zéolithe est un assemblage périodique présentant des cavités appelées cages qui sont interconnectées par l’intermédiaire de "fenêtres ". L’ouverture des fenêtres des cages est contrôlée par les cations et peut varier entre 3 et 10 (Å).
b a
Figure I. 4 :a) Cage élémentaire cubo–octaédrique de cristal de zéolithe A ou X.
b) Zéolithe de type A (LTA – Linde Type A) Les cubo–octaèdres sont assemblés par les faces carrées.
La zéolithe existe sous plusieurs formes différentes de composition chimique voisine de celle du sable. La synthèse industrielle de la zéolithe peut être soit une amélioration, par le biais de réaction chimique, d’un type naturel, soit une transformation d’un mélange homogène de sable, bauxite et de soude vers un système cristallin. Les zéolithes de type A (figure I.4 b), X et Y sont les plus souvent utilisés en séparation et purification de gaz par adsorption. Les principales propriétés physiques des zéolites sont données dans le tableau I.1.
Î Gel de silice
Le gel de silice (SiO2.nH2O) est une silice synthétique amorphe, dont la
structure des pores, créée par l’agglomération des microparticules sensiblement sphériques de dimension à peu près uniforme, est comprise entre 2 et 20 nm. Il présente l’avantage d’adsorber beaucoup d’eau (400g/kg) à une
pression de vapeur d’eau proche de la saturation. Les principales propriétés physiques des gels de silice sont données dans le tableau I.1.
Î Alumine activée
Préparée à partir de gibbsite Al(OH)3, elle présente une très grande affinité pour l’eau. Les alumines activées sont donc très hydrophiles et sont couramment utilisées pour le séchage. Les principales propriétés physiques des alumines activés sont données dans le tableau I.1.
I .2. 5 Les réfrigérants
Parmi les réfrigérants, neutre pour l’environnement, utilisés dans les systèmes frigorifiques à adsorption on peut citer l’eau, le méthanol et l’ammoniac. Le tableau I.2 donne les propriétés thermodynamiques de ces réfrigérants.
L’eau, possédant la meilleure chaleur latente de vaporisation, a l’avantage d’avoir une grande stabilité et d’être non toxique. Sa prise en glace à 0°C, limite son utilisation pour la production de froid aux basses températures.
L’ammoniac et le méthanol, de chaleur latente inférieure à celle de l’eau, ont l’avantage sur ce dernier de pouvoir produire du froid à des températures plus basses.
Il est important de noter que l’eau et le méthanol ont de faibles pressions d’utilisation, et nécessitent des unités hermétiques fonctionnant sous vide.
Par contre l’ammoniac présentant des pressions de fonctionnement élevées pose des problèmes de sécurité au niveau de l’installation.
Réfrigérant Température (°C) Chaleur latente de vaporisation (kJ kg-1) Pression vapeur (bar) 0 2485 0.0063 20 2442 0.0236 EAU 40 2397 0.0747 -30 1359 1.195 -10 1296 2.909 0 1262 4.294 Ammoniac 30 1146 11.665 -50 1190 0.01 -10 1182 0.04 Méthanol 30 1155 0.25
Tableau I.2 : Propriétés thermodynamiques de l’eau, de l’ammoniac et du méthanol [3]
I. 3 Critères de sélection du couple pour la production de froid par adsorption
La production du froid par adsorption dépend de la compatibilité du couple réfrigérant-adsorbant. Pour que les molécules du fluide frigorigène s’adsorbent sur le solide, il est nécessaire que l’adsorbant choisi ait des pores plus grands que les molécules du gaz à adsorber. A ce critère s’ajoutent les facteurs suivants :
¬Pour le solide adsorbant, il est généralement choisi en fonction de sa : conductivité thermique qui doit être grande pour avoir un bon transfert de chaleur au sein du lit d’adsorbant ;
)
capacité d’adsorption qui doit être :
plus élevée à basse température et à la pression d’équilibre dans XÎ
)
l’évaporateur,
plus faible à température élevée du cycle associée à la pression d’équilibre dans le condenseur,
YÎ
stabilité à des températures inférieures ou égales à 120°C ;
)
grande surface spécifique d’adsorption ;)
largement disponible.
)
¬Pour le fluide frigorigène, le choix est fait de telle sorte que le fluide : ait une molécule facilement adsorbable par l’adsorbant choisi.
)
possède une chaleur latente de vaporisation L élevée afin de produire le maximum de froid à l’évaporateur;
)
soit aisément adsorbable à basse température et plus difficilement à haute température;
)
ait une viscosité faible ;
)
soit stable chimiquement dans l’intervalle des températures d’utilisation ;
)
ne provoque pas la corrosion des éléments de la machine.
)
De l’analyse des propriétés, différentes, de ces fluides, il ressort que le choix du fluide dans les procédés de production du froid solaire par adsorption dépend aussi :
• des critères technologiques ou de sécurité qui peuvent éventuellement prendre le pas sur les critères thermodynamiques ;
• du domaine d’application visée :
¾ climatisation,
¾ évaporation inférieure à 0°C,
Basé sur les critères de choix cités antérieurement, les couples les plus étudiés dans le cas de la production du froid sont : zéolithe-eau, charbon actif-méthanol, charbon actif-ammoniac et silicagel-eau [4] [5] [6] [7] [8] [9 ].
I. 4 Cycle frigorifique intermittent à adsorption
I. 4. 1 Principe du cycle
La réalisation du cycle à adsorption est basée sur le principe de la réversibilité de l’adsorption physique: fixation de la vapeur du réfrigérant " adsorbat " sur l’adsorbant lorsqu’il est refroidi et libération de celle-ci lorsqu’il est chauffé. A l’équilibre thermodynamique,le système est donc bivariant. Cela signifie que la masse de réfrigérant adsorbée m à l’équilibre est une fonction de la température T et de la pression P :
(I .1)
m = f(T,P)
L’équilibre peut être décrit par :
¾ Des isobares donnant, pour des pressions constantes, la masse adsorbée en fonction de la température;
¾ Des isothermes (à températures constantes) donnant la masse adsorbée en fonction de la pression, pour plusieurs températures de l’adsorbant ;
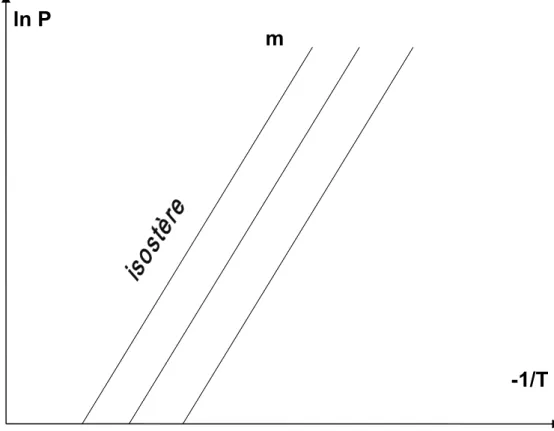
¾ Des isostères (à m adsorbée constante) donnant, pour plusieurs masses adsorbées fixées, la pression P en fonction de la température T.
Généralement les isostères se représentent de manière pratique dans le diagramme de Clapeyron (lnP, -1/T). Les droites parallèles de la figure I. 5 représentent un exemple d’isostères.
Lorsqu’on relie un échangeur de chaleur, dans lequel se trouve une masse d’adsorbant, contenant un réfrigérant, à un condenseur et un évaporateur on réalise un cycle frigorifique à adsorption.
-1/T
ln P
m
I. 4. 2 Principe de fonctionnement du cycle idéal
Le principe de fonctionnement d’un cycle thermodynamique adsorbant-réfrigérant est représenté d’abord pour un cycle idéal.
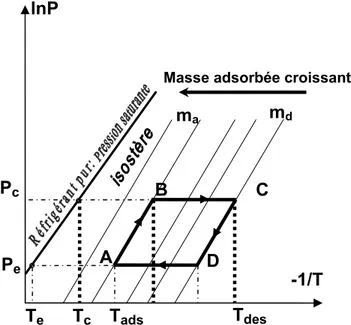
Un cycle idéal, est un cycle théorique qui ne présente pas de résistance aux transferts de masse et de chaleur. Dans le diagramme de Clapeyron, le cycle idéal est formé par deux isostères et deux isobares (figure I.6).
Le trajet thermodynamique décrit par un couple adsorbant -réfrigérant lors d’un cycle est constitué de deux phases principales:
Phase de chauffage désorption-condensation (Figure I. 7)
¬Chauffage isostérique
(AB) :Début de journée: Le capteur, isolé du condenseur et de l’évaporateur, se trouve à la température Tads (≈Ta) et à la pression Pe de l’évaporateur. Le
rayonnement solaire chauffe le capteur. La température de l’adsorbant et la pression du réfrigérant augmentent tandis que la masse totale du
réfrigérant adsorbée reste constante (au chemin isostérique). Tdes md -1/T lnP Pc Pe Tads B C D
Masse adsorbée croissante
ma
A Te Tc
Figure I. 6 : Représentation du cycle théorique à adsorption dans le diagramme de Clapeyron
Cette période est équivalente à la"compression " dans le cycle de compression classique .
JOUR
Tdes md -1/T lnP TadsMasse adsorbée croissante
B C D ma A Te Tc réfrigérant Evaporateur Chambre froide Condenseur Vanne d’isolement Pc Pe
Figure I. 7 : Phase échauffement et désorption
¬ Echauffement : Désorption-condensation
(BC)Une fois la pression dans le capteur atteint la pression de saturation correspondante à la température Tc du condenseur, ce dernier est mis en
communication avec le capteur (point B). L’énergie solaire permet simultanément l’augmentation de la température du capteur et la désorption du réfrigérant contenu dans l’adsorbant. Les vapeurs de réfrigérant libérées par l’adsorbant vont se condenser dans le condenseur et cette phase à pression imposée par le condenseur se poursuit tant que la température de l’adsorbant augmente. La désorption s’achève au point C quand l’adsorbant atteint la température maximale Tdes. Le condensat est évacué vers
l’évaporateur par simple gravité lors de sa formation. Cette période est équivalente à la"condensation " dans le cycle de compression classique.
Phase de refroidissement adsorption-évaporation (Figure I. 8)
"
¬ Refroidissement isostérique
(CD)lorsque le flux solaire diminue. La température de l'adsorbant diminue ainsi que la pression selon l’isostère (CD). Cette période est équivalente à "la
détente" dans le cycle de compression classique.
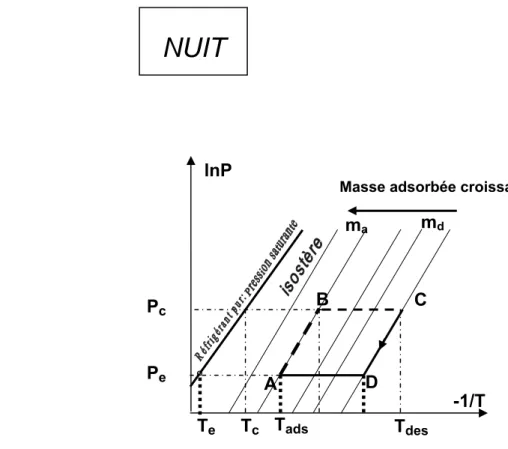
NUIT
È
Tdes md -1/T lnP TadsMasse adsorbée croissante
A B C D ma Tc Te Pc Pe
Figure I. 8 : Phase de refroidissement adsorption -condensation
¬ Refroidissement : Adsorption -Evaporation
(DA)La nuit, le capteur, connecté à l'évaporateur qui impose sa pression, continue à se refroidir. L’adsorbant se trouvant dans le capteur adsorbe le réfrigérant qui s’évapore en produisant du froid dans l’évaporateur. Cette période est équivalente à "l'évaporation " dans le cycle de compression
Ce cycle a la particularité d’être intermittent du fait que l’adsorbant est chauffé le jour et refroidi la nuit, ce qui s’adapte bien à l’intermittence de l’énergie solaire. La production du froid n’a lieu que pendant une partie du cycle (la nuit). Ce qui pose le problème de stockage du froid produit à l’évaporateur. I. 5 Définition des coefficients de performance d’une machine
frigorifique solaire à adsorption
L’évaluation des performances de la machine est déterminée à partir des quantités de chaleur Qe, Eu et E où :
Qe : est la quantité de chaleur extraite de l’évaporateur Qe =Ma L - Md Cp ( Tc- Te)
Ma masse de réfrigérant adsorbée [kg]
L chaleur latente de vaporisation du réfrigérant [J kg-1
] Md masse de réfrigérant désorbée [kg]
CP chaleur spécifique du réfrigérant [J kg-1
K-1] Tc température du condenseur [K]
Te température de l’évaporateur [K]
Le premier terme de Qe correspond au froid produit à l’évaporateur lors de l’évaporation de Ma. Le deuxième terme de Qe correspond à la chaleur
sensible du réfrigérant pour l’amener de Tc à Te.
Eu: est l’irradiation nécessaire pour effectuer la désorption augmentée de la chaleur sensible des différents composants du capteur.
∫
Ι = findeladésorption soleil du lever (t)dt A Eu av(I .2)
(I .3)
E : est l’irradiation globale reçue par la face avant du capteur.
∫
Ι = couchédesoleil soleil du lever (t)dt E Aav av solA : surface avant du capteur [m
où 2]
I : irradiance reçue par la face avant du capteur [Wm
-2]
(I .4)
Le coefficient de performance thermique COPth et le coefficient de performance
solaire COP sont donnés par les relations suivantes :
COPsol= QE e
(I.5)
COPth= QEe
u
(I.6)
Le rendement de captation est donné par :
η
= COPth COPsol =Eu E
(I.7)
I. 6 Isothermes d’adsorption
La quantité de réfrigérant ma adsorbée à l’équilibre pour une température donnée
T est fonction de la pression P :
ma= f(P)T
(I.8)
Les isothermes d’adsorption sont souvent déterminées expérimentalement en utilisant des méthodes gravimétriques, volumétriques ou chromatographiques
[10] [11]. Ces mesures expérimentales sont ensuite corrélées par des modèles
expérimentales, dans une plage étendue de pression et de températures. En pratique, il est toujours recommandé de rechercher et d’utiliser des modèles ayant à la fois une signification physique, en accord avec les lois fondamentales de la thermodynamique et des facilités de traitement numérique pour les simulations des procédés d’adsorption.
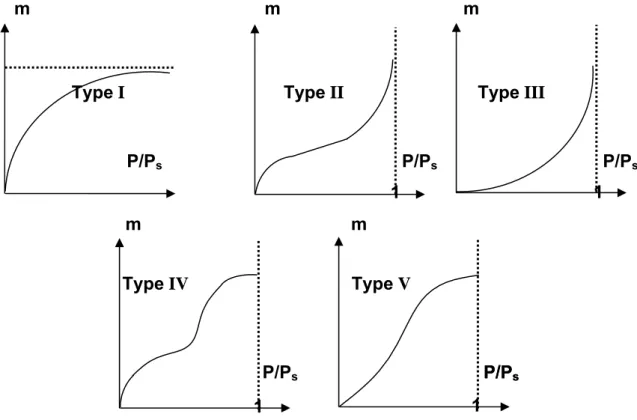
Les isothermes d’adsorption ont des formes variables et peuvent être regroupées en cinq types (figure I.9) selon LANGMUIR, BRUNAUER, EMETT et TELLER [ 2]
[ 12] [ 13] :
¬ Type I : Sont généralement obtenus dans le cas des adsorbants microporeux avec une saturation progressive des sites d’adsorption sensiblement équivalents.
¬ Type II et III : Sont observés avec les adsorbants ayant des distributions larges des tailles de pores avec une transition continue de l’adsorption en monocouche à l’adsorption en multicouche jusqu’à la condensation capillaire.
¬ Type IV : Peut résulter de la formation de deux couches successives d’adsorbat à la surface du solide quand les interactions entres les molécules du réfrigérant et la surface solide sont plus fortes que les interactions entre les molécules adsorbées. Dans ce cas, les sites d’adsorption de la seconde couche ne commencent à se remplir que quand la première couche est à peu près complète.
¬Type V : Contrairement au type IV les forces d’interaction entre les molécules adsorbées sont plus fortes que les forces d’interaction entre les molécules du réfrigérant et le solide.
m m m
Plusieurs modèles d’isothermes d’adsorption ont été développés, basés soit sur une approche de surface qui considère que l’adsorption est un phénomène de surface, soit sur une approche de volume qui considère que l’adsorption est un phénomène de remplissage de volume. Parmi les approches les plus courantes de la théorie d’adsorption physique citons :
I. 6. 1 Le modèle de Langmuir
Langmuir (1916) a développé le modèle d’adsorption monomoléculairefondé sur des bases théoriques en faisant les hypothèses suivantes:
La chaleur d’adsorption est la même pour toutes les molécules de réfrigérant ;
L’adsorption se produit en une seule couche c'est-à-dire si une molécule de réfrigérant arrive sur une surface déjà occupée par une molécule adsorbée, elle sera immédiatement réfléchie (Figure I. 10);
Figure I. 9 :les différents types d’isothermes d’adsorption Ps: est la pression saturante de l’adsorbat
XÎ
P/Ps
Type I Type II Type III
P/Ps P/Ps 1 1 Type IV Type V m m 1 P/Ps P/Ps P/Ps 1 YÎ
Il n’y a pas d’interactions entre les molécules adsorbées. ZÎ
Quand le comportement des molécules adsorbées ne dévie pas beaucoup des hypothèses de Langmuir les isothermes d’adsorption sont données par [2] [14]
avec q : la fraction adsorbée,
m : la masse de réfrigérant adsorbée par unité de masse d’adsorbant,
m0 : la masse de réfrigérant nécessaire pour remplir une couche monomoléculaire par une masse d’adsorbant , P : la pression d’équilibre d’adsorption,
b : la constante de Langmuir.
Le paramètre b dépend de la température selon la relation de Van’t Hoff :
Q est la chaleur d'adsorption.
(I.9)
(I.10)
m m q= bP 1 bP = + 0 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = RT Q exp b b 0Le modèle de Langmuir représente bien les isothermes d’adsorption de type I. • Aux basses pressions, bP est négligeable devant 1, et q tend vers bP, la
quantité adsorbée croît linéairement avec la pression : c’est la loi de Henry.
• Vers les pressions élevées, 1 est négligeable devant bP et q tends vers 1 (la couche est saturée).
• Entre les faibles Pressions où q varie linéairement avec P, et les fortes Pressions où q est égale à 1, on trouve le modèle empirique de Freundlich où :
kP
q
=
1/n(I.11)
avec
ions entre l’adsorbat et l’adsorbant.
I. 11 résume l’ensemble des expressions de q en fonction de la pression k la constante de Freundlich,
n une constante caractéristique des interact La figure relative. q P/Ps q = 1 q = kP1/n q = bP bP + 1 q = bP
Figure I. 11 : Représentations de Henry, Langmuir et de Freundlich de l’adsorption en monocouche
Les isothermes de Freundlich et de Langmuir s’appliquent à la partie arrondie de la courbe q = f(P/PS ). Les deux asymptotes correspondent aux cas limites. Les isothermes d’adsorption de Langmuir, uniquement valables pour des surfaces énergétiquement homogènes, s’appliquent relativement bien au cas de l’adsorption chimique. Notons qu’à l’origine Langmuir a établi son équation pour le cas de l’adsorption chimique.
Certains solides, par contre, présentent des surfaces hétérogènes où les sites d’adsorption sont de nature différente. Par exemple la structure ionique des zéolithes leur confère une surface hétérogène. Pour les charbons actifs l’hétérogénéité est due aux pores de différentes tailles.
Le modèle de Langmuir- Freundlich permet dans ce cas là de représenter les isothermes d’adsorption : P 1 bP q n n + =
(I.12)
avec n une constante caractéristique des interactions entre le réfrigérant et l’adsorbant, qui est généralement inférieur à 1.
Le modèle de Langmuir-Freundlich se réduit au modèle de Langmuir pour n = 1.
I. 6. 2 Modèle de BET
Les isothermes d’adsorption de type I c'est-à-dire dont la courbe tend vers une valeur constante (saturation) supposent que l’adsorption se fait en monocouche. Cependant lorsque les forces entre les molécules du réfrigérant et la surface du solide sont suffisamment grande, il y a transition de l’adsorption en monocouche à l’adsorption en multicouche.
Langmuir et autres après lui ont essayé d’établir une équation pour les isothermes d’adsorption dans le cas de l’adsorption en multicouches.
Le travail qui a eu le plus de succès est celui de Brunauer, Emmett et Teller(1938).
Ce travail connue sous le nom de modèle de BET est basée sur une adsorption en multicouche où chacune des couches obéit à la théorie de Langmuir [12]. En effet, quand on étudie les isothermes d’adsorption des gaz à des basses températures sous des pressions pouvant atteindre les pressions de saturation du gaz liquéfié, on obtient des courbes du type II, avec une partie concave (vers l’axe des pressions), aux basses pressions, et au contraire une partie convexe aux hautes pression (figure I.9). Brunauer, Emmett et Teller ont donné une interprétation théorique à l’isotherme type II, en étendant le raisonnement de Langmuir à l’adsorption plurimoléculaires. D’après eux, suivant les points, la surface peut être recouverte de 0, 1, 2, 3,……,i,….. couches moléculaires de l’adsorbat (figure I. 12).
Soit :
S0 la portion de surface inoccupée du solide ;
S1 la portion de surface occupée par une couche d’adsorbat ;
S2 la portion de surface occupée par deux couches d’adsorbat ;
Si la portion de surface occupée par i couches d’adsorbat ;
Sn la portion de surface occupée par n couches d’adsorbat ;
Sur chaque couche, il y a équilibre dynamique entre le nombre de molécules qui s’adsorbent et celles qui se désorbent. On peut donc, sur chaque couche à l’équilibre, admettre que la surface demeure constante. Par exemple, la couche d’ordre 2 se forme par adsorbtion sur la couche d’ordre un plus la désorption de la couche d’ordre 3. La disparition de cette couche d’ordre 2 se fait par désorption de cette couche plus la formation de la troisième couche.
on suppose ensuite que la vitesse d’évaporation des molécules adsorbées dans une couche d’ordre j est égale à la vitesse de condensation sur la couche d’ordre j-1, et que seul la formation de la première couche est énergétique, les autres couches subissent une simple condensation. En se basant sur ces hypothèses, Brunauer, Emmett et Teller [12] [14], proposent une équation de forme générale en considérant un nombre fini de couches n:
⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ + + − − + + n + − − = 1 n 1 n ( n ) P / P ( C ) P / P ( 1) (C 1 ) P / P ( ) P / 1) (n 1 ) P / P ( 1 ) P / P ( C m m q S S S S S S 0 P
(I.13)
=avec q : la fraction adsorbée,
m : la masse adsorbée par unité de masse d’adsorbant, m0 : la masse d’adsorbat nécessaire pour former une couche monomoléculaire par une masse d’adsorbant ,
n : le nombre de couches moléculaires d’adsorbat,
C : la constante caractéristique de l’adsorbat, qui prend la valeur approximative : ) RT Q Q exp( C= 1− L de la formation des couches supérieures.
rante de l’adsorbat à la température considérée.
gmuir. Pour un nombre infini de couches (nÆ∞), l’équation (I.13) s’écrit donc :
on Brunauer, Emmett et Teller peut avantageusement être mise sous la forme :
Cette forme est commode, car, elle montre que
avec Q1 est la chaleur d’adsorption de la première couche, QL est la chaleur de liquéfaction, donc
P : la pression d’équilibre d’adsorption, Ps : la pression de vapeur satu
Pour n = 1, l’équation (I.13) se réduit à celle de Lan
L’équati ⎥⎦ ⎢⎣ s s P P
(I.14)
(I.15)
P P Cm 1 -C Cm 1 m ) P -P ( P s s 00 + = ⎥ ⎥ ⎥ ⎤ ⎢ ⎢ ⎢ ⎡ + = = s P ) 1 -C ( 1 1 ) P -1 ( P P C m m q 0 m ) P P ( P s−
est une fonction
linéaire de ( − ) Ps P d’ordonnée à l’origine Cm0 1 et de pente Cm0
De cette ordonnée à l’origine et de la pente on déduit aussitôt la valeur de m 1
C
.
0, masse du gaz correspondante à la formation d’une monocouche. La théorie de
BET a rendu des services précieux en fournissant ainsi un moyen d’estimer la surface spécifique d’un adsorbant. La méthode consiste à déterminer la quantité adsorbée sur la première couche à partir d’une isotherme d’adsorption, généralement obtenue avec l’azote à une température cryogénique (T=78 K) ; la surface des pores est ensuite calculée en supposant que les molécules d’adsorbat recouvrent complètement la surface solide [2]
[16]. Ceci constitue l’application la plus importante de l’équation de BET. La linéarité de l’équation BET n’est en général observée que dans un intervalle de
ression relative limité est telle que :
des tailles conduit généralement à des isothermes d’adsorption de type II ou III.
volume d’adsorbat W est uniquement une fonction du potentiel de ce champ ε : av P la pression d’équilibre. 0.05< P/PS < 0.35 W = f( p
Le modèle de BET est utile pour décrire les systèmes gaz-adsorbant avec condensation capillaire dans les pores dont la distribution
I. 6. 3 Modèles thermodynamique de Dubinin-Polanyi
Il s’agit de modèles où le concept de recouvrement en surface, dans le modèle moléculaire, est remplacé par la notion de remplissage en volume des pores notamment pour les adsorbants contenant un grand nombre de micropores avec l’application de la théorie du potentiel de Polanyi [13][15]. Avec cette approche, on considère que les interactions entre les molécules du réfrigérant et la surface d’adsorbant sont déterminées par un champ de potentiel et que le
ε)
(I.16)
où
ε
= RTln(Ps/P),ec Ps la pression saturante,
Le modèle empirique proposé par Dubinin-Radushkevich est donné par :
ale adsorbable par unité de masse d’adsorbant,
β un paramètre de normalisation.
duit un paramètre supplémentaire n lié à la distribution des tailles de pores :
ramme d’adsorbant à la température T et à la ression P est donnée par :
rant prise approximativement égale à celle du liquide à la même température.
male du réfrigérant adsorbée par kg d’adsorbant est aussi do
yi réside dans leur inconsistance thermodynamique aux faibles pressions [2].
m0 =ρ(T) w0
(I.20)
W = W0 exp(-kε2/β2)
(I.17)
avec W le volume adsorbé par unité de masse d’adsorbant, W0 le volume maxim
k une constante,
Un autre modèle utilisant la même approche est proposé par Dubinin-Astakhov. qui intro
W = W0 exp(-kεn/βn)
(I.18)
La masse adsorbée par kilog p
m(T,P) = ρ(T) W
(I.19)
ρ(T) est la masse volumique du réfrigé
La masse maxi nnée par :
I. 7 Isostères d’adsorption
isostères sont représentées par l'équation empirique de type Clausius Clapeyron :
Q est la chaleur d’adsorption,
La relation donnant les pressions d’équilibre en fonction de la température pour une quantité de réfrigérant m constante est appelée isostère. Généralement les
∆V est la variation de volume molaire entre la phase gazeuse et la phase adsorbée.
ans la phase gazeuse, et si on suppose que le gaz est parfait, on peut écrire :
est la constante des gaz parfait ;
I. 22),
’intégration de l’équation (I. 23) permet d’écrire :
Si l’on néglige le volume molaire du corps adsorbé en comparaison avec celui d
R
et, par suite d’après l’équation (I. 21) et ( L C RT Q -P ln = +
(I.21)
V T Q T P m ∆ = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂(I.22)
P V= ∆(I.23)
2 m RT Q T P ln = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂(I.24)
RToù C est une constante.
Donc lnP est une fonction linéaire de 1/T) qui peut s’écrire pour un couple
(-donné sous la forme :
T B A P ln = +
A et B sont respectivement l’abscisse à l’origine et la pente pour chaque
ture, les isostères sont linéaires dans le diagramme de Clapeyron, donc A t B sont fonction de m seule nt, on peut alors écrire d’après l’équation (I.24) et
ù A(m) et B(m) sont des fonctions polynomiales de m seulement, et le tracé des
dsorption peut donc être déterminée à partir d’une droite
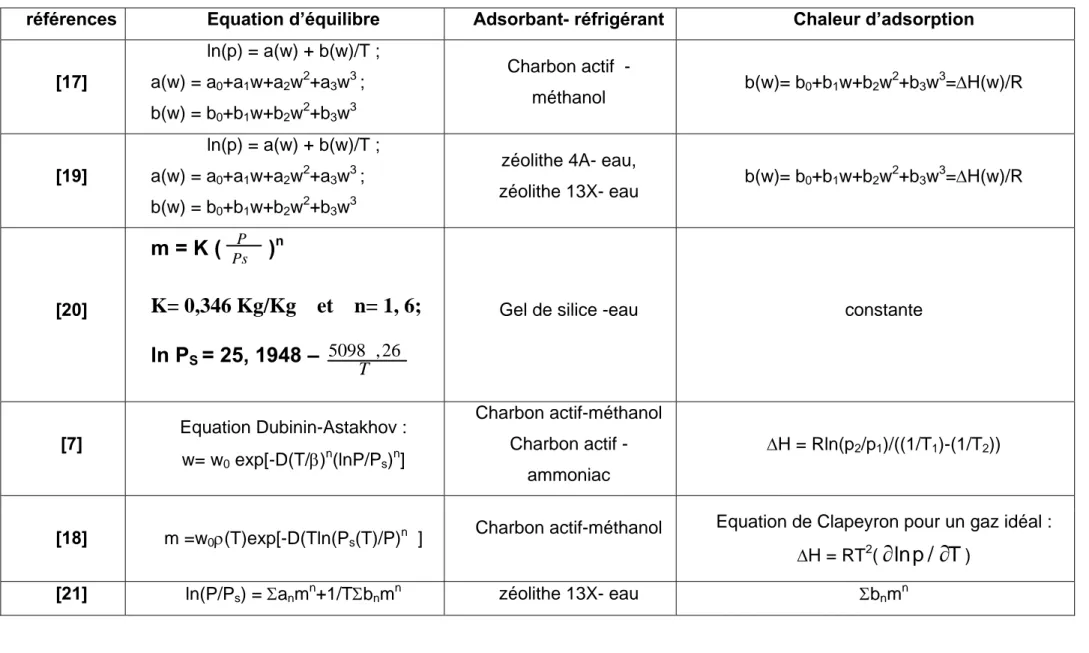
Des exemples d’équations d’équilibre et de chaleurs d’adsorption sont données dans le tableau I. 3 pour plusieurs couples adsorbant réfrigérant.
(I.25)
isostère m.
Si dans un certain domaine de température Q et C sont indépendants de la tempéra e me (I.25) : C= A(m)
et B(m) = − R
(I.26)
Q Oisostères expérimentales permet de les calculer [17] [18].
De ce fait, la chaleur d’a
représentant la variation de ln P en fonction de (-1/T) dans le diagramme de Clapeyron (figure I. 5).
références Equation d’équilibre Adsorbant- réfrigérant Chaleur d’adsorption [17] ln(p) = a(w) + b(w)/T ; a(w) = a0+a1w+a2w2+a3w3 ; b(w) = b0+b1w+b2w2+b3w3 Charbon actif - méthanol b(w)= b0+b1w+b2w 2 +b3w3=∆H(w)/R [19] ln(p) = a(w) + b(w)/T ; a(w) = a0+a1w+a2w2+a3w3 ; b(w) = b0+b1w+b2w2+b3w3
zéolithe 4A- eau,
zéolithe 13X- eau b(w)= b0+b1w+b2w 2 +b3w3=∆H(w)/R [20]
m = K (
Ps P)
nK= 0,346 Kg/Kg et n= 1, 6;
ln P
S= 25, 1948 –
T 26 , 5098Gel de silice -eau constante
[7] Equation Dubinin-Astakhov : w= w0 exp[-D(T/β)n(lnP/Ps)n] Charbon actif-méthanol Charbon actif -ammoniac ∆H = Rln(p2/p1)/((1/T1)-(1/T2))
[18] m =w0ρ(T)exp[-D(Tln(Ps(T)/P)n ] Charbon actif-méthanol
Equation de Clapeyron pour un gaz idéal : ∆H = RT2(
∂
ln
p
/
∂
T
)[21] ln(P/Ps) = Σanmn+1/TΣbnmn zéolithe 13X- eau Σbnmn
Tableau I.3 : Exemples d’équations d’équilibre et de chaleurs d’adsorption
CHAPITRE
II
: EXEMPLES DE PROTOTYPES DE
REFRIGERATEURS SOLAIRES A ADSORPTION
A travers le monde, des équipes de recherche s’intéressent à ce type de machine de production de froid. Ces équipes se sont consacrées au début à l’établissement de modèles de machines frigorifiques solaires [22] [23] [24] permettant de simuler le fonctionnement de la machine frigorifique à partir des données solaires réelles. D’autres équipes sont passées au stade de l’expérimentation sous un soleil artificiel
[25] [26] [9] où réel [27] [28]. Nous allons citer, selon le couple adsorbant réfrigérant utilisé, quelques réalisations expérimentables de machines frigorifiques solaires à adsorption qui ont été couronnées de succès.
II
. 1 Prototype utilisant le couple zéolithe- eauL’eau ne pouvant s’évaporer à des températures inférieures à zéro °C, le couple zéolithe–eau est limité au domaine où la température est supérieure ou égale à zéro °C. S’il s’agit simplement de maintenir un volume à quelques degrés au dessus de zéro °C, une évaporation à zéro °C suffit. De ce fait, ce couple est plus adapté au domaine de la climatisation.
A la fin des années 70 Tchernev [29] a étudié ce couple pour la climatisation. Wang [30] a aussi utilisé ce couple pour la climatisation d’une locomotive de train.
Meunier, un des pionniers dans le domaine de l’adsorption, a étudié théoriquement et expérimentalement le couple zéolithe eau [31] [32] [33] et montré que ce couple est le plus adapté pour l’obtention de températures supérieures où égales à 0°C. Son équipe a réalisé deux installations expérimentales:
• Une glacière solaire de volume de 150 litres. Le capteur, de surface égale à 0.8 m2, contient 23kg de zéolithe13X [34]. La quantité moyenne de glace produite à l’évaporateur est de 7.5 kg par m2
de capteur. Le coefficient de performance solaire obtenu est de l’ordre de 0,1.
• Grenier et al [35] ont étudié un entrepôt frigorifique de volume 12 m3 muni de 24 capteurs plans dont la surface est 20 m2. Les performances ont
montré que le COP solaire est toujours voisin de 0.1, correspondant à une production de glace dans l’évaporateur de 7kg par m2 de capteur et permettant de maintenir un écart de 20°C entre la température ambiante et les produits entreposés dans la chambre froide.
Figure II.1 : photo de l’entrepôt frigorifique solaire à adsorption
Le couple le plus étudié dans le domaine de la réfrigération solaire par adsorption est le charbon actif méthanol en raison de sa capacité à produire du froid à des températures inférieures à 0°C.
Une machine à glace solaire à adsorption a été réalisée par l’équipe de Meunier à Orsay [22] en France. La surface du capteur plan est de 6m2 et la masse du charbon actif est 135 kg. La masse de glace produite à l’évaporateur était de 30 à 35 kg et le COP solaire variait entre 0.07 et 0.12.
Trois machines à glace, réalisées et commercialisées par la société BLM –France sous licence CNRS –LMSI, ont été expérimentées dans le site d’Agadir (Sud du Maroc) [36]. L’analyse des résultats obtenus, durant la période 22 mai - 17 juillet 1990, montre que le COP solaire obtenu variait entre 0.08 et 0.12 du même ordre de grandeur que celui de la machine à glace solaire expérimentée au LIMSI [22] et que la masse de glace produite à l’évaporateur, chaque jour, était de 5.2 kg par m2 de surface de captation solaire.
Anyanwu et Ezekwe [37] ont fabriqué et testé un prototype de réfrigérateur solaire à charbon actif- méthanol. Contrairement aux autres réalisations que nous venons de citer, le capteur, de surface 12 m2, est constitué de 6 tubes en acier inoxydable remplis de charbon actif AC35. Les températures obtenues dans la chambre froide du réfrigérateur étaient comprises entre 1°C et 8.5 °C pour une température ambiante entre 18.5 °C et 34 °C.
A l’université de Jiao Tang de Shangai en chine, l’équipe de Li et Wang a étudié une installation hybride [38] [39] utilisant le couple charbon actif–méthanol. Ce système comporte un chauffe -eau solaire et une machine à glace à adsorption. L’installation est représentée sur la figure II.2.
4 3 2 Eau sanitaire froide Eau sanitaire chaude 1 5 6 7 8
1 Chauffe eau solaire
2 Réservoir d’eau
3 Capteur contenant l’adsorbant 4 Condenseur
5 Réservoir méthanol 6 Vanne
7 Evaporateur 8 Chambre froide
Figure II. 2: schéma de la machine hybride solaire à adsorption
Dans ce cas d’expérimentation, le générateur sous forme cylindrique (contenant le charbon actif) est placé dans un réservoir d’eau.
Le jour, le chauffe-eau solaire chauffe l’eau du réservoir contenant le générateur. La nuit, l’eau chaude, retirée du chauffe-eau, est stockée dans un autre réservoir pour une utilisation ultérieure domestique et remplacée ensuite par l’eau du réseau. Ainsi, le générateur refroidi provoque la production de la glace dans l’évaporateur. Ce système permet, pour un capteur de 2 m2, de produire 60 litres d’eau chaude à des températures autour de 80 °C et 10 kg de glace par jour.
A l’université de la province de Yunnan en Chine, l’équipe de Li et Wang ont construit et testé une machine à glace solaire autonome, sans vannes et sans réservoir de méthanol [40], utilisant le couple charbon actif–méthanol.
Cette machine testée d’abord sous des conditions climatiques réelles a donné des COP solaires entre 0.12 et 0.13. Ensuite elle a fonctionné à l’intérieur du laboratoire sous un ensoleillement artificiel (reproduisant les valeurs des ensoleillements réels reçus par l’unité sous des conditions climatiques réelles).
Les COP solaires obtenus étaient situés entre 0.137 et 0.146 plus importants que lorsque l’unité était sous ensoleillement réel. De ce travail, on peut remarquer que le
conditions climatiques (température ambiante, vitesse du vent, ensoleillement...) influencent les performances de la machine. Ceci sera montré dans ce travail.
II
.3 Prototype utilisant le couple gel de silice –eauLe couple gel de silice-eau a été moins étudié que les couples zéolithe –eau et charbon actif-méthanol.
Sakoda [41] a étudié un prototype expérimental utilisant le couple silicagel-eau. Le capteur, de 0.25 m2 de surface et d’épaisseur 5 cm, contient 1kg de gel de silice. L’unité a pu atteindre un COP thermique de 0.2 pour une journée claire d’insolation égale à 19.3 MJ par m2. D’après Sakoda, le COP thermique peut atteindre 0.4 pour un capteur solaire de 0.4 m2.
En Suisse, au sein du Laboratoire d’Energétique Solaire et de Physique du Bâtiment (EIVD), l’équipe de Philippe Dind a construit et expérimenté, durant le mois de septembre 2000, un prototype de réfrigérateur solaire à adsorption [42] utilisant le couple gel de silice-eau. Dans ce travail le capteur à tubes dont la surface est de 2 m2 est muni d’un double- vitrage. Testé au laboratoire sous ensoleillement artificiel, les performances du système ont montré que le COP solaire brut pouvait atteindre 0.19. Cette valeur est supérieure à celles atteintes par d’autres systèmes de réfrigération solaire sous des conditions climatiques réelles.
II
.4 Prototype utilisant le couple charbon actif- ammoniacLe couple charbon actif-ammoniac a été étudié principalement par Critoph [7] [43]
[44] [45] [46] qui a montré que (lorsque les pressions de fonctionnement sont
supérieures à la pression atmosphérique) l’ammoniac est le réfrigérant le mieux adapté pour la production du froid quand l’adsorbant est du charbon actif.
Sous ensoleillement artificiel, Critoph a étudié un réfrigérateur solaire à adsorption utilisant le couple charbon actif –ammoniac [25]. Le capteur composé de 14 tubes, de 2 m de long, en acier inoxydable, a une surface de captation d’environ 1.43 m2. Ces tubes sont revêtus d’une surface sélective (MaxorbTM ). Une masse de 17 kg de charbon actif est répartie dans les tubes du capteur. Un condenseur à eau, formé par un tube de 4 m de long en acier inoxydable, est immergé dans un réservoir de 100

![Tableau I.2 : Propriétés thermodynamiques de l’eau, de l’ammoniac et du méthanol [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/2195396.11943/22.892.117.779.162.782/tableau-proprietes-thermodynamiques-l-eau-l-ammoniac-methanol.webp)