Université de Lille
Année Universitaire 2018/2019
Faculté de Pharmacie de Lille
THESE
POUR LE DIPLOME D'ETAT
DE DOCTEUR EN PHARMACIE
Soutenue publiquement le 30 septembre 2019
Par Monsieur Bosio Thomas
_____________________________
OPEN LABEL PLACEBOS : INTERETS CLINIQUES ET ECONOMIQUES
_____________________________
Membres du jury :
Président : Bertrand Décaudin, doyen de la Faculté de Pharmacie de Lille
Directeur, conseiller de thèse : Claire Pinçon, MCU à la Faculté de Pharmacie de
Lille
Assesseur(s) : Jean-Marc Lefebvre, PA de médecine à Hem
Pascal Odou, PU PH à Lille
Université de Lille
Président : Jean-Christophe CAMART
Premier Vice-président : Damien CUNY
Vice-présidente Formation : Lynne FRANJIÉ
Vice-président Recherche : Lionel MONTAGNE
Vice-président Relations Internationales : François-Olivier SEYS
Directeur Général des Services : Pierre-Marie ROBERT
Directrice Générale des Services Adjointe : Marie-Dominique SAVINA
Faculté de Pharmacie
Doyen : Bertrand DÉCAUDIN
Vice-Doyen et Assesseur à la Recherche : Patricia MELNYK
Assesseur aux Relations Internationales : : Philippe CHAVATTE
Assesseur à la Vie de la Faculté et aux
Relations avec le Monde Professionnel : Thomas MORGENROTH
Assesseur à la Pédagogie : Benjamin BERTIN
Assesseur à la Scolarité : Christophe BOCHU
Responsable des Services : Cyrille PORTA
Liste des Professeurs des Universités - Praticiens Hospitaliers
Civ. NOM Prénom Laboratoire
Mme ALLORGE Delphine Toxicologie
M. BROUSSEAU Thierry Biochimie
M. DÉCAUDIN Bertrand Pharmacie Galénique
M. DEPREUX Patrick ICPAL
M. DINE Thierry Pharmacie clinique
Mme DUPONT-PRADO Annabelle Hématologie
M. GRESSIER Bernard Pharmacologie
M. LUYCKX Michel Pharmacie clinique
M. ODOU Pascal Pharmacie Galénique
M. STAELS Bart Biologie Cellulaire
Faculté de Pharmacie de Lille
3, rue du Professeur Laguesse - B.P. 83 - 59006 LILLE CEDEX 03.20.96.40.40 - : 03.20.96.43.64
Liste des Professeurs des Universités
Civ. NOM Prénom Laboratoire
M. ALIOUAT El Moukhtar Parasitologie
Mme AZAROUAL Nathalie Physique
M. BERTHELOT Pascal Onco et Neurochimie
M. CAZIN Jean-Louis Pharmacologie – Pharmacie clinique
M. CHAVATTE Philippe ICPAL
M. COURTECUISSE Régis Sciences végétales et fongiques
M. CUNY Damien Sciences végétales et fongiques
Mme DELBAERE Stéphanie Physique
M. DEPREZ Benoît Lab. de Médicaments et Molécules
Mme DEPREZ Rebecca Lab. de Médicaments et Molécules
M. DUPONT Frédéric Sciences végétales et fongiques
M. DURIEZ Patrick Physiologie
M. FOLIGNE Benoît Bactériologie
M. GARÇON Guillaume Toxicologie
Mme GAYOT Anne Pharmacotechnie Industrielle
M. GOOSSENS Jean François Chimie Analytique
M. HENNEBELLE Thierry Pharmacognosie
M. LEMDANI Mohamed Biomathématiques
Mme LESTAVEL Sophie Biologie Cellulaire
M. LUC Gerald Physiologie
Mme MELNYK Patricia Onco et Neurochimie
M. MILLET Régis ICPAL
Mme MUHR – TAILLEUX Anne Biochimie
Mme PAUMELLE-LESTRELIN Réjane Biologie Cellulaire
Mme PERROY Anne Catherine Législation
Mme ROMOND Marie Bénédicte Bactériologie
Mme SAHPAZ Sevser Pharmacognosie
M. SERGHERAERT Eric Législation
Mme SIEPMANN Florence Pharmacotechnie Industrielle
M. SIEPMANN Juergen Pharmacotechnie Industrielle
M. WILLAND Nicolas Lab. de Médicaments et Molécules
Liste des Maîtres de Conférences - Praticiens Hospitaliers
Civ. NOM Prénom Laboratoire
Mme BALDUYCK Malika Biochimie
Mme GARAT Anne Toxicologie
Mme GOFFARD Anne Bactériologie
M. LANNOY Damien Pharmacie Galénique
Mme ODOU Marie Françoise Bactériologie
Liste des Maîtres de Conférences
Civ. NOM Prénom Laboratoire
Mme ALIOUAT Cécile Marie Parasitologie
M. ANTHERIEU Sébastien Toxicologie
Mme AUMERCIER Pierrette Biochimie
Mme BANTUBUNGI Kadiombo Biologie cellulaire
Mme BARTHELEMY Christine Pharmacie Galénique
Mme BEHRA Josette Bactériologie
M BELARBI Karim Pharmacologie
M. BERTHET Jérôme Physique
M. BERTIN Benjamin Immunologie
M. BLANCHEMAIN Nicolas Pharmacotechnie industrielle
M. BOCHU Christophe Physique
M. BORDAGE Simon Pharmacognosie
M. BOSC Damien Lab. de Médicaments et Molécules
M. BRIAND Olivier Biochimie
M. CARNOY Christophe Immunologie
Mme CARON Sandrine Biologie cellulaire
Mme CHABÉ Magali Parasitologie
Mme CHARTON Julie Lab. de Médicaments et Molécules
M CHEVALIER Dany Toxicologie
M. COCHELARD Dominique Biomathématiques
Mme DANEL Cécile Chimie Analytique
Mme DEMANCHE Christine Parasitologie
Mme DEMARQUILLY Catherine Biomathématiques
M. DHIFLI Wajdi Biomathématiques
Mme DUMONT Julie Biologie cellulaire
Mme DUTOUT-AGOURIDAS Laurence Onco et Neurochimie
M. EL BAKALI Jamal Onco et Neurochimie
M. FARCE Amaury ICPAL
Mme FLIPO Marion Lab. de Médicaments et Molécules
Mme FOULON Catherine Chimie Analytique
M. FURMAN Christophe ICPAL
Mme GENAY Stéphanie Pharmacie Galénique
M. GERVOIS Philippe Biochimie
Mme GOOSSENS Laurence ICPAL
Mme GRAVE Béatrice Toxicologie
Mme GROSS Barbara Biochimie
M. HAMONIER Julien Biomathématiques
Mme HAMOUDI Chérifa Mounira Pharmacotechnie industrielle
Mme HANNOTHIAUX Marie-Hélène Toxicologie
Mme HELLEBOID Audrey Physiologie
M. HERMANN Emmanuel Immunologie
M. KAMBIA Kpakpaga Nicolas Pharmacologie
M. KARROUT Youness Pharmacotechnie Industrielle
Mme LALLOYER Fanny Biochimie
Mme LECOEUR Marie Chimie Analytique
Mme LEHMANN Hélène Législation
Mme LELEU-CHAVAIN Natascha ICPAL
Mme LIPKA Emmanuelle Chimie Analytique
Mme MARTIN Françoise Physiologie
M. MOREAU Pierre Arthur Sciences végétales et fongiques
M. MORGENROTH Thomas Législation
Mme MUSCHERT Susanne Pharmacotechnie industrielle
Mme NIKASINOVIC Lydia Toxicologie
Mme PINÇON Claire Biomathématiques
M. PIVA Frank Biochimie
Mme PLATEL Anne Toxicologie
M. POURCET Benoît Biochimie
M. RAVAUX Pierre Biomathématiques
Mme RAVEZ Séverine Onco et Neurochimie
Mme RIVIERE Céline Pharmacognosie
Mme ROGER Nadine Immunologie
M. ROUMY Vincent Pharmacognosie
Mme SEBTI Yasmine Biochimie
Mme SINGER Elisabeth Bactériologie
Mme STANDAERT Annie Parasitologie
M. TAGZIRT Madjid Hématologie
M. VILLEMAGNE Baptiste Lab. de Médicaments et Molécules
M. WELTI Stéphane Sciences végétales et fongiques
M. YOUS Saïd Onco et Neurochimie
M. ZITOUNI Djamel Biomathématiques
Professeurs Certifiés
Civ. NOM Prénom Laboratoire
M. HUGES Dominique Anglais
Mlle FAUQUANT Soline Anglais
M. OSTYN Gaël Anglais
Professeur Associé - mi-temps
Civ. NOM Prénom Laboratoire
M. DAO PHAN Hai Pascal Lab. Médicaments et Molécules
M. DHANANI Alban Droit et Economie Pharmaceutique
Maîtres de Conférences ASSOCIES - mi-temps
Civ. NOM Prénom Laboratoire
M. BRICOTEAU Didier Biomathématiques
Mme CUCCHI Malgorzata Biomathématiques
M. FRIMAT Bruno Pharmacie Clinique
M. GILLOT François Droit et Economie pharmaceutique
M. MASCAUT Daniel Pharmacie Clinique
M. ZANETTI Sébastien Biomathématiques
AHU
Civ. NOM Prénom Laboratoire
Mme DEMARET Julie Immunologie
Mme HENRY Héloïse Biopharmacie
Remerciement
Merci à Monsieur Bertrand Décaudin d’avoir bien voulu accepter d’être le président du jury,
malgré ses obligations de doyen.
Merci à Monsieur Pascal Odou de s’être intéressé à mon sujet et d’avoir participé à la diffusion
du questionnaire.
Merci à Madame Claire Pinçon pour son indéfectible soutien tout le long de ce long projet.
Merci à Monsieur Jean-Marc Lefebvre de s’être intéressé à mon sujet.
Faculté de Pharmacie de Lille
3, rue du Professeur Laguesse - B.P. 83 - 59006 LILLE CEDEX Tel. : 03.20.96.40.40 - Télécopie : 03.20.96.43.64
http://pharmacie.univ-lille2.fr
L’Université n’entend donner aucune approbation aux opinions
émises dans les thèses ; celles-ci sont propres à leurs auteurs.
Table des matières
Glossaire ... 3
1
Introduction... 5
2
Le Placebo ... 7
2.1 Origine du placebo ... 7 2.1.1 Etymologie ...72.1.2 Placebo avant la Seconde Guerre Mondiale ...7
2.1.3 Placebo dans la recherche clinique ...8
2.1.4 De « l’humble tromperie » au « puissant placebo » ...9
2.2 Définition du placebo et de l’effet placebo ... 9
2.3 Mécanismes de l’effet placebo ... 10
2.3.1 L’attente et le circuit de récompense du cerveau ... 10
2.3.2 Le conditionnement pavlovien ou conditionnement classique : la réponse neuro immunitaire ... 11
2.3.3 Relation entre les deux mécanismes ... 12
2.3.4 Le rôle du genre dans le placebo ... 13
2.4 L’utilisation actuelle du placebo... 13
2.4.1 Dans les essais cliniques ... 13
2.4.2 En vie réelle ... 14
2.5 Le dilemme éthique du placebo ... 14
2.5.1 En vie réelle ... 14
2.5.2 Dans les essais cliniques ... 16
3
L’open label placebo... 19
3.1 Histoire de l’open label placebo... 19
3.1.1 Emergence et naissance du concept ... 19
3.1.2 Premier essai clinique ... 19
3.1.3 Mécanismes de l’OLP... 20
3.2 Utilisations cliniques actuelles ... 22
3.2.1 Douleur ... 23
3.2.2 Immunologie ... 23
3.2.3 La migraine ... 23
3.2.4 Fatigue induite par le cancer ... 24
3.2.5 ADHD (trouble du déficit de l’attention avec ou sans hyperactivité) ... 24
4
L’effet nocebo ... 25
4.1 Histoire et mécanismes de l’effet nocebo ... 25
4.2 De l’importance des informations délivrées ... 26
4.2.1 Dans les essais cliniques ... 26
4.2.2 Dans les médias ... 26
4.3 Effets nocebo et open label placebo ... 26
5
Enquête sur les habitudes de prescriptions de placebos des médecins ... 29
5.1 Introduction ... 29
5.2 Matériel et méthodes... 29
5.2.1 Population étudiée ... 29
5.2.2 Variables recueillies ... 30
5.2.3 Protection des données... 31
5.2.4 Moyen de diffusion... 32
5.2.5 Analyses statistiques ... 32
5.3 Résultats ... 32
5.3.1 Caractéristiques de l’échantillon ... 33
2
5.3.3 Habitudes de prescriptions de placebos avec ou sans dissimulation ... 37
5.4 Discussion ... 41
5.4.1 Profil des médecins prescrivant des placebos ... 41
5.4.2 Intérêt des OLP pour la population pédiatrique ... 41
5.4.3 Aspects économiques... 42
5.4.4 Intérêts économiques liés à la limitation des EI ... 42
5.4.5 Informations ... 44 5.4.6 Limites de l’étude ... 46 5.4.7 Ouverture ... 46
6
Conclusions ... 47
6.1 Limites... 47 6.2 Perspectives ... 477
Ressources bibliographiques ... 49
8
Annexes ... 57
8.1 Annexe 1 : Enquête ... 578.2 Annexe 2 : Résultats bruts de l’enquête ... 73
8.2.1 Profil des répondeurs ... 73
8.2.2 Prescriptions ... 74
8.2.3 Délivrances des informations ... 75
Liste des Figures Figure 1 : Schéma simplifié du circuit de la récompense(30) ... 10
Figure 2 : Conditionnement pavlovien classique(33) ... 11
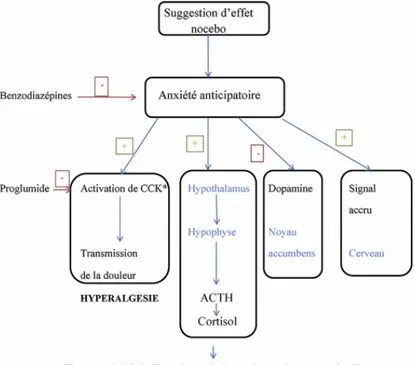
Figure 3 : Synthèse des mécanismes neurobiologiques impliqués dans l'effet nocebo(88) ... 25
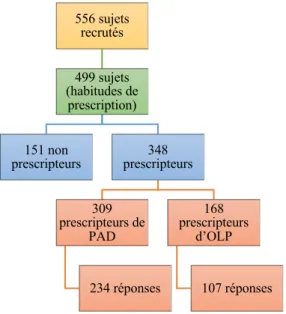
Figure 4 : Répartition des sujets ayant répondu au questionnaire ... 33
Liste des Tableaux Table 1 : Caractéristiques sociodémographiques des médecins. ... 33
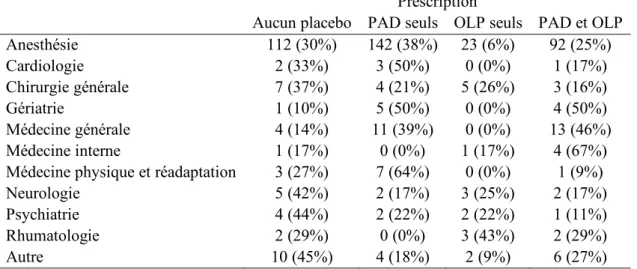
Table 2 : Prescription de placebos en fonction du DES. ... 34
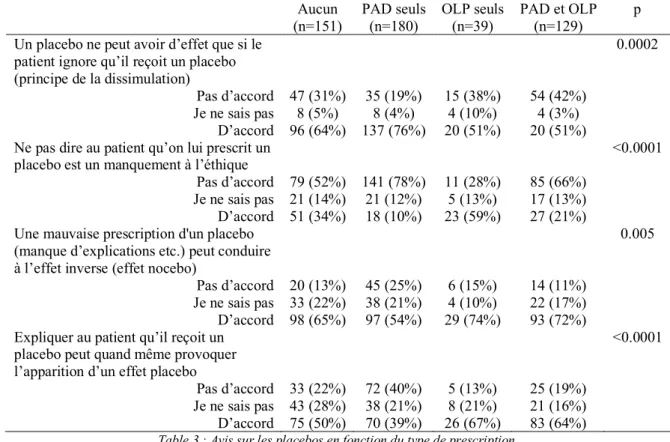
Table 3 : Avis sur les placebos en fonction du type de prescription. ... 35
Table 4 : Caractéristiques sociodémographiques des médecins en fonction de leur prescription. ... 35
Table 5 : Facteurs prédictifs de prescription de placebos en fonction du profil ... 36
Table 6 : Prescriptions de placebos par population. ... 37
Table 7 : Nature des placebos prescrits en fonction du type de placebo. ... 37
Table 8 : Place accordée aux placebos par type de placebo ... 38
Table 9 : Raisons des prescriptions des placebos en fonction du type de placebo... 38
Table 10 : Indications des placebos en fonction de leur nature. ... 38
Table 11 : Profil sociodémographique complet des prescripteurs ... 73
Table 12 : Habitudes de prescriptions et état des lieux des connaissances sur les placebos des prescripteurs ... 74
Table 13 : Délivrances des informations en fonction du type de placebo ... 75
Table 14 : Evaluation de l'efficacité des prescriptions en fonction du type de placebo ... 76
Table 15 : Evaluation de l'efficacité des prescriptions en fonction du type de placebo ... 77
Table 16 : Evaluation de l'amélioration de l'état des patients d'après le prescripteur, en fonction du type de placebo ... 78
Table 17 : Informations délivrées dans le cadre de la prescription des PAD ... 79
3
Glossaire
ADHD : trouble du déficit de l'attention avec ou sans hyperactivité AMM : Autorisation de Mise sur le Marché
ANSM : Agence Nationale de Sécurité du Médicament ATU : Autorisation temporaire d’utilisation
CHU : Centre Hospitalo Universitaire DES : Diplôme d’Etudes Supérieures
Dose extending : prolonger l’effet thérapeutique d’un médicament tout en diminuant la posologie/le nombre d’administrations, en se servant de placebo
EI : Effets Indésirables
IBS : Irritable Bowel Syndrom, Syndrome du Côlon Irritable IC : Intervalle de Confiance
OR : Odds-ratio
OLP : Open label placebo, ou placebo honnête
OTC : Over the Counter, médicament sans ordonnance PAD : Placebo avec dissimulation
RCT : Randomized Controlled Trial, Essai Randomisé Contrôlé RTU : Recommandation Temporaire d’Utilisation
5
1 Introduction
Les placebos sont utilisés depuis des siècles à différentes fins. Ils ont tout d’abord véhiculé une image négative, associée à la tromperie : tout le principe du placebo réside dans le fait que le patient ignore qu’il en reçoit un. Utilisés en premier lieu plutôt pour rassurer le patient zélé, les placebos ont progressivement gagné en intérêt au fil des siècles, alors que ses impacts thérapeutiques se précisaient. Dans la seconde moitié du 20ème siècle, les essais cliniques randomisés en double aveugle deviennent le
standard de la recherche clinique, et les nouveaux médicaments devaient dès lors faire leurs preuves face à un placebo : le placebo venait encore de gagner en importance. Aujourd’hui, les placebos font partie intégrante de l’arsenal thérapeutique à la disposition du médecin, et ne sont plus considérés comme des outils fantoches réservés aux patients incapables de partir de chez le praticien sans une prescription. Ainsi, une étude allemande de 2012 montre que 88% des médecins généralistes ont déjà prescrit un placebo dans leur carrière(1). Au Royaume-Uni, 97% des médecins généralistes admettent s’en être servi au moins une fois au cours de leurs carrière, et 77% s’en servent même au moins une fois par semaine(2).Pourtant, malgré son utilisation établie, ses mécanismes d’actions ne sont pas totalement élucidés.
L’effet placebo est également critiqué : sa part non négligeable dans les essais cliniques rend parfois difficile l’évaluation de l’efficacité purement attribuable au nouveau médicament testé(3), et peut même parfois conduire au refus de la demande d’autorisation de mise sur le marché de ce dernier(4). De plus, il est d’usage de penser que l’effet placebo ne peut être produit que si le patient n’est pas informé. Ce principe est à contresens du contexte éthique actuel dans lequel on recherche le consentement éclairé du patient, qui implique de ne rien lui dissimuler : le patient doit être acteur de sa propre santé, et doit prendre les décisions de façon autonome, et en toute connaissance de cause. Il devient éthiquement inenvisageable de lui dissimuler des informations sur son traitement. De plus, les mécanismes non élucidés du placebo peuvent entraîner sa mauvaise conception par le praticien et le patient, et peuvent entrainer des effets nocebo, effets négatifs dus à la prise d’un placebo(5).
Depuis quelques années émerge une nouvelle utilisation du placebo : l’open label placebo (OLP) ou placebo « honnête » : l’effet placebo peut apparaitre même si le patient est informé qu’il prend un placebo. Ce changement de paradigme est soutenu par quelques études, encore peu nombreuses, menées sur un faible nombre de sujets, mais aux résultats prometteurs, et ce pour diverses pathologies (douleurs chroniques du dos, migraine, allergie, etc.) et pour diverses catégories de patients (adultes, enfants). La totale transparence avec le patient résoudrait les problèmes d’éthique liés à la dissimulation lors de l’utilisation de placebo dans le sens traditionnel du terme, et le patient aurait toutes les clés en main pour être autonome dans ses choix de santé. Encore balbutiante, cette pratique doit confirmer ses preuves dans des essais cliniques de plus grande envergure, afin de devenir un nouvel outil de choix dans la pratique du praticien.
Pratique naissante, l’utilisation d’OLP n’est documentée que dans des essais cliniques : il n’y a actuellement à notre connaissance aucune étude permettant d’estimer la proportion de praticiens ayant adopté ce nouveau mode de prescription de placebo. C’est dans cet objectif qu’a été réalisée l’enquête présentée dans cette thèse. Le but est d’interroger les médecins de toutes les spécialités médicales existantes sur leurs habitudes de prescription de placebos. En les interrogeant à la fois sur leurs utilisations des placebos avec dissimulation (PAD) et d’OLP, il sera alors possible de savoir si cette nouvelle pratique est répandue, et comment elle se distingue de l’utilisation « classique » des placebos. Cette thèse sera structurée en plusieurs parties. Tout d’abord, on présentera une approche historique du placebo, de l’origine du mot à son utilisation actuelle en vie réelle et dans les essais cliniques. Les mécanismes de l’effet placebo, encore incertains, seront décrits dans la partie suivante. Ensuite seront
6 abordés les OLP, leur récente naissance, leurs potentiels mécanismes d’actions, et un état des lieux des essais cliniques les impliquant. Une partie abordera ensuite l’effet nocebo. La dernière partie sera consacrée à l’enquête réalisée sur les habitudes de prescriptions des praticiens.
7
2 Le Placebo
2.1
Origine du placebo
2.1.1 Etymologie
C’est au 14ème siècle que le mot placebo (latin pour « je plairai ») a été utilisé pour la première fois(6).
A cette époque, il désignait les proches du défunt qu’on engageait aux funérailles, ces derniers commençant leurs plaintes par « Placebo Domino in regione vivorum », que l’on peut traduire par « je dois plaire au Seigneur sur la terre des vivants ». Ici, le mot placebo porte une connotation négative de dévalorisation et de substitution, puisque les « pleureuses professionnelles » remplaçaient les membres de la famille du défunt. A la fin du 14ème siècle, le mot survient dans la culture populaire, toujours avec
cette consonance douteuse : Geoffrey Chaucer décrit dans « Merchant’s Tale » un homme appelé Placebo, un flagorneur(7). Même Molière, en son temps, utilisa ce mot à des fins espiègles.
Mais le premier usage médical documenté du mot placebo date seulement de la fin du 18ème siècle. Dans
le Nouveau Dictionnaire Médical de 1785, le placebo est décrit comme « un banal remède »(8). En 1811, le Lexico Medicum de Quincy définit le placebo comme un « qualificatif donné à n’importe quel remède plus adapté pour plaire que pour être bénéfique au patient »(9).
2.1.2 Placebo avant la Seconde Guerre Mondiale
Les placebos furent utilisés bien avant même qu’on en établisse une définition. Dans l’Egypte ancienne, le papyrus d’Ebers (1500 ans avant Jésus Christ) contenait une liste de 800 et quelques remèdes, mais dont une centaine était inactifs, voire carrément dangereux (excrément de crocodile ou sang de lézard) et seront appelés par la suite des placebos(10).
Au 16ème siècle, le placebo fut utilisé pour combattre les faux cas de possessions : quand un individu
présentait des signes douteux de possession diabolique, on lui présentait de fausses reliques, non authentifiées par une autorité religieuse : on peut parler de reliques placebos. Si le « possédé » réagissait à leur vue, de la même manière que si elles avaient été authentiques, on pouvait en déduire que le possédé simulait.(11)
En 1807, Thomas Jefferson parla de « fraude pieuse », observant que « L’un des meilleurs médecins que j’ai connu m’avait assuré qu’il se servait bien plus de pilules de pain, de gouttes d’eau colorée, et de poudre à base de cendre de pacanier que de tous les autres traitements réunis ».(12)
Richard Cabot d’Harvard expliqua comment il « a été éduqué, comme je suppose tous les médecins, à se servir de placebo, de pilules de pain, d’eau sous-cutanée, et d’autres appareils »(13). Seuls quelques praticiens considéraient la pilule de pain comme une menace pour l’intégrité de la médecine, et la plupart des codes éthiques soutenaient la « tromperie nécessaire ». Un « assortiment polychromatique de pilules de sucre » était communément ingurgité par les patients.(14) Malgré tout, les placebos servaient juste à apporter du confort au patient, sans aucun impact physiopathologique. La valeur du placebo était considérée comme inversement corrélée à l’intelligence du patient ; la pratique d’un rituel médical était plus efficace et nécessaire pour les patients « inintelligents, névrosés, ou inadaptés ».(15)
8
2.1.3 Placebo dans la recherche clinique
Jusqu’aux années 1950, l’essentiel des connaissances sur la pratique de la médecine venait d’études où de nouvelles substances étaient testées sans comparateur(16).
En 1801, John Haygarth rapporta les résultats de ce qui pourrait être le premier essai contrôlé par placebo. Haygarth traita cinq patients avec des imitations en bois des tracteurs de Perkins, baguettes métalliques brevetées car prétendument faites d’un alliage original doté d’un pouvoir de guérison(17). Quatre des 5 patients se sentirent mieux, et Haygarth obtint un résultat identique le lendemain avec de véritables tracteurs de Perkins. Haygarth comprenait le concept de placebo : « De ceci nous apprenons une importante leçon de médecine : la merveilleuse et puissante influence des passions de l’esprit sur l’état et les troubles du corps. Cela est trop souvent négligé dans le traitement des maladies...(…) cette expérience prouve clairement les incroyables effets de l’espoir et de la foi, excités par l’imagination, sur les maladies ». Haygarth pensait ainsi que l’imagination était le médiateur principal entre le corps et l’esprit, comme cela fut pensé durant la Renaissance.
En 1863, Austin Flint essaya de comprendre si les médicaments pour les rhumatismes articulaires changeaient réellement le cours naturel de la maladie(18). Flint traita 13 patients avec un placebo, à savoir de la teinture de quassia diluée donnée régulièrement. Ce traitement était largement connu comme le remède placebo pour le rhumatisme. En accord avec l’état de l’art de l’époque, Flint ne connaissait pas les groupes contrôles, mais conclut cependant que la « maladie s’est bel et bien terminée par auto-limitation » et que le traitement inerte avait marché. Cette explication fonctionnait bien avec les dogmes de l’époque : le placebo était une fraude et la dissimulation avait « l’effet moral d’un remède donné spécialement pour la maladie », mais il n’avait pas d’effet sur le cours naturel de la maladie : on n’excluait pas totalement que les placebos aient ce genre d’effet. Les placebos étaient des traitements donnés pour gérer le patient ou, comme dans l’expérience de Flint, servait de camouflage pendant que la nature réglait le problème.
Au début du 20ème siècle, le médecin allemand Adolf Bingel initia une étude clinique comparative à
grande échelle pour évaluer l’effet spécifique du sérum d’antitoxine de la diphtérie, dans le traitement de la maladie du même nom(18). Bingel se demandait à l’époque si l’antitoxine du sérum était responsable de l’effet ou si le même sérum sans antitoxine donnerait les mêmes résultats. Neuf cent trente-sept patients reçurent l’un ou l’autre des traitements (du serum avec de l’antitoxine de la diphtérie ou du sérum de cheval sans effet), et les effets observés furent les mêmes.
Dans les années 30, on assista à l’apparition du placebo dans la recherche clinique à travers deux études. Evan et Hoyle (13) et Gold et al. (18) employèrent le mot placebo pour le traitement inerte donné dans le groupe contrôle. Les deux études cherchaient à évaluer la valeur des médicaments contre l’angine de poitrine, et conclurent que ces médicaments censés traiter l’angine de poitrine n’exerçaient pas d’effet spécifique contre l’angine. Gold et al. tentèrent d’expliquer pourquoi le traitement inerte « fonctionnait » : leurs conclusions parlaient de « confiance suscitée par le traitement » ou encore de « stimulation apportée par une nouvelle procédure » et de « changement de conseiller médical ». En 1938, le mot placebo est utilisé encore une fois pour parler d’un traitement donné dans le groupe contrôle d’un essai(19). Dans le traitement du rhume, un vaccin avait donné des résultats prometteurs, dans des observations non contrôlées par des comparateurs pertinents. Dans ce nouvel essai, le groupe contrôle recevait alors un placebo, une capsule de lactose identique visuellement au vaccin. Les résultats furent négatifs : l’amélioration significative de l’état des patients dans le groupe placebo en fut la cause. On trouve ainsi en conclusion : « l’un des aspects les plus importants de cette étude est la diminution
9 significative du nombre de rhumes du groupe contrôle durant la période expérimentale. En fait ces résultats étaient aussi bons que ceux reportés dans les études non contrôlées précédentes qui recommandaient l’utilisation du vaccin contre le rhume ».
L’effet placebo était né. Néanmoins, l’acceptation du concept d’effet placebo par la communauté médicale au cours du 20ème siècle est laborieuse. Son mode d’action psychologique et obscur rappelle
trop l’obscurantisme scientifique qui régnait au Moyen Age.
2.1.4 De « l’humble tromperie » au « puissant placebo »
Jusque dans les années 50, on disait que le placebo « ne pouvait pas faire de mal et pouvait rassurer le patient » : on parlait alors d’« humble tromperie »(20). En recherche, les médecins commençaient tout doucement à reconnaitre les effets bénéfiques de ces substances inertes dans les groupes contrôles. Henry Beecher fut l’un des premiers chercheurs à noter ce phénomène. Dans son article phare, « The Powerful Placebo » de 1955, il passa en revue 15 essais contrôlés par placebo et conclut que l’effet placebo représentait 35.2% de l’effet bénéfique ressenti(21). De plus, dans les deux études qui incluaient un groupe contrôle sans traitement, aucune différence n’était observée entre ce groupe et le groupe placebo. Beecher commit une erreur que beaucoup font encore aujourd’hui : il attribua les effets observés dans le groupe placebo uniquement au placebo : Beecher confondait l’effet placebo et la réponse placebo. Beecher mesurait en effet la réponse placebo, et non stricto sensu l’effet placebo. L’effet placebo est obtenu par l’administration du placebo, alors que la réponse placebo est globale, multifactorielle, et prend en compte, notamment, l’évolution spontanée, le phénomène statistique de régression à la moyenne, les biais et autres facteurs confondants (comme le hasard)(22)Mais à l’époque, cet article eut une grande influence sur le concept de placebo, influence qui perdure encore aujourd’hui, et qui est probablement responsable du malentendu qui fixe à un tiers le nombre de sujets qui répondent au placebo, les fameux « placebos-répondeurs ». Kienle et Kiene plus tard formuleront au moins 19 autres raisons possibles pour les changements observés dans les groupes traités par placebos décrits dans l’article de Beecher (aléa thérapeutique, variabilité de l'effet placebo selon la pathologie, etc.)(23)
2.2 Définition du placebo et de l’effet placebo
De plus en plus documenté et accepté, le placebo et l’effet placebo virent leurs définitions modulées au cœur de débats scientifiques dans la seconde moitié du 20ème siècle.
Au début des années 60, Shapiro décrivit le placebo « comme toute procédure thérapeutique (ou composante de toute procédure thérapeutique) - a. qui est administrée délibérément pour produire un effet, ou - b. qui produit un effet qui n’était pas connu, sur un patient, un symptôme, une maladie ou un syndrome, mais qui est objectivement sans activité spécifique sur la condition en traitement »(24) Brody, lui, définit le placebo comme « une intervention désignée pour simuler une thérapie, qui au moment de l’utilisation n’est pas considérée comme un traitement spécifique pour la condition dans laquelle il est utilisé »(25). Le mot intervention est finement choisi, puisqu’il permet d’englober dans les placebos bien d’autres choses que les substances administrées : un examen clinique peut, par exemple, être considéré comme un placebo. On peut aussi, par exemple, considérer que la méthode Coué, basée sur l’autosuggestion, est une forme de placebo.
10 Le débat a fait rage quant à la définition de l’effet placebo. Shapiro parla de « l’effet psychologique ou psychophysiologique produit par le placebo ». Brody proposa une définition plus large : « L’effet placebo est la modification de l'état du malade attribuable à la valeur symbolique de l'intervention thérapeutique... ». Gotzsche définit l’effet placebo comme « la différence de résultat entre un groupe traité par placebo et un groupe contrôle non traité dans une expérimentation non biaisée »(26). C’est ici la définition la plus juste, mais irréaliste, car il est impossible d’effectuer des expérimentations non biaisées avec un groupe traité par placebo et un groupe non traité, car l’attribution du traitement ne peut être masquée.
Dans les recherches en psychologie sur l’effet placebo, la définition de Brody est la plus souvent utilisée. Pourtant, d’un point de vue méthodologique, c’est la définition de Gotzsche qui est la plus commune.
2.3 Mécanismes de l’effet placebo
Différents modèles ont été élaborés ces dernières années pour expliquer l’effet placebo. Ces modèles incluent des mécanismes neurobiologiques et psychobiologiques qui semblent fonctionner de manière coordonnée. Bien que les recherches se fassent de plus en plus abondantes sur le sujet, il est à noter qu’il n’existe pas de modèle universellement admis comme celui traduisant fidèlement l’effet placebo.
2.3.1 L’attente et le circuit de récompense du cerveau
Ce modèle est basé sur deux études : une chez les patients atteints de la maladie de Parkinson(27) et une sur la douleur(28). Il a été supposé, pour ces études, que l’attente d’une récompense, comme une amélioration de l’état de santé, jouerait un rôle dans l’effet placebo.
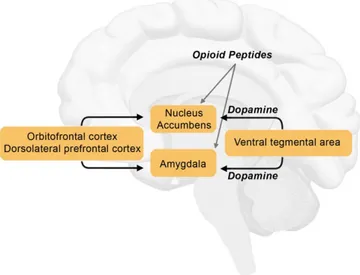
Il a déjà été démontré que, durant la phase d’attente de la récompense, c’est quand la probabilité d’avoir la récompense est de 50% (29) qu’on observe le plus de cellules dopaminergiques (localisées principalement dans le nucleus accumbens) activées toniquement. Une activation phasique des cellules dopaminergiques survient également après obtention de la récompense, et cette réponse est plus forte si la récompense est une surprise. Par conséquent, il semblerait que l’incertitude stimule le circuit de récompense du cerveau.
11 En se basant sur ces informations, le modèle neurobiologique du mécanisme de l’effet placebo, illustré sur la figure 1, est le suivant : quand une possibilité de récompense survient (par suggestion verbale), comme une amélioration de l’état de santé par le placebo, une combinaison de signaux neuronaux permet une activation tonique des cellules dopaminergiques. Ce modèle a été confirmé par imagerie médicale lors d’une étude sur l’effet analgésique du placebo(31). Ainsi, dans l’étude mentionnée précédemment, Scott et al. démontrent la corrélation entre la réponse au placebo et la récompense financière. Dans les deux cas, c’est le nucleus accumbens qui est impliqué. Cette étude renforce l’idée de l’implication du circuit de récompense du cerveau dans la réponse placebo, et donne des pistes de réponses à la question de savoir pourquoi certaines personnes répondent au placebo et d’autres non : la réponse peut être due à un circuit de récompense dopaminergique plus ou moins développé chez l’individu.
Scott et al. étudièrent également les opioïdes endogènes et les systèmes dopaminergiques des différentes zones du cerveau. Durant cette étude, les patients subissaient un test douloureux, en présence ou absence d’un placebo duquel on attendait une réponse analgésique. L’étude démontra ainsi que les activités dopaminergiques et celles du cerveau étaient associées à l’anticipation et étaient sensibles au placebo. Une forte réponse placebo était associée à une forte activité opioïde et dopaminergique dans le nucleus accumbens. Ainsi, comme vu dans sur la figure 1, ces deux systèmes (opioïde et dopaminergique) sont activés dans le nucleus accumbens après la prise d’un placebo, indiquant l’importance de ces neurotransmetteurs dans l’effet placebo.
2.3.2 Le conditionnement pavlovien ou conditionnement classique : la réponse
neuro immunitaire
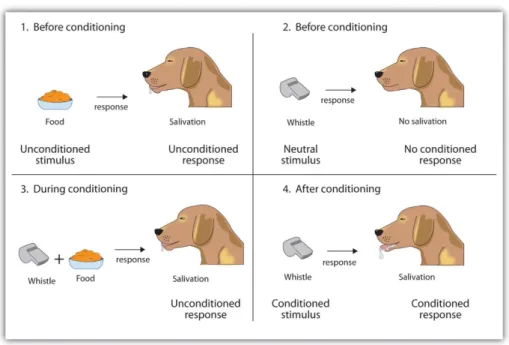
Le conditionnement pavlovien, développé au 20ème siècle, est un processus par lequel un individu va
associer une réponse déjà « programmée » (ex : saliver), qui est normalement déclenchée par un stimulus « conditionné » (ex : la présence de nourriture), à un stimulus « non - conditionné », c'est-à-dire à un stimulus neutre qui normalement ne déclenche aucune réponse (ex : le son d’une cloche). Dans sa célèbre expérience, illustrée en figure 2, Pavlov sonnait une cloche chaque fois qu’il servait de la nourriture à un chien(32). Puis un jour, Pavlov sonna la cloche mais ne servit aucune nourriture au chien : celui-ci saliva quand même.
12 Ce conditionnement classique fut également utilisé dans des expériences plus « médicales », pour évaluer une réponse neuro immunitaire. Par exemple, l’animal est exposé à un goût nouveau (la saccharine dans son eau) qui fait office de stimulus conditionné (SC). Ensuite un agent capable de produire une réponse immunitaire est injecté à l’animal, et fait office de stimulus non conditionné (SNC).
On observe alors que si le SC est à nouveau présenté à l’animal, ce dernier va subir une réponse immunitaire qui va mimer le SNC. De nombreuses études ont montré ce genre de résultats où la réponse immunitaire est conditionnée(34–36) (suppression de la production d’anticorps, modification de la circulation des lymphocytes etc.). L’utilisation de la cyclophosphamide comme SNC permit de montrer que le cortex insulaire et l’amygdale sont les points clés de la suppression de la production d’anticorps. D’autres études chez l’animal, cette fois sur le conditionnement comportemental, montrèrent une diminution de la morbi-mortalité chez les animaux en se servant de cyclophosphamide ou cyclosphoride(37), ou encore une augmentation de la survie en cas d’allogreffe de cœur hétérotopique en inhibant l’hypersensibilité de contact(36).
Des preuves du conditionnement comportemental de l’effet immunopharmacologique d’un médicament sont retrouvées chez l’homme également(38). Par exemple, les propriétés antihistaminiques de la desloratadine ont pu être mimées via la même technique de conditionnement comportemental chez des patients souffrant de rhinite allergique provoquée par les acariens(39).Ces études de conditionnement comportemental corroborent l’hypothèse que la douleur physiologique consciente et les mécanismes moteurs sont affectés par les attentes conscientes du patient, alors que les réponses hormonales et immunitaires sont médiées par le conditionnement comportemental.
2.3.3 Relation entre les deux mécanismes
Deux mécanismes semblent donc générer une réponse placebo : le premier, basé sur la suggestion et les attentes du patient, et le second, basé sur le conditionnement pavlovien. Bien que la relation entre les deux ne soit pas claire, celle-ci a fait l’objet de recherches. Benedetti montrera notamment que le conditionnement est médié par les attentes et que ces attentes n’influent pas sur les réponses conditionnées(40).
Des expériences ont également montré qu’une expérience antérieure peut façonner une réponse au placebo analgésique(41). Les sujets conditionnés à ressentir cet effet analgésique dans le contexte d’une douleur aigüe ressentirent moins la douleur jusqu’à 7 jours après. Ces données nous montrent qu’une expérience précédente avec le traitement de la douleur (réussie ou non) aura des effets à long terme sur les traitements suivants du même genre. Bien qu’intéressantes, ces études portaient sur des douleurs aigües, et non pas sur des douleurs chroniques et persistantes, d’où le recul à prendre concernant ce conditionnement par une précédente expérience.
13
2.3.4 Le rôle du genre dans le placebo
L’influence du genre dans l’efficacité du placebo est encore mal connue et est très peu étudiée.
Une étude sur la douleur ischémique semble montrer que les hommes répondaient mieux au traitement suite à la suggestion verbale(42), c’est-à-dire au discours du praticien, mais le fait que le traitement ait été donné uniquement par des femmes infirmières pourrait constituer un biais, les personnes tolérant mieux la douleur quand elle est évaluée par une personne du sexe opposé(43). Un effet du genre a également été observé dans un essai sur l’acupuncture, où les acupunctrices inspiraient plus confiance que leurs homologues masculins(44). Dans un essai sur le mal des transports, les femmes semblaient mieux réagir au conditionnement, alors que les hommes, eux, montraient une meilleure réponse quand ils étaient soumis à des suggestions verbales(45).
Encore obscure, l’influence du genre sur l’effet placebo doit sérieusement être mise à l’étude, dans le but d’adapter au mieux la stratégie à mettre en œuvre pour utiliser le placebo.
2.4 L’utilisation actuelle du placebo
Au vu des définitions adoptées communément de l’effet placebo, on comprend également qu’un médicament actif peut avoir un effet placebo. Il faut ainsi différencier les placebos purs et impurs. Un placebo pur est un « médicament » dénué de toute substance active (comprimé de sucre, de farine, etc…)
Un placebo impur est un médicament contenant un principe actif inefficace dans la pathologie pour laquelle il est prescrit. Ainsi, la vitamine C est donnée sans raisons scientifiques valables pour soigner la fatigue, le rhume, etc.(46)
2.4.1 Dans les essais cliniques
La seconde moitié du 20ème siècle voit l’avènement de l’utilisation du placebo dans la recherche médicale. Dans la méthode en double aveugle, les patients des groupes étudiés, ainsi que les médecins évaluateurs, ne savent pas qui reçoit un médicament ou un placebo. Ce standard établi permet alors d’avoir un avis objectif sur l’efficacité réelle de la molécule, en comparant les deux populations. Il est pourtant de plus en plus difficile pour les entreprises pharmaceutiques de terminer avec succès les essais cliniques face au placebo pour prouver l'efficacité de leur médicament. Les patients connaissent et comprennent en effet de mieux en mieux les essais cliniques, qui sont ainsi perçus comme des expériences longues et coûteuses, ce qui serait susceptible d’augmenter les attentes et donc la réponse placebo des participants. Aux Etats-Unis, l'utilisation autorisée de publicité concernant les médicaments (direct-to-consumer advertising) pourrait également renforcer les attentes des patients. L’effet placebo, omniprésent dans la recherche médicale, voit donc son utilisation chahutée.
14
2.4.2 En vie réelle
Les PAD sont utilisés de façon classique pour remplacer un treatment as usual (TAU).
Mais les PAD peuvent également être utilisés comme dose extenders, afin de tromper le cerveau, permettant ainsi de récréer l’effet bénéfique du traitement, sous couvert d’un stimulus (qui permet le conditionnement).
Par exemple, en 2002, Goebels et al. arrivent à mimer l’effet immunosuppresseur de la cyclosporine en administrant un placebo accompagné d’un stimulus (une boisson aromatisée et colorée)(47).L’effet immunosuppresseur conditionné est ainsi reproduit pendant 14 expositions au stimulus. Par la suite, l’administration d’une faible dose de cyclosporine en même temps que la boisson conditionnante permet de conserver l’immunosuppression.
L’efficacité du placebo administré en dose extending sera précisée, notamment en 2007, lors d’une étude où le conditionnement est utilisé pour prolonger l’effet de la morphine chez l’être humain(48). Dans cette étude, des patients se voient administrer de la morphine deux fois à une semaine d’intervalle, puis lors de la troisième semaine, le jour d’une compétition sportive, un placebo qui permet de mimer l’effet de la morphine (endurance face à la douleur et amélioration des performances physiques). Deux conclusions importantes sont à tirer de cette étude : étant donné les intervalles de temps (une semaine) utilisés entre chaque administration, le placebo en dose extending semble avoir un effet à long terme. Deuxième point important, plus éthique, si l’administration d’un placebo permet de mimer les effets de la morphine (interdite en compétition sportive) sous réserve de conditionnement, est-il acceptable d’en prendre dans le cadre de compétitions, ou cela doit-il être considéré comme une forme singulière de dopage ?
D’autres études corroborent l’idée que le placebo utilisé en dose extending permet de stimuler l’utilisation partielle d’un médicament. Ainsi, pour traiter le psoriaris, on peut trouver une étude où les patients se voient administrer 25%-50% du temps la dose complète d’un corticostéroide, et le reste du temps un placebo(49). Ce planning de prescription partielle du traitement permit alors une réduction des rechutes de psoriasis comparable (26.7%) à celle du groupe de patients recevant des doses complètes de corticostériodes (22.2%).
On comprend donc que le dose extending permet de mimer l’effet d’un médicament et de limiter l’utilisation de celui-ci en réduisant la dose, le placebo servant ainsi de booster.
2.5 Le dilemme éthique du placebo
2.5.1 En vie réelle
L’éthique de l’utilisation du placebo est un éternel débat avec, en son centre, le principe de la dissimulation de l’information au patient. Le débat prit une ampleur tout autre après la Seconde Guerre Mondiale, influencé par deux principes :
- Le consentement du patient : en réponse aux horreurs révélées par le procès de Nuremberg naissent des principes éthiques fondamentaux, comme le consentement du patient dans le cadre de sa prise en charge clinique et dans la recherche médicale.
15 - La découverte des mécanismes neurobiologiques derrière les effets placebo et nocebo : les nombreuses études qui jalonnent la seconde partie du 20ème siècle montrent que ces effets
sont inévitables, et qu’ils peuvent avoir un effet sur des symptômes alors bien connus, notamment la douleur.
Ces découvertes scientifiques couplées à cette nécessité d’autonomie du patient devraient plonger les cliniciens dans un sérieux dilemme éthique. Pourtant, l’utilisation de placebo, pur ou impur, est largement répandue chez les médecins, instigateurs de la tromperie, comme vu lors de l’introduction. Peut-on donc duper le patient sous couvert que l’effet placebo le soulagera de ses maux ?
L’autonomie du patient était devenue un point éthique central. Coggon et Miola expliquent que respecter l’autonomie du patient c’est(50) :
- Respecter sa liberté, et ne pas interférer dans les choix du patient
- S’assurer que le patient a à sa disposition toutes les informations nécessaires pour comprendre sa situation.
On comprend alors que mentir au patient en lui dissimulant des informations viole son autonomie. Plus encore, mentir au patient fragilise la confiance que celui-ci place en son médecin, confiance essentielle pour que le traitement fonctionne (en particulier chez le sujet non autonome, comme l’enfant) et pour continuer d’assurer le recrutement de patients dans les essais cliniques. Ainsi, si le patient découvre, d’une façon ou d’une autre, qu’il a été dupé, la confiance peut être perdue, possiblement à jamais. Un autre principe critiquable du placebo est la notion de « non-malfaisance ». Une idée très répandue est que le placebo est une substance inactive, et qu’ainsi, par définition, elle ne saurait faire de mal à qui que ce soit. Cela est bien évidement faux : le placebo n’est pas toujours une substance inerte et peut être n’importe quelle substance active (un placebo impur). On peut ainsi imaginer que la prescription d’antibiotiques en guise de placebo (pratique courante) entrainerait l’augmentation de l’antibio résistance dans la population(51). Même une simple gélule de sucre n’est pas sans danger pour le diabétique. De plus, selon Miller et Colloca, l’utilisation de placebo avec tromperie du patient pourrait renforcer l’idée qu’il y a un médicament pour tout (« a pill for every ill »)(5).
On comprend donc que l’utilisation de placebo ne pose pas qu’un problème éthique, mais aussi un problème de santé publique, et que sa simple définition est un manquement à l’éthique qui pourrait justifier son interdiction. Mais de l’autre côté du spectre, des arguments pour son utilisation existent. Une autre école de pensée déclare que le mensonge induit par l’utilisation du placebo n’est pas forcément un manquement éthique, Annoni dit même : « le devoir du médecin de soigner le patient prévaut sur le devoir de dire la vérité »(52). Il utilisa un exemple pour illustrer son propos : on considère le cas d’un patient qui fait une crise cardiaque en apprenant que son fils a eu un accident. Le patient demande alors au médecin si son fils a survécu, ce qui n’est pas le cas. Que doit dire le médecin ? S’il dit la vérité, il risque d’aggraver la situation du patient. S’il ment, il peut augmenter les chances du patient de s’en sortir. A travers cet exemple, on comprend que mentir au patient est un manquement grave au respect de son autonomie, mais que cela n’est pas aussi important que de sauver une vie.
Sans évoquer un cas aussi grave, il existe bien des situations où le bénéfice thérapeutique peut prévaloir sur les potentiels effets indésirables. Par exemple, les pseudos crises d’épilepsie ne peuvent être distinguées des véritables crises d’épilepsie(53). Or il a été démontré que dans le cadre du diagnostic, l’administration d’un placebo permet d’induire une crise chez les patients souffrant de pseudo crises, mais pas chez les patients véritablement épileptiques(54). En sachant qu’un diagnostic traditionnel de l’épilepsie se fait via un encéphalogramme durant la crise, on comprend l’intérêt du placebo, qui permet
16 un gain de temps dans la prise en charge du patient, via une procédure beaucoup moins invasive et moins couteuse.
Enfin un dernier argument qui vient contrebalancer les considérations éthiques vient… du patient lui-même. Ainsi, une enquête de 2016 révéla qu’une large portion des américains alors interrogés (50%-85%) trouvait acceptable l’utilisation de placebo par le médecin, invoquant les bénéfices potentiels comme argument(55). Toujours dans la même enquête, une partie des personnes jugeant inadmissible l’utilisation de placebo n’évoquait pas du tout le devoir du médecin de dire la vérité, mais plutôt son obligation de « faire plus » (plus d’examens diagnostiques, des substances actives plutôt que des placebos).
L’utilisation du placebo en vie réelle est donc une pratique largement répandue, qui, bien que soulevant un dilemme éthique, ne semble pas nécessairement en contradiction avec l’autonomie du patient, et son utilisation se fait toujours dans le cadre où les bénéfices thérapeutiques vont prévaloir. Les mécanismes sous-jacents des effets placebos et nocebos sont pourtant encore nébuleux à ce stade, induisant une certaine prudence relative à l’utilisation des placebos : il convient d’être sûr que des données cliniques empiriques existent, soutenant l’efficacité du placebo dans la pathologie concernée. L’administration de PAD doit donc se faire au cas par cas, en prenant en compte le contexte pathologique et la volonté du patient.
2.5.2 Dans les essais cliniques
Les essais randomisés contrôlés (RCT) sont très largement utilisés depuis la fin des années 50, mais sont également sources de dilemmes éthiques, notamment le « RCT dilemma ». Ce dilemme prend source dans la dualité entre la finalité de l’essai clinique et la finalité de la pratique clinique. Un essai clinique a pour but d’évaluer l’efficacité d’un médicament et de développer de nouvelles connaissances, alors que la pratique clinique a pour but de soigner le patient. Mais il arrive qu’évaluer l’efficacité d’un médicament ne coïncide pas avec le fait de soigner le patient au mieux. Cette dichotomie est encore plus flagrante en comparant les études contrôlées par placebo et les études contre substance active. Afin d’évaluer au mieux un nouveau traitement, il est possible de le comparer à un placebo, même si un traitement comparatif existe. C’est ici que deux écoles de pensées s’affrontent, entre ceux qui sont d’accord avec cet état de fait, et ceux qui jugent inacceptables les études contrôlées par placebo. Freedman développa la notion « d’équilibre clinique »(56) qui stipule qu’on ne peut faire un essai randomisé contrôlé en opposant le nouveau traitement à un placebo si un traitement précédent existe déjà ; l’objectif en vie réelle doit être le même que l’objectif de l’essai clinique : la santé du patient, et il serait ainsi inacceptable de faire perdre des chances d’amélioration de son état au patient.
De l’autre côté, Miller désavoue ce postulat et distingue la finalité de l’étude clinique à celle du praticien, et explique notamment qu’un essai clinique n’est pas conçu comme une thérapie pour le patient, puisqu’il n’est pas personnalisé.(57)
Ce débat sur l’utilisation du placebo dans les essais cliniques rejoint finalement le débat entre la finalité des essais cliniques et la finalité de la prise en charge du patient, qui sont très différentes. Dans la pratique clinique, le principe de bienfaisance et de non malfaisance est centré sur le patient ; la recherche clinique est, quant à elle, centrée sur l’acquisition de nouvelles connaissances sur la pathologie. Le seul cas dans lequel l’utilisation de placebo semble faire l’unanimité est dans le cas où aucun autre traitement comparatif n’existe. Même dans cette hypothèse, un maximum de précautions doit être pris pour éviter au patient de s’exposer à des risques inutiles.
17 Les études contrôlées par placebo posent également le problème du consentement éclairé du patient. Une enquête rend compte qu’à peu près la moitié des patients engagés dans un essai clinique ne comprend pas totalement le but et la nature de l’étude à laquelle ils participent, ainsi que d’autres aspects, incluant le principe de groupe contrôle ou de randomisation(58). Les patients pensent également que l’étude est conçue dans un but thérapeutique, alors que, comme écrit précédemment, ce n’est pas toujours le cas. Il est donc difficile de parler de consentement éclairé ou de respect de l’autonomie du patient quand on constate qu’il ne comprend pas pleinement dans quoi il est engagé. L’accent doit donc être mis sur la compréhension de l’essai clinique du patient afin de combler ce retard éthique important. C’est dans ce contexte de remise en question de ce dogme pourtant encore jeune qu’émergea l’idée d’être véritablement honnête avec le patient concernant l’utilisation de placebo.
19
3
L’open label placebo
3.1 Histoire de l’open label placebo
3.1.1 Emergence et naissance du concept
Ce sont sans conteste les travaux et réflexions de Ted Kaptchuk, professeur de médecine à Harvard, qui permettent d’expliquer au mieux l’émergence du phénomène.(59)
En 2008/2009, dans un essai clinique destiné à analyser la part de l’effet placebo dans le traitement du syndrome du côlon irritable (Irritated Bowel Syndrome ou IBS)(60,61), les patients interrogés, alors traités par acupuncture, exprimaient des sentiments différents de ceux qui étaient admis dans le cadre de l’utilisation de placebo, comme théorisés par Beecher notamment(21). Cinq thèmes émergèrent de ces entretiens avec les patients(62) :
- Les patients n’avaient pas d’attentes positives de leur traitement
- Les patients exprimaient spontanément de « l’espoir » comme principale motivation. « Je suis juste plein d’espoir », peut-on lire notamment.
- Les patients liaient cet espoir au désespoir. Un patient dit notamment « vous en arrivez à un point où vous êtes tellement désespéré que vous êtes prêt à essayer n’importe quoi. Si quelqu’un me dit que je devrais porter du rose tous les jours pour aller mieux, je le ferai. J’essayerais vraiment n’importe quoi… »
- Les patients étaient inquiets à l’idée de recevoir un placebo. Cela les préoccupait au point de demander sans arrêt s’ils étaient vraiment traités ou s’ils recevaient un placebo.
- Enfin, les patients étaient inquiets à l’idée qu’une amélioration de leur état serait purement « dans leur tête ». Une remarque typique était : « peut-être que c’est moi qui invente tout ça ? »
De ces entretiens, Kaptchuk retint surtout que les patients ne parlaient pas d’attente positive, mais plutôt « d’espoir », et que les patients étaient inquiets de recevoir un placebo, la dissimulation ne les dupant absolument pas. Vint alors l’hypothèse de discuter honnêtement de placebo avec le patient. Une telle discussion apaiserait-elle leurs craintes ? Est-ce que parler d’attente positive, potentiellement trompeuse, était réellement efficace et responsable de l’effet placebo ? Si les gens clamaient ne pas avoir d’attentes positives particulières sur le traitement, peut-être que les mécanismes de l’effet placebo sont plus inconscients, sensorimoteurs, et plus incarnés que ce que l’on pensait.
Cette étude était le point de départ des réflexions sur le placebo honnête (originalement open label placebo ou OLP), et d’autres études vinrent préciser cette notion nouvelle.
3.1.2 Premier essai clinique
Le premier essai clinique randomisé sur l’OLP assignait au hasard 80 patients souffrant d’IBS à recevoir un OLP en plus du TAU(60). Les relations patient/praticien étaient identiques pour les deux groupes. Les patients savaient clairement que le sujet d’étude était la prescription de placebo de façon honnête. Les discussions entre les deux parties n’étaient pas scriptées et ne duraient pas plus de 10 minutes. Kaptchuk se déclara passablement étonné en rédigeant le rapport au vu des résultats, et développa 4 points clés de cet essai clinique(59):
20 - Enlever les stigmas de l’effet placebo : il s’agit ici d’être le plus honnête possible. Durant cet essai, les patients étaient clairement informés que le but était de définir si l’effet placebo apparaissait même quand le patient était informé. Le praticien insistait sur le fait qu’il n’avait aucune idée de comment l’OLP fonctionnait.
- La nature automatique de l’effet placebo : il devait être clair pour le patient que la seule chose qu’il devait faire était de prendre le placebo. La présentation des informations n’incluait pas de « pensée positive » et il n’était pas dit non plus que l’effet placebo était un effet psychologique. Seul ce qui était connu de l’effet placebo traditionnel était présenté : le chien de Pavlov, la cloche, la salive, la connexion cerveau/goût qui se faisait automatiquement etc. Si l’OLP fonctionnait, cela devait être via des mécanismes similaires. - Pas besoin d’y croire : il était clairement expliqué aux patients qu’il n’était pas nécessaire d’y croire pour que l’effet apparaisse, ces derniers exprimant librement leurs doutes, trouvant même parfois ridicule l’idée de prendre un placebo en le sachant.
- Prendre le placebo est critique : l’accentuation était mise sur la prise du placebo deux fois par jour. On disait aux patients que les bénéfices de l’effet placebo pourraient aussi bien apparaitre graduellement que rapidement.
En trois semaines, les résultats étaient surprenants : 60% des patients sous OLP ressentait un soulagement adéquat (évalué sur un questionnaire standardisé), comparé à 35% pour le groupe sans traitement (p=0.002). Les autres mesures montraient des résultats similaires. Les résultats étaient cliniquement significatifs, et l’impact de cette étude fut étayé par l’attention des médias.
D’autres essais suivirent sur le même modèle, en adoptant certaines spécificités, et seront détaillées par la suite.
3.1.3 Mécanismes de l’OLP
3.1.3.1 La mémoire pharmacologique
Il est possible que les petites pilules de sucre qualifiées de placebo fonctionnent car elles font appel à une mémoire pharmacologique qui reproduirait une réponse apprise par le passé via une forme de conditionnement, comme décrite précédemment : c’est ce qu’on pourrait qualifier de conditionnement subconscient(5).
Les attentes conscientes du patient pourraient également jouer un rôle. Les OLP sont souvent délivrés avec des suggestions verbales positives pour insuffler de l’espoir au patient concernant l’amélioration de son état. Cette délivrance d’informations positives semble cruciale. En effet, une seule étude sur les OLP ne comprenait pas ces suggestions verbales, et c’est celle qui montre le plus petit effet de taille(63). En plus des suggestions verbales, la façon dont elles sont délivrées semble également importante et peut influencer le résultat(52,64).
21
3.1.3.2 Le renforcement partiel et le conditionnement classique
Comme vu précédemment, le dose-extending placebo s’appuie sur la capacité des humains (et des animaux) à acquérir un réflexe physiologique via des processus d’apprentissages associatifs (comme le conditionnement classique et le renforcement partiel). Le dose-extending fonctionnant avec les OLP (comme il le sera décrit plus loin), on peut supposer que les mécanismes responsables du dose extending pour les PAD s’appliquent au moins en partie aux OLP
3.1.3.3 La cognition incarnée
Théorie encore largement spéculative, la cognition incarnée est un nouveau mécanisme qui pourrait expliquer comment fonctionnent les OLP. D’après cette théorie, les interactions physiques que nous expérimentons influencent notre cognition(66). Par exemple, le son de la roulette du dentiste déclenche chez la plupart des gens une réaction corporelle, comme le frissonnement(67). De ce fait, des signaux sensoriels pourraient provoquer différentes réactions, notamment celles impliquées dans des expériences de guérison (réussies ou non). On comprend donc que la cognition incarnée est liée au conditionnement, puisqu’opérant au niveau subconscient et étant automatique, comme un réflexe. Liée, mais cependant différente, au point que certains pensent qu’aucun conditionnement particulier n’est nécessaire, et que la cognition survient suite à une expérience corporelle qui n’est pas médiée par le cerveau, comme c’est le cas du conditionnement classique. Ainsi, certains paramètres avec lesquels sont administrés les OLP pourraient faire réagir le corps et induire la cognition. Et c’est cette cognition qui, à son tour, déclencherait le relargage par le cerveau de substances endogènes analgésiques comme les endorphines. Cette théorie est encore jeune et nébuleuse, et gagne à être étudiée plus en profondeur.
3.1.3.4 L’incertitude et la nouveauté
Les patients qui se voient proposer des OLP sont souvent sceptiques quant à leurs effets, et « quelques traces d’incertitude sont toujours présentes dans l’espoir »(59).
Cette incertitude sur le résultat pourrait être un facteur positif pour la réponse OLP, et est à contrecourant de la littérature sur le PAD, qui insiste plutôt sur le contraire : la certitude ou les attentes positives par exemple.
Alors qu’on retrouve des expérimentations en laboratoire où la certitude produit de meilleurs résultats que l’incertitude(68,69) d’autres études semblent indiquer le contraire. Par exemple, dans une étude d’imagerie médicale du cerveau, Lidstone et al. montrent que les patients atteints d’une maladie de Parkinson répondent mieux au placebo quand ils sont incertains de recevoir de la levodopa ou un placebo, comparé à ceux qui sont certains de prendre un placebo : c’est dans le contexte d’incertitude qu’on retrouve le plus de relargage de dopamine(70). Lidstone conclura ainsi sur l’importance de l’incertitude sur l’effet placebo, au-delà des précédentes réponses aux traitements qu’a pu expérimenter le patient.
3.1.3.5 La relation soignant/soigné
Peu importe les mécanismes étudiés, l’administration d’un placebo se fait toujours au sein d’une relation soignant/soigné (quel que soit le type de soignant). Lorsqu’on veut démontrer l’efficacité d’un OLP, on le compare souvent à un TAU ou à un groupe contrôle sans traitement qui reçoit cependant les mêmes
22 informations que les autres participants, avant la randomisation. La délivrance de ces informations, ces suggestions verbales positives, ne peuvent expliquer seules les effets du placebo, et nous verrons par la suite, dans les essais cliniques, que délivrer un rationnel positif ne suffit pas, voire n’est pas nécessaire. Néanmoins, les signaux corporels non verbaux (la voix, le visage, les yeux, le discours, ou encore le toucher, la sensibilité, la proximité), les symboles (l’apparence, le cadre) et les comportements « rituels » (l’attention, la chaleur, l’empathie, la façon dont l’examen se déroule) constituent un ensemble de suggestions non verbales, et conduisent à un rapport de confiance qui pourrait interagir avec les OLP(71). .
3.1.3.6 Le traitement de l’erreur et de la prédiction (PEP)
Une nouvelle théorie encore balbutiante est développée par Ted Kaptchuk(59). Cette théorie part d’un postulat simple : la perception via nos sens est inséparable de la prédiction. Le cerveau serait ainsi constamment, sans s’en rendre compte, en train d’essayer de prédire les signaux qu’il va rencontrer. D’après Clark(72) le cerveau serait donc un organe statistique qui génèrerait des explications sur les stimuli qu’il rencontre. Il faut donc comprendre que des concepts comme les « explications, les hypothèses, les croyances » doivent être considérés comme des probabilités encodées par les neurones, ces probabilités étant mises à l’épreuve face à des preuves sensorielles : on parle de cerveau bayésien ou de modèle bayésien.
Cette théorie trouve des débuts de preuve dans de petites études qui ont démontré (chez le sujet sain pour le moment) que les informations sensorielles entrantes ne sont pas analysées de novo mais interprétées selon les informations que le cerveau connait déjà(73).
Le modèle bayésien a ainsi pu prédire avec succès l’effet analgésique du placebo dans un contexte clinique.(73,74)
Les mécanismes expliquant l’efficacité des OLP restent encore complexes à entrevoir, même si on y trouve des similitudes avec le placebo traditionnel : conditionnement et dose extending sont par exemple possibles. Mais des différences subsistent et restent inexpliquées, notamment le poids des interactions entre le patient et son environnement. Des contradictions sur certains points, comme la nécessité du conditionnement ou du rationnel, rendent encore plus difficile à démêler la toile qui constitue le fonctionnement du placebo honnête, toile largement entremêlée avec le fonctionnement des PAD.
3.2 Utilisations cliniques actuelles
La stratégie de dose extending vue précédemment fut appliquée à des placebos administrés sans tromperie du patient. Si le premier essai clinique impliquant des OLP concernait l’IBS, une maladie d’origine psychosomatique, les essais qui suivirent s’intéressèrent à des aires thérapeutiques diverses et variées.