CRISPR/Cas9 pour traiter la maladie de Huntington
Mémoire
Josiane Dufour
Maîtrise en neurobiologie - avec mémoire
Maître ès sciences (M. Sc.)
CRISPR/Cas9 pour traiter la maladie de Huntington
Mémoire
Josiane Dufour
Sous la direction de :
Résumé
La maladie de Huntington (MH) est une maladie neurodégénérative caractérisée par plusieurs symptômes moteurs, cognitifs et psychiatriques, causés par une expansion du trinucléotide CAG présent dans le gène huntingtine. L’expression de la protéine correspondante mène éventuellement à un dysfonctionnement et une mort cellulaire.
OBJECTIFS: À ce jour, il n’existe pas de thérapies efficaces afin de traiter ou ralentir la MH,
mais les essais actuels suggèrent qu’une réduction de la quantité de protéines mutantes pourrait être bénéfique. Dans cette étude, il a été question d’utiliser le système CRISPR/Cas9. Grâce à l’utilisation de l’enzyme Cas9, cette technologie d’édition du génome bien précise permet de cibler et corriger une mutation génétique; ce qui permettrait dans le cas de la MH de réduire le gène causant la pathologie. MÉTHODE : Un modèle de souris MH et un modèle contrôle sauvage, âgés de 12 mois, ont reçu des injections stéréotaxiques intracérébrales de virus AAV9 contenant la Cas9D10A et/ou l’ARN guide (SgCTG/eGFP). Des tests cognitifs et moteurs ont été effectués pendant 3 mois après les injections virales. Des tissus et du sang ont été récoltés lors du sacrifice des animaux. Les échantillons de cerveaux ont été analysés par immunofluorescence et par western blot pour déterminer le degré de contraction ainsi que le niveau d’expression et de colocalisation de la Cas9D10A et de l’ARN guide. RÉSULTATS: Une amélioration de certains comportements est notable après 3 mois post-injection chez les souris MH traitées avec les deux constructions. Les analyses biochimiques ont permis de détecter l’expression des deux vecteurs et une réduction de la quantité de protéines mutées. CONCLUSION : CRISPR/Cas9 pourrait potentiellement être utilisé pour réduire la quantité de protéines mutées et améliorer certains comportements cognitifs et moteurs. Une optimisation de l’utilisation de cette technologie pourrait mener à une thérapie intéressante pour la MH.
Abstract
Huntington’s disease (HD) is a neurodegenerative disorder characterized by a triad of motor, cognitive and psychiatric symptoms which results from an expansion of the CAG tract in the
huntingtin gene. This mutation encodes for a longer polyglutamine stretch in the mutant
huntingtin protein. Expression of the mutant protein eventually leads to cell dysfunction and death. OBJECTIVE: To this day, there is no disease-modifying therapy available for HD, but ongoing trials suggest that reducing the amount of the mutant protein could be beneficial. In this study we used the CRISPR/Cas9 system, a precise gene editing technology which can be directly employed with its partner enzyme, Cas9, to specifically target and correct genetic mutations, to shrink the causative mutation associated with HD. METHODS: A mice model of HD and littermate controls were aged to 12 months prior to undergoing stereotaxic intra-cerebral injections of AAV9 viruses containing either Cas9 D10A nickase and/or guide RNA (SgCTG/eGFP) targeted to the CAG expansion. Cognitive and motor testing were performed for 3 months after viral infection. Tissues and blood were collected at the completion of the protocol. Brain samples were analysed using immunofluorescence and western blotting to determine the degree of contraction achieved and the degree of expression and colocalization of GFP (guide RNA) and HA tags (Cas9D10A). RESULTS: Mild behavioural improvements were detected 3 months after co-administration of the two viral constructs to HD mice. Importantly, biochemical studies detected expression of both the guide RNA and the Cas9 in addition to a reduction in the amount of mHTT detected in HD mice receiving both viruses. CONCLUSION: CRISPR/Cas9 can be used to reduce the amount of mHTT and this is associated with improvements in cognitive and fine motor deficits. Further optimization of this technology could lead to a clinically relevant therapy.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures, tableaux, illustrations ... v
Liste des abréviations, sigles, acronymes ... vi
Remerciements ... ix Avant-propos ... x Introduction ... 1 La maladie de Huntington ... 1 La protéine huntingtine ... 6 Modèles animaux ... 12
Traitements actuels et essais cliniques ... 14
Modifications génétiques ... 16
Projet de recherche ... 22
Chapitre 1 – Matériel et méthode ... 24
Chapitre 2 - Résultats ... 32
Chapitre 3 – Discussion ... 40
Chapitre 4 – Perspectives ... 51
Conclusion ... 54
Bibliographie ... 55
Annexe A – Plasmide SpCas9 D10A ... 66
Liste des figures, tableaux, illustrations
Figure 1.. ... 4 Figure 2. ... 5 Figure 3.. ... 7 Figure 4.. ... 9 Figure 5. ... 11 Figure 6.. ... 16 Figure 7.. ... 18 Figure 8………28 Figure 9 ………...28 Figure 10………..34 Figure 11.. ... 33 Figure 12………..36 Figure 13………..37 Figure 14………..38 Figure 15………..39 Figure 16 ……….40 Figure 17………..41 Figure 18………..50Liste des abréviations, sigles, acronymes
AAV Virus adénoassocié Aβ Bêta amyloïde
ADN Acide désoxyribonucléique ARN Acide ribonucléique
ARNi Acide ribonucléique d’interférence ASO Oligonucléotides antisens
ATP Adénosine triphosphate
BDNF Brain-derived neurotrophic factor BHE Barrière hématoencéphalique CFP Cyan fluorescent protein chFP mCherry
CMV Cytomegalovirus
CRISPR Clustered regularly interspaced short palindromic repeats DAPI 4’,6-DiAmino-2-PhenylIndole
DRP Domaine riche en proline GABA Acide γ-aminobutyrique GFAP Glial fibrillary acidic protein GFP Green fluorescent protein HA Hemagglutinine
HEK Human embryonic kidney Htt huntingtine
hPSC Cellules souches pluripotentes humaines IPSC Cellules souches pluripotentes induites kb 1000 paires de bases
KPBS Phasphate-buffered Saline Potasium MA Maladie d’Alzheimer
MH Maladie de Huntington mHTT protéine huntingtin mutée MP Maladie de Parkinson PAM Protospacer adjacent motif PBS Phasphate-buffered Saline PFA Perfluoroalkoxy
Poly-Q Polyglutamines
PSN Polymorphismes d’un seul nucléotide Sa Staphylococcus aureus
SDS Sodium dodecyl sulfate SNC Système nerveux central
SP-PCR small pool polymerase chain reaction Sp Streptococcus pyogenes
TALEN Transcription activator-like effector nucleases TH Tyrosine hydroxylase
VIH Virus de l’immunodéficience humaine WT Sauvage
ZFN Protéines a doigts de zinc 6-OHDA 6-Hydroxydopamine
“The science of today is the technology of
tomorrow” - Edward Teller
Remerciements
J’aimerais tout d’abord remercier ma directrice Francesca Cicchetti qui m’a permis de faire partie de son équipe et de participer à plusieurs projets intéressants. Ces deux dernières années m’ont permis de développer mon esprit scientifique et d’en apprendre beaucoup sur moi-même. Merci aussi à Martine Saint-Pierre pour sa patience et son aide; je ne pense pas que ce laboratoire pourrait se passer de toi!
Un merci tout spécial à toute l’équipe pour les beaux moments passés ensemble, pour votre soutien et votre accueil. À Mélanie sans qui ce projet n’aurait jamais eu lieu et qui a été une mentore extraordinaire pour moi. À Philippe avec qui j’ai pu partager tellement de choses au cours de ces deux années et que j’espère pouvoir revoir très bientôt. À Marie et Héléna avec qui j’ai créé de beaux liens qui resteront longtemps. À Shireen qui m’a permis de confirmer qu’il est possible de survivre en se nourrissant que de poutines. À Giacomo, Alberto et Alex pour les bons moments passés ensemble. À Linda pour m’avoir toujours aidé sans compter le temps investi, pour les discussions sur les voyages et pour les bonnes recommandations de restos. À Maria pour sa grande générosité et sa douceur.
À mes amis du bureau pour les amitiés et les discussions qui nous ont tous permis de décrocher un peu de nos manipulations et des problèmes dans nos projets respectifs. À Jérémy pour son soutien, ses encouragements et son amour lors des moments plus difficiles.
Avant-propos
Durant mon séjour dans le laboratoire de la Dre Cicchetti, j’ai eu la chance d’être principalement impliquée sur le projet portant sur l’évaluation comportementale et post-mortem d’un traitement par CRISPR/Cas9 d’un modèle de souris huntingtoniennes, dont traite le présent mémoire. J’ai également eu la chance de participer à 3 autres projets; l’un portant aussi sur la maladie de Huntington, tandis que les deux autres sujets traitent de la maladie de Parkinson. La suite de cet avant-propos consistera en un bref résumé de ces projets secondaires.
Dans un premier temps, j’ai pu travailler sur le projet « parabiose irradiation » de Marie Rieux. L’objectif de ce projet était de mettre en évidence l’importance des cellules sanguines dans l’expression phénotypique de la maladie de Huntington. Pour ce faire, nous avons utilisé la technique de parabiose suivi d’une irradiation. La technique de parabiose consiste à lier deux organismes ensemble, dans ce cas-ci ce sont des souris qui ont subi l’opération. La parabiose va permettre aux cellules sanguines de la souris non irradiée de se propager et repeupler la niche hématopoïétique de la souris non irradiée. L’hypothèse était que la compromission de l’hématopoïèse chez la souris WT suivie d’une repopulation de la niche hématopoïétique par les cellules sanguines de la souris MH permettraient à la souris saine d’incorporer la protéine pathologique. L’étude inverse a également été effectuée. Il était alors question de déterminer les effets de la dilution de la protéine mutée dans l’organisme malade. Dans ce cas, la souris MH a été irradiée afin de favoriser une repopulation de la niche hématopoïétique par des cellules génétiquement saines. Des analyses de prélèvements sanguins sur les érythrocytes, les plaquettes et les leucocytes ont permis d’assurer l’efficacité de l’irradiation. Mon rôle dans le cadre de ce projet était principalement d’effectuer les analyses stéréologiques et donc de compter les agrégats de mHTT présents dans le cortex et le striatum des souris MH qui ont été ou non irradiées. J’ai également aidé avec la coupe des cerveaux pour les analyses post-mortem ainsi que pour quelques analyses par western blot.
Ensuite, j’ai travaillé sur le projet « explant » dirigé par Linda Suzanne David. La cystéamine, par ses propriétés cliniques et sa capacité à traverser la barrière hématoencéphalique, se voit être une molécule thérapeutique à fort potentiel. L’objectif du projet est donc de comprendre le rôle neuro-restaurateur de la cystéamine pour la maladie de Parkinson selon un modèle ex vivo. L’aire tegmentale ventrale d’embryons de souris PitX3 GFP de 14,5 jours
de développement a été prélevée, puis divisée en 5 à 6 pièces. Les explants se sont développés pendant 72 heures. Du 6-OHDA leur a ensuite été administré pendant 24 heures afin de détruire les neurites qui s’étaient développées, ce qui « imite » les dommages que peut entrainer la pathologie. Pendant les 48 heures suivantes, de la cystéamine et/ou de la rasagiline ont été ajoutées aux explants. Les cônes de croissance et les neurites ont été marqués avec une combinaison d’actine et de filamentine lors de la fixation des explants. Mon rôle a été de faire l’analyse de ces explants. Ainsi, le nombre de neurites et de cônes de croissance a été compté. Les résultats préliminaires montrent que le 6-OHDA réduit le nombre de neurites d’une façon similaire à ce qu’il est possible de voir chez les patients atteints de la maladie de Parkinson. Les évaluations en cours indiquent que la cystéamine et la rasagiline ne restaurent pas de façon significative les neurites. De nouvelles doses et méthodes d’analyse sont actuellement explorées.
Enfin, j’ai aussi travaillé sur le projet « raptor rasagiline » avec Alberto Siddu et Martine Saint-Pierre. Dans ce projet, le potentiel thérapeutique de la cystéamine dans le cas de la maladie de Parkinson est, cette fois-ci, évalué chez des souris présentant un phénotype parkinsonien. Ainsi, la cystéamine a été testée afin d’investiguer 1) les propriétés neuroprotectrices ou neurorestauratrices sur le système dopaminergique et 2) sur des aspects pathologiques proéminents, tels que les corps de Lewy, retrouvés principalement dans le cerveau (via l’utilisation d’une souris transgénique surexprimant la protéine alpha-synucléine, composante majeure des corps de Lewy). Lors des études, les résultats étaient comparés à la rasagiline, le seul médicament soupçonné d'avoir des capacités restauratrices dans le parkinsonisme humain. Mon rôle dans le cadre de ce projet était principalement d’effectuer les analyses stéréologiques suite à une analyse par immunohistochimie. Ainsi, des coupes de cerveau de 120 animaux ont été marquées par l’anticorps TH et j’ai compté les cellules dopaminergiques exprimant ou non ce marquage.
Introduction
La maladie de Huntington
Historique
C’est en 1872 que le médecin généraliste George Huntington décrit pour la première fois les symptômes de la maladie de Huntington (MH), la différenciant par le fait même de la chorée de Sydenham, qui était pour sa part une chorée infantile d’origine infectieuse. Il publie sa description dans le journal Medical and Surgical Reporter (Huntington 1872). La caractéristique la plus marquante de cette description est la présence de mouvements involontaires chez les patients atteints, ressemblant à une danse, d’où le nom de « chorée » donné par le Dr Huntington (Huntington 1872). Le terme « chorée » fut mis de côté plus tard et remplacé par « maladie », étant donné qu’il ne référait qu’à l’un des multiples symptômes de la maladie. À l’époque, Huntington observe que lorsqu’un patient atteint de la maladie a des enfants, un ou plusieurs de ceux-ci développeront à leur tour la maladie, ce qui laisse entrevoir l’aspect héréditaire de la maladie. Il observe également que les enfants non atteints n’ont pas d’enfants atteints, suggérant cette fois-ci que la maladie est génétiquement dominante (Huntington 1872). La description d’Huntington indique donc que la maladie touche les adultes, qu’elle est héréditaire et incurable (Huntington 1872). Cependant, c’est seulement en 1993 que le Huntington’s Disease Collaborative Research Group réussit à identifier le gène responsable de la maladie; il est d’abord nommé IT15,
Interesting Gene 15, avant d’être renommé « huntingtine ».
Prévalence
La prévalence de la MH dans le monde est de 2,71 cas sur 100 000 habitants (Pringsheim
et al. 2012). Or, il est possible d’observer une variation importante de prévalence entre les
différentes populations. L’analyse effectuée par Pringsheim et son équipe en 2012 sur plusieurs études montre qu’en Amérique du Nord, en Europe et en Australie, la prévalence de la MH est en moyenne de 5,70 personnes atteintes sur 100 000, alors qu’en Asie, on observe plutôt une prévalence de 0,40 sur 100 000; la comparaison des deux groupes a montré que la différence est significative. Cette importante différence peut être expliquée en partie par le nombre de répétitions de CAG présent en moyenne dans les populations. En effet, il a été montré que le nombre d’expansions de CAG est en moyenne plus grand dans les populations européennes (18,4 ± 3,7) que dans les populations asiatiques (16,5 ± 1,5)
et africaines (16,2 ± 2,5) (Squitieri et al. 1994; Pringsheim et al. 2012). Les différents haplotypes du gène huntingtine (Htt) peuvent également expliquer la diversité géographique et ethnique de la prévalence. En effet, les haplotypes A, B et C de la MH sont caractérisés par des polymorphismes d’un seul nucléotide (PSN), dont certains corrèlent avec la présence d’une expansion marquée de la répétition du CAG. Il est possible d’observer dans la population européenne ces haplotypes associés aux PSN de façon plus récurrente qu’en Asie ou en Afrique (Warby et al. 2009; Pringsheim et al. 2012). Au Canada, on évalue la prévalence de la MH à 13,2 personnes atteintes pour 100 000 habitants; une prévalence nettement plus élevée que la moyenne mondiale. Les populations ayant une ascendance européenne, comme c’est le cas du Canada, ont, logiquement, elles aussi une prévalence importante.
Causes génétiques
Le gène Htt est présent dans l’exon 1 du chromosome 4. Dans le cas de la MH, une mutation au niveau de ce gène entraine la production d’une protéine anormale (Gusella et al. 1983; Duyao et al. 1993). La protéine Htt possède une queue polyglutamine, soit une répétition du codon cytosine (C), adénine (A) et guanine (G) (CAG), codant pour la glutamine, en N-terminal. La longueur de la queue polyglutamine détermine la conformation de la protéine et donc, sa pathogénicité. Une queue polyglutamine présentant entre 6 et 35 triplets CAG entraine une fonction normale de la protéine. Lorsqu’il y a entre 35 et 39 répétitions, la pénétrance est incomplète, ce qui entraine une certaine instabilité dans le gène. Certains individus développeront la maladie, d’autres non, et leur descendance aura plus de probabilités d’avoir un nombre élevé de répétitions du trinucléotides CAG (Pringsheim et al. 2012). Au-delà de 39 répétitions, la protéine est dite mutée (mHTT), elle change de conformation et forme des agrégats dans le cytoplasme des neurones, ce qui compromet grandement sa fonction. Le développement de la maladie est alors inévitable (Sun et al. 2017). D’un point de vue génétique, l’allèle muté est autosomique dominant (Conneally 1984). Ainsi, la seule présence d’un allèle malade suffit à provoquer la pathologie. Par le fait même, les enfants d’un couple dont l’un des partenaires est porteur de l’allèle malade auront 50% de probabilité d’être malades à leur tour; s’ils ne sont pas malades, il n’y aucune probabilité qu’ils transmettent le gène à leur propre descendance. Aussi, il est important de noter que 10% des cas de MH sont des cas sporadiques, ce qui veut donc dire que la maladie est causée par une mutation de novo (Falush et al. 2000). Par ailleurs, il existe une
souvent supérieur à 60 (Wiatr et al. 2018). En effet, le nombre de répétitions du trinucléotides CAG a une très grande importance dans la pathologie; plus le nombre de CAG est élevé plus la maladie sera sévère et se déclenchera tôt (Sun et al. 2017). Les cas juvéniles de la maladie représentent environ 3 à 10% des cas MH (Sunwoo et al. 2010; Sun
et al. 2017).
Symptômes
La MH est divisée en plusieurs phases. On compte tout d’abord la phase présymptomatique. Ensuite, la phase prodromique est caractérisée par une légère altération des fonctions motrices et cognitives. Cette phase dure en moyenne 15 ans, mais n’est pas suffisante pour poser un diagnostic complet. Le diagnostic sera fait lorsque des troubles moteurs importants apparaitront chez un patient ayant des antécédents familiaux ou ayant effectué des tests génétiques. La maladie se manifeste par des troubles cognitifs, psychiatriques, ainsi que des dysfonctionnements moteurs (Walker 2007; Ha et Fung 2012); entre autres des mouvements involontaires et/ou non coordonnés qualifiés de « chorée » (Zuccato et al. 2010) sont observables chez les patients atteints. Le décès survient généralement de 10 à 30 ans après le diagnostic. Les patients souffrent de mouvements involontaires, de problèmes de coordination et de bradykinésie, soit une perte de la finesse ainsi qu’un ralentissement des mouvements. Des troubles de la posture et d’équilibre ainsi que des difficultés à déglutir et à articuler sont également à considérer pour ce qui est des troubles moteurs. En ce qui concerne les troubles cognitifs, ils sont nombreux dans le cas de la MH. Il est possible d’observer des pertes de mémoire, des problèmes d’orientation et des troubles d’attention. Une démence est également notable au fur et à mesure que la maladie s’aggrave. Enfin, dû à leur perte d’autonomie, de nombreux patients souffrent de dépression, en plus d’être affectés par de nombreux autres troubles psychiatriques tels que de l’irritabilité, de l’anxiété et de l’apathie.
D’un point de vue anatomique, il est possible d’observer chez les patients atteints de la MH une atrophie du striatum et du cortex, deux structures du cerveau importantes pour les systèmes cognitif et moteur (Figure 1) (Reiner et al. 2011). Le striatum fait partie des ganglions de la base et comprend le putamen, le noyau caudé et le noyau accumbens. C’est une région du cerveau qui est impliquée dans la genèse et l’inhibition des mouvements volontaires et involontaires, ce qui explique qu’une atrophie puisse avoir de si graves conséquences motrices pour un patient atteint de la MH. Ce sont les neurones GABAergiques épineux moyens qui sont le plus affectés dans le cas des atrophies du striatum; tandis qu’on parle plutôt des neurones de la couche VI dans le cas des atrophies corticales (Davies et Ramsden 2001). Des dégénérescences au niveau du cervelet, de l’hippocampe, du noyau du tronc cérébral et de la substance noire peuvent également être observées.
Aussi, la barrière hématoencéphalique (BHE) est une membrane endothéliale présente entre la circulation sanguine et le système nerveux central (SNC). La BHE a comme principale fonction la protection des neurones contre différents facteurs présents dans la circulation systémique et permet de maintenir le milieu du SNC de façon à ce qu’il soit hautement régularisé (Sweeney et al. 2018). Elle agit ainsi comme un filtre extrêmement sélectif. Dans le cas de la MH, une augmentation de la perméabilité de la BHE dans le noyau caudé est observable, ce qui entraine l’afflux d’agents pathogènes, de débris ou de cellules
Figure 1. Coupe d’un télencéphale humain, montrant un cerveau sain à droite et un cerveau
huntingtonien avancé à gauche. Des atrophies profondes au niveau du cortex et du noyau caudé ainsi qu’une expansion du ventricule sont observables (tirée de Reiner et al, 2011).
2015; Sweeney et al. 2018). En effet, une diminution de l’expression de la protéine occludine, une protéine transmembranaire présente dans les jonctions serrées, ainsi qu’une augmentation du nombre de leucocytes dans les espaces périvasculaires reflètent une augmentation de la quantité de cellules sanguines circulant dans le cerveau de patients MH. Les changements rapportés dans la BHE permettent ainsi aux leucocytes du système périphérique d’entrer dans le SNC plus facilement. Ces leucocytes joueraient alors le rôle de transporteur pour la mHTT vers le cerveau ou aurait un rôle dans les réponses inflammatoires cérébrales. L’accumulation de dépôts de fibrine observables dans les cerveaux MH concorde également avec cette théorie (Drouin-Ouellet et al. 2015).
Bien que l’impact de la MH sur les neurones ne soit plus à démontrer, le fait que la maladie soit ubiquitaire implique que toutes les cellules du corps expriment le gène muté. Ainsi, la mHTT entraine certaines répercussions dans plusieurs organes périphériques. En effet, des atrophies musculaires, une diminution de la production de certaines hormones importantes ou des problèmes au niveau du rythme cardiaque peuvent être observés (van der Burg et
al. 2009). Les détails quant à l’implication de la mHTT dans les troubles périphériques des
patients MH sont présentés dans la figure 2.
Figure 2. Pathologies périphériques présentes chez les patients atteints de la maladie de
La protéine huntingtine
Généralités
Le gène Htt code pour la protéine huntingtine, une protéine produite de façon physiologique par le corps humain. La protéine comprend environ 3144 acides aminés si on considère que la queue poly-Q contient 23 unités; le nombre d’acides aminés changeant en fonction de la longueur de la queue polyglutamine (Saudou et Humbert 2016). La protéine possède un poids moléculaire d’environ 350 kDa et comprend un total de 67 exons. On retrouve le gène
Htt au niveau du chromosome 4 en position 4p16.3 (Saudou et Humbert 2016). L’expansion
du trinucléotide CAG muté dans le cas de la MH se situe dans l’exon 1 de ce gène. Au niveau de cet exon, il est possible de compter trois domaines principaux, soit le domaine N-terminal, la queue poly-Q composée uniquement de glutamines et dont le nombre de polymorphismes est assez important, et enfin le domaine riche en proline, le DRP, qui est composé de 50 acides aminés (Tartari et al. 2008). Chacun de ces domaines a ses propres fonctions. Premièrement, le domaine N-terminal agit comme un signal d’export nucléaire. De nombreuses modifications génétiques peuvent survenir au niveau de ce domaine, ce qui impacte la localisation et la dégradation éventuelle de la protéine (Atwal et al. 2007; Thompson et al. 2009). En ce qui concerne le domaine DRP, il est lui aussi sujet à de nombreux polymorphismes. En effet, le DRP est impliqué dans l’interaction avec les autres protéines (Neveklovska et al. 2012). Aussi, le DRP et le domaine N-terminal joueraient un rôle important dans la tendance de la protéine à s’agréger dans le cas de pathologies. Enfin, le rôle du domaine de la queue poly-Q, qui est particulièrement polymorphique et dont la mutation engendre l’apparition de la MH, est assez peu connu.
Étant donné la présence de la mutation engendrant la MH dans l’exon 1, cet exon a été bien étudié, au détriment des 66 autres exons présents dans le gène de la Htt. Ainsi, le peu de recherches effectuées sur le reste du gène a pu montrer que la protéine pouvait prendre différentes conformations tridimensionnelles, allant même jusqu’à une centaine de conformations différentes, grâce aux motifs HEAT qui constituent les exons du gène (Seong
et al. 2010).
La protéine huntingtine n’a pas vraiment d’homologie structurale avec les autres protéines humaines, la détermination de ses fonctions normales a donc été plus compliquée. Ainsi, grâce à l’étude de la MH, certaines fonctions importantes de la Htt ont pu être identifiées
Fonctions de la protéine
Comme mentionné précédemment, la protéine Htt est ubiquitaire : elle est donc exprimée dans tous les tissus de l’organisme. Cependant, son expression est beaucoup plus importante au niveau du système nerveux central (Figure 3) (Carroll et al. 2015).
La protéine Htt est essentielle au bon fonctionnement de la cellule et permet la régulation de plusieurs fonctions cellulaires. La protéine Htt est impliquée dans les mécanismes de transports vésiculaires antérogrades et rétrogrades. Pour ce faire, la Htt s’associe avec d’autres protéines de transport, telles que la kinésine, la dynéine ou la dynactine (Elias et
al. 2014; Saudou et Humbert 2016). Ainsi, il lui est possible d’interagir dans le transport de
différents éléments cellulaires importants, tels que certaines vésicules transportant les précurseurs des vésicules synaptiques, des facteurs trophiques comme les facteurs neurotrophiques dérivés du cerveau (BDNF) ou de l’ATP (Saudou et Humbert 2016). La protéine Htt peut également s’associer avec des protéines de l’endocytose, ce qui implique qu’elle joue un rôle dans le recyclage des vésicules qui ne sont plus utiles (Modregger et al. 2003), dans le transport des endosomes (Pal et al. 2006) ainsi que dans le mécanisme d’endocytose (Engqvist-Goldstein et al. 2001). Les mécanismes d’autophagie de la cellule impliquent également la protéine Htt, et ce, toujours au niveau du transport, puisqu’elle joue
Figure 3. Expression des ARNm et des protéines de la huntingtine dans les tissus et les
un rôle dans le trafic des autophagosomes et des protéines qui lui sont associées au niveau des axones (Wong et Holzbaur 2014).
La protéine Htt interagit avec plusieurs facteurs de transcription, tels que NF-κB (Takano et Gusella 2002) ou p53 (Steffan et al. 2000), de même qu’avec des récepteurs nucléaires, ce qui implique qu’elle a un rôle au niveau de la régulation de la transcription. Il est également possible de retrouver la protéine Htt au niveau des microtubules et du fuseau mitotique, suggérant un rôle dans la division cellulaire (Elias et al. 2014). Aussi, la Htt permet l’inhibition de l’activation des caspases 3 et 9, prévenant ainsi l’apoptose (Zhang et al. 2006). La protéine, comme mentionné plus haut, favorise la transcription et le transport du BDNF; ces deux derniers rôles étant particulièrement importants pour la survie cellulaire. Enfin, la protéine Htt est essentielle à la différenciation des neuroblastes lors de la formation du striatum, du cortex ainsi que du thalamus (Reiner et al. 2001). Toujours lors de l’embryogénèse, la Htt est impliquée dans le mécanisme de migration, de la zone ventriculaire vers la plaque corticale, des neurones corticaux (Tong et al. 2011), mais aussi dans la mobilité ciliaire des épendymocytes, ce qui permet la circulation du liquide céphalorachidien (Keryer et al. 2011). Il a été montré que la suppression embryonnaire du gène était létale chez la souris. Ainsi, un knock-out du gène dans l’embryon n’est donc pas envisageable comme potentielle thérapie (Duyao et al. 1995; Nasir et al. 1995; Zeitlin et al. 1995).
La protéine mutée mHTT et son agrégation
Considérant la queue poly-Q anormalement longue dans le cas de la MH, la formation d’un ARN messager aberrant codant seulement pour l’exon 1 est possible; conduisant à la synthèse de la partie N-terminal de la protéine uniquement (Sathasivam et al. 2013). Ce fragment produit est alors considéré comme la première forme toxique de la mHTT (Ross et Tabrizi 2011). Ces fragments peuvent également être formés lors d’un clivage de la protéine complète. Il serait possible d’expliquer la toxicité de ces fragments par leur capacité à entrer dans le noyau de la cellule et ainsi perturber la transcription. Aussi, étant donné le changement de conformation de la protéine, ses implications dans les différents mécanismes vus plus haut ne sont plus possibles, ce qui engendre, par exemple, des inhibitions de l’autophagie et du protéasome, des altérations de l’endocytose ou encore des arrêts de transports vésiculaires provoquant la mort cellulaire (Frank 2014). Ainsi, plusieurs
de ces mécanismes peuvent survenir en même temps et contribuer à la pathogenèse de la MH.
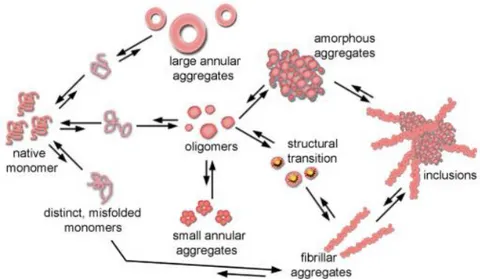
La MH est caractérisée par la présence d’agrégats de mHTT au niveau cellulaire, qu’il est possible d’observer dans le cytoplasme et dans le noyau. Dépendamment de la conformation que la protéine mutée prendra lors de son assemblage, différents niveaux de toxicités peuvent être possibles. Des études ont permis de démontrer que la forme fibrillaire de la mHTT est la forme la plus toxique de la protéine (Figure 4) (Legleiter et al. 2010; Hoop
et al. 2016; Drombosky et al. 2018). Ces formes fibrillaires sont également observables pour
d’autres protéines telles que l’alpha-synucléine et la bêta amyloïde (Aβ) dans la maladie de Parkinson (MP) et la maladie d’Alzheimer (MA) respectivement (Fernàndez-Busquets 2013). Dans les cas de ces trois maladies, les protéines pathogènes ont comme caractéristiques leur facilité à former des feuillets β, ce qui est très important dans les interactions entre protéines (Hoop et al. 2016); une propriété qui est également présente chez la protéine prion.
Propagation et propriétés prioniques
Les premières évidences de la propagation de la mHTT ont été observées dans des études
in vitro. En 2002, l’équipe de Yang a montré que les cellules Cas-7 et PC12 sont capables
d’intégrer des peptides poly-Q synthétiques lorsque ceux-ci étaient intégrés au milieu de culture (Yang et al. 2002). Cette étude est la première à montrer la capacité de la mHTT à
Figure 4. Modèle des agrégations et des repliements possibles en ce qui concerne la
être assimilée par d’autres cellules. Une étude publiée en 2009 s’intéresse plus spécifiquement à l’intégration de la forme fibrillaire de la mHTT avec une queue poly-Q de 44Q dans différents types cellulaires (Ren et al. 2009). Dans cette étude, en plus d’observer l’intégration dans les cellules par passage passif des fibrilles, il a également été possible de noter que les fibrilles s’associaient avec différentes protéines, telles que la Hsp70 et l’ubiquitine, la sous-unité du protéasome. De plus, en associant la Htt avec une queue poly-Q non pathologique de 25poly-Q et une protéine fluorescente CFP dans des cellules HEK293, il a également été montré que les fibrilles étaient capables d’entrainer l’agrégation de la Htt endogène, un mécanisme semblable à celui qu’on retrouve chez le prion (Ren et al. 2009). Enfin, une autre expérience utilisant des cellules HEK293 exprimant soit chFP-HttQ25 ou GFP-HttQ71 qui ont été mises en co-culture a permis de montrer que la GFP-HttQ71 a été capable de se propager vers les cellules exprimant la forme non mutée du gène et induire son agrégation (Ren et al. 2009). Une autre étude mettant ainsi la capacité de propagation de la mHTT en évidence.
Lors d’une étude publiée en 2014, des cerveaux ayant reçu des greffes de tissus fœtaux de striatum sont analysés (Cicchetti et al. 2014). Ces cerveaux provenaient de trois patients huntingtonniens greffés décèdent des suites de la MH environ 10 ans après leur opération. Des analyses par immunohistochimie ont été effectuées au niveau des striatum greffés. Il a été possible d’observer, comme la théorie l’indique, la présence d’agrégats mHTT dans différentes régions du cerveau, notamment au niveau des greffons (Figure 5) (Cicchetti et
al. 2014). Cela paraissait singulier compte tenu du fait que le matériel génétique des cellules
constituant le greffon n’a pas de mutation au niveau du gène Htt. La présence d’agrégats dans ces tissus, en théorie sains, peut s’expliquer par une propagation des agrégats déjà présents dans le cerveau des patients huntingtoniens, que ce soit dans les cellules ou dans l’environnement extracellulaire. On avait ici une première évidence in vivo de la capacité de la protéine huntingtine à se propager.
Enfin dans l’étude publiée en 2019 par Masnata et al. la capacité d’intégration de la mHTT a été démontrée après incubation de fibrilles recombinantes mHTT-Q48 dans 3 différents types cellulaires : des cellules neuronales GABA dérivées de cellules souches pluripotentes induites humaines, des macrophages humains dérivés THP-1 et des cellules SH-SY5Y, (Masnata et al. 2019). Ces intégrations ont également engendré de la mort cellulaire, des changements morphologiques et des variations d’agrégation de la Htt (Masnata et al. 2019). Cette étude semble, encore une fois, apporter des preuves que la mHTT possède la capacité à se propager.
Plusieurs autres études ont ainsi été menées afin de comprendre par quels mécanismes la mHTT se propage d’une cellule à une autre, mais également, quelles sont les implications d’une telle découverte sur ce qu’on connait de la MH et sur de possibles thérapies. Une première étude in vivo dans laquelle on exprime les 12 premiers exons du gène Htt avec un marqueur fluorescent dans les neurones olfactifs de drosophiles montre une propagation des agrégats dans tout le cerveau (Babcock et Ganetzky 2015). Cette étude a également montré que la mHTT se propage via des circuits neuronaux définis. Dans une deuxième étude chez la drosophile, des chercheurs tentent d’exprimer uniquement l’exon 1 de la Htt avec une queue poly-Q de 91 répétitions ainsi qu’une protéine fluorescente dans les
Figure 5. Présence de mHTT chez les patients huntingtonniens transplantés (tiré de
neurones olfactifs (Pearce et al. 2015). Ils viennent ensuite endommager par chirurgie les neurones olfactifs génétiquement modifiés, ce qui entraine la libération de la protéine mutée dans le milieu extracellulaire environnant. Les cellules gliales ont alors phagocyté la protéine Htt91Q relâchée; des agrégats formés des deux formes de Htt : de la forme saine de 25Q et/ou de celle mutée à 91Q, ont pu ensuite être observés (Pearce et al. 2015). Cette étude démontrait pour la première fois les capacités de la mHTT à s’agréger à la Htt et à la corrompre, une propriété également présente chez les prions.
Enfin, les premières études portant sur des modèles animaux plus élaborés ont été publiées. Dans une étude, des souris néonatales saines ont reçu des injections de cellules souches pluripotentes induites (IPSC) et de fibroblastes de patients huntingtoniens au niveau des ventricules cérébraux (Jeon et al. 2016). Ces injections ont permis d’observer le développement d’un phénotype huntingtonien chez les souris qui n’avaient à la base pas de mutation. Suite à cela, de nouvelles analyses ont été effectuées dans cette étude, sur des cellules SH-SY5Y afin d’essayer de comprendre les mécanismes de propagation de la mHTT (Jeon et al. 2016). L’étude a alors démontré que la mHTT pouvait être sécrétée par les cellules et que les exosomes leur permettaient de se disperser (Jeon et al. 2016). D’autres études ont permis de démontrer que les mécanismes de propagation de la protéine mutée sont multiples; notamment via des vésicules ou par endocytose (Ruiz-Arlandis et al. 2016). Masnata et al. ont également utilisé des souris sauvages nouveau-nées et adultes (Masnata et al. 2019). Dans l’étude, des fibrilles sont injectées de façon bilatérale intraventriculaire chez les nouveau-nés et de façon unilatérale intra corticale chez les adultes. Il a ainsi été possible de démontrer une modification de la Htt endogène et une présence de fibrilles dans les cerveaux de souris 14 mois après les injections (Masnata et
al. 2019).
Ces différentes études in vitro et in vivo apportent différentes preuves à la théorie du comportement prionique de la protéine mHTT. Ces informations sont particulièrement importantes pour la bonne compréhension des mécanismes d’action de la MH, et donc capitale pour le développement éventuel d’une thérapie ciblant directement la cause de la maladie.
Modèles animaux
par injections intrastriatales de reproduire la perte de neurones GABAergiques caractéristique de la MH (Pouladi et al. 2013). Les lésions engendrées causaient cependant plusieurs restrictions et n’entrainaient pas la plupart des manifestations neurologiques qu’implique la MH, qu’elles soient au niveau du striatum ou des autres structures impliquées dans la maladie. Les modèles créés par modifications génétiques ont donc été largement priorisés pour étudier la MH, d’autant plus considérant le caractère génétique de la maladie. Plusieurs approches génétiques ont été tentées afin de produire un modèle convenable à l’étude de la maladie : l’utilisation de la séquence complète ou seulement d’un fragment de la séquence de la mHTT, la répétition du CAG incorporée dans une construction génétique, l’utilisation d’un knock-in dans un locus endogène de la Htt, l’utilisation du gène Htt humain, l’utilisation d’un ADNc ou d’un ADN génomique contenant des introns et des séquences régulatrices ou encore l’utilisation des promoteurs Htt pour conduire à l’expression de la protéine mutée (Pouladi et al. 2013).
Certains modèles MH d’animaux invertébrés ont été générés grâce à ces techniques dont les modèles Caenorhabditis elegans et Drosophila melanogaster. Dans les deux cas, on observe de la dégénérescence et des dysfonctionnements neuronaux, ainsi que des dysfonctionnements mécano sensoriels liés à l’âge malgré le fait que la protéine HTT ne soit à la base pas présente dans la génétique de ces espèces (Pouladi et al. 2013). Considérant le fait qu’ils ont une génétique et des mécanismes très différents de ceux des humains, les invertébrés apportent leur lot de limitations. Cependant, ces modèles animaux sont amplement utilisés puisqu’ils sont peu dispendieux et simples à manipuler, ce qui permet d’étudier plusieurs molécules, principes et théories en lien avec la pathologie avant d’effectuer des manipulations chez des animaux plus complexes.
Les animaux vertébrés ont des liens plus étroit avec la génétique de l’humain. Ainsi, les rongeurs sont, comme c’est le cas pour plusieurs autres maladies, les animaux les plus étudiés dans le cas de la MH. On compte plus de 25 modèles de souris présentant un phénotype huntingtonien, lesquels sont classés selon 3 catégories les regroupant par méthode de modification génétique. Ainsi, soit l’exon 1 du gène Htt est introduit dans le génome de la souris (knock in), soit le gène Htt endogène est remplacé par la version humaine mutée, et dans ces cas-ci le gène peut être tronqué ou complet (Pouladi et al. 2013). Les modèles knock in représentent plus fidèlement le contexte génétique de la MH chez des patients humains (Menalled et al. 2012). Le promoteur utilisé ainsi que le nombre de répétitions du trinucléotides CAG vont également varier d’un modèle à l’autre. Les souris
zQ175 sont un modèle knock in bien connu de la MH et sont caractérisées par un nombre de répétitions de CAG d’environ 188 (Pouladi et al. 2013; Peng et al. 2016). Ce modèle de souris MH est utilisé principalement pour observer à long terme les mécanismes ou comportements à l’étude, étant donné que la maladie se développe plus tard et que le développement des symptômes est plus lent que chez certains autres modèles. Le modèle de souris R6/2, par exemple, est également très utilisé en recherche. Cette souche développe la maladie aux environs de 8 semaines de vie et les symptômes huntingtoniens sont sévères. D’un point de vue génétique, le modèle R6/2 compte 160 répétitions CAG. La souche zQ175 est le modèle utilisé dans le cadre de cette étude.
Enfin, l’utilisation de grands animaux comme modèles pour la MH est très limitée. Bien que l’utilisation de petits animaux soit fort pertinente et qu’elle permet l’acquisition d’une multitude d’informations, il n’en reste pas moins que les caractéristiques de la maladie observées chez les rongeurs ne sont pas exactement celles présentes chez l’Homme. Or, en étudiant des modèles de grands animaux, qui sont plus similaires d’un point de vue évolutif à l’humain, les mécanismes de la maladie seront plus fidèles à ceux des patients MH et le risque d’erreurs sera inévitablement plus faible (Yan et al. 2019). Des modèles de moutons, de mini cochons et de primates non humains ont tenté d’être développés (Pouladi
et al. 2013). La difficulté à modifier le génome de ces espèces, les grands coûts des
interventions ainsi que certains problèmes expérimentaux, tels que des morts prématurées ou des absences du phénotype de la maladie, compliquent cependant beaucoup la réussite de ces modèles (Pouladi et al. 2013; Yan et al. 2019).
Traitements actuels et essais cliniques
Actuellement, il n’y a pas de thérapie curative disponible pour les patients atteints de la MH; les thérapies actuelles se limitant à améliorer la qualité de vie des patients en amoindrissant les effets des symptômes. Les interventions pharmacologiques disponibles ciblent donc principalement les dysfonctionnements moteurs qui sont associés avec la MH. La tétrabénazine est spécifique et est le seul médicament approuvé par le US Food and Drug Administration pour traiter la chorée dans le cas de la MH (Frank 2014; Wyant et al. 2017). Les patients atteints peuvent aussi se voir prescrire des médicaments réduisant la quantité de dopamine dans l’organisme, permettant de soulager les symptômes relatifs aux mouvements désordonnés et à l’agitation (Dickey et La Spada 2018). Des antipsychotiques,
médicaments, tels que le tétrabénazine (Frank 2014). D’autres médicaments peuvent également être prescrits dépendamment des cas et des différents symptômes observés (Frank 2014; Wyant et al. 2017). La méthode de stimulation cérébrale profonde, une méthode notamment utilisée dans le cas de la maladie de Parkinson, est un traitement non pharmaceutique en essai clinique de phase 1; les résultats préliminaires montrant une certaine efficacité dans l’amélioration de quelques symptômes (Wojtecki et al. 2016). Depuis la découverte du gène causant la MH, de plus en plus d’approches thérapeutiques sont basées sur le fait de modifier directement la cause de la maladie. De la protection des neurones à diverses interventions métaboliques en passant par les thérapies géniques, les idées sont nombreuses (Dickey et La Spada 2018). Cependant, compte tenu du fait que la façon dont la mHTT entraine le développement de la MH n’est pas encore complètement connue, savoir quoi cibler est compliqué. Des essais ont été effectués afin d’augmenter la quantité de BDNF (Corey-Bloom et al. 2014), d’augmenter la protection mitochondriale (Huntington Study Group 2010), de diminuer l’excitotoxicité neuronale (Kremer et al. 1999) ou encore de diminuer les éléments réactifs de l’oxygène avec des coenzymes ou de la créatine par exemple, sans résultat significatif (Wyant et al. 2017). Les immunothérapies sont également des approches testées comme thérapie potentielle, étant donné le rôle du système immunitaire dans la MH qui ne peut plus être ignoré. En effet, il a été montré que la concentration de molécules pro-inflammatoires circulant dans l’organisme augmente dans le cas de la pathologie. Les résultats en essais de traitement pour cette caractéristique sont cependant trop peu concluants pour l’instant (Denis et al. 2019). La combinaison d’immunothérapies et d’autres types d’approches pourrait cependant être très intéressante. Les technologies de « gene silencing » sont maintenant en actif développement dans la recherche de thérapie pour la MH. Les techniques prometteuses comprennent l’utilisation d’oligonucléotides antisens (ASO) et d’ARN d’interférences (ARNi); le principe étant que si la production de la protéine mutée est inhibée, la neurodégénération devrait ralentir, voir complètement arrêter (Wyant et al. 2017; Dickey et La Spada 2018). L’utilisation de ASO a permis de montrer une réduction de la production de mHTT chez l’humain (Hu et al. 2009; Gagnon et al. 2010) ainsi qu’une amélioration de la pathologie et des symptômes chez la souris (Carroll et al. 2011; Kordasiewicz et al. 2012; Sun et al. 2014). Il est cependant à noter que la quantité de protéines Htt saines reste toujours en déclin dans ces expériences. Un essai clinique en cours (NCT02519036) utilisant les ASO montre, selon ses résultats
préliminaires, une réduction de la présence de mHTT dans le liquide cérébro-spinal des patients traités (Tabrizi et al. 2019).
Les approches de thérapies à partir de mécanismes de modifications génétiques tels que les protéines à doigts de zinc (ZFN) ou la technologie CRISPR/Cas9 sont également prometteuses et sont le sujet de ce mémoire.
Modifications génétiques
Historique
Certaines technologies permettant la modification du génome ont été découvertes et sont maintenant utilisées afin de traiter des maladies causées par des mutations génétiques (Figure 6).
Les protéines à doigts de zinc, par exemple, se fixent précisément sur une séquence de trois nucléotides d’un ADN (Boujard et al. 2015). L’endonucléase Fok1 ajoutée à la fin de cette séquence permet de couper le double brin de l’ADN, qui sera ensuite refermé grâce au système de réparation de la cellule (Boujard et al. 2015; LaFountaine et al. 2015; Chadwick et Musunuru 2017). En 2009, la méthode des Transcription Activator-Like effector
nucleases (TALEN) a commencé à être utilisée. Cette méthode permettait en effet de cibler
des séquences de nucléotides précises plus aisément que les nucléases à doigts de zinc (Tremblay 2015; Chadwick et Musunuru 2017). Il était alors possible de déterminer l’interaction réalisée entre l’une des quatre bases de l’ADN et les résidus variables présents dans un bloc de 34 acides aminés constituant le TALE; la nucléase à la fin de la séquence permettant de couper l’ADN double brin (Boujard et al. 2015; LaFountaine et al. 2015). La méthode de Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) (Cong
2015; Barrangou et Doudna 2016; Komor et al. 2016; Han et She 2017). Un gène peut donc être modifié par l’entremise d’une élimination ou d’un ajout de séquences de nucléotides, permettant ainsi la correction de mutations induisant les maladies héréditaires (Tremblay 2015; Han et She 2017). Le principe de cette technologie est originaire du système immunitaire des procaryotes : soit des bactéries et des archées (LaFountaine et al. 2015). En effet, les procaryotes utilisent ce principe afin de pouvoir dégrader et éliminer des éléments génétiques invasifs, tels que des plasmides ou des virus (Boujard et al. 2015; Gupta et Shukla 2017; Han et She 2017). On estime que le complexe CRISPR se retrouve dans 40% des bactéries et dans 90% des archées (Han et She 2017). Selon la classification faite par Makarova et son équipe en 2011, il est possible de distinguer 2 principales classes de système CRISPR qui comprennent 5 types de systèmes : la première classe comprend les Types I, II et IV et la deuxième classe, les Types II et V; chacune étant associée à leur protéine Cas (Fan et al. 2018). Seuls les Types I, II et IV ont été étudiés en détail (Fan et al. 2018). Dans le cas du Type II, qui nous intéresse particulièrement dans le cadre de ce mémoire, seule la protéine Cas9 est nécessaire (Makarova et al. 2011). La Cas9 est une enzyme spécialisée pour couper l’ADN. Elle possède deux sites de coupe, les domaines RuvC et HNH, un pour chaque brin d’ADN.
La Cas9, guidée par un ARN guide, reconnait tout d’abord une séquence de 2 à 4 paires de bases qu’on nomme le protospacer adjacent motif (PAM) (Tremblay 2015; Gupta et Shukla 2017; Han et She 2017), lequel suit une séquence d’ADN cible. En se liant au PAM, l’ARN guide associé à la Cas9 cherchera à se lier aux paires de bases complémentaires de sa séquence sur l’ADN disponible. Lorsqu’il y a une complémentarité entre les 12 premières paires de bases de l’ADN cible et de l’ARN guide, l’ADN cible se déroule et forme une boucle R. Un clivage précis de la séquence est ensuite effectué par les domaines RuvC et HnH de la protéine Cas9, ce qui entraine une coupure double brin (LaFountaine et al. 2015; Kim et
al. 2017). La coupure s’opère 3 paires de bases avant la séquence PAM. Suite à ce clivage,
l’ADN tentera de réparer sa séquence selon le mécanisme de réparation de la cellule; de la recombinaison non homologue, par insertions ou délétions. Il est également possible d’intégrer une séquence d’ADN donneur par recombinaison homologue (Figure 7) (Tremblay 2015; Kim et al. 2017). L’avantage de cette technologie est qu’il s’agit d’un mécanisme facile d’utilisation, précis et peu coûteux en comparaison avec d’autres techniques disponibles (Barrangou et Doudna 2016).
On distingue deux types de Cas9 : la Streptococcus pyogenes Cas9 (SpCas9) et la
Staphylococcus aureus Cas9 (SaCas9). Ces deux Cas9 se distinguent l’une de l’autre par
plusieurs aspects, mais ont malgré tout le même pouvoir d’édition du génome. La SpCas9 comporte 1368 acides aminés, tandis que la SaCas9 en compte 1053 (Friedland et al. 2015). Les Cas9 ciblent des séquences PAM différentes : NGG-3’ pour la SpCas9 et 5’-NNGRRT-3’ pour la SaCas9 (Ran et al. 2015). Il est également possible d’observer une différence en ce qui a trait à leur capacité à éviter les coupures hors cibles (Ran et al. 2015; Kaya et al. 2016).
Application du système CRISPR/Cas9 en neurosciences
Le système CRISPR/Cas9 a été exploité pour modifier génétiquement des plantes, des animaux et différents micro-organismes. Comme mentionné plus haut, les modèles animaux développés par modifications génétiques ont un rôle particulièrement important dans les différentes recherches médicales. Or, la venue du système CRISPR/Cas9 permet plus facilement ces interventions génétiques et permet également le développement de modèles plus complexes, par l’entremise de la possibilité de modification de plusieurs gènes à la fois (Heidenreich et Zhang 2016). En plus d’être appliquée sur des modèles animaux ou des
Figure 7. Illustration du principe de la technologie CRISPR-Cas9. (A) ARN guide se fixant
à la séquence cible. (B) Réparation de l’ADN par jonction d’extrémités non homologues (JENH) ou par intégration d’une séquence d’ADN donneur par recombinaison homologue (DRH) (traduit de LaFountaine et al. 2015).
kystique (Firth et al. 2015), sur des myoblastes provenant de la dystrophie myotonique de Duchenne (Ousterout et al. 2015) ou sur des rats exprimant le VIH ou une hépatite B (Kaminski et al. 2016) pour ne nommer que quelques exemples. En effet, l’une des portées importantes de CRISPR/Cas9 est son implication dans les thérapies cellulaires, notamment dans le développement de modèles ex vivo, dans les approches à partir de cellules souches hématopoïétiques et dans les immunothérapies à base de cellules T (Barrangou et Doudna 2016).
Les recombinaisons non homologues dans les neurones post-mitotiques ont pu être démontrées comme actives. Cependant, cette efficacité est moins claire dans le cas des recombinaisons homologues. En effet, la recombinaison homologue se produirait généralement dans les phases S et G2 du cycle cellulaire (van Gent et van der Burg 2007; Pardo et al. 2009). Or, ce processus serait rare dans le cas de cellules qui ne se divisent plus, telles que les neurones. Afin d’utiliser la recombinaison homologue dans le cas de maladies neurologiques, il sera nécessaire de se pencher sur les mécanismes impliqués dans cette technique, des cellules déjà différenciées (Heidenreich et Zhang 2016).
Dans le cas de la MP, des modèles de cellules somatiques ont été générés avec succès grâce à CRISPR/Cas9 en modifiant les gènes PARK et PINK1 (Zhou et al. 2015) et les gènes PARK, PINK1 et DJ1 (Wang et al. 2016). Ces cellules ont ensuite pu être implantées dans la substance noire de modèle de mini cochons. De plus, l’équipe de Chen en 2016 a transplanté des cellules souches pluripotentes humaines (hPSC) dérivées des neurones dopaminergiques du mésencéphale (hPSC-mDA) dans des cerveaux de souris présentant un phénotype parkinsonien (Chen et al. 2016). À l’aide de CRISPR/Cas9, le gène de récepteurs activés exclusivement par le clozapine-N-oxide avait préalablement été knock in dans les hPSC-mDA, le mutant fonctionnant comme un interrupteur activé. Les fonctions motrices des souris s’en sont vues améliorées. Une autre étude voulait comprendre la relation entre la variation de la séquence des amplificateurs, les différences allèles spécifiques et le fonctionnement des amplificateurs dans le cas de la MP (Soldner et al. 2016). Pour ce faire, l’équipe a identifié un variant génétique associé à la maladie dans un élément non codant d’un amplificateur qui régule l’expression de l’alpha-synucléine et ils ont utilisé CRISPR/Cas9 pour éliminer cet élément des cellules humaines. Ils ont ainsi pu démontrer que la mauvaise transcription de l’alpha-synucléine est associée avec la liaison dépendante de la séquence du facteur de transcription (Soldner et al. 2016).
En ce qui concerne la MA, une étude a généré des IPSC avec des mutations homozygotes ou hétérozygotes d’un gène muté causant la maladie dans les APP et la presenilin-1 grâce à une application de CRISPR/Cas9 (Paquet et al. 2016). Les résultats ont montré que le taux d’Aβ était plus élevé dans les cellules homozygotes, ce qui suggère que la technique utilisée est en mesure d’intégrer des séquences spécifiques dans des cellules IPS.
Avant que des thérapies utilisant le système CRISPR/Cas9 puissent faire l’objet d’essais cliniques chez l’humain, plusieurs problèmes pratiques et techniques vont devoir être réfléchis et résolus; il est possible de penser par exemple aux éventualités de clivages génomiques hors cibles, de s’assurer que la « livraison » du système CRISPR se fasse dans les cellules, l’organe ou les tissus ciblés ou de s’assurer qu’il n’y ait pas de nouvelles mutations engendrées suite au clivage (Barrangou et Doudna 2016; Han et She 2017).
Application du système CRISPR/Cas9 dans le contexte de la maladie de Huntington
Considérant la nature génétique de la MH, un traitement par modification du génome est plus qu’envisageable. L’utilisation de CRISPR/Cas9 comme outil thérapeutique dans le cas de la MH est cependant encore primitif. Les possibilités sont, toutefois, nombreuses et prometteuses; de l’idée de couper la séquence mutée afin de revenir à un nombre de CAG sain à celle d’insérer des codons stop ou des mutations faux-sens dans le but d’inactiver l’allèle mutant (Wild et Tabrizi 2017).
En 2016, l’équipe de Shin a permis d’inactiver l’allèle mutant, ce qui à son tour a permis de prévenir la production de l’ARN messager et de la protéine mHTT (Malkki 2016; Shin et al. 2016). Ils étaient donc à la recherche de SNP qui altéraient la région PAM sur le chromosome mutant, mais pas sur le chromosome sain. Ils ont ensuite utilisé deux ARN guides qui ciblaient spécifiquement l’allèle du gène Htt sur le chromosome mutant. Ils ont ainsi pu supprimer la région promotrice, le site du début de transcription et l’expansion CAG du gène mutant; ce qui a entrainé son inactivation complète (Malkki 2016; Shin et al. 2016). L’expérience a été réalisée sur des fibroblastes de patients MH. Dans la même lignée, une étude a analysé les régions génomiques adjacentes au gène Htt sur l’exon 1 pour identifier les SNP potentiels qui pourraient avoir un impact sur la spécificité du clivage lors d’une approche par CRISPR/Cas9 (Monteys et al. 2017). Merienne et son équipe a utilisé en 2017 le système CRISPR/Cas9 pour activer la machinerie de réparation de l’ADN cellulaire afin
les neurones corticaux de souris. Dans ces cas, la neuropathologie de la MH s’est vue réduite (Merienne et al. 2017). Toujours via l’utilisation du modèle murin, une autre étude a tenté de corriger la mutation mHTT présente dans le striatum. Les résultats ont montré une diminution significative du nombre d’agrégats présents dans le striatum ainsi qu’une amélioration des comportements moteurs des souris, suggérant alors que les neurones ont toujours la capacité d’éliminer les accumulations de protéines mutantes et de réparer certains dommages précoces (Yang et al. 2017).
D’un point de vue éthique
Évidemment, les applications du système CRISPR/Cas9 sont bien plus vastes et complexes que ce qui a pu être mentionné ici. De nouvelles avancées surviennent constamment et apportent chaque fois de nouvelles informations pertinentes à la recherche, qui pourront éventuellement être appliquées à l’humain. Toutefois, malgré le fait que la technique est très prometteuse, de nombreux questionnements et défis éthiques sont associés à l’utilisation de CRISPR/Cas9 à un niveau clinique. En 2018, Jiankui He annonce au cours d’un congrès qu’il a réalisé des expériences au cours desquelles il a réussi à modifier des embryons humains. Les enfants, des jumelles, sont nés et viables. L’objectif de He était d’obtenir des enfants chez lesquels la protéine CCR5, une protéine impliquée dans l’infection par le virus du VIH, a été éliminée par inactivation du gène par le système CRISPR/Cas9 (Jordan 2019). Lors d’un essai, seuls 4 blastocystes sont viables, mais aucun d’entre eux n’a été parfaitement modifié. He et les parents décident tout de même de tenter l’implantation des deux embryons ayant « le plus de potentiels ». Le premier embryon créé présente une délétion d’une paire de bases sur le gène CCR5 de l’un des chromosomes et une délétion de quatre paires de bases sur l’autre chromosome. Une mutation hors cible semble également présente dans une région inter génique. Le deuxième embryon créé présente quant à lui une délétion de 15 paires de bases sur un chromosome. À la naissance des jumelles, un séquençage complet de leur génome est effectué. Selon les résultats obtenus, le gène CCR5 a été édité, partiellement ou totalement, et la mutation hors cible présente chez le premier embryon n’était apparemment plus présente (Jordan 2019). He a été condamné à 3 ans de prison pour pratique médicale illégale suite à la présentation de son projet et des résultats (Cyranoski 2020).
Les travaux de He apportent de nombreux questionnements. D’abord, il est légitime de se demander à quoi le futur de ces bébés CRISPR ressemblera. On ne connait pas l’impact
complet de l’inactivation du gène CCR5; celui-ci ayant notamment des implications dans les mécanismes de protection contre d’autres types d’infections, tels que le virus du Nil occidental par exemple (Cyranoski 2019). Ces enfants devront donc être sous surveillance médicale toute leur vie. Ensuite, de quelles façons les travaux de He influenceront-ils le futur de la recherche médicale impliquant CRISPR? Est-ce que les chercheurs voudront faire acte de prudence en ralentissant les avancements afin d’éviter de refaire les mêmes erreurs que He et ainsi garantir la sécurité de toutes les procédures? Ou est-ce que, au contraire, cela normalisera les modifications génétiques sur des embryons humains, ce qui accélèrera inévitablement l’apparition de bébés mutés? Et enfin, si les bébés CRISPR représentent réellement le futur de l’espèce humaine, quelle est la limite à instaurer?
Projet de recherche
Comme mentionné plus haut, la MH est une maladie pour laquelle actuellement il n’y a aucun traitement curatif. Or, compte tenu de la nature génétique de la pathologie, les avancés quant à la technologie CRISPR/Cas9 sont particulièrement prometteuses.
Ainsi, dans le cadre de ce projet, nous travaillons en étroite collaboration avec l’équipe de Vincent Dion, dont le laboratoire se situe à Cardiff University au Royaume-Uni. Lors d’expériences préliminaires, l’équipe du Dr Dion a observé une contraction de la séquence ciblée ainsi que très peu de mutations dans les séquences avoisinantes, lorsqu’ils ont effectué une coupure simple brin en utilisant un ARN guide ciblant les répétitions CAG/CTG (SgCTG) (Cinesi et al. 2016; Aeschbach et Dion 2017). Ces tests ont été effectués sur des cellules lymphoblastoïdes issues de cultures de tissus de patients. Les objectifs de cette étude étaient de mieux comprendre les mécanismes d’instabilité des expansions CAG/CTG et de trouver une façon de contracter ces répétitions sans induire de nouvelles expansions. Dans un premier temps, l’équipe a comparé les techniques de ZFN et de CRISPR/Cas9 standard. Ils ont alors pu conclure qu’une coupure double brin dans la séquence mutée entraine une certaine instabilité; ce qui peut induire à son tour l’apparition de nouvelles mutations, dont des expansions (Cinesi et al. 2016). Ils ont alors utilisé la Cas9 D10A, qui a été conçue par une substitution aspartate-alanine dans le domaine RuvC de la Cas9 (Cong
et al. 2013), couplée avec un ARN guide ciblant spécifiquement les expansions CAG/CTG.
La Cas9 D10A permet d’induire une instabilité avec un biais certain pour les contractions ainsi qu’aucune mutation hors cible détectable. Les conclusions de cette étude ont été la confirmation de la réduction de la répétition CAG par la Cas9 D10A, l’établissement du fait
répétition, l’observation de très peu de coupures hors cibles ou de nouvelles mutations et le constat que l’utilisation de cette technique n’entraine pas l’augmentation de la quantité de morts cellulaires (Cinesi et al. 2016).
Hypothèse
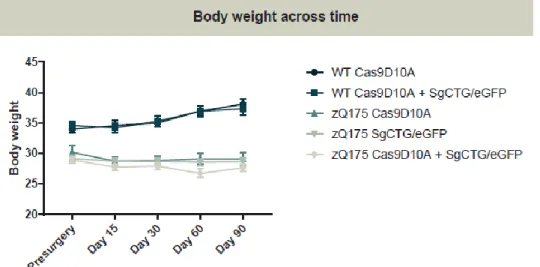
Suite au succès de la partie in vitro du projet, notre laboratoire était responsable de la réalisation des expériences in vivo, compte tenu de notre expertise sur le comportement animal ainsi que sur les analyses post-mortem réalisées sur des modèles murins huntingtoniens. Ainsi, des souris de souche zQ175 ont été utilisées et traitées avec des virus transportant de la Cas9 D10A et/ou des ARN guides (SgCT/eGFP). Nous avons émis l’hypothèse que la réduction de l’expansion de CAG qui code pour la polyglutamine réduira la toxicité de la mHTT et préviendra ainsi les troubles du comportement associés à la MH. Selon cette hypothèse, nous prévoyons une amélioration des capacités motrices et cognitives lors des tests effectués par les animaux malades traités lorsqu’ils sont comparés avec les animaux malades non traités. On prévoit également que l’atrophie du cortex et du striatum des souris huntingtonniennes traitées soit moins importante que celles des non traitées étant donné le ralentissement à prévoir de la maladie. Donc, le poids des cerveaux des souris traitées devrait être plus important que celui des souris non traitées (Heikkinen
et al. 2012). Également, afin que la technique fonctionne, la Cas9 D10A et l’ARN guide
doivent se retrouver dans les mêmes cellules. Ainsi, nous avons comme hypothèse que lors des analyses post mortem par immunofluorescence, il sera possible d’observer le marquage des deux vecteurs au sein des mêmes cellules. Enfin, la quantité de mHtt dans le cerveau des souris traitées avec la Cas9 D10A et l’ARN guide devrait être réduite comparé à celle des souris non traitées.
Objectif : L’objectif de ce projet est de déterminer l’impact sur le comportement et sur le
cerveau d’un traitement par CRISPR/Cas9 sur un groupe de souris zQ175 présentant un phénotype huntingtonien.