La microspectroscopie vibrationnelle comme outil
de caractérisation de la peau normale humaine et
reconstruite
Application à la peau psoriasique
Thèse
Marie Leroy
Doctorat en génie des matériaux et de la métallurgie
Philosophiae Doctor (Ph.D.)
Québec, Canada
© Marie Leroy, 2015
iii
Résumé
Le besoin de trouver de nouveaux pansements pour les personnes touchées par des plaies de la peau (brûlures, ulcères), et la nécessité de développer des modèles de peau adéquats pour tester de nouvelles formulations médicamenteuses développées in vitro, ont motivé la recherche dans le domaine des substituts de peau produits par génie tissulaire. Il est possible de produire des substituts de peau normale humaine (SPNH), constitués d’un derme et d’un épiderme stratifié (épiderme vivant, EV, et couche cornée, CC), en utilisant la méthode d’auto-assemblage développée par le Laboratoire d’Organogénèse Expérimentale (LOEX). Dans cette étude, des analyses par microspectroscopie vibrationnelle (infrarouge, IR, et Raman) ont été effectuées afin d’obtenir une caractérisation morpho-spectrale des trois couches caractéristiques des SPNH, qui ont été comparés à la peau normale humaine (PNH). Concernant la distribution et l’organisation des lipides, les résultats de microspectroscopie IR ont montré que les lipides de la CC étaient plus ordonnés que ceux de l’EV. En microspectroscopie Raman, les résultats confirment que la CC est une couche riche en lipides qui sont ordonnés dans la PNH et les SPNH. La quantité de lipides diminue et davantage de désordre apparait dans l’EV pour la PNH et les SPNH. Cependant les résultats montrent également qu’il y a moins de lipides dans les SPNH et que les lipides sont plus ordonnés dans la PNH. Concernant la structure secondaire des protéines et le contenu en protéines, les données montrent qu’ils sont similaires dans les SPNH et la PNH (kératine dans l’épiderme et collagène dans le derme). Finalement, l’organisation des lipides ainsi que le contenu en protéines des différentes couches sont similaires pour les SPNH et la PNH, confirmant que les SPNH reproduisent les propriétés essentielles de la peau native. Cette étude caractérise également la peau psoriasique humaine (PPH) et fournit une compréhension détaillée de son organisation et de sa composition moléculaire. Les microspectroscopies IR et Raman montrent une distribution similaire des lipides et du collagène pour la PNH et la PPH. Cependant, la PPH présente plusieurs caractéristiques montrant une perte globale d’organisation structurale qui pourrait expliquer la réduction de ses propriétés barrières. Il s’agit de la première caractérisation de la structure moléculaire de ces SPNH qui ont d’ores-et-déjà une application prometteuse dans le domaine clinique. La caractérisation de la PPH pourrait être le point de départ de la caractérisation des substituts pathologiques.
v
Abstract
Research in the field of bioengineered skin substitutes is motivated by the need to find new dressings for people affected by skin injuries (burns, diabetic ulcers), and to develop adequate skin models to test new drug formulations developed in vitro. It is possible to produce human skin substitutes (HSS) consisting in a dermis and a stratified epidermis (living epidermis, LE, and stratum corneum, SC), using the self-assembly method developed by the
Laboratoire d’Organogénèse Expérimentale (LOEX). In the present work, vibrational
microspectroscopy analyses (infrared, IR, and Raman) were performed to obtain in-depth morpho-spectral characterization of the three characteristic layers of HSS as compared with normal human skin (NHS). Concerning the lipid distribution and organization, IR microspectroscopy results suggest that lipids in the SC are more ordered than those in the LE. Raman microspectroscopy results confirm that the SC is a layer rich in lipids which are well-ordered in both NHS and HSS. The amount of lipids decreases and more disorder appears in the LE for both NHS and HSS. However, the results also show that there are fewer lipids in the HSS and that the lipids are more organized in the NHS. Concerning the secondary structure of proteins and protein content, the data show that they are similar in the HSS and in NHS (keratin in the epidermis and collagen in the dermis). Finally, the lipid organization as well as the protein composition in the different layers are similar for HSS and NHS, confirming that the HSS reproduce essential features of real skin. This study also investigates psoriatic human skin (PHS) and provides a deep understanding of its molecular organization and composition. IR and Raman microspectroscopies reveal a similar distribution of lipids and collagen for NHS and PHS. However, PHS exhibits various characteristics showing a global decrease of the structural organization that is compatible with a reduction in its barrier properties. It is the first characterization of the molecular structure of these HSS, which are already considered as a promising biological wound dressing for clinical applications. The characterization of PHS could be the starting point of the characterization of the pathological substitutes.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xiii
Liste des figures ... xv
Liste des abréviations et des sigles ... xxi
Remerciements ... xxvii
Avant-propos ... xxxv
0 Introduction ... 1
0.1 La peau : structure et physiologie ... 1
0.1.1 Fonctions ... 1 Protection ... 1 Échange ... 3 Autres ... 4 0.1.2 Structure ... 5 L’hypoderme ... 5 Le derme ... 6 L’épiderme ... 8 0.1.3 La couche cornée ... 11 Structure ... 11
Formation des lipides ... 13
Organisation des lipides ... 14
0.1.4 Les lipides présents dans l’épiderme ... 17
Les céramides ... 18
Les acides gras libres ... 19
viii
Les phospholipides ... 20
Les sphingolipides ... 20
0.1.5 Fonctions des différents lipides ... 21
0.2 Le psoriasis ... 23 0.2.1 Généralités ... 23 0.2.2 Étiologie ... 23 Facteurs génétiques ... 24 Facteurs immunologiques ... 24 Facteurs environnementaux ... 24 0.2.3 Symptômes ... 25
0.2.4 Les différents types ... 25
Psoriasis en plaques (ou psoriasis vulgaris) ... 25
Psoriasis en gouttes (ou psoriasis guttata) ... 26
Psoriasis érythrodermique ... 26
Psoriasis inversé ... 27
Psoriasis pustuleux ... 27
Autres types ... 28
0.2.5 Caractéristiques des plaques ... 28
0.2.6 Perturbations observées dans le psoriasis ... 30
0.3 Les modèles de peau ... 31
0.3.1 Généralités sur les substituts de peau ... 31
Historique : le gel de collagène ... 31
Modèles utilisant des échafaudages ... 32
0.3.2 Exemples de substituts de peau ... 32
ix
Les substituts épidermiques ... 33
Les substituts dermiques ... 34
Les composites derme/épiderme ... 35
0.3.3 La méthode d’auto-assemblage ... 35
Procédé ... 35
Comparaison de la méthode d’auto-assemblage avec les substituts commerciaux ... 37
0.4 Résultats préalables : caractérisation des substituts sains produits en utilisant la méthode d’auto-assemblage ... 38
0.4.1 Apparence macroscopique et histologie ... 38
0.4.2 Analyses immunohistochimiques ... 38
0.4.3 Absorption percutanée ... 39
0.4.4 Spectroscopie infrarouge ... 39
0.5 La spectroscopie vibrationnelle ... 40
0.5.1 La microspectroscopie infrarouge ... 40
Principe de la spectroscopie infrarouge ... 40
Le microscope infrarouge ... 43
La spectroscopie infrarouge appliquée à la peau ... 43
0.5.2 La microspectroscopie Raman ... 50
Principe de la spectroscopie Raman ... 50
Le microscope Raman ... 52
La spectroscopie Raman appliquée à la peau ... 53
0.5.3 La spectroscopie infrarouge étroitement liée à la spectroscopie Raman ... 57
Similitudes ... 57
x
0.6 Objectifs ... 59
1 Article 1 : Characterization of the structure of human skin substitutes by infrared microspectroscopy ... 63
1.1 Résumé ... 65
1.2 Abstract ... 67
1.3 Keywords ... 67
1.4 Introduction ... 69
1.5 Materials & Methods ... 71
1.5.1 Patients ... 71
1.5.2 Cell culture media ... 71
1.5.3 Production of human skin substitutes ... 72
1.5.4 Histological analyses ... 72
1.5.5 Infrared microspectroscopy analyses ... 72
1.6 Results & Discussion ... 73
1.6.1 Macroscopic analyses ... 73
1.6.2 Histological analyses ... 74
1.6.3 Infrared microspectroscopy analyses ... 75
1.7 Conclusion ... 82
1.8 Acknowledgements ... 83
2 Article 2 : A comparative study between human skin substitutes and normal human skin using Raman microspectroscopy ... 85
2.1 Résumé ... 87
2.2 Abstract ... 89
2.3 Keywords ... 89
2.4 Graphical abstract ... 91
2.5 Introduction ... 93
2.6 Materials & Methods ... 96
2.6.1 Patients ... 96
2.6.2 Cell culture media ... 96
xi
2.6.4 Histological analyses ... 97
2.6.5 Raman microspectroscopy ... 97
2.7 Results and discussion ... 98
2.7.1 Macroscopic analyses ... 98
2.7.2 Histological analyses ... 99
2.7.3 Comparison between lipid and protein content in skin substitutes and NHS 100 2.7.4 Comparison of skin substitute and NHS in terms of molecular and cellular organization ... 105
2.8 Conclusion ... 109
2.9 Acknowledgements ... 109
2.10 Conflict of interest ... 110
3 Article 3 : Using infrared and Raman microspectroscopies to compare ex vivo involved psoriatic skin with normal human skin ... 111
3.1 Résumé ... 113
3.2 Abstract ... 115
3.3 Keywords ... 115
3.4 Introduction ... 117
3.5 Materials and Methods ... 119
3.5.1 Patients ... 119
3.5.2 Histological analyses ... 120
3.5.3 ATR-IR analyses ... 120
3.5.4 Infrared microspectroscopy analyses ... 121
3.5.5 Raman microspectroscopy analyses ... 121
3.5.6 Sample variability ... 122
3.6 Results and discussion ... 123
3.6.1 Histological analysis ... 123
xii 3.6.3 Infrared microspectroscopy ... 125 3.6.4 Raman microspectroscopy ... 130 3.7 Conclusion ... 134 3.8 Acknowledgements ... 135 4 Discussion ... 137 5 Conclusion ... 141 6 Perspectives ... 143 Références ... 149
xiii
Liste des tableaux
Tableau 0.1. Bandes d'intérêt retrouvées dans un spectre infrarouge de peau normale
humaine. ... 44
Tableau 0.2. Bandes d'intérêt retrouvées dans un spectre Raman de peau normale humaine.
... 53
Tableau 2.1. Assignments of the Raman bands that are identified in the spectra of the
different layers (stratum corneum (SC), living epidermis (LE), dermis) of the human skin substitute. ... 102
Tableau 3.1. Information about the patients. ... 120
Tableau 3.2. Use of the samples. ... 123
Tableau 3.3. Average frequency of the peak corresponding to the CH2 symmetric stretching
xv
Liste des figures
Figure 0.1. Fonction barrière de la peau (adaptée de [8]). ... 1
Figure 0.2. Structure de la peau (adaptée de [9]). ... 5
Figure 0.3. Structure de l'épiderme (adaptée de [7]). ... 10
Figure 0.4. Représentation en « brique et mortier » de la couche cornée (adaptée de [13]). ... 13
Figure 0.5. Formation des bicouches de lipides à l'interface couche granuleuse / couche cornée (adaptée de [8]). ... 14
Figure 0.6. Formation des bicouches de lipides (adaptée de [17]). ... 15
Figure 0.7. Visualisation des disques lamellaires par microscopie électronique à balayage (tirée de [6]). ... 16
Figure 0.8. Visualisation des bicouches de lipides par microscopie électronique à balayage (tirée de [6]). ... 16
Figure 0.9. Organisation des lipides en bicouches et en phases cristallines (adaptée de [14]). ... 17
Figure 0.10. Structure moléculaire des différents céramides présents dans la couche cornée (adaptée de [14]). ... 18
Figure 0.11. Exemple de sphingomyéline. ... 20
Figure 0.12. Structure modèle d’un phosphoglycéride. ... 20
Figure 0.13. Exemple de phosphoglycéride. ... 20
Figure 0.14. Composition lipidique des différentes couches de l'épiderme (adaptée de [35]). ... 21
Figure 0.15. Phénomène de Koebner (tirée de [51]). ... 24
Figure 0.16. Psoriasis en plaques (tirée de [50]). ... 26
Figure 0.17. Psoriasis en goutte (tirée de [51]). ... 26
xvi
Figure 0.19. Psoriasis inversé (tirée de [51]). ... 27
Figure 0.20. Psoriasis pustuleux (tirée de [51]). ... 28
Figure 0.21. Histologie d'une peau psoriasique (tirée de [50]). ... 29
Figure 0.22. Régions préférentiellement touchées par le psoriasis et caractéristiques morphologiques d'une peau psoriasique (adaptée de [67]). ... 30
Figure 0.23. La méthode d'auto-assemblage. ... 36
Figure 0.24. Temps de production d'un substitut par la méthode d'auto-assemblage. ... 37
Figure 0.25. Apparence macroscopique et histologie (trichrome de Masson) d'un substitut sain produit en utilisant la méthode d'auto-assemblage (objectif 40×) (adaptée de [77]). ... 38
Figure 0.26. Cellule de Franz. ... 39
Figure 0.27. Le spectre électromagnétique. ... 41
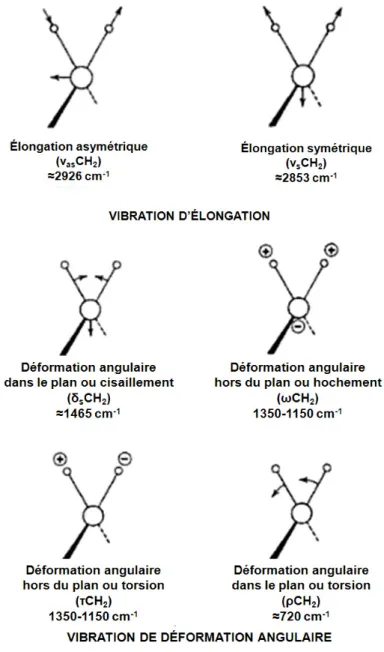
Figure 0.28. Modes de vibration. ... 42
Figure 0.29. Le microscope infrarouge. ... 43
Figure 0.30. Spectres infrarouge de peau normale humaine (tirée de [96]). ... 44
Figure 0.31. Organisation des lipides dans la peau normale humaine (adaptée de [115]). . 45
Figure 0.32. Transition de phases dans le cas de la couche cornée (adaptée de [115]). ... 47
Figure 0.33. Mise en évidence de différents constituants lipidiques et protéiniques de la couche cornée de porc (adaptée de [117]). ... 48
Figure 0.34. Mise en évidence des zones riches en collagène (B) et riches en kératine (C) lors de la cicatrisation d’une plaie (A) (tirée de [105]). ... 49
Figure 0.35. Visualisation de structures particulières dans une coupe de peau de porc (tirée de [111]). ... 50
Figure 0.36. Diagramme de niveaux d’énergie montrant les niveaux impliqués dans le signal Raman. L’épaisseur du trait est approximativement proportionnelle à l’intensité du signal correspondant aux différentes transitions (adaptée de Wikipédia). ... 51
xvii
Figure 0.38. Spectres Raman de peau normale humaine (tirée de [96]). ... 53
Figure 0.39. Spectres des différentes couches caractéristiques de la peau (tirée de [133]). 55
Figure 0.40. Mesure de la concentration d'eau dans la couche cornée (adaptée de [137]). . 55
Figure 0.41. Profil d'hydratation de la couche cornée en fonction de la profondeur. Distance
par rapport à la surface de la peau : (a) 0 µm, (b) 75 µm, (c) 80 µm, (d) 85 µm, (e) 90 µm (tirée de [138]). ... 56
Figure 0.42. Superposition de spectres de la couche cornée (A), de l’épiderme vivant (B) et
du derme (C) (tirée de [122]). ... 57
Figure 1.1. Macroscopic view of a human skin substitute produced using the auto-assembly
method (scale in centimeters). ... 74
Figure 1.2. Histological images of (a) human skin substitute produced using the
auto-assembly method compared to (b) normal human skin (scale bar = 100 µm). ... 74
Figure 1.3. From top to bottom, typical infrared spectra taken from the stratum corneum
(red), living epidermis (green) and dermis (blue); the region from 2750 to 3150 cm-1, mainly
assigned to stretching modes of methylene and methyl groups of lipids and proteins, and the amide I, II and III bands of the proteins, are highlighted. (a) Human skin substitute, and (b) normal human skin. ... 76
Figure 1.4. Superimposition of the 2750-3150 cm-1 region of the spectra recorded from the
SC (red), LE (green), and dermis (blue) (a: skin substitute; d: normal human skin); microscopic view (15× objective) (b: skin substitute; e: normal human skin) and the corresponding infrared image generated from the area of the 2850 cm-1 feature of lipids (c:
skin substitute; f: normal human skin). ... 78
Figure 1.5. Microscopic view (15× objective) of (a) skin substitute and (d) normal human
skin and the corresponding infrared images across skin sections (b: skin substitute; e: normal human skin), obtained from the position of the symmetric CH stretching (color scale from low (blue) to high (red) frequencies). The frequency profile from the SC to the LE is also displayed for the skin substitute (c), and NHS (f). ... 80
xviii
Figure 1.6. Superimposition of region between 950 and 1800 cm-1 of the spectra recorded
from the SC (red) and dermis (blue) (a: skin substitute; d: normal human skin); microscopic view (15× objective) (b: skin substitute; e: normal human skin) and the corresponding infrared image generated from the intensity of the 1342 cm-1 feature of collagen (c: skin
substitute; f: normal human skin). ... 82
Figure 2.1. Table of Contents for article “A comparative study between human skin
substitutes and normal human skin using Raman microspectroscopy”. ... 91
Figure 2.2. Macroscopic view of a human skin substitute produced using the self-assembly
method (scale in centimeters). ... 99
Figure 2.3. Histological images of (A) human skin substitute produced using the
self-assembly method compared to (B) normal human skin (scale bar = 100 µm). ... 99
Figure 2.4. Microscopic image of a human skin substitute section (10× objective). Red dots
correspond to places where the spectra have been taken to then be averaged (scale bar 20 µm). ... 100
Figure 2.5. Resulting average Raman spectra of the (A and B) stratum corneum (SC), (C and
D) living epidermis (LE) and (E and F) dermis of a human skin substitute (full lines) and normal human skin (dotted lines) showing the high frequency (2500 and 3200 cm-1) and the
fingerprint regions (700 and 1800 cm-1). Common features to all layers are identified in black.
Underlined frequencies refer to human skin substitute. ... 102
Figure 2.6. Raman spectra of the stratum corneum (SC, red) and living epidermis (LE, green)
in the spectral region between 1000 and 1150 cm-1 for (A) human skin substitute and (B)
normal human skin. (C) Histograms of the I1064/I1085 and (D) I1130/I1085 ratios. ... 107
Figure 2.7. Superposition of averaged spectra from the stratum corneum (SC, red), the living
epidermis (LE, green) and the dermis (blue), in the amide I region. ... 109
Figure 3.1. Histology images of (a) Normal Human Skin (NHSI) and (b) Psoriatic Human
xix
Figure 3.2. Thermotropism curves of the stratum corneum of the three Psoriatic Human Skin
samples (I; squares, II; triangles, III; diamonds) compared to Normal Human Skin control (circles; after [147]). ... 125
Figure 3.3. (a) Microscopic optical view of a Psoriatic Human Skin (PHSI) section (15×
objective) and corresponding infrared images showing (b) the lipid distribution, (c) the collagen distribution, and (d) the protein-to-lipid ratio (1 pixel = 5.5 µm). Red color indicates a high content/ratio, whereas green color indicates a low content/ratio. (e) Superimposition of spectra of the stratum corneum for Normal Human Skin (NHSI) and Psoriatic Human Skin (PHSI). (f) CH2 stretching mode region. ... 127
Figure 3.4. (i) Microscopic optical views (15× objective) and corresponding infrared images
showing (ii) the lipid distribution, (iii) the collagen distribution, and (iv) the protein-to-lipid ratio (1 pixel = 5.5 µm) for (a) PHSI (b) PHSII and (c) PHSIII. ... 128
Figure 3.5. Microscopic view (15× objective) of (a) Normal Human Skin (NHSI) and (c)
Psoriatic Human Skin (PHSI), and the corresponding infrared images across skin sections (b: Normal Human Skin, NHSI and d: Psoriatic Human Skin, PHSI), computed from the position of the center of gravity of the peak corresponding to the CH2 symmetric stretching mode
(color scale from low (green) to high (red) frequencies). ... 129
Figure 3.6. (a) Optical image of a Psoriatic Human Skin (PHSII) section (10× objective).
The red dots correspond to the locations where the Raman spectra were recorded prior being averaged (scale bar 20 µm). (b) Histological image of a Psoriatic Human Skin (PHSII) section (scale bar 100 µm). (c) Raman spectra of the stratum corneum for Normal (NHSIII, see text for details) and Psoriatic Human Skin samples (PHSII-Group 1) in the fingerprint (left) and C-H stretching (right) regions. ... 131
Figure 3.7. (a) Histograms of the I1130/I1085 and (b) I1060/I1085 ratios for the different
specimens. ... 132
Figure 3.8. (a) Superimposition of group 1 and group 2 averaged Raman spectra from the stratum corneum of a single section of Psoriatic Human Skin (PHSIII) – the inset shows the
C-H stretching region in detail, (b) Superimposition of two types of IR spectrum identified in the stratum corneum of a single section of Psoriatic Human Skin (PHSIII), (c) Third type
xx
of IR spectrum identified in stratum corneum of a single section of Psoriatic Human Skin (PHSIII), (d) Schematic representation of the organization of the stratum corneum of Psoriatic Human Skin (PHSIII) (top, the grid represents IR pixels) as deduced from microspectroscopic Raman-IR (bottom, squares represent IR pixels) and optical [161] observations. ... 134
Figure 6.1. Les différentes voies de pénétration à travers la peau d’un agent extérieur
(adaptée de [165]). ... 144
Figure 6.2. Mise en évidence de la répartition du propylène glycol deutéré (DPG) en fonction
de la répartition des protéines et des lipides dans une coupe de peau (adaptée de [149]). 145
Figure 6.3. Mise en évidence des liposomes présents dans une coupe de peau (tirée de [142]).
xxi
Liste des abréviations et des sigles
ADN : acide désoxyribonucléique AGL : acide gras libre
ATR-FTIR : infrarouge à transformée de Fourier par réflexion totale atténuée CER : céramide
CHOL : cholestérol
DMEM : Dulbecco-Vogt modification of Eagle’s medium NK : natural killer
HSS : human skin substitutes IR : infrarouge
LE : living epidermis
LIS : Laboratoire d’Ingénierie de Surface
LOEX : Laboratoire d’Organogénèse Expérimentale NHS : normal human skin
OCT : Optimal Cutting Temperature SB : (stratum basalum) couche basale SC : (stratum corneum) couche cornée
SG : (stratum granulosum) couche granuleuse SM : Sphingomyéline
SS : (stratum spinosum) couche épineuse TEWL : transepidermal water loss UV : ultraviolet
xxiii
À mes parents À Sébastien À notre foyer
xxv
“It always seems impossible until it’s done” Nelson Mandela
xxvii
Remerciements
Je remercie mon directeur de recherche, Gaétan Laroche, pour sa bienveillance, sa tolérance et son humanité. Je le remercie pour sa pédagogie, de mes premiers pas sur le microscope infrarouge au travail de rédaction sur les articles, pour son éthique de la recherche, et pour sa diplomatie. Je le remercie pour son éternelle disponibilité, quel que soit le jour, quelle que soit l’heure, quel que soit l’objet, la porte de son bureau est toujours ouverte. Je le remercie pour ses encouragements du début à la fin de cette aventure et son soutien sans faille. Merci d’avoir su composer avec mes forces, certes, mais aussi mes faiblesses. Merci de m’avoir fait confiance (plus que je ne me fais confiance à moi-même !) et d’y avoir cru jusqu’au bout (ou d’avoir si bien fait semblant d’y croire que j’y ai cru moi-même !). Son calme et sa patience ont toujours su contraster avec ma panique intérieure, rongée par le doute, c’est ce dont j’avais besoin pour arriver au bout de cette aventure. « Cette thèse, je te la dois ! »
Je remercie ma codirectrice, Michèle Auger, de m’avoir accueillie chaleureusement au sein de son équipe. Nous n’avons pas vraiment eu l’occasion de travailler directement ensemble, mais j’ai toujours apprécié sa disponibilité, sa réactivité et sa diplomatie. Je la remercie pour ses encouragements, ses commentaires et ses suggestions lors des réunions et de la révision des travaux, que ce soit pour les articles ou les présentations. Je la remercie également pour son assiduité quant à la signature de mes contrats pour les versements de ma bourse d’études qui ont permis de subvenir à mes besoins.
Je remercie ma codirectrice, Roxane Pouliot, de m’avoir fait une place dans son équipe. Merci d’avoir accepté que je travaille sur ce projet sans même me connaître, et de m’avoir donné la chance de travailler dans un laboratoire tout neuf. J’ai eu l’opportunité de connaître l’ancien et le nouveau LOEX, et j’ai ainsi pu profiter du confort et de la modernité d’un laboratoire fraîchement bâti. J’espère que, malgré nos différences et nos différents, mon passage dans son équipe restera finalement une expérience enrichissante, autant qu’elle l’a été pour moi.
Travailler en codirection m’a énormément appris : sur le plan scientifique, grâce aux différentes expertises des laboratoires, mais également sur le plan managérial car j’ai pu me
xxviii
familiariser à différentes manières de travailler, d’interagir et de communiquer. Même si cela n’a pas toujours été facile, je ressors plus forte de cette expérience qui m’a sans aucun doute solidement préparée à ma future carrière.
Je remercie Marc-André Fortin d’avoir accepté d’évaluer ma thèse. Je voudrais souligner son efficacité pour l’étape de pré-lecture, ce qui m’a permis d’optimiser le temps pour terminer mon doctorat. Merci pour les commentaires et suggestions, de l’examen pré-doctoral à la thèse, en passant par les séminaires de doctorat. Je le remercie pour son intérêt, sa précision et sa rigueur.
Je remercie Cyril Petibois d’avoir accepté d’évaluer ma thèse. Merci pour les commentaires et suggestions sur mon travail qui ont mis au défi mes acquis. Je le remercie également d’avoir bravé le froid de l’hiver québécois pour assister à ma soutenance !
Je remercie Houshang Alamdari d’avoir élégamment présidé ma soutenance de thèse. Je remercie les organismes subventionnaires : le Conseil de Recherche en Sciences Naturelles et en Génie du Canada (CRSNG), les Instituts de Recherche en Santé du Canada (IRSC) et le Fonds de Recherche du Québec – Nature et Technologie (FRQNT) pour le financement de ce projet. Je remercie le programme CREATE pour la Médecine Régénératrice du CRSNG (NCPRM), le Réseau de Thérapie Cellulaire et Tissulaire du Fonds de Recherche du Québec – Santé (ThéCell), l’Association des Étudiantes et des Étudiants de l’Université Laval Inscrits aux Études Supérieures (AELIÉS) et le bureau des bourses et de l’aide financière de l’Université Laval pour leur participation aux frais de déplacement lors des congrès.
Je remercie les collègues de l’Institut des Biomatériaux du Québec. C’est là que je suis arrivée en 2009 pour un stage, c’est là que j’ai passé le plus de temps, c’est mon laboratoire de cœur. Je remercie les professionnels de recherche : Pascale Chevalier, la GO
(Gentille Organisatrice) des réunions de groupe ! Marie-France Côté, la GO des parties de Noël ! Andrée-Anne Guay-Bégin, Vice-Maître du microscope et du spectromètre infrarouge ! Jacques Lacroix, pour avoir toujours veillé à ce qu’il y ait assez d’azote liquide pour
xxix
refroidir les détecteurs ! Jean Lagueux, pour ces histoires savoureuses de triplés ! Stéphane
Turgeon pour son assistance technique et pour avoir sauvé plus d’une fois mon chargeur
d’ordinateur ! Je remercie les membres du Laboratoire d’Ingénierie de Surface (LIS), pour
les échanges scientifiques, certes, mais aussi pour tous les bons moments passés en congrès. Mentions spéciales à Morgane pour les beaux souvenirs en Nouvelle Écosse ! à mon stagiaire Thomas Lecardez, à mes colocataires de bureau : Ibrahim et son « push push » de parfum
après la pause cigarette ! à Julien, pour avoir perpétué la tradition française de la bise quotidienne ! et enfin à mon amie Maryam « Azizam », avec qui j’ai partagé mes réussites et
mes échecs, mes joies et mes peines, merci d’avoir toujours été à l’écoute et de m’avoir toujours rassurée. Un an de thèse nous sépare, tu es comme une grande sœur, j’ai suivi tes pas…de doctorante et de maman ! Merci à tous les amis du labo pour l’atmosphère de travail détendue, les activités sociales et les soirées, merci à Caroline, pour les pauses goûter ! à Tia Vane pour les soirées enflammées rue de l’Amérique Française ! aux Italiens (Nina et Daniele & co) pour leurs merveilleuses tartes, pâtes et pizzas ! à Élé pour ses beaux écrans
de veille ! au grand Max, pour m’avoir fait sentir toute petite ! à Ranna pour son affection,
à Carlo grâce à qui je ne me suis jamais sentie seule au laboratoire même les week-ends et
jours fériés ! à Olexander, pour ses avis médicaux ! à Mahrokh et son prénom poétique ! à
Afghany et son rire ! à Agung, le roi des sushis ! Caroline R, Christian, Dawit, Dingkun, Erica, Essowè, Fanny, Farid, Giovanna, Ivan, Juliana, Lilit, Livia, Luc, Lucie, Ludivine, Marianna, Martin, Mathieu B, Mathieu M, Meryem, Michael, Myriam, Saleheh,… Merci à tous de m’avoir fait voyager : en Argentine, au Brésil, au Canada, en Chine, en Éthiopie, en Espagne, en France, en Indonésie, en Iran, en Italie, au Maroc, au Mexique, au Togo, en Tunisie, en Ukraine,…tout en restant à Québec !
Je remercie les collègues du groupe de recherche en biophysique et RMN des solides. Un grand merci à Thierry pour les discussions scientifiques (et moins scientifiques !), pour sa disponibilité, pour le travail consciencieux d’analyse de résultats, de révision d’article et de révision de la thèse. Merci à Jean-François Rioux-Dubé pour son assistance technique
précieuse, aux stagiaires postdoctoraux Marise Ouellet et Jean-François Labbé et à leurs
stagiaires respectifs Émile Robert et Marc-André Breton, pour avoir amorcé le projet Raman, à ma stagiaire, Laurie Bédard, à Matthieu, pour avoir mis mes échantillons de peau à
xxx
décongeler ! à Kim, pour ses mises à jours et ses discussions notamment lors de mes « dîpers » !,…
Je remercie les collègues du LOEX. Merci aux fondateurs du LOEX, le Docteur François Auger et la Docteure Lucie Germain. Merci à Dan Lacroix, pour sa sympathie, aux assistants de recherche et aux techniciens, pour leur travail incroyable d’assistance et
d’entretien, aux anciens étudiants du groupe de recherche de Roxane Pouliot, Jessica,
Alexandra et Lydia, pour leur transfert technique, à ma stagiaire, Marie Fraudeau, aux étudiants qui m’ont accueillie, en particulier Maryse, à Sabrina pour la sueur qu’on a fait
couler au Nautilus !,…
Je remercie les amis du département de génie des mines, des matériaux et de la métallurgie. Merci à François et Lucie, pour les repas comme à la maison, à Geoffroy pour
ses blagues plus que tendancieuses ! à Ramzi, Jean-François, Anne, Philippe, Majid, Mousa,
Maryam, Mahdi… Je remercie également le personnel administratif pour son efficacité, Ginette Cadieux, Andrée Lord, Martine Demers et Karine Fortin.
Je remercie les amis du Québec. Merci aux collègues qui sont devenus des amis, à Gad, toujours prêt à rigoler ! à Olivier, notre coloc d’un été, à Michel, Betty et Nathalie, les
danseurs de salsa endiablée ! Merci à ceux qui étaient dans la même galère (= le doctorat !),
à Omid et Soudeh, les irano-(franco-)canadiens ! à Rémi, le mystérieux mais affectueux. Merci à ceux qui se sont préservés du doctorat ! Merci à Laurence, pour son succulent gâteau
au chocolat, maintenant reine de deux hommes ! à Benjamin, l’agoraphobe ! Merci pour les
sorties, les soirées, les soupers, les fou-rires, tous les bons moments en votre compagnie. La vie d’expatrié n’est pas toujours facile et vous avez beaucoup aidé à la rendre plus douce.
Je remercie les amis du Québec… les vrais Québécois ! Merci à mes premiers colocs (ce sont peut-être les premiers à m’avoir donné le goût de rester ?), à François, pour son
initiation à la pêche aux petits poissons des chenaux ! à Sarah, pour nos discussions et nos soirées filles, pour les biscuits aux pépites de chocolat, pour son affection. Merci à
Andrée-Anne, pour m’avoir fait découvrir la Rive Sud, le Festivent et le Chocolat Favori, pour les
cours de baladi, et pour avoir été à l’écoute. Merci à ma petite famille québécoise, Stéphane,
xxxi
merci pour tous les bons moments passés ensemble, merci de m’avoir confié Arielle, ça m’aura fait une belle pratique !
Je remercie les amis VIP. Vous avez toujours été là, du (presque) début à la (presque) fin, pour le pire et pour le meilleur, vous me connaissez sous toutes les coutures (ou presque !), dans les moments sereins comme dans les moments de faiblesse. Merci d’avoir toujours été à l’écoute de mes complaintes ! Merci pour votre générosité et vos éternels encouragements ! Par ordre d’apparition : merci à Laeti, des soirées filles aux concerts de James Blunt, en passant par les tête-à-tête autour d’un café, nous partageons les mêmes valeurs et la même vision de la vie, que c’était agréable de se sentir comprise sur tant de plans ! Je souhaite que nos rêves se réalisent (prochain concert à Londres n’est-ce pas ?) ! Merci à Catherine, des mots doux sur mon bureau et des cartes de vœux à Saint Nicolas et autres repas chez vous, en passant par nos loisirs créatifs (céramique, poterie, perles), ton sourire a toujours su illuminer mes moments les plus sombres ! Tu es un trésor d’amie, si généreuse et affectueuse. Merci à Dju, des « pommes-pommes girls » à la virée à Washington, en passant par la filtration de ta bière à genoux au bord de ta baignoire, on en aura fait des folies ! Merci de m’avoir transmis ta passion pour le vernis et Grey’s Anatomy ! Nous nous sommes serré les coudes jusqu’au bout, on a réussi ! Merci à Eren, des journées sous la hotte aux cafés gourmands (au Second Cup avec les financiers !), en passant par les soirées et sorties ensemble, ton sourire et ton parfum sont caractéristiques ! Tu es un co-équipier extraordinaire, tu gardes toujours le moral et c’est communicatif !
Je remercie mes amis de France, qui sont restés fidèles malgré les kilomètres et les années, et ont toujours été au rendez-vous lors de mes retours au pays. Merci à tous d’être venus me rendre visite au Québec ! J’ai de très beaux souvenirs de vacances avec vous ! Nous ne comptons plus les années d’amitié qui nous lient, l’amitié dure bien plus que 7 ans ! Merci à Perrrrrine (la plus ancienne !) pour m’avoir toujours gardé une place dans ton cœur et dans ta vie, pour ta grande affection toute en pudeur, nous nous sommes vues grandir pendant toutes ces années et il nous reste une paire d’années pour nous voir mûrir (et pas vieillir !). Merci à ma Cat, pour tes messages et encouragements quotidiens, grâce à la technologie c’est comme si je t’avais eue près de moi tous les jours, merci pour tes câlins médicaments, merci d’avoir toujours été à l’écoute. Merci à mon Bénouche, du Québec à Madrid, tu m’auras
xxxii
suivie partout ! Que de fous-rire nous avons eus ensemble et combien de fois tu m’as manqué pour en partager ici ! Il n’existe qu’un compote comme toi au monde, tu es mâgnifique !
Je remercie mes frères (BB et P.) et leur famille, VTT et Taratata, Caroline et sa famille, pour nos échanges de courriels et votre accueil lors de mes retours en France. J’ai toujours eu hâte de vous retrouver ! La vie d’expatrié m’a fait réaliser à quel point la famille est importante et mon entourage m’a beaucoup manqué ces dernières années. C’est tellement frustrant de vivre les évènements de si loin, les évènements gais comme les évènements tristes. Je remercie ma belle-famille, pour votre accueil et votre affection, j’espère maintenant vous voir plus régulièrement !
Je remercie profondément mes parents. Je ne pensais pas que vous pourriez autant me manquer. Merci pour votre amour et votre tendresse. Merci pour l’enfance insouciante que vous m’avez offerte, merci de m’avoir donné le goût et les moyens d’apprendre et de découvrir, merci de m’avoir toujours encouragée à profiter de la vie. Merci pour les valeurs et l’éducation exemplaires que vous m’avez transmises et que j’espère pouvoir transmettre à mon tour. Merci d’avoir fait de moi la bonne personne que je suis aujourd’hui. Votre histoire d’amour et de parents est une grande source d’inspiration. Merci de m’avoir appris à aimer, aimer les gens, aimer les choses, aimer la vie, tout simplement.
Je remercie Sébastien. Merci de partager ma vie depuis plus de 5 ans. Merci de m’avoir supportée pendant toutes ces années, dans le sens d’encourager mais aussi dans le sens de tolérer mon caractère ! Merci pour le magnifique cadeau que tu m’as offert et que j’ai hâte de déballer ! J’espère que la route que nous suivons sera encore longue et nous mènera vers d’autres belles aventures…
Je remercie notre petit. Je t’attends depuis si longtemps, plus que quelques semaines et je verrai enfin ton visage ! Tu es déjà ma plus belle récompense ! Mais chut ! Il ne faudrait pas que tu prennes la grosse tête…
Et enfin je me remercie moi ! Je suis fière du chemin que j’ai parcouru jusqu’ici. De mes 20 premières années chez papa-maman dans le Nord de la France, à Paris pour 2 ans et demi (avec un séjour de 6 mois en Belgique), jusqu’ici à Québec depuis maintenant 6 ans. Je me félicite d’avoir persévéré dans cette dernière aventure, je dois sûrement beaucoup à mon
xxxiii orgueil ! L’expatriation m’a beaucoup fait grandir, parfois dans le plaisir, parfois dans la douleur, mais j’en ressors plus forte, et prête à affronter le monde des adultes !
xxxv
Avant-propos
La recherche dans le domaine du génie tissulaire de la peau est motivée par le besoin de tissus pour traiter les brûlures graves et les blessures chroniques, par la nécessité d’avoir recours à de nouveaux modèles de peau pour l’industrie pharmaceutique, et enfin par la volonté de comprendre la physiologie des peaux saines et des peaux malades. Ainsi, selon l’Organisation Mondiale de la Santé, les brûlures représentent un problème de santé publique, causant environ 195 000 décès par an. En 2008, plus de 410 000 blessures par brûlures ont été recensées aux États-Unis, dont environ 40 000 ont nécessité une hospitalisation. Ceci a bien sûr un impact économique considérable en raison des coûts directs relatifs aux soins et des coûts indirects, tels que les pertes de salaire et les soins prolongés. Concernant l’élaboration d’un médicament, ou plus généralement d’une formulation, plus d’une dizaine d’années sont nécessaires, des étapes de recherche et développement à la mise sur le marché en passant par les études cliniques qui représentent l’étape la plus longue. Les modèles proposés pour ces tests sont souvent des modèles humains sains, des modèles animaux ou des membranes artificielles, modèles peu adaptés à l’étude d’une pathologie particulière. De plus, concernant les produits cosmétiques, une nouvelle règlementation entrée en vigueur en juillet 2013, stipule que les tests sur les animaux doivent absolument être remplacés par des méthodes alternatives. Cette règlementation s’applique à tous les produits distribués en Europe, qu’ils aient été produits ou non sur le sol européen, et impose donc de nouvelles contraintes à l’industrie cosmétique mondiale. Quant à la conception de modèles cliniques pathologiques, elle peut permettre de mieux comprendre les mécanismes des maladies de peau, ce qui pourrait contribuer à rendre plus efficace la conception de formules médicamenteuses ciblées pour traiter ces maladies. Dans ce contexte, le développement de nouveaux modèles de peau les plus proches possibles de la peau native, saine ou pathologique, devient essentiel.
Le Laboratoire d’Organogénèse Expérimentale (LOEX) a été le premier laboratoire à proposer un modèle de peau reconstruite produit sans utiliser de matériaux exogènes. Grâce à la méthode d’auto-assemblage, il est ainsi possible de produire des substituts sains et pathologiques, à partir uniquement de cellules de patients. Une des pathologies considérée au LOEX est le psoriasis. Le psoriasis est une dermatose chronique qui touche 2 à 3 % de la population mondiale, soit environ 80 millions de personnes. L’étiologie de cette pathologie
xxxvi
auto-immune reste encore incomplète. Afin d’étudier les mécanismes de cette maladie et de pouvoir tester de nouvelles formulations in vitro, un modèle de peau psoriasique a été élaboré au LOEX par l’équipe de Roxane Pouliot.
Ce projet de doctorat a d’abord consisté à comparer la structure moléculaire des substituts sains avec la structure de la peau normale humaine, en utilisant la microspectroscopie vibrationnelle. Deux types de microspectroscopie vibrationnelle ont été utilisés : l’infrarouge et le Raman. Forts de ces deux techniques, et dans le but de développer des substituts pathologiques adéquats, une caractérisation complète de l’organisation moléculaire de la peau psoriasique ex vivo a ensuite été effectuée. Cette étude préalable permettra ainsi de caractériser les substituts psoriasiques dans des travaux futurs. Il s’agit d’un projet de doctorat multidisciplinaire, puisque l’expertise acquise pendant cette formation s’étend du génie tissulaire (avec la production des substituts de peau) aux analyses physico-chimiques (microspectroscopies infrarouge et Raman). Ce projet a été effectué sous la direction de Gaétan Laroche du Laboratoire d’Ingénierie de Surface (LIS) (Centre de Recherche du Centre Hospitalier Universitaire de Québec (CRCHU de Québec), Hôpital Saint François d’Assise), en codirection avec Michèle Auger du Groupe de Recherche en biophysique et en RMN des solides (Département de Chimie de l’Université Laval), et en codirection avec Roxane Pouliot du groupe psoriasis du LOEX (CRCHU de Québec, Hôpital de l’Enfant Jésus). Chaque laboratoire possède une expertise particulière. Ainsi, chronologiquement, les substituts de peau sont produits au LOEX, puis analysés par microspectroscopie infrarouge au LIS et enfin analysés par microspectroscopie Raman au Département de Chimie de l’Université Laval.
La thèse est divisée en 3 parties. La première partie est l’introduction, elle présente la peau, le psoriasis et les modèles de peau, ainsi que les objectifs du projet de doctorat. La deuxième partie est composée de 3 chapitres qui correspondent aux 3 articles qui ont été écrits au cours de la thèse. La dernière partie rassemble la discussion, la conclusion et les perspectives des travaux.
Je suis première auteure des trois articles présentés dans cette thèse :
Characterization of the structure of human skin substitutes by infrared microspectroscopy
xxxvii Publié dans le journal « Analytical and Bioanalytical Chemistry », numéro spécial « Morpho-Spectral Imaging », en novembre 2013 (volume 405, numéro 27, pages 8709 à 8718). J’ai produit les substituts sains, j’ai réalisé l’ensemble des analyses au microscope infrarouge, de l’acquisition à l’interprétation des spectres. J’ai écrit la première version du manuscrit, qui a été retravaillée avec Gaétan Laroche, puis révisée par Michel Lafleur, Michèle Auger et Roxane Pouliot.
A comparative study between human skin substitutes and normal human skin using Raman microspectroscopy
Avec pour co-auteurs : Jean-François Labbé, Marise Ouellet, Jessica Jean, Thierry Lefèvre, Gaétan Laroche, Michèle Auger et Roxane Pouliot.
Publié dans le journal « Acta Biomaterialia » en juin 2014 (volume 10, numéro 6, pages 2703 à 2711).
Dans ce travail, j’ai réalisé l’acquisition des spectres des substituts sains (produits par moi-même) présentés dans cette publication conjointement avec ma stagiaire d’été Laurie Bédard. La mise en place des paramètres expérimentaux, l’acquisition des spectres des échantillons contrôles de peau normale humaine et des premiers substituts de peau sains (produits par Jessica Jean), et le début d’interprétation des spectres ont été réalisés par les stagiaires postdoctoraux Marise Ouellet et Jean-François Labbé, et leurs stagiaires d’été respectifs Émile Robert et Marc-André Breton. J’ai également approfondi et élargi l’interprétation des spectres et j’ai écrit la première version du manuscrit, avec comme document de base une ébauche d’article écrite par Jean-François Labbé à partir du rapport de stage d’Émile Robert. La première version du manuscrit a été retravaillée avec Gaétan Laroche et Thierry Lefèvre, puis révisée par Michèle Auger et Roxane Pouliot.
Using infrared and Raman microspectroscopies to compare ex vivo involved psoriatic skin with normal human skin
Avec pour co-auteurs : Thierry Lefèvre, Roxane Pouliot, Michèle Auger et Gaétan Laroche. Accepté dans le « Journal of Biomedical Optics » en janvier 2015.
J’ai réalisé l’ensemble des analyses au microscope infrarouge et au microscope Raman, de l’acquisition à l’interprétation des spectres. J’ai écrit la première version du manuscrit, qui a
xxxviii
été retravaillée avec Gaétan Laroche et Thierry Lefèvre, puis révisée par Michèle Auger et Roxane Pouliot.
Je suis également seconde auteure d’un article (non inclus dans la thèse) :
Characterization of a psoriatic skin model produced with involved or uninvolved cells.
Avec pour co-auteurs : Jessica Jean, Alexandra Duque-Fernandez, Geneviève Bernard, Jacques Soucy et Roxane Pouliot.
Publié en ligne dans le « Journal of Tissue Engineering and Regenerative Medecine » le 20 décembre 2012 (DOI: 10.1002/term.1666).
J’ai réalisé des analyses d’infrarouge par ATR sur des substituts sains, psoriasiques lésionnels, et psoriasiques non lésionnels que j’avais produits lors d’une de mes manipulations de culture cellulaire pour compléter le nombre de lignées cellulaires étudiées.
Enfin, je suis co-auteure d’un chapitre de livre (non inclus dans la thèse) :
Advanced Materials for Biomedical Applications in Functional Materials for Energy, Sustainable Development and Biomedical Sciences, Mario Leclerc, Robert Gauvin (eds),
Walter de Gruyter GmbH, Berlin/Boston (2014) (ISBN # 978-3-11-030782-5). Avec Gad Sabbatier, Lucie Levesque, Diego Mantovani, Gaétan Laroche, et al.
Les travaux réalisés dans cette thèse ont été présentés dans différents
congrès nationaux (Canadian Biomaterials Society (CBS), Vancouver, 2011, Ottawa, 2013,
Halifax, 2014 ; Congrès Canadien de Chimie (CSC), Québec, 2013) et internationaux (International Conference on Advanced Vibrational Spectroscopy (ICAVS), Sonoma Country, USA, 2011 ; World Biomaterials Congress, Chengdu, Chine, 2012 ; European Biomaterials Society (ESB), Madrid, Espagne, 2013). J’ai également reçu différents prix pour mes présentations (six prix de la meilleure présentation par affiche ; colloque étudiant du Centre de Recherche sur les Matériaux Avancés 2014, journée du Centre de Recherche du Centre Hospitalier Universitaire de Québec 2014, ESB 2013, CBS 2011 (2 prix), colloque annuel du Centre Québécois sur les Matériaux Fonctionnels 2010 ; et deux prix de la
xxxix meilleure présentation orale ; journée scientifique du Centre LOEX de l’Université Laval 2013, colloque étudiant du CERMA 2011).
Au-delà de mes travaux de doctorat, j’ai participé à la création du Chapitre Étudiant de Québec de la Société Canadienne des Biomatériaux (CBS-QCSC) (écriture de la charte et du plan d’affaire, responsable communication pour l’organisation d’évènements). J’ai co-organisé des journées de conférences (journées portes-ouvertes du LOEX, colloque étudiant du Centre de Recherche sur les Matériaux Avancés (CERMA)). J’ai également été chargée de cours et assistante d’enseignement pour le cours de thermodynamique métallurgique dispensé au Département de Génie des Mines, des Matériaux et de la Métallurgie.
1
0 Introduction
0.1 La peau : structure et physiologie
La peau est l’organe le plus lourd et le plus étendu de l’organisme. Elle pèse 4 kg et représente une surface moyenne de 2 m². Son épaisseur est de 2 mm en moyenne, elle varie de 1 mm au niveau des paupières (peau fine) à 4 mm au niveau des paumes et des plantes (peau épaisse). La structure et la physiologie de la peau ont été détaillées dans plusieurs ouvrages de référence.[1-10] Seules les principales caractéristiques seront décrites dans cette thèse.
0.1.1 Fonctions
La peau possède plusieurs fonctions et propriétés dont certaines sont rassemblées à la
Figure 0.1 :
Figure 0.1. Fonction barrière de la peau (adaptée de [8]). Protection
La peau joue le rôle de barrière entre l’organisme et l’environnement :[2]
Menaces physiques
(irradiations UV, IR, chaleur, stress mécanique) Menaces microbiennes
(bactéries, virus) (irritants, allergènes) Menaces chimiques
Couche cornée Épiderme Barrière pour
les pertes en eau
Prévention de la perte d’eau excessive et du dessèchement
2
- contre les agressions physiques : la couche cornée, couche la plus externe, est résistante à la friction et assure une grande partie de la résistance mécanique de la peau ; elle est extensible, ce qui lui permet de résister aux étirements, dépressions et frottements. Le derme est extensible et élastique, il maintient la tension de la peau et protège les réseaux vasculaires et nerveux. L’hypoderme joue le rôle d’isolant thermique et mécanique, il est une sorte de coussin de protection qui sépare la peau des organes, des muscles et des os. Lorsque la peau subit des agressions mécaniques, il absorbe une partie de l’énergie mécanique sous forme d’énergie de déformation.
- contre les agressions chimiques : l’épiderme est hydrophobe, il protège le derme qui est mécaniquement résistant mais hydrophile. La peau est une barrière imperméable particulièrement grâce à la couche cornée et au film hydrolipidique de surface (sébum).[3] La couche cornée est résistante aux agressions chimiques grâce à sa structure à base de kératine, résistante au froid et au chaud, et résistante à la friction.[8]
- contre les microorganismes (propriétés antimicrobiennes) : la peau est infranchissable pour l’ensemble des bactéries grâce à la couche cornée. L’effet antimicrobien est induit par la desquamation (qui élimine en permanence les bactéries adhérentes), le pH relativement acide de la couche cornée (pH = 5-6, contre pH = 7,4 pour l’épiderme vivant [3]), le film hydrolipidique et la flore résidante de la peau (constituée de bactéries). De plus, la peau est capable de produire des peptides et des protéines, les défensines, qui possèdent une activité antimicrobienne. Ces molécules sont synthétisées dans les kératinocytes des couches profondes de l’épiderme et au niveau des canaux sudoripares dans le derme.
- contre les agressions infectieuses (propriétés immunologiques) : plusieurs types cellulaires présents dans la peau participent ainsi à la défense immunitaire. Les kératinocytes sécrètent des peptides antimicrobiens, sont capables de déclencher une réponse inflammatoire (sous l’action des UV par exemple) qui stimule l’activité des lymphocytes T, modulent l’activité des cellules dendritiques, ont parfois une fonction de cellules présentatrices d’antigène et peuvent être les cellules cibles de la réponse immunitaire (ce qui entraîne leur lyse cytotoxique). Les cellules de Langerhans ont un rôle anti-infectieux (bactéries, virus) et anti-tumoral. Les cellules dendritiques sont capables d’initier une réponse des lymphocytes T naïfs. Les lymphocytes T sont des
3 cellules tueuses qui déclenchent la cascade immunologique pour éliminer l’antigène et le conservent en mémoire. Les macrophages sont capables d’éliminer les virus et les bactéries. Les cellules NK (Natural Killer) ont un effet cytotoxique sur les cellules infectées par des virus ou les cellules cancéreuses.
- contre les rayons solaires : la surface de la peau est capable de réfléchir une partie du rayonnement solaire (essentiellement visible et UVA), et ce principalement au niveau de la couche cornée. Une autre partie est absorbée dans la peau, plus ou moins profondément selon le type de peau et le type de rayonnement. Seules les radiations absorbées ont un effet photochimique. Les effets peuvent être néfastes (formation de radicaux libres, vieillissement de la peau, stress oxydatif, altération du processus de transcription de l’ADN, inactivation de certaines protéines, etc…) ou bénéfiques (production de la vitamine D). La photoprotection naturelle de la peau est assurée par la barrière mélanique : la mélanine (fabriquée dans les mélanosomes) est capable de diffracter et d’absorber la lumière. L’énergie absorbée est ainsi transformée en chaleur, tout en protégeant les structures physiologiques environnantes. Les grains de mélanosomes (produits par les mélanocytes) présents dans les kératinocytes se disposent, sous l’effet des UV, en bouclier au-dessus du noyau. La mélanine est également un radical libre stable qui permet la neutralisation des espèces radicalaires réactives générées par les UV.
Échange
La peau est le lieu d’échanges divers entre l’organisme et l’environnement :[2] - perméabilité à l’eau : la peau permet de réguler les pertes en eau de l’organisme
(TransEpidermal Water Loss, TEWL).[8] Le film hydrolipidique de surface protège la peau de la déshydratation par son effet occlusif. La teneur en eau de la partie supérieure de la couche cornée varie de 10 à 20%.
- perméabilité aux agents externes (absorption) : la fonction barrière de la peau n’est pas absolue puisque la peau est perméable à pratiquement toutes les substances. Seul varie le degré de perméabilité qui est lié à l’état physiologique de la peau et aux propriétés physicochimiques des composés dont elle retarde l’entrée. L’épaisseur de la couche
4
cornée est un facteur important d’absorption. Cependant, l’efficacité de la fonction barrière dépend du nombre de couches cellulaires mais aussi du taux et du type des lipides intercellulaires. L’hydratation de la couche cornée ainsi que sa température augmentent sa perméabilité.
- perméabilité aux agents internes : élimination de la sueur par exemple, par les glandes sudoripares.
- échanges de chaleur (thermorégulation) : l’Homme est un homéotherme : il maintient sa température constante à 37 oC même si la température extérieure change. Le
métabolisme (principale source de chaleur de l’organisme), le système vasculaire cutané (vasoconstriction et vasodilatation), et les glandes sudoripares (élimination de l’énergie thermique sous forme de vapeur d’eau) permettent de réguler les échanges thermiques.
Autres
La peau a aussi d’autres fonctions :[2]
- sensorielle : la peau est le siège de perceptions variées : le derme contient des terminaisons nerveuses qui transmettent les sensations de toucher, de chaleur, de froid, de pression et de douleur au cerveau, permettant défense et adaptation au milieu environnant.[1, 9]
- métabolique : la peau est le siège de la synthèse de la vitamine D dans la partie profonde de l’épiderme, sous l’influence des rayons UVB. Le tissu adipeux est également un réservoir d’énergie et d’hormones.
- maintien de l’intégrité : la peau est en constante activité : régulation hydrique, renouvellement et synthèse (cycle pilaire et renouvellement de l’épiderme), autoréparation (ADN) et cicatrisation des plaies. La cicatrisation est une réponse du revêtement cutané à toute atteinte à son intégrité. Toute lésion tissulaire induit une réaction inflammatoire qui permet d’éliminer l’agent agresseur et les tissus nécrotiques, puis la réparation des tissus lésés. Les étapes de la cicatrisation sont : la phase vasculaire et inflammatoire (formation du caillot), la phase de réparation tissulaire (épidermisation), et la phase de maturation (et remodelage).
5 - sociale : à travers la couleur, la texture et l’odeur, la peau transmet des messages sexuels et sociaux (le rougissement traduit un sentiment de gêne). Les expressions du visage reflètent des émotions variées.[9]
0.1.2 Structure
La peau est constituée de trois tissus superposés : l’hypoderme (le plus profond), le derme et l’épiderme (le plus externe) (Figure 0.2).
Figure 0.2. Structure de la peau (adaptée de [9]).
Dans la peau on retrouve les annexes cutanées : les glandes et les phanères implantés dans le derme. Il existe deux sortes de glandes : les glandes sudoripares qui excrètent la sueur, et les glandes sébacées qui excrètent le sébum. Les phanères sont les poils et les ongles.[9]
L’hypoderme
L’hypoderme est la couche la plus profonde de la peau, il est constitué de tissu adipeux sous-cutané (par opposition au tissu adipeux viscéral ou intra-abdominal). Il est rattaché à la partie inférieure du derme par des expansions de fibres de collagène et de fibres élastiques.
6
Le tissu adipeux constitue le plus grand réservoir d’énergie de l’organisme. Il est capable de stocker les lipides sous forme de triglycérides (captation) ou de les libérer sous forme d’acides gras et de glycérol (lipolyse). Il joue le rôle de manteau thermique et d’amortisseur en cas de choc, contribuant ainsi à la plasticité du tissu cutané.[1]
Le derme
Le derme est un tissu conjonctif fibreux, élastique, qui constitue le support mécanique de la peau. Il mesure en moyenne de 1 à 2 mm d’épaisseur (3 à 4 mm au niveau de la paume de mains et de la plante des pieds, et 0,6 mm au niveau des paupières et du prépuce).[3] Il renferme le système vasculaire de la peau (réseaux sanguin et lymphatique) et joue un rôle important dans la thermorégulation. On y trouve des fibres nerveuses et des récepteurs sensoriels. Il contient des cellules qui interviennent de façon active dans les mécanismes de défense de l’organisme contre les micro-organismes pathogènes (leucocytes, mastocytes et macrophages). Le processus de réparation constitue également une des fonctions essentielles des tissus conjonctifs.[1]
Dans le derme, on trouve des cellules impliquées dans la défense non spécifique et dans la surveillance immunitaire : leucocytes, cellules dendritiques dermiques, mastocytes, macrophages. Mais les principales cellules du derme sont les fibroblastes, responsables de la synthèse et de l’entretien de la matrice extracellulaire. Elles synthétisent ainsi les composants fibreux (collagène, élastine), la substance fondamentale (gel de protéoglycanes) et les glycoprotéines de structure (fibronectine). Les fibroblastes peuvent produire mais aussi dégrader le collagène et la matrice extracellulaire.
Le collagène est une protéine fibreuse du milieu extracellulaire des tissus conjonctifs. C’est la protéine la plus abondante du corps humain. Elle est responsable de la résistance mécanique des tissus à l’étirement. Il existe plus de 25 types de collagène :[11] les types I et III sont des collagènes fibrillaires, constituants majeurs du derme. Ils sont sécrétés dans le milieu extracellulaire sous forme de procollagène à l’origine du collagène. Les molécules de collagène ont une structure hélicoïdale rigide à trois brins. Ce sont des molécules riches en proline, en hydroxyproline et en glycine. Leur séquence est de type X-Y-glycine, la glycine permettant aux trois chaînes α-hélicoïdales de s’enrouler pour former la triple hélice de
7 collagène. Les molécules de collagène s’associent pour former des fibrilles de 50 à 200 nm de diamètre. Les fibrilles s’agrègent pour former des fibres de plusieurs micromètres de diamètre.[1]
Les fibres élastiques sont un composant intégral de la matrice extracellulaire. Elles fournissent les propriétés élastiques aux tissus biologiques dont le rôle physiologique nécessite une déformation répétée et une relaxation au cours du temps. Les fibres élastiques sont retrouvées principalement dans les tissus conjonctifs et vasculaires, les poumons et la peau. Le cœur des fibres élastiques (90 %) est composé d’élastine, protéine dont le précurseur est la tropoélastine. Les molécules d’élastine s’assemblent pour former des filaments d’élastine de 3 à 5 nm de diamètre qui s’associent eux-mêmes en fibrilles, celles-ci vont ensuite s’agréger pour former les fibres.. Les filaments d’élastine sont alignés parallèlement à l’axe de la fibre. L’élastine est le contributeur essentiel à l’élasticité des fibres. Sa principale fonction, lorsqu’elle est hydratée, est sa capacité à s’étendre et à se rétracter de manière élastique, même après plusieurs cycles de sollicitation. L’étirement des fibres élastiques permet de passer d’un état désordonné à un état ordonné où les filaments s’alignent selon l’axe d’application de la force.[12]
La membrane basale, séparant le derme de l’épiderme, est appelée jonction dermo-épidermique. Elle est constituée de fins feuillets de matrice extracellulaire (50 à 80 nm d’épaisseur). La jonction dermo-épidermique se distingue par la présence d’ancrages :
- côté épiderme, des filaments d’ancrage issus des hémidesmosomes assurent la jonction entre les kératinocytes basaux et la membrane basale (lamina lucida)
- côté derme, les fibres d’ancrage, composées de collagène, interagissent avec la membrane basale (zone fibrillaire).
Entre la lamina lucida et la zone fibrillaire, on trouve la lamina densa constituée en majorité de collagène de type IV.
La membrane basale joue un rôle mécanique de soutien pour les cellules et les tissus, et un rôle biologique tel que la filtration de divers sels et molécules. Elle contrôle également le comportement cellulaire au cours du développement et au cours des remaniements tissulaires.[1]
8
L’épiderme
L’épaisseur de l’épiderme est environ celle d’une feuille de papier, mais elle varie d’un endroit à l’autre du corps, de 1,5 mm au niveau palmo-plantaire à 0,05 mm au niveau des paupières. L’épiderme n’est pas vascularisé ; les nutriments proviennent du derme et y pénètrent par diffusion.[1, 3]
L’épiderme est un épithélium pavimenteux stratifié kératinisé : - pavimenteux car les cellules de sa couche superficielle sont plates - stratifié car il est constitué de plusieurs assises cellulaires
- kératinisé car il synthétise une protéine fibreuse, la kératine, insoluble dans l’eau, qui confère aux kératinocytes, et donc à l’épiderme, sa fonction de protection.
L’épiderme est constitué de quatre ou cinq couches cellulaires (peau fine ou peau épaisse) dans lesquelles on trouve quatre types de cellules :
- les kératinocytes : cellules les plus nombreuses, elles représentent 80% de la population cellulaire de l’épiderme.
- les mélanocytes : cellules capables de synthétiser la mélanine (sous forme de granules appelées mélanosomes). La mélanine protège les cellules en absorbant les rayons ultraviolets du soleil qui pourraient endommager leur ADN.
- les cellules de Langerhans : cellules appartenant au système immunitaire qui défendent l’organisme contre les agressions extérieures.
- les cellules de Merkel : cellules nerveuses qui jouent le rôle de récepteur sensoriel (toucher).
De la profondeur à la surface, on distingue cinq couches de kératinocytes définis par leur position, leur forme, leur morphologie et leur état de différenciation (Figure 0.3) :[1, 3] - couche basale ou couche germinative : couche la plus profonde de l’épiderme, en contact avec la jonction dermo-épidermique. Il s’agit d’une monocouche de cellules cylindriques qui s’ancrent dans la jonction dermo-épidermique grâce aux tonofilaments reliés en hémidesmosomes, et aux cellules voisines grâce aux tonofilaments reliés en desmosomes (jonctions serrées). Les tonofilaments sont constitués de kératine. Le cytoplasme de ces cellules est riche en organites cellulaires et en mélanosomes qui se
![Figure 0.1. Fonction barrière de la peau (adaptée de [8]).](https://thumb-eu.123doks.com/thumbv2/123doknet/6651148.181857/41.918.278.677.545.888/figure-fonction-barrière-peau-adaptée.webp)
![Figure 0.5. Formation des bicouches de lipides à l'interface couche granuleuse / couche cornée (adaptée de [8])](https://thumb-eu.123doks.com/thumbv2/123doknet/6651148.181857/54.918.214.664.436.653/figure-formation-bicouches-lipides-interface-granuleuse-cornée-adaptée.webp)
![Figure 0.7. Visualisation des disques lamellaires par microscopie électronique à balayage (tirée de [6])](https://thumb-eu.123doks.com/thumbv2/123doknet/6651148.181857/56.918.118.405.112.433/figure-visualisation-disques-lamellaires-microscopie-électronique-balayage-tirée.webp)
![Figure 0.10. Structure moléculaire des différents céramides présents dans la couche cornée (adaptée de [14])](https://thumb-eu.123doks.com/thumbv2/123doknet/6651148.181857/58.918.113.755.471.945/figure-structure-moléculaire-céramides-présents-couche-cornée-adaptée.webp)
![Figure 0.22. Régions préférentiellement touchées par le psoriasis et caractéristiques morphologiques d'une peau psoriasique (adaptée de [67])](https://thumb-eu.123doks.com/thumbv2/123doknet/6651148.181857/70.918.240.638.103.554/régions-préférentiellement-touchées-psoriasis-caractéristiques-morphologiques-psoriasique-adaptée.webp)



![Figure 0.31. Organisation des lipides dans la peau normale humaine (adaptée de [115])](https://thumb-eu.123doks.com/thumbv2/123doknet/6651148.181857/85.918.220.739.538.837/figure-organisation-lipides-peau-normale-humaine-adaptée.webp)