FACULTE MIXTE DE MEDECINE ET DE PHARMACIE DE ROUEN
ANNEE 2017 N°
(Diplôme d’état)
Par
Chloé KERVARREC
Née le 16 septembre 1989 à Rouen
Présentée et soutenue publiquement le jeudi 5 octobre 2017
Les patients sous traitements anticoagulants
connaissent-ils leur traitement ? Comparaison des
antivitamines K versus anticoagulants oraux directs
en Seine Maritime.
PRÉSIDENT DU JURY : Monsieur le Professeur Hervé LEVESQUE
DIRECTEUR DE THESE : Madame le Docteur Valérie VILLAMAUX
MEMBRES DU JURY : Monsieur le Professeur Ygal BENHAMOU
Monsieur le Professeur Emmanuel LEFEBVRE
THESE POUR LE
DOCTORAT EN MEDECINE
2
ANNEE UNIVERSITAIRE 2016 - 2017 U.F.R. DE MEDECINE ET DE-PHARMACIE DE ROUEN
---
DOYEN : Professeur Pierre FREGER
ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire
Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale
Mme Bouchra LAMIA Havre Pneumologie
Mr Olivier BOYER UFR Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Pierre CZERNICHOW (surnombre) HCH Epidémiologie, économie de la santé Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication Mr Pierre DECHELOTTE HCN Nutrition
3
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie Mr Jean François GEHANNO HCN Médecine et santé au travail Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie Mr Michel GODIN (surnombre) HB Néphrologie M. Guillaume GOURCEROL HCN Physiologie Mr Dominique GUERROT HCN Néphrologie Mr Olivier GUILLIN HCN Psychiatrie Adultes
Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence Mr Pascal JOLY HCN Dermato - Vénéréologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
4
Mme Isabelle MARIE HB Médecine interne Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie Mr Loïc MARPEAU HCN Gynécologie - Obstétrique
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie M. Benoit MISSET HCN Réanimation Médicale Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie Mr Didier PLISSONNIER HCN Chirurgie vasculaire Mr Gaëtan PREVOST HCN Endocrinologie Mr Bernard PROUST HCN Médecine légale
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie Mr Guillaume SAVOYE HCN Hépato-gastrologie Mme Céline SAVOYE–COLLET HCN Imagerie médicale Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale Mr Jean-Jacques TUECH HCN Chirurgie digestive Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale Mr Pierre VERA CB Biophysique et traitement de l’image
5
Mr Eric VERSPYCK HCN Gynécologie obstétrique Mr Olivier VITTECOQ HB Rhumatologie
Mr Jacques WEBER HCN Physiologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire Mr Gérard BUCHONNET HCN Hématologie Mme Mireille CASTANET HCN Pédiatrie Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mme Dominique LANIEZ UFR Anglais – retraite 01/10/2016
6
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Jean-Jacques BONNET Pharmacologie
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mme Elisabeth SEGUIN Pharmacognosie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
7
Mr Abdelhakim ELOMRI Pharmacognosie
Mr François ESTOUR Chimie Organique
Mr Gilles GARGALA (MCU-PH) Parasitologie
Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ASSISTANT HOSPITALO-UNIVERSITAIRE
Mme Sandrine DAHYOT Bactériologie
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mr Souleymane ABDOUL-AZIZE Biochimie
Mme Hanane GASMI Galénique
Mme Caroline LAUGEL Chimie organique
8
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mr Jean-Jacques BONNET Pharmacodynamie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mme Elisabeth SEGUIN Pharmacognosie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
9
III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mr Philippe NGUYEN THANH UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
Mme Yveline SEVRIN UFR Médecine générale
10
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905) Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (phar) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079) Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
11
Par délibération en date du 3 mars 1967, la faculté a arrêté que les opinions émises dans les dissertations qui lui seront présentées doivent être considérées comme propres à leurs auteurs et qu’elle n’entend leur donner aucune approbation ni improbation.
12
Au président du jury de thèse,
Monsieur le Professeur Hervé LEVESQUE,
Vous me faites l’honneur de présider ce jury de thèse, veuillez trouver ici l’expression de ma profonde et respectueuse considération. Je vous suis reconnaissante de m’avoir fait confiance et de m’avoir ouvert les portes de la médecine vasculaire.
13
Au membre du jury de thèse,
Monsieur le Professeur Ygal BENHAMOU,
Je te remercie de me faire l’honneur de juger cette thèse. Merci de m’avoir accueillie dans l’unité d’Angéiologie où j’ai beaucoup appris à tes côtés grâce à ta disponibilité et tes précieux conseils.
14
Au membre du jury de thèse,
Monsieur le Professeur Emmanuel LEFEBVRE,
Vous me faites l’honneur de juger ce travail, veuillez trouver ici l’expression de mes sincères remerciements et de mon profond respect.
15
A la directrice de thèse
Madame le Docteur Valérie VILLAMAUX
Je te remercie d’avoir accepté de diriger ce travail, de ta disponibilité tout au long de son élaboration. Merci de m’avoir accueillie dans ton cabinet et de m’avoir fait découvrir la médecine générale.
16
Au Docteur Nicole CAILLEUX TALBOT,
Pour m’avoir accueillie dans l’unité d’Angéiologie et tant appris au cours de ces deux semestres enrichissants avec simplicité et bienveillance.
A Guillaume Armengol et Sébastien Miranda,
Merci de m’avoir encadrée et accompagnée durant mon internat, pour votre disponibilité et vos précieux conseils.
A Agathe,
Merci de m’avoir donnée les bons conseils avant même de commencer l’internat et de m’avoir accompagnée pendant celui ci. Merci de m’avoir fait découvrir la lymphologie.
A Salma,
Merci de m’avoir accompagnée dans l’aventure de mon premier mémoire, pour ta gentillesse, ta disponibilité et tes précieux conseils.
A tous mes maîtres de stage, hospitaliers, médecins généralistes, médecins vasculaires,
En particulier au Dr BEGARIN, Dr DUMESNIL, Dr GOURVIL, Dr ARNOUX MIGRAINE Pour leur disponibilité, leur accessibilité et pour m’avoir toujours accueillie avec sympathie et bienveillance tout au long de ma formation.
A l’équipe du service vasculaire et thrombose,
Pour votre dynamisme, le plaisir de travailler avec vous, merci de m’avoir accueillie dans votre univers.
A mes amis et co-internes,
Pour tous ces bons moments passés et futurs au cours des années au travail et en dehors.
A ma famille,
Toujours présente à mes côtés, à me soutenir dans tous mes projets.
A ma belle famille,
Sur qui l’on peut toujours compter, merci de nous accompagner dans nos projets.
A mon mari, Edouard,
17
TABLE DES MATIERES
ABREVIATIONS………... 20
I. INTRODUCTION………... 21
I. 1. Les antivitamines K (AVK)
……….. 23
I. 1. 1. Différents types d’AVK
……… 23
I. 1. 2. Mécanisme d’action
………. 23
I. 1. 3. Pharmacocinétique, pharmacodynamie
……… 25
I. 1. 4. Facteurs influençant l’activité des AVK
……….. 26
I. 1. 5. Contre indications
………... 30
I. 1. 6. Modalités de prescription et surveillance biologique
………... 31
I. 2. Les anticoagulants oraux directs (AOD)
………. 33
I. 2. 1. Différents types d’AOD
……… 33
I. 2. 2. Mécanisme d’action
………. 33
I. 2. 3. Pharmacocinétique, pharmacodynamie
……… 35
I. 2. 4. Facteurs influençant l’activité des AOD
……….. 36
I. 2. 5. Contre indications
……… 38
I. 2. 6. Modalités de prescription et surveillance biologique
……….. 39
I. 3. Indications des anticoagulants oraux
………... 41
I. 4. Iatrogénie
………... 44
I. 4. 1. Effets indésirables
………44
I. 4. 2. Education thérapeutique
………... 47
I. 5. Objectif de l’étude
………... 49
II MATERIEL ET METHODES……… 50
II. 1. Description de l’étude
………. 50
II. 2. Population de l’étude
……….. 50
II. 3. Recueil de données
………. 51
II. 4. Analyse statistique
……….. 52
III RESULTATS………. 54
III. 1. Caractéristiques des médecins généralistes
……… 54
III. 2. Caractéristiques de la population
……….. 54
III. 2. 3. Population totale
………... 54
III. 2. 3. Comparaison AVK AOD
……… 55
III. 3. Critère de jugement principal
……….. 59
III. 2. 1 Note moyenne de connaissance du traitement
………. 59
III. 2. 2 Analyse comparative par question
……… 61
18
III. 4. 1 Observance
………... 62
III. 4. 2 Modalités d’informations
……… 62
III. 4. 3 Satisfaction et impact sur la qualité de vie du traitement anticoagulant
… 64
IV DISCUSSION……… 65
V CONCLUSION………... 71
VI BIBLIOGRAPHIE……… 72
VII ANNEXES……… 77
VII. 1. Score CHA2DS2–VASC
………... 77
VII. 2. Score HAS-BLED
……… 77
VII. 3. Score HEMORR2HAGE
………... 78
VII. 4. Questionnaire de thèse
……….. 79
VIII RESUME………. 81
19
LISTE DES FIGURES
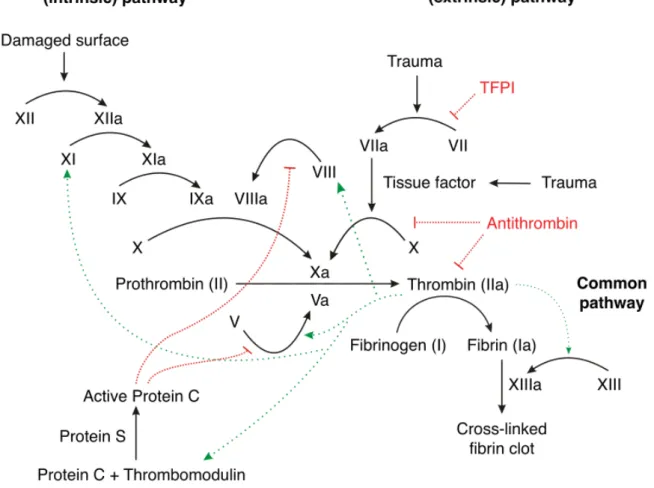
Figure 1 : Schéma de la cascade de coagulation………. 24
Figure 2 : Cycle de la vitamine K et mécanisme d’action des AVK……….. 25
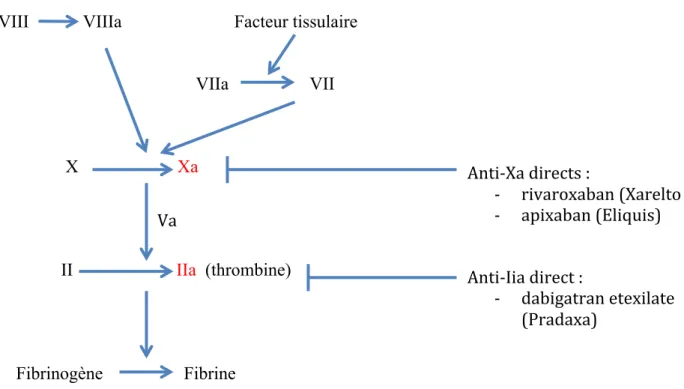
Figure 3 : Schéma simplifié de la coagulation et cibles des AOD……….. 34
Figure 4 : Déperdition de la communication orale……….. 47
Figure 5 : Répartition des catégories professionnelles des patients selon leur traitement anticoagulant oral……… 56
Figure 6 : Répartition des molécules dans le groupe AVK……… 57
Figure 7 : Répartition des molécules dans le groupe AOD……… 57
Figure 8 : Répartition des indications thérapeutiques dans le groupe AVK……….. 58
Figure 9 : Répartition des indications thérapeutiques dans le groupe AOD……….. 58
Figure 10 : Répartition des AOD et des AVK selon les centres d’études………... 59
Figure 11 : Répartition de la connaissance globale des patients du groupe AVK……….. 60
Figure 12 : Répartition de la connaissance globale des patients du groupe AOD…... 60
Figure 13 : Répartition des professionnels de santé délivrant l’information sur le traitement anticoagulant oral………... 63
Figure 14 : Evaluation de la satisfaction dans le groupe AVK et dans le groupe AOD…. 64
LISTE DES TABLEAUX
Tableau 1 : Dénominations et demi-vies des antivitamines K utilisées en thérapeutique... 26Tableau 2 : Dénominations et demi-vies des anticoagulants oraux directs utilisés en thérapeutique……….. 35
Tableau 3: Principales caractéristiques pharmacocinétiques du dabigatran étexilate, du rivaroxaban et d l’apixaban………. 36
Tableau 4 : Liste non exhaustive des médicaments interférents avec les AOD…………. 37
Tableau 5 : Synthèse des indications des anticoagulants oraux………. 43
Tableau 6 : Caractéristiques épidémiologiques des médecins généralistes………... 54
Tableau 7 : Caractéristiques épidémiologiques des patients inclus selon la classe de traitement anticoagulant oral……….. 55
Tableau 8 : Connaissance du traitement anticoagulant oral dans les groupes AVK et AOD……… 61
20
ABREVIATIONS
AAP : Anti Agrégant Plaquettaire
AFSSAPS : Agence Française de Sécurité Sanitaire des produits de santé AINS : Anti Inflammatoires Non Stéroïdiens
AMM : Autorisation de Mise sur le Marché
ANSM : Agence Nationale de Sécurité du Médicament et des produits de santé AOD : Anticoagulants Oraux Directs
AVC : Accident Vasculaire Cérébral AVK : Antivitamines K
CHU : Centre Hospitalier Universitaire EP : Embolie Pulmonaire
FANV : fibrillation atriale non valvulaire HAS : Haute Autorité de Santé
INR : International Normalised Ratio
MTEV : Maladie Veineuse Thrombo Embolique NACO : Nouveaux Anticoagulants Oraux P-gp : Glycoprotéine P
PPSPR : Protocole Pluri Professionnel des Soins de Premier Recours TVP : Thrombose veineuse profonde
21
I. INTRODUCTION
Les antivitamines K (AVK) ont longtemps été la seule classe pharmacologique d’anticoagulant oral pour le traitement des arythmies cardiaques ainsi que pour les pathologies thromboemboliques. Ces médicaments figuraient en 2000 au premier rang des médicaments entraînant des effets iatrogènes. Ils étaient responsables en France d’environ 17 000 hospitalisations par an pour hémorragie, avec près de 4800 décès 16. Devant cet état des lieux, les industriels ont développés des molécules anticoagulantes ayant un effet inhibiteur direct de la thrombine (anti-IIa), ou du facteur Xa (anti Xa) créant ainsi une nouvelle classe thérapeutique, appelée NACO (Nouveaux Anticoagulants Oraux Directs) puis AOD (Anticoagulants Oraux Directs). Le Dabigatran et le Rivaroxaban ont obtenu l’Autorisation de Mise sur le Marché (AMM) en 2008 dans la prévention des événements thrombo emboliques veineux en chirurgie orthopédique tandis que l’Apixaban a obtenu l’AMM en 2011 3, 4, 5.
L’utilisation des anticoagulants n’a cessé d’augmenter au cours des dernières années, avec un doublement des ventes des anticoagulants oraux entre 2000 et 2012. Ceci s’explique par un vieillissement de la population française puisque vingt pourcents de la population française a plus de 65 ans. En effet, l’exposition aux anticoagulants augmente avec l’âge ainsi 13,7% des sujets âgés de 65 ans et plus ont été exposés au moins une fois à un anticoagulant en 2013 2.
Parallèlement, les ventes d’AVK ont doublé entre 2000 et 2011, mais on note une décroissance en 2013. Cette décroissance coïncide avec la mise à disposition en France des anticoagulants oraux directs et l’élargissement de leurs indications. En 2013, les AOD ont obtenu l’AMM dans la prise en charge des fibrillations atriales non valvulaires puis dans le traitement de la maladie thrombo embolique veineuse 2. Près de la moitié des patients (48%) débutant un traitement anti coagulant oral cette année là en France s’est vu prescrire un traitement par NACO 1, 2.
Les AOD font actuellement l'objet de débats très vifs dans la communauté médicale internationale, d’autant que leur prescription concerne une très large population, souvent fragile et pour de longues durées de traitement. Les données récentes de la littérature
22
offrent une place primordiale aux AOD en montrant leur non infériorité par rapport à la Warfarine alors qu’ils exposent à un risque hémorragique plus faible. Ainsi les recommandations de la société européenne de cardiologie les ont placés en première ligne dans le traitement de la fibrillation atriale depuis 2012 50.
Cependant, même si la surveillance du traitement semble facilitée, par rapport aux AVK, les effets indésirables graves sont les mêmes en cas de mauvaise observance du patient ou de non respect de règles simples. Ainsi une étude récente issue du registre européen RIETE a montré que le mésusage de ces traitements exposait à un risque de complications accrues 51. C’est pourquoi nous nous sommes interrogés sur la qualité de la connaissance des patients de leur traitement anticoagulant.
Notre étude, après un bref rappel sur les AVK et les AOD, avait pour objectif principal de comparer les connaissances des patients sous anticoagulants oraux au long cours selon leur traitement : AVK versus AOD.
Les objectifs secondaires étaient d’évaluer comparativement les modalités de l’information thérapeutique délivrée, le ressenti concernant le traitement et l’observance déclarée par le patient selon l’anticoagulant oral.
23
I.1 Les antivitamines K (AVK)
I.1.1 Différents types d’AVK
Il existe deux grandes classes d’AVK disponibles en France : les coumariniques (Acénocoumarol : SINTRON®, Warfarine : COUMADINE®) et les dérivés de l’indanedion (Fluindione : PREVISCAN®) 2.
Le Fluindione (PREVISCAN®) est l’AVK le plus utilisé en France (81,4% des patients sous AVK en France en 2011).
I.1.2 Mécanisme d’action
L’hémostase secondaire est un processus complexe et hautement régulé qui aboutit, après une cascade de réactions enzymatiques, à la conversion du fibrinogène soluble en fibrine insoluble permettant de consolider le clou hémostatique formé par les plaquettes et d’aboutir à la formation d’un caillot (figure1). Les facteurs de coagulation impliqués sont des sérines protéases qui pour être fonctionnels ont besoin de phospholipides membranaires et de calcium.
Les facteurs de la coagulation, synthétisés pour la plupart par le foie, sont divisés en précurseurs (pro-enzymes) de sérine protéase (facteurs II, VII, IX, X, XI, XII, protéine C), en cofacteurs (facteurs V, VIII, protéine S), et en substrat (fibrinogène).
La synthèse hépatique de certains facteurs de la coagulation (II, VII, IX et X et les protéines C et S) implique dans une de ses étapes une enzyme de type carboxylase. Sous l’action de cette carboxylase, les précurseurs hépatiques inactifs, sont transformés par la fixation de groupements carboxyliques en facteurs de coagulation activables. Ces derniers leur permettent, par l’intermédiaire du calcium, de se fixer à un support phospholipidique spécifique. Cette réaction de carboxylation nécessite la présence d’un cofacteur, la vitamine K. Elle fournit les ions nécessaires à la carboxylation des précurseurs hépatiques vitamines K dépendants.
La prothrombine (facteur II) est le facteur de coagulation terminal qui a la capacité d’activer une boucle d’autoamplification via une activation des facteurs V et du facteur VIII. Afin de réguler ce système, et d’éviter un emballement de la coagulation la thrombine activée (IIa) active également le complexe protéique thrombomoduline/protéine C/protéine S situé à la
24
surface de l’endothélium vasculaire. Ce dernier clive les facteurs de coagulations VIIIa et Va. L’effet immédiat est de ralentir la production de thrombine et donc d’inhiber la coagulation (figure 1).
Figure 1 : Schéma de la cascade de coagulation.
Les antivitamines K (AVK) inhibent la synthèse hépatique des facteurs de la coagulation vitamine K dépendants (facteurs II, VII, IX, X, protéines C et S) en empêchant le mécanisme de réduction de la vitamine K. Ils inhibent l’activité de deux enzymes, la vitamine K époxyréductase et la vitamine K réductase (figure 2).
25
Figure 2 : Cycle de la vitamine K et mécanisme d’action des AVK.
I.1.3 Pharmacocinétique, pharmacodynamie
Les AVK sont administrés par voie orale. Leur absorption se fait de façon presque intégrale par le tractus digestif. La concentration maximale dans le plasma est atteinte 2 à 6 heures après l’absorption. Dans le plasma, la molécule se lie de façon réversible et très importante à l’albumine (90 à 97%). La fraction liée représente un réservoir alors que l’activité anticoagulante dépend de la fraction libre. Cette dernière est métabolisée par le foie où elle exerce son action inhibitrice sur la vitamine K époxyréductase et la vitamine K réductase. Lorsque la concentration de la forme libre diminue, une partie de la forme liée à l’albumine s’en dissocie et devient active expliquant en partie l’effet prolongé des AVK.
L’excrétion des AVK se fait par voie biliaire sous forme de dérivés inactifs, une petite partie sera également filtrée au niveau du glomérule rénal et excrétée dans les urines. Au niveau digestif, ces substances peuvent être réabsorbées par un cycle entéro-hépatique, puis excrétées par les urines. Cependant, l’Acénocoumarol est peu ou pas dégradé et est excrété sous forme inchangée dans les urines.
26
Les AVK diffèrent par leur nature chimique. Le délai et la durée d’action de ces molécules sont fonction de la rapidité de leur absorption, de leur degré de liaison à l’albumine plasmatique, de leur affinité pour le récepteur hépatique et de la rapidité de leur catabolisme. On peut ainsi distinguer les AVK à demi-vie courte (Acénocoumarol) ou longue (Warfarine, Fluindione) (Tableau 1).
Le délai d’action dépend surtout de la demi-vie des facteurs inhibés et varie entre 6 heures (facteur VII et protéine C) et 2–3 jours (facteurs X et II). Ainsi, l’équilibre d’un traitement par AVK est atteint au bout de 8 jours en moyenne que l’AVK soit de demi vie courte ou longue. En revanche, l’arrêt de la prise d’un AVK à demi vie courte entraine une réversibilité d’action plus courte que pour les AVK à demi vie longue.
Tableau 1 : Dénominations et demi-vies des anti vitamines K utilisées en thérapeutique
I.1.4 Facteurs influençant l’activité des AVK
Il existe une grande variabilité intra individuelle (alimentation, interactions médicamenteuses, …) et inter individuelle (facteurs génétiques, …) de l’effet anticoagulant des AVK. Dans la mesure où l’index thérapeutique des AVK est étroit (faible différence entre les doses efficaces et les doses hémorragiques), cette variabilité impose un suivi biologique de l’effet anticoagulant obtenu pour une adaptation posologique fréquente.
D.C.I Dénomination commerciale (en heures)Demi vie
Durée d’action après arrêt des AVK (en jours
Fluindione PREVISCAN®, comprimés
quadrisécables à 20mg 31 3-4
Acénocoumarol
SINTROM®, comprimé quadrisécables à 4mg
MINI SINTROM® comprimé à 1mg 8-11 2-3
27
Alimentation
L’alimentation et la flore intestinale apportent des besoins journaliers nécessaires en vitamines K. Une consommation importante de certains aliments riches en vitamine K tels que le choux, les épinards, le soja, ou les haricots verts diminue l'effet anticoagulant des AVK. Il est donc conseillé de ne pas consommer plus d’une portion d’un de ces aliments par semaine chez les patients traités par AVK. D’autres aliments tels que le persil, la ciboulette, l’huile de colza également riches en vitamine K peuvent être consommés plus régulièrement car les quantités consommées sont réduites. En revanche, des déficits d’apport en vitamine K peuvent survenir notamment lors d’une alimentation parentérale exclusive ou dans des cas de malnutrition ou de dénutrition importante et nécessitent une supplémentation.
Etant donné l’importance des apports alimentaires dans l’équilibre du traitement, une éducation des patients vis-à-vis du régime alimentaire est indispensable afin de limiter les risques liés à des fluctuations d’efficacité des anticoagulants.
Interactions médicamenteuses
Les interactions médicamenteuses sont responsables de nombreux déséquilibres ou d’accidents hémorragiques évitables. Plusieurs mécanismes d’interaction ont pu être mis en évidence :
1. Effet sur le métabolisme hépatique : Les AVK sont métabolisés par le cytochrome P450 de type CYP2C9 en des métabolites inactifs. Tout ce qui modifie le fonctionnement de ce cytochrome peut donc modifier l'INR. De nombreux médicaments ont une action inhibitrice comme le phénobarbital, le méprobamate, la rifampicine, la phénytoïne, la carbamazépine. Ils accélèrent le catabolisme hépatique des AVK et diminuent leurs effets. L’association des ces traitements n’est pas contre indiquée mais doit suivre certaines règles : la prise de barbituriques sous traitement AVK se traduira par une augmentation du catabolisme et un risque d'inefficacité du traitement anticoagulant : les doses d'AVK devront être augmentées afin de maintenir le même niveau d’anticoagulation. A l’inverse, son arrêt lèvera l'effet inducteur imposant donc la diminution de dose des AVK. Le phénomène inverse se retrouve avec les inhibiteurs enzymatiques.
28
2. Effet sur la production endogène de vitamine K : La destruction de la flore intestinale par les antibiotiques à large spectre administrés par voie orale (tétracyclines, chloramphénicol, néomycine) perturbe la synthèse de la vitamine K et potentialise l'effet des AVK. Les huiles minérales (huile de paraffine), non résorbées par le tractus intestinal, et les laxatifs, par augmentation du transit, diminuent aussi la résorption et potentialisent l'effet anticoagulant. Le patient doit donc être informé de toutes ces interactions, et comprendre le danger d’une automédication qui pourrait induire un sur ou sous dosage de son traitement anti coagulant. L’étape d’éducation du patient est donc indispensable car la modification des habitudes quotidiennes peut être responsable d’effets secondaires graves. Cette liste d’interactions n’est pas exhaustive et il importe qu’au moment de toute prescription médicamenteuse le clinicien se pose la question d’une interférence éventuelle et au moindre doute rapproche dans le temps la surveillance des INR.
3. Compétition sur la liaison à l’albumine : Certaines molécules ont également une forte liaison à l’albumine plasmatique. Ainsi, il peut exister une compétition au niveau de ce transporteur, ce qui peut entrainer une augmentation de la fraction libre et active des antivitamines k.
Hypoalbuminémie
Les antivitamines K ont une forte liaison à l’albumine plasmatique. Plusieurs situations pathologiques telles que la dénutrition, l’insuffisance hépatique, le syndrome néphrotique ou l’inflammation sont responsables d’une diminution des taux d’albumine plasmatique, et donc d’une augmentation de la fraction libre active des antivitamines K avec un risque hémorragique 52.
Co morbidités
Les patients qui bénéficient d’un traitement anticoagulant sont souvent issus d’une population de base (âge, nombreux médicaments, …) qui présente plus de comorbidités que la population générale. Cette population poly pathologique est donc plus à risque d’accident aux anti coagulants. Ainsi une étude a montré que les patients ayant un score de comorbidité de Charlson élevé avaient un risque d’hémorragie augmenté de près de 50% 24.
29
Par ailleurs, des pathologies intercurrentes peuvent être à l’origine de modification directe ou indirecte du métabolisme des antivitamines K :
• Une pathologie hépatique aigüe peut être responsable d’une insuffisance hépato cellulaire : La diminution de la synthèse des facteurs de la coagulation, la diminution du métabolisme des AVK, seront responsables d’une augmentation de l’activité anti coagulante
• Les causes d’hypermétabolisme (épisode infectieux aigu, hyperthyroïdie) ou d’hypométabolisme (Hypothyroïdie)
• L’Insuffisance rénale est une situation fréquente chez les personnes âgées et qui entraine une diminution de la clairance du médicament avec une augmentation subséquente du risque hémorragique 25.
Aussi, toute pathologie limitant l’absorption digestive (résection intestinale chirurgicale, etc…) de la vitamine K va majorer l’effet anti coagulant d’un traitement anti vitamine K.
Facteurs génétiques
Des variations génétiques (polymorphismes) ont été identifiées comme des déterminants majeurs de la réponse aux AVK 54. Deux gènes sont principalement impliqués : l'un codant pour la vitamine K époxyde réductase, VKORC1, cible pharmacologique des AVK, et l'autre codant pour le cytochrome P450 2C9, CYP2C9, responsable du métabolisme des AVK coumariniques en dérivés inactifs. Les polymorphismes de VKORC1 et CYP2C9 sont très fréquents dans la population générale et varient en fonction de l'origine ethnique. Les patients porteurs de ces polymorphismes présentent une hypersensibilité aux AVK, qui se traduit par une dose faible à l'équilibre, une réponse précoce à l'instauration du traitement et un risque de surdosage majoré par rapport aux patients « sauvages ».
De rares cas de résistance héréditaire aux AVK ont été décrits 54. Une résistance aux AVK se définit par l’impossibilité d’obtenir une hypocoagulabilité pour des doses trois fois supérieures à la dose habituellement utilisée pour obtenir un équilibre thérapeutique. Ce diagnostic ne sera retenu qu’après avoir éliminé les causes les plus fréquentes de résistance au traitement : défaut d’observance, cause alimentaire, interaction médicamenteuse, défaut d’absorption intestinale.
30
I.1.5 Contre-indications
Les contre-indications absolues communes aux trois AVK sont 16: - Les hypersensibilités connues à un des produits ou excipients, - L’insuffisance hépatique sévère,
- La grossesse. Les AVK traversent la barrière placentaire et peuvent donc induire des désordres hémorragiques chez le fœtus et des fœtopathies. Si une anticoagulation doit être maintenue au cours de la grossesse, un relais par un autre traitement anticoagulant est indispensable.
En revanche, l’allaitement est compatible avec la prise de certains AVK : La warfarine et l’acénocoumarol contrairement au fluindione passent en très faible quantité dans le lait maternel, aucun effet indésirable n'a été observé chez les enfants allaités. Si l'allaitement est exclusif, un apport en vitamine K1 est recommandé aux doses usuelles.
- En association à l’acide acétylsalicylique :
o pour des doses anti inflammatoires (> ou égale 1g par prise et/ou > ou égale 3g par jour)
o pour des doses antalgiques ou antipyrétiques (> ou égale 500mg par prise et/ou >3g par jour) et en cas d’antécédent d’ulcère gastroduodénal
- Miconazole,
- Anti-inflammatoire non stéroïdien (AINS) avec la phénylbultazone, - Millepertuis.
D’autres contre indications sont relatives :
- En association avec l’acide acétylsalicylique :
o à dose antalgique ou antipyrétique (>500mg/prise ou <3g/jour) en l’absence d’antécédents d’ulcère gastroduodénal.
o à dose antiagrégante (de 50 à 375mg/jour) en cas d’antécédent d’ulcère gastroduodénal,
- En association avec des AINS autre que des pyrazolés - En association avec le 5-FU
31
- Une situation pathologique sous jacente : des lésions organiques susceptibles de saigner (néoplasie), après une intervention neurochirurgicale ou ophtalmologique ou possibilité de reprise chirurgicale, un ulcère gastro duodénal récent ou évolutif, des varices oesophagiennes, une hypertension artérielle maligne, des antécédents d’AVC hémorragique, une insuffisance rénale chronique sévère avec clairance de la créatinine inférieure à 20ml/min, en raison des troubles pré existants de l’hémostase.
S’il n’y a pas d’autres alternatives, après avoir évalué le rapport bénéfice/risque, les AVK sont utilisés avec une posologie initiale réduite de moitié et en surveillant plus fréquemment l’INR.
I.1.6 Modalités de prescription et surveillance biologique
Modalités de prescription
Il est recommandé de commencer le traitement avec une dose de 20 mg de Previscan® (1 cp), de 5 mg de Coumadine® (1cp) ou de 4 mg de Sintrom® (1cp). Cette dose s’administre en une prise, le soir de préférence. Le premier contrôle de l’INR est effectué 2 à 3 jours après la première prise afin de dépister une hypersensibilité. L’adaptation thérapeutique se fait par paliers de 25 % de la dose avec des contrôles INR tous les 3 à 5 jours après chaque modification de dose. Trouver la dose moyenne d’équilibre demande au minimum 1 semaine et parfois beaucoup plus. Pendant cette période, les contrôles d’INR ont lieu tous les 3 jours. Quand la dose d’équilibre est trouvée, les contrôles sont espacés, tous les 15 jours puis au moins une fois par mois. Dans certains cas, il peut être nécessaire d’alterner deux doses différentes un jour sur deux.
La prescription et la délivrance d’un traitement par AVK doivent être accompagnées d’éléments d’éducation thérapeutique. Il faut insister sur l’observance thérapeutique, la nécessité d’une prise quotidienne et à heure fixe, l’importance d’une mesure régulière de l’INR, surtout en cas de pathologie intercurrente (contrôle de l’INR dans les 72h). Le patient doit connaître les situations exposant à un déséquilibre du traitement et les signes évocateurs de surdosage. L’automédication doit être proscrite, le régime alimentaire bien expliqué. Les injections intra musculaires sont interdites.
32
Un carnet d’information et de suivi contenant une carte personnelle de traitement par AVK doit être remis au patient dans lequel il note la dose d’AVK prescrite et les résultats d’INR 16.
Surveillance biologique
La surveillance biologique des patients sous AVK se fait par le dosage de International Normalised Ratio (INR). Celle ci doit être régulière afin d’obtenir l’activité anticoagulante efficace, tant l’index thérapeutique de ces molécules soumis aux variabilités inter et intra individuelles est étroit.
L’INR est calculé à partir de la mesure du temps de Quick (TQ) selon la formule : INR = [TQ du malade / TQ du témoin ]
Le temps de Quick (TQ) explore l’activité globale de trois des quatres facteurs vitamine K dépendants : les facteurs II, VII et X. Au cours du traitement par AVK, l’expression du temps de Quick en taux de prothrombine (TP) est affectée par la sensibilité du réactif du laboratoire utilisé (thromboplastine). Pour un même niveau d’anticoagulation une thromboplastine sensible donne un TP plus bas qu’une thromboplastine moins sensible. Il est donc préférable que le patient effectue le contrôle INR toujours dans le même laboratoire.
L’INR cible recommandé pour la plupart des indications correspond à une valeur cible de 2,5 soit un intervalle d’INR compris entre 2 à 3. Seules les prothèses valvulaires cardiaques mécaniques requièrent un INR cible plus élevé selon le type de prothèse, sa localisation et les risques propres inhérents au patients. Il varie entre 2,5 (fourchette entre 2 et 3) et 4 (fourchette entre 3,5 et 4,5).
La surveillance biologique est une contrainte indispensable pour le bon suivi de ces patients du fait d’une labilité intra et inter individuelle importante, et du fait d’un index thérapeutique étroit. Cependant deux études françaises ont mis en évidence que le temps passé en zone thérapeutique avec les AVK était inférieur à 70% 14, 15. Ce constat a motivé l’industrie pharmaceutique à développer une alternative aux antivitamines K.
33
I.2. Les anticoagulants oraux directs (AOD)
I.2.1 Différents types d’anticoagulants
Il existe deux classes d’anticoagulants oraux directs commercialisés en France : un inhibiteur de la thrombine (facteur II) : le Dabigatran (PRADAXA®) et des inhibiteurs du facteur Xa : le Rivaroxaban (XARELTO®) et l’Apixaban (ELIQUIS®)
I.2.2 Mécanisme d’action
Le Dabigatran
Le Dabigatran étexilate, administré par voie orale, est une prodrogue sans activité pharmacologique, de petite taille, rapidement convertie en dabigatran par hydrolyse catalysée par des estérases dans le plasma et dans le foie. Le dabigatran est un inhibiteur direct sélectif et réversible de la thrombine et est la principale substance active plasmatique. La thrombine permet la conversion du fibrinogène en fibrine lors de la cascade de la coagulation, son inhibition empêche la formation du caillot. Il agit en inhibant directement la thrombine libre, la thrombine liée à la fibrine et l'agrégation plaquettaire induite par la thrombine (figure 3).
Le Rivaroxaban
Le Rivaroxaban est un inhibiteur direct hautement sélectif du facteur Xa, doté d'une importante biodisponibilité par voie orale. L'inhibition du facteur Xa interrompt les voies intrinsèques et extrinsèques de la cascade de coagulation sanguine, inhibant ainsi la formation de thrombine et le développement du thrombus. Le rivaroxaban n'inhibe pas la thrombine (facteur II activé) et aucun effet sur l’hémostase primaire n’a été décrit (figure 3).
34
L’Apixaban
L'apixaban est un inhibiteur oral réversible, direct et hautement sélectif du site actif du facteur Xa. Il inhibe le facteur Xa libre et lié au caillot, et l'activité de la prothrombinase. Cette dernière est un complexe enzymatique formé à la surface des plaquettes composé du facteur Xa , du facteur Va reliés aux phospholipides par le calcium. Ce complexe est 100 000 fois plus actif que l'enzyme (Xa) seul.
L'apixaban n'a pas d'effet direct sur l'agrégation plaquettaire, mais inhibe indirectement l'agrégation plaquettaire induite par la thrombine. En inhibant le facteur Xa, l'apixaban prévient la formation de thrombine et le développement du thrombus (figure 3).
VIII VIIIa Facteur tissulaire VIIa VII X Xa II IIa (thrombine) Fibrinogène Fibrine
Figure 3 : schéma simplifié de la coagulation et cibles des AOD
Anti-Xa directs : - rivaroxaban (Xarelto - apixaban (Eliquis) Va Anti-Iia direct : - dabigatran etexilate (Pradaxa)
35
D.C.I Mécanisme d’action Nom commercial Demi vie (en heure)
Dabigatran Inhibiteur direct de la
thrombine
PRADAXAgélules de 75mg, 110mg ou
150mg
8 - 17
Rivaroxaban Inhibiteur direct du
facteur Xa
XARELTO ® cp de 10, 15mg ou 20mg
7 - 11
Apixaban Inhibiteur direct du
facteur Xa
ELIQUIS cp de 2,5mg ou 5 mg
9 - 14
Tableau 2 : Dénominations et demi-vies des anticoagulants oraux directs utilisés en thérapeutique
I.2.3 Pharmacocinétique, pharmacodynamie
Absorption
Après administration orale, le Dabigatran étexilate, prodrogue inactive, est rapidement absorbé et converti en Dabigatran, dans le plasma et dans le foie pour être actif. A l’inverse, les "xabans" (Inhibiteurs de l’activité Xa) qui sont d’emblée actifs n’ont pas besoin d’être transformés in vivo en métabolites actifs. L’absorption des AOD est rapide avec des concentrations plasmatiques maximales (Cmax) qui sont obtenues 1 à 4 heures après la prise du comprimé. L’absorption du dabigatran dépend du pH gastrique : elle est diminuée en cas de traitement concomitant par inhibiteur de la pompe à protons.
Transport plasmatique et intra cellulaire
Les "-xabans" sont fortement liés aux protéines plasmatiques et donc non dialysables alors que le dabigatran est très faiblement lié aux protéines plasmatiques ce qui le rend accessible à une épuration extra rénale 21. Tous les AOD sont des substrats de la P-gp (glycoprotéine P) et donc soumis à d'éventuelles interactions médicamenteuses. Les "-xabans" présentent également un métabolisme hépatique, dépendant du CYP 3A4, ce qui expose également à un risque d'interactions médicamenteuses.
36
Elimination
Les AOD ont une demi-vie plus brève (entre 9 et 15h) que celle de la warfarine (35 à 45 h) AVK de référence. Cette caractéristique peut être un avantage en cas d’intervention chirurgicale urgente, malgré l’absence d’antagoniste à la différence des AVK. Les AODS sont surtout éliminés par voie rénale. Le dabigatran est éliminé à 80% par voie rénale, sous forme inchangée, alors que les "-xabans" présentent une élimination rénale de l'ordre de 30% (légèrement variable selon la molécule) (tableau 3).
Dabigatran
étexilate Rivaroxaban Apixaban
Cible
pharmacologique (thrombine) Facteur Iia Facteur Xa Facteur Xa
Biodisponibilité (%) 7,2% 80-100% 50%
Fixation aux
protéines 35% 95ù 87%
Demi-vie (h) 7-17h 7-11h 8-15h
Tmax (h) 1,5 – 3h 2-4h 0,5-2h
Métabolisme UGT (20%) CYP3A4/3A5
CYP2J2 CYP3A4/3A5 Elimination - 80% rénale, forme active - 20% rénale et biliaire, métabolites - 36% rénale, forme active - 32% rénale, métabolites - 32% fécale, métabolites - 25% rénale, forme active
Tableau 3: Principales caractéristiques pharmacocinétiques du dabigatran étexilate, du rivaroxaban et d l’apixaban
I.2.4 Facteurs influençant l’activité des AOD
Alimentation
Les interactions alimentaires avec les AOD sont rares, mis à part le jus de pamplemousse ingéré de façon régulière, un inhibiteur de la P-gp et du CYP3A4, qui augmente alors le risque de surdosage.
37
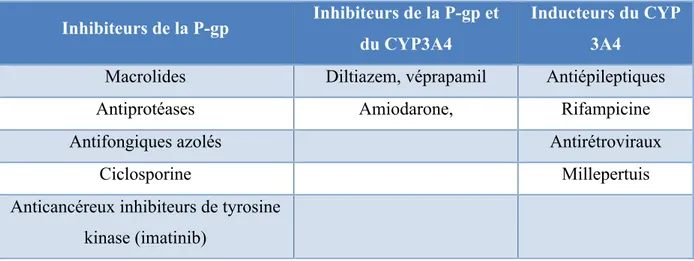
Interactions médicamenteuses
Les AOD sont des substrats de la P-gp, protéine transmembranaire contrôlant le passage transmembranaire des médicaments. Les anti Xa sont métabolisés par l’isoenzyme CYP 3A4 du cytochrome P450. L’utilisation simultanée de médicaments interférant avec la P-gp et/ou la CYP 3A4 sont susceptibles de modifier la concentration plasmatique des AOD (tableau 4)
Inhibiteurs de la P-gp Inhibiteurs de la P-gp et du CYP3A4
Inducteurs du CYP 3A4
Macrolides Diltiazem, véprapamil Antiépileptiques
Antiprotéases Amiodarone, Rifampicine
Antifongiques azolés Antirétroviraux
Ciclosporine Millepertuis
Anticancéreux inhibiteurs de tyrosine kinase (imatinib)
Tableau 4 : Liste non exhaustive des médicaments interférents avec les AOD
Poids
Il existe peu de données de la littérature chez les sujets de poids extrêmes. Dans l’étude EINSTEIN-PE seulement 1,8% de la population étudiée pèse moins de 50kg et 14% de plus de 100kg. L’étude AMPLIFY-EXT comporte environ 7% de patients de moins de 60kg. Ainsi, les patients pesant moins de 50kg aurait une augmentation de l’aire sous la courbe (ASC) alors que les patients ayant un poids supérieurs à 100-120kg aurait un effet minimal (Cmin) diminué de 20% 2. Les recommandations actuelles déconseillent l’utilisation de ces molécules au-delà de 120kg.
38
Insuffisance rénale
Les AOD étant en partie (surtout le dabigatran à 80%) éliminés par voie rénale, une insuffisance rénale, même légère, expose donc au risque de surdosage. En cas d’insuffisance rénale, le Vidal propose des réductions de posologie mais cela est uniquement recommandée sur la base du modèle pharmacocinétique et n’a pas été étudiée dans cette situation clinique. Des méta analyses issues des grands essais sur les AOD suggèrent cependant que les insuffisants rénaux font partie des patients qui bénéficient le plus de la réduction du risque hémorragique avec un effet sur les accidents thrombotiques superposables par rapport aux AVK 12.
Age
Une diminution de la posologie doit être systématiquement considérée chez la personne âgée > 80 ans. Ces populations sont effectivement à risque d’avoir des modifications itératives de leur qualité de filtration rénale, notamment en cas de situation pathologique avec l’utilisation de certains médicaments : diurétiques, anti-inflammatoires non stéroïdiens, inhibiteurs de l’enzyme de conversions, sartans.
I.2.5 Contre indications
Les contres indications suivantes sont communes au dabigatran, rivaroxaban et apixaban : - Une hypersensibilité à la substance active ou à l’un des excipients
- Un saignement évolutif cliniquement significatif
- Une lésion ou maladie, si considérée comme étant à risque significatif de saignement majeur (ulcération gastro-intestinale en cours ou récente, présence de tumeurs malignes à haut risque de saignement, lésion cérébrale ou rachidienne récente, chirurgie cérébrale, rachidienne ou ophtalmique récente, hémorragie intracrânienne récente, varices oesophagiennes connues ou suspectées, malformations artérioveineuses, anévrismes vasculaires ou anomalies vasculaires majeures intrarachidiennes ou intracérébrales),
39
- Une atteinte hépatique associée à une coagulopathie et à un risque de saignement cliniquement significatif, y compris les patients cirrhotiques avec un score de Child Pugh classe B ou C
- L’Apixaban et le Rivaroxaban sont contre-indiqués en cas de clairance de la créatinine inférieure à 15 ml/min, le dabigatran est contre indiqué pour une clairance de la créatinine inférieure à 30 ml/min et à manier avec grande prudence.
- La grossesse et l’allaitement : Les AODs n'ont pas été évalués chez la femme enceinte et de ce fait ne sont pas indiquées.
Comme pour les AVK, l’association avec les anti-inflammatoires non stéroïdiens (AINS) et les antiagrégants plaquettaires (AAP) est non recommandée car elle augmente le risque hémorragique. Ces indications doivent être restreintes aux spécialistes dans des situations cliniques particulières et validées.
I.2.6 Modalités de prescription et surveillance biologique
Modalités de prescription
Une évaluation de la clairance de la créatinine selon la formule de Cockroft-Gault avant l’initiation du traitement par AOD, puis une fois par an est indispensable. La surveillance doit être majorée en cas d’insuffisance rénale connue et chez le sujet âgé.
Certaines règles doivent être expliquées au patient sur les modalités d’administration du traitement en fonction de la molécule :
• Le Dabigatran doit être pris une fois par jour à jeun ou au cours du repas. La présence d’aliments n’affecte pas la biodisponibilité du dabigatran mais retarde de 2 heures les concentrations plasmatiques au pic. La gélule doit être avalée entière avec un verre d’eau pour faciliter la distribution dans l’estomac. L’ouverture des capsules augmente de 75% la biodisponibilité, ce qui est fortement déconseillé du fait du risque de surdosage.
• L’Apixaban doit être pris deux fois par jour (matin et soir en de préférence) à jeun ou au cours du repas. L’absorption d’aliments n’a pas d’effet sur la biodisponibilité, donc l’Apixaban peut être pris indépendamment des repas. Le comprimé peut être écrasé chez les patients ayant des troubles déglutition.
40
• Le Rivaroxaban doit être pris au cours du repas par voie orale. La biodisponibilité du rivaroxaban est proche de 80%, il est absorbé de façon active et est retrouvé sous forme inchangée dans le plasma. Les concentrations plasmatiques sont atteintes en 3h après l’ingestion. A partir de 15mg, la biodisponibilité diminue avec l’augmentation de dose. Ce phénomène est plus marqué à jeun, ce qui explique qu’il est conseillé de le prendre au milieu du repas si la dose est supérieure à 15mg. Comme l’Apixaban, il peut être écrasé.
Surveillance biologique
La posologie des AOD est standardisée et ne nécessite pas de monitorage biologique de l’efficacité en routine. Cela constitue un de leur principal avantage aussi bien pour le patient que le médecin prescripteur.
Cependant, le dosage varie selon l’AOD prescrit, l’indication thérapeutique et les situations à risques de surdosage : âge élevé, poids extrêmes, fonction rénale altérée, association thérapeutique. Il en résulte une hétérogénéité de schémas posologiques et un risque accru de mésusage. Par exemple, la posologie d’ELIQUIS® doit être réduite de 50% si le patient présente au moins 2 critères de fragilité : âge > 80 ans, poids < 60kg, créatinine sérique > 133micromol/l.
Cette absence de suivi de l’activité anticoagulante chez les patients sous AOD au long cours ne doit pas occulter la nécessité d’une surveillance clinico-biologique régulière ni de banaliser le traitement anticoagulant 7.
En cas d'hémorragie grave ou de nécessité de chirurgie urgente (définie comme une chirurgie ne pouvant être reportée) chez un patient sous AOD, des dosages spécifiques peuvent être réalisés :
- dabigatran : dosage de l'hemoclot thrombin inhibitor ;
41
I.3 Indications
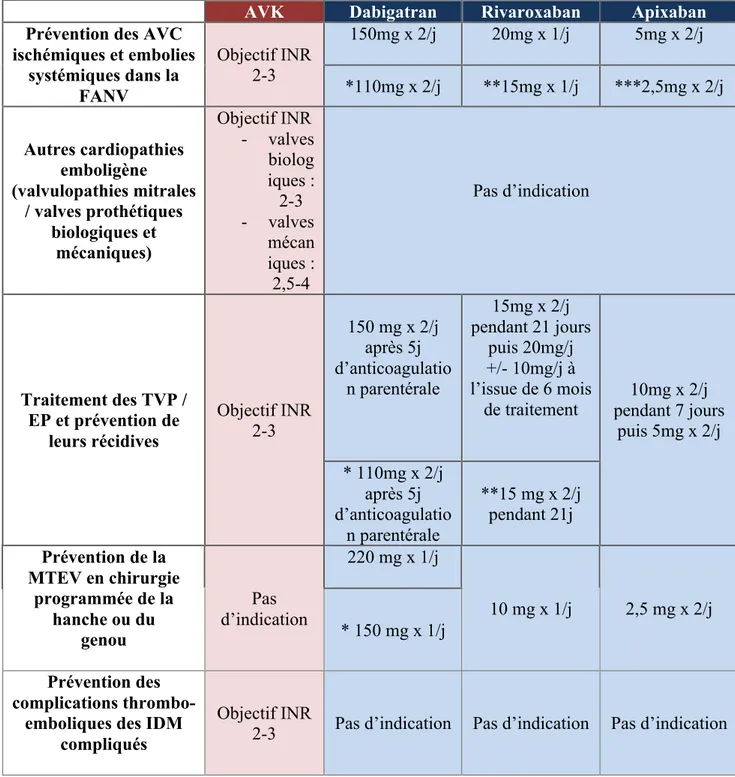
Les AVK sont indiqués en prévention primaire et secondaire des complications thrombo emboliques des cardiopathies emboligènes (fibrillation auriculaire, flutter, tachycardie atriale, valvulopathies mitrales, prothèses valvulaires) et des infarctus du myocarde compliqués (thrombus mural, dysfonction ventriculaire gauche sévère, dyskinésie emboligène), en traitement curatif des thromboses veineuses profondes et de l’embolie pulmonaire ainsi qu’en prévention de leurs récidives2. Ils sont les seuls traitements anticoagulants oraux indiqués dans la fibrillation atriale (FA) valvulaire. En effet, l’étude clinique RE-ALIGN met en évidence une augmentation du risque hémorragique et d’un manque d’efficacité avec une augmentation de complications thromboemboliques (de type thrombose de valve ou accident vasculaire cérébral (AVC)) chez les patients ayant bénéficié d’une chirurgie pour prothèse valvulaire cardiaque mécanique traités par dabigatran en comparaison aux patients traités par warfarine 2, 6 (tableau 5).
Les AOD ont reçu initialement leur autorisation de mise sur le marché (AMM) dans la prévention des évènements thromboemboliques veineux en chirurgie orthopédique 3, 4, 5. Leurs indications se sont ensuite rapidement élargies : Les essais randomisés de phase III RE-LY 9, ROCKET 39 et ARISTOTLE 33, comparant respectivement le dabigatran, le rivaroxaban et l’apixaban à la Warfarine, ont prouvé leur efficacité en prévention primaire des accidents vasculaires cérébraux et embolies systémiques chez les adultes atteints de fibrillation atriale non valvulaire (FANV) présentant un ou plusieurs facteurs de risque : antécédent d’AVC ou accident ischémique transitoire (AIT), âge supérieur à 75 ans, insuffisance cardiaque, diabète, HTA. Ces études ont amenés l’European Society of Cardiology (ESC) en 2016 et la Haute Autorité de Soins (HAS) à recommander l’instauration d’un traitement par AOD en première intention lorsque le score de CHADS2VASC ≥ 2 (annexe 1) en prenant en compte la balance bénéfice-risque. Le risque hémorragique est évalué en pratique clinique par le score HASBLED ou HAEMORRHAGE (annexe 2 et 3). Il est à noter que ces scores bien que couramment utilisés n’ont été validés qu’avec les AVK et dans la fibrillation atriale. Un traitement anticoagulant est à discuter si le score CHA2DS2-VASc est = 1, en fonction du risque hémorragique et du contexte, notamment chez les personnes âgées.
42
Plus récemment, la publication des études EINSTEIN 27, EINSTEIN-PE 28, AMPLIFY 29 et AMPLIFY-EXT 30 a permis l’AMM du Rivaroxaban et de l’Apixaban dans le traitement curatif des thromboses veineuses profondes (TVP) et des embolies pulmonaires (EP), et dans la prévention des récidives de TVP et d’EP chez l’adulte (tableau 5).
Suite à l’étude RECOVER 26, l’European Medicines Agency (EMA) rend un avis favorable à l’approbation européenne du dabigatran dans le traitement de la TVP et de l’EP et dans la prévention des récidives de TVP et d’EP chez l’adulte après 5 jours d’anticoagulation parentérale. Cependant la commission de l’HAS a pris acte du fait que le laboratoire ne demandait pas l’inscription des spécialités PRADAXA 110 mg et PRADAXA 150 mg dans cette indication et rappelle que de ce fait ces spécialités ne sont pas remboursables.
Le traitement d’un patient sous AVK ne doit être changé qu’en cas de fluctuations de l’INR en dehors de la zone thérapeutique. Il est fortement déconseillé de modifier le traitement anticoagulant AVK d’un patient bien équilibré en dehors des contre-indications.
43
AVK Dabigatran Rivaroxaban Apixaban
Prévention des AVC ischémiques et embolies systémiques dans la FANV Objectif INR 2-3 150mg x 2/j 20mg x 1/j 5mg x 2/j *110mg x 2/j **15mg x 1/j ***2,5mg x 2/j Autres cardiopathies emboligène (valvulopathies mitrales / valves prothétiques biologiques et mécaniques) Objectif INR - valves biolog iques : 2-3 - valves mécan iques : 2,5-4 Pas d’indication Traitement des TVP / EP et prévention de leurs récidives Objectif INR 2-3 150 mg x 2/j après 5j d’anticoagulatio n parentérale 15mg x 2/j pendant 21 jours puis 20mg/j +/- 10mg/j à l’issue de 6 mois
de traitement pendant 7 jours 10mg x 2/j puis 5mg x 2/j * 110mg x 2/j après 5j d’anticoagulatio n parentérale **15 mg x 2/j pendant 21j Prévention de la MTEV en chirurgie programmée de la hanche ou du genou Pas d’indication 220 mg x 1/j 10 mg x 1/j 2,5 mg x 2/j * 150 mg x 1/j Prévention des complications
thrombo-emboliques des IDM compliqués
Objectif INR
2-3 Pas d’indication Pas d’indication Pas d’indication
* Situations à risque hémorragique : insuffisance rénale modérée : CG [30-50 ml/min], administration concomitante de verapamil / amiodarone / quinidine, âge >75 ans, gastrite ou RGO.
** Situations à risque hémorragique : insuffisance rénale modérée : CG [30-49 ml/min], insuffisance rénale sévère : CG [15-29 ml/min]. *** Situations à risque hémorragique : âge > 80 ans, poids corporel <60 kg, créatinine sérique supérieure à 133 micromol/l.
44
I.4. IATROGENIE
I.4.1 Effets indésirables
Tous les médicaments anticoagulants, AVK ou AOD, exposent à deux types d’effets indésirables : les complications hémorragiques et les complications non hémorragiques.
Les accidents hémorragiques
Les accidents hémorragiques sont la complication la plus fréquente, potentiellement grave. On estime à environ 5000 le nombre d’accidents mortels liés aux hémorragies sous AVK par an 2. L’étude EMIR en 2008 montre que les accidents hémorragiques des médicaments anticoagulants de la classe des antivitamines K (AVK) sont la première cause d’accidents iatrogènes. Ils sont à l’origine du plus fort taux d’incidence d’hospitalisation pour effets indésirables : 12,7% en 2007 8.
L’arrivée des AOD sur le marché a bien sûr été soumise à l’évaluation du risque hémorragique des AOD. Dans la plupart des études de phase III ce risque était comparé à celui de la Warfarine.
L’étude RE-LY a montré une réduction significative du taux d’hémorragie majeure pour le dabigatran à posologie réduite versus warfarine dans la fibrillation atriale non valvulaire (FANV) 9. Les études ARISTOTLE et AMPLIFY29, 33 ont montré une réduction significative du taux d’hémorragies majeures de l’apixaban versus warfarine dans la FANV et la maladie thrombo embolique veineuse (MTEV). L’étude EINSTEIN-PE a montré une réduction du risque d’hémorragie majeure sous rivaroxaban versus warfarine dans le traitement de l’EP28. En revanche, il a été observé davantage de saignements digestifs sous Xarelto® que sous Warfarine dans l’étude ROCKET 39. Les agences du médicament ont demandé aux industriels de faire des études dites de vrai vie pour étudier au mieux le risque hémorragique associé à ces traitements ainsi l’étude XALIA qui étudiait le Rivaroxaban n’a pas montré d’augmentation des hémorragies digestives, cependant il n’a pas été montré non plus de réduction globale du risque hémorragique 10.
Quatre méta-analyses fondées sur les résultats des essais cliniques disponibles ont tenté, depuis 2012, de comparer les performances respectives des nouveaux anticoagulants oraux à celles de la warfarine :