UN MODÈLE POUR L'ÉTUDE DE L'HOMÉOSTASIE DES LYMPHOCYTES B
JOSÉE PARADIS
DÉPARTEMENT DE MICROBIOLOGIE ET D'IMMUNOLOGIE UNIVERSITÉ MCGILL, MONTRÉAL
SEPTEMBRE 2004
MÉMOIRE PRÉSENTÉ EN VUE DE L'OBTENTION DU DIPLÔME DE MAÎTRISE ÈS SCIENCES
(IMMUNOLOGIE)
1+1
Published Heritage Branch Direction du Patrimoine de l'édition 395 Wellington StreetOttawa ON K1A ON4 Canada
395, rue Wellington Ottawa ON K1A ON4 Canada
NOTICE:
The author has granted a non-exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
telecommunication or on the Internet, loan, distribute and sell th es es
worldwide, for commercial or non-commercial purposes, in microform, paper, electronic and/or any other formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
ln compliance with the Canadian Privacy Act some supporting forms may have been removed from this thesis.
While these forms may be included in the document page count,
their removal does not represent any loss of content from the thesis.
•
••
Canada
AVIS:
Your file Votre référence ISBN: 0-494-06437-4 Our file Notre référence ISBN: 0-494-06437-4
L'auteur a accordé une licence non exclusive permettant
à
la Bibliothèque et Archives Canada de reproduire, publier, archiver,sauvegarder, conserver, transmettre au public par télécommunication ou par l'Internet, prêter, distribuer et vendre des thèses partout dans le monde, à des fins commerciales ou autres, sur support microforme, papier, électronique et/ou autres formats.
L'auteur conserve la propriété du droit d'auteur et des droits moraux qui protège cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement reproduits sans son autorisation.
Conformément
à
la loi canadienne sur la protection de la vie privée, quelques formulaires secondaires ont été enlevés de cette thèse.Bien que ces formulaires aient inclus dans la pagination, il n'y aura aucun contenu manquant.
llillJ~~ J)~~ ~illlIIt~~ ... .
Résumé ... . ilbstract ... .
~iste des tableaux ... .
~iste des figures ... .
~iste des abréviations, sigles et symboles ... . 1. Introduction ... . 1.1 Le système de costimulation B7/CD28/CTLA-4 ... . 1.2 Les effets d'une expression constitutive de la molécule
B7.2 par les lymphocytes B ... . 1.3 Le développement et la maturation des lymphocytes B. ..
1.4 But et objectifs de ce projet de maîtrise ... . 2. ~atériels et méthodes ... . 2.1 Souris ... , 2.2 Détermination du génotype des souris ... . 2.3 Préparation des suspensions cellulaires ... . 2.4 Marquage des cellules et cytométrie de flux ... . 3. Résultats ... .
3.1 La déplétion des lymphocytes B chez les souris B7.2 transgéniques est indépendante de la voie apoptotique
Page iii Page vi Page viii Page x Page xi Page xii Page 1 Page 1 Page 5 Page 9 Page 12 Page 14 Page 14 Page 14 Page 16 Page 17 Page 19 TNF/TNFR-l ... Page 19 3.2 Population des lymphocytes B chez les souris B7.2
transgéniques déficientes en CMH de classe 1 ou en
CMH de classe II... . . .. Page 23 3.3 La déplétion des lymphocytes B dans les souris B7.2
transgéniques ne semble pas être un évènement prénatal. Page 30 3.4 Cinétique de l'ontogénie et analyse phénotypique des
lymphocytes B de la moelle osseuse des souris B7.2
3.5 Cinétique de l'ontogénie et analyse phénotypique des lymphocytes B de la rate des souris B7.2 transgéniques
de la lignée 27... ... Page 37 3.6 Cinétique de l'ontogénie et analyse phénotypique des
lymphocytes B des ganglions lymphatiques des souris
B7.2 transgéniques de la lignée 27... ... Page 44 3.7 Retard de la maturation des lymphocytes B chez les
souris B7.2 Tg de la lignée 7 âgées de vingt
Jours... Page 51 3.8 La déplétion des lymphocytes B chez les souris B7.2
transgéniques est dépendante de la spécificité
antigénique ... Page 54 3.9 Immaturité des lymphocytes B chez les souris OT-11
B7.2 double transgéniques âgées de vingt
Jours... ... ... Page 58 4. Discussion et conclusion. . . .. Page 62
4.1 La contrepartie physiologique de l'étude des souris B7.2
transgéniques... Page 62 4.2 L'implication d'un mécanisme apoptotique dans la
déplétion des lymphocytes B B7.2 transgéniques... Page 63 4.3 La participation des lymphocytes T CD4+ et CD8+ dans
la déplétion des lymphocytes B chez les souris B7.2
transgéniques... ... ... ... ... ... ... ... ... Page 66 4.4 La cinétique de l'ontogénie des lymphocytes B chez les
souris B7.2 transgéniques... Page 67 4.5 L'importance de la spécificité antigénique dans la
déplétion des lymphocytes B B7.2 transgéniques... Page 74 4.6 Conclusion... Page 76
5. Remerciements Page 78
7. Annexe 1: Compliance of certification for mouse
Résumé
La souris B7.2 transgénique:
Un modèle pour l'étude de l'homéostasie des lymphocytes B.
La protéine B7.2, exprimée par les cellules présentatrices de l'antigène, serait la principale molécule de la famille B7 impliquée dans l'initiation de la réponse immunitaire dépendante des lymphocytes T par son interaction avec le récepteur CD28 exprimé à la surface des cellules T. La molécule B7.2 peut aussi se lier avec le récepteur CTLA-4 qui, contrairement à la molécule CD28, agit à titre de régulateur négatif de l'activation des lymphocytes T. Normalement, l'expression de la protéine B7.2 est fortement régulée afin d'assurer la disponibilité transitoire de ce signal de costimulation menant à l'activation des lymphocytes T. Il a été démontré à l'aide de plusieurs modèles expérimentaux que le blocage du système B7/CD28 prévient l'initiation de réponses immunitaires contre des molécules exprimées par le Soi. Il a donc été postulé que l'expression dérégulée de la molécule B7.2 à la surface des cellules présentatrices de l'antigène pourrait briser la tolérance vis-à-vis du Soi et induire des désordres auto-immuns systémiques.
C'est en se basant sur cette hypothèse que des souris transgéniques (Tg), dans lesquelles la molécule B7.2 est exprimée de façon constitutive à la surface des lymphocytes B, ont été générées. Les souris B7.2 Tg ont révélé un rôle tout à fait inattendu du système B7.2/CD28 dans le maintien de l'homéostasie des cellules B. En effet, ces souris présentent une réduction drastique du nombre de lymphocytes B au niveau de la moelle osseuse et des organes lymphoïdes périphériques. Cette déplétion des cellules B est dépendante de la présence des lymphocytes T et de l'expression du récepteur CD28.
Le but principal de ce projet de maîtrise était d'étudier plus en profondeur les processus impliqués dans la déplétion des lymphocytes B chez les souris B7.2 Tg. Nous avons démontré que la déplétion des lymphocytes B qui expriment de façon constitutive la molécule B7.2 n'implique pas la voie apoptotique activée par le TNFR-I et peut être induite par les lymphocytes T CD8+.
L'étude du développement des lymphocytes B au cours de l'ontogénie a révélé qu'un défaut de maturation des lymphocytes B se produit très tôt lors du développement des souris B7.2 Tg. Ce phénotype est observé même chez les souris B7.2 Tg qui possèdent un répertoire de récepteurs des cellules T (TcRs) restreint. Par contre, à l'âge adulte ces souris montrent un compartiment lymphocytaire B tout à fait normal, contrairement aux souris B7.2 Tg qui possèdent un répertoire de TcRs polyclonal.
Ces études suggèrent que deux mécanismes immunologiques distincts sont impliqués dans la déplétion des lymphocytes B chez les souris B7.2 Tg. Un premier mécanisme induirait un arrêt de la maturation des lymphocytes B dans la rate très tôt au cours de l'ontogénie et se produirait même en présence d'une population de lymphocytes T dont le répertoire de TcRs est restreint. Le second mécanisme se produirait uniquement en présence d'un répertoire de TcRs polyclonal, indiquant la nécessité d'une reconnaissance de peptides du Soi présentés par les molécules du CMH exprimées à la surface des lymphocytes B par certains TcRs.
Abstract
The B7.2 transgenic mouse:
A model for studing B cell homeostasis.
The B7.2 molecule, which is mainly expressed on antigen-presenting cells, is well known to provide a costimulatory signal for the initiation of antigen-specific T cell responses through its interaction with CD28 expressed on T cells. B7.2 also binds to CTLA-4 which, in contrast to CD28, is a negative regulator of T cell activation. Normally, tightly regulated expression of B7.2 ensures the transient availability of this costimulatory signal. Because blockade of the CD28 pathway was able to inhibit the activation of self-reactive T cells in several experimental models, it has been postulated that deregulated expression of B7.2 on antigen-presenting cells may break self-tolerance and induce systemic auto immune diseases.
To test this hypothesis, transgenic (Tg) mice that constitutively express the costimulatory ligand B7.2 on B lymphocytes have been generated. These mice revealed an unforeseen role for the B7.2/CD28 costimulatory pathway in the maintenance of lymphocyte homeostasis. Adult transgenic mice expressing constitutively B7.2 on B lymphocytes have very low number of B cells in bone marrow and peripheral lymphoid organs. This mechanism requires the expression of CD28 on syngeneic T lymphocytes.
This master degree project helped us to understand sorne aspects by which the B7.2/CD28 interaction leads to the B cell elimination in B7.2 Tg mlce. First, we show that the TNF/TNFR-I apoptotic pathway is not involved in the depletion of B7.2 Tg B cells. We report also that the two T cell subsets, CD4+ and CD8+, are able to mediate the elimination ofB7.2 Tg B cells. Then, the kinetic of B cell ontogeny in B7.2 Tg mice and their wild-type littermates reveals that, early in life, B7.2 Tg mi ce exhibit a delay in B
cell maturation. This delay in B cell maturation early in ontogeny is also observed in B7.2 Tg mice that express a monoclonal specificity of the T cell antigen receptor (TcR) (B7.2/0T-I double Tg mice). However, adult B7.2/0T-I double Tg mice have a normal B cell compartment in lymphoid organs.
From our study, we conclude that there are two mechanisms by which B7.2/CD28 interaction leads to the depletion of B cells. One involves the induction of a developmental arrest that can occur even in the presence of a restricted TcR repertoire. The other involves an active process, which occurs only in the presence of a polyclonal TcR repertoire. Thus, B7.2/CD28 interaction, in addition to its critical role as a mediator of T cell proliferation in response to foreign antigens, has a functional role in the regulation of B cell homeostasis.
Liste des tableaux
Tableau 1 Nombres absolus des lymphocytes B de la moelle
Liste des figures
Figure 1 Population des lymphocytes B chez les souris B7.2
transgéniques déficientes pour la molécule TNFR-l.... Page 22
Figure 2 Population des lymphocytes B chez les souris B7.2
transgéniques déficientes en CMH de classe
II... ....
Page 27Figure 3 Population des lymphocytes B chez les souris B7.2
transgéniques déficientes en CMH de classe 1.. . . .... Page 29
Figure 4 Population des lymphocytes B du foie chez les souris
néonatales B7.2 transgéniques... Page 33
Figure 5 Population des lymphocytes B de la moelle osseuse
chez les souris B7.2 transgéniques à différents
âges... ... ... Page 36
Figure 6 Population des lymphocytes B de la rate chez les
souris B7.2 transgéniques à différents âges ... Page 41
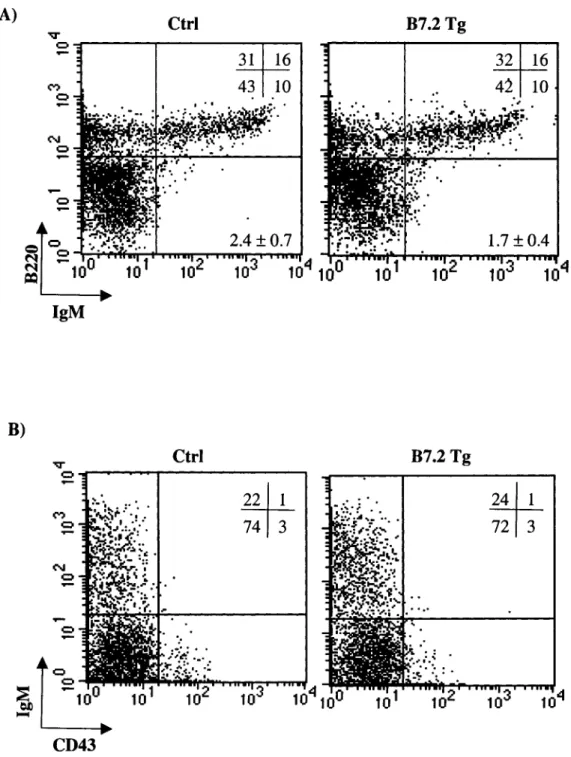
Figure 7 Caractérisation phénotypique des lymphocytes B de la
rate des souris B7.2 transgéniques à différents âges.. ... Page 43
Figure 8 Population des lymphocytes B des ganglions
lymphatiques périphériques chez les souris B7.2
transgéniques à différents âges... .... Page 48
Figure 9 Caractérisation phénotypique des lymphocytes B des
ganglions lymphatiques périphériques chez les souris
B7.2 transgéniques à différents âges... Page 50
Figure 10 Caractérisation phénotypique des lymphocytes B
chez les souris B7.2 Tg de la lignée 7 âgées de vingt
jours... Page 53
Figure 11 Population des lymphocytes B chez les souris adultes
OT-IIB7.2 double transgéniques ... Page 57
Figure 12 Caractérisation phénotypique des lymphocytes B
Liste des abréviations, sigles et symboles
ACK: Solution "Ammonium-Chloride Killing" ADN: Acide désoxyribonucléique
ADNc: Acide désoxyribonucléique complémentaire ARNm: Acide ribonucléique messager
B7.2 mod: Expression constitutive modérée (moderate) de B7.2 B7.2 hi: Expression constitutive élevée (high) de B7.2
BcR: Récepteur de cellule B (B Cell Receptor)
CD: Groupe de différentiation (Cluster Differentiation)
CLIP: Peptide de la chaîne invariante associée au CHM de classe II (Class II-Associated Invariant-Chain Peptide)
CMH: Complexe majeur d'histocompatibilité CP A: Cellule présentatrice de l'antigène
CTLA-4: Antigène 4 associé au lymphocyte cytotoxique (Cytotoxic T Lymphocyte- Associated Antigen 4)
Ctrl: Contrôle
dbTg: Double transgénique D.O.: Densité optique
dNTPs: Desoxynucléotides tri-phosphate
F ACS: Solution "Fluorescence Activated Cell Sorting" FSC: Taille cellulaire (Forward scatter)
FasL: Fas ligand
Fc: Région constante de la chaîne lourde d'immunoglobuline FITC: Fluorescéine isothiocyanate
HBSS : Milieu Hank's Balanced Salts Solution HSA: Heat-Stable Antigen
Ig: Immunoglobuline
Igll: Chaîne lourde d'immunoglobuline INF -y: Interféron gamma
IL: Interleukine L: Ligand n: Nombre
NK: Cellule Natural Killer PBS: Tampon phosphate salin
PCR: Réaction de polymérase en chaîne (Polymerase Chain Reaction) PE: Phycoerythrine
R: Récepteur
SSC: Granulosité cellulaire (Side scatter) TcR: Récepteur de cellule T (T Cell Receptor) TE: Tampon Tris-EDT A
Tg: Transgénique
TNF: Facteur de nécrose tumorale (Tumor Necrosis Factor) Va: Chaîne variable alpha du TcR
1.1 Le système de costimulation B7/CD28/CTLA-4.
Le développement d'une réponse immunitaire acqUIse dépend de l'activation des lymphocytes T. L'activation des cellules T requiert un premier signal, ou signal 1, qui est fourni par le récepteur des cellules T (TcR) suite à la liaison d'un peptide antigénique présenté par les molécules du complexe majeur d'histocompatibilité (CMH) de classe 1 ou de classe II. Un deuxième signal, ou signal 2, est également nécessaire. Celui-ci est assuré par des récepteurs dits de costimulation. L'existence du signal 2 permet une meilleure supervision de la réponse des lymphocytes T, puisque l'absence du signal de costimulation entraîne l'anergie, un état dans lequel les cellules T ne sont plus réceptives à une stimulation antigénique (Jenkins et Schwartz, 1987).
La molécule CD28, exprimée constitutivement par la majorité des cellules T CD4+ et CD8+ naïves, est le récepteur de co stimulation le mieux caractérisé (Slavik et al., 1999). La costimulation via la molécule CD28 permet l'augmentation et le soutien de la réponse des lymphocytes T initiée lors de l'engagement du TcR par le complexe CMH/peptide. Le signal via le récepteur CD28 assure la survie des lymphocytes T par l'induction de gènes anti-apoptotiques tels que bel-XL (Boise et al., 1995). De plus, il favorise la
prolifération des cellules T par la production d'IL-2, cette dernière résultant de l'induction de la transcription du gène codant pour cette cytokine et de la stabilisation de son ARNm (Greenfield et al., 1998). La prolifération des
lymphocytes T est également facilitée par la progression à travers le cycle cellulaire grâce à l'expression de certaines kinases de la phase G1 (Nagasawa
et al., 1997) et à la dégradation de l'inhibiteur du cycle cellulaire p27Kip
(Firpo et al., 1994). De plus, l'engagement du récepteur CD28 diminue le
TcR qui doivent être engagées pour induire l'expansion clonale des cellules T (Viola et Lanzavecchia, 1996). Ceci serait le résultat de signaux intracellulaires induits via le récepteur CD28 qui conduisent à la réorganisation des microtubules d'actine du cytosquelette et au recrutement de radeaux lipidiques lors de la formation de la synapse immunologique (Viola
et al., 1999; Wulfing et Davis, 1998). L'importance de la costimulation via le récepteur CD28 a été démontrée in vivo. En effet, si on empêche l'interaction de la molécule CD28 avec ses ligands, on prolonge la durée des greffes et on réduit la sévérité de certaines maladies auto-immunes chez plusieurs modèles expérimentaux (Salomon et Bluestone, 2001). De plus, on constate, chez les souris possédant une délétion du gène codant pour le récepteur CD28, une absence de centres germinatifs lors d'une immunisation avec un antigène protéique étranger, ce qui indique que le récepteur CD28 est important dans la collaboration entre les lymphocytes B et les lymphocytes T lors de la réponse immune (Shahinian et al., 1993; Ferguson et al., 1996).
Paradoxalement, le récepteur CD28, qm transmet des signaux intracellulaires lors de l'activation des lymphocytes T qui répondent aux antigènes du Soi, serait aussi important pour maintenir la tolérance des lymphocytes T. En effet, on a montré que le récepteur CD28 est nécessaire pour la génération et/ou la maintenance des cellules T régulatrices, qui sont d'une importance capitale dans le maintien de la tolérance périphérique (Tang
et al., 2003). Finalement, l'engagement du récepteur CD28 en absence d'un signal au niveau du TcR pourrait aussi avoir un effet physiologique. Il a en effet été démontré qu'une stimulation de la molécule CD28 augmente la transcription des gènes codant pour l'IL-2 et l'IL-4 indépendamment de l'engagement du TcR (Raab et al., 2001).
Le récepteur CD28 est structurellement homologue à la molécule CTLA-4, un récepteur exprimé à la surface des cellules T activées par la stimulation de leurs TcRs (Brunet et al., 1987; Harper et al., 1991). Contrairement au
récepteur CD28, la molécule CTLA-4 agit à titre de régulateur négatif de l'activation des lymphocytes T. Un des effets de l'engagement du récepteur CTLA-4 est d'empêcher la transcription du gène codant pour l'IL-2 en inhibant la translocation du facteur de transcription NF-AT au niveau du noyau cellulaire (Brunner et al., 1999). De plus, la costimulation via la
molécule CTLA-4 freine la progression à travers le cycle cellulaire en inhibant la production de la cycline 03 et des kinases cdk4 et cdk6, ainsi qu'en empêchant la dégradation de l'inhibiteur p27Kip (Brunner et al., 1999).
Malgré le fait que les récepteurs CD28 et CTLA-4 possèdent des fonctions opposées, ceux-ci partagent deux ligands communs, soit les molécules B7.l (CD80) et B7.2 (CD86), qui font partie de la grande famille des molécules B7 (Sharpe et Freeman, 2002). Les molécules B7.l et B7.2 présentent une grande homologie structurale et sont exprimées principalement par des cellules spécialisées dans la présentation de l'antigène (CPA), soit les cellules dentritiques, les monocytes, les macrophages et les lymphocytes B activés (Chambers, 2001). La molécule B7.2 est exprimée faiblement à la surface des CPAs au repos, alors que la protéine B7.1 est absente. Suite à l'activation des CPAs, l'expression de la molécule B7.2 est rapidement augmentée à leur surface, alors que la protéine B7.1 est induite plus lentement et est exprimée sur une plus longue période de temps (expression maximale après 48h versus 4-5 jours, respectivement) (Lenschow et al., 1994). Dans cet ordre d'idées, il
a été démontré que l'expression de la molécule B7.2, contrairement à celle de la molécule B7.l, est rapidement augmentée à la surface des lymphocytes B matures suite à l'engagement de leurs récepteurs des cellules B (BcRs) par un antigène (Lenschow et al., 1994). Il a donc été proposé que B7.2 serait la
principale molécule costimulatrice impliquée dans l'initiation de la réponse immune dépendante des cellules T via l'interaction avec le récepteur CD28, alors que l'interaction B7.lICD28 servirait plutôt à soutenir l'activation des lymphocytes T.
Il a récemment été démontré que les molécules B7.1 et B7.2 ne sont pas seulement exprimées par les lymphocytes B au stade mature. En effet, B7.1 est détectable à la surface des cellules pro-B et pré-B de la moelle osseuse fraîchement isolées, et l'expression de B7.2 est observée lorsque ces cellules sont mises en présence d'IL-7 (Gray et al., 2002). De plus, l'expression du
récepteur CD28 a été décelée à la surface des cellules stromales (Gray et al.,
2002). Ces résultats suggèrent que ces molécules co stimulatrices pourraient jouer un rôle fonctionnel dans le développement des lymphocytes B au niveau de la moelle osseuse.
Des études récentes indiquent que les protéines B7.1 et B7.2 ne semblent pas agir uniquement comme ligands pour les récepteurs CD28 et CTLA-4, mais peuvent aussi générer eux-mêmes des signaux intracellulaires. Il a été démontré que l'engagement des molécules B7.1 et B7.2 par des anticorps monoclonaux chez les lymphocytes B purifiés modifie la prolifération des cellules B induite par différents stimuli, la production d'IgG, l'expression de molécules anti- et pro-apoptotiques ainsi que la phosphorylation protéique (Hirokawa et al., 1996; Suvas et al., 2002). D'ailleurs, la molécule B7.2
possède une longue queue cytoplasmique comprenant jusqu'à trois sites potentiels de phosphorylation par la protéine kinase C ainsi qu'un résidu tyrosine (Lenschow et al., 1996). De plus, il a été rapporté que B7.2 devient
phosphorylée suite à l'activation des cellules B (Lenschow et al., 1996). Il a
aussi été montré que les molécules B7.1 et B7.2 exprimées à la surface des cellules dentritiques peuvent délivrer des signaux intracellulaires, qui conduisent à l'augmentation de la production d'INF-y et de TNF-a (Grohmann et al., 2002).
1.2 Les effets d'une expression constitutive de la molécule B7.2 par les lymphocytes B.
Il a été mentionné à la section 1.1 que la molécule B7.2 serait la principale molécule de la famille B7 impliquée dans l'initiation de la réponse immunitaire dépendante des lymphocytes T. Normalement, l'expression de la protéine B7.2 est fortement régulée afin d'assurer la disponibilité transitoire de ce signal de costimulation menant à l'activation des lymphocytes T. En effet, il a été démontré qu'en absence de lymphocytes T présentant la spécificité appropriée, l'expression de la molécule B7.2 est rapidement diminuée à la surface des cellules B matures stimulées in vivo
avec un antigène (Constant, 1999). De plus, l'expression de la protéine B7.2 est réprimée sur les lymphocytes B anergiques spécifiques pour des molécules du Soi (Hodgkin et Basten, 1995). Il a aussi été publié que la restauration sélective de l'expression de la molécule B7.2 sur des lymphocytes B auto-réactifs anergiques amène une prolifération massive et une production d'anticorps dirigés contre des molécules du Soi durant l'interaction avec des cellules T CD4+ spécifiques (Rathrnell et al., 1998).
Il a été démontré à de multiples repnses que le blocage du système B7/CD28 prévient l'initiation de réponses immunitaires contre des molécules exprimées par le Soi (Salomon et Bluestone, 2001). Une expression accrue de la molécule B7.2 a en effet été détectée à la surface des lymphocytes B sanguins chez des patients souffrant du lupus érythémateux disséminé, maladie qui consiste en une production chronique d'IgG dirigées contre l'ADN et plusieurs autres molécules exprimées dans le noyau cellulaire (F olzenlogen et al., 1997; Roth et al., 1997). De plus, la production d'anticorps dirigés contre l'ADN chez les souris atteintes du lupus est dépendante de l'expression de la protéine B7.2 (Nakajima et al., 1995).
Par ces observations, il a donc été postulé que l'expression dérégulée de B7.2 à la surface des cellules présentatrices de l'antigène pourrait briser la tolérance vis-à-vis du Soi et induire des désordres auto-immuns systémiques. C'est en se basant sur cette hypothèse que deux groupes de recherche indépendants ont généré des souris transgéniques dans lesquelles la molécule B7.2 est exprimée de façon constitutive à la surface des lymphocytes B, et ce dès les premiers stades de leur développement dans la moelle osseuse (Fournier et al., 1997; Van Parijs et al., 1997). Le transgène utilisé par
Fournier et al. contient la région codante de l'ADNc de B7.2 sous le contrôle
transcriptionnel d'un promoteur de la molécule CMH de classe· 1 et d'un élément "enhancer" de la chaîne lourde Il des immunoglobulines. Ce transgène permet l'expression constitutive de B7.2 chez les lymphocytes B et T ainsi que chez les cellules NK (Fournier et al., 1997). Le groupe de Van
Parijs et al. utilise un transgène contenant la région codante de l'ADNc de
B7.2 ou de B7.1 dont la transcription est contrôlée par un promoteur et un élément "enhancer" de la chaîne lourde Il des immunoglobulines. L'expression constitutive des molécules B7.2 et B7.l est observée à la surface des lymphocytes B de la moelle osseuse et des cellules T (Van Parijs
et al., 1997).
Les souris B7.2 Tg générées par Fournier et al. ainsi que par Van Parijs et al. ont révélé un phénomène tout à fait inattendu. En effet, les lignées
transgéniques qui expriment de façon constitutive les molécules B7.1 et B7.2 sur les lymphocytes B présentent toutes une réduction drastique de ces cellules au niveau de la moelle osseuse (Fournier et al., 1997; Van Parijs et al., 1997). Dans les deux lignées B7.2 trangéniques générées par Fournier et al., soit les lignées 27 et 7 (expression à la surface des lymphocytes B
matures de la molécule B7.2 à un niveau modéré ou élevé respectivement), cette déplétion des lymphocytes B de la moelle osseuse conduit à une diminution marquée des lymphocytes B dans les organes lymphoïdes périphériques tels que la rate et les ganglions lymphatiques (Fournier et al.,
1997). Par contre, les souris transgéniques générées par Van Parij s et al. et
qui expriment de façon constitutive B7.l ou B7.2 dans la moelle osseuse ne montrent pas de réduction du nombre de lymphocytes B au niveau des organes lymphoïdes périphériques (Van Parijs et al., 1997). Cette différence
entre les deux systèmes transgéniques n'est pas claire mais pourrait s'expliquer par le fait que chez les souris générées par Van Parijs et al., une
fraction des précurseurs de cellules B n'expriment pas le transgène et peuvent migrer vers la périphérie pour compléter leur programme de différentiation. Selon un mécanisme homéostatique inconnu, ces lymphocytes B pourraient remplir la niche allouée aux lymphocytes B.
Le mécanisme qui conduit à la déplétion drastique des lymphocytes B dans les souris B7.2 Tg n'est pas encore complètement connu. Fournier et al. ont
montré que ce processus dépend de la présence des lymphocytes T et de l'expression du récepteur CD28. En effet, les souris B7.2 Tg qui sont déficientes en lymphocytes T (souris B7.2 Tg TcRP -/-) ou dans l'expression de la molécule CD28 (souris B7.2 Tg CD28 -/-) ont un nombre normal de lymphocytes B dans la moelle osseuse, la rate et les ganglions lymphatiques (Fournier et al., 1997). Le transfert de lymphocytes T de type sauvage dans
les souris B7.2 Tg TcRP -/- a conduit à l'élimination des lymphocytes B de la moelle osseuse, ce qui a permis de montrer que l'expression du transgène B7.2 par les lymphocytes T n'est pas requise pour l'élimination des lymphocytes B dans les souris B7.2 Tg (Fournier et al., 1997). Cette observation est d'ailleurs supportée par les résultats de Van Parijs et al. qui
montrent que la lignée transgénique exprimant la molécule B7.l uniquement sur les lymphocytes B et non sur les lymphocytes T présente aussi une perte importante des lymphocytes B au niveau de la moelle osseuse (Van Parijs et al., 1997). Le processus d'élimination des lymphocytes B dans les souris
B7.2 Tg implique donc l'interaction entre la molécule B7.2 exprimée par les lymphocytes B et la molécule CD28 exprimée par les lymphocytes T.
Le mécanisme par lequel l'interaction B7.2/CD28 conduit à la perte des lymphocytes B n'implique pas les molécules Fas et FasL (Fournier et al.,
1997). Par contre, il est clair qu'il s'agit d'un mécanisme apoptotique puisque l'expression constitutive de la molécule anti-apoptotique Bcl-2 dans les lymphocytes B des souris B7.2 Tg permet de restaurer la population de cellules B dans la moelle osseuse, la rate et les ganglions lymphatiques périphériques (Blanchette, 2001). Cependant, il est important de préciser que les lymphocytes B qui se retrouvent dans les organes lymphoïdes périphériques des souris B7.2 Tg et qui expriment le transgène bcl-2 démontrent en grande majorité un phénotype immature (Blanchette, 2001).
Même si les lymphocytes B sont à peme détectables dans la moelle osseuse des souris B7.2 Tg, ces animaux ne sont pas tout à fait dépourvus de lymphocytes B matures dans la rate. L'examen des différents sous-types de lymphocytes B au niveau splénique a révélé que les populations de cellules B transitionnelles de type 2 (T2) et folliculaires sont fortement diminuées chez les souris B7.2 Tg, alors que le nombre de lymphocytes B de la zone marginale est augmenté chez ces animaux comparativement aux souris de type sauvage (Blanchette, 2001). De plus, la génération des lymphocytes de type B-l qui peuplent la cavité péritonéale n'est pas affectée chez les souris B7.2 Tg (S. Fournier, résultats non-publiés). Ces analyses démontrent que l'interaction B7.2/CD28 affecte particulièrement la génération d'une population spécifique de lymphocytes B, soit les lymphocytes B folliculaires.
Ces études révèlent donc que le système B7/CD28, bien connu pour jouer un rôle important dans l'activation des lymphocytes T, est aussi impliqué dans la régulation de l'homéostasie des lymphocytes B. La contrepartie physiologique du phénomène observé chez les souris B7.2 Tg n'est pas claire. Il est possible que l'expression des molécules B7.l et/ou B7.2 par les cellules immatures de la moelle osseuse serve à identifier les cellules répondant aux antigènes du Soi et à les éliminer.
1.3 Le développement et la maturation des lymphocytes B.
Les travaux qui ont conduit à la rédaction de ce mémoire de maîtrise ont impliqué l'analyse de différentes sous-populations de lymphocytes B. Afin de faciliter la présentation des résultats expérimentaux, il est opportun de rappeler les étapes du développement des lymphocytes B. Chacun des stades du développement des cellules B est caractérisé par le réarrangement séquentiel et l'expression des gènes codant pour les chaînes lourdes et légères des immunoglobulines ainsi que par l'expression de différentes molécules de surface (Hardy et Hayakawa, 2001). La génération des lymphocytes B a lieu dans le foie foetal et se poursuit par la suite dans la moelle osseuse à la naissance. Le premier sous-type de lymphocyte B à être généré est la cellule pro-B, celle-ci étant dérivée d'une cellule souche hématopoiétique pluripotente. C'est à ce stade que le réarrangement des différents segments des gènes codant pour la chaîne lourde des immunoglobulines débute, où les portions DH et JH se joignent lorsque la cellule pro-B est au stade précoce, et où les segments VH et DJH se réarrangent quand la cellule pro-B a atteint le stade tardif. On assiste alors à l'expression de la chaîne ~, caractérisant le second sous-type de lymphocyte B à survenir dans le développement, soit la cellule pré-B. La cellule pré-B passe par un premier stade dit "cellule pré-B large", où la chaîne ~ est exprimée à la surface cellulaire en combinaison avec une chaîne légère substitutive, ce qui forme le pré-BcR. Ensuite, la cellule pré-B large se divise et devient la cellule "pré-B petite", où le réarrangement des segments VL et
h
de la chaîne légère d'immunoglobuline a lieu. Les lymphocytes pro-B et pré-B peuvent se différencier par l'expression du marqueur CD43, où les cellules pro-B sont CD43+ et les cellules pré-B CD43-. Dès que l'assemblage d'une chaîne légère est terminé et qu'une molécule complète d'IgM tenant lieu de récepteur des cellules B (BcR) est exprimée à la surface cellulaire, la cellule est alors définie en tant que cellule B immature. Les cellules B immatures sont sujettes à la sélection négative si leur BcR a la capacité de se lier à des antigènes du Soi. Ladélétion des cellules B immatures réagissant contre le Soi peut être évitée par un mécanisme appelé le traitement du récepteur, qui consiste en un second réarrangement des gènes codant pour la chaîne légère des immunoglobulines afin de produire un nouveau BcR. Si, à la suite du traitement du récepteur, la cellule B immature exprime à nouveau un BcR qui se lie à des antigènes du Soi, cette cellule B sera exclue du répertoire. Dans le cas de la reconnaissance d'un antigène du Soi multivalent (par exemple les molécules du CMH présentes en grand nombre à la surface cellulaire), la cellule B immature mourra par apoptose; si l'antigène du Soi est soluble, la cellule pourra migrer en périphérie mais sera anergique (Janeway et al., 2001). Les cellules B immatures ne réagissant pas contre le Soi quittent la moelle osseuse et poursuivent leur maturation en périphérie au niveau de la rate.
Il existe quatre sous-types de lymphocytes B au niveau splénique: les cellules B transitionnelles de type 1 (Tl), les cellules B transitionnelles de type 2 (T2), les cellules B folliculaires et les cellules B de la zone marginale (Loder et al., 1999). Ces différentes sous-populations de lymphocytes B peuvent se différencier par l'expression différentielle des molécules IgM, CD21 et CD23. Les lymphocytes B Tl (IgMéleVé CD21" CD23-) représentent les cellules B nouvellement émigrées de la moelle osseuse. Si elles reçoivent les signaux appropriés, ces cellules B Tl se développent alors en cellules B T2 (IgMéleVé CD21 élevé CD23élevé). Ces signaux sont jusqu'à présent indéterminés, mais la différentiation des cellules B Tl en cellules B T2 serait dépendante d'un signal au BcR (Loder et al., 1999). Les cellules B T2 migrent dans les follicules et se différencient en cellules B folliculaires (IgM+ CD21 + CD23élevé). Les lymphocytes B folliculaires pourraient également avoir comme précurseurs les cellules B Tl (Loder et al., 1999). Finalement, l'origine des cellules B de la zone marginale (IgMéleVé CD21 élevé CD23 bas) reste obscure: elles pourraient dériver des cellules B T2 (Roark et al., 1998; Amano et al., 1998), des lymphocytes B folliculaires (Dammers et al., 1999) ou avoir pour origine le foie fœtal (Carvalho et al., 2001).
Les lymphocytes B folliculaires et les cellules B de la zone marginale représentent les deux populations de lymphocytes B matures au niveau splénique. Ces deux populations de lymphocytes B correspondent respectivement à 80-90 % et 5-10 % des cellules B comprises dans la rate d'une souris adulte (Oliver et al., 1997). Les lymphocytes B folliculaires sont
juxtaposés aux gaines lymphoïdes périartériolaires de la pulpe blanche, celle-ci composée en majorité de cellules T. Les cellules B folliculaires peuvent donc facilement participer à la réponse immunitaire dépendante des cellules T (Liu et Arpin, 1997). Les lymphocytes B de la zone marginale, comme leur nom l'indique, sont situés dans la zone marginale à proximité du sinus marginal et d'une panoplie de macrophages bordant les follicules (Martin et Keamey, 2000). Par leur situation anatomique, les cellules B de la zone marginale sont exposées aux antigènes véhiculés par la circulation sanguine et font partie de la première ligne de défense dans les réponses immunes indépendantes des lymphocytes T contre les antigènes bactériens (Martin et al., 2001; Balâzs et al., 2002).
Les lymphocytes B folliculaires ne sont pas sessiles, mais font partie du pool de lymphocytes matures recirculants, passant du sang dans les follicules lymphoïdes primaires des ganglions lymphatiques, de la rate, de même que vers d'autres tissus lymphoïdes périphériques (plaques de Peyer de l'intestin grêle, amygdales, appendice) et de là retournent dans le sang via le système lymphatique (Janeway et al., 2001). Si les cellules B rencontrent un antigène
et des lymphocytes T auxiliaires appropriés lors de leur passage dans un tissu lymphoïde, elles deviennent activées et migrent au centre des follicules lymphoïdes pour y établir des centres germinatifs, qui sont des sites d'intense prolifération des lymphocytes B où a lieu l 'hypermutation somatique des gènes réarrangés des régions variables des anticorps (Janeway et al., 2001). Ces cellules B se transforment alors en plasmocytes sécréteurs d'anticorps, qui sont surtout retrouvés dans les cordons médullaires des ganglions
lymphatiques, dans la pulpe rouge de la rate, dans la moelle osseuse et dans la lamina propria des muqueuses (Janeway et al., 2001).
Un autre sous-type de lymphocytes B, les cellules B-l, sont aussi des lymphocytes B matures résidant majoritairement dans les cavités pleurale et péritonéale (Hayakawa et Hardy, 2000). Ces lymphocytes B sont classés en deux sous-types, soit les cellules B-l a (CD5+) et B-l b (CDS-) (Berland et
Wortis, 2002). Au même titre que les lymphocytes B de la zone marginale, les cellules B-l semblent contribuer significativement aux réponses immunes indépendantes des cellules T contre les antigènes multivalents (Martin et al.,
2001). Les précurseurs de ces cellules sont un sujet controversé. La plupart des cellules B-l dériveraient de cellules souches résidant dans le foie fœtal, alors que certaines cellules B B-l seraient générées à partir des cellules B folliculaires (aussi appelées cellules B-2) en réponse à une activation indépendante des cellules T de type 2 (Wortis et al., 1995; Clarke et Arnold,
1998).
1.4 But et objectifs de ce projet de maîtrise.
Le but principal de ce projet de maîtrise était d'étudier plus en profondeur les processus impliqués dans la déplétion des lymphocytes B chez les souris B7.2 Tg. Un des objectifs de ce projet était de déterminer si l'interaction entre les molécules TNF-a et TNFR-I est impliquée dans la déplétion des cellules B B7.2 Tg, le système TNF/TNFR-l étant une des voies apoptotiques bien connue chez les lymphocytes (Smith et al., 1994; Sedger et al., 2002).
Nous avons donc croisé les souris B7.2 Tg avec des souris déficientes pour la molécule TNFR-l. Nous avons aussi voulu déterminer si la déplétion des lymphocytes B chez les souris B7.2 Tg est dépendante des lymphocytes T CD4+ et/ou CD8+. Pour répondre à cette question, nous avons généré des souris B7.2 Tg qui sont déficientes dans la génération de l'une ou l'autre de ces sous-populations de lymphocytes T. Ensuite, nous avons dressé la
cinétique de l'ontogénie des cellules B chez les souris B7.2 Tg à partir de la naissance afin de mieux comprendre le processus de déplétion des lymphocytes B chez ces animaux. Finalement, nous avons voulu étudier l'importance de l'interaction entre le TcR et le complexe CMH/peptide dans l'élimination des lymphocytes B B7.2 Tg engendrée par l'interaction entre la molécule B7.2 et son récepteur CD28 exprimé par les lymphocytes T. Nous avons donc généré des souris B7.2 Tg dont la spécificité des TcRs exprimés par les lymphocytes T est restreinte en croisant celles-ci avec les souris OT-1 Tg, qui expriment un TcR transgénique spécifique pour un peptide de l'ovalbumine. Toutes ces analyses ont été effectuées dans le cadre des souris B7.2 Tg de la lignée 27, où la molécule B7.2 est exprimée à un niveau modéré à la surface des lymphocytes B matures. Certains résultats ont aussi été corroborés par l'utilisation des souris B7.2 Tg de la lignée 7, où la molécule B7.2 est exprimée de façon élevée à la surface des lymphocytes B matures.
2- Matériels et méthodes
2.1 Souris
La génération des souris C57Bl/6- B7.2 Tg a été décrite par Fournier et al.
(Fournier et al., 1997). Les souris C57BI/6-p2-m -/-, C57B1/6- I-Ap -/- et
C57BI/6-0T-1 Tg ont été obtenues de Jackson Laboratory (Bar Harbor, ME, États-Unis). Les souris C57BI/6-TNFR-1 -/- ont été fournies par le Dr Trevor Owens (Université McGiIl, Montréal, Canada). Les souris OT-l Tg et TNFR-l -/- ont été croisées avec des souris B7.2 Tg de la lignée 27. Les souris p2-m -/- et I-Ap -/- ont été croisées avec des souris B7.2 Tg de la lignée 7 et de la lignée 27. Les souris négatives pour le transgène B7.2 ont été employées à titre de contrôles dans les expériences.
2.2 Détermination du génotype des souris
Afin de vérifier la présence ou l'absence du transgène B7.2, du transgène OT-l, des cellules T CD8+ dans les souris potentiellement p2-m-/- ou des cellules T CD4+ dans les souris potentiellement I-Ap -/-, environ 0.3 mL de sang a été prélevé de la veine de la queue dans 1 mL de solution Alsevier (144 mM dextrose/ 71 mM NaCl/ 27 mM citrate de sodium). Les échantillons sanguins ont été lavés dans 3 mL de solution FACS (154 mM NaCI/ 8,1 mM Na2HP04/ 2,68 mM KCI/ 1,47 mM KH2P04/ 1 % sérum de boeuf (Sigma) inactivé par la chaleur, 0.1 % NaN3), et les érythrocytes ont été
lysés dans 3 mL de tampon de lyse ACK (150 mM NH4Cl/ 1 mM KHC03 /
0.1 mM Na2EDT A). Après un lavage dans la solution F ACS, les cellules ont été resuspendues dans 50 ).tL de solution F ACS et ensuite incubées avec les anticorps fluorescents pendant 25 min dans la glace et à la noirceur. Un anti-CD8-FITC (10 ).tg/mL, clone Ly2, Pharmingen) a été utilisé afin de détecter la présence de cellules T CD8+ chez les souris potentiellement p2-m -/-, un anti-CD4-FITC (10 ).tg/mL, clone L3T4, Pharmingen) a été employé afin de
. vérifier la présence de cellules T CD4+ chez les souris potentiellement I-Ap -/-, un anti-Va2-FITC (10 Ilg/mL, clone B20.1, Pharmingen) a été utilisé afin de détecter le transgène OT-I et/ou un anti-B7.2-PE (4 Ilg/mL, clone RMMP-2, Cederlane) a été employé afin de détecter la présence du transgène B7.2. Les cellules ont été lavées une première fois dans la solution F ACS et une seconde fois dans la solution PBS IX (154 mM NaCl/ 8,1 mM Na2HP04e12H20/ 2,68 mM KCI/ 1,47 mM KH2P04/ 0.1 % NaN3) avant l'analyse en cytométrie de flux sur un F ACScan (Becton Dickinson). 5 XI03 évènements cellulaires ont été collectés, en excluant les cellules mortes par leurs caractéristiques FSC/SSC. L'analyse des données a été effectuée à l'aide du programme Cell Quest (Becton Dickinson).
Afin de vérifier la présence ou l'absence de la délétion du gène codant pour TNFR-I, environ 1 cm de queue de souris a été digéré avec 0.4 mg de protéinase K (ICN Biomedicals) dans 700 ilL de solution de digestion (50 mM Tris pH 8.0/ 100 mM EDTA/ 0.5 % SDS) toute la nuit à 55 oc. 700 ilL de phénol (pH 7.9, Sigma) a été ajouté au matériel digéré, et le mélange a été soumis au vortex pendant 2 min et centrifugé à 13 000 rpm pendant 20 min à la température ambiante. La phase aqueuse a ensuite été transférée dans 700 ilL de phénol-chloroforme 1: 1 (pH 7.9, Sigma! Fisher Scientific), soumise au vortex pendant 2 min, et centrifugée de nouveau à 13 000 rpm pendant 20 min à la température ambiante. La nouvelle phase aqueuse a été transférée dans 700 ilL d'éthanol 95 %, et 70 ilL de 3M sodium-acétate (pH 5.2) a été ajouté afin de faire précipiter l'ADN génomique. L'ADN a ensuite été lavé dans 1 mL d'éthanol 70 %, asséché pendant 30 min à l'air ambiant, resuspendu dans 100 ilL de tampon TE (10 mM Tris-HCl pH 7.4/ 1 mM Na2EDTA pH 8.0) et chauffé à 60 oC pendant 10 min afin de favoriser la solubilisation de l'ADN. La concentration en Ilg/mL a été déterminée par analyse spectrophotométrique (où une D.O. de 1 à 260 nm= 50 Ilg/mL d'ADN double-brin). 400 ng d'ADN génomique a été utilisé afin d'effectuer une
analyse par PCR à l'aide des amorces spécifiques pour la séquence codante de TNFR-l (Dr Trevor Owens, Université McGill, Montréal, Canada): TNFR-I-5' GGC TGC AGT CCA CGC ACT GG (amorce commune spécifique aux gènes de type sauvage et mutant), TNFR-I-3' TGT GAA AAG GGC ACC TTT ACG GC (amorce spécifique au gène de type sauvage) et TNFR-I-3' ATT CGC CAA TGA CAA GAC GCT GG (amorce spécifique au gène de type mutant). Les concentrations finales des réactifs utilisés lors du PCR étaient les suivantes: 0,8 /lM des amorces énumérées ci-dessus, 50 U/mL Taq polymérase (Amersham Pharmacia Biotech), 0,2 mM dNTPs (Amersham Pharmacia Biotech), tampon PCR IX sans MgCh (Perkin Elmer) et 2 mM MgCh (Perkin Elmer). Les conditions de PCR étaient les suivantes: 94 oC 5 min; pour 29 cycles: 94 oC 1 min, 63 oC 30 sec et 72 oC 1,5 min; 72 oC 10 min; 4 oc. Les résultats du PCR ont été visualisés par électrophorèse sur gel d'agarose 0.8 % (Sigma) contenant 0.5 /lg/mL de bromure d'éthidium (Sigma).
2.3 Préparation des suspensions cellulaires
Les cellules de la moelle osseuse ont été libérées des fémurs et des tibias par l'injection dans les cavités osseuses de milieu HBSS complet (milieu "Hank's Balanced Salts Solution" (Sigma) enrichi de 5 % de sérum de boeuf (Sigma) inactivé par la chaleur, 0.2 mM de 2-mercaptoéthanol (BioShop), 400 U/mL de pénicilline G (Sigma) et 0.4 mg/mL de streptomycine (GibcoBRL» à l'aide d'une seringue comprenant une aiguille de jauge 21 dans le cas d'os provenant de souris adultes et de jauge 26 dans le cas d'os provenant de jeunes souris (âgées de 2 à 20 jours). Les cellules de la rate, des ganglions lymphatiques (axillaires, brachiaux et inguinaux) et du foie ont été préparées dans du milieu HBSS complet en écrasant doucement les tissus entre les extrémités givrées de deux lames de microscope en verre. Les cellules des ganglions lymphatiques ont été lavées dans du HBSS complet. Les cellules hépatiques ont été resuspendues dans une solution de 44 %
Percoll (Amersham Biosciences) préparée dans du HBSS complet, et centrifugées sur un gradient de 67.5 % Percoll préparé dans l'eau à 600 rcf pendant 20 min à la température ambiante. Afin de lyser les érythrocytes, les cellules de la moelle osseuse, de la rate et du foie ont été traitées avec le tampon ACK- dans le cas de cellules provenant de souris adultes- ou avec la solution de Oey (resuspension de maximum 108 cellules dans 1 mL de solution F ACS, et traitement avec 5 mL de solution de Oey: 131 mM NH4Cl/ 13,4 mM NaHC03 / 5,55 mM dextrose/ 4,96 mM KCl/ 2, Il mM Na2HP04e12 H20/ l,53 mM CaCh/ 1,03 mM MgChe6 H20/ 0,283 mM MgS04e7 H20/ 0,2 mM KH2P04)- dans le cas des cellules provenant de jeunes souris. Ces cellules ont ensuite été lavées dans du HBSS complet. Les suspensions cellulaires ont finalement été filtrées à travers une membrane de nylon afin de retirer les agrégats tissulaires. Le compte cellulaire a été effectué à l'aide d'un hémacymètre en excluant les cellules mortes par coloration au Trypan bleu (Sigma- solution 0,4 % préparée dans du PBS IX).
2.4 Marquage des cellules et cytométrie de flux
Après un lavage dans la solution F ACS, les cellules (l06) ont été incubées
pendant 15 min sur la glace en présence de 20 ,...g/mL d'un anti-CD32/CD16 afin de bloquer les récepteurs Fc, lavées dans la solution F ACS, re-suspendues dans cette solution aux concentrations appropriées à chacun des anticorps utilisés et marquées avec les anticorps couplés à la biotine pendant 25 min sur la glace. Les cellules ont ensuite été lavées dans la solution F ACS, resuspendues dans cette solution aux concentrations appropriées à chacun des anticorps utilisés et marquées avec les anticorps fluorescents pendant 25 min sur la glace et à la noirceur. Les cellules ont ensuite été lavées une première fois dans la solution F ACS et une seconde fois dans la solution PBS IX avant d'être analysées en cytométrie de flux sur un F ACScan (Becton Dickinson). 104 évènements cellulaires ont été collectés, en excluant les cellules mortes d'après leurs caractéristiques FSC/SSC.
L'analyse des données a été effectuée à l'aide du programme Cell Quest (Becton Dickinson). Les anticorps qui ont été utilisés dans cette étude sont les suivants: B220-FITC et PE (6 Ilg/mL, clone Ly5; Cederlane), anti-IgM-biotine (10 llg/mL, clone 11/41; Pharmingen), anti-B7.2-PE (4 llg/mL, clone RMMP-2; Cederlane), anti-CD21/CD35-FITC (10 Ilg/mL, clone 706; Pharmingen), anti-CD23-PE (6 Ilg/mL, clone B3B4; Pharmingen), anti-IgD-FITC (10 Ilg/mL, clone 11-26c.2a; Pharmingen), anti-CD62L-biotine (10 Ilg/mL, clone MEL-14; Pharmingen), anti-CD l-biotine (10 Ilg/mL, clone 1B1; Pharmingen), anti-CD4-FITC (10 Ilg/mL, clone L3T4; Pharmingen), anti-CD8-PE (10 Ilg/mL, clone Ly2; Pharmingen), anti-CD43-FITC (10 Ilg/mL, clone Ly-48, leukosialin; Pharmingen) et anti-Va2-FITC (10 Ilg/mL, clone B20.1; Pharmingen). Le Cy-Chrome conjugué à la streptavidine (2 Ilg/mL, Pharmingen) a été employé afin de révéler les anticorps couplés à la biotine.
3. Résultats
3.1 La déplétion des lymphocytes B chez les souris B7.2 transgéniques est indépendante de la voie apoptotique TNFITNFR-l.
Il a été démontré auparavant que la déplétion des cellules B chez les souris B7.2 Tg est dépendante de la présence des lymphocytes T (Fournier et al.,
1997). De plus, la population de cellules B chez les souris B7.2 Tg est restaurée lorsque la molécule anti-apoptotique Bc1-2 est exprimée de façon transgénique par les lymphocytes B (Blanchette, 2001). Ces observations nous ont donc amené à poser l'hypothèse que la déplétion des lymphocytes B chez les souris B7.2 Tg pourrait être causée par l'induction d'un mécanisme apoptotique chez les cellules B B7.2 Tg, celui-ci étant directement engendré par l'interaction avec les lymphocytes T.
Plusieurs mécanismes peuvent être utilisés par les cellules T afin d'induire l'apoptose chez d'autres lymphocytes. Le principal mécanisme utilisé par les cellules T CD8 + cytotoxiques qui conduit à la mort par apoptose de leurs
cellules cibles est le relâchement de granules lytiques contenant les protéines perforine et granzymes (Shresta et al., 1998). Un autre mécanisme bien connu
menant à l'apoptose des lymphocytes activés implique l'interaction entre FasL, récepteur exprimé par les lymphocytes T, et la molécule Fas exprimée par la cellule cible (Krammer, 2000). Finalement, la production de cytokines par les cellules T, telles que l'INF-y, le TNF-a et le TNF-p, peuvent engendrer l' apoptose d'autres lymphocytes par leur liaison au récepteur d'INF-y (Garvy et Riley, 1994) ainsi qu'aux récepteurs du TNF-a, soit TNFR-l et TNFR-2 (Sedger et al., 2002).
Il a été observé précédemment chez les souris B7.2 Tg lprllpr (souris ayant
une mutation dans le gène codant pour la molécule Fas qui empêche celle-ci de générer un signal intracellulaire) que le nombre de lymphocytes B est égal
au nombre de cellules B chez les souris B7.2 Tg, ce qui a permis de conclure que la déplétion des cellules B B7.2 Tg est indépendante de la voie apoptotique Fas/FasL (Fournier et al., 1997). En se basant sur le fait que le
TNF-a est une cytokine induite chez les lymphocytes T suite à l'interaction B7/CD28 (Thompson et al., 1989) et que le TNFR-l peut être exprimé par les
cellules B de la moelle osseuse (Sedger et al., 2002), nous avons croisé des
souris déficientes pour le TNFR-l avec les souris B7.2 Tg de la lignée 27 afin de vérifier si l'interaction TNF /TNFR -1 est impliquée dans la déplétion des lymphocytes B chez les souris B7.2 Tg.
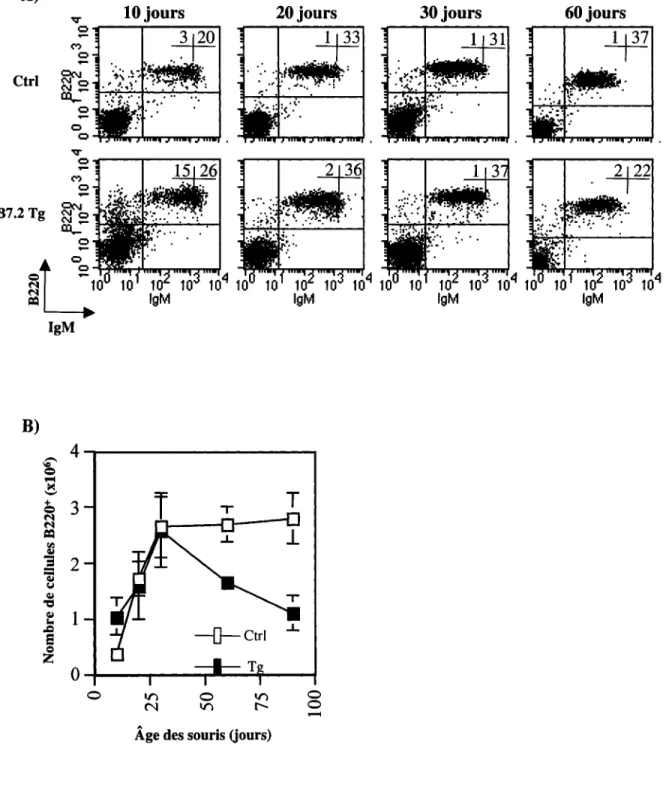
Les cellules provenant de la moelle osseuse, de la rate et des ganglions lymphatiques périphériques ont été marquées avec un anticorps anti-B220, B220 étant une molécule exprimée par les lymphocytes B à chaque stade de leur développement dans la moelle osseuse ainsi que lors de leur maturation en périphérie. On observe que le nombre absolu des lymphocytes B dans la moelle osseuse, la rate et les ganglions lymphatiques des souris TNFR-l -/-B7.2 Tg est grandement diminué comparativement aux souris de type sauvage et aux souris TNFR-l -/- (figure 1). De plus, le nombre absolu des cellules B dans les organes lymphoïdes des souris TNFR-l -/- B7.2 Tg est comparable au nombre absolu des lymphocytes B dans les tissus lymphoïdes des souris B7.2 Tg (figure 1).
Ces résultats démontrent que le mécanisme apoptotique conduisant à la déplétion des cellules B B7.2 Tg n'implique pas la voie TNF/TNFR-l.
Figure 1- Population des lymphocytes B chez les souris B7.2 transgéniques déficientes pour la molécule TNFR-l. Les cellules de la moelle osseuse (provenant d'un fémur et d'un tibia) (A), de la rate (B) et des ganglions lymphatiques périphériques (C) ont été marquées avec un anticorps anti-B220 et analysées en cytométrie de flux. La fréquence des cellules B220+ (panneaux de gauche) est indiquée sur les profils B220 versus FSC pour les souris Ctrl, TNFR-I -/-, B7.2 Tg de la lignée 27 et TNFR-I -/- B7.2 Tg de la lignée 27. Le nombre absolu de cellules B (panneaux de droite) est représenté pour chaque type de souris. Le nombre de souris analysées dans le cadre de ces expériences est: Ctrl n=2, TNFR-I -/- n=l, B7.2 Tg n=2 et TNFR-I -/- B7.2 Tg n=3. Les souris étaient âgées de huit semaines.
Figure 1 A) Moelle osseuse Ctrl TNFR·l·l· FSC-Height FSC-Height B) Rate "'0 _ _ ....:C:.:l:.:rl _ _ ~ TNFR·l·l·
c:!
541
,~~~~
~ 0 P::;1."co..:-
.-i.:, ... : ... :, •.•. ·.·.·Y j ... < •.... ~ . ,o W;'~".
O
~ :··f~:':·' hiIJ. •. '. o -I".,. ... ~~'--'r::::
i", '. 1000 0 1000 ... o 87.2 Tg TNFR·l ·1· 8T.2 Tg o---~ 1000 FSC-Height C) Ganglions lymphatiques "'0 -r-_....;C;..;l;..;rl_---. M o ~ NO œ.,..:-TNFR·l·l·39
~
~ 20 ~ 0•
-
K ' - ' 0 15 N•
+
N al '" <1) 10 ] '0 u <1) "c::I 1::!-S
0..
+
Z Ctrl TNFR-I 87.2 TNFR-I -1--1- Tg 87.2 Tg 75 ... ---~€
- 60 ~ ~ ~ 45 '" <1) ] - 30 8•
•
+
~
15 : . ~ O~_r--._-~--~~ T Ctrl TNFR-I 87.2 TNFR-I -1--1- Tg 87.2 Tg 3.5 - r - - - Io
N 2.5 N al '" <1) ]"8
1.5 .$5~
o 0.5 Z•
..
•
•
•
•
1
Ctrl TNFR-I 87.2 TNFR-I -1--1- Tg 87.2 Tg3.2 Population des lymphocytes B chez les souris B7.2 transgéniques déficientes en CMH de classe 1 ou en CMH de classe II.
Il a été démontré précédemment que la déplétion des lymphocytes B B7.2 Tg est dépendante de l'interaction avec les cellules T (Fournier et al., 1997).
Afin de déterminer la sous-population de lymphocytes T, CD4+ et/ou CDS+, qui est impliquée dans la déplétion des cellules B B7.2 Tg, nous avons croisé les souris B7.2 Tg de la lignée 7 et 27 avec des souris p2-m -/- (souris déficientes pour les protéines du CMH de classe I) ou I-Ap -/- (souris déficientes pour les protéines du CMH de classe II).
Lors de la sélection positive dans le thymus, les thymocytes double-positifs (CD4+ CDS+) se différencient en thymocytes simple-double-positifs et perdent soit le co-récepteur CD4 si leurs TcRs sont sélectionnés par des molécules du CMH de classe l, soit le co-récepteur CDS si leurs TcRs sont sélectionnés par des molécules du CMH de classe II. Ces thymocytes deviennent alors des lymphocytes T CDS+ et T CD4+ respectivement. Les souris p2-m -/- sont déficientes pour la molécule p2-microglobuline, protéine liée de façon non-covalente à la chaîne a du CMH de classe 1. Les cellules de ces animaux n'expriment pas de molécules du CMH de classe 1 à leur surface puisque la chaîne p des protéines du CMH 1 doit s'associer à la molécule p2-microglobuline pour être exprimée à la surface cellulaire. Les souris p2-m -/- ne possèdent donc pratiquement pas de cellules T CDS+, puisque ces lymphocytes ne peuvent être sélectionnés positivement par l'interaction de leurs TcRs avec les molécules du CMH de classe 1 lors de leur développement dans le thymus. Chez les souris I-Ap -/-, la chaîne p des molécules du CMH de classe II de type H2-A n'est pas exprimée. Les molécules du CMH de classe II de type H2-E n'existant pas chez la lignée de souris C57BL/6, l'expression de la molécule du CMH de classe II est presque totalement éliminée chez ces animaux. Ces souris ne possèdent donc que très peu de lymphocytes T CD4+, ces cellules ne pouvant subir la sélection
positive thymique par la restriction de leurs TcRs aux molécules du CMH II. Les croisements avec ces souris mutantes nous ont permis de générer des souris B7.2 Tg qui ne contiennent pratiquement qu'une seule des deux sous-populations de lymphocytes T, soit les lymphocytes T CD4+ dans le cas des souris p2-m B7.2 Tg et les lymphocytes T CD8+ chez les souris I-Ap -/-B7.2 Tg.
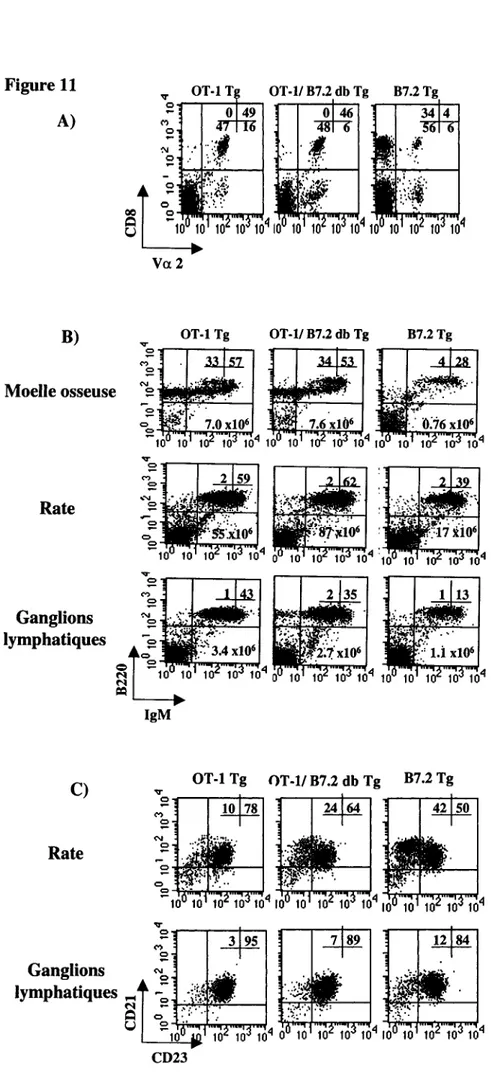
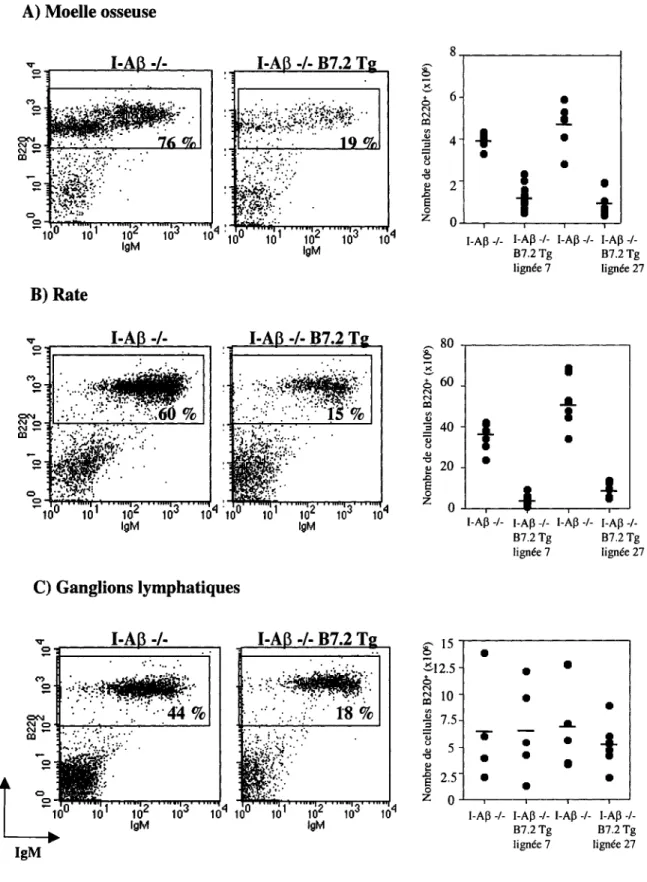
Les cellules provenant de la moelle osseuse, de la rate et des ganglions lymphatiques périphériques ont été marquées avec des anticorps anti-B220 et anti-IgM. En premier lieu, on observe que le nombre absolu des lymphocytes B provenant de la moelle osseuse des souris I-Ap -/- B7.2 Tg est de quatre fois inférieur au nombre absolu des cellules B compris dans la moelle osseuse des souris I-Ap -/- (figure 2A). Le nombre absolu des cellules B au niveau splénique est de sept à dix fois plus bas chez les souris I-Ab -/- B7.2 Tg que chez les souris I-Ab -/- (figure 2B). Par contre, de façon surprenante, le nombre absolu des lymphocytes B compris dans les ganglions lymphatiques des souris I-Ap -/- B7.2 Tg est égal ou supérieur au nombre absolu des cellules B dans les ganglions lymphatiques des souris I-Ab -/- (figure 2C).
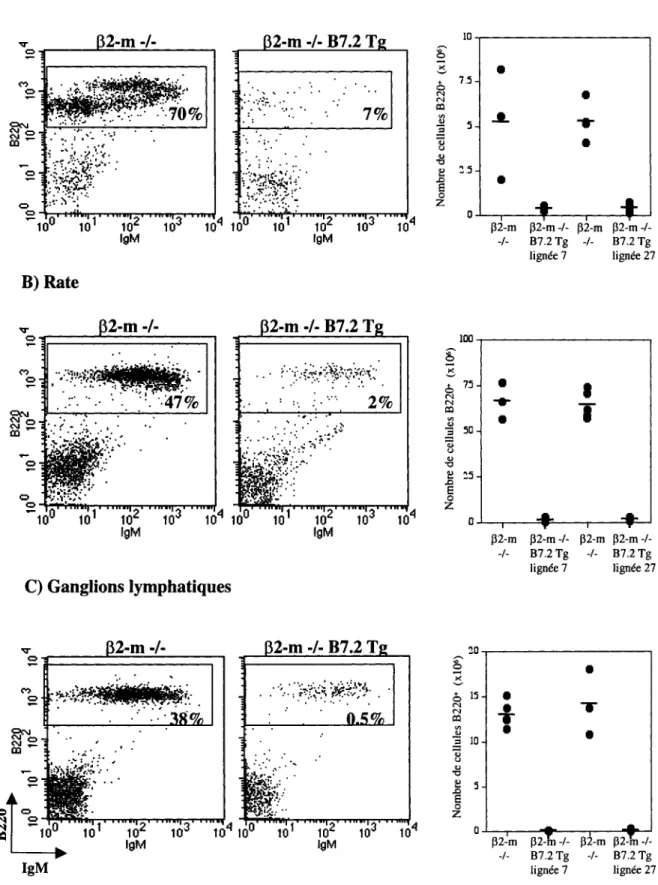
La déplétion des lymphocytes B en présence de cellules T CD4+ semble beaucoup plus drastique qu'en présence de cellules T CD8+. En effet, le nombre absolu de lymphocytes B compris dans la moelle osseuse des souris p2-m -/- B7.2 Tg est d'environ dix fois plus bas que le nombre absolu des lymphocytes B des souris p2-m -/- provenant de ce même tissu (figure 3A). Cette déplétion marquée des cellules B B7.2 Tg est aussi observée en périphérie, où le nombre absolu des lymphocytes B provenant de la rate et des ganglions lymphatiques des souris p2-m -/- B7.2 Tg est de vingt à quatre-vingt fois inférieur au nombre absolu des cellules B comprises dans ces organes lymphoïdes chez les souris p2-m -/- (figures 3B et 3C).
Ces résultats démontrent qu'une déplétion des cellules B B7.2 Tg a lieu lorsque celles-ci interagissent soit avec des lymphocytes T CD4+ ou avec des cellules T CD8+. De plus, la diminution de la population de lymphocytes B B7.2 Tg semble beaucoup plus drastique chez les souris p2-m -/- B7.2 Tg que chez les souris I-Ap -/- B7.2 Tg.
Figure 2- Population des lymphocytes B chez les souris B7.2
transgéniques déficientes en CMU de classe II. Les cellules de la moelle
osseuse (provenant d'un fémur et d'un tibia) (A), de la rate (B) et des ganglions lymphatiques périphériques (C) ont été marquées avec des anticorps anti-B220 et anti-IgM et analysées en cytométrie de flux. La fréquence des cellules B220+ chez les souris I-Ab -/- (panneaux de gauche) et I-Ab -/- B7.2 Tg de la lignée 27 (panneaux médians) est indiquée sur les profils B220 versus IgM. Les nombres absolus (panneaux de droite) des cellules B220+ sont illustrés pour les souris I-Ab -/-, I-Ab -/- B7.2 Tg de la lignée 7 et I-Ab -/- B7.2 Tg de la lignée 27. La moyenne (-) des nombres absolus est indiquée. Le nombre de souris utilisées est: I-Ab -/- B7.2 Tg de la lignée 7 n=ll et I-Ab -/- n=7; I-Ab -/- B7.2 Tg de la lignée 27 n=lO et I-Ab -/- n=9. Les souris utilisées dans le cadre de ces expériences étaient âgées de cinq à neuf semaines.
Figure 2 A) Moelle osseuse H) Rate C) Ganglions lymphatiques
V01===============~
" ,.
. . ',. " . .. •••.•. :·i'i;i:I. <'>0':':"~~:'T~~~::"
, ' . 1 -: . . . . ,e • •• " • • ON . :' :,"44 % ~ ~ 011.---.-::...-...,.:....-:....--'---' co IgM IgM 8 §;' ~ 6 b N N i%l '" ., 4 :3 '8 ~ ~ 2 ,Q El 0 z 0 ~ 80 ~ ><6'
60 N N i%l '" ., :3 40 Q) u ., "0 20 ] El 0 z 0 §;' 15 ~I2.5 ~ ~ ID '":ê
7.5 Q) u ~ 5•
•
I-A~-1-t
•
I-A~-1-•
T•
•
.1
•
•
1
•
t
t
I-A~ -1- I-A~ -1- I-A~
-1-87.2 Tg lignée 7
•
.a...
•
•
-1-I-A~ -1- I-A~ -1-87.2 Tg lignée 7•
•
•
•
•
..a.•
87.2 Tg lignée 27 -1-I-A~ -1-87.2 Tg lignée 27•
t
~
2.5 • • ~ o..l..-~----,r---_r_---r----'•
•
I-A~ -1- I-A~ -1- I-A~ -1- I-A~
-1-87.2 Tg 87.2 Tg
Figure 3- Population des lymphocytes B chez les souris B7.2 transgéniques déficientes en CMH de classe I. Les cellules de la moelle osseuse (provenant d'un fémur et d'un tibia) (A), de la rate (B) et des ganglions lymphatiques périphériques (C) ont été marquées avec des anticorps anti-B220 et anti-IgM et analysées en cytométrie de flux. La fréquence des cellules B chez les souris p2-m -/- (panneaux de gauche) et p2-m -/- B7.2 Tg de la lignée 27 (panneaux médians) est indiquée sur les profils B220 versus IgM. Les nombres absolus des cellules B220+ (panneaux de droite) sont illustrés pour les souris p2-m -/-, p2-m -/- B7.2 Tg de la lignée 7 et p2-m -/- B7.2 Tg de la lignée 27. La moyenne (-) des nombres absolus est indiquée. Le nombre de souris utilisées est: p2-m -/- B7.2 Tg de la lignée 7 n=8 et p2-m -/- n=5; p2-m -/- B7.2 Tg de la lignée 27 n=8 et p2-m -/- n=5. Les souris utilisées dans le cadre de ces expériences étaient âgées de cinq à neuf semaines.
Figure 3 A) Moelle osseuse v o_-_...r:::~::.:.:...:..._---. B2-m -1-B) Rate


![Figure 7 A) Ctrl B7.2 Tg 2joun ~~~~~.J ~. ~!M] v_ ;.' . !'! ' ............ '. ~IC·' ..](https://thumb-eu.123doks.com/thumbv2/123doknet/7721485.248433/56.915.152.811.116.1076/figure-ctrl-b-tg-joun-v-ic.webp)