© Benoit Chénard, 2020
Contribution à l'étude de méthodes de mitigation de la
corrosion de l'acier d'armature dans les ouvrages en
béton armé
Mémoire
Benoit Chénard
Maîtrise en génie civil - avec mémoire
Maître ès sciences (M. Sc.)
Contribution à l’étude de méthodes de mitigation
de la corrosion de l’acier d’armature dans les
ouvrages en béton armé
Mémoire
Benoît Chénard
Sous la direction de :
Benoît Bissonnette, directeur de recherche
Marc Jolin, codirecteur de recherche
ii
Résumé
Plusieurs pays nordiques qui utilisent des sels de déglaçage et les régions côtières bordées par les eaux salines sont confrontés à d’importants problèmes de corrosion affectant leurs infrastructures en béton armé. Afin de prolonger la durée de vie de ces ouvrages, les produits de mitigation de la corrosion présentent un réel intérêt.
Dans le cadre de ce projet de recherche, deux traitements directs de mitigation de la corrosion ont été étudiés, soit les inhibiteurs de corrosion migrateurs et la protection cathodique par anode sacrificielle noyée, ainsi qu’un traitement à incidence indirecte sur la corrosion, soit le chemisage par tissu de fibres de carbone. L’objectif de cette recherche était de déterminer l’influence de ces approches sur la cinétique de corrosion mesurée dans des corps d’épreuve en béton armé préalablement corrodés. Pour ce faire, des mesures du suivi de l’activité électrochimique ont été réalisées sur les corps d’épreuve en béton armé, ayant fait l’objet d’un conditionnement préalable pour favoriser l’initiation de la corrosion, et comparées aux résultats de simulations numériques.
Ni les mesures électrochimiques, ni les résultats générés dans les simulations n’ont révélé de réduction significative de l’activité de corrosion dans les corps d’épreuve. Pour les inhibiteurs de corrosion migrateurs testés, il est présumé que les produits n’ont pas été en mesure de pénétrer jusqu’à l’armature. Il semble toutefois que son efficacité repose sur une fonction secondaire qui est l’imperméabilisation du béton. En ce qui concerne les anodes sacrificielles, la résistivité électrique du béton empêche la formation efficace d’une pile galvanique entre celles-ci et la barre d’armature corrodée. Le modèle numérique a permis d’évaluer une diminution maximale du 63 % du courant de corrosion lorsqu’une anode sacrificielle est directement apposée contre la surface de corrosion active. Le chemisage avec tissu de fibres de carbone s’est quant à lui montré inefficace dans une perspective de mitigation de la corrosion à court terme. En effet, le taux de consommation de l’oxygène par l’activité électrochimique dans la dalle ne permet pas de diminuer significativement les courants de corrosion.
iii
Abstract
It is well known that corrosion of steel rebar is the most important degradation mechanism in reinforced concrete structures. Coastal regions bordered with saline water and northern countries using de-icing salts are faced with tremendous corrosion problems of their reinforced concrete structures. To enhance the lifespan of corroded concrete structures, corrosion mitigation products become more essential.
In this research project, two direct mitigation treatments were studied, migrating corrosion inhibitors and cathodic protection with sacrificial anodes, as well as a secondary perspective treatment that is carbon fibre-reinforced polymers wrapping. The objective was to study the influence of mitigation products on corrosion rate in pre-corroded reinforced concrete specimens. The program is conducted throughout experimental phase that requires electrochemical monitoring on concrete specimens, preliminary corroded in a controlled environment, and a modeling phase for validation.
In spite of the widespread use of these treatments, the experimental and numerical based results have shown no significant reduction of corrosion rates in the various specimens. For the tested migrating corrosion inhibitors, it is suggested that the products have not been able to reach the reinforcement. Nevertheless, their efficiency seems to be promoted by a secondary function that is the concrete waterproofing. Concerning the sacrificial anodes, the electrical resistivity of concrete hinders the formation of an efficient galvanic cell between the zinc pellet and the corroded rebar. The numerical model evaluated a maximum decrease of 63 % of the corrosion current in case the zinc pellet is place directly under the corrosion zone. Finally, wrapped polymer has not exhibited any significant short-term corrosion-mitigation effect in concrete. In fact, the rate of oxygen consumption associated with the electrochemical activity inside the test slabs is not enough to cause a significant decrease in the currents of corrosion.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Liste des tableaux ... vii
Liste des figures ... viii
Remerciement ... xii
Introduction ... 1
Mise en contexte ... 1
Organisation du document ... 2
Chapitre 1 - Revue de la documentation scientifique ... 3
1.1 Généralités du béton de ciment ... 3
1.1.1 Composition du béton ... 3
1.1.2 Composition chimique du ciment Portland ... 4
1.1.3 Hydratation du ciment Portland ... 4
1.1.4 Microstructure de la pâte de ciment hydraté ... 5
1.2 Transport dans le béton ... 7
1.2.1 Mécanismes de transport... 7
1.2.2 Paramètres contrôlant le transport dans le béton ... 9
1.2.3 Modélisation numérique du transport de l’eau ... 11
1.3 Corrosion de l’acier dans le béton ... 13
1.3.1 Généralités de la réaction électrochimique dans le béton armé ... 14
1.3.2 Notions du potentiel électrochimique ... 15
1.3.3 Passivation des barres d’armature ... 16
1.3.4 Dépassivation des barres d’armature ... 18
1.3.5 Polarisation d’une macropile... 19
1.3.6 Facteurs contrôlant la corrosion ... 23
1.4 Mesures de corrosion par techniques électrochimiques ... 28
1.4.1 Potentiel de corrosion ... 29
1.4.2 Résistance à la polarisation linéaire... 30
1.5 Traitements de mitigation de la corrosion de l’acier d’armature ... 32
1.5.1 Inhibiteurs de corrosion migrateurs ... 32
1.5.2 Protection cathodique par anode sacrificielle ... 36
1.5.3 Chemisage au moyen de tissus de fibres de carbone ... 40
Chapitre 2 – Programme de recherche ... 43
v
2.2 Objectifs de recherche ... 43
Chapitre 3 - Méthodologie ... 45
3.1 Vue d’ensemble du programme de recherche ... 45
3.2 Fabrication des dalles d’essai en béton armé ... 46
3.2.1 Configuration des dalles d’essai en béton armé ... 46
3.2.2 Caractéristiques des matériaux utilisés ... 47
3.2.3 Caractéristiques du mélange ... 49
3.2.4 Construction des coffrages des dalles d’essai ... 51
3.2.4 Fabrication des corps d’épreuve et des cylindres de béton ... 51
3.2.5 Essais de caractérisation sur béton durci ... 54
3.3 Corrosion et traitement des dalles d’essai ... 60
3.3.1 Initiation accélérée de la corrosion ... 61
3.3.2 Cycles de mouillage-séchage ... 64
3.4 Application des traitements de mitigation de la corrosion ... 66
3.4.1 Traitement au moyen d’inhibiteurs de corrosion migrateurs ... 66
3.4.3 Traitement par protection cathodique passif au moyen d’anodes sacrificielles noyées ... 67
3.4.1 Traitement au moyen de chemisage par tissu de fibres de carbone ... 69
3.5 Suivi de l’activité électrochimique ... 70
3.5.1 Potentiel de corrosion ... 71
3.5.2 Résistance à la polarisation linéaire... 72
3.6 Simulations numériques ... 74
3.6.1 Paramètres du modèle ... 74
3.6.2 Validation des données d’entrées ... 76
3.6.3 Modélisation de la corrosion ... 76
3.6.4 Résistance à la polarisation linéaire... 80
3.7 Autopsie des dalles d’essai ... 81
Chapitre 4 – Résultats et Analyse ... 82
4.1 Caractérisation du béton ... 82
4.1.1 Essais de caractérisation usuels ... 82
4.1.2 Propriétés de transport et de résistivité du béton ... 83
4.2 Résultats des mesures du suivi de l’activité électrochimique ... 85
4.2.1 Conditions ambiantes dans la chambre d’essai ... 85
4.2.2 Temps d’initiation de la corrosion ... 85
4.2.3 Phases de conditionnement avant et après les traitements ... 87
4.3 Autopsie des dalles d’essai ... 92
4.4 Simulations numériques ... 93
vi
4.4.2 Évolution de l’état hydrique ... 95
4.4.3 Évaluation de la densité de courant limitant ... 101
4.4.4 Distribution des courants de corrosion dans les dalles d’essai ... 103
4.4.5 Résistance à la polarisation linéaire et évolution de la surface anodique .... 106
4.4.5 Temps de consommation du dioxygène dans les dalles de FRP ... 116
4.4.6 Intensité du courant anodique ... 118
4.4.7 Comparaison des potentiels de corrosion expérimentaux et numériques .... 121
Conclusion ... 127
Inhibiteur de corrosion migrateur ... 127
Anode sacrificielle noyée ... 128
Chemisage par tissu de fibres de carbone ... 128
Perspectives de recherche ... 129
Bibliographie ... 131
ANNEXE A - Analyse granulométrique du sable et de la pierre ... 138
ANNEXE B - Analyse chimique du ciment Portland ... 141
ANNEXE C – Temps d’initiation de la corrosion ... 143
vii
Liste des tableaux
Tableau 1.1 : Principaux composés du ciment Portland ... 4
Tableau 1.2 : Classification des pores ... 6
Tableau 1.3 : Interprétation des mesures du potentiel de corrosion selon l’ASTM C876 ... 30
Tableau 1.4 : Taux de corrosion typiques de l’acier dans le béton en fonction de la résistance à la polarisation linéaire ... 31
Tableau 3.1 : Composition chimique et minéralogique du ciment Portland GU ... 47
Tableau 3.2 : Composition des mélanges des volets 1 et 2 ... 50
Tableau 3.3 : Fabrication des corps d’épreuve et des cylindres de béton pour les volets 1 et 2 ... 52
Tableau 3.5 : Résumé des paramètres d’entrée des corps d’épreuve... 74
Tableau 3.6 : Propriétés électrochimiques des aciers d’armature et des anodes sacrificielles ... 75
Tableau 4.1 : Caractéristiques du béton à l’état frais ... 82
Tableau 4.2 : Résistance en compression ... 83
Tableau 4.3 : Propriétés de transport et de résistivité du béton ... 83
Tableau 4.4 : Température et humidité relative dans la chambre d’essai pour les différentes phases de l’expérimentation des volets 1 et 2 ... 85
Tableau 4.5 : Synthèse des surfaces anodiques estimées par la comparaison des mesures de résistance à la polarisation linéaire expérimentale et théorique ... 115 Tableau 4.6 : Temps de consommation théorique du dioxygène dans les dalles FRP . 116
viii
Liste des figures
Figure 1.1 : Mécanismes affectant la pénétration des ions chlorure dans le béton ... 8
Figure 1.2 : Degré d’hydratation nécessaire à l’interruption de la continuité capillaire ... 10
Figure 1.3 : Coefficient de diffusion apparents des ions chlorure dans des bétons de ciment Portland ... 11
Figure 1.3 : Corrosion de l’acier d’armature ... 14
Figure 1.5 : Initiation et propagation de la corrosion... 15
Figure 1.6 : Diagramme de Pourbaix du système Fe-H2O à 25 °C ... 17
Figure 1.7 : Corrosion par piqûre de l’acier d’armature ... 19
Figure 1.8 : Illustration de la polarisation entre une zone active et passive d’une macropile à l’état 1D... 20
Figure 1.9 : Densité de probabilité de la concentration critique en ions chlorure ... 24
Figure 1.10 : Prédiction du profil de Cl- après une exposition de 50 ans pour trois concentrations de C3A a) Cl- totaux et b) Cl- libres ... 25
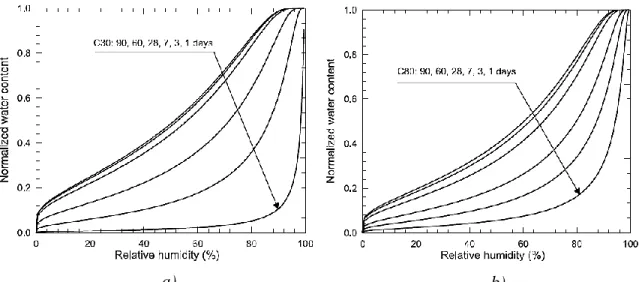
Figure 1.11 : Prédiction de la densité de courant de corrosion selon l’humidité relative pour un béton E/C = 0,5 ... 26
Figure 1.12 : Relation entre le degré de saturation et l’humidité relative selon l’avancement de l’hydratation du ciment a) béton E/C = 0,62 et b) E/C = 0,30 ... 27
Figure 1.13 : Influence du rapport anode/cathode sur la densité du courant de corrosion ... 28
Figure 1.14 : Champ électrique dans une macropile... 29
Figure 1.15 : Groupements fonctionnels de (a) l‘aminoalcool et (b) l’acide carboxylique ... 33
Figure 1.16 : Diagramme de polarisation illustrant le principe de la protection cathodique ... 37
Figure 1.17 : Anode sacrificielle de zinc typique ... 38
Figure 1.18 : Installation d’un anode sacrificielle noyée ... 38
Figure 1.19 : Influence de la disponibilité en oxygène sur l’intensité de corrosion ... 41
Figure 3.1 : Dimensions de la dalle ... 46
Figure 3.2 : Câblage électrique entre les barres d’armature ... 48
Figure 3.3 : Configuration des coffrages en bois ... 51
Figure 3.4 : Plan de coupe des éprouvettes pour les propriétés de transport et de résistivité ... 54
Figure 3.5 : Montage de l’essai de migration ... 55
ix
Figure 3.7 : Montage pour l’essai de résistivité sur cylindre de béton ... 58 Figure 3.8 : Courbe du potentiel en fonction du courant obtenu de l’essai de
résistivité sur cylindre de béton ... 59 Figure 3.9 : Mesure de l’humidité relative interne des dalles au moyen d’une sonde de type résistif ... 60 Figure 3.10 : Séquence de préparation, conditionnement et traitement des dalles
expérimentales ... 61 Figure 3.11 : Assemblage des bassins pour mettre en œuvre la procédure de
migration accélérée des ions chlorure - a) vue en perspective et
b) vue de latérale... 62 Figure 3.12 : Montage expérimentale pour la mise en œuvre de la procédure de
migration accélérée des ions chlorure - a) connexion des électrodes de graphite, b) connexion au bornier et c) vue globale des 16 dalles d’un même volet ... 63 Figure 3.13 : Dispositif utilisé pour la mise en œuvre des cycles de mouillage-
séchage sur les dalles d’essai - a) éléments exposés lors des cycles de séchage et b) éléments recouverts lors des cycles de mouillage ... 65 Figure 3.14 : Application de l’inhibiteur de corrosion migrateur à base
d’aminoalcool (inhibiteur 1) sur une dalle d’essai ... 67 Figure 3.15 : Installation des anodes sacrificielles dans un coffrage ... 68 Figure 3.16 : Positionnement des anodes sacrificielles dans les coffrages ... 68 Figure 3.17 : Renforcement par tissu de fibres de carbone appliqué sur la dalle d’essai 70 Figure 3.18 : Périodicité du suivi de l’activité électrochimique des dalles d’essai ... 71 Figure 3.19 : Connexion pour la mesure du potentiel de corrosion ... 72 Figure 3.20 : Connexion pour la mesure de la résistance à la polarisation linéaire ... 73 Figure 4.1 : Distribution du temps d’initiation de la corrosion dans les dalles d’essai selon la mesure du suivi de l’activité électrochimique : a) volet 1 et
b) volet 2 ... 86 Figure 4.2 : Suivi de l’activité électrochimique des dalles d’essai du volet 1 durant les périodes de conditionnement pré- et post-traitement ... 88 Figure 4.3 : Suivi de l’activité électrochimique des dalles d’essai du volet 2 durant les cycles de mouillage-séchage ... 91 Figure 4.4 : Surface anodique des dalles de référence du volet 1 et 2 après autopsie .... 93 Figure 4.5 : Évolution théorique de la masse d’eau évaporée en fonction du temps pour le séchage ... 94 Figure 4.6 : Évolution théorique de l’humidité relative des dalles de référence du volet 1... 98 Figure 4.7 : Évolution théorique de l’humidité relative de la dalle d’essai en fonction du temps pour les phases de conditionnement II et III ... 99 Figure 4.8 : Degré de saturation évalué en fonction de la profondeur au cours d’un cycle de mouillage-séchage à stabilité hydrique ... 100
x
Figure 4.9 : Concentration théorique en dioxygène dans la dalle lors du 45e cycle
de mouillage-séchage pour les dalles du volet 1 ... 102 Figure 4.10 : Distribution théorique des lignes de courant de corrosion dans la
dalle de référence du volet 1 après 300 jours en cycle de mouillage
séchage ... 104 Figure 4.11 : Distribution théorique des courants de corrosion dans la dalle traitée par une anode sacrificielle noyée en position 1 après 300 jours en
cycle de mouillage-séchage ... 105 Figure 4.12 : Distribution théorique des courants imposés durant l’essai de
polarisation linéaire... 107 Figure 4.13 : Évaluations expérimentale et théorique de la résistance à la
polarisation linéaire des dalles de référence des volets 1 et 2 durant la phase I d’initiation accélérée de la corrosion ... 109 Figure 4.14 : Évaluations théorique et expérimentale de la résistance à la
polarisation linéaire après 7 jours de cycles mouillage-séchage ... 111 Figure 4.15 : Évaluations théorique et expérimentale de la résistance à la
polarisation linéaire après 50 jours de cycles mouillage-séchage ... 112 Figure 4.16 : Évaluations théorique et expérimentale de la résistance à la
polarisation linéaire en fonction du courant limitant après 300 jours de cycles mouillage-séchage pour les dalles de référence ... 113 Figure 4.17 : Évaluations théorique et expérimentale de la résistance à la
polarisation linéaire après 300 jours de cycles mouillage-séchage ... 114 Figure 4.18 : Bilan des courants d’échange entre l’anode sacrificielle en position 1 (120 mm), la surface de corrosion et les surfaces cathodiques -
Surface de corrosion de 2 cm2 ... 118 Figure 4.19 : Bilan des courants d’échange entre l’anode sacrificielle en position 1 (120 mm), la surface de corrosion et les surfaces cathodiques -
Surface de corrosion de 10 cm2 ... 119
Figure 4.20 : Bilan des courants d’échange entre l’anode sacrificielle à 0 mm, la surface de corrosion et les surfaces cathodiques - Surface de corrosion de 2 cm2 ... 120 Figure 4.21 : Quadrillage de la cartographie du potentiel de corrosion ... 121 Figure 4.22 : Cartographies expérimentale et théorique du potentiel de corrosion des dalles de référence du volet 1 après 300 jours en cycle de mouillage séchage (à la fin d’une période de mouillage de 4 jours)... 122 Figure 4.23 : Cartographie expérimentale et théorique du potentiel de corrosion des dalles de référence du volet 1 après 300 jours en cycle de mouillage séchage (à la fin d’une période de séchage de 3 jours) ... 123 Figure 4.24 : Cartographie expérimentale et théorique du potentiel de corrosion de la dalle de référence 2 du volet 1 après 300 jours en cycle de
xi
« L’obstination est le chemin de la réussite. »
xii
Remerciements
Je tiens à communiquer ma plus sincère gratitude à mon directeur Benoît Bissonnette et mon codirecteur Marc Jolin pour la confiance démontrée depuis l’initiation jusqu’à la conclusion de ce projet de recherche. Malgré leurs nombreuses occupations, ils ont toujours été disponibles pour répondre à mes interrogations et m’aiguiller lorsque j’en avais besoin. Ce fut un agréable plaisir de vous côtoyer et de m’imprégner de votre rigueur scientifique.
J’adresse également ma reconnaissance envers l’équipe de Simco Technologies Inc. avec qui j’ai collaboré pour la réalisation de ce projet de recherche. Un remerciement particulier revient à Éric Samson et Yannick Protière, qui ont contribué à l’ébauche et au suivi des mes travaux. Leurs connaissances en matière de corrosion et de modélisation numérique furent très enrichissantes et nécessaires pour l’aboutissement d’un projet aussi élaboré.
Un merci également spécial au professeur Stéphane Laurens de l’Institut national des sciences appliquées (INSA) de Toulouse qui s’est montré très généreux dans son rôle d’évaluateur. Il a certainement contribué à enrichir ce travail de recherche.
Mes pensées vont aussi à Mathieu Thomassin Mailhot qui a toujours démontré un grand professionnalisme dans l’élaboration de mon programme expérimental. Ses conseils furent grandement appréciés. Je tiens aussi à remercier tout le personnel du CRIB, dont notamment Martin Lapointe, Alain Melançon et Pierre-André Tremblay qui m’ont aidé dans la fabrication des corps d’épreuve et la mise au point des essais expérimentaux.
Je ne pourrais également oublier mes amis et partenaires Émile Blouin-Dallaire, Sammy Joseph-Essalik et Vincent Carrier qui m’ont si souvent rendu visite dans ma « batcave » et sur qui j’ai pu compter lorsque j’en ai eu besoin. Je conserve d’excellents souvenirs passés à vos côtés. Un dernier remerciement tout particulier s’adresse à ma copine Pascale. Sa patience et ses encouragements furent si importants dans la réalisation de ce projet de recherche. J’en suis infiniment reconnaissant et choyé.
1
Introduction
Mise en contexte
L’usage du béton de ciment pour l’industrie de la construction constitue une option incontournable en raison de sa disponibilité, de son faible coût et des multiples configurations qu’il permet de créer (Faustino et coll., 2016). Cette forte dépendance aux matériaux cimentaires est toutefois responsable d’environ 5 % de tout le CO2 rejeté dans
l'atmosphère (Le Quéré et coll., 2016). Dans une perspective de développement durable, l’utilisation adéquate du béton ainsi que le développement de techniques permettant de prolonger la durée de vie des infrastructures revêtent une importance capitale.
Un des facteurs premiers de détérioration des ouvrages en béton armé est la corrosion des barres d’armature en acier. Dans le béton sain, non fissuré et non contaminé, le pH élevé de la solution interstitielle protège naturellement l’acier en favorisant la formation d’une couche protectrice stable à la surface des barres, appelée couche de passivation. Toutefois, lorsque le béton est exposé aux chlorures et/ou à un environnement moins basique, cette couche de passivation se dégrade et perd ses fonctions protectrices. C’est alors que les réactions électrochimiques peuvent être initiées et accélérées (Bertolini et coll., 2004). Les produits de corrosion engendrés exercent à ce moment une pression sur le béton d’enrobage, ce qui conduit éventuellement à sa fissuration, à une pénétration accélérée des chlorures et ultimement à une perte d’adhérence des barres d’armature (Nguyen et coll., 2007). Dans un pays nordique comme le Canada, une part importante des ouvrages en béton se trouve à risque en raison de l’utilisation intensive et répandue des sels déglaçants pour l’entretien du système routier en période hivernale. Que ce soit des ponts routiers, des routes de béton armé ou autres constructions routières, la corrosion induite par les ions de chlore peut rapidement diminuer la durée de vie des infrastructures et générer des dépenses importantes à des fins de réhabilitation ou de reconstruction.
Dans une démarche de réhabilitation, plusieurs produits de mitigation de la corrosion ont été développés et améliorés au cours des dernières années par les manufacturiers afin
2
d’offrir aux maîtres d’ouvrage des solutions efficaces pour réduire l’activité de corrosion dans les structures. Parmi ces solutions, la protection cathodique par l’installation d’anodes sacrificielles noyées et les inhibiteurs de corrosion migrateurs présentent un grand intérêt. L’impact de ces traitements sur l’initiation et la propagation de la corrosion demeure difficilement quantifiable, car peu de résultats ont été obtenus et publiés dans des conditions bien contrôlées.
Par ailleurs, d’autres interventions d’entretien non spécifiquement destinées à la prévention de la mitigation de la corrosion peuvent influencer indirectement la manifestation du phénomène. C’est le cas notamment du renforcement par chemisage avec tissu de carbone.
Organisation du document
Ce mémoire débute au chapitre 1 par une présentation de l’état des connaissances actuelles de la corrosion induite par les ions chlorure dans le béton armé ainsi que des traitements envisagés dans le cadre de cette étude. Par la suite, les objectifs du programme de recherche ainsi que la méthodologie employée sont présentés respectivement aux chapitres 2 et 3 présentent respectivement les objectifs de la recherche et la méthodologie employée pour atteindre ces objectifs. Les résultats obtenus suite à la réalisation de ces travaux sont décrits dans le chapitre 4. Ces résultats sont ensuite détaillés et comparés avec ceux rapportés dans la revue de la documentation scientifique. Pour finir, les conclusions de la recherche ainsi que les recommandations identifiées à la lumière des résultats obtenus sont présentées au chapitre 5.
3
Chapitre 1 - Revue de la documentation scientifique
Le présent chapitre se veut une revue de l’état des connaissances actuelles en ce qui a trait au processus de corrosion dans le béton armé et aux trois types d’interventions abordés dans le cadre de cette recherche : le chemisage par tissus de fibres de carbone, les inhibiteurs de corrosion migrateurs et la protection cathodique par la mise en place d’anodes sacrificielles. Une attention particulière est accordée aux différentes notions qui soulèvent débats au sein de la communauté scientifique quant à l’utilisation de ces produits. Cette revue débute par des notions générales du béton de ciment qui lui confèrent ses propriétés de diffusion des agents chimiques, notamment les ions chlorure responsables de la corrosion de l’acier d’armature. Les processus électrochimiques sont par la suite abordés depuis le mécanisme d’initiation jusqu’aux principaux facteurs influençant sa cinétique, de même que les principales mesures permettant d’évaluer l’activité de corrosion par techniques électrochimiques. Enfin, l’efficacité des trois types d’intervention à ralentir la corrosion des barres d’armature est décrite en fonction des recherches publiées à ce jour.
1.1 Généralités du béton de ciment
1.1.1 Composition du béton
Le béton durci est un matériau hétérogène constitué d’une fraction granulaire (sable, gravier ou pierre concassée) enrobée d’une pâte de ciment hydraté. La pâte est composée de ciment Portland avec ou sans ajouts cimentaires, d’eau et d’air. Lors de la mise en contact du liant avec l’eau, une réaction d’hydratation est enclenchée entre les différents constituants du liant, ce qui mène à la prise du matériau et à son durcissement à long terme (Kosmatka et coll., 2011).
La corrosion de l’acier d’armature n’est généralement pas fonction du type de granulats, ces derniers étant beaucoup moins perméables que la pâte de ciment. C’est en effet dans la pâte de ciment que les contaminants, comme les ions chlorure et l’oxygène peuvent migrer jusqu’aux armatures pour initier la corrosion (Rosenberg et coll., 1989).
4
1.1.2 Composition chimique du ciment Portland
Le ciment Portland est le type de liant hydraulique le plus couramment utilisé dans l’industrie (Neville, 2000). Sa confection débute par le broyage des matières premières, soit une combinaison de calcaire, de schiste, d’argile, de sable et de minerai de fer, de manière à obtenir des proportions appropriées de chaux, de silice, d’alumine et de fer. La poudre ainsi formée est appelée cru de ciment. Le cru est par la suite acheminé dans un four rotatif chauffé aux environs de 1500 °C. Cette étape résulte en la formation du clinker
de ciment. La phase finale de la production du ciment Portland est le broyage du clinker et
l’ajout de gypse afin de régulariser, entre autres, le temps de prise du ciment (Kosmatka et coll., 2011). Le Tableau 1.1 présente les 5 principaux composés du ciment Portland ainsi que les proportions relatives de chacun (Bertolini et coll., 2004). Il est toutefois nécessaire de préciser que le ciment est fabriqué à partir de produits naturels, il contient donc un pourcentage d’impuretés qui peut varier d’un lieu de fabrication à un autre.
Tableau 1.1 : Principaux composés du ciment Portland (Bertolini et coll., 2004)
Composés Composition Abréviation Proportion
Silicate tricalcique 3CaO·SiO2 C3S 50 - 65 %
Silicate bicalcique 2CaO·SiO2 C2S 15 - 20 %
Aluminate tricalcique 3CaO·Al2O3 C3A 5 - 15 %
Aluminoferrite tétracalcique 4CaO·Al2O3·Fe2O3 C4AF 5 - 10 %
Gypse CaSO4·2H2O CS 3 - 5 %
1.1.3 Hydratation du ciment Portland
Comme mentionné précédemment, la réaction du ciment avec l’eau est une réaction dite d’hydratation. Lors de l’hydratation, une série de réactions transforment les composés présentés au Tableau 1.1 en hydrates insolubles dans l’eau et qui, avec le temps, forment une masse rigide.
5
La réaction d’hydratation du C3S et du C2S mène notamment à la formation d’une famille
de silicates de calcium hydraté, soient des gels de C-S-H, de l’anglais Calcium Silicate
Hydrate. Les deux réactions qui impliquent le C3S et le C2S dégagent une grande quantité
de chaleur et sont responsables de la résistance de la pâte. Plus spécifiquement, les données expérimentales suggèrent que le C3S influence surtout la prise finale et le durcissement à
court terme de la pâte, alors que le C2S serait responsable du gain en résistance à long
terme. Par ailleurs, les deux réactions forment une grande quantité de chaux hydratée, soit la portlandite (Ca(OH)2).Dans la solution interstitielle, la forte concentration en ions OH
-procure un pH élevé aux matériaux cimentaires (Vichot et Ollivier, 2008).
La réaction du C3A avec l’eau formant de l’hydrogrenat, C3AH6, est très violente, mais est
toutefois contrôlée par l’ajout de gypse au clinker. En fait, le gypse réagit avec le C3A et
l’eau pour former de l’ettringite recouvrant les particules de C3A et empêchant leur prise
rapide. Après épuisement du gypse, le C3A réagit avec l’eau et l’ettringite pour former un
complexe aluminates de calcium hydraté et, ultimement, d’hydrogrenat. La quantité de gypse à ajouter au clinker revêt une très grande importance. En effet, une quantité minimale est nécessaire afin de réagir avec tout le C3A disponible au début de la réaction et ainsi
éviter une prise éclair du ciment. Cependant, si un surplus de gypse est présent après la prise initiale, il réagit avec le C3A et forme des sulfoaluminates expansifs. De manière
contrôlée, le C3A influence la pâte de ciment au moment de la prise initiale, mais contribue
peu sa résistance à long terme (Vichot et Ollivier, 2008).
En ce qui concerne le C4AF, les données indiquent que son hydratation dégage peu de
chaleur et que sa dissolution entraîne la précipitation du même groupe de composés que celui du C3A (Vichot et Ollivier, 2008).
1.1.4 Microstructure de la pâte de ciment hydraté
La matrice cimentaire est constituée d’un réseau poreux dont la perméabilité est fonction du diamètre des pores, de leur interconnectivité, ainsi que de leur tortuosité. Ces pores sont généralement divisés en trois catégories : les pores de gel, les pores capillaires et les bulles d’air.
6
Les pores de gel sont principalement les espaces qui se forment entre les feuillets de C-S-H lors de l’hydratation du C3S et du C2S. Ces pores ont un diamètre inférieur à 3 nm,
soit de l’ordre de quelques molécules d’eau, et constituent environ 28 % du volume des C-S-H formés, indépendamment du degré d’hydratation et du rapport eau/ciment. Bien que ces pores communiquent entre eux, la perméabilité des hydrates demeure très faible puisque l’eau est fortement adsorbée à la surface des particules de C-S-H (Vichot et Ollivier, 2008).
Les pores capillaires correspondent à la fraction résiduelle du volume occupé au départ par l’eau de gâchage. En effet, cette eau occupe initialement un réseau de vides interconnectés que les hydrates remplissent au fur et à mesure que l’hydratation progresse. Les pores capillaires sont les espaces résiduels inoccupés par les produits de l’hydratation. La perméabilité de la pâte de ciment, qui est régie par le volume total, le diamètre moyen et la continuité des pores capillaires, dépend donc du degré d’avancement de l’hydratation et du rapport eau/ciment initial (Neville, 2000). Cette perméabilité est d’ailleurs responsable du transport des différents réactifs intervenant dans la corrosion des barres d’armature.
À une autre échelle, des bulles d’air sont piégées naturellement dans le béton lors du malaxage et, suivant les besoins en quantité accrue, grâce à l’ajout d’adjuvant entraîneur d’air. Ces bulles agissent comme soupapes afin de dissiper les pressions dans la phase liquide lors de la cristallisation de l’eau en période de gel. Des vides d’air, non sphériques ceux-là, peuvent aussi résulter d’une mauvaise compaction du béton lors de la mise en place (Neville, 2000). Une classification usuelle des différents vides selon leur taille est présentée au Tableau 1.2.
Tableau 1.2 : Classification des pores (Powers et Brownyard, 1947)
Identification Diamètre moyen typique (µm)
Pores des hydrates 0,001- 0,004 Pores capillaires 0,01 - 1
Air entraîné 60 - 1000
7
1.2 Transport dans le béton
Le transport des ions au sein de la phase liquide du béton, qui occupe une fraction du volume des pores selon le degré de saturation, est induit par les mécanismes d’advection et de diffusion (Samson, 2005 ; Samson et coll., 2003). Ces mécanismes permettent donc à la solution interstitielle de circuler à travers un réseau de pores interconnectés et, possiblement, de contaminer le béton lorsque des agents agressifs comme les chlorures sont présents dans l’eau à laquelle le matériau est exposé.
Divers facteurs peuvent influencer le transport des contaminants dans le béton. Les plus importants abordés dans ce document sont la structure poreuse du matériau, la température et le degré de saturation du matériau.
1.2.1 Mécanismes de transport
Le transport ionique par diffusion dans une solution, connu sous le nom de déplacement
brownien, est le résultat de l’agitation thermique des particules qui provoque leur
déplacement aléatoire. Cette agitation provoque une série de collision qui a pour effet de disperser les particules vers les régions les moins concentrées jusqu’à l’obtention d’un équilibre (Samson, 2005 ; Vichot et Ollivier, 2008).
Comme les ions sont chargés électriquement, leurs déplacements sont aussi affectés par un couplage électrique entre les différentes espèces et par l’activité chimique de la solution. D’abord, la solution interstitielle est une solution ionique dont l’électroneutralité doit être préservée lorsqu’aucun courant n’est induit. Durant le processus de diffusion, certains ions voyagent plus rapidement que d’autres et ont donc tendance à se séparer des autres. Cependant, comme les charges de signe opposé s’attirent mutuellement, les ions les plus rapides sont ralentis et les plus lents sont accélérés, dans un processus conduisant le système à l’état d’électroneutralité. Le résultat est la création d’un champ électrique local appelé potentiel de diffusion (Samson et Marchand, 2007). Les ions qui composent majoritairement la solution interstitielle des bétons non contaminés sont les hydroxydes (OH-), le sodium (Na+), le potassium (K+), les sulfates (SO
8
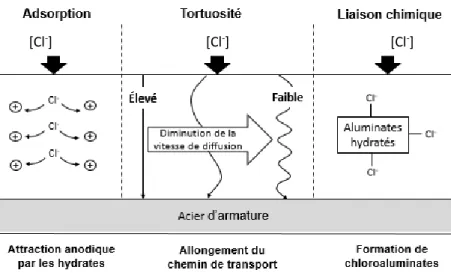
L’activité chimique de la solution dépend pour sa part du point d’équilibre entre la phase liquide (solution ionique) et la phase solide (matrice cimentaire). Lorsque la composition de la solution poreuse est modifiée, une certaine quantité de la phase solide peut se dissoudre ou précipiter en réponse à la tendance naturelle vers l’état d’équilibre. Les ions de la solution poreuse peuvent également réagir avec les autres espèces présentes pour former de nouveaux composés (Samson et coll., 2003). En ce qui concerne plus spécifiquement les ions chlorure, ils peuvent donc demeurer libre dans la solution interstitielle, être adsorbé à la surface interne des hydrates ou se lier chimiquement à des produits d’hydratation. Dans le dernier cas, les chlorures peuvent notamment réagir avec le C3A ou le C4AF pour former notamment du chloroaluminate de calcium, aussi appelé
sel de Friedel (Fig. 1.1).
Simultanément, le transport ionique dans le béton s’opère grâce à l’advection, c’est-à-dire le transport des ions résultant de l’écoulement de l’eau dans le milieu poreux. Dans certains cas où le béton demeure saturé, l’existence d’un gradient de pression hydraulique provoque de déplacement de l’eau à travers l’échantillon. Il s’agit d’une application de la loi de Darcy. Dans le cas des bétons non saturés, le transport du fluide se fait sous l’action de tensions capillaires. Lorsque le matériau est soumis au séchage, la différence de pression entre la phase liquide et gazeuse des pores provoque une succion de la solution interstitielle à travers la masse de béton (Samson et Marchand, 2007).
Figure 1.1 : Mécanismes affectant la pénétration des ions chlorure dans le béton (adapté de Jones et coll., 1993)
9
1.2.2 Paramètres contrôlant le transport ionique dans le béton
La pénétration des ions chlorures dans le béton est un processus multifactoriel qui est influencé par les caractéristiques intrinsèques du matériau et de l’environnement extérieur. Les principaux facteurs sont explicités dans les sections suivantes.
1.2.2.1 Structure poreuse
La perméabilité de la pâte de ciment hydraté, qui gouverne le transport d’un fluide, est principalement affectée par le rapport eau/ciment (E/C), le degré d’hydratation et la zone d’interface pâte-granulat.
Il est important de préciser que la perméabilité de la structure poreuse n’est pas influencée uniquement par sa porosité, cette dernière étant une mesure du volume total des vides. En effet, elle dépend de la dimension, de la distribution, de la forme, de la tortuosité et de la continuité des pores de la pâte de ciment (Neville, 2000). Un béton présentant une porosité connectée et une faible tortuosité est généralement caractérisé par une perméabilité élevée.
Le rapport E/C joue un rôle déterminant dans la perméabilité de la pâte de ciment puisqu’il influence la taille et la quantité des vides initialement occupés par l’eau de gâchage ; plus le rapport E/C initial est grand, plus la perméabilité est grande. Successivement, plus le degré d’hydratation est grand, plus la perméabilité est faible, car les produits d’hydratation remplissent progressivement les pores capillaires.
Une relation entre le rapport E/C et le degré d’hydratation est présentée à la Figure 1.2 et décrit l’évolution de la continuité capillaire dans la pâte de ciment. Cette figure met en évidence l’importance de la cure sur l’interconnectivité du réseau capillaire. Elle permet de constater qu’au-delà d’un certain rapport E/C, les pores capillaires demeurent interconnectés, et ce, peu importe le degré d’hydratation. En effet, les produits d’hydratation n’occupent pas un volume suffisamment grand pour contrebalancer les vides occupés initialement par l’eau (Vichot et Ollivier, 2008).
10
Figure 1.2 : Degré d’hydratation nécessaire à l’interruption de la continuité capillaire (adapté de Neville, 2000)
La zone d’interface pâte-granulat, ou l’ITZ (de l’anglais Interfacial Transition Zone), est généralement plus poreuse que la matrice cimentaire en raison de la densité réduite des grains de ciment et des particules fines contre la paroi des granulats. Cette zone offre donc un chemin préférentiel pour le passage de l’eau, des gaz ou des ions, ce qui est d’autant plus vrai lorsque les ITZ sont interconnectés. Pour un même rapport E/C, la perméabilité est donc plus grande dans les bétons que dans les mortiers puisque l’interconnectivité générale des ITZ est plus importante (Pigeon, 2018).
1.2.2.2 Température
La température est un autre facteur qui gouverne le transport des ions chlorures dans le béton. En effet, plus la température est élevée, plus les ions possèdent de l’énergie pour diffuser dans la solution poreuse ou réagir avec d’autres particules. Plusieurs recherches ont tenté de décrire l’effet de la température sur la diffusivité des ions chlorure. Cette diffusivité est caractérisée par le coefficient de diffusion des ions chlorure exprimé en m²/s. Dhir et coll. (1993) ont réalisé leur expérimentation sur des bétons de ciment Portland. La Figure 1.3 de la page suivante montre les résultats de leur expérimentation selon différents rapports E/C. Cette figure montre clairement que plus la température augmente pour un même rapport E/C, plus le coefficient de diffusion de l’ion Cl- augmente.
11
Figure 1.3 : Coefficient de diffusion apparents des ions chlorure dans des bétons de ciment Portland (Dhir et coll., 1993)
1.2.2.3 Degré de saturation
Le degré de saturation d’un élément en béton est une mesure de la quantité d’eau relative dans ses pores. Comme les ions diffusent par la phase liquide, le degré de saturation affecte directement la diffusion ionique.
Dans un milieu saturé, la pénétration des ions chlorure est le résultat de la diffusion ionique, soit l’action combinée du gradient de concentration, du couplage électrique entre les différents ions et de l’activité chimique de la solution. Toutefois, lorsque le degré de saturation varie, le transport des ions en solution est facilité par le mécanisme de remontée capillaire. Ce deuxième mécanisme se révèle beaucoup plus rapide que le phénomène de diffusion, mais est généralement limité par la faible profondeur de séchage des bétons
(Jones et coll., 1993 ; Nilsson et coll., 1996). C’est donc majoritairement par diffusion que
les ions chlorure atteignent les barres d’armature (Stanish et coll., 1997). Alors plus le degré de saturation diminue, plus le transport des ions chlore diminue également (Madhavi et Annamalai., 2016).
1.2.3 Modélisation numérique du transport ionique
Plusieurs logiciels de modélisation numérique tentent de prédire la pénétration des ions par l’application des notions de transport dans la pâte de ciment. C’est notamment le cas du
12
logiciel STADIUM® qui traite du transport multi-ionique d’au moins huit espèces (OH-, Na+, K+, SO42-, Ca2+, Al(OH)4-, Mg2+ et Cl-) pour les matériaux cimentaires saturés et
insaturés.
Dans un premier temps, STADIUM® prédit le transport des ions grâce à l’application de la conservation de la masse dans un matériau cimentaire. De ce fait, il tient compte de la variation de la concentration des ions en fonction du temps, du flux diffusif et advectif des ions ainsi qu’un terme source/puits (ri) pour les réactions chimiques se produisant dans la phase liquide (Éq. 1.1). Pour résoudre ce système d’équations, les résultats sont calculés de manière itérative grâce au découplage du module de transport des ions à celui de la chimie (Samson, 2018).
𝜕𝑐𝑖
𝜕𝑡 + 𝑑𝑖𝑣(𝑗⃗⃗ ) + 𝑟𝑖 𝑖 = 0
Le terme diffusif repose sur la loi de Nernst-Planck étendue qui tient compte de la diffusion ionique, du couplage électrique et de l’activité chimique, auxquels s’ajoutent les effets de température et les mouvements d’advection. L’équation (1.2) présente le système composant le module transport ionique du modèle pour une teneur en eau w du matériau cimentaire (Samson, 2018) :
où ci [mmol/L] est la concentration des espèces i dans la solution des pores, w [m³/m³] est le degré de saturation, Di [m²/s] est le coefficient de diffusion, Dw [m²/s] est le coefficient de diffusion de l’eau, zi est le nombre de valence des espèces ioniques i,
F [96488,46 C/mol] est la constante de Faraday, R [8,3143 J/mol/K] est la constante des
Diffusion Couplage électrique Activité chimique
Température Advection 𝜕(𝑤𝐶𝑖) 𝜕𝑡 = 𝑑𝑖𝑣 ( 𝐷𝑖𝑤𝑔𝑟𝑎𝑑(𝐶𝑖) +𝐷𝑖𝑧𝑖𝐹 𝑅𝑇 𝑤𝐶𝑖𝑔𝑟𝑎𝑑(𝜓) + 𝐷𝑖𝑤𝐶𝑖𝑔𝑟𝑎𝑑(ln(𝛾𝑖)) + 𝐷𝑖𝐶𝑖ln(𝛾𝑖𝐶𝑖) 𝑇 𝑔𝑟𝑎𝑑(𝑇) + 𝐶𝑖𝑉⃗ 𝑙 ) (1.2) (1.1)
13
gaz parfaits, T [K] est la température du matériau, ψ [V] est le potentiel d’électrodiffusion,
yi est le coefficient d’activité chimique et V [m/s] la vitesse de déplacement du liquide. Pour chaque incrément de calcul, ce modèle est basé sur les hypothèses suivantes :
ـ Température constante ;
ـ Phase solide du ciment non déformable ; ـ Hydratation additionnelle du ciment négligée ;
ـ Produits d’hydratation du ciment uniformément répartis dans le matériau ; ـ Effet négligeable de la gravité sur le transport d’eau ;
ـ Déplacement de la phase gazeuse par diffusion uniquement.
Pour fournir au modèle les paramètres spécifiques du matériau, une série de tests doit être réalisée préalablement en laboratoire afin d’évaluer les grandeurs suivantes :
ـ Coefficient de diffusion des ions dans le béton (DOH) ;
ـ Perméabilité intrinsèque du béton (ks) et degré de saturation à 50 % H. R. (S50) ;
ـ Porosité (ϕ) ;
ـ Résistivité du béton à l’état saturé (ρsat).
1.3 Corrosion de l’acier dans le béton
La forte alcalinité du béton apporte naturellement aux barres d’armature une excellente protection face à la corrosion. En effet, le pH élevé de la solution au sein de la matrice cimentaire mène à la formation d’une fine couche d’oxydes adhérant à la surface des aciers qui est appelée film passif. La diminution du pH causée par la lixiviation des ions OH- ou, encore, la pénétration d’agents agressifs comme les chlorures et le gaz carbonique, sont toutefois responsables de la destruction de ce film passif. À ce moment, la corrosion du métal peut s’initier, ce qui se traduit par la production de nouveaux oxydes occupant un espace de 2 à 6 fois supérieur au fer initial (Chen et coll., 2017). Les pressions internes induites dans le béton d’enrobage conduisent à sa fissuration et à la pénétration accélérée de l’oxygène et des espèces corrosives.
14
O2
1.3.1 Généralités sur les réactions électrochimiques dans le béton armé
Le phénomène de corrosion est un processus naturel qui a pour effet de conduire les métaux à leur état initialement oxydé, étant plus stable sur le plan thermodynamique (Pigeon, 2018). Ce processus repose sur la formation d’une ou plusieurs piles électrochimiques le long d’une barre d’armature lorsqu’il y a bris du film passif. Ces piles sont composées de deux électrodes, soit une anode et une cathode, par lesquelles s’échangent des espèces chimiques et un courant électrique (Fig. 1.4). La réaction de corrosion est possible lorsque les quatre composantes suivantes sont présentes simultanément :
ـ Un conducteur ionique : Il s’agit d’un électrolyte capable de véhiculer les ions de
la cathode vers l’anode, soit la matrice cimentaire dans le cas présent.
ـ Une connexion électrique : Élément qui permet le transfert des électrons de
l’anode vers la cathode. Pour le béton armé, il s’agit de l’acier d’armature.
ـ Une anode : Il s’agit du lieu où la corrosion se produit. Le fer passe en solution et
libère des électrons suite à une réaction d’oxydation :
Fe ↔ Fe
2++ 2e
ـ Une cathode : Endroit où la présence d’oxygène et d’eau, jumelée aux électrons
provenant de l’anode, réagissent par réduction pour former des ions hydroxydes :
½O
2+ H
2O + 2e
-↔ 2OH
-Cette dernière équation témoigne de la nécessité dans le processus de corrosion de l’acier d’armature d’avoir un apport en eau et en oxygène pour alimenter la réaction cathodique.
Figure 1.4 : Corrosion de l’acier d’armature (adapté de Pigeon, 2018) Béton
Acier
Cathode Anode
15
Le processus de corrosion peut être décomposé en deux phases, soit l’initiation et la propagation. La phase d’initiation est la période de temps nécessaire pour réunir les conditions requises pour briser le film passif. La phase de propagation, quant à elle, débute lorsqu’il y a bris du film passif, dès l’instauration de la pile électrochimique (Fig. 1.5).
Figure 1.5 : Initiation et propagation de la corrosion (Bertolini et coll., 2004)
1.3.2 Notions du potentiel électrochimique
La tendance à l’oxydation est une propriété qui est dépendante du métal considéré. Leur activité chimique en présence d’un électrolyte est exprimée par le potentiel électrochimique qui représente une mesure de la capacité d’échange d’électrons à travers l’interface métal-électrolyte (Andrade, 2007). Ce potentiel est défini par l’équation 1.3 de Nernst :
𝐸 = 𝐸0+𝑅𝑇 𝑛𝐹ln 𝑘
où E [V] est le potentiel de l’électrode, E0 [V] est le potentiel standard, R [J/mol/K] est la constante des gaz parfaits, T [K] est la température absolue, n est le nombre d’électrons échangés, F [C/mol] est la constante de Faraday et k est la constante d’équilibre des ions
16
présents dans l’électrolyte. Pour la réaction du Fe(II)/Fe, k représente l’activité des ions Fe2+ en solution.
Bien que les potentiels absolus des électrodes ne soient pas mesurables, il est possible de déterminer E0 par rapport à une électrode de référence, soit l’électrode standard à
l’hydrogène (SHE) pour laquelle on pose arbitrairement E0 = 0 à 25 °C. Dans les études
considérant les ions chlorure, l’électrode de calomel saturée (KCl/Hg2Cl2, Hg) est
généralement utilisée. À ce moment, la valeur du potentiel prend la forme de E0 + 0,2415 V (Ghali, 2005).
Lorsqu’un métal pur et homogène, dénoté M, est plongé dans un électrolyte contenant des ions Mz+, il est soumis à la réaction d’équilibre d’oxydoréduction suivante :
𝑀 𝑀𝑧++ 𝑧𝑒−
À l’équilibre, soit avant l’initiation de la corrosion, le taux d’oxydation sur le métal est égal au taux de réduction et correspond à un certain potentiel d’équilibre. Cet équilibre est poussé vers l’oxydation lorsqu’un courant positif est induit dans le métal et vers la réduction dans le cas d’un courant négatif (François et coll., 2018).
1.3.3 Passivation des barres d’armature
L’acier d’armature noyé dans un matériau cimentaire sain et non contaminé (pH > 13) présente un taux de corrosion négligeable qui est attribué à la formation d’une fine couche protectrice, appelée film passif, à la surface de l’armature. Lorsque le métal entre en contact avec l’électrolyte, il y a formation d’une double couche à l’interface métal-électrolyte composée d’ions ferriques de la solution interstitielle attirés contre la paroi du métal. Son épaisseur est généralement de 3 à 15 nm (Williamson et Isgor, 2016). Le fort gradient de potentiel qui unit les ions à la charge négative résiduelle dans le métal contrôle le transport des cations et des anions à travers la double couche. D’autres paramètres, tels que la température et les espèces chimiques entourant le métal, affectent directement la nature du
Red
17
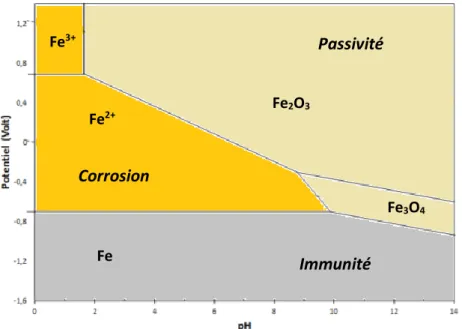
film passif et, ainsi, la vitesse de corrosion (Alhozaimy et coll., 2014). La nature de cette couche a été mise en évidence par les travaux de Pourbaix qui, basés sur l’application de l’équation de Nernst en conditions stables, décrivent l’état thermodynamique ainsi que la composition du film selon le pH et le potentiel du milieu.
À partir du diagramme de Pourbaix illustré à la Figure 1.6, il est possible d’identifier l’état d’oxydation du fer en fonction du pH de la solution poreuse et du potentiel du métal. Dans la zone d’immunité, le fer est présent sous sa forme thermodynamique la plus stable, soit le Fe0. Dans la zone de passivité, le fer est présent sous forme oxydée, entre autres
l’hématite (Fe2O3) ou la magnétite (Fe3O4). Dans un béton non contaminé, le pH de la
solution interstitielle permet la formation de ces oxydes. À lui seul, le phénomène de passivation n’interrompt pas le processus de corrosion, mais il diminue néanmoins sa progression à quelques microns par année (Rosenberg et coll., 1989). Finalement, dans la zone de corrosion, le fer est présent sous forme d’ions Fe2+ ou Fe3+ (Barrera, 2014).
Figure 1.6 : Diagramme de Pourbaix du système Fe-H2O à 25 °C (adapté de Nasser, 2010) Immunité Passivité Corrosion Fe Fe3+ Fe2+ Fe2O3 Fe3O4
18
1.3.4 Dépassivation des barres d’armature
Tel que vu à la section précédente par le diagramme de Pourbaix, le pH au pourtour de l’armature est responsable de la stabilité du film passif face à la corrosion. Toutefois, en contact avec un environnement chimique agressif, le pH du matériau cimentaire peut chuter et entraîner la destruction du film passif ; on parle alors de dépassivation. Il existe deux principaux mécanismes responsables de la dépassivation de l’acier d’armature, la carbonatation et l’action des chlorures (Bertolini et coll., 2004).
Le premier correspond à une diminution uniforme du pH due à la pénétration d’un front d’acide carboxylique (HCOOH), provenant généralement de la dissolution du dioxyde de carbone atmosphérique. L’acide réagit avec la portlandite de la matrice pour former de la calcite, CaCO3 et de l’eau, réduisant ainsi le pH de manière uniforme autour de la barre
d’armature. Dans un béton ordinaire exposé, la pénétration de la carbonatation est de l’ordre de 1 mm par année à une humidité relative optimale de 50 à 70 % (Duchesne, 2018).
Dans les pays nordiques, c’est davantage l’action des ions chlorure issus de l’épandage des sels déglaçants qui est en cause. Avec le temps, une fraction de ces ions migre jusqu’à l’acier d’armature, l’autre se lie chimiquement ou physiquement à la matrice cimentaire. Lorsque la concentration critique en ions chlorure est atteinte, la couche de passivation est dissoute à certains endroits en raison de son manque d’uniformité. Les surfaces qui ne sont plus protégées deviennent les zones anodiques de la pile électrochimique, alors que les surfaces intactes demeurent les zones cathodiques. Il existe donc un rapport élevé de surface cathode/anode, qui est responsable de la dissolution localisée de l’acier en profondeur, plutôt que répartie en surface. C’est le phénomène de corrosion par piqûres. Le mécanisme de destruction du film passif par les chlorures est toujours sujet à débat au sein de la communauté scientifique. Il est cependant accepté que la formation de zones anodiques locales provienne d’une baisse du pH inférieure à 5, conséquemment à la présence d’acide chlorhydrique. Il y a par la suite formation de chlorures ferreux qui diffusent vers des zones de pH élevé, où ils se dissolvent en ions Fe2+ et Cl-. De ce fait, il
y a formation d’hydroxyde de fer avec les ions OH- issus de la réaction cathodique et
19
le flux d’ions chlorure vers la zone anodique. Cette réaction est dite autocatalytique, puisque les chlorures sont constamment recyclés et accélèrent la corrosion de l’armature. Elle peut d’ailleurs atteindre un taux de corrosion jusqu’à 1 mm par an, ce qui peut rapidement conduire à une réduction significative de la section d’acier (Bertolini et coll., 2004). De manière générale, le terme micropile est utilisé pour désigner un système où les zones anodiques et cathodiques sont réparties uniformément, tel est le cas lorsque la corrosion est initiée par la carbonatation et qu’il y a présence d’un seul rang d’armature. Le terme macropile désigne quant à lui un système comportant des anodes et cathodes distinctes à l’échelle spatiale, caractéristique de la corrosion par piqûre induite par les chlorures (Elsener, 2002).
La Figure 1.7 illustre le phénomène de corrosion par macropile, où la corrosion est initiée par la destruction ponctuelle du film passif par l’action des chlorures.
Figure 1.7 : Corrosion par piqûre de l’acier d’armature (Vichot et Ollivier, 2008)
1.3.5 Polarisation d’une macropile
La corrosion par macropile est générée par des différences locales de l’état électrochimique de l’acier, donnant lieu à des zones anodiques et cathodiques éloignées (Laurens et coll., 2016). Dans le cas présent, ces différences surviennent lorsqu’une concentration critique d’ions chlorure atteint localement l’acier d’armature et provoque sa dépassivation. Les zones anodiques et cathodiques étant électriquement connectées, les électrons produits de
20
la réaction anodique sont consommés par la réaction cathodique qui se produit ailleurs sur le réseau de barres d’armature. La macropile, ou corrosion galvanique, est donc caractérisée par un champ de potentiel non uniforme entre les zones anodiques et cathodiques, causé par la résistivité électrique du béton et qui résulte en un courant ionique circulant des zones actives aux zones passives. Cette résistivité électrique est un paramètre majeur qui gouverne l’intensité du courant de corrosion de la macropile (Im) et, par le fait même, la dissolution locale de l’acier d’armature.
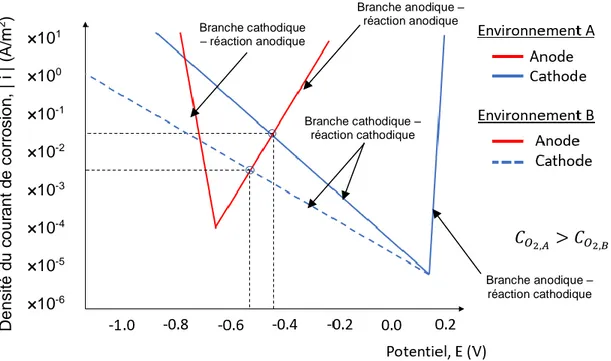
La corrosion par macropile est généralement présentée par le couplage d’une zone active et d’une zone passive, chacune possédant un potentiel d’équilibre défini par les réactions d’oxydation et de réduction (Ecorr,a < Ecorr,p) (Laurens et coll., 2016). Toutefois, due à leur connexion électrique, la zone passive de l’acier d’armature subit une polarisation cathodique, alors que la zone active de l’acier subit une polarisation anodique. Les potentiels passif et actif se rapprochent mutuellement, sans toutefois atteindre la même valeur en raison de la résistivité électrique du béton (Fig. 1.8). Dans le but de simplifier la représentation du phénomène, un système unidimensionnel est employé pour définir les potentiels actif et passif de l’acier, bien que la réalité tridimensionnelle d’un tel système nécessite d’avoir recours à des champs de potentiel.
Figure 1.8 : Illustration de la polarisation entre une zone active et passive d’une macropile à l’état 1D (Laurens et coll., 2016)
21
Les courbes de polarisation illustrées à la Figure 1.8 sont présentées en termes d’intensité du courant de corrosion (Ia, Ip) afin de tenir compte des surfaces active et passive de l’acier (Sa et Sp, respectivement). À l’équilibre, les courants anodique et cathodique sont égaux, mais de signe opposé :
𝐼𝑎 = −𝐼𝑝 = 𝐼𝑚
En tenant compte de la résistivité électrique unidimensionnelle du béton (Re), il est également possible de relier le potentiel de l’acier à l’état passif au potentiel de l’acier à l’état actif :
𝐸𝑝− 𝐸𝑎 = 𝑅𝑒𝐼𝑚
Il est par ailleurs à noter qu’un courant de corrosion résiduel de la zone active (Imicro) peut demeurer après le couplage. Le courant de corrosion total est égal à la somme du courant de la macropile (Im) et du courant résiduel de la micropile (Imicro).
Le comportement des courbes de polarisation, tant pour la zone active que passive, peut être modélisé par les équations de Butler-Volmer, en utilisant les paramètres électrochimiques appropriés (Laurens et coll., 2016) :
𝑖 = 𝑖𝑐𝑜𝑟𝑟(𝑒𝑥𝑝 (𝐸 − 𝐸𝑐𝑜𝑟𝑟
𝑏𝑎 ) − exp (−
𝐸 − 𝐸𝑐𝑜𝑟𝑟 𝑏𝑐 ))
où Ecorr [V/ref] est le potentiel de corrosion du système à l’équilibre, i [A/m2] est la densité
de courant nette à un potentiel E (impliquant une polarisation autour du potentiel d’équilibre Ecorr), icorr [A/m2] est la densité de courant de corrosion, ba et bc [V] sont respectivement les coefficients de Tafel anodique et cathodique du système. Ces coefficients sont déduits à partir des courbes de polarisation anodique et cathodique présentées à la Figure 1.8, qui elle est fonction du courant I [A] et du potentiel E [V].
La linéarisation de l’équation 1.6 ci-haut, en posant l’hypothèse que ex ≈ 1 + x, permet de réécrire l’équation de Butler-Volmer sous la forme :
(1.4)
(1.5)
22 𝑖 = 𝑖𝑐𝑜𝑟𝑟 𝛽𝑎+ 𝛽𝑐
𝛽𝑎𝛽𝑐 (𝐸 − 𝐸𝑐𝑜𝑟𝑟)
L’Équation 1.7 peut ensuite être réorganisée en notant ΔE = E - Ecorr et Δi = i - 0 = i :
𝑖𝑐𝑜𝑟𝑟 = 𝛽𝑎𝛽𝑐 𝛽𝑎+ 𝛽𝑐
∆𝑖 ∆𝐸
Pour une faible polarisation, qui représente la variation du potentiel autour du potentiel de corrosion, la variation de la pente ΔE/Δi est jugée linéaire. C’est d’ailleurs cette pente qui est assimilée à la résistance à la polarisation linéaire Rp, exploitée par la méthode du suivi de l’activité électrochimique. Il est finalement possible d’assimiler le terme 𝛽𝑎𝛽𝑐
𝛽𝑎+𝛽𝑐 à une
constante B exprimée en volt, ce qui permet d’écrire l’équation de Stern-Geary (Pigeon, 2018) :
𝑖𝑐𝑜𝑟𝑟 = 𝐵 𝑅𝑝
D’autre part, la loi de Faraday est particulièrement intéressante lorsque vient le moment de déterminer le temps de consommation du dioxygène par la réaction cathodique dans un béton corrodé et non saturé pour un flux extérieur nul (Pigeon, 2018) :
∆𝑡 =𝑛𝑜²∙ 𝐹 ∙ 𝑧𝐹𝑒2+ 2 ∙ 𝐼𝑐𝑜𝑟𝑟
où Δt le temps de consommation du O2 [s], no2 est le nombre de moles du dioxygène [mol],
F est la constante de Faraday [As/mol],
z
Fe2+ est la valence du Fe2+ et Icorr est le courant de corrosion [A]. Le nombre de moles de dioxygène correspond au volume dans la fraction gazeuse et liquide de la dalle de béton.(1.7)
(1.8)
(1.9)
23
1.3.6 Facteurs contrôlant la corrosion
Le temps d’initiation et la vitesse de corrosion des aciers d’armature sont régis par des facteurs qui dépendent de la qualité du béton et des conditions d’exposition. Dans cette section, trois facteurs ayant une importance significative dans le cadre de cette recherche sont abordés, soit la concentration critique en ions chlorure pour initier la corrosion, le degré de saturation du béton ainsi que le rapport surfacique anode/cathode. Une liste plus exhaustive inclut également les différents paramètres cités à la section 1.2.2 qui régissent la vitesse de transport des espèces ioniques dans le béton.
1.3.6.1 Concentration critique en ions chlorure
Il a été mentionné dans les sections précédentes que les armatures noyées dans le béton sont, au départ, protégées par une fine couche d’oxydes de fer à leur surface en raison de l’environnement fortement basique du matériau. Cependant, une détérioration très localisée du film passif survient lorsqu’une concentration critique en chlorures (Ccrit) est atteinte au droit de l’armature. C’est alors que la corrosion est initiée. La connaissance de cette concentration est un paramètre fondamental dans la prédiction de la durée de vie d’une structure contaminée en ions chlorure (Xu et coll., 2010).
Depuis des décennies, plusieurs études ont tenté de déterminer une valeur unique de la concentration critique en ions chlorure. Une des raisons qui explique la divergence des résultats obtenus est d’abord son caractère multifactoriel. En effet, Ccrit dépend entre autres des proportions volumétriques du mélange de béton, du type de ciment, du contenu en C3A,
du rapport E/C, de la température, de l’humidité relative, des conditions de surface de l’acier et du type de sel de chlorures pénétrant dans le matériau. L’autre raison est le manque de concordance sur la définition même de Ccrit, soit sur la détermination du seuil de corrosion (produits de corrosion visibles, potentiel de corrosion ou courant de corrosion) ou soit sur l’expression de la concentration critique (Alonso et coll., 2000). Dans ce dernier cas, la valeur est généralement exprimée par la concentration massique critique en ions Cl- totaux par rapport à la masse de ciment ou à la masse totale de béton sec. Ces chlorures totaux constituent la somme des ions liés chimiquement à la matrice cimentaire et des ions
24
libres de la solution interstitielle. Dans la documentation scientifique, il est rapporté que
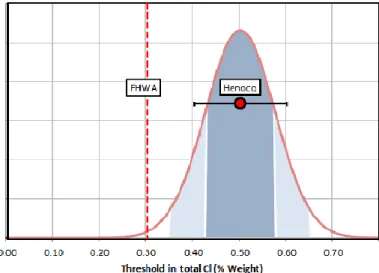
Ccrit varie de 0,3 à 2,0 % en masse de ciment et qu’une valeur moyenne de 0,5 % est généralement utilisée (Simco Technologies Inc., 2013). La borne inférieure de 0,3 % étant spécifiée par la Federal Highway Administration (FHWA) selon qui cette concentration représente le seuil nécessaire à l’initiation de la corrosion pour un acier noir standard. La Figure 1.9 présente une analyse statistique réalisée par Simco Technologies Inc. à partir des données tirées de la revue scientifique de Henocq et coll. (2007).
Figure 1.9 : Densité de probabilité de la concentration critique en ions chlorure (Simco Technologies Inc., 2013)
Une autre manière d’exprimer Ccrit est le ratio entre la concentration en Cl- libres et en ions hydroxyde de la solution [Cl-]/[OH-]. Bien que la concentration en ions hydroxyde peut se révéler difficile à mesurer dans le béton, cette approche est considérée plus représentative, car elle considère l’effet de protection du pH contre l’initiation de la corrosion. La valeur critique pour les mortiers varie entre 1,17 et 3,98 par Alonso et coll. (2000).
La fixation des ions chlorure à la matrice cimentaire est un paramètre déterminant dans l’estimation de la concentration critique au droit de l’armature. C’est essentiellement la teneur en C3A du ciment formant les phases AFm, dont la combinaison avec les chlorures
forme des sels de Friedel, qui est responsable de la réduction de la teneur en chlorures libres. D’après l’étude numérique de Glass et Buenfeld (2010), l’effet de la teneur en C3A
25
dans la solution interstitielle (Fig. 1.10). L’étude a permis de montrer que plus la teneur en C3A est grande, plus d’ions chlorure sont en mesure d’être fixés à la matrice cimentaire
ce qui augmente principalement la concentration en chlorures totaux près de la surface. Cependant, comme les ions chlorures sont rapidement fixés à la matrice, la concentration en chlorures libres dans la solution interstitielle diminue plus la profondeur augmente.
Figure 1.10 : Prédiction du profil de Cl- après une exposition de 50 ans pour trois concentrations de C3A a) Cl- totaux et b) Cl- libres (Glass et Buenfeld, 2000)
1.3.6.2 Degré de saturation du béton
Le degré de saturation du béton est un paramètre essentiel qui influence sa conductivité électrique ainsi que l’approvisionnement en O2 sur les surfaces cathodiques. Cette situation
traduit deux besoins antagonistes pour la réaction électrochimique.
D’une part, les ions circulent par la phase liquide du réseau capillaire. Un haut degré de saturation entraîne donc une augmentation de la conductivité électrique du béton et donc du courant de corrosion. On parle de contrôle par résistance de la corrosion. La conductivité électrique est également dépendante du volume et de la tortuosité du réseau capillaire. Ce dernier paramètre est le rapport de la longueur du chemin réel parcouru entre deux points sur la distance rectiligne qui les sépare. Dans un milieu liquide sans obstacle, la tortuosité est égale à 1. Elle décroit vers une valeur de 0, correspondant à un matériau isolant électriquement, pour un réseau capillaire de moins en moins interconnecté.