La Dicarbonyl L-xylulose réductase (DCXR) dans
l’épididyme : une enzyme, plusieurs fonctions.
Thèse
Ayodélé AKINTAYO
Doctorat en Biologie cellulaire et moléculaire
Philosophiae doctor (Ph.D.)
Québec, Canada
Résumé
L’épididyme est un organe complexe impliqué dans la maturation des spermatozoïdes et l’acquisition de leur pouvoir fécondant. Il possède plusieurs régions présentant toutes, différents profils d’expression génique. Le gène de la DCXR (Dicarbonyle L-xylulose réductase) retrouvé chez plusieurs espèces est fortement conservé au cours de l’évolution. Il code pour une protéine impliquée dans différents processus biologiques dont la voie métabolique énergétique de dégradation de l’inositol. DCXR est exprimée dans l’épididyme chez certaines espèces étudiées (souris, hamster, singe, humain). Chez l’homme, la protéine présente sur les spermatozoïdes est impliquée dans leur liaison à l’ovocyte et son absence sur les spermatozoïdes a été corrélée avec des cas d’infertilité idiopathique.
Nous avons émis l’hypothèse que, d’une part la conservation de la séquence du gène de la DCXR entre les espèces permet un maintien de son rôle dans l’interaction entre les gamètes chez ces différentes espèces. D’autre part, la séquence de la protéine DCXR contient des domaines qui lui confèrent ses différentes fonctions.
Nous avons basé nos recherches sur les modèles murin, humain et bovin. La possibilité de quantifier l’infertilité du taureau, en fait un modèle de choix pour l’étude des protéines impliquées dans la fécondation. Nous rapportons ici, l’identification de la DCXR dans l’épididyme de taureau. La protéine bovine est fortement exprimée dans l’épididyme, mais présente des différences d’expression et de localisation par rapport au modèle humain. Nous démontrons, dans l’épididyme, l’expression des gènes des enzymes de la voie de dégradation de l’inositol. L’activité enzymatique xylitol déshydrogénase mesurable en présence de la DCXR recombinante ou du fluide épididymaire, suggère un rôle de la DCXR dans le maintien du bilan énergétique via la voie de dégradation de l’inositol.
Par induction de mutations ponctuelles dans la DCXR d’origine humaine nous avons mis en évidence les régions impliquées dans le pouvoir enzymatique de la protéine, mais l’impact sur la propriété de liaison à la zone pellucide de l’ovocyte n’a pas pu être vérifié. De même, l’incidence de la délétion génique de DCXR n’a pu être étudiée. Nos résultats suggèrent une différence dans le rôle de la DCXR en fonction de l’espèce malgré la présence d’une forte homologie de séquence.
Abstract
The epididymis is a complex organ involved in spermatozoa maturation and acquisition of their fertilization abilities. The epididymis is segmented in different regions with specific gene expression patterns. DCXR gene, found in many species, is highly conserved during the evolution. The DCXR protein is involved in different biological processes of which, the inositol degradation energetic pathway. DCXR is highly expressed in the epididymis of studied species (mouse, hamster, monkey, human). In human, DCXR protein is found on the spermatozoa and is important for the binding of spermatozoa to the oocyte. The lack of this protein has been correlated with idiopathic infertility cases.
We hypothesized that the high sequence homology of DCXR between species is associated with functionally conserved properties of the protein in mediating sperm-oocyte binding. We further hypothesized that the DCXR protein sequence contains specific functional domains that permit its multiple biological roles.
We used the murine, human and bovine models for our studies. Bovine is a model in which the fertility can be quantified, what makes it interesting for the study of protein involved in fertilization. We report here the identification of DCXR in bull epididymis. The protein is highly expressed in the epididymis but shows expression and localization differences with the human counterpart. In the bovine epididymis, we identify the gene expression of enzymes involved in the inositol degradation metabolic pathway. The recombinant DCXR protein and the epididymis fluids xylitol dehydrogenase enzymatic activity, suggest the involvement of the protein in energy production by means of the inositol degradations pathway. By point mutations induction in the human DCXR, we revealed the protein domains involved in its enzymatic properties. Preliminary experiments did not conclusively demonstrate a role for DCXR during sperm-zona pellucida binding and a pilot test to create a DCXR-null animal model was unsatisfactory. Therefore, future research should focus on elucidating the function of this protein on male reproductive function.
All together our results suggest a difference in the role of DCXR depending on the species studied.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux et figures ... xi
Liste des abréviations ... xiii
Remerciements ... xvii
Avant-propos ... xxi
Chapitre I : Introduction ... 1
I.1. Le testicule, « usine » à spermatozoïdes ... 3
I.1.1. Structures tissulaires ... 3
I.1.1.1. La capsule testiculaire ou albuginée : ... 3
I.1.1.2. Espaces interstitiels : ... 4
I.1.1.3. Les tubes séminifères : ... 4
I.1.1.4. Innervation et vascularisation : ... 5
I.1.2. Composition en types cellulaires ... 5
I.1.2.1. Cellules germinales et la spermatogenèse : ... 5
I.1.2.1.1. Spermatogenèse ... 7
I.1.2.1.2. Spermiogenèse ... 7
I.1.2.2. Les cellules de Sertoli ... 9
I.1.2.3. Les cellules de Leydig ... 9
I.1.3. Résumé partiel : ... 10
I.2. L’épididyme, un organe, plusieurs régions, un rôle. ... 11
I.2.1. Anatomie de l’épididyme ... 11
I.2.1.1. Cellules principales ... 13
I.2.1.2. Cellules apicales et Narrow ... 15
I.2.1.3. Cellules claires... 15
I.2.1.4. Cellules basales ... 16
I.2.1.5. Cellules à halo ... 16
I.2.2. La lumière du tube épididymaire, un espace immunosupprimé. ... 16
I.2.3. Un organe avec une diversité de protéines produites ... 18
I.2.4. Régulation de l’expression génique dans l’épididyme ... 19
I.2.4.1. Facteurs testiculaires lumicrines ... 19
I.2.4.2. Facteurs spermatiques... 19
I.2.4.3. Facteurs de croissance ... 20
I.2.4.4. Hormones stéroïdiennes androgène et oestrogène ... 20
I.2.4.5. Facteurs autres ... 21
I.2.4.5.2. Variations thermiques ... 22
I.2.4.5.3. Petits ARNs ... 22
I.2.4.5.4. Sécrétions épididymaires (épididymosomes) ... 22
I.2.5. L’épididyme et la maturation des spermatozoïdes ... 23
I.2.5.1. Protéines ... 23
I.2.5.1.1. Les épididymosomes : ... 24
I.2.5.1.2. Protéines associées aux épididymosomes et transférées aux spermatozoïdes ... 25
I.2.5.2. La phosphorylation du flagelle ... 27
I.2.5.3. Les lipides membranaires ... 28
I.2.6. Résumé partiel : ... 29
I.3. La protéine DCXR ... 30
I.3.1. Biochimie de la protéine DCXR ... 30
I.3.1.1. Homologies interspécifiques de la DCXR ... 32
I.3.1.2. Localisation tissulaire de la DCXR ... 32
I.3.2. La DCXR, une protéine de type moonlighting (multifonctionnelle). ... 33
I.3.2.1. Description des protéines de type moonlighting : ... 33
I.3.2.2. Rôles liés à son pouvoir enzymatique ... 34
I.3.2.2.1. Détoxification ... 34
I.3.2.2.2. Métabolisme énergétique (sugar metabolism) ... 36
I.3.2.2.3. Mécanisme de régulation de l’expression de la DCXR... 38
I.3.2.3. Rôles non liés au pouvoir enzymatique : ... 38
I.3.2.3.1. Variation du niveau de DCXR dans les cas de cancer. ... 38
I.3.2.3.2. Protéine marqueur de la maturation spermatique; rôle dans le processus de fécondation. ... 39
I.3.2.3.2.a. DCXR sur les spermatozoïdes ... 40
I.3.2.3.2.b. DCXR impliqué dans les cas d’infertilité idiopathique. ... 41
I.3.3. Résumé partiel : ... 42
I.4. Hypothèses et objectifs ... 43
I.4.1. Hypothèse ... 44
I.4.2. Objectifs ... 44
I.4.3. Justification du choix des modèles ... 44
I.4.3.1. Le modèle bovin ... 44
I.4.3.1.1. Possibilité d’avoir une valeur quantitative relative de la fertilité d’un individu mâle. (Caractéristique importante de ce modèle) ... 45
I.4.3.1.2. Disponibilité du matériel ... 45
I.4.3.1.3. Puissance statistique due à l’hétérogénéité dans les échantillons obtenus. ... 45
I.4.3.2. Le modèle humain ... 46
I.4.3.3. Le modèle murin ... 46
Bibliographie ... 47
Chapitre II : Dicarbonyl L-xylulose reductase (DCXR), a “moonlighting protein” in the bovine epididymis ... 71
II.1 Résumé ... 73
II.3 Introduction ... 77
II.4 Materials and methods ... 79
II.4.1 Tissues and spermatozoa ... 79
II.4.2 RNA extraction and bovine DCXR cloning ... 79
II.4.3 Quantitative real-time PCR assay ... 80
II.4.4 In situ hybridization ... 80
II.4.5 DCXR antibody production ... 81
II.4.6 Other antibodies used in this study ... 82
II.4.7 Immunohistochemistry ... 82
II.4.8 Epididymal vesicles (epididymosomes) isolation ... 83
II.4.9 Proteolytic treatment of epididymosomes, fluid, and recombinant proteins ... 83
II.4.10 Epididymal tissues and spermatozoa sub cellular fractionation ... 83
II.5 Results ... 85
II.6 Discussion ... 95
II.7 Supplemental data ... 98
II.8 Acknowledgements ... 104
II.9 References ... 105
Chapitre III : L’implication de la DCXR dans le mécanisme énergétique dans l’épididyme bovin ... 109
III.1. Résumé ... 111
III.2. Introduction ... 113
III.3. Matériel et méthode ... 115
III.3.1. Tissus et spermatozoïdes ... 115
III.3.2. Préparation du fluide et des spermatozoïdes ... 115
III.3.3. Fractionnement cellulaire ... 115
III.3.4. Fractionnement des spermatozoïdes ... 116
III.3.5. Production de la protéine recombinante ... 116
III.3.6. Mesure de l’activité enzymatique ... 116
III.3.7. Extraction ARN et clonage des gènes... 117
III.3.8. PCR quantitative en temps réel ... 117
III.4. Résultats ... 119
III.5. Discussion ... 135
III.6. Références ... 141
Chapitre IV : Rapports sur l’étude de l’importance de la DCXR dans la fertilité et de sa capacité de liaison à la zone pellucide. ... 143
IV.1. Identification et caractérisation des domaines de la protéine DCXR chez l’humain .. 145
IV.1.1. Mise en contexte et exposition des objectifs du projet ... 145
IV.1.2. Matériel et méthode ... 147
IV.1.2.1. Production des protéines recombinantes par Saccaromyces. pombe (S. pombe) ... 147
IV.1.2.2. Mesure de l’activité enzymatique ... 149
IV.1.2.4. Biotinylation des protéines ... 150
IV.1.2.5. Interaction spermatozoïdes/ovocytes dénudés en présence de protéine recombinante. 150 IV.1.3. Résultats et discussions ... 153
IV.2. Invalidation génique de la DCXR murine ... 163
IV.2.1. Mise en contexte et exposition des objectifs du projet ... 163
IV.2.2. Matériel et méthode ... 165
IV.2.2.1. Production des cellules ES transfectées ... 165
IV.2.2.2. Extraction d’ADN de cellules ES transfectées ... 165
IV.2.2.3. Génération des souris ... 166
IV.2.2.4. Extraction d’ADN génomique de queue de souris ... 167
IV.2.2.5. Protocole de Southern blot ... 167
IV.2.3. Résultats et difficultés rencontrées ... 169
IV.3. Références ... 173
Chapitre V : Discussions et perspectives. ... 175
V.1. La DCXR chez les différentes espèces. ... 176
V.1.1. Le Modèle KO ... 176
V.1.2. Analyse de la protéine par induction de mutations ... 178
V.1.3. Le modèle bovin ... 183
V.1.3.1. DCXR chez le bovin ... 184
V.1.3.2. Implications de son rôle énergétique dans l’épididyme et sur les spermatozoïdes. ... 189
V.2. Conclusion ... 192
Liste des tableaux et figures
Chapitre I
Schéma I-1 : Schématisation de la structure du testicule humain. ... 6
Schéma I-2 : Représentation schématique des étapes de la spermatogenèse. ... 8
Figure I-1 : Représentation schématique de la formation du tractus génital mâle. Maturation du rein embryonnaire et du canal de wolff en épididyme. ... 12
Figure I-2 : Représentation schématique de la structure de l'épididyme. Nous avons pris ici l'exemple de l'épididyme bovin. ... 14
Figure I-3 : Image de microscopie électronique montrant la fusion de microvésicules avec la membrane d'un spermatozoïde de la tête de l'épididyme de bovin. ... 26
Tableau I-1 Protéines associées aux épididymosomes dans le fluide épididymaire chez différentes espèces.. ... 27
Figure I-4 : Diagramme représentant la protéine DCXR et ses différentes régions connues. ... 32
Chapitre II Table II-1 : Polymerase chain reaction primers sequences used for this study ... 80
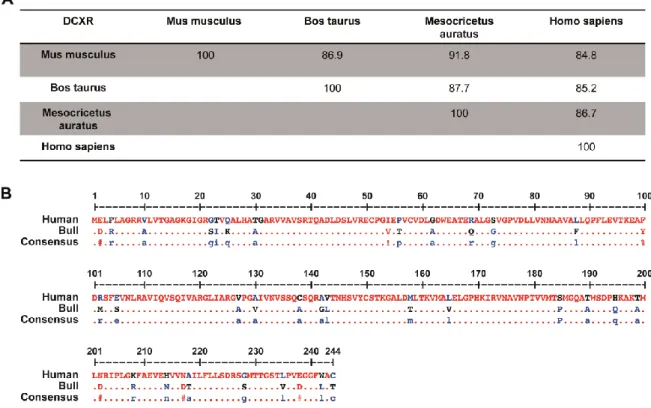
Figure II-1 : Mammalian DCXR sequence homology ... 86
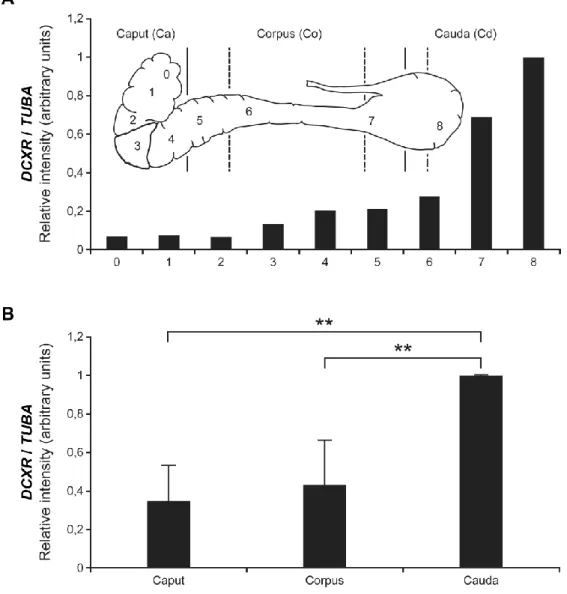
Figure II-2 : DCXR mRNA expression along the epididymis. ... 87
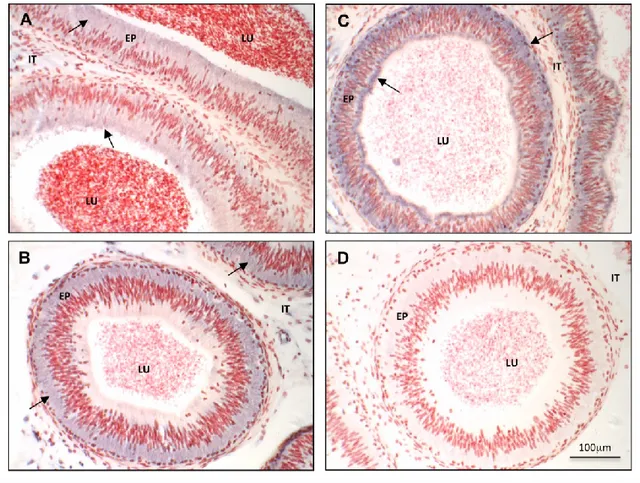
Figure II-3 : In situ hybridization localization of bovine DCXR mRNA on tissue cryosections of bovine caput (A), corpus (B, D) and Cauda (C) epididymidis. ... 88
Figure II-4 : DCXR protein levels along the bovine epididymis. ... 89
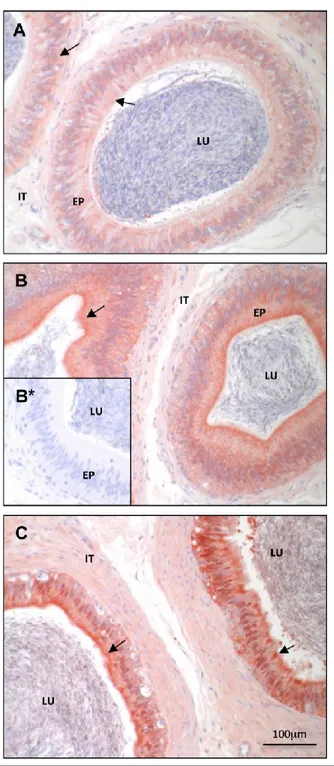
Figure II-5 : Immunohistochemical localization of bovine DCXR protein along the bovine epididymis. ... 91
Figure II-6 : DCXR protein levels associated with spermatozoa. ... 92
Figure II-7 : Dcxr protein levels in the epididymal fluid. ... 93
Figure II-8 : Trypsin digestion of cauda epididymal fluid before ultracentrifugation (Total); after ultracentrifugation (soluble fraction); epididymosomes, and recombinante DCXR protein. ... 94
Figure II-S-1 : In situ hybridization localization of bovine DCXR mRNA on tissue cryosections of bovine caput (A) corpus (B) and cauda (C) epididymidis. ... 98
Figure II-S-2 : Expression and purification of bovine recombinant DCXR protein. ... 99
Figure II-S-3 : DCXR antibodies characterization. ... 99
Figure II-S-4 : Tissue expression of bovine DCXR protein. ... 100
Figure II-S-5 : Immunohistochemical localization of bovine DCXR protein in caput (A), corpus (B) and cauda (C) epididymidis using a rabbit anti-DCXR antiserum (A,B and C). ... 101
Figure II-S-6 : Immunohistochemical staining on bovine caput (A), corpus (B) and cauda (C) epididymidis with rabbit anti-DCXR antiserum, pictures at higher magnification (1000X). ... 102
Figure II-S-7 : DCXR protein on ejaculated spermatozoa. ... 103
Figure II-S-8 : DCXR protein and anti-DCXR antiserum sperm-zona pellucida interference assay. ... 103
Chapitre III Figure III- 1 : Détection de la protéine DCXR dans différents tissus bovins. ... 119
Tableau III-1 : Caractéristiques cinétiques de la recDCXR-bov et du fluide de la queue de
l'épididyme. ... 121
Figure-III-2 : Détermination du pH optimum ... 122
Figure-III-3 : Influence de la température sur l'activité xylitol déshydrogénase. ... 124
Figure-III-4 : Influence du βmercaptoéthanol sur l'activité de la recDCXR-bov. ... 124
Figure-III-5 : Variation de l'activité de la protéine recDCXR-bov en fonction des conditions de stockage. ... 125
Figure-III-6 : SDS-PAGE sur les fractions de recDCXR conservées à -20 °C ... 126
Figure-III-7 : Mesure de l'activité enzymatique liée aux spermatozoïdes, en fonction de la température. ... 127
Diagramme III-1 : Représentation de la voie de dégradation de l'inositol et ses rapports avec d'autres voies métaboliques. ... 129
Tableau III- 2 : Liste des séquences d'oligo utilisées pour la détection des transcrits de la voie de dégradation du myo-Inositol. ... 131
Figure-III-8 : Expression des gènes de la voie de dégradation du myo-inositol. ... 133
Chapitre IV Tableau IV.1-1 : Séquence des amorces utilisées pour le clonage. ... 148
Figure IV.1-1 : Détection de la DCXR humaine native et de la recombinante bovine. ... 153
Figure IV.1-2 : Représentation schématique des versions de la protéine recombinante rec-DCXR. ... 155
Figure IV.1-3 : Vérification des protéines recombinantes sur gel d'acrylamide. ... 156
Figure IV.1-4 : Variation de l'activité enzymatique de la DCXR en fonction des mutations. ... 157
Figure IV.1-5 : Test de liaison des spermatozoïdes de taureaux à l'ovocyte bovin en présence de recDCXR d’origine humaine. ... 159
Figure IV.1-6 : Composition protéique de la ZP bovine ... 160
Figure IV.2-1 : Stratégie d'invalidation de gène de la DCXR murine. ... 166
Figure IV.2-2 : Stratégie de screening par Southern-blot. ... 170
Liste des abréviations
ABP Androgen binding proteinADAM2/3/7 A Disintegrin and Metalloprotease domain 2/3/7 AGEs Advanced Glycation End-products
AGPI Acides gras polyinsaturés AKR1A1 Alcool dehydrogenase AMH Anti-Müllerian hormone
AQP9 Aquaporine 9
AR Aldose reductase
Bax BCL2-associated X protein BCL2 B-cell lymphoma 2
BMP4 Bone morphogenetic protein 4
CAIV Membrane-associated carbonic anhydrase CAR2 Carbonic anhydrase 2
CatSper1 Cation channel, sperm associated 1 CLC3 Chloride chanel protein 3
CLU Clusterin
CML N-carboxymethyl-lysine
CREB C-AMP Response Element-binding protein Crisp1 Cystein-rich secretory protein 1
CRYL1 L-Gulonate dehydrogenase DEFB126 Beta-defensin 126
DCXR Dicarbonyl L-xylulose reductase DHT Dihydrotestostérone
DTT Dithiotreitol
Edn1 Endothelin 1
Egf Epithelial growth factor
ELSPBP1 Epididymal sperm binding protein 1 ESR1 Estrogen receptor 1
E2 Estradiol
FGF Fibroblast growth factor
FGFr Fibroblast growth factor receptor FSH Follicle-stimulating hormone
gACE germinal Angiotensin I-Converting Enzyme GDNF Glial cell-derived neurotrophic factor GGT γ-glutamyl transpeptide
GLIPR1L1 Glioma pathogenesis-related protein 1 GPI Glycosylphosphatidylinositol
Gpx-5 Glutathione peroxidase 5 GST Glutathione-S-transferase HCC Hepatocellular Carcinoma
HE5 Human epididymal 5
Igfbp3 Insulin-like growth factor binding protein 3 Igf1 Insulin-like growth factor 1
KIDCR kidney dicarbonyl reductase
LH Luteinizing hormone
MIF Macrophage migration inhibitory factor
MIOX Myo-oxygénase
MLCR Mouse lung carbonyl reductase NFATs Nuclear factor of activated T-cells NFkB Nuclear factor-kappa B
NPC2 Niemann–Pick disease, type C2 ORE Osmotic response element
OREBP Osmotic response element binding protein
PC Phosphatidylcholine
PE Phosphatidylethanolamine
RAGEs Receptor of AGEs
ROS Reactive oxygen species
SDR Short-Chain dehydrogenase/reductase SLC9A3 solute carrier family 9, subfamily A
SM Sphingomyelin
SODH Sorbitol dehydrogenase SOL Solution de fertilité
SOX9 SRY (sex determining region Y)-box 9 SPAM1 Sperm adhesion molecule 1
TGFβ Transforming growth factor beta TNR Taux de non-retour
TonE Tonicity-responsive Element
TonEBP Tonicity-responsive Element binding protein
Ub Ubiquitin
Remerciements
Je ne peux passer sans faire l’éloge de ces personnes qui m’ont soutenu dans cette quête de connaissance et qui ont participé à l’édification de ce travail.
Un grand merci au Dr Robert Sullivan qui m’a donné la chance d’évoluer pendant toutes ces années dans son équipe. Merci Robert pour ces conseils, merci de m’avoir éclairé lorsque tout semblait perdu, merci pour ton soutien indéfectible. Un merci particulier à « maman » Christine Légaré pour sa disponibilité et son sens critique. Christine, je n’aurais pas été le plus facile de tes enfants, merci d’avoir toujours pu trouver les mots pour me permettre de persévérer. Je remercie également M. Gilles Frenette pour son apport inestimable à ma formation. Merci d’avoir toujours pu trouver une réponse à mes questions et d’avoir été une référence pour moi. Je n’aurais finalement jamais pu aller avec toi à tes sorties de pêche, mais merci de m’avoir laissé puiser dans ton océan de savoir.
Je souhaite également adresser mes remerciements à toutes ces entités de savoir qui à jamais, feront partie de l’équipe Sullivan : Dr Louis-Jean Bordeleau, Marie-Ève Bergeron, Dr Julieta Caballero, Dr Olivier D’Amours, Dre Clémence Belleannée. Merci pour l’aide et le soutien scientifique et moral que vous avez apporté pour la production de ce travail.
Comme de coutume en Afrique, élever un enfant n’est pas uniquement l’affaire de ses parents ou de ses proches. Toute la communauté y apporte une aide. Je remercie tous les membres de « l’axe du mâle » et, à plus grande échelle, tous les membres du centre de recherche en biologie de la reproduction d’avoir été cette communauté africaine impliquée dans mon éducation. Merci pour l’environnement stimulant qu’ils ont su mettre en place pour la formation des étudiants. Team JJT, équipe R. Viger, équipe Y. Tremblay, équipe P. Leclerc, étage 1 du bloc T, Sonia Morisset, qu’auraient été ces années sans vous? Merci d’avoir été partie de mon monde.
Je terminerai en remerciant ma famille de Québec (les choux) qui n’a ménagé aucun effort pour créer un environnement de soutien et d’entre-aides mutuelles qui a largement contribué à ma stabilité et à mon confort affectif. Un gros remerciement à mes parents, mes sœurs et à mon frère pour leur soutien et leurs encouragements. Ma famille, j’ai enfin fini.
Merci à mon amie de cœur qui, malgré la distance, a toujours su trouver les mots justes et la force pour m’encourager dans les moments difficiles. Anja, merci pour ton amour et ton soutien. Ich liebe dich.
À tous ceux qui ont croisé mon chemin, à tous ceux qui ont partagé mon destin, à tous ceux dont les mots ont trouvé une place pour me soutenir, à tous ceux qui m’ont esquissé un sourire, ces longues années ont toutes été embellies par votre présence, vos conseils, votre soutien. Sachez que chacune de vos attentions se retrouve dans chacun des mots cette thèse.
Avant-propos
Jusqu’au 19e siècle, la compréhension de la reproduction reposait sur la théorie de la
préformation. Cette théorie était soutenue par deux courants de pensée. L’être humain serait déjà préformé et compacté dans un des gamètes : soit dans l’ovule (ovisme), le sperme ne servant qu’à fournir l’essence vital. Soit compacté dans le spermatozoïde (animaculisme), l’ovule n’ayant dans ce cas qu’une fonction nourricière. Cette théorie ne laisse aucune place
à l’épididyme dans la maturation des spermatozoïdes et l’acquisition de leur pouvoir fécondant.
Les connaissances ont évolué et sont actuellement bien loin de la description faite par Nicolas Hartsoeker de cet « être accroupi » dans la tête du spermatozoïde (Image 1). Il persiste néanmoins de nombreux points d’ombres, notamment sur les causes de l’incompatibilité interspécifique des gamètes chez certaines espèces, la compréhension des phénomènes impliqués dans la reconnaissance entre les deux gamètes, l’identification des mécanismes impliqués dans l’interaction entre ces deux gamètes, l’identification des causes de l’infertilité. Avec la baisse de fertilité à laquelle fait face l’humanité, la compréhension et la maitrise de ces phénomènes ont pris une certaine importance.
Dans cette ébauche de dissertation, nous faisons l’exercice de la recherche d’explication pour comprendre les phénomènes entourant ce dialogue entre l’ovocyte (gamète femelle) et le spermatozoïde (gamète mâle) chez les mammifères. Nous nous sommes attardés sur l’étude d’une protéine à large spectre de fonction exprimée dans l’épididyme, la DCXR, qui a montré une importance dans le processus de fécondation chez l’homme. Pour répondre à nos différents objectifs, nous avons questionné plusieurs modèles différents.
Dans le chapitre premier de ce document, nous avons dressé un portrait de cette protéine, de son tissu d’expression (l’épididyme) dans le tractus reproducteur mâle, suivi d’un exposé de nos hypothèses et objectifs.
Le second chapitre, présenté sous forme d’article en anglais, a été accepté pour publication dans le journal PlosOne sous la référence : Ayodélé Akintayo, Christine Légaré and Robert Sullivan. Dicarbonyl L-xylulose reductase (DCXR), a “moonlighting protein” in the bovine epididymis. (2015, PlosOne). Nous y étudions la DCXR dans le modèle bovin qui revêt des caractéristiques intéressantes pour l’identification des marqueurs de fertilité. J’ai effectué l’ensemble du travail expérimental, l’analyse et la rédaction du manuscrit. Christine Légaré a participé à la conception des expériences, à l’analyse et à la révision du manuscrit. Mon directeur de recherche (Dr Robert Sullivan) a participé à l’analyse et à la révision du manuscrit.
Le troisième chapitre est présenté sous forme d’article en français. Il regroupe les données d’expériences incomplètes (nombre de répliquas biologiques inférieurs à 3) visant à prouver le rôle enzymatique de la DCXR dans le tractus épididymaire chez le bovin. Des expériences sont en cours pour une possible publication de ces résultats. J’ai effectué l’ensemble du travail expérimental, l’analyse et la rédaction du manuscrit. Gilles Frenette a participé à l’analyse et à la révision du manuscrit. Mon directeur de recherche ( Dr Robert Sullivan) a participé à l’analyse et à la révision du manuscrit.
Le quatrième chapitre est scindé en deux parties. Dans la première, en nous appuyant sur l’implication connue de la DCXR humaine dans la fécondation, nous avons cherché à identifier les régions de la protéine responsables de ses différents rôles. Dans la seconde partie, pour décrire l’impact de l’absence de la protéine sur la fertilité, nous avons opté pour le seul modèle possible de délétion génique, la souris. J’ai effectué l’ensemble du travail expérimental dans ces deux parties à l’exception de la conceptualisation de la construction génique et de la transfection des cellules ES, réalisées par Christine Légaré. Les étapes nécessitant une manutention animalière ont été réalisées par le Dr Daniel Phaneuf. J’ai
également effectué l’analyse et la rédaction du manuscrit. Christine Légaré a largement participé à la conception des expériences, à l’analyse et à la révision du manuscrit. Mon directeur de recherche (Dr Robert Sullivan) a participé à l’analyse et à la révision du manuscrit.
Le cinquième chapitre clôt cette thèse sur une discussion de l’ensemble de nos résultats et observations.
I.1. Le testicule, « usine » à spermatozoïdes
Usine de la production des gamètes mâles, le testicule possède une fonction exocrine, par la production des spermatozoïdes, et une fonction endocrine, grâce à la production d’androgène, la testostérone. La seconde vague de gamétogenèse ou spermatogenèse y débute avec la puberté et l’augmentation de la production de testostérone. Du point de vue anatomique, le testicule est un organe à structure polarisée, richement innervé et vascularisé [(Thibault & Levasseur 2001) page 256].
I.1.1. Structures tissulaires
Chez les espèces exorchides, le testicule est situé dans le scrotum, où la température est inférieure à celle du reste du corps, suspendu à l’extrémité du cordon spermatique (schéma 1). Chez l’homme, cette différence est de l’ordre de 1 à 2 °C (Mieusset & Bujan 1995). Ce dernier est engainé par une tunique fibreuse recouverte, sur un de ses côtés, par le muscle crémaster. Les contractions de ce muscle sensible aux variations de température permettent de maintenir les testicules à une température propice à la spermatogenèse. La condition pathologique consistant au maintien des testicules dans la cavité abdominale (cryptorchidie) chez certaines espèces exorchides (homme, cheval, verrat) entraine une spermatogenèse anormale et l’occurrence de tumeurs et cancers chez l’homme [(Thibault & Levasseur 2001) page 256-257].
I.1.1.1. La capsule testiculaire ou albuginée :
Capsule fibreuse recouvrant le testicule, elle est tapissée à l’extérieur par la « tunique vaginale » d’origine péritonéale et de l’intérieur par la « tunique vasculaire » riche en vaisseaux sanguins (Roosen-Runge 1962, Clermont 1972).
L’albuginée est constituée majoritairement de fibres de collagène et chez certaines espèces, de cellules musculaires lisses. Elle est richement innervée par des terminaisons nerveuses de type adrénergiques et cholinergiques. Il est admis que chez l’homme, la tunique albuginée a des contractions rythmées qui permettent de drainer les spermatozoïdes hors du testicule (Clermont 1958, Hermo & Clermont 1976). Des invaginations de l’albuginée au
niveau du rete testis forment les septa ou cloisons qui délimitent des lobules testiculaires contenant les unités de production des spermatozoïdes, les tubes séminifères (schéma 1).
I.1.1.2. Espaces interstitiels :
L’espace entre les tubes séminifères est comblé par un tissu conjonctif lâche riche en vaisseaux sanguins, lymphatiques et en nerfs. On y retrouve également d’autres types cellulaires comme les fibroblastes, macrophages, lymphocytes et les cellules de Leydig, support de la production androgénique du testicule. Elles jouent un rôle primordial dans l’homéostasie endocrinienne du testicule (Hermo & Clermont 1976, Hermo et al. 1977). L’abondance et la répartition spatiale de ces différents types cellulaires varient d’une espèce à l’autre. Toutes ces cellules baignant dans l’humeur interstitielle interagissent entre elles et répondent aux facteurs véhiculés via le sang et relâchés par les vaisseaux sanguins et lymphatiques (FSH; LH). Elles agissent sur la spermatogenèse en exerçant un contrôle de type endocrine et paracrine sur les cellules de Sertoli et les cellules germinales [(Thibault & Levasseur 2001) page 258]
I.1.1.3. Les tubes séminifères :
Structure tubulaire formant un réseau dans chaque septum ou compartiment, les deux extrémités du tube sont ouvertes et se jettent dans le tube droit. Ce dernier est une structure liée au rete testis qui recueille les spermatozoïdes pour les diriger vers l’épididyme. Les tubes séminifères sont composés de plusieurs types cellulaires (Clermont 1972). De l’intérieur à l’extérieur des tubes, on trouve :
— la lame basale riche en laminine, collagène de type IV, entactine et héparane sulfate sur laquelle reposent les cellules de Sertoli et les cellules germinales encore à leurs premiers stades de différenciation [(Thibault & Levasseur 2001) page 257-258]. Ces types cellulaires seront décrits plus tard dans ce document.
— quelques couches de cellules péritubulaires (cellules myoïdes) riches en myosine, actines et fibronectine. Leur cohésion se fait par l’intermédiaire des molécules de cadhérine dont la région cytoplasmique est attachée aux filaments d’actine du cytosquelette. Ne présentant pas de traces d’innervation, l’activité contractile de cette couche de cellules myoïdes est soumise à un contrôle endocrine/paracrine qui permet l’évacuation des
— une couche de fibronectine et de fibrilles de collagène de type I et IV complexé aux parois des capillaires lymphatiques.
Ces composantes du revêtement extérieur des tubes séminifères jouent un rôle important dans l’activité fonctionnelle des cellules de Sertoli et germinales par la production de facteurs paracrine et en véhiculant les molécules issues du tissue interstitiel (Bardin et al. 1988, Skinner 1991, Mruk & Cheng 2004, Siu & Cheng 2004).
I.1.1.4. Innervation et vascularisation :
Le système testiculaire est vascularisé et drainé par un complexe d’artères et de veines qui assurent l’approvisionnement sanguin : l’artère testiculaire, les veines testiculaires et épididymaires (schéma 1).
L’artère se divise en une multitude de branches qui irriguent l’albuginée et les cloisons interlobulaires du testicule. Les veines quant à elles, se regroupent pour former le plexus pampiniforme sur le pôle dorsal du testicule. Le sang veineux testiculaire est extrêmement riche en testostérone et stéroïdes sulfates et les vaisseaux lymphatiques transportent aussi une grande quantité de stéroïdes conjugués. Ces stéroïdes seront distribués dans l’organisme pour participer au maintien des caractères sexuels secondaires.
L’innervation du complexe testiculaire est étroitement liée au système vasculaire. Les terminaisons nerveuses adrénergiques innervent les muscles lisses de la gaine péritubulaire et les vaisseaux dont elles contrôlent la vasomotricité. Le tractus nerveux testiculaire contient des fibres afférentes sensitives, impliquées dans la perception de la douleur suite à des traumatismes testiculaires [(Thibault & Levasseur 2001) page 259].
I.1.2. Composition en types cellulaires
I.1.2.1. Cellules germinales et la spermatogenèse :
Au cours de développement embryonnaire, les cellules germinales primordiales terminent leur migration depuis l’ectoderme extraembryonnaire, dans la crête génitale en suivant un signal chimiotactile (TGFb; Kit-ligand; stem cell factor) émis par les cellules de la crête génitale.
Les cellules germinales ou spermatogonies subissent plusieurs évènements de mitose, pour augmenter le stock de cellules germinales, puis de méiose avant de donner le gamète haploïde porteur du pouvoir fécondant.
Schéma I-1 : Schématisation de la structure du testicule humain.
I.1.2.1.1. Spermatogenèse
La spermatogenèse est constituée d’étapes de mitoses, méioses et spermiogenèse. Les mitoses donnent naissance aux spermatocytes de type-I qui subissent différentes étapes de méiose : prophase I (préleptotène, leptotène, zygotène, pachytène) métaphase I, anaphase I, télophase I, pour la première division réductionnelle, puis prophase II, métaphase II anaphase II et télophase II pour la méiose équationnelle. Ces processus permettent de séparer les chromosomes afin de passer de la spermatogonie diploïde aux spermatides haploïdes. Il s’en suit des étapes de maturation ou spermiogenèse (Schéma II) qui permettent aux spermatides de se développer en des spermatozoïdes complètement différenciés, mais encore incapables de féconder (voir section I.1.2.1.2). Chez certains mammifères, une température inférieure à celle du corps est nécessaire à la mise en place de toutes ces structures, conditions retrouvées dans les testicules logés dans le scrotum.
I.1.2.1.2. Spermiogenèse
Faisant suite à la dernière division méiotique, la spermiogenèse est l’étape de métamorphose des spermatides rondes en spermatozoïdes. Techniquement, après ces étapes, la spermatogonie à 2 n chromosomes donne naissance à 16 spermatozoïdes à 1 n chromosome (Schéma II). Cette phase de maturation est subdivisée en plusieurs étapes dont le nombre varie selon les espèces [(Thibault & Levasseur 2001) page 262-265]. Ces étapes nécessitent la mise en place d’un nouveau protéome et un complet remodelage de la structure de la cellule (organelles, vésicules acrosomales, flagelle et autres structures spécifiques) (van Lith et al. 2007). Brièvement, on assiste à une réorganisation des structures de la cellule. 1- ) La chromatine subit des remaniements structuraux permettant la condensation du noyau qui passe d’une forme ovoïde à une forme aplatie, allongée et polarisée. Les histones sont remplacées par les protamines, assurant la compaction de l’ADN. 2- ) Les structures de l’appareil de Golgi se regroupent en une vésicule au pole apicale pour former l’acrosome, contenant les enzymes hydrolytiques nécessaires au processus de fécondation. 3- ) La queue ou flagelle du spermatozoïde est composé de trois parties (la pièce intermédiaire, la pièce principale et la pièce terminale). Elle se développe avec la mise en place de structures dont le complexe axonémal essentiel à la mobilité du spermatozoïde et l’organisation des mitochondries autour des fibres denses externes dans la
pièce intermédiaire (de Kretser et al. 1998). L’excès de cytoplasme est expulsé du spermatozoïde et phagocyté par les cellules de Sertoli.
L’acquisition du pouvoir fécondant de ces spermatozoïdes ainsi formés se fait grâce à l’interaction avec une multitude de protéines et complexes protéiques finement régulés par l’expression, phase spécifique, d’une multitude de gènes que les spermatozoïdes rencontrent au cours de leur périple dans l’épididyme ainsi que dans le tractus femelle avant la rencontre avec l’ovocyte (Hermo et al. 2010a, Hermo et al. 2010b).
Schéma I-2 : Représentation schématique des étapes de la spermatogenèse.
Schéma adapté de http://web.archive.org/web/20051018214301/http://spiral.univ-lyon1.fr/polycops/HistologieFonctionnelleOrganes/ GenitalMasculin/gm4rd.html
I.1.2.2. Les cellules de Sertoli
Ces cellules somatiques sont présentes au sein de la gonade dès les premières étapes du développement testiculaire (13,5 jours post coïtum chez le rat). Elles produisent l’hormone anti-Müllerienne (AMH) dès les premiers stades grâce à l’expression SRY et de SOX9. L’AMH permet la différenciation du tractus génital mâle et la régression des canaux de Müller. Au cours de leur développement dans la phase embryonnaire, les cellules de Sertoli s’associent les unes aux autres au pole basale, par des jonctions de type adhérentes (Russell & Peterson 1985, Fuchs & Karakesisoglou 2001) et englobent les cellules germinales pour former l’ébauche des cordons séminifères (Griswold 1998, Mruk & Cheng 2004). Cette liaison met en place deux compartiments : un basal contenant les cellules germinales jusqu’au stade préleptotène, puis un compartiment central contenant les spermatocytes et les spermatides (Dym & Fawcett 1970, Cavicchia & Sacerdote 1988). Ces complexes de structures d’adhérence constituent la barrière hématotesticulaire qui met en place un environnement assurant une protection des spermatozoïdes contre le système immunitaire et les composés néfastes pour ces derniers (Dym & Fawcett 1970, Russell 1977, Pelletier & Byers 1992). La barrière ne laisse filtrer que des molécules de très petite taille. Les cellules de Sertoli contrôlent ainsi tous composés entrants en contact avec les gamètes en croissance et produisent les composés nécessaires au développement et à la différenciation de ces cellules (Kissinger et al. 1982, Mather et al. 1983, Griswold 1988, Griswold 1995, Siu & Cheng 2004). Les cellules de Sertoli adjacentes sont en contact avec les gamètes par des jonctions d’adhésion et des jonctions communicantes (gap junctions) qui permettent les échanges et le contrôle de la production des gamètes (Madara 1998). Certains facteurs de croissance produits par les cellules de Sertoli (IGF-1; GDNF) permettent le contrôle de la prolifération et la croissance des cellules germinales (Hofmann et al. 2005, Hess et al. 2006, He et al. 2008).
I.1.2.3. Les cellules de Leydig
Constituant du testicule, les cellules de Leydig se retrouvent groupées en amas isolés autour des capillaires sanguins et lymphatiques, entourés de la lame basale. Leur cytoplasme est riche en réticulum endoplasmique lisse et en enclaves lipidiques nécessaires à la synthèse du cholestérol qui servira dans les mitochondries et microsomes, à la stéroïdogenèse
(testostérone, estradiol, androsténediol). La production des stéroïdes par les cellules de Leydig est sous le contrôle de la LH hypophysaire. La testostérone produite dans les testicules compte pour 95 % de la production totale de l’organisme. Elle agit sur les cellules de Sertoli et permet la croissance et la différenciation des gamètes. En guise de rétrocontrôle, les cellules de Sertoli influencent la réceptivité des cellules de Leydig pour la LH [(Thibault & Levasseur 2001) page 280-281].
I.1.3. Résumé partiel :
Le testicule est donc la première base opérationnelle pour la production des spermatozoïdes qui se fait suivant des séquences finement orchestrées par les gènes exprimés par les cellules du testicule. Cette production est largement dépendante des stéroïdes produits par les cellules de Leydig. Les cellules de Sertoli isolent les spermatozoïdes du système immunitaire de l’organisme afin de garantir leur survie et leur permettre la production de structures essentielles à leur rôle dans la fécondation. Encore inachevé après sa différenciation, le spermatozoïde doit passer par l’étape de l’épididyme avant d’être éjaculé.
I.2. L’épididyme, un organe, plusieurs régions, un rôle.
« If anyone asks what the epididymis is, we shall answer that it is a vessel constituting by
various twists a body affixed to the back of the testicle » (Hinton et al. 1995). C’est par ces
mots que l’épididyme était décrit par certains pionniers de la recherche en reproduction. Il était considéré comme un tube dans lequel les spermatozoïdes sont conservés pour leur permettre de vieillir (« grandir »). Les recherches, aujourd’hui, ont permis d’aller plus loin dans la compréhension de son rôle. Les spermatozoïdes formés et libérés du testicule ne possèdent pas encore le pouvoir fécondant ni la capacité de se mouvoir. Leur différenciation et maturation n’est pas uniquement matière de temps d’incubation, mais se poursuivent dans le tube épididymaire qui met en place un environnement propice aux modifications biochimiques et structurales des spermatozoïdes. Ces cellules ayant un génome éteint du point de vue de la transcription et de la traduction, toute modification est soutenue par les cellules épithéliales de l’épididyme.
I.2.1. Anatomie de l’épididyme
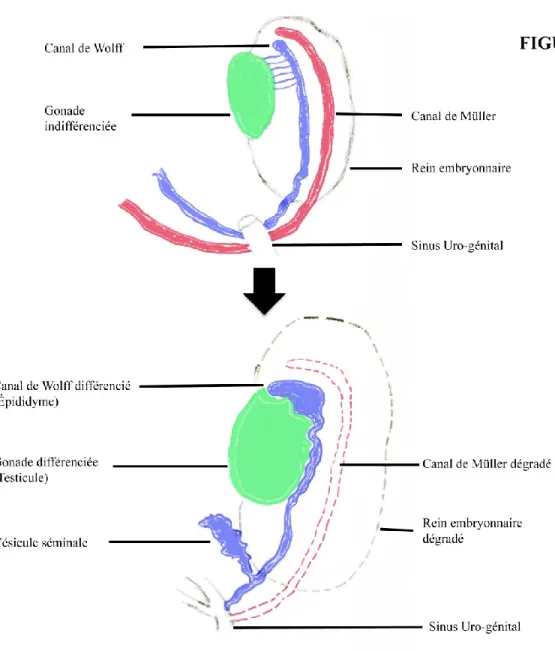
Au cours de la vie fœtale, à des moments variables selon les espèces (aux environs du quatorzième jour post-conception chez la souris; 50e chez le bovin et 8 semaines chez l’homme), le « conceptus » subit une différenciation sexuelle qui se traduit par des variations morphologiques des gonades. Pendant ces étapes dans le rein embryonnaire (mésonéphros), chez le mâle, la production de l’hormone anti Müllerienne (AMH) induit la régression des canaux de Müller en faveur des canaux de Wolff. Grâce à la testostérone testiculaire, les canaux de Wolff s’épaississent et se différencient pour former le canal déférent dans sa région postérieure et l’épididyme dans sa région antérieure. Les canules du mésonéphros se transforment, elles, en canaux efférents qui connecteront l’épididyme aux tubes séminifères testiculaires. Les vésicules séminales proviennent aussi d’un bourgeonnement de la paroi latérale externe de l’épithélium du canal de Wolff dans sa région postérieure. Ces évènements surviennent tous dans les mêmes périodes. Ainsi, l’épididyme et une grande partie des organes composant le tractus génital mâle proviennent du rein embryonnaire (Figure I-1).
Figure I-1 : Représentation schématique de la formation du tractus génital mâle.
Maturation du rein embryonnaire et du canal de wolff en épididyme.
Selon les espèces, le tubule épididymale possède une longueur variable (5 mètres chez l’homme; 60 m chez le bélier et jusqu’à 80 m chez l’étalon) (Bedford 1994) et cette longueur du tube implique qu’il soit extrêmement circonvolué. On distingue trois principales régions anatomiques : la région antérieure ou tête (caput), la région
intermédiaire ou corps (corpus) et la région caudale ou queue (cauda) qui se termine par le canal déférent. Ces régions séparées par des travées conjonctives sont caractérisées par des variations morphologiques flagrantes chez certaines espèces (Taureau, Verrat), mais moins visibles chez l’homme par exemple. Il est à noter que les rongeurs possèdent « le segment initial », une quatrième région anatomique de l’épididyme (Belleannee et al. 2012b). Région qui, comme son nom l’indique, occupe la première région de l’épididyme et se situe en amont de la région de la tête.
D’un point de vue structural, la paroi du tube épididymaire est un épithélium pseudostratifié entouré par une couche de cellules musculaires lisses qui assurent un péristaltisme permanent, contrôlé par des fibres nerveuses noradrénergiques et cholinergiques (Setchell et al. 1994).
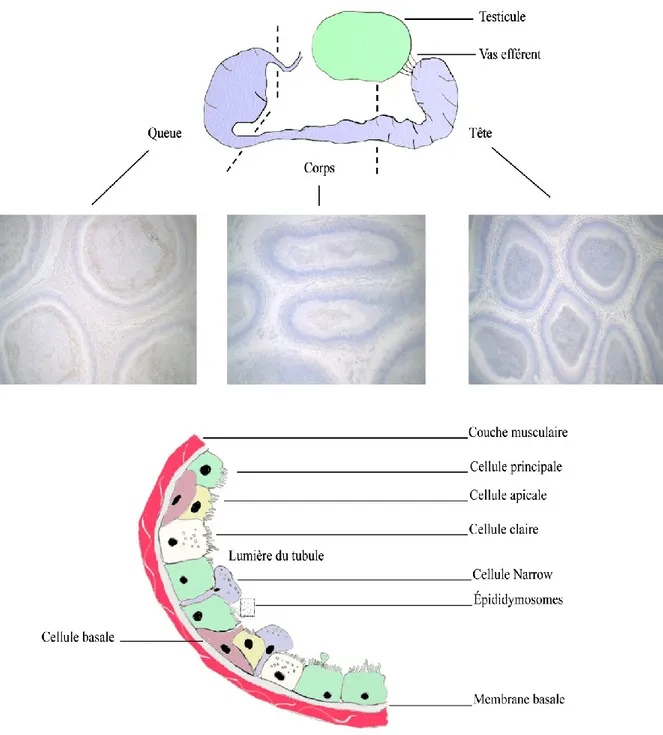
On peut distinguer dans l’épithélium du tube épididymaire, selon l’espèce étudiée, six (6) types cellulaires (Figure I-2).
I.2.1.1. Cellules principales
Présentes sur toute la longueur de l’épididyme, elles reposent sur la membrane basale. Ces cellules constituent entre 65 et 80 % de la population totale de cellules épithéliales de l’épididyme. Elles ont une morphologie allongée avec un pôle apical présentant des microvillosités. La taille des cellules et la longueur des microvillosités diminuent tout au long de l’épididyme pour atteindre un minimum dans la région caudale (Joseph et al. 2011) peut-être dû à la pression exercée par le stockage des spermatozoïdes dans cette région de l’organe. L’une des fonctions principales connues pour les cellules principales est la synthèse de protéines et leur sécrétion dans la lumière du tube épididymaire (Abe et al. 1983) pour servir à générer un environnement propice à la maturation des spermatozoïdes. Elles expriment des canaux ioniques et des transporteurs telle l’aquaporine 9 (AQP9), les pannexins, la chloride channel protein (CLC3), la membrane-associated carbonic anhydrase (CAIV) (Kaunisto et al. 1995, Pastor-Soler et al. 2001, Isnard-Bagnis et al. 2003, Turmel et
al. 2011). À l’instar de leur morphologie, les propriétés sécrétrices des cellules principales
Figure I-2 : Représentation schématique de la structure de l'épididyme. Nous avons
I.2.1.2. Cellules apicales et Narrow
Ces deux types cellulaires se retrouvent dans l’épithélium de la région proximale de l’épididyme (Segment initial et caput) (Adamali & Hermo 1996). Les noyaux de ces cellules sont situés dans leur région apicale où la membrane est en contact avec la lumière de l’épididyme. Les cellules étroites (Narrow) se prolongent quant à elles entre les cellules principales pour atteindre la région basale de l’épithélium épididymaire. Leur cytoplasme est riche en vacuoles, vésicules endocytiques, lysosomes et mitochondries qui attestent de leur activité endocytique et sécrétrice. Ces deux types cellulaires ne présentent que de légères différences dans la production des enzymes impliquées dans la voie d’endocytose lysosomale. L’expression de l’anydrase carbonique de type II (CAR2) est spécifique aux cellules étroites, mais les enzymes lysosomales cathepsin D et beta-hexosaminidase A sont présentes dans les deux types cellulaires (Hermo et al. 2000). De concert avec les cellules claires, les cellules étroites sont responsables de l’acidification du fluide épididymaire en contrôlant le flux de protons (H+ V-ATPase) et la résorption des ions bicarbonates (Breton
et al. 1999, Bagnis et al. 2001).
I.2.1.3. Cellules claires
Larges cellules présentes dans l’épithélium tout le long de l’épididyme, leur nombre augmente lorsqu’on s’éloigne des régions proximales. Les cellules claires sont riches, comme les cellules étroites, en mitochondries, vésicules, corps multivésiculaires, lysosomes et gouttelettes lipidiques (Hermo et al. 1988, Hermo et al. 1992, Joseph et al. 2011) tous regroupés dans la région apicale de la cellule. La présence en grand nombre des organelles d’endocytose confère à ces cellules le plus fort pouvoir d’endocytose de l’épithélium épididymaire (Hermo et al. 1988). Elles sont responsables entre autres de la régulation du pH par l’acidification active du fluide luminal par l’action des pompes à protons (H+ V-ATPase) (Shum et al. 2008, Shum et al. 2009) ainsi que de l’endocytose et de la lyse de bon nombre de protéines et structures membranaires (gouttelettes cytoplasmiques) présentes dans la lumière de l’épididyme (Hermo et al. 1988, Vierula et al. 1995).
I.2.1.4. Cellules basales
Les cellules basales quant à elles, sont situées à la base de l’épithélium en contact avec la lame basale. Elles représentent 15 à 20 % du total des cellules de l’épithélium possèdent de fines projections entres les cellules principales, qui leurs permettent un contact avec la lumière de l’épididyme (Marengo & Amann 1990, Adamali & Hermo 1996). Ces prolongements permettent à ces cellules d’échantillonner le fluide et ainsi réguler leur fonction et celle des cellules avoisinantes. Cette régulation s’effectue grâce à des interactions cellules - cellules, à l’exemple de la détection de l’angiotensine II luminal par les récepteurs à angiotensine de type II, exprimés par les cellules basales, permettant ainsi la régulation du pH par les cellules claires (Shum et al. 2009). Leur contact avec la lame basale leur permettrait aussi de récupérer certains composés sanguins pour les transférer aux cellules avoisinantes et dans le fluide (Cheung et al. 2005, Shum et al. 2008).
I.2.1.5. Cellules à halo
Cellules de type immunitaire (lymphocytes TH, lymphocytes T cytotoxiques, macrophages) que l’on retrouve tout le long de l’épididyme avec une abondance dans la région proximale (Nashan et al. 1989, Seiler et al. 1999). Elles sont néanmoins isolées de la lumière épididymaire et donc des spermatozoïdes par la barrière hématoépididymaire. Leur rôle exact dans cet environnement immunosupprimé, reste encore à découvrir.
I.2.2. La lumière du tube épididymaire, un espace immunosupprimé.
Les cellules de l’épithélium de l’épididyme sont liées entre elles de façon cohésive grâce à la présence en leur pôle apical, de jonctions serrées composées de structures de type zona occludens, zona adherens et desmosomes. La synergie entre ces différentes structures assure une étanchéité de ces liaisons et forme ainsi la barrière hématoépididymaire (Hoffer & Hinton 1984, Mital et al. 2011). Cette barrière assure l’intégrité du milieu intra-luminal en empêchant l’entrée de molécules provenant du système sanguin ou lymphatique et d’un autre point de vue, elle empêche la fuite des protéines et composés spécifiques du fluide épididymaire.
À cette barrière physique (anatomique), s’ajoute un système de barrières physiologiques composé des transporteurs membranaires qui importent ou exportent des composés (transporteurs de D-glucose, d’ions, d’eau, de bicarbonate, d’acide aminé, de L-carnitine, de xénobiotiques) (Turner et al. 1980, Hinton & Howards 1981, Hinton & Howards 1982). Bon nombre de ces transporteurs se retrouvent au niveau basal de l’épithélium pour faire passer les molécules du système sanguin vers la lumière de l’épididyme (Brooks et al. 1973, Hinton & Hernandez 1987, Radigue et al. 1996). La barrière physiologique assure donc le maintien d’un environnement spécifique propice à la maturation des spermatozoïdes. C’est une structure dynamique qui assure et fait face aux variations du milieu tout au long de l’épididyme. Un défaut dans un de ces transporteurs peut mener à une variation du milieu qui se répercutera sur la fertilité de l’individu. Exemple des souris invalidées pour le gène cRos (ROS1) qui ont un dérèglement dans la concentration intraluminale de glutamate, phosphate inorganique et aussi au niveau du pH. Il en résulte des spermatozoïdes incapables de réguler leur volume dans un milieu hypotonique (Sonnenberg-Riethmacher et al. 1996, Yeung et al. 1999a, Wagenfeld et al. 2002, Xu et al. 2003, Yeung et al. 2004).
En troisième lieu, la barrière est renforcée par une veille immunologique. Les cellules du système immunitaire présentes sur la partie externe de l’épithélium et dans le tissu interstitiel (macrophages, lymphocytes T CD4+ et CD8), n’ont pas de contact direct avec la lumière du tube et les molécules autoantigéniques des spermatozoïdes présentes dans le fluide épididymaire, ne sont pas acheminées vers l’extérieur (Dym & Romrell 1975, Beagley et al. 1998). L’absence du système immunitaire dans ce tube n’implique pas l’absence de système de défense contre des pathogènes à l’instar de l’abondance des Beta-defensins, peptide antimicrobien (Patil et al. 2005, Zhou et al. 2013, Dorin & Barratt 2014). On y retrouve aussi certains facteurs immunorégulateurs (Pollanen & Cooper 1994). Contrairement à l’énoncé précédent concernant les cellules du système immunitaire, il a été démontré récemment la présence d’un réseau de certaines cellules dendritiques qui présentent des prolongements membranaires au travers des jonctions de la barrière physique pour entrer en contact avec le fluide et les spermatozoïdes dans la région proximale de l’épididyme dans le but d’échantillonner le fluide et de maintenir l’immunotolérance (Da Silva et al. 2011).
I.2.3. Un organe avec une diversité de protéines produites
Le fluide épididymaire, dans lequel baignent les spermatozoïdes dans la lumière du tube, est riche de par sa diversité en protéines. Sa composition diverge de celle du sang ou tout autre liquide physiologique. On retrouve au niveau du fluide, dans la tête de l’épididyme, des protéines et composés provenant des humeurs testiculaires produites en grande partie par les cellules de Sertoli. Ces protéines sont rapidement détruites ou diluées par d’autres protéines produites localement. Cette grande variété protéique change tout au long de l’épididyme, confrontant ainsi les spermatozoïdes à des cocktails protéiques variés, nécessaires à leur maturation (Turner et al. 2003). Ces protéines, produites par les cellules constituant l’épithélium de l’épididyme (cellules principales, cellules claires), sont sécrétées suivant deux voies : Une sécrétion de type apocrine, générant des microvésicules (épididymosomes) et une de type mérocrine.
La variété dans les protéines produites tout le long de l’organe est imputable à la variation dans le profil d’expression des gènes. En effet, chaque région de l’épididyme possède un profil d’expression génique différent et cette compartimentalisation induit des expressions protéiques segments spécifiques (Johnston et al. 2005, Zhang et al. 2006, Dube et al. 2007, Jelinsky et al. 2007, Johnston et al. 2007, Thimon et al. 2007, Guyonnet et al. 2009). Chaque segment en devient spécialisé dans une étape de la production de spermatozoïdes matures et fertiles : caput et corpus dans l’acquisition de la motilité et du pouvoir fécondant (Turner 1995); La cauda dans le stockage des spermatozoïdes avant l’éjaculation (Jones & Murdoch 1996). L’intégrité de ce milieu est d’une importance capitale pour la genèse de spermatozoïdes fertiles, à l’exemple des souris dépourvues du récepteur à oestrogène ESR1 qui présentent des problèmes de réabsorption du liquide testiculaire au niveau de segment initial. Ce phénotype a été relié au dérèglement de l’expression de certaines protéines (SLC9A3, CAR2, AQP1 et AQP9) impliquées dans le maintien de l’équilibre fluidique. Ce dérèglement se répercute sur les spermatozoïdes qui en sont moins vigoureux, moins mobiles et incapables de féconder même in vitro (Joseph et al. 2011).
I.2.4. Régulation de l’expression génique dans l’épididyme
L’occurrence d’une telle variabilité structurale et d’expression génique implique l’existence d’une fine régulation sous le contrôle de plusieurs facteurs.
I.2.4.1. Facteurs testiculaires lumicrines
Le fluide, produit par les cellules de Sertoli et les cellules germinales, baignant les spermatozoïdes à leur sortie du rete-testis est riche en diverses molécules, dont les facteurs de croissance (FGF) et hormones stéroïdiennes couplés à des transporteurs (Cotton et al. 2008). Des expériences d’ablation du testicule ou d’obstruction du vas efférent chez le rat et la souris, empêchant ainsi le passage du fluide et des spermatozoïdes du testicule vers l’épididyme, a résulté en une variation de l’expression des gènes épididymaire, une baisse de la synthèse et sécrétion protéique et à de l’apoptose dans le segment initial (Holland et
al. 1992, Fan & Robaire 1998, Hinton et al. 1998, Lan et al. 1998, Hermo et al. 2000). Ces
variations ne sont pas uniquement imputables aux hormones stéroïdes puisqu’un apport d’androgènes ne permet pas de renverser le phénotype apoptotique (Fawcett & Hoffer 1979). Les facteurs impliqués dans cette régulation sont encore inconnus, mais des pistes mènent aux facteurs de croissance (Lan et al. 1998) et à l’influence des spermatozoïdes eux-mêmes.
I.2.4.2. Facteurs spermatiques
Reyes-Moreno et ses collaborateurs (2008) ont pu montrer l’influence pro-proliférative, température dépendante, des spermatozoïdes éjaculés, débarrassé du fluide séminal, sur des cultures primaires de cellules de l’épithélium de tête, du corps et de la queue de l’épididyme. Le facteur spermatique réel n’est lui aussi pas spécifiquement identifié, mais des évidences penchent sur l’activité de l’aromatase (production d’oestrogènes à partir de testostérone) présente sur les spermatozoïdes. L’oestrogène produit activerait plusieurs gènes de l’épididyme (Hess et al. 1995) impliqués dans la résorption de l’eau (AQP9) (Belleannee et al. 2009). Les spermatozoïdes testiculaires possèdent aussi l’enzyme gACE (germinal Angiotensin I-Converting Enzyme) qu’ils libèrent dans le fluide épididymaire
(Metayer et al. 2002). Cette enzyme convertit l’angiotensine I en angiotensine II qui est impliquée dans la réabsorption de l’eau.
I.2.4.3. Facteurs de croissance
Le testicule produit, de façon continue, les facteurs de croissance qui sont utilisés par les cellules de l’épithélium du segment initial de l’épididyme. L’ajout de FGF2 (Fibroblast Growth Factor 2) à une expérience d’obstruction du canal efférent, permet de restaurer l’activité de l’enzyme GGT (γ— glutamyl transpeptide) (Lan et al. 1998). Cela implique donc une régulation de l’expression des gènes via les récepteurs à FGF (Fgfr) dans le segment initial (Kirby et al. 2003). L’activation de la voie des récepteurs à FGF permettrait le maintien des voies de signalisations anti-apoptotiques dans le segment initial.
I.2.4.4. Hormones stéroïdiennes androgène et oestrogène
Produite en grande quantité par les cellules de Leydig, la testostérone atteint l’épididyme par le fluide luminal et par la circulation sanguine. Elle joue un rôle très important dans le maintien de la structure de l’épididyme. Elle est impliquée dans les fonctions telles que le métabolisme, le transport d’ions, la synthèse et sécrétions des protéines épididymaires ainsi que la maturation spermatique (Bilinska et al. 2006). La testostérone dans le fluide est couplée à des ABP (androgen binding protein), elles aussi d’origine testiculaire (Danzo et
al. 1977), qui permettent l’internalisation de la testostérone dans les cellules principales de
la tête de l’épididyme où l’ effet des androgènes est le plus marqué (Sipila et al. 2006, Hamzeh & Robaire 2010). La testostérone y est métabolisée par la 5-alpha réductase en DHT (Dihydrotestostérone) biologiquement plus actif ou en E2 (oestrogène) par l’aromatase que l’on retrouve aussi dans les spermatozoïdes (Joseph et al. 2011).
Les androgènes régulent l’expression génique dans l’épididyme via les voies de signalisation MEK, ERK ½ et CREB (Hamzeh & Robaire 2011) ou par la formation de complexes avec les récepteurs à androgènes qui se fixent sur les gènes possédant la séquence consensus (Janne et al. 2000, Heinlein & Chang 2002). Il vient alors l’action de co-activateurs ou corépresseurs qui déterminent la résultante (Malovannaya et al. 2011). Par orchidectomie bilatérale ou utilisation d’antagonistes de récepteurs à androgènes (Kaur
plusieurs gènes androgène-dépendants ont été identifiés, parmi lesquels, cystein-rich secretory protein 1 (Crisp1), glutathione peroxidase 5 (Gpx-5), carbonic anhydrase, angio-tensinogen [(Kohane et al. 1983, Rigaudiere et al. 1992, Kaunisto et al. 1999, Leung et al. 2000) respectivement] subissent des modifications. La DHT (androgène biologiquement plus actif) a une action ciblée sur les gènes de facteurs de croissance (Egf, Igf1, Igfbp3), facteurs impliqués dans la prolifération cellulaire (Bmp4, Edn1), protéines de Gap Junction (Gja1, Gjb3, Gja4) et les récepteurs aux interleukines impliquées dans la réponse immunitaire (Il13ra2, Il1rl1) (Hamzeh & Robaire 2010). Le rôle des androgènes ne se limite pas qu’à la régulation de l’expression génique, mais aussi à la survie cellulaire (Fan & Robaire 1998).
L’oestrogène produit par l’aromatase testiculaire ou présent dans les spermatozoïdes, se fixe sur les récepteurs à oestrogène (ESR1 ou ESR2) qui à leurs tours se fixent sur les éléments de réponse aux oestrogènes (ERE) présents sur la région promotrice des gènes. L’oestrogène cible les gènes impliqués dans l’équilibre hydrique de la lumière de l’épididyme (AQP9; Angiotensine II) (Bilinska et al. 2006, Joseph et al. 2011). Certains gènes possèdent des éléments de réponse aux androgènes et aux oestrogènes (AQP9), ce qui implique la nécessité d’un contrôle minutieux du niveau de ces deux hormones notamment par l’inactivation du E2 via sa sulfatation par l’enzyme EST chez le bovin (Frenette et al. 2009).
I.2.4.5. Facteurs autres
I.2.4.5.1. La pression
La vasectomie est une intervention chirurgicale consistant à rompre la continuité entre la partie distale de la queue de l’épididyme et le vas déférent, obstruant ainsi la queue distale et empêchant le passage des spermatozoïdes lors de l’éjaculation. Les études ont montré une variation dans le profil d’expression de certains gènes épididymaux suite à cette intervention : DCXR, Niemann–Pick disease, type C2 (NPC2), DEFB126, ADAM7 (Thimon et al. 2008, Sullivan et al. 2011, Belleannee et al. 2013). Ces variations peuvent être imputées à l’augmentation de la pression intraluminale exercée par les spermatozoïdes et le fluide qui s’accumule au niveau de la queue obstruée. Légare et ses collaborateurs
(2001) ont montré un déplacement de la région d’expression du gène DCXR de la région du corps (région d’expression normale) vers les régions plus proximales. Ils ont postulé que cette variation serait due à la modification morphologique subie par l’épithélium de l’épididyme. Ces modifications ne touchent pour autant pas tous les gènes (Legare et al. 2004).
I.2.4.5.2. Variations thermiques
La température joue un rôle important dans la physiologie de la reproduction chez les mammifères et cela s’observe par le positionnement extérieur des gonades mâles (testicules) dans le scrotum (sauf le cas de l’éléphant) à une température 1 à 2 °C inférieure à celle de l’organisme (Bedford 1991, Wang et al. 1997). De même que la spermatogenèse (cas de cryptorchidie), il a été démontré que le stockage des spermatozoïdes dans la queue de l’épididyme et les sécrétions protéiques par les cellules épididymaires sont sensibles à la température (Bedford & Yanagimachi 1991, Regalado et al. 1993, Reyes-Moreno et al. 2008). Lorsque la température de l’épididyme augmente pour atteindre celle de l’organisme, on observe une surexpression des gènes bcl-2 et bax, appartenant à la famille de gènes proapoptotique BCL2, et une induction de l’apoptose des cellules principales de l’épithélium (Jara et al. 2002).
I.2.4.5.3. Petits ARNs
Les petits ARNs (siRNA; microRNA; piwi-associated RNA) sont connus pour leur rôle dans la régulation de la transcription des gènes dans plusieurs organes (Plasterk 2006). Leur rôle dans l’acquisition et le maintien de la fertilité a aussi été démontré dans le testicule (Papaioannou & Nef 2010, Romero et al. 2011). Bon nombre de ces miARNs ont été identifiés dans l’épididyme chez l’homme (Zhang et al. 2010, Belleannee et al. 2012a) et une ablation du gène Dicer, nécessaire à la maturation des miARNs, dans le segment initial chez la souris, mène à une dédifférenciation du tissu (Bjorkgren et al. 2012).
I.2.4.5.4. Sécrétions épididymaires (épididymosomes)
Le flux du fluide épididymaire est continu. Les protéines produites par les cellules en amont sont acheminées en aval où elles agissent sur les spermatozoïdes ou sur les cellules