Université de Montréal
Analyse du CMH de classe chez l’omble de fontaine (SalvelinusfontinaÏis) et résistance à Aeromonas salmonicida
par
Philippe D’Autray Tarte
Département de Microbiologie et Immunologie Faculté de Médecine
Mémoire présenté à la Faculté des études supérieures en vue de l’obtention du grade de M.Sc en Microbiologie et Immunologie
Septembre, 2004
.4y Grade conféré \
/. à cornperdu (L
200% NO, f ;
w
(35
LJ2
V,
de Montréal
Direction des bibliothèques
AVIS
L’auteur a autorisé l’Université de Montréal à reproduire et diffuser, en totalité ou en partie, par quelque moyen que ce soit et sur quelque support que ce soit, et exclusivement à des fins non lucratives d’enseignement et de recherche, des copies de ce mémoire ou de celle thèse.
L’auteur et les coauteurs le cas échéant conservent la propriété du droit d’auteur et des droits moraux qui protègent ce document. Ni la thèse ou le mémoire, ni des extraits substantiels de ce document, ne doivent être imprimés ou autrement reproduits sans l’autorisation de l’auteur.
Afin de se conformer à la Loi canadienne sur la protection des renseignements personnels, quelques formulaires secondaires, coordonnées ou signatures intégrées au texte ont pu être enlevés de ce document. Bien que cela ait pu affecter la pagination, il n’y a aucun contenu manquant. NOTICE
The author of this thesis or dissertation has granted a nonexclusive license allowing Université de Montréal to reproduce and publish the document, in part or in whole, and in any format, solely for noncommercial educational and research purposes.
The author and co-authors if applicable retain copyright ownership and moral rights in this document. Neither the whole thesis or dissertation, nor substantial extracts from it, may be printed or otherwise reproduced without the author’s permission.
In compliance with the Canadian Privacy Act some supporting forms, contact information or signatures may have been removed from the document. While this may affect the document page count, it does not represent any loss of content from the document.
Université de Montréal faculté des études supérieures
Ce mémoire intitulé
Analyse du CMH de classe 11f3 chez l’omble de fontaine (SalveÏinusfontinalis) et résistance à Aeromonas salmonicida
Présenté par:
Philippe D’Autray Tarte
a été évalué par un jury composé des personnes suivantes:
Réai Lallier président-rapporteur Pierre Belhumeur Directeur de recherche Louis Bematchez Codirecteur Marc Drolet membre du jury
C
Table des matières
Abréviation.vi
Remerciements vii
Liste des tableaux ix
Liste des figures x
Résumé xii Abstract xiii Revue de Littérature 1 1.] Aerornonas salmonicida 1 1.1.1 Historique 1 1.1.2 Taxonomie et classification 1 1.1.3 Généralités 2 1.1.3.1 Furonculose: définition 2
1.1.3.1.1 Signes et symptômes distinctifs 2
1.1.3.1.2 Infection suraigué! aigué / chronique 3
1.1.3.1.3 Phénoméne du porteur sain 4
1.1.3.2 Espèces touchées 4 1.1.3.3 Apparition saisonnière 5 1.1.3.4 Transmission 5 1.1.4 Pathogenèse 6 1.1.4.1 Facteur de virulence 6 1.1.4.1.1 Structures de surface 6 1.1.4.1.1.1 La couche A ou «A-layer » 6 1.1.4.1.1.2 LPS 8 1.1.4.1.2 Produits excrétés 8 1.1.4.1.2.1 Protéases 9
1.1.4.1.2.2 Toxine endommageant les membranes 9
1.1.4.1.2.2.1 GCAT 9
1.1.4.1.2.3 Autres toxines 10
1.2 Système Immunitaire des Poissons 11
1.2.1 Principaux organes 11
1.2.1.1 Rein 11
1.2.1.2 Thymus 12
1.2.1.3 Rate 12
1.2.1.4 Les tissus associés aux muqueuses 13
1.2.2 Défense non spécifique 13
1.2.2.1 Humorale 13 1.2.2.2 Cellulaire 14 1.2.3 Défense spécifique 15 1.2.3.1 Humorale 16 1.2.3.2 Cellulaire 18 1.2.4 CMH 21 1.2.4.1 Introduction 21 1.2.4.2 Structure et fonctions 21 1.2.4.3 Polymorphisme 23 1.2.4.4 Le CMH de classe II 25
1.2.4.5 Influence du CMH sur la reproduction 26
1.2.4.6 Influence du CMH sur la résistance aux maladies 27
1.3 Prophylaxie chez les poissons contreA. sainionicida 29
1.3.1 Antibiotiques 29
1.3.2 Vaccination traditionnelle 30
O
1.3.3 Vaccination passive 313 Matériel et méthodes .35
3.1 Souches bactériennes 35
3.2 Culture et conservation des souches bactériennes 35
3.3 Animaux utilisés lors de l’étude 35
3.4 Laboratoire d’infection 36
3.4.1 Généralités 36
3.4.2 Système de refroidissement 37
3.4.3 Système de filtration et d’aération 37
3.4.4 Système d’éclairage 39
3.4.5 Monitoring des différents paramètres 39
3.4.6 Période d’adaptation 40
3.4.7 Généralités lors des infections 40
3.5 Vaccination passive contre A. saïrnonicida 41
3.5.1 Production des anticorps contre A. salmonicida chez le lapin 41
3.5.1.1 Vérification de la spécificité des anticorps 42
3.5.1.1.1 Purification des protéines de la membrane externe (OMP) 42
3.5.1.1.2 Préparation des protéines totales 43
3.5.1.2 Westem-Blot 43
3.5.1.3 FACS 44
3.5.2 Détermination d’une DL5O 45
3.5.3 Essai de protection du vaccin par injection 46
3.6 Résistance chez l’omble de fontaine vs CMH 1113 47
3.6.1 Souche Rupert et Lavai 47
3.6.2 Détermination des allèles par SSCP 48
3.6.2.1 Extraction d’ADN 48
3.6.2.1.1 Extraction d’ADN total (pour quelques échantillons) 49
3.6.2.1.2 Extraction avec le système MontageTM BAC96 Miniprep Kit de Millipore 50 3.6.2.2 Amplification de l’exon 2 de la chaîne13du CMH de classe II 50 3.6.2.3 Analyse des allèles par SSCP (Single Strand Conformational Polymorphism) 52
3.6.3 Séquençage des différents allèles obtenus par SSCP 53
3.6.3.1 Extraction d’ADN des bandes découpées sur gel et 2ième amplification par PCR 53 3.6.3.2 Purification sur gel agarose, récupération des bandes et clonage 54
3.6.3.3 Miniprep et digestion HaeII 54
3.6.3.4 Séquençage 54
3.6.4 Production de familles expérimentales 55
3.6.5 Maintien des familles et transport des poissons 56
3.6.6 Epreuve d’infection des familles à la furonculose 57
3.6.7 Analyse des résultats (génotypage) 59
3.6.7.1 Extraction d’ADN et PCR de l’exon 2(TAQ) 59
3.6.7.2 Identification des allèles par digestion Ahi I 59
3.6.7.3 Analyse statistique 60
4 Résultats 62
4.1 Croissance d’Aeronzonas saïrnonicida 62
4.2 Vaccination Passive contre A. salmonicida 62
4.2.1 Création d’anticorps et vérification de la spécificité des anticorps 62
4.2.1.1 Western Blot 62
4.2.1.2 FACS 64
4.2.2 Expérimentation DL5O 65
4.2.3 Expérimentation de vaccination passive 66
4.3 CMH 1113 vs résistance chez l’omble de fontaine 68
4.3.1 Souche Rupert 68
4.3.1.1 SSCP (détermination des allèles) 68
4.3.1.2 Séquence des différents allèles 69
4.3.1.3 Test de résistance /Analyse statistique 70
4.3.1.3.1 Test de résistance 70
4.3.1.3.3 Analyse statistique .74
Ç
4.3.1.3.3.1 Influence du poids 764.3.1.3.3.2 Analyse globale 76
Nombre d’aIIèIe 77
Temps de survie moyen transformé 77
(Allèle A) 77
Temps de survie moyen transformé 77
(Allèle B) 77
Temps de survie moyen transformé 77
(Allèle D) 77 Ecart-type 77 O 77 1 77 2 77 5 Discussion 78 6 Conclusion 87 7 Références 89 ANNEXE I xiv ANNEXE II xvi
ANNEXE III xvii
ANNEXE IV xix
Q
Abréviation• CMH : Complexe majeur d’histocompatibilité
• GCAT: Glycérophospholipide Cholestérol AcylTransférase • LPS t Lipopolysaccharide
• TSA t Tripticase Soy Agar
• DL5O t Dose létale tuant50%
• LARSA : Laboratoire Régional des Sciences Aquatiques • Mtl : Montréal
• SSCP: Single Strand Conformationnal Polymorphism
• PCR: Réaction de polymérase en chaîne (Polymerase Chain Reaction) • QTL t Quantitative Tract Loci
• GLM t Modèle général linéaire « General Linear Model»
• OMP: Protéines de la membrane externe (Outer Membrane Proteins) • FACS t fluorescent Activated Cell Sorting
Remerciements
Je désire remercier dans cette section toutes les personnes ayant participé de près ou de loin à l’élaboration et à la réalisation de ce projet de recherche. J’aimerais remercier plus particulièrement:
• Le docteur Pierre Beffiumeur, professeur agrégé au département de Microbiologie et d’Immunologie de l’Université de Montréal pour m’avoir permis de réaliser ce projet, son support constant et son grand dévouement durant les deux années de ma maîtrise.
• Le docteur Louis Bematchez, professeur agrégé du département de biologie de l’Université Laval pour ses nombreux conseils et son grand savoir au niveau de la génétique des poissons.
• M. Sébastien Croisetière, agent de recherche dans le laboratoire du Dr Beihumeur pour ses nombreux conseils, le développement des protocoles d’identification des allèles, de même que l’identification des alièles pour la souche Rupert, ainsi que son aide précieuse tout au long des étapes du projet.
• Le docteur Réai Lallier, Directeur du Réseau Aquaculture Québec (RAQ), pour son énorme implication au niveau du projet de vaccination et ses grandes connaissances au sujet des infections chez les poissons.
• M. Daniel Proulx, administrateur scientifique du Réseau Aquaculture Québec (RAQ), pour m’avoir transmis une partie de ses nombreuses connaissances sur le maintien des salmonidés en laboratoire et ses nombreux conseils.
• M. Guy Peny, stagiaire post-doctoral au laboratoire du Dr Bematchez pour son aide au niveau du maintien des poissons, de la création des familles et pour avoir donné un sens à toutes ces données.
• M. Martin Clément, agent de recherche dans le laboratoire du Dr Beihumeur pour ses connaissances et son aide précieuse au niveau de la biologie moléculaire.
o
• M. Robert Gélinas, propriétaire de la pisciculture d’Arthabaska inc., pour son implication lors de la frai, pour nous avoir fourni les nombreuses truites
mouchetées nécessaires aux tests d’infection et pour son support au niveau de la recherche sur les salmonidés.
• M. Serge Higgins, directeur du laboratoire régional des sciences aquatiques (LARSA), pour son aide au niveau du maintien des 24 familles de truites mouchetées de souche Rupert pendant 1 an et son implication lors de l’identification des poissons.
• M. Serge Sénéchal, Mme Annie-Claude Mihaille et M. Daniel Morency pour leur implication au niveau du développement de la caractérisation des antisérums de lapins
• L’organisme Valorisation Recherche Québec (VRQ) pour le financement du projet et de ma bourse de recherche
• Tous les étudiants du laboratoire du Dr Beïhumeur pendant ces 2 années, plus particulièrement Karine Lainesse et Kathleen Couillard.
• Tous les membres du Département de Microbiologie et d’Immunologie de la faculté de Médecine de l’Université de Montréal.
o
Liste des tableaux
I. Horaire d’injection pour la production d’anticorps anti —A. salmonicida chez 4 lapins 41
U. Conditions expérimentales utilisées dans les essais de protection de l’omble de fontaine à l’aide des
immunsérums de lapin contre Aeromonas saïrnonicida 46
III. Schéma de reproduction pour les géniteurs domble de fontaine de souche Rupert avec leurs génotypes
respectifs au niveau du CMH classe 11F3 48
IV. Moyenne et variance du poids (g) chez les différentes familles d’omble de fontaine de souche Rupert...56
V. Familles d’omble de fontaine de souche Rupert utilisées lors des infections du 7 et 15 octobre 2002 57
VI. Corrélation entre le poids et le temps de survie post infection pour la progéniture de chacun des géniteurs (truite mouchetée) utilisés lors de l’expérimentation et déterminée par analyse de variance par régression
linéaire 75
VII. Acides aminés en position 5 à 10 retrouvés chez plusieurs allèles de l’exon 2 du CMII de classe 11f3 du saumon atlantique (Langefors et al., 2001) et de l’omble de fontaine de souche Rupert 86
Liste des figures
1. Représentation schématique de la surface cellulaire de Aeromonas salmonicida
-Inspirée de Kay et Trust (1991) 7
2. Structure de la forme sécrétée des immunoglobulines téléostéens (tétramère)- Inspiré de Kaattari et
Piganelli (1996) 17
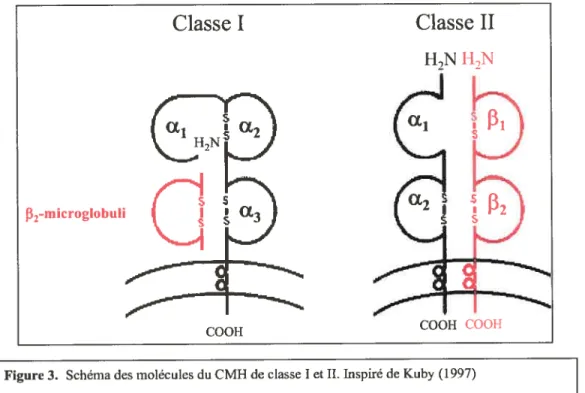
3. Schéma des molécules du CMH de classe I et II -Inspiré de Kuby (1997) 22
4. Schéma de l’organisation génétique des gènes du CMH de classe II x etf3chez le saumon atlantique
(Saïrno satat) -Inspiré de Stet et al. (2002) 26
5. Laboratoire d’infection de l’Université de Montréal 38
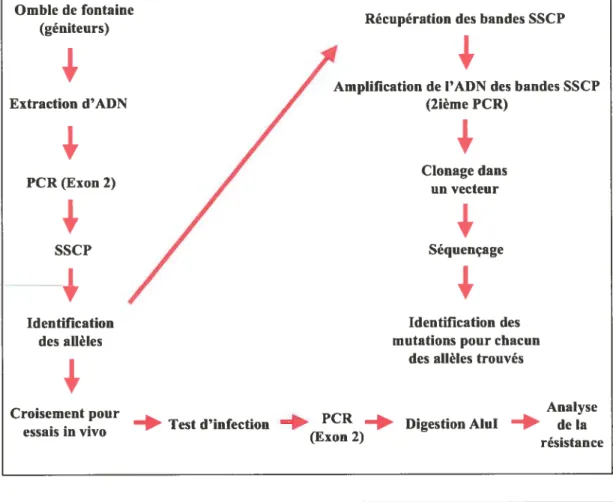
6. Représentation schématique des différentes étapes nécessaires au projet de détermination de la
résistance à A. salmonicida vs le CMH de classe IIf3 pour l’omble de fontaine 49
7. Représentation schématique des oligonucléotides utilisés pour l’amplification par PCR de l’exon 2 de
la chaîne f3 du CMH de classe II 51
8. Spécificité des antisérums de lapin anti-A erornonas saïrnonicida détectée par Western Blot chez différents extraits protéiques provenant de Aeromonas salmonicida et Yersinia ruckeri 63
9. Analyse de la spécificité des anticorps produits en lapin (4) par la méthode de FACS (Fluorescent
Activated Cdl Sorting) 64
10. Pourcentages de mortalité obtenus chez l’omble de fontaine (30g) pour trois différentes concentrations bactériennes (l0, l0, 106cellules/ml), en fonction du temps post infection lors des essais de
détermination de la DL5O pour le pathogène Aeromonas saïmonicida 01-3526 65
11. Pourcentages de mortalité obtenus chez l’omble de fontaine (30g) pour six différentes conditions, en fonction du temps post infection lors des essais de vaccination à l’aide d’antisémms produits en lapins
contre le pathogène Aeromonas satrnonicida 01-3526 67
12. Allèles A, 3, C, D, E et f de l’exon 2 du CMH de classe IIf3 présents chez différentes ombles de
13. Séquences d’ADN des allèles A, B, D, E et F de l’exon 2 du CMH de classe 1113 retrouvées chez
l’omble de fontaine de souche Rupert 69
14. Séquences en acides aminés des allèles A, B, D, E et F de l’exon 2 du CMH de classe 11f3 retrouvées
chez l’omble de fontaine de souche Rupert 70
15. Distribution des mortalités(%) suite aux tests de résistance àA. salmonicida chez les différentes familles d’omble de fontaine de souche Rupert lors du premier réplicat de l’expérimentation 71
16. Distribution des mortalités(%)suite aux tests de résistance àA. saïrnonicida chez les différentes familles d’omble de fontaine de souche Rupert lors du deuxième réplicat de l’expérimentation 72
17. Allèles A, B et D de l’exon 2 du CMH de classe 1113 présents chez différentes ombles de fontaine de souche Rupert, différenciés par digestion du produit de PCR à l’aide de l’enzyme Alu I et migration
sur gel de polyacrylamidc 73
18. Patron de restriction Alu I des allèles A, B et D de l’exon 2 du CMH de classe 1113 de l’omble de
fontaine de souche Rupert 74
19. Temps de survie post infection transformé (x°”) en fonction du nombre d’allèle (A, B, D) du CMH de classe 1113 chez l’omble de fontaine de souche Rupert selon une analyse globale effectuée par GLM de
régression partielle 77
20. Allèles P, H, I et L de l’exon 2 du CMH de classe 1113 présents chez différentes truites mouchetées de souche Laval (poisson 2, 12, 30 et 5) et différenciés par la méthode du SSCP xiv
21. Séquences en acides aminées des allèles P, H, I et L de l’exon 2 du CMH de classe 1113 retrouvées chez
l’omble de fontaine de souche Laval xv
C
RésuméL’industrie piscicole étant de plus en plus active au Québec, de nombreux problèmes semblent être récurrents à ce type de pratique. Parmi les nombreuses infections pouvant être reliées à l’aquaculture, l’une des principales sources de mortalité semble être la furonculose causée par le pathogène bactérien Aeromonas salmonicida. Deux principales approches ont été utilisées dans le cadre de cette recherche afin de mettre au point de nouvelles techniques pour contrôler les infections à Aerornonas salmonicida affligeant un membre de la famille des Salmonidae, l’omble de fontaine. Le premier volet de cette recherche a consisté à mettre au point une vaccination passive à l’aide d’antiséra de lapin administrés oralement et efficaces contre A. saïmonicida chez l’omble de fontaine. Les résultats des essais de protection par vaccination ont démontré un effet protecteur des antisérums (10 à 100 fois la LD5O). Le deuxième volet a consisté à démontrer une résistance accrue procurée par certains allèles du CMH de classe 1113 face à A. salmonicida chez l’omble de fontaine. Nous avons donc identifié 5 allèles (A, B, D, E, F) chez 62 parents géniteurs d’omble de fontaine de souche Rupert. Vingt-quatre familles ont été formées à partir de ces géniteurs et leur progéniture a été analysée au point de vue de leur résistance face à une infection à A. saïmonicida. Suite au génotypage de ces individus, des évidences tendent à démontrer que le CMH de classe 1113 semble être associé à la résistance à A. salmonicida. Notamment, il a été démontré que le nombre et la présence de l’allèle A est associée à une résistance accrue à la furonculose (P=0,0134) de même que pour l’allèle B (P=0,0727).
Mots clés : Aerornonas saïmonicida, Omble de fontaine, Vaccination passive, CMH,
Abstract
Piscicultural industiy being increasingly active in Quebec, many problems seem recurrent with this type of practice. Among the many infections related to aquaculture, one of the main cause of mortahty seems to be the furunculosis caused by a bacteria named Aeromonas salmonicida. Two approaches will be studied in this research in order to develop new techniques to control the infections caused by Aerornonas saïrnonicida afflicting a member of the family of the Salmonidae, the brook charr. The first part of this research consisted in developing an effective passive vaccination using rabbit antiserum and orally administrated against A. saïmonicida, using the brook charr. Protection challenge using IP injection of the antiserum have shown that the vaccine offers an increased protection against ffie disease (10 to 100 times the LD5O). The second part of the work consisted in identifying alleles of the MHC class 11f3 that confer an increased resistance to A. salmonicida in brook charr. We have identified 5 alleles (A, B, D, E, F) from 62 lineages of brook charr from Rupert strain. 24 families have been created using these parents and their progeny have been challenged to determinate their resistance against A. salmonicida. Some evidences show that association can be made between MHC class 1113 and furunculosis resistance. We have also demonstrated that the number and the presence of allele A (P=0,0134) and allele B (P=0,0727) is correlated with an increased resistance against furunculosis.
Key words: Aerornonas satrnonicida, Brook charr, Passive vaccination, MHC, Resistance
1 .1 Aeromonas salmonicida 1.1.1 Historique
Le pathogène Aeromonas saïmonicida, l’agent étiologique de la furonculose chez les salmonidés, est depuis une centaine d’années, identifié comme un pathogène important chez le poisson. En effet, c’est en Allemagne en 1894 qu’Emmerich et Weibel isolèrent le pathogène pour la première fois, suite à une épidémie dans une pisciculture de truites brunes. Depuis ce temps, un bon nombre d’études ont reconnu la présence de plusieurs sous-espèces de cette bactérie permettant l’élaboration d’une taxonomie détaillée de cette espèce. De plus, d’autres études montrèrent que cette bactérie est aussi retrouvée en milieu naturel (Duff et Stewart, 1933; Fish, 1937, Hiney et Olivier, 1999). Aeromonas saïmonicida est certainement le pathogène de poisson le plus étudié à ce jour à cause de sa distribution géographique très étendue, de la grande variété de poissons pouvant être infectés et des effets économiques dévastateurs d’une épidémie sur l’industrie piscicole.
1.1.2 Taxonomie et classification
Aeromonas saïrnonicida est une bactérie Gram négative faisant partie de la famille des Vibrionaceae. Membre du genre Aeronzonas, A. saïrnonicida est la seule bactérie psychrophile appartenant à ce genre. Sa subdivision a été premièrement établie entre le A. salmonicida typique (référant à la furonculose classique) et le A. salmonicida atypique. Selon la neuvième édition du Bergey’s Manual ofDeterminative Bacteriology (Hol et al., 1994), A. saïrnonicida est subdivisé en 4 sous-espèces distinctes saïrnonicida, mascoucida, achrornogenes et srnithia. La première de ces sous-espèces représente la forme typique de A. saïrnonicida tandis que les trois autres réfèrent à la forme atypique préalablement mentionnée. Des évidences tant au niveau phénotypique que génotypique ont clairement révélé que la sous-espèce saïnionicida forme un groupe très homogène tandis qu’il existe beaucoup plus de variations chez les 3 autres sous-espèces (Cipriano, 2001). En effet, les analyses moléculaires et génotypiques des formes atypiques ne
1.1.3 Généralités
1.1.3.1 furonculose: définition
La furonculose est l’une des principales maladies associées avec le pathogène bactérien Aerornonas saïmonicida. Cette maladie est répandue à travers le monde entier et est principalement associée aux salmonidés. Elle est définie comme une bactérémie généralisée avec des lésions focalisées dans les muscles. Le pathogène responsable de cette infection est Aerornonas salmonicida subsp. salmonicida. Cependant, la furonculose n’est qu’une des nombreuses maladies associées à cette espèce bactérienne. En effet, d’autres maladies comme la maladie ulcérative des truites «Trout Ulcer Disease », la maladie ulcérative du poisson rouge «Goldfish ulcer disease» et
l’érythrodermatite de la carpe «Carp Erythrodermatitis » sont aussi causées par le même pathogène bactérien.
1.1.3.1.1 Signes et symptômes distinctifs
La furonculose classique chez les salmonidés, comme son nom l’indique, est caractérisée par les lésions cutanées et musculaires qu’elle cause (furoncle). Ces lésions quoique spectaculaires, ne sont pas retrouvées chez toutes les formes de furonculose et constituent même l’exception plutôt que la règle (Bemoth, 1997). Plusieurs manifestations cliniques de la maladie sont facilement identifiables chez les différents types de furonculose comme un noircissement cutané, un refus alimentaire, l’exophtalmie, des hémorragies au niveau des viscères, une liquéfaction des reins, un foie pâle et la rate gonflée (Stoskopf 1993). Les auteurs ont donc identifié 3 principales formes de la furonculose se retrouvant chez les salmonidés soit la forme suraigu, aigu et chronique tel que décrit dans la revue de Hiney et Olivier (1999).
1.1.3.1.2 Infection suraigu/aigu / chronique
La forme suraigu de la furonculose se retrouve principalement chez les très jeunes salmonidés. Cette forme est très difficilement identifiable par le manque de signes cliniques apparents. Cependant, un léger noircissement de la peau, une légère augmentation du rythme respiratoire, de même qu’une légère exophtalmie peuvent être observés. De par leur déficience immunitaire, les alevins infectés par ce type de septicémie ne survivent généralement pas suite à la contamination.
La forme aigu de la maladie affecte principalement les jeunes poissons en croissance. Cette forme de la maladie est celle où les principaux signes de la furonculose sont observés. Les principaux signes externes sont le noircissement de la peau, des hémorragies à la base des nageoires, un refus alimentaire, des difficultés natatoires ainsi qu’un comportement apathique. Comme son nom l’indique, cette forme de la maladie cause la mort du poisson infecté en 2 ou 3 jours post infection et il n’y a habituellement pas de développement de furoncle étant donné la courte durée de la maladie. Il est à noter que plusieurs signes internes sont aussi présents lors du développement de la maladie comme des hémorragies sur les parois abdominales, chez les viscères et dans le coeur du poisson infecté. Une augmentation de la taille de la rate, des hémorragies au foie et des nécroses au niveau des tissus parenchymateux peuvent aussi être observées chez cette forme de la maladie.
La troisième forme de furonculose est la forme sous-aigus ou chronique. Elle est principalement retrouvée chez les poissons plus âgés. C’est principalement chez cette forme que les furoncles peuvent être observés. Dans ce type d’infection, il y a aussi un noircissement cutané, mais de façon moins prononcé. Les signes de manque d’appétit, de léthargie, d’exophtalmie et d’hémorragie à la base des nageoires peuvent aussi être retrouvés chez cette forme de la maladie. Pour ce qui est des signes internes, les salmonidés infectés présentent généralement une congestion viscérale générale et une péritonite. La mortalité pour cette forme de la maladie est faible et certaines cicatrices peuvent être laissées suite à une guérison des lésions.
C
1.1.3.1.3 Phénomène du porteur sainUne des principales caractéristiques permettant la transmission de la furonculose dans les piscicultures est le fait que certains poissons peuvent être infectés sans qu’aucun signe clinique ne soit apparent. Cette caractéristique est connue depuis presque aussi longtemps que la furonculose elle-même (Hiney et Olivier, 1999). La nature de cette infection cachée reste cependant méconnue. Une définition générale de ces infections a été formulée par Hiney et al. (1997) et se caractérise par la présence de A. saïmonicida, de ces antigènes ou de son ADN dans ou sur un poisson ne manifestant aucun signe clinique de la furonculose. Malgré la connaissance du phénomène depuis plus de $0 ans, il n’y a aucune certitude face à la localisation des bactéries dans les poissons porteurs. Plusieurs hypothèses ont été avancées. Une de celles-ci décrit la présence de la bactérie à l’extérieur du poisson, sur la couche de mucus, sur les nageoires et dans l’intestin (Klontz, 196$; Markwardt et Klontz 19$9b; Cipriano et al., 1992; Hiney et al., 1994). Une localisation interne de la bactérie a aussi été avancée par certains auteurs (Hiney et al., 1997; Nomura et al., 1991a b; idem, 1992). Étant donné le manque d’information sur ce type d’infection et le manque de test fiable de détection, le test de prédilection semble être l’induction de stress chez les poissons. permettant la déclaration de la maladie chez les porteurs sains (Hiney et aÏ. 1994; Cipriano et al. 1997).
1.1.3.2 Espèces touchées
Presque tous les poissons sont susceptibles aux infections à A. salmonicida à des niveaux variables (revue dans Hiney et Olivier, 1999). Cependant, pour ce qui est de la furonculose, les espèces de la famille des salmonidés sont les plus sensibles. Toutefois, il y a une grande étendue de sensibilité même chez les salmonidés. La truite brune (Saïmo tr;ttta), l’omble de fontaine (Salvelinus fontinalis) et le saumon atlantique (Salmo salar) sont considérés comme étant très sensibles à la furonculose tandis que la truite arc-en-ciel (Salmo gairdneri) semble très peu sensible (Cipnano et Hartwell 1$$6; McCarthy 1977). De plus, chez la même espèce, la susceptibilité à la furonculose peut varier entre les différentes lignées, rendant cette caractéristique très intéressante pour le développement de lignées résistantes (Cipriano et al., 2002).
La furonculose est principalement une maladie associée au stress chez les poissons (Olivier, 1983). Ces stress peuvent se manifester sous différentes formes comme les dommages physiques, une qualité d’eau non conforme, la présence de parasites ou d’ autres maladies, une diète inadéquate et des stress d’ordre manutentionnaire effectués par le pisciculteur (Olivier, 1997; Pickering, 1997). Deux périodes de l’année sont particulièrement propices au développement de la maladie. La première de ces périodes est le début de la saison estivale où deux principaux facteurs sont en cause. Premièrement, l’élévation de la température semble être le principal facteur ayant une influence sur le déclenchement des épisodes de furonculose en pisciculture (Mainar, 1988). Le second facteur est le fait que cette période constitue le temps de l’année où les pisciculteurs procèdent à la transition eau douce/eau salée chez certaines espèces. Les changements physiologiques ayant lieu lors de ce transfert abaissent l’efficacité du système immunitaire ce qui a une incidence directe sur les infections (Maule et al.. 1986). La deuxième période propice se situe lors de la frai où les changements physiologiques chez les poissons ont pour effet d’abaisser le système immunitaire des poissons (Hiney et Olivier, 1999).
1.1.3.4 Transmission
Le principal mode de transmission horizontale de A. salmonicida est par contact avec des porteurs sains asymptomatiques. Le pathogène est soit distribué d’un poisson à l’autre par contact direct ou bien par le largage de bactéries dans le bassin par ces porteurs sains. (Cipriano, 2001). De plus, la maladie peut aussi être transmise par l’entremise de matériel contaminé, A. salmonicida étant capable de résister plus de 6 jours sur un filet sec (McCarthy, 1977). La bactérie résiste aussi plusieurs jours en eau douce, eau saumâtre, eau salée et plusieurs mois dans la vase de rivière sans perdre son pouvoir pathogène (McCarthy, 1977). Il a aussi été démontré que la bactérie peut se disperser par aérosols, rendant encore plus facile la dissémination de la maladie dans un lieu d’élevage où les bassins sont très rapprochés les uns des autres (Bowseer, 1996).
C
1.1.4 PathogenèseLe pathogène A. saïrnonicida, comme tout pathogène extracellulaire possède une multitude de facteurs, permettant l’infection de l’hôte, la résistance aux défenses de l’hôte et sa transmission d’un individu à l’autre. Ces facteurs nécessaires à sa survie sont donc présentés dans cette section.
1.1.4.1 Facteur de virulence
On distingue deux principales catégories chez les différents facteurs de virulence de A. salmonicida: les structures de surface cellulaire et les produits extracellulaires sécrétés par la cellule.
1.1.4.1.1 Structures de surface
1.1.4.1.1.1 La couche A ou «A-layer»
L’une des principales caractéristiques de A. salmonicida est la présence à sa surface d’une couche protéique supplémentaire nommée la couche A «A-layer». Il a été
démontré que cette couche, associée à la surface externe de la paroi cellulaire, était présente chez les souches virulentes de A. salmonicida (Udey, 1978). Sa présence est absolument nécessaire à la virulence de la souche bactérienne. En effet, il a été démontré que la virulence d’un mutant isogénique est substantiellement diminuée par rapport à la souche sauvage (Kay et aI., 1981). De plus, plusieurs auteurs ont affirmé que les souches typiques possédant la couche A sont virulentes chez les poissons et capables de former de tels agrégats, tandis que des souches ne la possédant pas ne sont pas virulentes et incapables de former des agrégats cellulaires (Kay et al., 1984; Kay et Trust, 1997). La principale composante de cette couche est la protéine A, une protéine insoluble dans l’eau, hydrophobe et possédant un poids moléculaire de 49 kilodaltons (Cipriano, 2001). La protéine A est localisée à la surface de la cellule sous forme d’un treillis régulier répété et structuré de façon tétragonale (Kay et al. 1981) et est codée par le gène vapA (Chu et al., 1991). Sa présence est non seulement limitée aux souches typiques, mais
aussi aux sous-espèces atypiques de la bactérie (Hamilton et al., 1981). De plus, la
couche A se retrouve directement attachée à la membrane externe bactérienne par son
association avec l’antigène O des lipopolysaccharides (LPS) (Kay et Trust, 1991).
Plusieurs fonctions ont été décrites pour la couche A depuis sa découverte comme
principal facteur de virulence. En effet, la couche A de A. salmonicida est une couche
protéique multifonctionnelle unique et constitue la première couche S à laquelle on a
désigné une fonction. (Kay et Trust, 1991). Une des premières fonctions décrites a été
celle de barrière de protection contre les protéases et le complément (Munn et al., 1982). De plus, il a été démontré que la couche A possède la fonction de lier spécifiquement les IgG et les IgM présents dans le sérum (Phipps et Kay, 1988). Il a même été proposé que
la capacité de lier tes immunoglobulines et d’autres protéines extracellulaires pourrait
permettre à la bactérie de masquer à sa surface les récepteurs immunogéniques, permettant sa dissimulation face au système immunitaire de l’hôte (Kay et Trust 1997). Une autre dc ses fonctions serait de promouvoir la pénétration bactérienne et de faciliter
l’adhésion aux cellules de l’hôte (Garduno et al., 2000). Dc plus, ces auteurs ont
ç
(
LPS: antigèrie-O Couche A{
D
LPS: au ou “core”D
Protéines membranaircsFigure I Représentation schématique de la surface cellulaire deAeroînonassalmonicida.
déterminé que ce pathogène est invasif et qu’une phase intracellulaire de la bactérie est possible pour sa réplication dans les cellules non phagocytaires. Finalement, la charge négative nette conférée par la couche A serait aussi responsable de sa survie prolongée dans l’eau (Sakai, 1986).
1.1.4.1.1.2 LPS
Les lipopolysaccharides (LPS) constituent le deuxième facteur de virulence associé aux membranes de A. salmonicida. Ces chaînes sont retrouvées de façon commune chez les bactéries Gram négatives. Ces chaînes sont composées de deux principaux constituants soit un lipo-oligosaccharide de faible poids moléculaire, situés sous la couche A et un LPS de haut poids moléculaire, contenant les chaînes de polysaccharide O traversant la couche A (Hiney et Olivier, 1999). Ces chaînes O contribuent à la résistance au complément et, comme cité auparavant, servent à l’attachement de la couche A sur la surface cellulaire (Trust et al., 1996). En effet, des mutants sans chaînes O relâchent la couche A dans le surnageant de culture, étant incapables de la fixer sur les membranes. Il est aussi à noter que seules les souches de A. saïrnonicida possédant une couche A et des LPS intacts sont virulentes chez l’omble de fontaine (Cipriano et Blanch, 1989).
1.1.4.1.2 Produits excrétés
Lors de l’infection par A. salmonicida, le développement des signes cliniques est médié par l’action de différents produits sécrétés par la cellule dans le milieu. Ces différentes enzymes constituent une partie très importante des facteurs de virulence étant donné que l’injection d’un extrait de matériel extracellulaire de A. salmonicida seul a entraîné la mort de poissons susceptibles à la furonculose (Ellis, 1991). Dans la revue effectuée par Ellis (1997) sur ce sujet, les produits sécrétés ont été subdivisés en trois groupes bien distincts soit les protéases, les toxines endommageant les membranes ainsi que les autres toxines.
1.1.4.1.2.1 Protéases
C’est en 1975, que pour la première fois une protéase a été extraite d’un extrait cellulaire et fut capable d’induire des lésions sous forme de furoncle chez le poisson (Shieh et MacLean, 1975). Depuis cette découverte, les différentes protéases de A. salmonicida ont été caractérisées de façon plus précise. La principale protéase présente chez A. saïmonicida est une protéase aikaline à sérine de 70 kDa thermosensible (Tajima et al. 1984). Cette protéase, extraite des produits extracellulaires, possède une DL5O de 2,4 jig/g lorsque injectée chez de jeunes saumons tout en produisant des hémorragies et une liquéfaction musculaire (Lee et Ellis, 1989). Il a aussi été démontré dans cette étude que cette protéase ainsi que la principale hémolysine (GCAT) présente chez A. salmonicida, lorsque combinées ensemble, ont un effet additif pour la toxicité envers les poissons. La protéase à sérine est codée par le gène aspA (Coleman et aI., 1993). La protéase à sérine aspA n’est pas essentielle à l’infection par A. salmonicida, mais une étude a révélé un rôle de la protéase dans l’activation de l’hémolysine GCAT (Vipond et al., 1998). Une étude de Price et al. (1989) a aussi démontré la production de deux types de protéases: l’une de 70 kDa (semblable à celle décrite par Tajima et al., 1984) capable de digérer la caséine ainsi que la gélatine et une autre protéine de 20 kDa digérant la gélatine et non la caséine. De plus, une métalloprotéase fut aussi isolée avec une activité maximale à pH 7,5 et 40°C contre la gélatine et l’azocoll, mais non contre la caséine (Arnesen et al., 1995).
1.1.4.1.2.2 Toxine endommageant les membranes 1.1.4.1.2.2.1 GCAT
Le facteur extracellulaire le plus toxique connu à ce jour chez A. salmonicida est une lipase bactérienne capable d’utiliser le cholestérol comme accepteur d’acyl (Vipond et al., 1998). Elle est nommée glycerophospholipid: cholestérol acyltransferase (GCAT) et forme une protéine d’environ 25 kDa (Lee et Ellis, 1990). C’est associé en complexe avec le LPS (complexe: 2000kDa) que le GCAT possède des effets hémolytiques chez
C
les érythrocytes de poisson, leukocytolytiques et cytotoxiques. De plus ce complexe estlétal pour le saumon atlantique lorsque injecté à une concentration de 0,045 .tg/g (DL5O)(Lee et Ellis, 1990). Selon la même étude, la présence du LPS dans le complexe ne semble pas affecter l’activité enzymatique du GCAT libre, mais aurait plutôt un rôle à jouer dans la stabilisation de l’enzyme. En effet, lorsque complexé au LPS, le GCAT est plus stable à la chaleur et son activité hémolytique et létale est 8 fois plus élevée. Comme cité auparavant, le complexe GCAT/LPS et la protéase à sérine ont un effet additif sus la létalité chez le poisson. Lorsque analysée séparément, la dose minimale considérée comme létale chez le saumon atlantique est 55 fois plus élevée pour la protéase que pour le complexe GCAT/LPS (Lee et Ellis, 1989). Toutefois lorsque ces facteurs sont combinés, la dose minimale létale de ces produits extracellulaires dépend non seulement des concentrations absolues de la protéase et du GCAT/LPS mais aussi de leur concentration relative (Lee et Ellis, 1990). Par la suite, il a été démontré par infection avec des mutants ne pouvant pas exprimer soit le GCAT ou la protéase à sérine que ces deux toxines ne sont pas essentielles à l’infection bactérienne (Vipond, 1998). Cette observation soulève donc de nombreuses questions par rapport aux facteurs de virulence. Le GCAT et la protéase ne constituent donc que deux toxines non essentielles faisant partie d’un ensemble de facteurs permettant le développement de la furonculose chez le poisson.
1.1.4.1.2.3 Autres toxines
D’autres toxines ont aussi été identifiées chez A. salmonicida. L’une d’elle est la H lysine dont la nature est encore inconnue (Ellis, 1997). Cette protéine est active sur les érythrocytes d’une grande variété d’espèces. De plus, deux peptides hémolytiques (ASH3 et ASH4) ont été découverts par Hirono et Aoki (1993). Ces peptides ont la capacité de lyser les érythrocytes de poisson et leurs séquences offrent une grande homologie avec le gène d’aerolysine de A. hydrophila (ASH3) et d’une famille de gènes communs à plusieurs espèces des Vibnonaceae (ASH4) (Ellis, 1997).
C
1.2 Système Immunitaire des PoissonsLes différents progrès en terme de développement d’une vaccination efficace contre A. saïrnonicida durant la dernière décennie ont permis aussi d’augmenter de façon substantielle les connaissances du système immunitaire des poissons (Hiney et Olivier, 1999). En général, la plupart des composantes du système immunitaire du poisson sont similaires à celles retrouvées chez les vertébrés supérieurs. Cette section sera donc consacrée à résumer les connaissances sur le système immunitaire retrouvé chez le poisson en mettant un accent particulier sur les interactions de celui-ci avec le pathogène A. salmonicida.
1.2.1 Principaux organes
Les organes responsables de la réponse immunitaire constituent l’une des principales différences du système immunitaire du poisson avec celui des vertébrés supérieurs. Les principaux organes lymphoïdes composant le système immunitaire du poisson sont le rein, le thymus, la rate ainsi que les tissus lymphoïdes associés aux muqueuses comprenant la. peau, l’estomac et les ouïes (Press et Evensen, 1999).
1.2.1.1 Rein
Le rein est un organe lymphoïde de première importance chez les téléostéens et consiste en deux segments de structure similaire la partie antérieure «head kidney», et la partie
médiane et postérieure (Zapata et al., 1996). Ces deux régions possèdent une fonction hématopoïétique. Cependant, cette fonction est plus prononcée dans la région antérieure qui a perdu toutes fonctions excrétrices (Zapata, 1979). Cette dernière région constitue majoritairement un compartiment lympho-myéloïde (Press et Evensen, 1999). Le rein des téléostéens, constituant un réservoir et un site de différenciation des cellules précurseurs du sang est phylogénétiquement lié à la moelle osseuse des vertébrés supérieurs (Zapata, 1979). De plus, la présence de macrophages, de lymphocytes T et B a été observée chez le rein des téléostéens, soulignant un rôle important des tissus
un producteur majeur d’anticorps et le parenchyme de la région antérieure possède la capacité de séquestrer les antigènes pour de longue période (Brattgjerd et Evensen, 1996). Cette dernière caractéristique révèle un rôle possible de cet organe dans la mémoire immunologique (Press et al., 1996).
1.2.1.2 Thymus
Le deuxième organe lymphoïde primaire est le thymus. Chez le thymus, deux parties distinctes peuvent être identifiées, soit la couche externe ou cortex et la couche interne ou medulla (Press et Evensen, 1999). Le cortex contient habituellement une densité plus élevée de thymocytes que la medulla. De plus, le thymus est l’organe contenant les macrophages (Zapata et al., 1996), les monocytes (Castillo et aÏ., 1990), les cellules géantes multinucléées (Pulsford et al., 1991), les mélanomacrophages (Pulsford et al., 1991), les cellules myoïdes (Zapata et Cooper, 1990) et les cellules exprimant des immunoglobulines (Loon et al., 1981). Finalement, des expériences menées sur la migration de thymocytes marqués et sur les effets de la thymectomie sur la maturation du système immunitaire suggèrent que le thymus des téléostéens possède la même fonction que celui des vertébrés supérieurs, soit d’être la source principale de cellules T immunocompétentes (Zapata et al., 1996).
1.2.1.3 Rate
La rate est considérée chez le poisson comme un organe lymphoïde secondaire. Les tissus de la rate, dont la fonction est de filtrer le sang en séquestrant et en s’occupant des antigènes, ne sont pas très développés chez les téléostéens dus à l’abondance de tissus lymphohématopoïétiques rénaux (Zapata et al., 1996). La rate peut être divisée en deux parties bien distinctes soit la pulpe rouge et blanche. La pulpe rouge, qui occupe la majorité de l’organe, contient des macrophages et des lymphocytes (Press et Evensen, 1999). Des cellules liant les antigènes et produisant des immunoglobulines ont aussi été
pour sa part peu développée et est majoritairement constituée de mélanomacrophages impliqués dans la destruction des érythrocytes (Press et Evensen, 1999).
1.2.1.4 Les tissus associés aux muqueuses
Les tissus associés aux muqueuses des téléostéens sont composés de l’intestin, de la peau et des ouïes. Ces tissus, composés d’une couche de mucus et d’éléments de défense du système immunitaire non spécifique, sont exposés directement à l’environnement extérieur et constituent la première ligne de défense contre les pathogènes (Dalmo et al., 1997). L’intestin de ces poissons contient donc des populations de leucocytes incluant les macrophages, les lymphocytes, les mastocytes, les granulocytes et les cellules du plasma (Georgopoulou et Vemier, 1986). Ces cellules sont aussi présentes au niveau des ouïes et de la peau, et les antigènes peuvent aussi être séquestrés par ces épithéliums (Press et Evenberg, 1999).
1.2.2 Défense non spécifique 1.2.2.1 Humorale
Le sérum, le mucus et les oeufs de poisson contiennent plusieurs substances capables d’inhiber la croissance des pathogènes. Ces substances sont habituellement des protéines ou des glycoprotéines et leurs cibles avec lesquelles elles interagissent sont retrouvées chez plusieurs pathogènes (Yano, 1996). Parmi ces nombreuses enzymes, deux sous-ensembles ont été formés par Ellis (1999). Le premier de ces sous-ensembles est constitué des substances capables d’inhiber la croissance bactérienne. La première substance de cette catégorie sont les transferrines, séquestrant le fer et empêchant sa disponibilité aux bactéries. La seconde est constituée des antiprotéases comme la a2-macroglobuline. Cette substance possède la capacité de neutraliser les toxines protéolytiques produites par les bactéries dont certaines toxines secrétées par A. salmonicida (Salte et al., 1992). Finalement, les lectines sont capables de lier certains sucres et ont été retrouvées chez les oeufs, le mucus et le sérum de plusieurs espèces de
C
poissons (Ellis, 1999). Chez les oeufs de saumon coho, il a été démontré que la lectinepossédait la capacité d’agglutiner A. saïrnonicida (Youssif et al., 1 994a).Le second sous-ensemble est constitué des substances capables de provoquer la lyse bactérienne. Ces substances comprennent premièrement les peptides anti-bactériens possédant la capacité de désorganiser les membranes bactériennes. De plus, on retrouve chez le mucus de la peau de plusieurs espèces de poisson, des protéases avec une activité semblable à la trypsine. La troisième de ces substances est la protéine C réactive qui réagit avec la phosphorylcholine, un composant des structures de surface retrouvé chez les bactéries, les champignons et les parasites. Ce composé possède la caractéristique d’activer le complément et ainsi d’activer les défenses menant à la lyse et à la phagocytose (Ellis, 1999). Finalement, les deux derniers produits sont le lysozyme et le complément. Le lysozyme est une enzyme capable d’hydrolyser des constituants de la couche de peptidoglycan de la paroi bactérienne. Cette enzyme est retrouvée dans le mucus, le sérum, les oeufs et les tissus riches en leucocytes. Une étude a démontré que le lysozyme provenant d’oeufs de saumon coho a un effet bactéricide à une concentration de 700 ig/m1 sur A. salmonicida (Yousif et al., 1994b). Le complément, pour sa part, consiste en un système de protéines du sérum agissant de façon centrale chez plusièurs mécanismes de défense de l’hôte. Les téléostéens possèdent les deux voies de la cascade du complément soit la voie classique et la voie alterne, comparables à celles des mammifères (Yano, 1996). Cependant, la voie alterne, étant indépendante des anticorps, semble être plus importante chez les poissons que chez les mammifères (Ellis, 1999). L’activation de ce système se fait par les LPS de la paroi cellulaire des bactéries gram négatives et peut mener à la lyse de la bactérie par les cellules phagocytaires (Ellis,
1999).
1.2.2.2 Cellulaire
Plusieurs types cellulaires sont impliqués dans la réponse immunitaire non spécifique. En effet, une variété de leucocytes y participe incluant les monocytes/macrophages, les granulocytes (neutrophiles, éosinophiles et basophiles) et les cellules cytotoxiques non
spécifiques (Secombes, 1996). Les macrophages des poissons sont similaires à ceux des vertébrés supérieurs par leur morphologie et leurs fonctions. Ils agissent ainsi comme des cellules présentatrices d’antigènes, sécrétrices de cytokines et cellules effectrices (phagocytose) (Olivier, 1999). Les principaux phénomènes impliquant les défenses non spécifiques cellulaires sont l’inflammation et la phagocytose. L’inflammation est définie comme la réponse à une invasion microbienne et/ou un endommagement tissulaire menant à une accumulation locale de leucocytes et de fluides (Secombes, 1996). Les macrophages et les granulocytes sont des cellules phagocytaires mobiles retrouvées dans le sang et dans les tissus lymphoïdes secondaires, et sont particulièrement importants lors de l’inflammation. La phagocytose est le processus par lequel les cellules intemalisent, tuent et digèrent les agents infectieux. Ce processus est considéré comme un mécanisme important de défense non spécifique tout en étant impliqué dans le processus initial de la réponse immunitaire spécifique (Olivier, 1983). Les macrophages et les granulocytes (neutrophiles et dans certain cas les éosinophiles) sont les principales cellules phagocytaires et peuvent ingérer une grande variété de particules inertes ou antigéniques, ainsi que des ligands solubles (Secombes, 1996). De plus, il a été démontré par Lamas et Ellis (1994) que les neutrophiles isolés du saumon atlantique migrent en la présence de A. saïmonicida, démontrant l’importance de ces mécanismes dans la réponse immunitaire face à ce pathogène.
1.2.3 Défense spécifique
En plus des nombreux éléments du système de défenses non spécifiques, les poissons possèdent un système complet de défenses spécifiques semblables aux mammifères. En effet, ils constituent dans l’évolution l’un des premiers groupes possédant un système spécifique complet, étant le groupe le plus primitif possédant un système composé du CMH et des récepteurs des cellules T (Nakanishi et al., 1999). Toutefois, ce système reste, en terme évolutif, très primitif par rapport au système des mammifères et la prochaine section aura pour but de décrire les différentes composantes du système de
défenses spécifiques des téléostéens, en mettant l’emphase sur les différences avec celui des mammifères.
1.2.3.1 Humorale
La principale caractéristique des défenses humorales spécifiques des téléostéens est la capacité de celui-ci de produire des anticorps. Cet élément de défense nécessitant la participation des cellules B, des cellules Tauxiiiiaires et des cellules présentatrices d’antigènes a été trouvé chez tous les téléostéens étudiés jusqu’à maintenant (Kaattari, 1992). La principale différence entre les immunoglobulines des téléostéens et des mammifères consiste en la présence majoritaire d’une seule classe d’immunoglobuline chez les poissons semblable au IgM des mammifères. La structure des IgM des téléostéens est très similaire à celle des mammifères, possédant une région f ab (liaison à l’antigène) et Fc (carboxy-terminale). Cependant, chez les téléostéens, la molécule est majoritairement retrouvée sous forme de tétramères composés de quatre sous-unités monomériques, chacune possédant deux chaînes lourdes
(—
72kDa) et deux chaînes légères(-
27kDa) (Kaatari et Piganelli, 1996). Ceci diffère de la structure monomérique et pentamérique retrouvée chez les mammifère (Janeway et al., 2001). En résumé, les anticorps sont formés par les chaînes lourdes (2) et légères (2) formant des paires liées par des ponts disulfures. Ces paires sont jointes ensemble par les chaînes lourdes avec le même type de lien disulfure formant ainsi une molécule d’anticorps (Watts et al., 2001). Les différents monomères sont liés ensemble par des liaisons covalentes via des ponts disulfiires ou bien de façon non covalentes (Kaattari et Piganeïli, 1996). La région variable correspondant à la région fab est formée de la portion N-terminale des chaînes lourdes et légères constituant ainsi le site de liaison à l’antigène. De plus, chacun des monomères est identique dans la molécule tétramérique (Kaattari et Piganelli, 1996).La variabilité dans le pooi d’anticorps est assurée par l’épissage aléatoire des régions codant pour des éléments de structure, par l’association des différentes chaînes lourdes et légères lors de leur formation par les cellules B et par le processus des mutations somatiques (Kaattari et Piganelli, 1996). De plus, malgré le manque de diversité au
niveau des classes d’anticorps, les téléostéens sont capables de générer une grande variété d’immunoglobulines de structure différente par la distribution non uniforme du type de
liaison moléculaire liant les différents monomères. Ces différences de liaison
moléculaire (covalente, non covalente) vont donc jouer sur la flexibilité de la structure du tétramère (Kaattari et Piganelli, 1996). Cette dernière caractéristique constitue une autre différence de ce système avec celui des mammifères.
Les différentes fonctions des immunoglobulines des poissons sont semblables à celles des
mammifères. Parmi ces fonctions, on retrouve la capacité des anticorps d’effectuer la
neutralisation de toxines produites par les agents pathogènes, la capacité de précipitation et d’agglutination formant des complexes insolubles antigènes-anticorps, le phénomène d’opsonisation permettant le recouvrement d’un antigène facilitant ainsi la phagocytose,
et la capacité d’activation du complément (Kaattari et Piganelli, 1996). Toutes ces
fonctions nous démontrent l’aspect centrale de cette molécule au sein du système inimunitaire.
L’une des principales caractéristiques des anticorps est son rôle dans la mémoire immunologique. Cette faculté permet un établissement beaucoup plus rapide et important
iigure2 Sfructure de la forme sécrétée des immunoglobulines téléostéens (tétramère). Inspiré de
de la réponse immunitaire face à un envahisseur. Chez les mammifères, cette réponse secondaire du système immunitaire est caractérisée par une augmentation logarithmique du niveau d’anticorps monomériques et en la différenciation par le changement d’isotype (Kaattari et Piganelli, 1996). Chez les poissons, ces phénomène ne sont pas possibles ou bien sont d’un ordre bien inférieur. Cependant, des expérimentations ont démontré une augmentation de la production des anticorps lors de la réponse secondaire (Arkoosh et Kaattari, 1991). Ces augmentations sont faibles par rapport à l’augmentation logarithmique observée chez les IgG des mammifères, mais sont quand même appréciables comparativement à l’amplitude de la réponse secondaire des IgM des vertébrés supérieurs.
Récemment, des anticorps semblables aux IgD ont été découverts chez le poisson chat (Wilson et al., 1997) ainsi que chez le saumon atlantique et la truite brune (Hordvik et al.,1999), ce qui laisse entrevoir plusieurs autres découvertes sur ce sujet.
La production d’anticorps contre A. saïmonicida a été un sujet très étudié chez les salmonidés, particulièrement suite àune immunisation à l’aide de cellules entières mortes ou de produits extracellulaires (Olivier, 1999). En effet, des titres en anticorps très élevés ont pu être observés chez les salmonidés suite à une injection intrapéritonéale ou intramusculaire de A. salmonicida (Secombes et Olivier, 1997). Chez les poissons plus âgés, des études de prolifération ont démontré la présence du phénomène de mémoire chez les cellules B lors de l’infection à A. saïrnonicida et qu’une deuxième exposition au pathogène mène à une réponse plus rapide et plus forte des anticorps (Secombes et Olivier, 1997). La réponse humorale en anticorps chez les salmonidés contre A. salmonicida semble aussi être indépendante des cellules T (Olivier, 1999).
1.2.3.2 Cellulaire
La réponse immunitaire spécifique indépendante des anticorps est appelée immunité cellulaire. Chez les mammifères, la plupart des composantes de ce système sont très bien
vertébrés inférieurs. Toutefois, plusieurs des composantes du système mammifère ont pu être identifiées chez les poissons. Premièrement, il a été démontré que les téléostéens possèdent des populations de lymphocytes analogues aux cellules B et T retrouvées chez les mammifères (Manning et Nakanishi, 1996). Ces cellules sont caractérisées par des protéines présentes à leur surface soit les immunoglobulines et le récepteur 1CR respectivement. Les immunoglobulines ont été détectées à la surface des cellules B dans le sang, la rate, le rein et très peu dans le thymus par marquage à l’aide d’anticorps monoclonaux chez plusieurs espèces de poissons (Manning et Nakanishi, 1996). Pour ce qui est des cellules T, bien que les récepteurs 1CR à leur surface aient été identifiés au niveau moléculaire, aucun anticorps spécifique à ces récepteurs ont été décrits (Jansson et al., 2003). Beaucoup de travail en ce sens reste à accomplir, car aucun marqueur équivalent aux molécules CD4, CD8 et CD3 des mammifères n’est disponible (Manning et Nakanishi, 1996). Cependant, plusieurs fonctions qui nécessitent la présence de lymphocytes T actifs chez les mammifères ont été identifiées chez les poissons. Ces fonctions sont principalement la réaction aux allogreffes «allografi reaction» (Tatner et Manning., 1983), la réponse proliférative aux produits du CMH «mixed lymphocyte reaction» (Miller et al., 1986) et la réponse anti-haptène des anticorps face aux antigènes thymus-dépendants « anti-hapten antibody response to thymus-dependent antigens » (Miller et al., 1987). Différentes expérimentations basées sur des études fonctionnelles et/ou sur des réactions avec des anticorps monoclonaux ont permis de distinguer 2 types de cellules B (Bi et B2) ainsi que deux types de cellules T (Tauxiiiiaire et lcotoxique) (Watts et al., 2001). En plus des lymphocytes, les macrophages de même que les granulocytes font partie intégrante du système de défense spécifique des poissons. Ils font partie de la famille des cellules présentatrices d’antigènes, de même que les cellules B, possédant la capacité de présenter les antigènes à leur surface (Manning et Nakanishi, 1996). Les différentes molécules impliquées dans la présentation de l’antigène seront analysées dans une prochaine section.
Le système de défense spécifique peut être subdivisé en 3 grands axes suivant qu’il nécessite ou non la participation des lymphocytes T. Des études où une thymectomie a été effectuée ont démontré que certains antigènes reconnus comme T-indépendants
ç
(cellules mortes de A. saïmonicida) n’ont pas modifié la production d’anticorps chez la truite arc-en-ciel (Manning, 1992). Ces anticorps sont donc T indépendants et sont produits par le type Bi des cellules B, ayant une faible affinité et une capacité de lier plusieurs antigènes (Watts et al., 2001). Le deuxième axe constitue la réponse T-dépendante produisant des anticorps par l’intermédiaire des cellules B. Cette réponse constitue la réponse classique à un pathogène, où il y a collaboration des cellules présentatrices d’antigènes (CMH de type II), des lymphocytes ‘auxiliaires et des cellule B2(Kaattari, 1992). Cette réaction impliquera le relâchement de plusieurs cytokines et entraînera la production d’anticorps. Lors des expériences de thymectomie, les niveaux d’anticorps produits suite à l’introduction d’antigènes T dépendant furent moindre, et ce seulement dans les expériences de longue durée (9 mois) (Tatuer et al., 1987). Le dernier type de réaction est la réponse T-dépendante menant à la destruction cellulaire sans l’intermédiaire des anticorps. Cette réaction immunitaire est dépendante d’une cellule présentant un antigène par l’intermédiaire du CMH classe I et d’une cellule Tcytotoxique, et
nécessite la cytokine 112 (Manning et Nakanishi, 1996). Ce procédé bien que connu chez les mammifères a été démontré chez les poissons par des expériences de rejet de greffon et de réaction d’hypersensibilité de type retardée (Nakanishi et al., 1999). Cependant, beaucoup de travail reste à effectuer pour caractériser la réponse T cytotoxique chez les poissons.
Bien que la réponse du système immunitaire face au pathogène A. salmonicida semble être T indépendante, on retrouve certains processus à médiation cellulaire dans la réponse de l’hôte face à ce pathogène bactérien. En effet, il a été démontré in vitro qu’il y a relâchement d’un facteur activant les macrophages (MAF), suite à l’immunisation à l’aide de cellules entières mortes ou de produits extracellulaires de A. salmonicida (Marsden et al., 1994). 11 a même été démontré que les macrophages traités au MAF acquièrent la capacité de tuer A. salmonicida (Graham et al., 1982). De plus, la production de MAF corrèle avec la prolifération des lymphocytes et la production d’anticorps suivant une vaccination avec des cellules entières de A. salmonicida (Secombes et Olivier, 1997).
C
1.2.41.2.4.1 CMHIntroductionDurant la réponse spécifique, une des étapes les plus importantes est la présentation des antigènes aux lymphocytes T. Cette présentation est médiée par l’entremise des molécules du complexe majeur d’histocompatibilité (CMH) et permet le déclenchement de la cascade d’événements menant à la réponse spécifique du système immunitaire. Chez les mammifères, ce complexe est très bien caractérisé tant au niveau de la structure que de ses fonctions. Chez ces derniers, le CMH encode deux classes distinctes (I et II) de glycoprotéines de par leurs structures et leurs fonctions. Chez les poissons, les deux classes du CMH ont aussi été identifiées, premièrement chez la carpe commune (Hashimoto et al., 1990), et maintenant caractérisées chez plusieurs espèces de poissons dont les salmonidés (Grimholt et al., 2003). La prochaine section aura pour but de présenter le CMH des poissons en comparaison avec celui des mammifères tout en mettant l’emphase sur les plus récentes découvertes faites dans ce domaine.
1.2.4.2 Structure et fonctions
Les gènes du CMH de classe I et II codent pur des molécules de la surface cellulaire liant et présentant de courts peptides aux cellules T. En général, les molécules de classe I sont constituées d’une chaîne alpha ainsi que de la beta2-microglobuline et leur principale fonction est de présenter de courts peptides (8 à 10 acides aminés), dérivés du cytosol, aux cellules Tcytotoxjques CD 8+. Les molécules de classe II contiennent, pour leur part, une chaîne Œ et une chaîne f3 et présentent des peptides (13 acides aminés et
plus), intemalisés par des cellules présentatrices d’antigènes, aux cellules Tauxiiiiaires CD4+ (Grimholt et al., 2003).
Les molécules de classe I sont exprimées de façon ubiquitaires sur toutes les surfaces de cellules nucléées pour ainsi activer la réponse immunitaire médiée par les cellules Tcytotoxiques. La chaîne lourde (45kDa, Œ) est constituée de trois domaines extracellulaires
désignés cd (N-terminal), Œ2 et Œ3, d’une région transmembranaire et d’une queue
Les domaines Œ1 et u2 forment la niche peptidique liant les peptides ainsi présentés aux
récepteurs TCR des cellules Tcytotoxiques. La niche peptidique permet donc la liaison de peptides ayant une certaine spécificité avec la molécule du CMH. Les gènes du CMH étant très polymorphiques (voir section suivante), une variété d’antigènes pourront donc être présentés aux cellules T. Les principales différences entre les différents allèles du CMH sont retrouvées à certains sites de la niche peptidique permettant la liaison des peptides. Ces différences sont en fait des changements d’acides aminés à des positions bien précises. Ces acides aminés sont directement impliqués dans l’ancrage des peptides présentés et leur emplacement de même que leur nature permet la spécificité avec différents antigènes. De plus, les molécules du CMH de classe I ne permettent pas la présentation de peptides longs de par leur structure fermée (Janeway et al., 2001).
Les molécules de classe II sont exprimées généralement de façon plus spécifique à la surface des lymphocytes B, des macrophages, et des cellules T activées. Les molécules dc classe II sont des hétérodimères constitués d’une chaîne lourde (30-34 kDa, a) et d’une chaîne légère (26-29 kDa, f3). Les deux chaînes sont constituées respectivement de deux domaines extracellulaires (cxl et cx2; f31 et f32). Les domaines cxl et f31 sont les
domaines N-terminaux et forment la niche peptidique liant les peptides ainsi présentés aux récepteurs TCR des cellules Tauxjiijajres. Les même mécanismes au niveau de la niche peptidique sont présents chez le CMH de classe II. Cependant, de par sa structure ouverte, le CMH de classe II permet la présentation de peptides beaucoup plus longs que le CMH de classe I (Janeway et al., 2001).
Chez les mammifères, le CMH est un complexe génique formé d’une multitude de gènes codant pour tous les types de CMH (I et II). Par exemple, le HLA humain (Human Leukocyte Antigen) contient tous les gènes codant pour les différentes chaînes de classe I et II sur le même chromosome (6) tandis que la B2-microglobuline et les chaînes invariables se retrouvent sur un autre chromosome (15 et 5). Il faut aussi noter que le HLA est poÏygénique, car il contient plusieurs gènes encodant les molécules de classe I et II (Janeway et al., 2001). Chez les poissons, une différence majeure est observable. En effet, les gènes de classe I et de classe II sont retrouvés sur des groupes de liaison génétique différents (Grimholt, 2003). De plus, des études ont révélé que le saumon atlantique possède un seul locus codant pour le CMH de classe I et un seul locus codant pour le CMH de classe II (Grimholt et al., 2002 ; Stet et al., 2002). Cependant, les gènes codant pour les chaînes Œ et f3 du CMH de classe II se retrouvent sur le même groupe de
linkage (Stet et al., 2002). Ces dernières caractéristiques sont très intéressantes car elles permettent de discriminer la contribution des classes I et II dans les études portant sur la résistance aux maladies contrairement aux modèles mammifères où une multitude de liaisons génétiques entrent en jeu.
1.2.4.3 Polymorphisme
Chez les poissons comme chez les mammifères, les gènes du CMH font partie des gènes les plus polymorphiques du génome, possédant une multitude d’allèles par locus. Cette grande diversité permet à chaque individu de posséder l’habilité de lier et de présenter une multitude de ligands peptidiques et ainsi combattre de façon efficace un bon nombre d’infections. Cette diversité est donc essentielle non seulement au niveau de l’individu mais aussi au niveau de l’espèce afin de permettre sa pérennité. Chez les mammifères,
C
les régions les plus variables sont les régions directement associées à la niche peptidiquesoit les domaine cd et Œ2 du CMH de classe I et le domaine 31 du CMH de classe II(Janeway et al., 2001). De plus, le domaine al du CMH de classe II des mammifères est beaucoup moins polymorphique que les autres domaines impliqués dans la niche peptidique (Marsh et al., 2000). Cependant chez le poisson, la région cd du CMH de classe II semble être beaucoup plus polymorphique que chez les mammifères (Stet et al., 2002).
Plusieurs hypothèses ont été émises pour expliquer la grande variabilité des gènes du CMH. Deux principaux types de mécanisme expliquant ce polymorphisme ont été décrits soit les mécanismes se basant sur la maladie et ceux se basant sur la reproduction. Les modèles se basant sur les maladies proposent que la diversité génétique au niveau du CMH est maintenue par une sélection influencée par la co-évolution de l’hôte par rapport aux pathogènes. Deux principaux modèles sont retrouvés dans la littérature, le premier étant l’avantage de l’hétérozygote. Ce modèle se base sur l’hypothèse qu’un individu hétérozygote dans une population exposée à de nombreux pathogènes est avantagé par sa plus grande capacité de présenter une grande variété d’antigènes et ainsi résister à un plus grand nombre de pathogènes qu’un individu homozygote (Hughes et al., 1988). Le deuxième modèle est l’hypothèse de l’avantage de l’allèle rare proposant que les déterminants antigéniques du parasite seront sélectionnés afin d’exploiter les défauts du système immunitaire de l’hôte le plus commun (Clarke et Kirby, 1966 ; Takhata et Nei, 1990). Ce système va donc procurer un avantage aux individus possédant un ou des allèles rares au niveau du CMH.
Le deuxième grand type de mécanisme est fondé sur les bénéfices génétiques de la sélection sexuelle. Actuellement, deux principales hypothèses expliquent comment ce type de mécanisme influence le polymorphisme du CMH (Penn, 2002). Premièrement, les différences de «fitness» au niveau des infections parmi les génotypes du CMH vont favoriser des mécanismes reproductifs produisant des génotypes hautement adaptés à ces maladies dans la descendance. Le deuxième de ces modèles est l’hypothèse de
c
par Potts et Wakeland (1990). Cette hypothèse suggère que les croisements sélectifs basés sur le CMH sont similaires à d’autres systèmes d’incompatibilité génétique (système d’incompatibilité des plantes) afin d’éviter les lignées pures.1.2.4.4 Le CMH de classe II
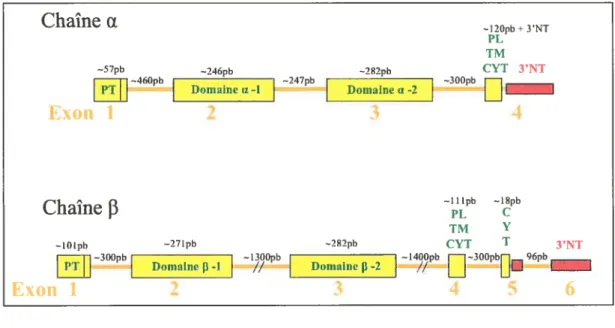
L’organisation génomique du CMH classe llx et f3 a été caractérisée chez le saumon atlantique par Stet et al. (2002). Pour ce qui est du gène du CMH de classe Ilu, on retrouve chez le saumon atlantique 4 exons flanqués de 3 introns. Le premier exon code pour le peptide de tête et pour 3 acides aminés du domaine u 1. Le deuxième exon code pour le reste du domaine ul, l’exon 3 pour le domaine u2 et finalement l’exon 4 code pour un peptide de liaison, une région transmembranaire hydrophobe, une courte région cytoplasmique et une région 3’ non traduite. Pour ce qui est des introns, il sont semblables chez les 2 poissons (réplicats) de cette étude tant au niveau de la longueur que de leur séquence. Cependant, quelques divergences au niveau de la longueur ont été identifiées pour l’intron 3. La longueur et l’arrangement des introns/exons sont représentés en Figure 4. Il est à noter que l’organisation exonlintron retrouvée dans cette étude est identique à celle retrouvée chez le poisson zèbre (Dania sp.) (SUltman et al., 1993).
Pour ce qui est du gène codant pour le CMH de classe 1113, on retrouve chez le saumon 6 exons et 5 introns. Le premier exon code aussi pour le peptide de tête et pour 2 acides aminés du domaine f31. Le second exon code pour le reste du domaine 131, tandis que l’exon 3 code pour le domaine 132. L’exon 4 code pour le peptide de liaison, la région transmembranaire et pour la région cytoplasmique manquant les 4 derniers acides aminés. Ces derniers sont codés par l’exon 5 contenant aussi 6 paires de bases de la région 3’ non traduite. Finalement, l’exon 6 code pour le reste de la région 3’ non traduite. Quelques divergences au niveau de la longueur des introns ont été observées dans cette étude. Ces divergences ont été observées dans l’intron 1, 2, 3 et 4 tandis que l’intron 5 semble être identique tant au niveau de la séquence que de la longueur.