Le rôle des archées dans l’inflammation et leur
impact sur la santé humaine
Thèse
Pascale Blais Lecours
Doctorat en microbiologie
Philosophiae Doctor (Ph.D.)
Québec, Canada
Résumé
Les archées sont depuis peu reconnues comme étant des microorganismes ubiquitaires retrouvées dans le système digestif de l’humain et de plusieurs animaux. Les humains peuvent donc être exposés aux archées par leur propre microflore intestinale, mais aussi par le contact avec des fèces animales, dont les composantes peuvent être aérosolisées et inhalées. L’impact de ces archées sur la santé respiratoire et intestinale des humains n’est pas clairement établi. La composition exacte des bioaérosols doit être définie afin de bien comprendre ce à quoi sont exposés les humains. Par ailleurs, l’impact de Methanosphaera
stadtmanae (MSS) et Methanobrevibacter smithii (MBS), deux espèces d’archées retrouvées
dans le tractus intestinal, est inconnu dans un contexte de maladies inflammatoires de l’intestin.
L’étude de la biodiversité des bioaérosols des fermes laitières a démontré la présence de grandes concentrations et de plusieurs espèces de bactéries et d’archées dans l’air de ces environnements. Les mécanismes inflammatoires pulmonaires à la base de la réponse immune causée par les archaea ont été étudiés grâce à un modèle murin d’exposition chronique des voies respiratoires. MSS a démontré un potentiel immunogénique plus fort que MBS, en induisant davantage d’altérations histopathologiques, de cellules inflammatoires et de cellules dendritiques myéloïdes activées que MBS dans les poumons de souris. Le potentiel inflammatoire de MSS et MBS a aussi été confirmé avec un modèle de cellules humaines. Finalement, afin d’étudier le rôle des archées dans l’inflammation intestinale, la présence de MBS et de MSS a été évaluée dans les selles de patients atteints de maladies inflammatoires de l’intestin et de sujets sains. Une prévalence accrue de l’archée inflammatoire MSS a été retrouvée dans les selles des patients. Des anticorps spécifiques à MSS ont aussi été retrouvés en plus grande concentration chez ce groupe de sujets.
Ces résultats démontrent que les archées sont présentes à la fois dans les bioaérosols et dans les intestins humains et qu’elles peuvent avoir des impacts sur l’inflammation respiratoire et intestinale. Nous ne commençons qu'à explorer la présence des archées dans l’environnement humain et la réponse à ces agents méconnus. Leur rôle en tant qu'agents protecteurs, pro-inflammatoires ou tolérés mérite d'être approfondi.
Abstract
Archaea have recently been recognized as ubiquitous microorganisms found in the digestive tract of human and several animal species. Humans can thus be exposed to archaea through several routes such as their own intestinal microflora, but also via exposure to animal manure which components can be aerosolized and inhaled. Archaeal impact on respiratory and intestinal human health is not known. Bioaerosol’s exact composition must be defined in order to better understand what humans are exposed to. Moreover, the role of
Methanosphaera stadtmanae (MSS) and Methanobrevibacter smithii (MBS), two archaeal
species found in human gut, on the health of the intestinal tract and potentially in inflammatory bowel diseases is unknown.
Studies on dairy barns’ bioaerosol’s biodiversity revealed the presence of high airborne concentrations and various species of bacteria and archaea. Pulmonary inflammatory mechanisms of immune response to archaea were studied using a chronic airway exposure mouse model. MSS showed a higher immunogenic potential than MBS, with more severe hitopathological alterations and higher numbers of inflammatory cells and activated myeloid dendritic cells in exposed mice lungs than MBS. The inflammatory potential of MSS and MBS was also confirmed with a human cell model. Finally, to study the role of archaea in bowel inflammation, the presence of MBS and MSS was evaluated in stool samples from inflammatory bowel diseases’ patients and control subjects. A higher prevalence of the inflammatory archaea MSS was detected in stool samples from patients. MSS-specific antibodies were also found in higher concentration in this group.
These results show that archaea are present in bioaerosols and human gut and that they can have an impact on respiratory and intestinal inflammation. We are just beginning to explore the presence of archaea in human environment and our response to these unheralded agents. Their role as protective, proinflammatory or tolerated agents awaits further studied.
Table des matières
RÉSUMÉ ... III
ABSTRACT ...V
TABLE DES MATIÈRES ... VII
LISTE DES TABLEAUX ... XI
LISTE DES FIGURES ... XIII
LISTE DES ABRÉVIATIONS ET DES SIGLES ... XVII
REMERCIEMENTS ... XXI
AVANT-PROPOS ... XXIII
1.
CHAPITRE I. INTRODUCTION GÉNÉRALE ... 1
1.1 LES ARCHÉES ... 1
1.1.1 Phylogénie des archées ... 1
1.1.2 Génétique moléculaire des archées ... 2
1.1.3 Membrane et paroi archéennes ... 4
1.1.4 Biodiversité des archées ... 6
1.1.5 Méthanogènes ... 7
1.2 EXPOSITION DES HUMAINS AUX ARCHÉES : L’AIR ... 8
1.2.1 Les bioaérosols ... 8
1.2.2 Méthodes d’échantillonnage des bioaérosols ... 9
1.2.3 Les bioaérosols en milieux de travail ... 10
1.2.4 L’impact des bioaérosols sur la santé respiratoire humaine ... 11
1.2.5 Les maladies respiratoires non infectieuses associées aux bioaérosols ... 13
1.2.6 Les archées dans l’air ... 15
1.3 EXPOSITION DES HUMAINS AUX ARCHÉES : MICROFLORE INTESTINALE ... 17
1.3.1 Composition des archées chez l’humain ... 17
1.3.2 Maladies inflammatoires de l’intestin ... 18
1.4 LE SYSTÈME IMMUNITAIRE ... 19
1.4.1 Immunité cellulaire ... 19
1.4.2 Immunité humorale ... 21
1.4.3 Immunogénicité et inflammation ... 22
1.4.4 Les modèles animaux pour l’étude de l’inflammation ... 24
1.5 LE POTENTIEL IMMUNOGÈNE DES ARCHÉES ... 25
1.5.1 Les archaeosomes ... 25
1.5.2 Les protéines de surface ... 25
1.5.3 Les protéines intracellulaires ... 26
2.
CHAPITRE II. PROBLÉMATIQUE, HYPOTHÈSES ET OBJECTIFS ... 27
2.1 PROBLÉMATIQUE ... 27
2.2 HYPOTHÈSES ... 28
3.
CHAPITRE III. CARACTÉRISATION DES BIOAÉROSOLS DE FERMES LAITIÈRES : RECONSTRUIRE LE CASSE-TÊTE DES MALADIES
RESPIRATOIRES OCCUPATIONNELLES EN UTILISANT DES APPROCHES
MOLÉCULAIRES ... 31
3.1 RÉSUMÉ ... 31
3.2 ABSTRACT ... 32
3.3 INTRODUCTION ... 33
3.4 MATERIALS AND METHODS ... 34
3.4.1 Sampling, collecting and processing methods ... 34
3.4.2 Total DNA extraction ... 35
3.4.3 Quantitative real-time PCR ... 35
3.4.4 DGGE ... 36
3.4.5 Phylogenetic analysis ... 36
3.4.6 Antigen-specific immunoglobulin G detection ... 37
3.4.7 Statistical analysis ... 37
3.5 RESULTS... 38
3.5.1 High concentrations of airborne archaea and bacteria in dairy barns ... 38
3.5.2 Methanogens and various species of bacteria aerosolized in dairy barns ... 39
3.5.3 Dairy barn workers were sufficiently exposed to airborne S. rectivirgula to induce a humoral response ... 40
3.6 DISCUSSION ... 40
3.7 CONCLUSION ... 42
3.8 REFERENCES ... 43
4.
CHAPITRE IV. PROPRIÉTÉS IMMUNOGÈNES D’ESPÈCES D’ARCHÉES RETROUVÉES DANS LES BIOAÉROSOLS ... 55
4.1 RÉSUMÉ ... 55
4.2 ABSTRACT ... 56
4.3 INTRODUCTION ... 57
4.4 MATERIALS AND METHODS ... 58
4.4.1 Archaeal suspension preparations ... 58
4.4.2 Animals ... 58
4.4.3 Airway exposure protocol ... 58
4.4.4 BALF analysis ... 59
4.4.5 Histopathological studies ... 59
4.4.6 Immunoglobulin titration ... 59
4.4.7 Statistical analysis ... 60
4.5 RESULTS ... 60
4.5.1 Histopathological alterations in the lungs differ between archaeal species ... 60
4.5.2 Nature and numbers of leukocytes found in BALF differ between archaeal species ... 61
4.5.3 Archaea induce an antigen-specific adaptive response ... 61
4.8 REFERENCES ... 66
5.
CHAPITRE V. PRÉVALENCE ACCRUE DE METHANOSPHAERA STADTMANAE DANS LES MALADIES INFLAMMATOIRES DE L’INTESTIN ... 77
5.1 RÉSUMÉ ... 77
5.2 ABSTRACT ... 78
5.3 INTRODUCTION ... 79
5.4 MATERIAL AND METHODS ... 80
5.4.1 Volunteers recruitment ... 80
5.4.2 Ex vivo stimulation of PBMCs with MBS and MSS ... 81
5.4.3 Sampling and processing methods ... 81
5.4.4 Total DNA extraction ... 82
5.4.5 Quantitative real-time PCR ... 82
5.4.6 Statistical analysis ... 83
5.4.7 Ethical considerations ... 83
5.5 RESULTS ... 84
5.5.1 Subjects’ characteristics ... 84
5.5.2 Validation of immunogenicity of MBS and MSS in humans ... 84
5.5.3 MSS-specific DNA amplification with qPCR method ... 84
5.5.4 Concentrations of total bacteria in stool samples from patients and controls ... 85
5.5.5 Concentrations and prevalence of methanogenic species in stool samples of controls and IBD patients ... 85
5.5.6 Patients’ characteristics and archaeal gut microbiota ... 85
5.5.7 Antigen-specific IgGs in plasma of controls and patients ... 86
5.6 DISCUSSION ... 86
5.7 CONCLUSION ... 88
5.8 REFERENCES ... 89
CHAPITRE VI. DISCUSSION GÉNÉRALE ... 101
6.1 LES ARCHÉES : UNE COMPOSANTE MAJEURE DES BIOAÉROSOLS ... 101
6.2 IMMUNOGÉNICITÉ DE MBS ET MSS ... 103
6.3 IMPACT DES ARCHÉES SUR LA SANTÉ RESPIRATOIRE ... 105
6.4 IMPACT DES ARCHÉES SUR LA SANTÉ INTESTINALE ... 106
CHAPITRE VII. CONCLUSIONS ... 109
CHAPITRE VIII. PERSPECTIVES ... 111
Liste des tableaux
Tableau 1.1. Comparaison de différentes caractéristiques moléculaire des
archées, des bactéries et des eucaryotes ... 3
Tableau 1.2. Composantes des bioaérosols et maladies respiratoires associées ... 14
Tableau 1.3. Différents CDs étudiés dans cette thèse ... 21
Tableau 3.1 Primers, probe and GC clamps used in the study ... 51
Tableau 3.2. Sequence matches for bands from DGGE gels containing dairy barn archaeal and bacterial DNA ... 52
Tableau 3.3. IgG specific for S. rectivirgula in plasma of dairy barn workers compared to that in plasma of controlsa ... 53
Tableau 4.1. Histopathological alterations in the lungs of mice exposed to MBS or MSS. ... 75
Tableau 5.1. Primers and probes used in the study ... 95
Tableau 5.2. Clinical status of recruited patients ... 96
Tableau 5.3. Comparison of the presence of MSS and/or MBS in stool samples from control subjects and patients ... 97
Liste des figures
Figure 1-1. Arbre phylogénétique (figure adaptée à partir de Woese et al.,
1990 et de Brochier-Armanet et al., 2011). ... 2
Figure 1-2. Comparaison des lipides membranaires des bactéries avec ceux des archées. a) Membrane des bactéries b) Caldarchaeol c)
Archaeol (figure adaptée de Albers and Meyer, 2011). ... 5
Figure 1-3. Zone de déposition des particules dans l’appareil respiratoire
humain (figure inspirée de (Létourneau, 2010) ... 12
Figure 1-4. Photos de MBS et MSS, deux espèces d’archées méthanogènes retrouvées dans l’environnement humain. Les photos ont été prises au microscope à contraste de phase et au microscope à fluorescence avec un grossissement de 1000X, sans coloration
cellulaire. ... 16
Figure 3-1. Airborne archaeal and bacterial concentrations 16S rRNA gene from dairy barn samples (average ± SEM), as determined by quantitative PCR. Comparison between IOM, NIOSH and Coriolis air samplers (n=13 each). LOD, 4x102 16S rRNA genes for archaea and 2x103 16S rRNA genes for bacteria. No statistical differences between results from the three air
samplers tested (archaea: p=0.3135, bacteria: p=0.4981). ... 47
Figure 3-2. Airborne S. rectivirgula 16S rRNA gene concentrations from dairy barn samples (average ± SEM), as determined by quantitative PCR from IOM air sampler (n=13). Dotted line at 2x103
equals LOD of the PCR. ... 48
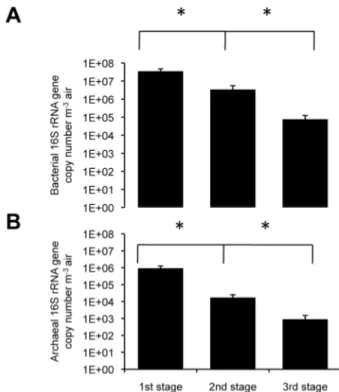
Figure 3-3. Size distribution particles in the dairy barns: airborne archaeal and bacterial concentrations of 16S rRNA gene from dairy barn samples (average ± SEM), as determined by quantitative PCR. Comparison between the three NIOSH sampler stages (n=13 each). LOD, 1x102 16S rRNA genes for archaea and
6x102 16S rRNA genes for bacteria. *: p<0.05 ... 49
Figure 3-4. Lack of correlation between the concentration of 16S rRNA genes
of archaea and bacteria in dairy barns. Comparison between IOM (r=0.2629, p=0.3853), NIOSH (r=0.0839, p=0.7852) and Coriolis (r=0.0464, p=0.8803) air samplers (n=13 each). Data from the same barn are represented by the same color. LOD, 4x102 16S rRNA genes for archaea and 2x103 16S rRNA
genes for bacteria. ... 50
Figure 4-1. Experimental model. Mice reveived intranasal instillations of saline or; 6.25µg, 25µg, 100µg of MBS or; 6.25µg, 25µg, 100µg of MSS, once daily, starting on day 0, for three consecutive days in a week, during three weeks. Mice were
euthanized on day 20, four days after last archaea instillation. ... 69
Figure 4-2. MBS and MSS induce dose-dependant histopathological altérations in the lungs. Hematoxylin and eosin-stained sections of the lungs obtained from A) mice instilled with
saline 3 times a week for 3 weeks; mice instilled with B) 6.25, C) 25 or D) 100 µg og MBS 3 times a week for 3 weeks; mice instilled with E) 6.25, F) 25 or G) 100 µg of MSS 3 times a week for 3 weeks. MSS strongly induces the formation of tertiary lymphoid organ-like structures (arrows) compare to MBS. Specimens shown are representative of 6 induvidual
observations per groups. ... 70
Figure 4-3. Quantification of leukocyte subsets in the BALF of mice instilled with increasing doses of two archaeal species. A) Total immune cell numbers in BALF of mce instilled with 6.25, 25 or 100 µg of MBS or MSS for 3 weeks. B) Leukocyte subset numbers in BALF of mice exposed to 6.25, 25 and 100 µg of MBS for 3 weeks. C) Leukocyte subset numbers in BALF of mice exposed to 6.25, 25 and 100 µg of MSS for 3 weeks. Results expressed as average ± SEM. For both archaeal species, BALF cell subtypes were mainly composed of macrophages and lymphocytes. MSS also induced a significant acculumation of eosinophils and of neutrophils. Letters a and b represent statistical différences between treatment regimens within a same cell type. Results from two pooled experiments obtained with similar results are presented
and 14 to 22 mice per group were analyzed. p<0.05 ... 71
Figure 4-4. Dominance of CD4+ T lymphocytes and CD19+ B lymphocytes in BALF of mice instilled with archaeal species. The numbers of CD4+ T cells, CD8+ T cells and CD19+ B cells were analyzed in BALF of mice exposed for 3 weeks to 6.25, 25 and 100 µg of A) MBS or B) MSS. Compared to MBS, MSS induced strong CD4+ helper T cell and CD19+ B cell responses in the Airways, which plateaued from the lowest dose instilled. Results are expressed as médian ± interquartile intervals. Letters a and b represend statistical diffenrences between treatment regimens within a same cell type. Six mice per
group were analyzed. p<0.05. ... 72
Figure 4-5. MBS and MSS induce a dose dependant production of antigen-specific IgG in plasma. Titers of antigen-antigen-specific IgG were measured by ELISA in plasma of mice exposed to 6.25, 25 and 100 µg of A) MBS or B) MSS. C) Titers are expressed as the logarithmic inverse of plasma dilutions. Both archaea induce a dose-responsive generation of archaea-specific antibodies. Results are expressed as mean ± SEM. Letters a and b represent statistical différences between treatment
regimens. Six mice per group were analyzed. p<0.05. ... 73
Figure 4-6. MSS induces stronger myeloid dendritic cells response than MBS in the airways of mice. Flow cytometric analyses were performed on BALF cells of mice exposed to 6.25 or 100 µg of MBS or MSS for 3 weeks. Compared to saline-treated mice, MBS induced a low accumulation of myeloid dendritic
numbers of cells (average ± SEM). Six mice per group were analyzed. a: p<0.05, represent statistically differences
compared to saline. b: p=0.08. ... 74
Figure 5-1. TNF concentrations in supernatants of non-stimulated and MBS- or MSS- stimulated PBMC from healthy human subjects. TNF was quantified by direct ELISA (average ± SEM). Cells
from eleven subjects per group were analyzed. p<0.001 ... 93
Figure 5-2. IgG response in plasma of controls subjects and IBD patients. Titers of A) MBS and B) MSS-specific IgGs. C)
Quantification of total IgGs. Results are expressed as average ± SEM. Eighteen controls (9 positive for MBS and 4 positive for MSS in stool samples) and seventeen patients (6 positive for MBS and 9 positive for MSS in stool samples) were
Liste des abréviations et des sigles
AAE Alvéolite allergique extrinsèqueBALF Bronchoalveolar lavage fluid
iBALT Inducible bronchus-associated lymphoid tissue CD Cluster de différentiation
CMH Complexe majeur d’histocompatibilité CPA Cellule présentatrice de l’antigène CU Colite ulcéreuse
DGGE Denaturant gradient gel electrophoresis HWCGI Hot Water Crenarchaeotic Group I IBD Inflammatory bowel disease IgG Immunoglobuline G IL Interleukine IOM Institute of Medicine LOD Limit of détection MBGB Marine Benthic Group B MBS Methanobrevibacter smithii
MC Maladie de Crohn
MCG Miscellaneous Crenarchaeotic Group MII Maladies inflammatoires de l’intestin MSS Methanosphaera stadtmanae
NAG N-acétyl-D-glucosamine
NAT N-acétyltalosaminuronique
NIOSH National Institute of Occupational Safety and Health NK Natural killer
PBMC Peripheral blood mononuclear cell PCR Réactions de polymérase en chaine PolD Polymérase D
SEM Standard error of the mean SR Saccharopolyspora rectivirgula
STEPO Syndrome toxique d’exposition aux poussières organiques TNF Tumor necrosis factor
Remerciements
L’écriture de cette thèse n’aurait pas été possible sans le soutien de plusieurs personnes. J’aimerais tout d’abord remercier ma directrice de recherche Caroline Duchaine, qui m’a non seulement conseillée, appuyée, et guidée tout au long de mes études graduées, mais qui m’a aussi donné le gout de la recherche. Caroline, merci pour ta disponibilité, pour ton enthousiasme et pour ta passion pour la recherche et les sciences. J’ai adoré les années passées à travailler dans ton laboratoire. Je te remercie de m’avoir prise sous ton aile et d’avoir pu faire partie d’un laboratoire de renommée mondiale! J’en suis très fière!
J’aimerais aussi remercier mon codirecteur David Marsolais qui m’a énormément aidée dans le volet immunologie de ma thèse. David, merci pour ton enthousiasme contagieux envers de nouveaux résultats, pour tes conseils précieux sur l’écriture d’articles scientifiques et pour l’aide indispensable apportée en laboratoire et à l’animalerie. T’avoir comme codirecteur a bonifié grandement ma thèse!
Merci aux membres du jury de cette thèse, Yvon Cormier, Michel Frenette et Jakob Bonlokke, pour les nombreuses discussions ainsi que leurs conseils et commentaires qui m’ont amplement aidé à l’écriture de cette thèse.
Merci aux membres de l’équipe Duchaine avec qui j’ai passé de superbes années et dont l’amitié m’est très chère. Merci à Valérie pour son altruisme et sa générosité, et bien sûr pour son organisation légendaire. Merci à Nathalie d’être une super référence pour plusieurs techniques et d’être toujours disponible quand on a besoin d’elle. J’aimerais dire un merci spécial à Marc pour la supervision générale de mon projet de recherche, pour ta présence lors de l’échantillonnage dans les fermes laitières, pour ton aide à l’animalerie et bien sur pour tout le bon temps passé en ta compagnie. Merci à tous les étudiants de l’équipe que j’ai côtoyés : Laetitia, Mélissa, Anne, Martyne, Louis, Phillipa, Rémi, Nicolas, Léa, Vanessa, Evelyne, Kevin, Éric, Hamza, Marie-Josée T. et Daniel. J’ai beaucoup apprécié les journées passées à travailler avec vous.
Merci à Marie-Josée Beaulieu pour ton aide précieuse lors de mes débuts avec les souris et pour tes connaissances qui me semblaient infinies sur le travail à l’animalerie et sur la culture cellulaire. Tes conseils valent de l’or!
Merci aux organismes subventionnaires (IRSST, CCHSA, CRSNG) qui ont subventionné mes projets de recherche et aux organismes m’ayant octroyé des bourses d’études (PHARE, IRSST, FRSQ) et de stage (RSR).
Merci aux membres des équipes Marsolais et Blanchet avec qui j’ai travaillé : Anne-Marie, Michel, David, Marie-Renée, Anick et Émilie. Merci à Marie-Ève, ma voisine de bureau, pour ton amitié et tes connaissances si précieuses en informatique, plus particulièrement sur le tableur Excel! Merci à tous les étudiants, professionnels de recherche et chercheurs de l’unité de pneumologie du CRIUCPQ que j’ai côtoyés durant mes études graduées. Je suis chanceuse d’avoir pu évoluer dans un milieu aussi enrichissant où tout un chacun s’entraide et où les connaissances du groupe sont mises à profits des étudiants.
Merci à Steve Charette et à son équipe de recherche, ainsi qu’à Luc Trudel pour les nombreuses discussions scientifiques bien sûr, mais aussi pour votre amitié. Merci à Robert J. Forster pour l’opportunité enrichissante d’apprendre à cultiver des méthanogènes.
Finalement, j’aimerais remercier mon conjoint, Charles, et ma famille, qui m’ont offert un support irremplaçable au cours des dernières années.
Avant-propos
Contexte de la recherche
Cette thèse est divisée en deux thèmes de recherche différents, soit l’inflammation causée par les archées dans 1) les bioaérosols et dans 2) les intestins humains. Les travaux effectués dans le cadre du premier thème, c’est-à-dire les chapitres III et IV, ont été réalisés grâce à une subvention de l’Institut de recherche Robert-Sauvé en santé et en sécurité du travail (IRSST) ainsi qu’à une subvention pour un projet pilote du Centre canadien de santé et sécurité en milieu agricole (CCSSMA). Les travaux du chapitre V concernent le deuxième thème de recherche et ont été subventionnés par des subventions du Conseil de recherche en sciences naturelles et en génie du Canada (CRSNG).
Contributions
Les travaux présentés dans cette thèse ont été effectués par moi-même, sous la direction de la professeure Caroline Duchaine et sous la codirection du docteur David Marsolais ainsi que sous la supervision du comité aviseur composé des Drs Caroline Duchaine, David Marolais, Yvon Cormier et Michel Frenette, avec l’assistance technique de Marc Veillette.
Le manuscrit présenté au chapitre III intitulé «Caractérisation des bioaérosols de fermes laitières : reconstruire le casse-tête des maladies respiratoires occupationnelles en utilisant des approches moléculaires» a été publié dans le journal Applied and Environmental Microbiology (février 2012). Je suis l’auteure principale de cet article scientifique, coécrit par Marc Veillette et Caroline Duchaine. J’ai effectué l’échantillonnage avec l’aide de M. Veillette et accompli le traitement des échantillons, l’analyse des données et l’écriture de l’article sous la supervision de Dre Duchaine. L’article a été révisé par les trois auteurs. Les personnes suivantes ont été remerciées pour leurs différentes contributions dans l’article : William G. Lindsley pour nous avoir fourni l’échantillonneur NIOSH, Gaëtane Racine pour avoir effectué les ponctions sanguines chez les volontaires, Serge Simard pour les analyses statistiques effectuées, Robert Forster pour avoir cultivé et fourni les archées et tous les volontaires ayant participé à l’étude.
Le manuscrit présenté au chapitre IV intitulé «Propriétés immunogènes d’espèces d’archées retrouvées dans les bioaérosols» a été publié dans le journal PLoS One (août 2011). Je suis l’auteure principale de cet article scientifique, coécrit par Caroline Duchaine, Michel Taillefer, Claudine Tremblay, Marc Veillette, Yvon Cormier et David Marsolais. J’ai effectué
l’échantillonnage et le traitement des échantillons avec l’aide des MM. Taillefer, Veillette et Marsolais et l’analyse des données et l’écriture de l’article sous la supervision de Dr. Marsolais. Dre Tremblay a effectué les analyses histopathologiques et Dr Cormier a aidé lors de l’analyse des données et de la rédaction. L’article a été révisé par l’ensemble des auteurs. Les personnes suivantes ont été remerciées pour leurs différentes contributions dans l’article : Robert Forster pour avoir cultivé et fourni les archées, Serge Simard pour les analyses statistiques effectuées et Marie-Josée Beaulieu pour l’expertise technique apportée.
Le manuscrit présenté au chapitre V intitulé «Prévalence accrue de Methanosphaera
stadtmanae dans les maladies inflammatoires de l’intestin» a été publié dans le journal PLoS
One (janvier 2014). Je suis l’auteure principale de cet article scientifique, coécrit par David Marsolais, Yvon Cormier, Marie Berberi, Chantal Haché, Raymond Bourdages et Caroline Duchaine. J’ai effectué le recrutement des participants avec l’aide de Mme Berberi et des Drs Haché et Bourdages et accompli le traitement des échantillons, l’analyse des données et l’écriture de l’article sous la supervision de Dre Duchaine. Dr Cormier a aidé lors de l’analyse des données et de la rédaction. L’article a été révisé par l’ensemble des auteurs. Les personnes suivantes ont été remerciées pour leurs différentes contributions dans l’article : Mylène Duchaine pour le recrutement de volontaires et les ponctions sanguines effectuées, Serge Simard pour les analyses statistiques effectuées, Michel Frenette et Yves Lacasse pour leur participation à plusieurs discussions ainsi que tous les volontaires ayant participé à l’étude.
1. Chapitre I. Introduction générale
1.1 Les archées
1.1.1 Phylogénie des archées
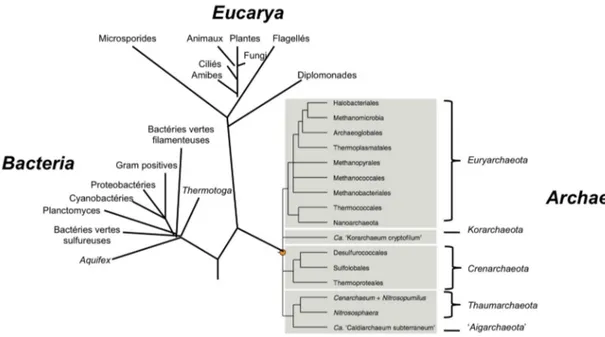
Les Archaea sont un des trois grands domaines de la vie avec les Eucarya et les Bacteria (Woese & Fox, 1977, Woese et al., 1990) (Figure 1-1). Ces microorganismes sont classés en plusieurs phylums, dont les deux principaux sont les Euryarchaeota et les Crenarchaeota. Le groupe des Euryarchaeota contient à lui seul toutes les espèces méthanogènes et halophiles ainsi que plusieurs microorganismes thermophiles et psychrophiles. Le groupe des
Crenarchaeota, quant à lui, regroupe les archées hyperthermophiles (Allers & Mevarech,
2005, Schleper et al., 2005, Brochier-Armanet et al., 2008). En plus du phylum
Korarchaeota ne comprenant à ce jour qu’une espèce cultivée, Brochier-Armanet et al. ont
suggéré en 2008 un quatrième phylum d’archées, les Thaumarchaeota, comprenant les
Crenarchaeota mésophiles (Brochier-Armanet et al., 2008). Différents «clusters» d’archées
tels MCG (Miscellaneous Crenarchaeotic Group), MBGB (Marine Benthic Group B) et HWCGI (Hot Water Crenarchaeotic Group I) ne cadrent pas dans les phylums archéens établis dans l’arbre phylogénétique (Pester et al., 2011). De nouveaux phylums ont donc été proposés sous le nom de Aigarchaeota (Nunoura et al., 2011) et de Geoarchaeota (Kozubal
et al., 2013), mais ces derniers demeurent controversés. Le phylum des Geoarchaeota
regrouperait les espèces archéennes vivant dans les sources thermiques très acides du Parc National de Yellowstone.
Figure 1-1. Arbre phylogénétique (figure adaptée à partir de Woese et al., 1990 et de
Brochier-Armanet et al., 2011).1.1.2 Génétique moléculaire des archées
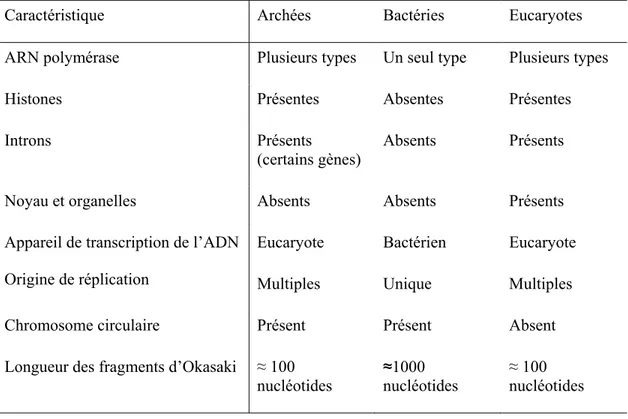
Les archées possèdent des caractéristiques à la fois des bactéries et des eucaryotes. En effet, leur système de traitement de l’information (réplication, transcription, traduction et réparation de l’ADN) ressemble à celui des eucaryotes tandis que leur physiologie et leur métabolisme rappellent davantage celui des bactéries (Forterre et al., 2002, Allers & Mevarech, 2005, Schleper et al., 2005, Lindas & Bernander, 2013). À l’exception d’un unique génome circulaire retrouvé chez la très grande majorité des archées, la génétique moléculaire de ces microorganismes est très différente de celle des bactéries, comme le démontre le tableau 1.1. Ces deux domaines cellulaires ont tout d’abord été différenciés par la reconstruction phylogénétique du gène de la sous-unité ribosomale 16S de l’ARN (Woese & Fox, 1977, Woese et al., 1990). Chez les archées comme chez les bactéries, ce gène est universel et est fréquemment utilisé pour caractériser la biodiversité d’un environnement par amplification PCR (Baker et al., 2003, Yu et al., 2008). Le réplisome des archées, c’est-à-dire leur complexe de réplication, est aussi de nature eucaryote (Samson & Bell, 2011, Lindas & Bernander, 2013). Les polymérases impliquées dans la réplication de l’ADN sont aussi homologues à celles retrouvées chez les eucaryotes, à l’exception de la PolD retrouvée
eucaryotes (Matsunaga et al., 2003). Enfin, contrairement aux bactéries qui ne possèdent qu’une seule origine de réplication de l’ADN, les archées possèdent des origines de réplication multiples tout comme les cellules eucaryotes (Lindas & Bernander, 2013). La transcription des archées implique aussi des systèmes similaires aux eucaryotes (Langer et
al., 1995). Malgré certaines divergences inter espèces, les archées possèdent plusieurs types
d’ARN polymérases dépendantes de l’ADN et ces dernières, en plus des différents facteurs de transcription, sont homologues à celles des eucaryotes (Lindas & Bernander, 2013, Spang
et al., 2013). Le système de transcription de l’ADN des archées en ARN puis la traduction en
protéines, dont plusieurs facteurs d’initiation de la traduction, possède aussi beaucoup d’homologie avec celui des eucaryotes (Londei, 2005, Benelli & Londei, 2011). Enfin, en plus de posséder des histones associées à l’ADN (Reeve et al., 2004), certaines espèces d’archées possèdent des homologies avec les gènes du cytosquelette des eucaryotes (Bernander & Ettema, 2010, Samson & Bell, 2011, Spang et al., 2013). Les introns, absents chez les bactéries, sont aussi retrouvés dans certains gènes archéens (Tocchini-Valentini et
al., 2011).
Tableau 1.1. Comparaison de différentes caractéristiques moléculaire des archées, des
bactéries et des eucaryotesCaractéristique Archées Bactéries Eucaryotes
ARN polymérase Plusieurs types Un seul type Plusieurs types
Histones Présentes Absentes Présentes
Introns Présents
(certains gènes)
Absents Présents
Noyau et organelles Absents Absents Présents
Appareil de transcription de l’ADN Eucaryote Bactérien Eucaryote
Origine de réplication Multiples Unique Multiples
Chromosome circulaire Présent Présent Absent
Longueur des fragments d’Okasaki ≈ 100
nucléotides ≈1000 nucléotides
≈ 100 nucléotides
1.1.3 Membrane et paroi archéennes
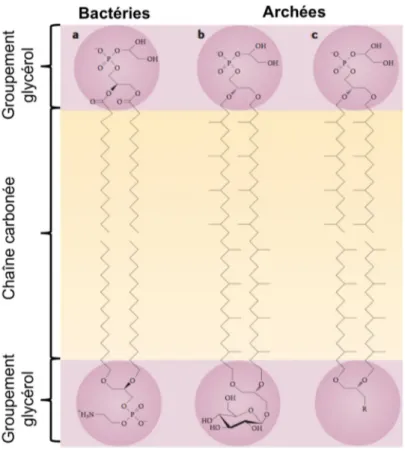
Les archées possèdent une paroi cellulaire dépourvue de peptidoglycane et des lipides membranaires uniques. La membrane des archées possède effectivement des lipides qui ne sont pas retrouvés dans d’autres formes de vie, les archaeols et les caldarchaeols étant les principaux (Figure 1-2). Contrairement à la membrane bactérienne qui est constituée d’une bicouche lipidique dont la chaine carbonée est linéaire et dont le groupement glycérol est lié par une liaison ester au glycérol-3-phosphate, les archées possèdent des lipides polaires dont la chaine carbonée est habituellement saturée et ramifiée et est reliée au glycérol par des liens éther (Kates, 1992, Sprott et al., 2003). Autant pour les archaeols que pour les caldarchaeols, le groupement glycérol est lié par une liaison éther au glycérol-1-phosphate (Albers & Meyer, 2011). Cette dernière caractéristique est unique puisque la chaine carbonée des lipides de toutes les autres formes de vie connues est liée au glycérol par des liens ester. Les caldarchaeols ont la caractéristique de former une monocouche lipidique dans la membrane des archées, contrairement aux archaeols qui eux forment une bicouche lipidique (Patel & Sprott, 1999, Patel & Chen, 2005, Patel & Chen, 2010). Choquet et al ont démontré qu’une plus grande proportion de caldarchaeols dans la membrane assurait une plus grande stabilité des archées à l’hydrolyse et à l’oxydation (Choquet et al., 1994).
La composition lipidique de la membrane des archées varie largement selon l’espèce (Choquet et al., 1994, Sprott et al., 1999). Par exemple, l’espèce d’archée Methanosphaera
stadtmanae (MSS)contient une majorité de lipides archaeols et la fraction phospholipidique est principalement constituée d’archaetidylinositol alors que chez Methanobrevibacter smithii (MBS), les archaeols et les caldarchaeols sont représentés en proportion équivalente et le phospholipide le plus souvent retrouvé est la phosphosérine (Sprott et al., 1999).
Figure 1-2. Comparaison des lipides membranaires des bactéries avec ceux des archées. a)
Membrane des bactéries b) Caldarchaeol c) Archaeol (figure adaptée de Albers and Meyer,2011).
La paroi des archées est elle aussi très différente de celle des bactéries. Premièrement, une seule espèce d’archée est connue à ce jour pour avoir deux membranes lipidiques, soit
Ignicoccus hospitalis (Albers & Meyer, 2011). Ensuite, la majorité des archées possède une
couche protéique à leur surface appelée «S layer», composée habituellement d’une seule espèce protéique ou glycoprotéique et souvent associée à la membrane cytoplasmique, qui contribuerait à la forme des cellules ainsi qu’à une protection contre les chocs osmotiques (Albers & Meyer, 2011). De plus, quelques espèces du groupe des méthanogènes possèdent une paroi composée de pseudopepdidoglycane ou pseudomuréine. Cette composante est semblable au peptidoglycane (muréine) bactérien quant à sa structure physique et sa fonction, mais diffère au niveau de sa composition chimique. En effet, alors que la peptidoglycane est composée d’acide N-acétylmuramique et de N-acétyl-D-glucosamine (NAG) liés par des liens β(14) glycosidiques, la pseudopeptidoglycane est composée d’acide
N-acétyltalosaminuronique (NAT) et de NAG liés par des liens β(14) glycosidiques (Visweswaran et al., 2011). Les archées, tout comme les bactéries, peuvent être classifiées selon deux groupes selon la composition de leur paroi : les archées à Gram positif, dont les membres possèdent du pseudopepdidoglycane dans leur paroi, et les archées à Gram négatif qui sont les plus fréquentes et qui ne possèdent que la couche protéique à leur surface (Kandler & Konig, 1998).
La membrane et la paroi des archées leur confèrent une stabilité augmentée à différents traitements. En effet, une membrane composée de caldarchaeols est davantage rigide et stable, tout en étant moins perméable (Patel & Chen, 2005). Cette propriété de la membrane des archées permet à plusieurs d’entre elles de résister à de hautes températures, à des pH extrêmes ainsi qu’à certaines activités enzymatiques (Patel & Chen, 2005). C’est entre autres grâce à cette stabilité accrue de leur membrane que plusieurs archées peuvent croitre dans des environnements extrêmes.
Par ailleurs, les archées possèdent une résistance intrinsèque à plusieurs antibiotiques. En effet, puisque la paroi des archées est dépourvue de peptidoglycane (muréine), les antibiotiques inhibant la production de cette composante telle la pénicilline, la vancomycine, la fosfomycine et les β-lactames n’ont aucun effet sur la croissance archéenne (Kandler & Konig, 1998). De plus, l’absence de stérols dans la paroi des archées empêche l’action de l’amphotéricine B (Baginski & Czub, 2009, Dridi et al., 2011). Enfin, nonobstant l’enveloppe cellulaire, les archées sont résistantes à des antibiotiques ciblant la réplication et la transcription de l’ADN bactérien (i.e rifampicine, ofloxacine), en raison de la plus grande similitude de ces processus moléculaires avec les eucaryotes (Dridi et al., 2011). Curieusement, il semble que seuls les agents antimicrobiens efficaces sur les bactéries et les eucaryotes ont un effet inhibiteur sur la croissance des archées retrouvées chez l’humain, telles Methanosphaera stadtmanae (MSS) et Methanobrevibacter smithii (MBS) (Dridi et al., 2011).
1.1.4 Biodiversité des archées
La communauté scientifique a longtemps pensé que les archées n’étaient présentes que dans les environnements extrêmes tels les sources d’eaux acides ou thermales, les bassins hyper salés, les sédiments marins ou les environnements complètement anoxiques. Cependant,
archées dans des environnements beaucoup moins hostiles (DeLong, 1998). Par exemple, des méthanogènes ont été retrouvées dans le lisier de porc (Whitehead & Cotta, 1999, Snell-Castro et al., 2005), dans le fumier des vaches (Gattinger et al., 2007) et des poules (Saengkerdsub et al., 2007) ainsi que dans les fèces humaines (Nottingham & Hungate, 1968, Dridi et al., 2009). Des espèces d’archées non cultivées ont par ailleurs été retrouvées dans d’autres niches écologiques (Auguet et al., 2010), tels le sol (Bates et al., 2011)et les océans (Venter et al., 2004). Cependant, dû aux exigences de croissance et de culture considérables de ces microorganismes, les archées ont été et sont encore peu étudiées par les microbiologistes. Les Crenarchaetoa, par exemple, seraient ubiquitaires autant en milieux terrestres qu’aquatiques mais peu de membres ont jusqu’à maintenant été cultivées (Baker et
al., 2003).
1.1.5 Méthanogènes
Les méthanogènes sont des espèces d’archées mésophiles appartenant au phylum des
Euryarchaeota. En effet, ces microorganismes sont les seuls à avoir le méthane comme
produit final de leur métabolisme. Ils utilisent la respiration anaérobique pour produire de l’énergie par différents procédés, soit la réduction du CO2 ou du formate (méthanogènes dits «hydrogénotrophes»), du groupement méthyl C1, l’acétate ou bien le méthanol et les groupements aminés et sulfurés pour produire le méthane grâce à l’hydrogène comme accepteur d’électrons (Liu & Whitman, 2008).
La méthanogénèse requiert différentes enzymes et cofacteurs uniques pour cette voie métabolique (Hedderich & Whitman, 2006). Il est ainsi possible de cibler les gènes de ces enzymes lors de l’amplification par PCR afin d’étudier ces microorganismes. Par exemple, le gène de la sous-unité α de la méthyl coenzyme M réductase (mcrA) est exclusif aux méthanogènes, à l’exception des archées oxydant le méthane, et démontre une phylogénie semblable à celle du gène de l’ARNr 16S (Steinberg & Regan, 2009). Par ailleurs, les gènes
mtaABC ne sont présents que chez l’espèce Methanosphaera stadtmanae et chez les espèces
du genre Methanosacrina et codent pour des enzymes uniques permettant de catalyser la réaction de la formation de la méthyl coenzyme M à partir du méthanol et de la coenzyme M (Ding et al., 2002, Fricke et al., 2006). Enfin, un gène impliqué dans la fixation de l’azote (nifH) peut aussi être utilisé comme cible dans des études de biodiversité des méthanogènes. En effet, chez les méthanogènes, ce gène code pour une enzyme nitrogénase non fonctionnelle et est unique à ce groupe de microorganismes (Johnston et al., 2010). La
coenzyme déazaflavine F420, un porteur d’électrons, est aussi seulement retrouvée chez les méthanogènes et est unique en son genre, puisqu’elle confère une autofluorescence intense à ce groupe de microorganismes lorsqu’elles sont exposées à une lumière ultraviolette de 420 nm (Garcia et al., 2000). Cette caractéristique peut être mise à profit afin de discriminer les méthanogènes d’autres types de microorganismes.
Les méthanogènes sont très sensibles à l’oxygène (Fetzer & Conrad, 1993, Yuan et al., 2009). Ces microorganismes possèdent un potentiel d’oxydoréduction d’environ -110 à -300 mV, tout dépendant des protéines impliquées dans le transfert d’électrons lors de la respiration (Thauer et al., 2008). Cette sensibilité est cependant très variable d’une espèce à l’autre. En effet, certaines espèces sont tuées après seulement quelques minutes à quelques heures d’exposition à l’oxygène, alors que d’autres peuvent tolérer une faible exposition d’une ou deux journées (Jarrell, 1985).
En raison des exigences élevées de croissance de ces microorganismes, il est très difficile de les cultiver (Wolfe, 2011, Khelaifia et al., 2013). Les méthanogènes ont une niche écologique diversifiée comprenant plusieurs environnements anoxiques, tels les sédiments marins et les sols inondés (Liu & Whitman, 2008), les rizières (Liu & Whitman, 2008, Yuan et al., 2009) et les digesteurs anaérobiques (Garcia et al., 2000).Elles sont aussi retrouvées en quantités considérables dans les fèces animales et humaines (Saengkerdsub & Ricke, 2013).
1.2 Exposition des humains aux archées : l’air
1.2.1 Les bioaérosols
Les bioaérosols sont des particules organiques en suspension dans l’air ayant un diamètre aérodynamique de 0,02 à 100 µm et provenant d’organismes vivants ou dépendants de la vie (plantes, champignons, bactéries, archées, animaux, humains, protistes, virus) (Ruzer & Harley, 2013). Ces particules peuvent être composées de microorganismes entiers morts ou vivants, de fragments de microorganismes, de protéines, d’allergènes de haut poids moléculaire, de toxines, de résidus métaboliques, ou de structures végétales microscopiques (ex. pollen, spores, fragments végétaux) (Douwes et al., 2003). Les bioaérosols peuvent avoir des propriétés infectieuses, allergéniques, toxiques ou pharmacologiques (Cox & Wathes, 1995) et peuvent donc affecter la santé des êtres vivants qui y sont exposés. Plusieurs composantes des bioaérosols demeurent inconnues, dont principalement les composantes
1.2.2 Méthodes d’échantillonnage des bioaérosols
Les différentes méthodes d’échantillonnage de l’air ont permis de caractériser les bioaérosols de plusieurs environnements de travail. Ces méthodes peuvent être classées en deux catégories, soit les méthodes traditionnelles par culture et les méthodes indépendantes de la culture microbienne. Les méthodes traditionnelles d’échantillonnage par culture permettent la caractérisation des microorganismes viables, souvent présents en faibles concentrations mais ayant une importance clinique plus grande. Les méthodes d’échantillonnage couplées à une analyse de la biodiversité par biologie moléculaire, au contraire, permettent une caractérisation des microorganismes non-viables des bioaérosols. Ces derniers sont habituellement présents en très grandes concentrations. Une grande partie des études de caractérisation des bioaérosols ont été effectuées en utilisant les méthodes de culture comme c’est le cas dans les bâtiments agricoles (Duchaine et al., 1999, Letourneau et al., 2010, Just
et al., 2011), les scieries (Duchaine & Meriaux, 2000, Duchaine et al., 2000), les cabinets de
dentiste (Dutil et al., 2009), les tourbières (Meriaux et al., 2006) ainsi que les usines de machinage (Gilbert et al., 2010, Gilbert et al., 2010). Cependant, ces méthodes sous-estiment grandement la charge microbienne et ne permettent pas une description complète des microorganismes retrouvés dans l’air (Amann et al., 1995).
Il est maintenant possible d’utiliser plusieurs types d’échantillonneurs en combinaison avec des méthodes de biologie moléculaire afin de décrire la biodiversité microbienne complète de l’air. En effet, des impacteurs liquides tels le Coriolis (Bertin Technologies, Montigny-le-Bretonneux, France)(Bertin Technologies) et le BioSampler (SKC Inc.), des cyclones à deux étages tel le NIOSH (BC 251) (Lindsley et al., 2006) ainsi que des échantillonneurs à filtre comme la cassette IOM (Institute of Occupational Medicine) permettent la capture de tous les microorganismes de l’air (cultivables ou non), qui peuvent ensuite être identifiés par des approches moléculaires. Chacun de ces échantillonneurs possède des caractéristiques de récolte des particules différentes adaptées à divers milieux, tout dépendant des analyses des résultats effectuées subséquemment. Ces caractéristiques sont le volume d’air échantillonné par minute, le médium dans lequel les particules présentes dans l’air sont échantillonnées, la grosseur des particules échantillonnées et la possibilité ou non de faire de l’échantillonnage personnel. Le Coriolis, qui peut échantillonner de grands volumes d’air par minute, est donc utilisé lorsque les agents recherchés sont en faibles concentrations dans l’air. L’échantillonneur NIOSH, lui, permet de séparer les particules de l’air échantillonnées selon leur grosseur et d’étudier chacune de ces fractions. L’Institute of Occupational Medicine a
conçu un échantillonneur, la cassette IOM, récoltant seulement les particules inhalables, pouvant pénétrer dans toutes les zones de l’arbre respiratoire, dont le D50 (diamètre aérodynamique minimum des particules échantillonnées à plus de 50%) est de 100µm.
La grande variété d’échantillonneurs d’air disponibles aide à améliorer la caractérisation des bioaérosols, mais engendre aussi certaines problématiques. En effet, il n’existe pas de lignes directrices quant au choix de l’échantillonneur à utiliser et il devient alors difficile de comparer les résultats obtenus dans des études effectuées avec des échantillonneurs différents.
1.2.3 Les bioaérosols en milieux de travail
Les bioaérosols sont retrouvés en plus ou moins grande concentration dans plusieurs environnements de travail. En effet, les environnements de travail peuvent être divisés en quatre groupes selon leur taux de charge biologique dans l’air, soit les milieux fortement contaminés, les milieux moyennement contaminés, les milieux faiblement contaminés et les milieux très faiblement contaminés (Thorne et al., 2014). Les milieux fortement contaminés aux bioaérosols regroupent entre autres les environnements agricoles (fermes d’élevage, bâtiments de confinement animal, bâtiments d’entreposage du grain) ainsi que les usines de traitement de matières organiques supportant la croissance microbienne telles les tourbières, les scieries et les usines d’épuration des eaux usées (Meriaux et al., 2006, Thorne et al., 2014). C’est dans ces milieux que sont davantage retrouvés les bioaérosols complexes, c’est-à-dire ayant une charge biologique variée et abondante. Les usines de transformation des aliments et les milieux domestiques dont la source de contamination microbienne est élevée sont quant à eux classés dans les milieux moyennement contaminés aux bioaérosols (Goyer et
al., 2001, Thorne et al., 2014). Certains milieux sont faiblement contaminés aux bioaérosols
tels les écoles, les maisons, les hôpitaux et les édifices à bureaux (Thorne et al., 2014). Enfin, les environnements très faiblement contaminés ont des normes très strictes quant aux niveaux de bioaérosols retrouvés et regroupent entres autres les milieux pharmaceutiques, les «salles blanches», certains laboratoires et les salles chirurgicales (Hurst et al., 2002, Thorne et al., 2014).
Les voies respiratoires des travailleurs de ces différents milieux sont exposées à des concentrations plus ou moins fortes de bioaérosols. Selon Hinds et collaborateurs, un adulte au repos respire 3 m3 d’air par 8 heures et levolume respiré lors d’un travail exigeant peut
environnements fortement contaminés aux bioaérosols sont donc fortement exposés aux différentes composantes des bioaérosols via leur système respiratoire.
1.2.4 L’impact des bioaérosols sur la santé respiratoire humaine
Les bioaérosols peuvent être la cause de problèmes respiratoires chez les travailleurs (ATS, 1998, Cormier et al., 2000, Meriaux et al., 2006, National Institute for Occupational Safety and Health, 2007, Gilbert et al., 2010). En effet, les personnes travaillant dans un milieu fortement contaminé par les bioaérosols telles les porcheries et les fermes laitières sont sujettes à respirer une quantité très élevée de particules biologiques. À titre d’exemple, à l’intérieur d’une porcherie, considérant qu’un travailleur inhale jusqu’à 42 m3 d’air lors d’une journée de travail et que les bioaérosols y contiennent en moyenne 108 bactéries par m3, un producteur de porcs pourrait respirer jusqu’à 1010 bactéries par journée de travail (Hinds, 1999, Nehme et al., 2008). Cette exposition aux poussières organiques peut avoir des impacts sur la santé respiratoire des travailleurs. En effet, le National Institute for Occupational Safety and Health (NIOSH) a rapporté une mortalité et une morbidité liées aux maladies respiratoires plus élevées chez les travailleurs exposés aux bioaérosols (National Institute for Occupational Safety and Health, 2007).
L’impact des particules biologiques dans l’air sur la santé humaine dépend de plusieurs facteurs tels que la nature de ces particules, leur immunogénicité, leur concentration, leur grosseur ainsi que le site de déposition de ces particules dans l’arbre respiratoire (Hinds, 1999, Roy & Milton, 2004). Les différences intrinsèques de l’hôte, par exemple la génétique, influencent aussi l’impact que peuvent avoir les bioaérosols sur la santé humaine (Hauswirth & Sundy, 2004). Seuls des microorganismes viables peuvent causer une infection respiratoire. Cependant, plusieurs composantes non viables des bioaérosols sont non infectieuses mais peuvent tout de même causer des dommages pulmonaires. En effet, ces dernières peuvent posséder des propriétés toxiques ou antigéniques pouvant causer des réactions allergiques ou d’hypersensibilité dans les voies respiratoires.
En plus de la concentration de la charge biologique dans l’air, la grosseur des particules contenues dans les bioaérosols est un déterminant majeur de leur impact sur la santé respiratoire humaine. L’arbre respiratoire humain est composé d’une section nasopharyngée regroupant les voies respiratoires supérieures (nez, bouche, larynx et pharynx), d’une section trachéobronchiale composée des voies respiratoires inférieures de la trachée aux bronchioles terminales et finalement, d’une section pulmonaire, les alvéoles, où les échanges gazeux se
font (Hinds, 1999, Roy & Milton, 2004). Les particules aérosolisées sont classées en différentes catégories selon leur diamètre aérodynamique et selon la région de déposition dans l’arbre respiratoire. Les particules inhalables ont un diamètre plus petit que 100µm et peuvent atteindre les voies respiratoires supérieures. La fraction thoracique regroupe les particules ayant un diamètre aérodynamique d’environ 10µm qui peuvent donc se déposer au niveau du larynx et des bronches. Finalement, les particules de la fraction respirable sont celles ayant un diamètre aérodynamique d’environ 3,5µm qui peuvent alors se déposer dans les bronchioles terminales et dans les alvéoles (Macher, 1999). Ces dernières particules sont les plus dangereuses pour la santé humaine puisqu’elles peuvent pénétrer profondément dans l’arbre respiratoire, là où il n’y a aucune surface muqueuse permettant l’élimination des corps étrangers (Hinds, 1999). Certaines particules peuvent être phagocytées par les macrophages alvéolaires ou être dissoutes et passer dans le système sanguin, mais ce processus prend des mois ou des années. Des particules de poussière fibreuses comme la silice ou l’amiante peuvent cependant interférer avec ces mécanismes de clairance et causer de la fibrose pulmonaire
(Hinds, 1999).
En effet, les particules contenues dans les bioaérosols ont un diamètre aérodynamique inférieur à 200µm et celles plus petites que 5µm, lorsque respirées, sont susceptibles de se rendre aux bronches ou aux alvéoles, où elles peuvent exercer leur potentiel toxique et/ou inflammatoire.Figure 1-3. Zone de déposition des particules dans l’appareil respiratoire humain (figure
inspirée de (Létourneau, 2010)1.2.5 Les maladies respiratoires non infectieuses associées aux bioaérosols
Diverses maladies de nature non infectieuse sont associées à l’exposition aux bioaérosols (Hauswirth & Sundy, 2004). En effet, cette exposition peut induire de l’inflammation pulmonaire causée par des agents toxiques ou pro inflammatoires, ou bien par des allergènes (Douwes et al., 2003). L’exposition aux bioaérosols peut donc mener à des réactions toxiques et être à l’origine de bronchites chroniques et de syndromes toxiques d’exposition aux poussières organiques (STEPO). Les bioaérosols peuvent aussi causer des réactions d’hypersensibilité telles l’asthme allergique, la rhinite et l’alvéolite allergique extrinsèque (AAE). Enfin, le syndrome du bâtiment malsain cause des symptômes non spécifiques qui sont associés à la présence de bioaérosols (Burge, 2004).
Les maladies respiratoires causées par les bioaérosols sont caractérisées par des réponses immunes distinctes. Par exemple, l’asthme est souvent caractérisé par une infiltration d’éosinophiles et de neutrophiles dans les poumons et de l’hyperréactivité bronchiquemenant à un remodelage tissulaire des voies respiratoires supérieures (Busse & Lemanske, 2001). À l’inverse, l’AAE présente une accumulation importante de lymphocytes dans les voies respiratoires, la formation de granulomes dans les poumons et de la fibrose pulmonaire (Girard & Cormier, 2010). La bronchite chronique est, quant à elle, caractérisée par des infiltrats tissulaires composés de monocytes et de lymphocytes et un recrutement de neutrophiles à la surface de l’épithélium (Balbi et al., 1994). Le STEPO induit une forte accumulation de neutrophiles dans les poumons (Lecours et al., 1986).
La nature des composantes des bioaérosols influence le type de réaction développée. Par exemple, les endotoxines retrouvées dans la paroi des bactéries à Gram négatif ont un fort potentiel inflammatoire (Heederik et al., 2007) et sont davantage associées au développement de réactions toxiques (Douwes et al., 2003). D’autres composantes sont davantage associées au développement de réactions d’hypersensibilité. En effet, l’AAE peut être induite par plusieurs différents agents tels les excréments d’oiseaux (poumon des éleveurs de pigeons), les champignons (poumon des champignonnistes) et l’écorce des érables (maladies des écorceurs de troncs d’érable) (Douwes et al., 2003). Une forme de AAE est principalement retrouvée dans les milieux agricoles, le poumon du fermier, et est causée par un actinomycète thermophile appelé Saccharopolyspora rectivirgula, croissant dans les ballots de foin humide. L’identification de ce microorganisme par les méthodes microbiologiques traditionnelles est ardue et les approches par biologie moléculaire sont maintenant utilisées pour sa détection (Duchaine & Cormier, 2010). Le poumon du fermier, bien que beaucoup
plus rare aujourd’hui, a été largement répandue dans les années 80 et 90(Canadian Centre for Occupational Health and Safety, 1997-2011, Arya et al., 2006). Les nouvelles technologies de mise en balles du foin ont permis de diminuer grandement l’incidence de la maladie, mais
S. rectivirgula demeure encore un agent important à documenter même si moins de fermiers
sont atteints.
Alors que certains agents biologiques retrouvés dans l’air sont reconnus pour causer des dommages pulmonaires (Tableau 1.2), l’étiologie de plusieurs symptômes rencontrés chez les travailleurs exposés aux bioaérosols demeure inconnue (Douwes et al., 2003). En effet, la complexité des bioaérosols de certains environnements augmente la difficulté de déterminer l’étiologie des différentes maladies. Plusieurs symptômes sont attribués à la forte présence d’endotoxines dans les bioaérosols, mais le ratio des concentrations d’endotoxines dans l’air versus la fréquence et la sévérité des symptômes n’est toujours pas prouvé (Poole & Romberger, 2012). De plus, la fraction importante des microorganismes non cultivables retrouvés dans l’air est encore mal caractérisée et l’impact de ces derniers sur les maladies respiratoires associées aux bioaérosolsest peu étudié. Il est aussi possible que la combinaison de certaines composantes dans l’air ait un effet synergique sur le développement de maladies respiratoires. Par exemple, Cormier et collaborateurs ont démontré qu’une infection virale augmentait la réponse immune à S. rectivirgula dans un modèle murin(Cormier et al., 1996). La caractérisation des différents agents composant les bioaérosols est donc nécessaire afin de comprendre les maladies respiratoires occupationnelles liées aux poussières organiques.
Tableau 1.2. Composantes des bioaérosols et maladies respiratoires associées
Composantes desbioaérosols
Maladies respiratoires
Symptômes Immunopathologies Références
Saccharopolyspora rectivirgula Poumon du fermier (AAE) Fièvre, malaise, nausée, oppression thoracique, mal de tête Lymphocytose, granulomes, fibrose pulmonaire, titre élevé d’IgG (May et al., 2012) Endotoxines, acide muramique, ammoniaque, sulfide d’hydrogène, acariens Bronchite chronique Toux produisant des expectorations durant trois mois (deux années consécutives) Neutrophilie (surface de l’épithélium), monocytose et lymohocytose dans les tissus (Balbi et al., 1994, May et al., 2012)
Endotoxines, spores fongiques, mycotoxines
STEPO Fièvre, malaise, dyspnée, oppression thoracique, mal de tête Neutrophilie, libération des cytokines 1, IL-6, IL-8, TNF (Lecours et al., 1986, Seifert et al., 2003, Hauswirth & Sundy, 2004, Heederik et al., 2007) Allergènes, endotoxines, peptidoglycane, ADN bactérien Asthme (allergique ou non), syndrome s’apparentan t à l’asthme Toux, oppression thoracique, dyspnée, respiration sifflante IgE (asthme allergique), éosinophilie, inflammation chronique, hyperréactivité bronchique, remodelage tissulaire (Busse & Lemanske, 2001, von Mutius, 2004, May et al., 2012) Allergènes, endotoxines, peptidoglycane, ADN bactérien Rhinite allergique Congestion, rhinorrhée, éternuements, prurit, inflammation de la muqueuse nasale Neutrophilie, IL-8, IL-6 (von Mutius, 2004, May et al., 2012) Spores de moisissures Syndrome du bâtiment malsain Congestion, prurit, gorge sèche, fatigue, mal de tête Inconnu (Douwes et al., 2003, Burge, 2004)
1.2.6 Les archées dans l’air
Les archées méthanogènes présentes dans les fèces animales et humaines sont susceptibles d’être aérosolisées et donc d’être présentes en grand nombre dans les bioaérosols de plusieurs milieux de travail tels les milieux agricoles (porcheries, fermes laitières, poulaillers). De fait, en 2009, Nehme et al. ont démontré la présence de jusqu’à 108 archées par m3 d’air dans les porcheries (Nehme et al., 2009).Les bioaérosols étudiés étaient composés principalement de deux espèces d’archées méthanogènes, soit Methanobrevibacter smithii (MBS) et
Methanophaera stadtmanae (MSS). Cette étude était la première à faire état de la présence
pas possible de détecter les méthanogènes avec les méthodes traditionnelles de culture puisque ces microorganismes sont extrêmement sensibles à l’oxygène donc sont très affectés par l’aérosolisation. Des études effectuées ultérieurement à l’étude présentée au chapitre III de cette thèse ont aussi démontré la présence d’archées dans l’air de poulaillers (Just et al., 2013) et d’usines d’épuration des eaux usées (Blais Lecours et al., 2014).
1.2.6.1 Methanobrevibacter smithii et Methanosphaera stadtmanae
MBS et MSS sont deux espèces d’archées méthanogènes Gram positives du phylum des
Euryarchaeota (Figure 1-3). Alors que MBS a une morphologie de coccobacilles de 1,5 à 2
µm et s’arrange en paires ou en petites chainettes (Miller et al., 1982, Dridi, 2012), les cellules de MSS sont des coques de 1,0 à 1,2 µm et forment des paires ou des tétrades (Dridi, 2012). Aucune des deux espèces n’est motile. Autant MBS que MSS sont hydrogénotrophes, mais MSS possède le métabolisme le plus restrictif de toutes les méthanogènes. En effet, contrairement à MBS, le seul donneur d’électrons qu’MSS utilise pour générer son énergie est le méthanol. De plus, MSS possède le plus bas taux de bases azotées G et C de tous les génomes archéens séquencés à ce jour (Fricke et al., 2006). Un protocole d’amplification de l’ADN par PCR a été mis au point pour l’amplification spécifique de l’ADN de MBS (Johnston et al., 2010), mais aucun protocole n’existe pour MSS.
Figure 1-4. Photos de MBS et MSS, deux espèces d’archées méthanogènes retrouvées dans
l’environnement humain. Les photos ont été prises au microscope à contraste de phase et au1.3 Exposition des humains aux archées : microflore intestinale
1.3.1 Composition des archées chez l’humain
Le corps humain est l’hôte de plusieurs espèces d’archées, la grande majorité étant des méthanogènes (Dridi et al., 2011). Des archées ont été retrouvées dans la bouche (Brusa et
al., 1993), le vagin (Belay et al., 1990) ainsi que l’intestin humain (Brusa et al., 1993, Dridi,
2012). Methanobrevibater oralis est l’espèce archaebactérienne principale d’origine buccale et serait indirectement responsable de causer la parodontite, une maladie inflammatoire chronique du parodonte. En effet, M. oralis utiliserait les produits finaux des réactions métaboliques des bactéries buccales anaérobies (H2, CO2, acétate, méthyamines) et permettrait à ces bactéries de croitre dans les interfaces entre les dents et les gencives, causant des dommages tissulaires locaux (Robichaux et al., 2003, Nguyen-Hieu et al., 2013). Une autre espèce du genre Methanobrevibacter, M. smithii, a été retrouvée dans des échantillons de fluides vaginaux (Belay et al., 1990). De façon surprenante, seuls les échantillons de patientes souffrant de vaginoses bactériennes se sont révélés positifs à l’archée. Le système digestif humain contient quant à lui une quantité importante d’archées, encore une fois principalement des méthanogènes. Le genre le plus souvent retrouvé est celui des Methanobrevibacter, mais les genres Methanosphaera et Methanomassiliicoccus peuvent aussi y être détectés (Dridi, 2012). Selon Pochart et al., les méthanogènes représenteraient 12% de la flore anaérobe totale du colon distal, mais seulement 0,003% dans le colon proximal (Pochart et al., 1993).
1.3.1.1 MBS et MSS dans l’intestin humain
MBS et MSS sont deux archées importantes du microbiote intestinal. Leur rôle serait de supporter la fermentation des polysaccharides en empêchant l’accumulation d’acides et de produits finaux de réactions métaboliques, ainsi que de consommer l’hydrogène produit par les autres microorganismes intestinaux (Stams, 1994, Samuel et al., 2007, Nakamura et al., 2010, Dridi et al., 2011). Tel que mentionné précédemment, MBS est l’espèce la plus fréquemment retrouvée dans l’intestin humain. Cette archée représenterait jusqu’à 11.5% de tous les microorganismes intestinaux (Eckburg et al., 2005). En ciblant les gènes universels de l’ARNr 16S et de la sous-unité β de l’ARN polymérase (rpoB) archaebactérienne, Dridi et
al. ont démontré une large prévalence (95,5%) de MBS dans des échantillons de selles
humaines, comparativement à MSS qui a été retrouvé chez seulement 29,4% de la population étudiée (Dridi et al., 2009). Ces données sont controversées puisque plusieurs autres études
démontrent que MBS n’est retrouvé que chez le tiers de la population des États-Unis et de la Grande-Bretagne (Johnston et al., 2010). À ce jour, les archées intestinales n’ont été associées qu’à une seule maladie, soit l’obésité. En effet, plusieurs études ont démontré la réduction de la fréquence et des quantités de MBS dans le microbiote intestinal des patients obèses (Million et al., 2011, Million et al., 2013). À l’inverse, des patients souffrant d’anorexie auraient des taux plus grands de cette archée dans l’intestin (Armougom et al., 2009). Une étude chez le rat a par contre démontré une association entre la colonisation du système digestif par MBS et la prise de poids (Mathur et al., 2013).
1.3.2 Maladies inflammatoires de l’intestin
La microflore intestinale est nécessaire au bon fonctionnement de la digestion. Par contre, il arrive que la présence de certains microorganismes dans le système digestif humain amène une problématique inflammatoire, comme c’est le cas pour les maladies inflammatoires de l’intestin (MII). L’incidence et la prévalence des MII sont en constante augmentation à travers le monde (Molodecky et al., 2012, Burisch et al., 2013). En Amérique du Nord, le nombre de patients diagnostiqués par année atteint entre 20 000 et 100 000 cas (Loftus, 2004). Les deux formes principales de ces maladies sont la maladie de Crohn (MC) et la colite ulcéreuse (CU). Elles se déclarent habituellement vers le début de l’âge adulte et persistent durant toute la vie du patient (Loftus, 2004, Hanauer, 2006). Les MII sont rarement létales, mais sont associées à une très grande morbidité (Podolsky, 2002, Hanauer, 2006). Elles sont caractérisées par des phases actives exigeant souvent l’hospitalisation des patients et par des phases de rémission plus ou moins longues (Manichanh et al., 2012). Ce qui induit les exacerbations (phases actives de la maladie) n’est encore pas très bien compris, mais des associations avec la prise d’antibiotique, le tabagisme, le stress, la pollution et la diète ont été décrites (Ananthakrishnan, 2013). Bien que certains traitements thérapeutiques et chirurgicaux soient disponibles afin de freiner les épisodes d’exacerbation, il n’existe malheureusement aucun traitement curatif pour l’une ou l’autre des deux formes de maladies. Les MII sont des maladies chroniques caractérisées par une inflammation incontrôlée de la muqueuse intestinale du colon (CU) ou du système digestif complet (MC) (Xavier & Podolsky, 2007, Abraham & Medzhitov, 2011). La source de cette inflammation est encore incertaine, mais l’hypothèse de la dysbiose, c’est-à-dire un déséquilibre entre les microorganismes commensaux bénéfiques et des pathogènes de la lumière intestinale semble