1+1
National Library 01 CanadaBibliothèque nationale du Canada
Acquisitions and Direction des acquisitions et Bibliographie services Branch des services bibliographiques
395 Wellington Street 395. rue Wellington
Ottawa. Ontario Ortawa (Onlario)
K1AON4 K1AON4
NOTICE
AVIS
.,
"
The quality of this microform is
heavily
dependent
upon
the
quality of the original thesis
submitted
for
microfilming.
Every effort has been mlde to
ensure the highest quality of
reproduction possible.
If pages a!"e missing, contact the
university
which
granted
the
degree.
Sorne pages may have indistinct
. print especially if the original
pages were typed with a poor
typewriter
ribbon
or
if
the
university sent us an inferior
photocopy.
Reproductionin full or in part of
this microform, is governed by
th~~
Canadian
Copyright
Act,
R.S.C.
j970,
c.
C·30,
and
subsequent amendments.
Canada
La qualité de cette microforme
dépend grandement de la qualité
de
la
thèse
soumise
au
microfilmage.
Nous avons tout
fait pour assurer une qualité
supérieure de reproduction.
S'il manque des pages, veuillez
communiquer avec l'université
qui a conféré le grade.
La
qualité
d'impression
de
certaines pages peut laisser
à .
désirer, surtout si
les pages
originales
ont
été
dactylographiées
à
l'aide d'un
ruban usé ou si l'université nous
a fait parvenir une photocopie de
qualité inférif:iure.
La reproduction, même partielle,
de cette m!croforme est soumise
à la Loi canadienne sur le droit
d'auteur, SRC 1970, c. C·30, et
ses amendements subséquents.
•
•
•
LES TENSIOMETRES POUR L'IRRIGATION EN MILIEU TOURBEUX
by
BENOIT LEBEAU
A thesis submitted to the faculty of Graduate Studies and Research in partial fulfillment
of the requirements for the degree of MASTER OF SCIENCE
in
Agricultural Engineering
Macdonald Campus of McGiII University, Montreal
1+1
National Ubraryof Canada Bibliothèque nationaledu Canada Acquisitions and Direction des acquisitions et Bibliographie Services Branch des services bibliographiques 395 Welli!l91on Siteel 395. rue Wellington
Ottawa. Ontario Ottawa (Onlario)
K1A 0N4 K1A ON4
THE AUTHOR HAS GRANTED AN IRREVOCABLE NON-EXCLUSIVE LICENCE ALLOWING THE NATIONAL LffiRARY OF CANADA TO
REPRODUCE, LOAN, DISTRmUTE OR SELL COPIES OF mSIHER THESIS BY ANY MEANS AND IN ANY FORM OR FORMAT, MAKING TmS THESIS AVAILABLE TO INTERESTED PERSONS.
THE AUTHOR RETAINS OWNERSHIP OF THE COPYRIGHT IN mSIHER THESIS. NEITHER THE THESIS NOR SUBSTANTIAL EXTRACTS FROM IT MAY BE PRINTED OR OTHERWISE REPRODUCED WITHOUT mSIHER PERMISSION.
ISBN 0-612-05577-9
Canadrt
L'AUTEUR A ACCORDE UNE LICENCE IRREVOCABLE ET NON EXCLUSIVE PERMETTANT A LA BffiLIOTHEQUE NATIONALE DU CANADA DE
REPRODUIRE, PRETER, DISTRmUER OU VENDRE DES COPIES DE SA THESE DE QUELQUE MANIERE ET
SOUS QUELQUE FORME QUE CE SOIT POliR METTRE DES EXEMPLAIRES DE CETTE THESE A LA DISPOSITION DES PERSONNE INTERESSEES.
L'AUTEUR CONSERVE LA PROPRIETE DU DROIT D'AUTEUR QUI PROTEGE SA THESE. NI LA THESE NI DES
EXTRAITS SUBSTANTIELS DE CELLE· CI NE DOIVENT ETRE IMPRIMES OU AUTREMENT REPRODUITS SANS SON AUTORISATION.
•
RÉSUMÉLa gestion dese~uxd'irrigation des cultures en récipients demeure toujours une tâche réservée à un personnel très qualifié. N'ayant pas les instruments nécessaires pour déterminer les besoins d'eau réels, les serristes et pépiniéristes peuvent enregistrer des pertes de croissance de leurs cultures de l'ordre de 20 à
30%, dues au stress hydrique.
Après avoir revu les différentes méthodes utilisées pour la culture au champ, des essais ont été réalisés sur l'utilisation de tensiomètres en vue de solutionner le problème.
Les tests ont été effectués sur deux substrats tourbeux, utilisant deux types de capsules poreuses (1 bar - débit standard et 1 bar - débit rapide). Les instruments ont également été utilisés sous deux modes soit fixe, ou non fixe permettant de prendre une lecture ponctuelle en trois heures.
Les résultats démontrent que les instruments donnent d'excellents indices pour les conditions normales de production, soit lorsque le taux de saturation est maintenu entre 50 et 100% et ce, sous les deux modes d'utilisation.
Idéalement, le choix de l'instrument doit être basé sur les caractéristiques hydriques du substrat. Peu de différence a été observé dans le substrat 1, utilisant les deux types d'instrument, mais dans le substrat 2 la capsule
à
débit rapide a donné de meilleurs résultats. Cette demière a en fait une plus grande porosité et des pores plus grosses qui s'adaptent mieux aux caractéristiques du substrat 2, constitué de particules plusgrossières que le substrat 1.•
•
ABSTRACT
Water management for the irrigation of containerized production remains a task reserved to a highly qualified personnel. Without proper instruments to determine the actual water needs, nursery crops can face growth losses of 20 to 30%.
Reviewing the differant methods that are used in field production, tensiometer have shawn the greatest potential of adaptation to potted plants.
Tests on the unlization oftensiometerwere realized on two peat-vermiculite substrates, using two types of porous cup (1 bar - standard flow and 1 bar - hlgh flow). The instruments were tested while permanently fixed in the growlng medium, and temporarily fixed for three hours in the growing medium.
The results show that the instruments give excellent measurements for normal condition of growth, requiring saturation level between 50 and 100%, and that for both mode of operation.
Preferably, the choice of the Instrument should be based on the hydraullc characteristics of the substrate. Little difference have been found using both instrument in the substrate 1, but in substrate 2 however, the high f10w porous cups have given better response. The high f10w cups have higher poroslty and
bigger pores that suit better substrate 2, which is made of coarser partlcles.
REMERCIEMENTS
Je tiens en premier à remercier mon épouse, Gita Nayeri, qui a bien accepté de sacrifier plus d'un an de notre vie commune, pour que je puisse réaliser mon projet de maîtrise. Seule à Brockville, Ontario, enceinte de notre garçon, Jonathan-Navid, elle m'a aidé et encouragé tout au long de mes études.
Jonathan,àqui je désire dédier ce projet de recherche, a sans aucun doute été ma source d'énergie principale en fin de course.
Je remercie également M. Conrad Drolet et M. Jean-Paul Campagna, de la pépinière forestière de Berthier du Ministère des ressources naturelles, pour m'avoir permis de faire mon projet d'étude. Je tiens à souligner aussi l'aide et l'information que m'ont donnée l'équipe professionnelle et technique de la pépinière. Je suis très reconnaissant
à
l'équipe de l'irrigation qui a da sa plierà
quelques prescriptions d'irrigation particulières. MerciàM. Yves Perreault, qui m'a fait connaître la gestion de l'irrigation des semis forestiers cultivés en récipients et qui a participé à la prise de lecture.
Merci à Dr. Suzelle Barrington, ma directrice de thèse. Ses recommandations en ce qui a trait l'analyse des résultats, sa coopération et son encouragement ont été très appréciés.
De l'université McGiII, je dois également des remerciements
à
Dr. A.M.O. Mohamed du département de Génie civil pour m'avoir fait connaître M. Frank Caporuscio, du centre de recherche de géotechnologie. M. Caporuscio m'a permis de réaliser les tests de rétention d'eau de mes substrats en laboratoire. Je tiensàle remercier tout particulièrement pour son aide et d'avoir pris le temps d'installer et de mettre
à
ma disposition l'équipement nécessaire.•
TABLE DES MATIERES1- INTRODUCTION .. . . 1
1.1 Objectifs . . . 5
1.2 Limites du projet 6 11- REVUE DE LITTÉRATURE . . . 7
2.1 L'importance de l'eau et de l'irrigation pour les plantes. . . 7
2.1.1 L'excès d'eau 7 2.1.2 Le manque d'eau 9 2.1.3 Les avantages d'un stress hydrique modéré . . . 9
2.1.4 Les avantages d'une bonne gestion de l'eau. . . .. 11
2.2 Instrument de mesure de la teneur en eau 13 2.2.1 Les méthodes manuelles . . . .. 14
2.2.1.1 Méthode à la vue et au touché ...• 14
2.2.1.2 Méthode de la pesée du contenant 14 2.2.2 Les méthodes mécaniques ...•... 15
2.2.2.1 Diffusion de neutrons .•... 15
2.2.2.2 Absorption ou atténuation de rayon gamma 16 2.2.2.3 Bloc de résistance électrique . . . .. 16
2.2.2.4Tensiomètre . • . . . • . . . .. 17
2.3 Le potentiel matriciel du sol ...•...••. 18
2.3.1 Potentiel osmotique . . . • . . . .. 19
2.3.2 Potentiel de gravitation 19 2.3.3 Potentiel matriciel ...•.... 20
2.4 Courbe de rétention d'eau .•...•...••• 20
•
111- MÉTHODE ET DISPOSITIF EXPÉRIMENTAL ... . . .. 233.1 Caractérisation des matériaux 23 3.1.1 Courbe de rétention en laboratoire . . . .. 24
3.1.2 Densité apparente, granulométrie et densité des particules 29 3.1.2.1 Densité apparente 30 3.1.2.2 Granulométrie 31 3.1.2.3 Densité des particules. . . .. 31
3.2 Essais de micro-tensiomètres . . . .. 32
3.2.1 Fabrication des micro-tensiomètres 32 3.2.2 Échantillonnage des substrats pour les essais 35 3.2.3 Essais ...•... 35
3.2.4 Analyse statistique 40 IV- RÉSULTATS ET DISCUSSION 42 4.1 Caractérisation des matériaux ..•... 42
4.1.1 Observations générales . . . • . . . . .. 42
4.1.2 Granulométrie . . . .. 42
4.1.3 Densité apparente et densité des particules ...•... 46
4.1.3.1 Densité apparente ...•.••... 46
4.1.3.2 Densité des particules. • . . . .. 46
4.1.4 Courbes de rétention . • . . . .. 48
4.2 Performance des tensiomètres . . • . . . • • . . . • . • • .• 54
4.2.1 Micro-tensiomètre fixe à débit standard (SF) • • . . • • • .. 54
4.2.2 Micro-tensiomètre fixe à débit rapide (HF) 65 4.2.3 Micro-tensiomètre non-fixe à débit régulier (SNF) .73 4.2.4 Micro-tensiomètre non-fixe à débit rapide (HNF) 76 V- CONCLUSION .... . . • . . . .. 79
LISTE DES TABLEAUX
Tableau 1: Superficie et valeur de la production de la floriculture sous
serre 3
Tableau 2: Caractéristiques des pierres poreuses, utilisées pour la
construction des micro-tensiomètres 34
Tableau 3: Cédule des essais de micro-tensiomètres 39
Tableau 4: Capacité de rétention d'eau du substrat 1 43
Tableau 5: Capacité de rétention d'eau du substrat 2 43
Tableau 6: Granulométrie du Substrat 1 44
Tableau 7: Granulométrie du Sub.::!rat 2 . . . .. 44
Tableau 8: Densite Apparente 47
Tableau 9: Densité des Particules . . . • . . . 47
Tableau 10: Caractérisation moyenne des carottes des substrats 1 et 2 . .. 55
Tableau 11: Sortie de régression des modèles mathématiques utilisés . . .. 57
LISTE DES FIGURES
Figure 1: Nombre de plants reboisés par année 4
Figure 2: Courbes de rétention d'eau de trois types de sol et d'un
substrat tourbeux 21
Figure 3: Exemple de courbe de rétention d'eau 21 Figure 4: Disposition des récipients dans le tunnel expérimental 25 Figure 5: Zone d'échantillonnage dans la carotte 26 Figure 6: Échantillon dans un anneau de soutient . . . .. 26 Figure 7: Micro-tensiomètre expérimental . . . .. 33 Figure 8: Position du micro-tensiomètre dans la carotte . . . .. 36 Figure 9: Courbes de rétention du substrat 1 mesurées en laboratoire ..•. 49 Figure 10: Courbes de rétention du substrat 2 mesurées en laboratoire .•. 50 Figure 11: Courbes de rétention minimales et maximales des substrats 1
et 2, mesurées en laboratoire ...•....•.... 51 Figure 12: Taux de perte d'eau des échantillons au cours de la
détermination des courbes de rétention d'eau du substrat 1
en laboratoire . . . • • • . • • . . . .. 52 Figure 13: Taux de perte d'eau des échantillons au cours de la
détermination des courbes de rétention d'eau du substrat 2
en laboratoire . . . • . . . .. 53 Figure 14: Courbe de rétention d'eau du substrat 1 obtenue à l'aide des
micro-tensiomètres SF ...•...•••...•... 56 Figure 15: Performance des micro-tensiomètres SF dans le substrat 1 •.. 59 Figure 16: Courbe de rétention d'eau du substrat 2 obtenue
à
l'aide desFigure 17: Performance des micro-tensiomètres 8F dans le substrat 2 . . .. 62
Figure 18: Courbes de rétention d'eau des substrats 1 et 2 obtenues à
l'aide des micro-tensiomètres 8F . . . .. 64
Figure 19: Perforrnance des micro-tensiomètres HF dans le substrat 1 . . .. 66
Figure 20: Courbes de rétention d'eau du substrat 1 obtenues à l'aide
des micro-tensiomètres 8F et HF 67
Figure 21: Performance des micro-tensiomètres HF dans le substrat 2 . . .. 69
Figure 22: Courbes de rétention d'eau du substrat 2 obtenues à l'aide
des micro-tensiomètres 8F et HF 70
Figure 23: Courbes de rétention d'eau des substrats 1 et 2 obtenues à
l'aide des micro-tensiomètres HF . . . .. 72
Figure 24: Performance des micro-tensiomètres 8NF dans le substrat 1 . .. 74
Figure 25: Performance des micro-tensiomètres SNF dans le substrat 2 . .. 75
Figure 26: Performance des micro-tensiomètres HNF dans le substrat 1 77
Figure 27: Performance des micro-tensiomètres HNF dans le substrat 2 78
•
1· INTRODUCTIONUne bonne gestion de l'eau està la base de la réussite de toute production de qualité. Un milieu saturé pendant trop longtemps, ou un manque d'eau pour une période prolongée, peut causer des pertes importantes de rendements.
Par conséquent, la gestion de l'eau des plants cultivés en récipients demeure une tâche réservée à un personnel très qualifié. Les techniques servant
à déterminer le niveau d'humidité des substrats sont très subjectives et I~s
instruments de mesure ne sont pas disponibles. Bien que plusieurs instruments existent pour la culture au champ, ceux-ci ne peuvent généralement pas être utilisés en récipient, soit à cause de leurs dimensions, ou bien à cause du milieu dans lequel ils doivent être utilisés.
Le problème est important et concerne plusieurs producteurs, tels les serristes et les pépiniéristes. Pendant les saisons fraîches et froides, ces derniers arrosent trop souvent leur culture, alors que durant les chaleurs de l'été, ils arrosent trop peu souvent, ce qui cause des pertes de croissance de 20 à 30 %,
dues au stress hydrique (Ross et al, 1985).
Un instrument servant à déterminer l'état de l'eau des substrats de culture est donc nécessaire pour réduire ces pertes et pourrait ainsi s'appliquer à une production végétale importante en serre.
Au Canada, la superficie totale de production en serre de verre et plastique, pour 1993, était de 9.53 millions de m2, alors que la valeur totale des ventes était
de 763 millions de dollars. A elle seule, l'industrie florale rapportait 626 millions de dollars. Selon Statistique Canada (1993), la production floricole de 1993 comprenait 146 millions de fleurs coupées, 108 millions de plants en pots et 797 millions de plants destinés à des plate-bandes.
L'industrie des cultures de serres au Québec a connu un développement rapide au cours de la dernière décennie. L'horticulture omementale a par exemple évoluéàun rythme annuel moyen de 12%, depuis 1983. D'autre part, l'horticulture maraîchère a plus que doublé ces superficies !ln culture de légumes de 1981 à
1990, passant de 40,5 haà 90,3 ha.
Les potées fleuries se retrouvent au second rang de la production québécoise sous serre en termes de valeur des ventes (Tableau 1
l,
même si leur surface de production n'a augmentée que de 2% de 1983 à 1990.Entre les années 1983 et 1991, le Québec a reboisé un nombre important de plants forestiers, pour atteindre un maximum de 250 millions de plants en 1990-1991 (Figure 1
l.
Cet objectif a pu être atteint grâce à la production de semis forestiers en récipients. En 1990-1991, quelques 205 millions de semis forestiers étaient cultivés en récipients, soit dans des serres, ou bien dons des tunnels. La production en récipients représente plus de 80% de la production provinciale de semis forestiers et est estimée à plus de 25 millions de dollars.Tableau 1: Superficie et valeur de la production de la floriculture sous serre (Source: MAPAQ, 1992)
-Catégories 1983 1988 1990
de
fleurs superficie valeurà la superficie valeur à la superficie valeur à la
production production production
(ha) ('000$) (ha) ('000$) (ha) ('000 $)
Fleurs 53.9 11688 54.0 14000 60.0 plus de annuelles 15000 Fleurs 1.4 374 1.5 500 3.0 500 vivaces Fleurs 4.9 2535 6.8 4000 7.0 4000 coupées Bulbes 0.6 160 0.6 200 0.6 200 Potées 9.8 10236 9.7 12000 10.0 plus de fleuries 12000 Paniers 8.0 4462 8.0 4500 8.0 4500 suspendus 1 Total 1/ 78.6
1
29455 1 80.6 1 35200 1 88.6 1 plus de 1 36200•
•
:Il
CD C
;
....
nombre de plants (millions)...
...
1\) 1\) c.> Z en 0 en 0 en 0 0 1974-19750 0 0 0 0 0 0 3 cr al 1975-1976 a. CD 1976-19n "2-Pl 19n-1978 ~ -fil 1978-1979 al cr 1979-1980~
CD- 1980-1981 fil "C 1981-1982 Pl.,
Pl 1982-1983 ~ ~ CD- 1983-1984 CD ~ 1984-1985 ~ 5· !!l. 1985-1986 CD-al 1986-1987 a. 1987-1988 CD fildl
1988-1989~
1989-1990...
1990-1991 CD CD 1\) ~•
Dans le but de remédier au problème de gestion de l'eau, qui touche plus de 88 ha de productions végétales abritées, un instrument est recherché pour déterminer les cédules optimalesd'irri!~ation. Une meilleure gestion assurerait non seulement une production optimale, mais aussi une réduction du gaspillage d'eau et des pertes de fertilisants par lessivage.Après avoir considéré les différentes techniques et instruments disponibles sur le marché, le choix s'est arrêté sur les micro-tensiomètres. Ces instruments semblent bien s'adapter aux récipients et permettent d'avoir un indice indirect du stress interne de la plante.
1.1 Objectifs
Les objectifs de ce travail sont donc:
1- de vérifier l'utilisation de micro-tensiomètres dans un milieu tourbeux, pour céduler les opérations d'irrigation,
2- de comparer la précision des micro-tensiomètresàdébit standardà ceux
à débit rapide,
3- de vérifier le temps de réponse des instruments,
4- de déterminer la tension
à
laquelle l'irrigation des substrats utilisés doit être déclenchée.•
1.2 Limites du projetLe projet a été réalisé à la pépinière forestière de Berthier du Ministère québécois des ressources naturelles. Les tests ont été effectués sur deux substrats différents, faits à base de tourbe et de vermiculite. Ces mélanges sont utilisés en pépinière forestière pour la culture du bouleau jaune.
Les tensiomètres utilisés furent construits selon la méthode détaillée i'lar Cassel et Klute (1986) et étaient de deux types, soit fait d'une céramique à débit standard, ouàdébit rapide. Ils ont été utilisés selon deux modes, soit fixe, ou non-fixe, permettant ainsi de vérifier la possibilité d'utiliser les instruments de façon à
prendre une mesure ponctuelle de l'état de l'eau du substrat.
Pour vérifier la précision des relevés pris
à
l'aide des micro-tensiomètres, les résultats ont été comparésà
des essais de rétention d'eau des deux substrats réalisés en laboratoire.•
11- REVUE DE LITTÉRATURE2.1 L'importance de l'eau et de l'irrigation pour les plantes
En général, l'humidité du sol est un facteur limitant la croissance des cultures, soit lorsqu'elle est trop basse ou trop élevée (Larson, 1974). Ces deux conditions extrêmes causent la plupart du temps un stress indésirable aux plantes. Cependant, à certains moments on peut laisser baisser volontairement l'humidité du sol, ou du substrat, pour contrôler la croissance des plants.
Jarvis (1992) définit le stress comme étant un facteur pouvant produire une tension dommageable pour le plant. La tension est dans la plupart des cas élastique, c'est-à-dire réversible, mais peut devenir plastique (irréversible) si le stress est trop sévère ou prolongé. Chez les plantes, la tension est mesurée en termes de déformation des cellules et tissus, ou par des changements de métabolisme.
2.1.1 L'excès d'eau
Arroser abondamment les plants durant l'été favorise la croissance, mais peut aussi causer à certains moments de sérieux problèmes, soit à cause d'une nouvelle pousse trop tardive, soitàtort de favoriser le développement de certaines maladies et la pourriture des racines.
Quand les apports d'eau dépassent légèrement les besoins, les plants peuvent devenir plus grands, mais aussi plus tendres, dû àune haute teneur en eau des cellules. Ceci peut faire flétrir certaines plantes plus rapidement lors de journées très ensoleillées, ou encore lors de conditions d'air sec (Nelson. 1991).
•
De tels plants sont généralement plus fragiles, donc se conservent moins bien après la récolte et s'adaptent mal au transport.Dans une situation où les semis poussent vites et forment des bourgeons, une pousse peut être provoquée tard l'été, ou tôt l'automne. Même si des plants plus grands semblent être favorables, une autre pousse tard en saison est plus souvent nuisibleà la vigueur de la plante étant donné que les nouveaux tissus des semis sont peu résistants et peuvent être endommagés par le gel (Duryea, 1984).
En revanche, un sol saturé en eau peut entraîner l'asphyxie des racines retardant ainsi le développement des racines et réduisant la photosynthèse. Aussi, un volume d'air du substrat de moins de 20% pendant trop longtemps produit certains processus de réduction dans les sols, telle la dénitrification (Williams et Hanks, 1976). Ce processus est responsable des pertes d'azote sous forme gazeuse par volatilisation, réduisant les engrais azotés disponibles à la plante.
En plus d'être responsable du lessivage des éléments nutritifs, un surplus d'eau encourage le développement des maladies causées par des champignons (Williams et Hanks, 1976). Un excès d'eau favorise entre autres la présence de pathogènes tels que le Phytophthera, le Pythium et le Fusarium (Lavender, 1984). Ces champignons provoquent la fonte des semis en pré-émergence et l'infection du plant en croissance (Thompson, 1984).
2.1.2 Le manque d'eau
Lorsque la plante manque d'eau, celle-ci subit aussi un stress hydrique (McDonald, 1984). Ce phénomène se produit lorsque le potentiel de l'eau de la plante (PMS) tombe sous -12 à -15 atm. Un stress semblable peut altérer la croissance de la plante. Le temps nécessaire pour atteindre ce stress dépend de plusieurs facteurs dont l'eau du sol disponible à chaque semis, la demande en évaporation et les caractéristiques des semis. Le potentiel d'eau auquel la plante est sensible peut varier selon plusieurs facteurs tels l'espèce, l'âge et le stade phénologie (McDonald, 1984).
Le stress hydrique affecte entre autres la photosynthèse, retarde la croissance et la maturation des racines et interfère avec l'absorption d'eau et la capacité de conduction du système racinaire (Larson, 1974). En fait, la croissance ainsi que les fonctions physiologiques et métaboliques s'y reliant sont les premiers processus
à
être retardés quand l'eau devient manquante (McDonald, 1984). L'élongation des racines et de la tige et la croissance en volume et en poids sec sont sévèrement limitées (McDonald, 1984). En plus, Duryea (1984) rapporte qu'un stress sévère (10 atm < PMS < 15 atm) peut également inhiber la formation de bourgeons et réduire la résistance au froid.2.1.3 Les avantages d'un stress hydrique modéré
Il est donc important d'éviter les stress sévères et plutôt d'opter pour un stress hydrique modéré. Selon Duryea (1984), cette approche a plusieurs avantages. Elle peut:
- causer une formation hâtive des bourgeons,
•
- rendre les plants plus résistants au froid,- rendre les plants plus tolérants lorsque les racines sont exposées à l'air lors de l'extraction, de l'entreposage et de la manutention,
- donner de plus petit semis, démontrant un rapport hauteur:diamètre plus près de l'unité,
- empêcher les délais de bourgeonnement au printemps suivant, - donner un meilleur potentiel de survie au champ.
La date de l'induction du stress hydrique est par contre très importante. Des semis ayant reçu le stress hydrique plutôt en saison sont de dimensions plus petites avec un poids sec des racines plus élevé (Duryea, 19B4). En plus, la résistance au froid des sapins Douglas diminue quand la date d'initiation du stress est retardée (Duryea, 19B4).
Le stress hydrique modéré (PMS= Bà 12 atm à la pré-aube) devrait être appliqué aussitôt que la culture à atteint la hauteur et le diamètre désiré. Mais· puisque le stress modéré optimum varie selon le type de sol, les conditions climatiques et l'espèce des semis, les niveaux exacts doivent être définis pour chaque pépinière. L'élaboration d'un régime d'irrigation et la vérification de son effet sur la qualité des semis pour chaque pépinière sont donc essentielles avant qu'une prescription puisse être faite.
•
2.1.4 Les avantages d'une bonne gestion de l'eauL'objectif premier de la gestion de l'eau est d'éviter un stress hydrique indésirable aux plants et les conséquences négatives aux semis qui s'en suivent. Il peut également servir à protéger les plants contre des conditions climatiques extrêmes, ou pour certaines pratiques culturales.
Mise à part la période de la germination, qui demande un apport d'eau régulier de petit volume, l'irrigation des plants sous-entend par la suite une saturation complète du substrat de culture (Van Eerden, 1974; Thompson, 1984).
Au moment de la germination, seule la zone supérieure du substrat nécessite d'être maintenue humide, ce qui requiert de petits volumes d'eau. Plus tard, tout le substrat doit être par contre maintenu humide puisque les racines envahissent rapidement le milieu de culture.
Pour que l'eau puisse s'infiltrer dans le substrat, la zone supérieure doit avant tout être saturée. Ainsi, lors d'irrigation, il est important d'atteindre la saturation complète du substrat. Ceci permet également l'évacuation des sels accumulés. Une concentration de sels minéraux trop élevée, provenant des fertilisations fréquentes, peut causer des dommages aux racines et limiter l'approvisionnement en eau de la plante (Nelson, 1991). Pour éviter ce problème, on recommande en général d'appliquer lors de l'irrigation un surplus d'eau d'environ 10% (Langhans, 1990).
Après ressuyage, une irrigation efficace permet donc de garder les pores du sol, ou du substrat, remplis d'une fraction d'eau et d'une fraction d'air (McDonald, 1984). La présence d'une phase gazeuse volumétrique importante est une caractéristique primordiale dans un support de culture. Celle-ci permet en
particulier l'approvisionnement en oxygène du système racinaire et l'évacuation du gaz carbonique produit par la respiration des racines et des micro-organismes.
En général, les recommandations d'irrigation pour plants forestiers sont établit d'après (Duryea, 1984);
- l'espèce d'arbre,
- la taille actuelle des plants par rapport aux spécifications des semis, - le stade de croissance des plants,
- les conditions climatiques, - les caractéristiques du sols,
- la cédule des autres pratiques culturales, - la densité du lit de semences.
Il existe également des périodes d'Irrigation critiques, commune à chaque pépinière, telles que (Duryea, 1984);
- pour rafraîchir les semences qui viennent d'être semÉles ou viennent de germées,
- pour maintenir une température et un taux d'humidité acceptable pour les jeunes semis,
- pour promouvoir la croissance des plants, - pour protéger les semis contre la gelée,
- pour augmenter le rendement de plusieurs pratiques culturales telles que la fertilisation, la culture de racines, l'extraction et le repiquage,
- pour contrôler le stress hydrique et l'endurcissement des semis, - pour aider les semis
à
entrer en dormance.Réunissant l'ensemble des informations, on conclut qu'il est important, lors d'irrigation, de saturer le substrat sur toute sa hauteur. Après l'irrigation, par
•
contre, ilost suggéré de laisser les plants utiliser l'eau disponible, jusqu'à ce qu'on observe un stress hydrique modéré.Dans plusieurs cas, la croissance est réduite considérablement lorsque 50 %de la réselve en eau a été utilisée. Ainsi l'irrigation devrait commencer à ce point pour une croissance optimum (Warkentin, 1984).
En appliquant cette technique, on crée une fluctuation de l'humidité du sol . particulièrement favorable au développement des plants (Gonzalez et D'Aoust,
1988).
A moins d'avoir une très bonne connaissance du milieu de croissance et des besoins des plants cultivés, la gestion de l'irrigation de façon optimale requiert l'utilisation d'instruments de mesure, permettant de déterminer l'état de l'eau du substrat.
2.2 Instrument de mesure de la teneur en eau
Contrairement à la culture en racines-nues, il y a peu de méthodes ou d'instruments disponibles pour déterminer rapidement et avec précision la teneur en eau des substrats des plants cultivés en récipient. Les méthodes actuelles consistent soit à la pesée du contenant, soit à la méthode très subjective de la vue et du touché des carottes.
2.2.1 Les méthodes manuelles
2.2.1.1 Méthodeà la vue et au touché
Cette méthode consisteàun examen subjectif du substrat. La personne en charge de l'irrigation peut, par la couleur du substrat, faire une première estimation de la teneur en eau. En compressant ensuite la carotte avec la main, elle peut évaluer le degré de saturation de la carotte. Cette méthode a l'avantage d'être très rapide, mais par contre ne permet pas de déterminer avec précision les besoins d'eau réels de la plante. Cette tâche doit donc être remplie par une personne qualifiée pour juger adéquatement les besoins d'eau.
2.2.1.2 Méthode de la pesée du contenant
Cette méthode nécessite qu'une balance et consiste
à
déterminer au préalable le poids du récipient lorsque la substrat est saturé et le poids du récipient et du substrat lorsque l'irrigation est nécessaire. Ainsi l'irrigation peut être déclenchée au moment où le poids du récipient atteint cette deuxième mesure. Cette méthode bien que quantitative et précise peut induire en erreur la personne chargée de l'irrigation si le poids croissant des plants n'est pas considéré tout au long de la saison. En plus, cette méthode et bien d'autres utilisées aux champs, n'indiquent pas l'état de stress des plants, mais seulement la teneur en eau du sol, qui n'est pas nécessairement disponible aux plants.•
2.2.2 Les méthodes mécanIquesLes problèmes associés aux méthodes manuelles ont donc favorisé la recherche de nouvelles techniques. Les critères sur lesquels l'étude se basent incluent;
- la précision,
- la facilité d'utilisation,
- le degré d'adaptation aux récipients.
Les techniques qui ont été revues, dans l'espoir de pouvoir en adapter une
à la culture en récipient sont entre autres:
- la diffusion de neutrons (neutron scattering) - les rayons gamma
- les blocs de résistance électrique - les tensiomètres
2.2.2.1 DIffusion de neutrons
Cette méthode est basée sur le phénomène du ralentissement marqué des neutrons par les atomes hydrogènes, comparativement
à
d'autres atomes. En comptant le nombre de neutrons ralentis, émis d'une source, il est possible d'estimer la teneur en atome d'hydrogène d'un certain sol et ainsi en inférer la teneur en eau. Cette méthode est la plus utilisée des méthodes indirectes pour déterminer la teneur en eau des sols minéraux, puisque l'eau est principalement la seule source d'atome hydrogène. Par contre, dans les sols où il a présence d'une fraction importante de matière organique, ou bien une densité racinaire considérable, il y a des risques d'erreur étant donné que des atomes hydrogènes, autre que ceux de l'eau, y sont présent (Kramer. 1983).2.2.2.2 Absorption ou atténuation de rayon gamma
Cette méthode se base sur le changement de radiation absorbée par le sol lors de variation de sa teneur en eau. La quantité de radiation pouvant traverser une couche de sol dépend de la densité, ce qui varie principalement avec la teneur en eau. On rapporte par contre que cette technique ne peut être utilisée dans des sols qui peuvent ~ubir des retraits et gonflements (shrink and swell), à
moins que les changements de la densité apparente soient très petits comparativement à ceux de la teneur en eau (Kramer, 1983).
Bien que ces techniques soient de haute technologies, elles ne sont guère utilisables dans la culture en récipient, principalement à cause de leurs grandes dimensions, mais également à cause du milieu de culture, qui est de nature organique et qui risque d'affecter considérablement les lectures.
2.2.2.3 Bloc de résistance électrique
A part le contrôle de l'état hydrique d'un sol par la mesure de la teneur en eau, on peut mesurer le potentiel matriciel de l'eau retenue dans le sol. Ceci peut se faire d'une façon indirecte utilisant des blocs de résistance, ou bien de façon directe à l'aide de tensiomètres.
Ces techniques plus simples sont à priori plus intéressantes et surtout mieux adaptées à la culture de semis en récipient.
Les blocs de résistance électrique sont des blocs fait de matériel poreux, tel que du gypse, de la fibre de verre, du nylon, ou du plâtre de paris, dont deux électrodes y sont incorporées. En contact avec le sol, la teneur en eau des blocs s'équilibre avec celle du milieu.
•
•
Le principe de fonctionnement de cet instrument est basé sur la résistance électrique du bloc, qui varie selon sa teneur en eau. Cette résistance est par la suite correléeà la teneur en eau du substrat et au potentiel de l'eau du sol, après calibrage.
Bien que le principe et l'utilisation soient simples, les blocs de résistance sont peu adaptablesà la culture en récipient. Ces instruments sont généralement trop gros et aussi trop sensibles aux variations de température et de la teneur en sels du substrat. De part leur apport en minéraux, les importantes fertilisations appliquées aux cultures en récipient variant au cours de la saison font de ces instruments une technique inappropriée pour ce type de culture.
2.2.2.4 Tensiomètre
Les tensiomètres sont des instruments qui servent
à
mesurer directement le potentiel matriciel du sol, permettant de faire des inférences indirects sur le stress hydrique interne des semis (McDonald, 1984).Les tensiomètres consistent en une pierre ou capsule poreuse, remplie d'eau et rattachée à un manomètre. Le manomètre peut être une jauge Bourdon ou tout simplement un manomètre au mercure. Lorsque l'instrument est mis en contact avec le sol, l'eau
à
l'intérieur du tensiomètre s'équilibre avec le potentiel matriciel de l'eau du sol (Mcdonald, 1979). Lorsque le sol s'assèche, l'eau du tensiomètre s'échappe par la pierre poreuse, créant ainsi une succion. Cette succion ou tension est enregistrée par le manomètre, qui est directement reliéà
la colonne d'eau reliant la pierre poreuse. Dans la situation contraire, c'est-à-dire lors du mouillage du substrat, l'eau du sol entre dans le tensiomètre, passant par la pierre poreuse et exerce une pression, ce qui fait baisser la tension.
Les tensiomètres sont reconnus pour bien fonctionner entre 0 et 0.8 atm de tension, ce qui correspond très bien aux conditions dans lesquels poussent les semis de plants forestiers. Le tensiomètre est également un instrument simple d'opération, facile à construire, peu dispendieux et qui mesure directement la tension.
Bien que le tensiomètre commercialement disponible soit trop gros pour être utilisé dans les récipients, il est possible de se procurer de plus petites capsules permettant d'adapter cet instrument à la culture en récipient. Ces instruments seront dorénavant connus sous le nom de micro-tensiomètre.
Parmi les instruments actuellement disponibles sur le marché, seul le micro-tensiomètre semble donc être utilisable pour gérer les eaux d'irrigation, afin d'atteindre un régime optimal.
2.3 Le potentiel matriciel du sol
Le potentiel de l'eau du sol est relié
à
son niveau énergie et est constitué principalement de trois composantes, soit du potentiel osmotique, du potentiel de gravitation et du potentiel matriciel. En d';:lUtres termes, le potentiel total de l'eau est une mesure de sa facilité d'extraction du sol (McDonald, 1984).Le niveau d'énergie ou potentiel est un concept très important, puisqu'il permettraà la plante, selon son niveau, de puiser l'eau dont elle a de besoin. SI l'eau est faiblement retenue par les particules du substrat, la plante aura de la facilité
à
s'approvisionner en eau. mais par contre si l'eau est retenue fortement, la plante peut être soumisà
un état de stress.2.3.1 Potentiel osmotique
Le potentiel osmotique est l'énergie associée au phénomène de l'osmose, qui est la diffusion entre deux solutions de concentrations différentes,àtravers une membrane semi-perméable. En principe, l'eau (solvant) se déplace d'un milieu à
faible concentration de sels (soluté), vers un milieu à concentration plus élevée (Plamondon, 1975).
Bien que ce phénomène peut ne pas affecter significativement le mouvement de "eau dans le sol, il peut nuire grandement aux plants, en réduisant son pouvoir d'absorption d'eau. C'est par ce phénomène, entre autres, que les racines des plantes absorbent l'eau. La présence de soluté dans l'eau du sol, tels les sels minéraux provenant des fertilisations, affecte les propriétés thermodynamiques de l'eau et réduit son énergie potentielle (Hillel, 1980). Plus la concentration de soluté est élevée, plus la plante a de la difficulté
à
s'alimenter en eau et doit ainsi exercer une succion osmotique plus forte pour puiser l'eau du sol (Plamondon, 1975). Ainsi, le potentiel osmotique varie selon la concentration de soluté dans l'eau du sol.2.3.2 Potentiel de gravitation
Le potentiel gravitationnel de l'eau du sol est déterminé par son élévation relative
à
un point de référence arbitraire.L'eau, comme tout autre corps, est attirée vers le centre de la terre, par la force gravitationnelle (Hillel, 1980). Pour soutirer l'eau du sol, il faut donc exercer un travail égal
à
l'énergie de gravitation qui réside en elle.2.3.3 PotentIel matricIel
Le potentiel matriciel, ce que l'on appelle communément la tension, ou la succion, est le potentiel mesuré par les tensiomètres. Ce potentiel réfère à
l'énergie par laquelle l'eau est retenue par les particules du sol. Elle comprend les forces de remontée capillaire, d'absorption et celles qui existent aux interfaces eau-air (Bentz, 1978). Cette énergie représente une fraction importante du travail que la plante doit faire pour extraire l'eau du sol.
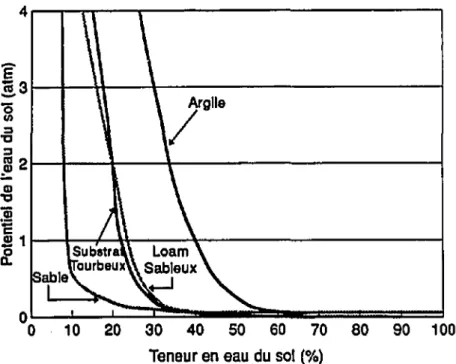
La relation qui existe entre la quantité d'eau retenue par le sol et la tension peut être représentée graphiquement par des courbes de rétention d'eau (Plamondon, 1975). Des exemples sont présentées à la figure 2.
2.4 Courbe de rétention d'eau
Sur une courbe de rétention d'eau, chaque teneur en eau correspond
à
un potentiel et celui-ci diminue d'une façon non-linéaire suivant la baisse en teneur d'eau du sol (McDonald, 1984).Les courbes de rétention (Figure 2) démontrent qu'une argile retient beaucoup plus d'eau qu'un sable, pour une tension donnée. Par exemple,
à
une tension de 1 atm, l'argile possède toujours 40% de son eau, alors que le sable n'en possède plus que 10%. Ceci suggère également que l'eau d'une argile est plus fortement retenue par le potentiel matriciel, que celle d'un sable. Donc, même si l'argile retient plus d'eau celle-ci n'est pas nécessairement disponibleàla plante.30 40 50 60 70 aD 90 100
Teneur en eau du sol (%)
•
4 Ê ëü3 -'0 en : ) 'C : ) ~2 m 'C-
.!!! E m1;f
0 0 10 20•
Figure 2: Courbes de rétention d'eau de trois types de sol et d'un substrat
tourbeux (Sources: McDonald, 1984; White, 1964)
100r---~ a aO~---_r"--___I Réserve en eau pour la plante b
o
I-""'---...----L---''--.&...-"'''''---'----'----'---L_'---...o
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15Potentiel matriciel (atm)
•
Figure 3: Exemple de courbe de rétention d'eau (Source: McDonald, 1984).
a)capacitéderétention au champ, b) teneur en eau au point de flétrissement permanent
L'utilisation des courbes de rétention peut donc révéler beaucoup d'information relative à la gestion des eaux d'irrigation (Figure 3). On peut entre autres ydéterminer la capacité de rétention au champ (a), la teneur en eau au point de flétrissement permanent (b) et la réserve en eau du sol pour la plante (la différence entre les points a et b) (Bentz, 1978).
La réserve en eau est une information importante, puisqu'elle indique le volume d'eau total disponible à la plante, pour un substrat quelconque. Contrairement à la culture au champ, pour laquelle la réserve en eau est déterminée à partir de la capacité au champ (correspondantà0.1 atm ou 340 cm de pression d'eau (cm p.d.)) et le point de flétrissement (correspondantà 15 atm), celle des substrats organiques correspond au volume d'eau existant entre la "capacité en bac" et le point de flétrissement (Argillier et al, 1991). Lacapacité en bac est obtenue à une tension de 10 cm p.d. (Lemaire et al, 1989). D'autre part, l'eau facilement disponible à la plante se retrouve entre les tensions de 10 et 100 cm p.d. pour les substrats de culture en récipients. Une tension de 100 cm p.d. est donc souvent considérée par les praticiens comme étant la tension
à laquelle ('irrigation doit être déclenchée (Lemaire et al, 1989). D'autres auteurs, tels que McDonald (1984), suggèrent que l'irrigation soit amorcée lorsque le potentiel matriciel commence
à
descendre vers le point de flétrissement, puisque la tension exacteà laquelle la croissance de la partie aérienne et celle des racines devient affectée est souvent inconnue.III· MÉTHODE ET DISPOSITIF EXPÉRIMENTAL
3.1 Caractérisation des matériaux
Deux substrats ont été utilisés pour les essais, faits à base de tourbe de sphaigne et de vermicullte. Les proportions étaient de 2:1 respectivement, sur une base volumétrique. La différence entre les deux substrats se situe au niveau du type de mousse utilisée.
Le Ministère des ressources naturelles utilise deux types de mousse pour la production de plants forestiers, soit de type "A" ou de type "BOO. Règle générale, le type "A" est utilisé pour l'ensemencement en récipients forestiers de petites cavités alors que le type "BOO sertàcelui des grosses cavités etàl'ensemencement
à racines nues.
Les spécifications d'approvisionnement du Ministère sont bien précises et comprennent une description détaillée de la granulométrie, de la capacité maximale d'absorption en eau, du caractère acide, de l'humidité relative de la tourbe en sac, de la présence de débris et du tamisage requis. D'une façon générale, la mousse de type "A" contient moins de grosses fibres (20 mailles et moins) que le type "BOO et aussi moins de débris (roches, branches, brindilles, etc.) (annexe 1).
Dorénavant, le substrat
à
base de tourbe de sphaigne de type "A" sera connu sous le nom de "Substrat 1" alors que pour l'autre on utilisera "Substrat 2".Les deux substrats ont été utilisés pour la production en récipient de bouleau jaune. Les récipients, d'une capacité de 300 cm3, sont faits de styrofoam. Un récipient semblable est présenté à l'annexe 2, de marque Ventblock (Modèle 45/340 ml), fait par Beaver Plactic, en Alberta. Ils mesurent 15
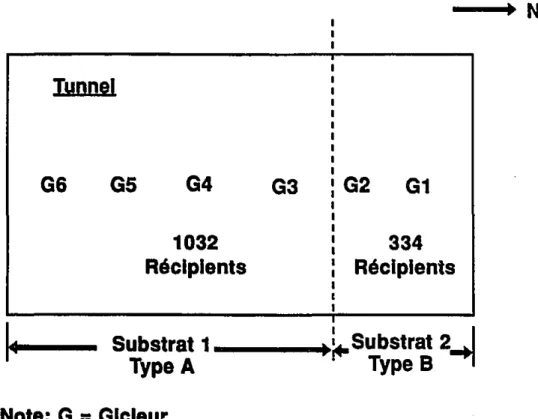
centimètres de hauteur, avec une diamètre supérieur d'environ 5 cm. Labase est de forme conique, avec une perforation permettant le drainage du substrat. La disposition des récipients dans le tunnel expérimental est présentée à la figure 4.
Afin d'avoir une description plus précise des deux substrats utilisés, une caractérisation des matériaux a été réalisée à partir de cinq (5) échantillons, par substrat. Les échantillons furent prélevés dans la partie Inférieure de la carotte, zone dans laquelle les micro-tensiomètres ont été installés lors des essais (Figure 5). Les échantillons mesurent en moyenne 3.7 cm de haut et ont un diamètre de 5.1 cm, ce qui représente un volume moyen de 76.5 cm3.
3.1.1 Courbe de rétention en laboratoire
Pour des fins de comparaison et pour éventuellement déterminer la précision des micro-tensiomètrell, des courbes de rétention d'eau ont été dressées en laboratoire. Des méthodes similaires à celles décrites par Lemaire (1989) et Topp et Zebchuk (1979) ont été utilisées pour des succions inférieures
à
10 cm p.d., alors que celle de Klute (1986) a été utilisée pour les tensions plus élevées.
Dans un premier temps, les cinq échantillons de chaque substrat ont été placés dans des anneaux servant de support (Figure 6) et déposés dans un bac d'eau pendant plus de 48 heures, afin d'être bien saturés.
--+.
NIunnel
G6 G5G4
1032
Récipients
G3G2
G1
334
Récipients
Substrat 1_ _-
...
~Substrat
2-.1
Type
A
Type
B
Note: G
=
Gicleur
•
Zone D/6cho.ntlllonnQge El1Jplncel'1ent prévu des l'\Ic:ro-tQnslo,,,'lltrQso•
•
Figure 5: Zone d'échantillonnage dans la carotte
Anneau -~
Figure 6: Échantillon dans un anneau de soutient
26
Echantillon
Tissu léger, peu serré
•
Une fois saturés, les 10 échantillons ont été pesés et transférés sur une tableàsuccion de type "bac de sable", permettant de déterminer la rétention d'eau des substrats, à de basses tensions. D'abord, la hauteur d'eau de la table àsuccion a été abaissée juste au dessous des échantillons. La tension étant mesurée a partir de la mi-hauteur des échantillons, ceci correspondait à une tension de 1.9 cm de pression d'eau (cm p.d.). Une fois l'équilibre de l'eau du substrat atteint, les échantillons étaient à nouveau pesés avant d'être soumis à
une tension plus élevée. La tension suivante était de 10 cm p.d., ce qui correspond à la capacité en bac des substrats organiques.
Étant donné la hauteur limitée de la table à succion, soit 10 cm, les échantillons ont ensuite été mis en chambre à pression pour les tensions suivantes: 100, 340, 723 et 1033 cm p.d.. La tension de 100 cm p.d. a été choisie parce que c'est souvent la tension à laquelle on déclenche l'irrigation des substrats organiques. La tension de 340 cm p.d. d'autre part, correspond à la tension qui est utilisée pour déterminer la capacité au champ des sols minéraux. La tension de 723 a été choisie arbitrairement entre 340 et 1033 cm p.d., cette dernière correspondant souvent à la tension maximale acceptable pour la culture au champ.
Pour les essais utilisant la chambre à pression. un maximum de 12 à 16 jours était alloué pour que l'équilibre soit atteint, dû aux contraintes de disponibilité des équipements de laboratoire.
Une fois ces essais terminés, les échantillons ont été séchés au four
à
une température de 65 oC jusqu'à ce que leur poids soit constant en fonction du temps.•
Connaissant le poids frais des échantillons pour une tension (t) donnée et le poids sec des échantillons, la teneur en eau pondérale (Wp) correspondant àchaque tension a pu être calculée comme suit:
(poids frais!l) (g) - poids sec (g))
poids sec (g)
• 100 (1 )
L'équation (1) a permis de construire les courbes de rétention d'eau des substrats 1 et 2, présentant la teneur en eau pondérale en fonction de la tension. Afin d'améliorer la présentation des résultats, la teneur en eau pondérale a été convertie en indice de saturation (1). Ceci a nécessité une analyse de la densité, permettant de déterminer la porosité totale des échantillons. Du même coup, une analyse de la granulométrie a été faite pour mieux caractériser les substrats.
L'indice de saturation se calcule comme suit:
W
y=
•
100 (2)n
où
1 = indice de saturation (%)
W
y = teneur en eau volumétrique (%) n = porosité totale (%)alors que la teneur en eau volumique et la porosité totale se déterminent de la façon suivante:
poids frais (g) - poids sec (g)
volume total (cm3)
28
•
W
v = volume d'eau (cm 3 ) ---•
100 (4) volume total (cm3) et n = 1-
r.
r
(5) oùr.
= densité apparente (g/cm3)r
= densité des particules (g/cm3)Ces analyses permettent 1) de déterminer le volume occupé par la mousse et par l'eau à la saturation et 2) de comparer les courbes de rétention d'eau obtenuesà l'aide des micro-tensiomètres pour en mesurer la performance.
3.1.2 Densité apparente, granulométrie et densité des particules
La densité apparente de chaque substrat a été déterminée àpartir de ces cinq échantillons.
Pour chaque substrat, trois (3) de ces cinq (5) échantillons ont servi à
l'analyse de granulométrie. Suite à cette analyse, un de ces échantillons a été récupéré pour s'ajouter aux deux autres échantillons, permettant ainsi d'avoir également trois échantillons pour déterminer la densité des particules.
•
3.1.2.1 Densité apparenteLa densité apparente des substrats a été déterminée sur une base sèche et sur une base fraîche.
Ladensité apparente sur une base sèche (b.s.) représente le rapport entre la masse de matière sèche et le volume apparent occupé par cette matière sèche (Equation6).Cette densitéfutmesuréeà partir du poids et du volume de la tourbe séchéeà l'étuve, de chacun des 5 échantillons.
fa
(b.s.) =Poids sec (g)
Volume occupé par la masse sèche (cm3)
(6)
La densité apparente sur une base fraîche (b.f.) est d'autre part le rapport entre la masse de matière sèche et le volume apparent occupé par la masse fraîche (Equation 7). Cette densité fut mesuréeà partir du poids sec et du volume de la tourbe humide à saturation contenue dans chacun des 5 échantillons.
fa
(bJ.) =Poids sec (g)
Volume occupé par la masse fraîche (cm3)
(7)
Il Y existe une différence entre ces deux densités, pour la tourbe de sphaigne. Ceci est dû au rétrécissement de la tourbe lorsque celle-ci est séchée
à l'étuve.
3.1.2.2 Granulométrie
L'analyse de granulométrie s'est effectuée par tamisage à sec selon la méthode détaillée par Parent et Caron (1993). L'analyse a été réalisée pour chaque substrat à partir de trois (3) échantillons séchés utilisant les tamis de 75,
150,250,500, 840 ~m.
3.1.2.3 Densité des particules
Pour chaque substrat, la densité des particules a été déterminée
à
partir de deux (2) échantillons entiers. Ces échantillons ont été divisés en trois (3) sous-échantillons. Chacun de ces trois (3) sous-échantillons a été émietté avant d'être placé dans des cylindres gradués et recouvert de kérosène dont la densité a été prédéterminée en laboratoire. Le volume déplacé par le substrat représente ainsi la densité des particules, connaissant le poids des sous-échantillons mis dans le cylindre.Trois autres sous-échantillons par substrat ont été recueillis à partir d'un échantillon reconstitué, ayant servi aux test de granulométrie.
La
densité des particules a été déterminée pour chacun des échantillons selon la méthode ci-haut mentionnée.La densité des particules de tourbe de sphaigne et de vermiculite ont été déterminées de la même façon.
3.2 Essais de micro-tensiomètres
Les essais envisagés consistaient premièrement à expérimenter l'utilisation des micro-tensiomètres dans un milieu tourbeux. Deuxièmement, la précision de deux types de micro-tensiomètre (standard et rapide) a été vérifiée, afin de déterminer lequel des instruments était le mieux adapté au milieu de culture. Pour terminer, on a analysé la précision d'une lecture ponctuelle, c'est-à-dire une lecture enregistrée par un micro-tensiomètre trois heures après avoir été inséré dans une carotte de sphaigne.
3.2.1 Fabrication des mlcro-tenslomètres
Au total huit micro-tensiomètres ont été construits suivant le modèle décrit par Cassel et Klute (1986) (Figure 7).
Le principe de cet instrument est le même qu'un tensiomètre conventionnel que l'on utilise au champ. Les seules différences résident au niveau des composantes. Dans ce cas-ci, des manomètres au mercure et des pointes poreuses de petites dimensions (3/8" ou 9.53 mm de diamètre) sont utilisés.
Six micro-tensiomètres ont été construits avec une pierre poreuse à débit standard (standard flow: Modèle 652x07-B1 M1), alors que deux autres étaient faits d'une pierre poreuse à débit rapide (high flow: Modèle 652x07-B1 M3). Les caractéristiques de chacune sont résumées au tableau 2, et plus en détail
à
l'annexe 3.
•
Mlcro-tensI0Mè-tre
ManoMètre
l''lercure
éprouvette
échelle grnduée
~- bOlJchon tubedu
MnnoMètre
,
cera.Mlque
tige cl'acryllquetube
pourrecharger
•
•
Figure7: Micro-tenslomètre expérimental
•
Tableau 2: Caractéristiques des pierres poreuses, utilisées pour la construction des micro-tensiomètrespropriétés Pierre poreuseà Pierre poreuse à
débit standard débit rapide
-Pression d'entrée d'air 1 1
(atm)
Dimension des pores 2.1 2.5
(~m) Porosité approximative 34 45 (%volume) Conductivité hydraulique 3.46 X 10-7 8.6 X 10-6 (cmls) 34
3.2.2 Échantillonnage des substrats pour les essais
Les carottes de tourbe requises pour réaliser les essais ont été recueillies dans le tunnel 25 de la pépinière de Berthier. Au total 108 échantillons pour chacun des substrats ont été récoltés aléatoirement sur une période de neuf (9) semaines. Au cours de ces essais, le système racinaire des plants de bouleau envahissait déjà le milieu de culture, permettant ainsi de retirer facilement les plants et la carotte de sphaigne des récipients, pour les transporter en serre expérimentale pour réaliser les tests. Les plants n'ont pas été coupés pour les tests, ce qui a permis d'assécher les substrats plus rapidement par évapotranspiration.
3.2.3 Essais
Dans la serre expérimentale, juste avant que les essais furent entrepris, les carottes de tourbe étaient saturées par trempage dans un récipient rempli d'eau et égouttées pendant une (1) heure.
Au moment venu, selon l'essai, le micro-tensiomètre était inséré à cinq centimètres de l'extrémité de la carotte (Figure 8), qui faisait en moyenne 12 cm de haut. Ce point d'insertion correspond approximativement au deux tiers de la hauteur total du substrat.
10 0. 15 CM
•
•
•
r
5 CM ...L..- '--L.,_ _- - :L
Figure 8: Position du micro-tensiomètre dans la carotte
•
Les essais, visant à tester les micro-tensiomètres à débit standard non-fixes, ont commencé dès la première semaine d'expérimentation. Utilisant quinze (15) carottes par substrat, toutes saturées au début de la semaine, la prise de lecture a été répartie sur trois jours de cette première semaine. Procédant ainsi,il a été possible d'obtenir des carottes avec différents taux d'humidité et donc de vérifier la précision de l'instrument dans différentes conditions. Les jours de lecture, un micro-tensiomètreàdébit standard était inséré dans cinq carottes, pour chaque substrat. Trois heures étaient allouées à l'instrument pour atteindre J'équilibre avec la tension matricielle du substrat, avant de prendre la lecture ponctuelle. Les carottes étaient ensuite pesées pour déterminer leur teneur réelle en eau et en fonction des essais en laboratoire, la vraie tension d'eau.
Pendant cette même période, un deuxième essai était également effectué, afin de vérifier la performance des micro-tensiomètres
à
débit rapide fixes. Dans ce cas-ci, un (1) instrument était utilisé pour une durée d'une semaine, installé de façon fixe dans une (1) carotte préalablement saturée. Ce dispositif a permis de mesurer ia tension matricielle au fur età mesure que la carotte s'assèchait par le phénomène d'évapotranspiration. A chaque fois que la tension était relevée, le poids de la carotte était enregistré pour déterminer la teneur réelle en eau, permettant de faire le parallèle avec les résultats obtenus en laboratoire.Ces deux essais ont été répétés
à
deux autres occasions, soità
la cinquième (5 ième) et à la neuvième (9 ième) semaine d'expérimentation.Entre temps, les autres essais, servant à tester les micro-tensiomètres à
débit standard fixes etàdébit rapide non-fixes, ont pu être réalisés simultanément, soit au cours des semaines 2, 3,
'4
et 6, 7, 8, ainsi que pendant les fins de semaines (F). Au début de chacune de ces périodes et pour chaque substrat, un tensiomètreà
débit,standard était installé fixe dans 3 carottes saturées. Pour les essais d'une durée d'une semaine, plusieurs lectures étaient prises au cours de.'
".
,.
la période afin de déterminer la tension du milieu pour différents taux d'humidité. Les fins de semaine par contre, les instruments étaient installés le vendredi après-midi et la lecture de la tension était relevée le lundi matin suivant.
Pour chaque substrat, à la fin de chaque période des essais précédents, une mesure ponctuelle était également prise à l'aide d'un micro-tensiomètre à
débit rapide. Cette mesure était prise sur une autre carotte qui avait aussi été saturée en début de période, soit en même temps que les autres. Avant de prendre la lecture ponctuelle, trois heures étaient allouées à l'instrument pour atteindre l'équilibre avec la tension matricielle du substrat.
La cédule pour l'ensemble des tests est présentée au tableau 3.
Au moment de la lecture du tensiomètre, les carottes étaient pesées dans le but de déterminer leur degré de saturation. Pour ce faire, la teneur en eau volumique des carottes a été calculée selon l'équation (4).
Le poids moyen des plants de bouleau jaune et de la tourbe occupant une carotte ont été retranchés de la masse totale de façon à déterminer le poids de l'eau. Considérant la densité de l'eau comme étant égale
à
1 g/cm3,le volume occupé par l'eau (Veau) se trouve à être égale au poids de l'eau. Le volume total (Vtolal) représente, tant qu'à lui, le volume moyen d'une carotte.En utilisant la porosité moyenne de chaque substrat, la teneur en eau volumique peut être convertit en Indice de saturation par l'équation (2),
Reliant l'Indice de saturation aux tensions correspondantes mesurées à l'aide des micro-tensiomètres, les courbes de rétention comparatives ont pu être construites.
•
Tableau 3: Cédule des essais de micro-tensiomètresNombre de carottes prélevées par période et par essai
•
semaine SUBSTRAT 1 SNF SF HNF 1 15 F 2 F 3 F 4 F 5 F 6 F 7 F 8 F 9 F TOTAL SUBSTRAT 2 5NF SF HNF 15 3•
Essai: SNF SF HNF HF F= Tensiomètre
à
débit standard. non-fixe = Tensiomètre à débit standard. fixe = Tensiomètre à débit rapide. non-fixe = Tensiomètre à débit rapide, fixe = Fin de semaine•
3.2.4 Analyse statistiqueDeux modèles mathématiques de régression ont été comparés pour décrire la rétention de l'eau des substrats, utilisant les résultats obtenus à l'aide des micro-tensiomètres. L'allure des courbes de rétention n'étant pas linéaire, l'équation de la courbe exponentielle et de la courbe de puissance ont été utilisées.
La régression linéaire des relations curvilignes et le coefficient de corrélation ont été utilisés pour dsterminer le modèle qui décrit le mieux la relation qui existe entre l'indice de saturation et la tension des micro-tensiomètres. La régression linéaire a été faite à l'aide du logiciel Lotus. Celui-ci calcule l'ordonné à l'origine, la pente et le coefficient de détermination (r2).
Pour donner une allure linéaire aux équations curvilignes,il suffit de prendre le logarithme de l'équation (Uttle et al., 1978). Pour la courbe exponentielle, ceci se traduit comme suit:
y
=
log Y
=
log Y =ab x log (ab x)
log (a) + xlog (b) (8)
En traçant le log de l'indice de saturation (log Y) versus la tension (x), les résultats suivent l'allure d'une droite. A partir de la régression linéaire, les coeffic'lents "a" et Ob" sont calculés en prenant l'inverse du logarithme de l'ordonnée à l'origine (log a) et de la pente (log b).
Pour la courbe de puissance, on obtient:
•
y = log Y = log Y=
ax b log (ax b)log (a) + blog (x) (9)
Le logarithme de l'indice de saturation (log Y) est tracé en fonction du logarithme de la tension (log x). Le coefficient "b" de l'équation représente la pente de la droite alors que le coefficient "a" est égale
à
l'inverse du logarithme de l'ordonnée (log a).Le coefficient de corrélation des courbes est tout simplement la racine carré du coefficient de détermination (r2) (Steel et Torrie, 1986).
En comparant les courbes de rétention obtenues en laboratoire à celles obtenuesàl'aide des micro-tensiomètres, l'utilisation des micro-tensiomètres peut donc être vérifiée pour les milieux tourbeux.
IV- RÉSULTATS ET DISCUSSION
4.1 Caractérisation des matériaux
4.1.1 Observations générales
D'après le poids frais et sec des échantillons, le substrat 2 retient une fois et demi plus d'eau que le substrat 1, à saturation (Tableau 4, 5). Pour un même volume, le substrat 1 peut contenir en eau six (6) fois son poids sec alors que le substrat 2 retient neuf (9) fois son poids.
4.1.2 Granulométrie
D'après les analyses de granulométrie, le substrat 2 comporte plus de grosses particules que le substrat 1, mais l'écart type des différentes fractions de ce premier démontre par contre une plus grande variation dans sa composition (Tableau 6, 7).
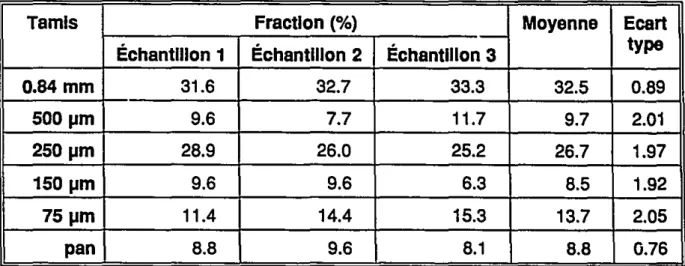
Les analyses de granulométrie réalisées sur le substrat 1 et 2 (Tableau 6, 7), révèlent que plus de 30 % et 40 % du poids de l'échantillon est constitué de particules plus grosses que 0.84 mm, respectivement. Plus précisément, cette fraction représente 32.5 %du substrat 1, avec un écart type de 0.89 %, alors qu'elle forme 41.9 % du substrat 2, mais avec un écart type de 6.99 %. Il a été noté que cette fraction est composée principalement de vermiculite.
•
Tableau 4: Capacité de rétention d'eau du substrat 1Échantillon Volume de Poids de Poids sec de Rapport l'échantillon l'échantillon l'échantillon Eau
saturé ---(cm3) (g) (g) Tourbe sèche 1 76.5 77.1 11.0 6.0 2 76.5 77.6 9.8 6.9 3 76.5 77.3 11.0 6.1 4 76.5 77.5 10.2 6.6 5 76.5 79.6 10.7 6.4 1 Moyenne
Il
76.5 1 77.8 1 10.6 1 6.4 1Tableau 5: Capacité de rétention d'eau du substrat 2
Échantillon Volume de Poids de Poids sec de Rapport l'échantillon l'échantillon l'échantillon Eau
saturé _..
_---(cm3) (g) (g) Tourbesèche 1 76.5 71.9 7.3 8.8 2 76.5 78.0 7.6 9.3 3 76.5 76.0 6.5 10.7 4 76.5 77.4 7.2 9.8 5 76.5 74.3 6.9 9.8 1 Moyenne
Il
76.5 1 75.5 1 7.1 1 9.7 1•
Tableau 6: Granulométrie du Substrat 1Tamis Fraction (%) Moyenne
Ecart
Échantillon 1 Échantillon 2 Échantillon 3 type
0.84 mm 31.6 32.7 33.3 32.5 0.89 SOO IJm 9.6 7.7 11.7 9.7 2.01 2S0 IJm 28.9 26.0 25.2 26.7 1.97 1S0 IJm 9.6 9.6 6.3 8.5 1.92 7SIJm 11.4 14.4 15.3 13.7 2.05 pan 8.8 9.6 8.1 8.8 0.76
Tableau 7: Granulométrie du Substrat 2
Tamis Fraction (%) Moyenne
Ecart
Échantillon 1 Échantillon 2 Échantillon 3 type
0.84 mm 49.3 41.0 35.4 41.9 6.99 SOO IJm 20.3 9.0 13.8 14.4 5.68 2S0 IJm 15.9 11.5 23.1 16.9 5.82 1S0 IJm 1.4 6.4 7.7 5.2 3.30 7SIJm 7.2 20.5 13.8 13.9 6.63 pan 5.8 11.5 6.2 7.8 3.22 44
•
La vermiculite se retrouve également dans le tamis de 500 Ilm, mais ne représentent que moins du tiers de cette fraction. Plus de 56 % du poids sec du substrat 2 a un diamètre supérieurà 500 Ilm tandis que le substrat 1 n'en contient que 42 %.Une autre fraction importante dans le substrat 1 regroupe les particules dont le diamètre se situe entre 250 et 500 Ilm. Dans le substrat 2 par contre, cette grosseur de particule ne représente guère plus que celles dont les particules se trouvent entre 500 Ilm et 0.84 mm, ou entre 75 et 150 Ilm. En moyenne, les particules retenues par le tamis de 250 Ilm représentent 27 % du poids total du substrat 1, alors qu'elles ne constituent que 16.9%du substrat 2. Dans le:s deux substrats, les particules retenues par le tamis de 250 Ilm, ainsi que celles de plus petites dimensions, sont composées uniquement de tourbe de sphaigne.
Les analyses démontrent plus de variation dans la composition des échantillons du substrat 2 que dans le substrat 1. L'écart type moyen, calculé pour chaque fraction, varie entre 3.22 % et 6.99 % pour le substrat 2 alors qu'il est inférieur ou égale à 2.05% pour le substrat 1.
Les raisons possibles pour de telles variations dans la distribution des particules sont causées, soit que la mousse utilisée était naturellement hétérogène, ou bien qu'il y ait eu un mauvais mélange au moment de )'empotage.
•
4.1.3 Densité apparente et densité des particules 4.1.3.1 Densité apparenteLes densités apparentes ont été calculées sur une base sèche ainsi que sur une base fraîche (Tableau 8), selon les équations 6 et 7 respectivement. Exprimée sur une base sèche, la densité apparente du substrat 1 est en moyenne de 0.21
g/cm3. Cette densité est légèrement plus élevée que celle du substrat 2, dont la
densité apparente moyenne est de 0.14 g/cm3.
La densité apparente des deux substrats, exprimée sur une base fraîche, est relativement semblable, soit en moyenne de 0.14 g/cm3 pour le substrat 1 versus 0.10 g/cm3 pour le substrat 2.
La différence qui existe entre la densité apparente exprimée sur une base sèche et celle exprimée sur une base fraîche est due à la diminution de volume après séchage des échantillons.
4.1.3.2 Densité des particules
La densité moyenne des particules pour le substrat 1 est de 1.20 g/cm3, avec un écart type de 0.11 (Tableau 9). Le substrat 1 présente moins de variations dans la densité des particules que celle du substrat 2. Ce demier a une densité moyenne des particules de 1.47 g/cm3 avec un écart type de 0.37 g/cm3. Au cours des analyses, des valeurs variant entre 0.85 et 2.28 g/cm3 ont été observées pour le substrat 2, alors que pour le substrat 1, les valeurs se trouvaient entre 0.91 et 1.46 g/cm3 (Annexe 4).
Tableau 8: Densité Apparente
Substrat 1 Substrat 2
Échantillon Densité Apparente (g/cm3) Densité Apparente (g/cm3)
8. S.(1) 8. F.(2) 8. S. 8. F. 1 0.22 0.15 0.13 0.10 2 0.20 0.14 0.16 0.11 3 0.21 0.15 0.13 0.09 4 0.20 0.14 0.15 0.10 5 0.21 0.15 0.14 0.10 Moyenne 0.21 0.14 0.14 0.10 Ecart type 0.01 0.01 0.01 0.01 (1) 8.S: Base Sèche (2) 8.F: Base Fraîche
Tableau 9: Densité des Particules
Substrat 1 Substrat 2
Échantillon Densité des ~artlcules Densité des
(g/cm) Particules (g/cm3) 1 1.14 1.64 2 1.32 1.72 3 1.13 1.04 Moyenne 1.20 1.47 Ecart type 0.11 0.37