UNVERSITÉ MOHAMMED-V
FACULTÉ DES SCIENCES
Rabat
THÈSE DE DOCTORAT
Présentée par
Maria BOUDALIA
Discipline : Chimie-Physique
Spécialité : Electrochimie- Corrosion -Matériaux
Titre :
Soutenue le 25 Mars 2015
Devant le jury
Président :
Mr. Abdellah GUENBOUR Professeur - Faculté des Sciences - Rabat
Examinateurs :
Mr. Abdelkbir BELLAOUCHOU Professeur - Faculté des Sciences - Rabat Mr. Belkheir HAMMOUTI Professeur - Faculté des Sciences - Oujda Mr. Mohamed EBN TOUHAMI Professeur - Faculté des Sciences - Kenitra Mr. Hassan OUDDA Professeur - Faculté des Sciences - Kenitra Mr. Mohamed TABYAOUI Professeur - Faculté des Sciences - Rabat
Mr. Ayssar NAHLE Professeur-Université de Sharjah - Emirates Arabes Unis
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 37 77 18 34/35/38, Fax: +212 (0) 37 77 42 61, http://www.fsr.ac.ma
CORROSION EN MILIEUX PHOSPHORIQUES
DE L’ACIER INOXYDABLE AUSTENITIQUE 904L
EN PRESENCE DES INHIBITEURS ECOLOGIQUES
ق
ملس و هيلع الله ىلص الله لوسر لا
":
لكل امنا و تاينلاب لامعلاا امنا
ئرما
ام
ىون
"
و هيلع الله ىلص لاقو
ملس
:
"
لج و زع الله ركشي لا سانلا ركشي لا نم
"
Toutes les lettres Ne sauraient trouver les mots qu’il faut...
Tous les mots ne sauraient exprimer la gratitude, l’amour, le respect, la
reconnaissance...
Je dédie cette thèse A...
La mémoire de ma grande mère…
Que ce travail soit l’expression de mon éternel attachement au souvenir de tes
sacrifices, Que Dieu, le miséricordieux, vous accueille dans son éternel paradis.
Aussi, c’est tout simplement que...
Je dédie ce travail A…
A mes très chers parents
En ce jour, votre fille espère réaliser l’un de vos rêves !
Les deux personnes qui ont toujours été présents pour me chérir, me protéger et
me soutenir tant moralement que matériellement pour que je puisse atteindre mon
but. Votre prière et Vos bénédictions ont été pour moi le meilleur et le grand
secours pour mener à bien tous mes études. Aucun mot ne saurait exprimer ma
reconnaissance et ma gratitude à votre égard, Puisse cette thèse symboliser le
fruit de vos longues années de sacrifices consentis pour mes études et mon
éducation. Veuillez trouver dans ce modeste travail la récompense de vos
sacrifices et l’expression de mon amour et de mon attachement indéfectible.
Puisse le Grand Dieu, le tout puissant, vous protège et vous accorde meilleure
santé et longue vie.
A ma tante Leila
L’amour que je vous porte est sans égal, votre soutien et votre encouragements
ont été pour moi d’un grand réconfort Que dieu vous protège et vous assure une
bonne santé et une longue et heureuse vie.
A mes chères sœurs Majdouline et Ilham
A Mon cher et adorable Frère Zakaria
A mes beaux frères Khalil et Mourad
Je vous remercie énormément pour votre soutien et j'espère que vous trouverez
dans cette thèse l'expression de mon affection pour vous.
A mes adorables neveux : Shamsedin, Yasmine et Shahin siraj
Votre présence et vos sourires m’apportaient toujours le rayon de soleil à mes
sombres jours.
A toute ma famille
Je vous dédie ce travail avec toute mon affection et ma plus grande estime.
A tous mes amis(es)
Je remercie particulièrement mes deux adorables amies d’enfance Kaoutar
Ellouzi et Siham Ljouad
A tous mes professeurs
Avec tous mes respects et mon éternelle reconnaissance…
Une dédicace spéciale à deux personnes qui ont assistés à l’avancement de mes
travaux :
Monsieur le Pr.Abdelkbir Bellaouchou et Monsieur le Pr.Abdellah
Guenbour. Je garderai dans mon cœur votre générosité, votre compréhension et
votre efficacité. Pour tout ce que vous m'avez donné, je vous remercie très
sincèrement.
Cette thèse a été une de mes plus belles expériences.
Merci mon Dieu
!
Ce travail a été réalisé au Laboratoire de Sciences de Matériaux, Nanotechnologies et Environnement-Département de chimie de la Faculté des Sciences de Rabat.
Mes premiers remerciements vont naturellement à mes Directeurs de thèse,
Il m’est impossible de ne pas commencer en remerciant Monsieur Abdellah
GUENBOUR, professeur d’enseignement supérieur et responsable du Laboratoire de
Sciences de Matériaux, Nanotechnologies et Environnement de la Faculté des Sciences de Rabat. Je tiens à vous remercier vivement pour la confiance que vous m’avez témoignée en m'accueillant au sein de votre équipe au laboratoire et d’avoir bien assuré la direction et l'encadrement de mes travaux de thèse. Vous m’avez toujours garanti la possibilité de travailler dans les meilleures conditions, je peux dire aujourd’hui que j’ai eu beaucoup de chance de vous avoir comme directeur de thèse. Je vous suis reconnaissante de m’avoir fait bénéficier tout au long de cette aventure doctorale de votre grande compétence, de votre rigueur intellectuelle et de votre efficacité certaine que je n’oublierai jamais. Soyez assuré de ma sincère reconnaissance et de mon plus profond respect.
Je trouve difficilement les mots qui vont contribuer à remercier également à mon directeur de thèse, Monsieur Abdelkbir BELLAOUCHOU, professeur d’enseignement supérieur à la Faculté des Sciences de Rabat. Je vous adresse Un immense merci d'avoir cru en mes capacités, pour votre temps que vous m’avez accordé, pour vos encouragements et vos qualités humaines et scientifiques, aussi pour votre bienveillance. Vous n’avez ménagé aucun effort pour m’orienter et me conseiller tout au long de la réalisation de ce travail par votre immense savoir–faire. Vous avez eu un réel impact positif sur mon parcours de doctorat. Je vous suis vraiment grée pour votre investissement dans Le déroulement de mon travail et pour votre implication très positive au cours de la période assez anxiogène de la préparation de cet examen. Que vous trouvez ici l'expression de ma très respectueuse considération pour la grande modestie et l'extrême bienveillance dont vous faites toujours.
Je voudrais aussi témoigner toute ma gratitude à Monsieur Mohamed TABYAOUI, professeur d’enseignement supérieur à la Faculté des Sciences de Rabat. Merci pour l’honneur que vous m’avez fait et l’intérêt que vous avez manifesté en acceptant de participer
à mon jury de thèse en qualité de rapporteur. Vous avez toujours su vous rendre disponible pour répondre à mes questions et je vous suis très reconnaissante pour vos remarques pertinentes et les conseils précieux que vous m'avez prodigué lors de ce travail.
Je remercie très chaleureusement Monsieur Mohamed EBN TOUHAMI, professeur d’enseignement supérieur à la faculté des sciences de Kenitra, veuillez-trouvez à travers ce travail ma sincère reconnaissance pour avoir accepté de faire partie des rapporteurs et d’avoir dégagé du temps pour vous y consacrer. Je vous suis reconnaissante d’avoir porté votre regard d’expert sur mon manuscrit. Vos remarques seront une aide précieuse pour la valorisation de ce travail.
Je suis très reconnaissante à Monsieur Hassan OUDDA, professeur d’enseignement supérieur à la Faculté des Sciences de Kenitra, pour l’honneur qu’il m’a fait en acceptant d’être parmi les rapporteurs de mon jury de thèse. Vos remarques seront particulièrement utiles pour l’amélioration de mon travail. Veuillez trouver ici mes sincères remercîments et mon plus profond respect.
Un grand merci à Monsieur Belkheir HAMMOUTI, professeur à la faculté des sciences d’Oujda d’avoir accepté de participer à mon jury et d’avoir fait ce long voyage pour assister à cette soutenance. Merci pour votre implication à mes côtés qui a toujours été parfaitement sans faille. J’ai eu la chance et l’honneur de vous côtoyer au cours de ma thèse, Je vous remercie pour toute la patience et la disponibilité dont vous avez fait preuve à mon égard, pour vos multiples conseils ainsi que, pour l’intérêt que vous avez porté à mes travaux. Veuillez trouver ici l'expression de mes remerciements et de ma gratitude les plus sincères et ma profonde admiration pour toutes vos qualités humaines et scientifiques.
Je tiens aussi à exprimer mes remercîments à Monsieur Ayssar NAHLE, professeur à l’Université de Sharjah aux Émirats Arabes Unis et directeur du centre de « Corrosion Prevention & Control Research Center », pour l’intérêt qu’il a porté à mon travail. Et de m'avoir honoré par sa présence et d'avoir accepté d’être parmi les membres de jury.
Enfin, je remercie, toutes les personnes qui m'ont encouragé et soutenu de prés ou de loin durant la réalisation de ce travail. Je pense aux membres du Laboratoire de Matériaux,
Discipline: Physical -Chemistry
Specialty: Electrochemistry-Corrosion-Materials
Title o f the thesis
CORROSION OF AUSTENITIC STAINLESS STEEL 904L IN
PHOPHORIC ACID IN PRESENCE OF ECOLOGICAL INHIBITORS
Abstract:
The aim of this work is to propose a technical and economic solution to the destructive effect of corrosion of 904L stainless steel in phosphoric acid. This is the use of ecological inhibitors, biodegradable and environmentally friendly: essential oils from two medicinal plants (Lavandula stoechas and Artemisia herba alba) and a clay rock (kaolin / muscovite).
The extraction of the two plants by steam distillation yielded essential oils characterized by the presence of two major compounds; it is L-fenchone and 1,8-cineole, respectively for Lavandula stoechas and Artemisia herba alba. The XRD and IR have identified the presence of muscovite (10.7%) and kaolinite (79.3%) in mineral clay.
The influence of the concentration and temperature on the corrosion process of the two grades of stainless steel 904L in polluted phosphoric medium in the absence and presence of inhibitors was investigated by electrochemical measurements: polarisation curves and spectroscopy electrochemical impedance.
These natural compounds effectively inhibit 904L alloy; Lavandula stoechas has an efficiency of 87.3 and 80.3% at a concentration of 1.2g /L, Artemisia herba alba attained 85.3 and 803% at a concentration of 1g /L and the clay has an efficiency of 77.9% at a 88.3et concentration 8g /L respectively for the MB and MS. Temperature affects the inhibitory efficiency of essential oils, however, the efficiency remains almost stable in the presence of clay. The plot of languimir isotherm showed that adsorption of essential oils follows this isotherm. Surface analyzes by optical microscopy allowed the visualization of an adherent and stable layer on the surface of two grades of 904L stainless steel.
Discipline : Chimie-Physique
Spécialité : Electrochimie-Corrosion-Matériaux
Titre de la thèse :
CORROSION EN MILIEUX PHOSPHORIQUES
DE L’ACIER INOXYDABLE AUSTENITIQUE 904L EN PRESENCE
DES INHIBITEURS ECOLOGIQUES
Résumé :
Le but de ce travail est de proposer une solution technique et économique à l’effet destructeur de la corrosion des nuances de l’acier inoxydable 904L en milieux phosphoriques. Il s’agit de l’utilisation des inhibiteurs écologiques, biodégradables et respectueux à l’environnement : des huiles essentielles issus de deux plantes médicinales (Lavandula stoechas et Artemisia herba alba) et d’une roche argileuse ( kaolinite / muscovite) .
L’extraction des deux plantes par hydrodistillation a permis d’obtenir des huiles essentielles caractérisées par la présence de deux composés majoritaires : L-fenchone et 1,8-Cineole respectivement pour Lavandula stoechas et Artemisia herba alba. La DRX et l’IR ont permis
d’identifier la présence de la muscovite (10.7%) et la kaolinite (79.3%) dans l’argile minérale . L’influence de la concentration et de la température sur le processus de corrosion de deux
nuances de l’acier inoxydable 904L en milieu phosphorique pollué en absence et en présence des inhibiteurs a été étudiée par des mesures électrochimiques : courbes de polarisation et spectroscopie d’impédance électrochimique.
Les composés naturels testés inhibent efficacement la corrosion des deux nuances (M.B et M.S) de l’alliage 904L ; ainsi Lavandula stoechas a une efficacité de 87.3 et 84.2% à une concentration de 1.2g/L, Artemisa herba alba atteint 88.3 et 77.9% à une concentration de 1g/L et l’argile a une efficacité de 80.8et 80.3% à une concentration de 8g/L respectivement pour le M.B et M.S. La température influe sur l’efficacité inhibitrice des huiles essentielles, par contre en présence de l’argile le pouvoir protecteur reste quasiment stable. Le tracé de l’isotherme de Languimir a montré que l’adsorption des huiles essentielles suit cette isotherme. Les analyses de surface effectuées par microscopie optique a permis la visualisation d’une couche adhérente et stable à la surface des deux nuances de l’acier inoxydable 904L.
Liste des abréviations
Symbole
Signification
PNB
MEB
DRX
IR
AFNOR
CE
ECS
NACE
RE
SIE
ISO
C
C
dcE
corrE
PBE
pI
corrI
pR
Rp
S
t
T
θ
φ
CPE
C
d
C
SCC
HN
DN
AH.E
E
aH
aProduit national de production
Microscope électronique à balayage
Diffraction des rayons X
Infra Rouge
Association Française de Normalisation
Contre électrode
Electrode au calomel saturé
National Association of Corrosion Engineers
Electrode de Référence
Spectroscopie d’impédance Electrochimique
International Organization for Standardization
Concentration
Capacité de double couche
Potentiel de corrosion
Potentiel bande plate
Potentiel de passivité
Densité de courant de corrosion
Intensité de passivité
Résistance
Résistance de polarisation
Surface
Temps
Température
Taux de recouvrement
Déphasage
Elément constant de phase
Capacitance
Epaisseur de la couche
Capacité de charge d'espace
Capacité de la couche de Helmholtz
Densité de donneur
Densité d’accepteur
Huile essentielle
Energie d’activation
SOMMAIRE
INTRODUCTION GENERALE ... 1
ChapitreI: Rappels bibliographiques
………3I-1. L’industrie phosphorique…….………...…..4
I .1.1.Procédés de fabrication de l’acide phosphorique………...…………..4
I.1.1.1.Procédé par voie thermique ... 4
I.1.1.2.Procédé par voie humide ... 5
I.1.2 Agressivités du milieu phosphorique ... 6
I.1.2.1.Agressivité chimique des impuretés solubles... 6
I.1.2 .2.Agressivité mécanique du milieu ... 7
I.2. Aciers inoxydables ... 8
I.2.1.Aciers inoxydables austénitiques ... 9
I.3. Influence de la composition chimique des alliages ... 10
I.4.Résistance des alliages à la corrosion ... 12
I.5.Alliages soudés ... 14
I.6.Inhibition de la corrosion des matériaux en milieux acides ... 15
I.7.Généralités sur l'utilisation des inhibiteurs de corrosion ... 16
I.7.1. Propriétés des inhibiteurs ... 17
I.7.2.Les classes d’inhibiteurs ... 17
I.7.3.Les inhibiteurs organiques ... 18
I.7.5. Les inhibiteurs minéraux ... 18
I.8. Mécanismes d’action électrochimiques ... 19
I.9. Mécanismes d’action interraciale. ... 20
I.9.1.Adsorption physique ... 20
I.9.2.Chimisorption... 21
I.9.3.Pouvoir protecteur des films formés ... 21
I.9.4.Structure moléculaire des inhibiteurs ... 22
I.10. Isotherme d’adsorption ... 23
I.11.Applications des inhibiteurs dans le domaine de corrosion. ... 25
1.11.1.Généralités sur les huiles essentielles ... 26
I.11.2.Caractéristiques des plantes ... 28
I.11.3.Généralités sur les argiles ... 32
Chapitre II: Méthodes d'études et conditions expérimentales
…………..35II.1. Matériaux étudiés ... 36
II.2. Electrolyte ... 37
II.3. Techniques d’étude électrochimique : ... 37
II.3.1.Méthodes stationnaires : Courbes de polarisation potentiodynamique…………..…..….37
II.3.2.Méthodes transitoires : Spectroscopie d’impédance éléctrochimique………...…….39
II.4. Préparation des inhibiteurs étudiés: ... 47
II.5. Techniques d’analyses chimiques ... 39
II.5.1. Identification des Huiles essentielles ... 45
II.5.1.1. Hydrodystillation ... 45
II.5.1.2. Chromatographie à phase gazeuse ... 47
II.5.2. Identification de la roche argileuse ... 51
SOMMAIRE
II.5.2.2. Spectroscopie d’Infrarouge ... 54
II.6.Techniques d’analyses de surface ... 54
Chapitre III: Corrosion des nuances de l’acier inoxydable 904L en milieux
phosphoriques
………..….55III.1.Etude du comportement électrochimique ... 56
III.1.1.Etude chronopotentiométrique……….….58
III.1.2.Courbes de polarisation ... 64
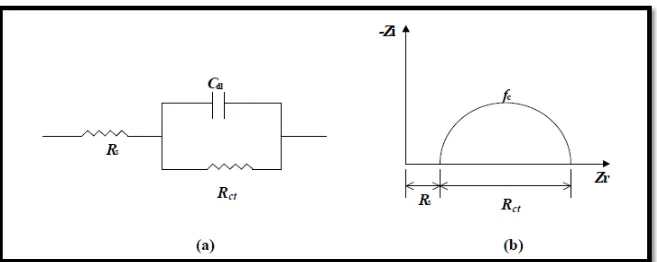
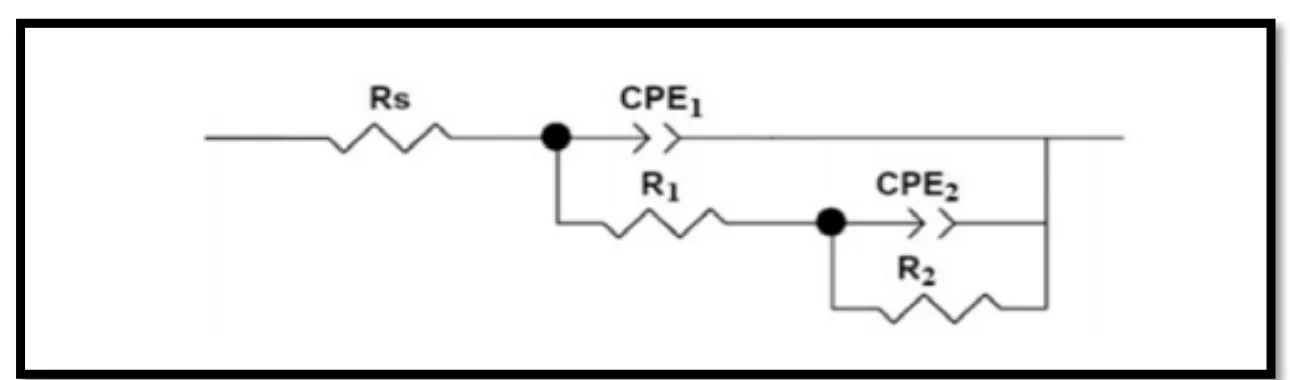
III.1.3.Spectroscopie d’impédance éléctrochimique ... 68
III.2.Propriétés semi-conductrices des couches passives : Approche de Mott-Schottky ………...70
III.3.Analyses de surface ... 76
III.4.Conclusion ... 80
Chapitre IV: Etude de l’effet inhibiteur des huiles essentielles et argile sur
la corrosion de l’acier 904L dans l’acide phosphorique
………..82IV-1.Etude de l’inhibition avec l’huile extraite de la lavandula stoechas……….…..83
IV-1.1.Comportement électrochimique………....83
IV.1.1.1.Courbes de polarisation. ... 83
IV.1.1.2. Spectroscopie d’impédance électrochimique ... 86
IV.1.2.Effet de la température. ... 90
IV.1.3.Isotherme d’adsorption ... 94
IV-2 Etude de l’inhibition avec l’huile extraite d’Artemisia Herba Alba ... 99
IV.2.1.Comportement Electrochimique ... 99
IV.2.1.1.Courbes de polarisation ... 99
IV.2.1.2.Spectroscopie d’impédance électrochimique ... 101
VI.2.2.Effet de la température ... 104
IV.2.3.Isotherme d’adsorption ... 107
IV-3.Etude de l’inhibition avec une argile en milieu phosphorique ... 112
IV-3.1.Courbes de polarisation : ... 112
IV.3.2.Spectroscopie d’impédance électrochimique ... 114
IV.3.2. Effet de la température ... 117
IV-4.Conclusion ... 122
CONCLUSION GENERALE ... 124
References Bibliographes………...……….…….……..130
Liste des figures... 138
INTRODUCTION
GENERALE
1
INTRODUCTION GENERALE
La corrosion est un processus très complexe qui fait intervenir de nombreux paramètres qui déterminent la durée de vie d’une installation et sa fiabilité. La maîtrise de ce processus permet d’une part la diminution des charges d’entretien (coût d’investissement) et d’autre part l’amélioration des conditions de sécurité du personnel. On estime que la corrosion détruit un quart de la production annuelle mondiale d’acier, ce qui représente environ 150 millions de tonnes par an (ou encore 5 tonnes par secondes) et que le cout de corrosion est à plus de 4.2% du PNB dans les pays industriels.
La corrosion qui est l’attaque des matériaux par le milieu environnant n’épargne aucune industrie chimique en particulier, l’industrie de la fabrication des engrais, des détergents de l’alimentation animale, des plastifiants….L’acide phosphorique est le principal dérivé actuel de la chimie de phosphore et l’intermédiaire quasi-indispensable pour l’élaboration de la plupart de ces produits.
Au Maroc, l’industrie phosphorique se positionne en place de leader vu que notre pays possède les trois quarts des réserves mondiales de phosphates évaluées à 80 milliards de tonnes. L'Office Chérifien des Phosphates (OCP) est le premier exportateur mondial des phosphates.
L’industrie des phosphates constitue un environnement très agressif vis-à-vis des matériaux. A l’état pur, l’acide phosphorique est peu corrosif par rapport à l’acide nitrique et à l’acide sulfurique, mais la présence des impuretés dans l’acide phosphorique produit par voie humide entraine de nombreux problèmes de corrosion. En effet l’acide phosphorique industriel contient diverses impuretés dont les chlorures, les fluorures, les sulfates et les cations métalliques (Al3+, Fe3+, Mg2+….) qui jouent un rôle déterminant dans le comportement agressif du milieu.
L’étude de l’influence des impuretés des acides phosphoriques industriels en regard de l’agressivité de ces milieux a fait l’objet de plusieurs publications et mémoires (voir partie bibliographie). Ces recherches ont ressorti le rôle prépondérant des ions chlorures, sulfates et fluorures, de faibles quantités de ces ions peuvent altérer les films de passivité des aciers inoxydables austénitiques, matériaux couramment utilisés dans la fabrication, le stockage et le transport de l’acide. D’autres facteurs d’origine mécanique et thermique (transfert de chaleur) accentuent encore l’agressivité des milieux phosphoriques.
En matière de lutte contre la corrosion, parmi les solutions possibles, il s’agit d’agir sur l’environnement avec lequel le matériau est en contact.
2
L’utilisation des inhibiteurs est l’une des méthodes les plus pratiques pour la protection contre la corrosion en particulier dans des solutions acides. Toutefois, les composés synthétiques utilisées comme inhibiteurs, sont couteux et pour la plupart très dangereux.
La nature non-toxique et biodégradable des produits naturels a conduit à leur utilisation en tant qu’inhibiteurs vert. Les produits naturels tels que les composés extraits de plantes semblent être une alternative écologique idéale pour remplacer les traditionnels inhibiteurs de corrosion.
Dans ce contexte, nous avons examiné en milieu phosphorique pollué, l’effet inhibiteur des composés naturels organiques et minéraux sur les deux nuances de l’acier inoxydable (904L).
Pour se faire, nous avons utilisé des méthodes électrochimiques et spectroscopiques (MEB, DRX, IR) afin de mieux élucider nos résultats.
En cherchant une présentation claire de notre travail et compte-tenu de la multiplicité des paramètres qui entrent en jeu, ainsi que la complexité du mode d’action du phénomène de corrosion, nous avons adopté le plan suivant :
Le premier chapitre est une synthèse succinte des connaissances bibliographiques concernant la fabrication de l’acide phosphorique et les études des problèmes spécifiques de la corrosion des matériaux rencontrés dans ce milieu. Aussi, ce chapitre fait le point sur les inhibiteurs de corrosion et en particulier les huiles essentielles ainsi que les inhibiteurs minéraux.
Dans le deuxième chapitre, nous décrivons les techniques opératoires mises en œuvre dans le cadre de notre étude.
Le troisième chapitre comprend deux parties. La première concerne une étude sur le comportement électrochimique des nuances de l’acier inoxydables en milieu phosphorique pollué, la deuxième partie quant à elle, est consacrée à l’étude des propriétés physico-chimiques des films passifs formés en surface des nuances de l’acier inoxydables.
Dans le quatrième chapitre nous nous sommes intéressés à l’étude de l’action inhibitrice de trois composés naturels à savoir une huile essentielle de la lavande, une huile essentielle de l’armoise et une argile utilisée en tant qu’inhibiteur minéral en milieu acide pollué.
3
Chapitre I :
Rappels bibliographiques
-Position du problème
4
Chapitre I
Bilan Bibliographique-Position du Problème
I-1.L’industrie phosphorique
L’acide phosphorique est un produit phare qui rentre dans la fabrication des engrais à 90%; les phosphates alimentaires ; les tripolyphosphates (lessives) avec 3 % de la consommation mondiale d'acide phosphorique ; dans les traitements de surface des métaux (phosphatation) ; dans l'alimentation du bétail (phosphates de Ca2+, Na+, Mg2+) ; dans des produits pharmaceutiques ; dans des produits chimiques pour le traitement des eaux,…La composition et la pureté de l’acide phosphorique dépendent de l’origine des phosphates naturels et surtout du procédé de fabrication.
L’apatite, qui est le principal constituant des minerais de phosphates, peut être schématisée par la formule générale Ca10(PO4)2 X2 dans laquelle X est le plus souvent le fluor,
mais peut être également Cl ou OH. Le groupement (PO4) peut être partiellement substitué par
VO4, AsO4, SiO3 ou CO3. C’est le degré de cette substitution qui introduit des différences
dans la composition de divers gisements.
Il y a deux catégories de procédés pour la fabrication de l’acide phosphorique, les procédés au four et les procédés par voie humide. Les premiers comprennent le procédé électrique au haut fourneau et le procédé au four électrique. Ce dernier est très utilisé pour fabriquer le phosphore élément, dont la plus grande partie est transformé en acide phosphorique pour des usages autres que la fabrication d’engrais. Les procédés par voie humide peuvent être classés suivant l’acide utilisé pour décomposer le phosphate naturel, dans l’industrie, on emploie les acides sulfurique, nitrique ou chlorhydrique.
I .1.1.Procédés de fabrication de l’acide phosphorique I.1.1.1.Procédé par voie thermique
Le premier stade de ce procédé est l’obtention de phosphore élément dans un four électrique. Le four est alimenté par un mélange de coke, de phosphate en nodules ou en morceaux d’une autre forme et de cailloux de silice. Le courant électrique, qui entre dans le four par des électrodes en carbone ou en graphite, fond la silice et le phosphate; ce dernier est réduit par le carbone contenu dans le coke [1].
5
On enlève continuellement du four le phosphore à l’état de vapeur, mélangé au monoxyde de carbone. Le phosphore est condensé à l’état liquide ; il est transformé en acide phosphorique dans une usine distincte. Le coût de production dans ce cas est élevé en raison de la consommation d’énergie à haute température, d’ou l’utilisation réduite de cette méthode. Ce procédé peut être résumé selon la séquence suivante :
Minerai de phosphate + SiO2 → P2O5
2 P2 O5 + 10 C → 10CO + P4
P4 + 5 O2 → P4O10
P4 O10 + 6 H2 O → 4 H3PO4
I.1.1.2 Procédé par voie humide
Le procédé par voie humide reste le plus utilisé industriellement, certes il conduit à un acide moins pur que celui produit par voie thermique, mais d’un prix de revient moins élevé. Le procédé se résume en trois grandes étapes (figure I-1) : l’attaque du minerai phosphaté ; la filtration de la bouillie et la concentration de l’acide.
Figure. I.1:Schéma de fabrication de l'acide phosphorique par voie humide.
L’attaque du minerai de phosphate se fait dans des réacteurs (cuves d’attaque), par l’acide sulfurique concentré (93-98 %) selon la réaction suivante :
6
La principale réaction peut être représentée par l’équation suivante, le phosphate naturel étant supposé être du fluor apatite pure :
Ca10X2(PO4)6+ 10 H2SO4+ 20 H2O 10 (CaSO4,2H2O) + 6 H3PO4+ 2 HX
Où X=Cl ou F
D’autres réactions parasites se produisent lors de l’attaque du phosphate, elles sont dues à la présence d’impuretés dans le minerai tels que : SiO2, F-, Al2O3, Fe2O3, MgO... etc.
Elles sont à l’origine de la complexité des milieux phosphoriques industriels ; les produits qui en résultent entraînent souvent des problèmes de corrosion sévères.
On peut classer les procédés commerciaux par voie humide suivant la forme cristalline du sulfate de calcium formé: anhydre (CaSO4), hémihydrate (CaSO4, 1/2H2O) et dihydrate
(CaSO4, 2H2O).
Au niveau de cette étape, la dégradation des matériaux est favorisée par la présence des matières en suspension et par les impuretés contenues dans le minerai ou introduites dans l’eau de lavage [2,3]. Ces deux éléments aggravent très sérieusement l’agressivité du milieu.
La filtration quant à elle, permet de séparer l’acide phosphorique du sulfate de calcium à l’aide d’un filtre sous vide avec lavage systématique à contre-courant. La filtration permet d’obtenir un acide phosphorique titrant de 25 à 32 % en P2O5. Le produit est ainsi acheminé
aux évaporateurs pour être concentré à 54 % en P2O5 environ.
La concentration se produit par évaporation sous vide dans un échangeur tubulaire où l’acide est porté à 80°C par chauffage à l’aide de vapeur d’eau à 140°C.
I.1.2.Agressivités du milieu phosphorique
I.1.2.1.Agressivité chimique des impuretés solubles
L’agressivité dépend des impuretés présentes à chaque stade de production de l’acide. Il semble bien établi que l’action de ces solutions soit essentiellement due à la présence d’impuretés chimiques solubles ou insolubles. Par contre, la présence des ions métalliques oxydants peut favoriser dans une certaine mesure la passivité des aciers et des alliages inoxydables. Il faut souligner ici que la concentration en ions halogénés diminue au niveau des derniers stades de fabrication, ce qui explique une agressivité décroissante du milieu au fur et à mesure que la concentration en P2O5 s’élève. Cette diminution d’agressivité est
également due au fait que les ions oxydants tels que Fe3+ et Al3+ se concentrent au cours de la fabrication de l’acide, favorisant un pouvoir oxydant de plus en plus accentué et donc une meilleure tenue des alliages passivables [5].
7
Le type et les quantités d’impuretés présents dans le minerai de phosphate, l’acide filtré et l’acide concentré sont indiqués dans le tableau I.1.
Phosphates Bouillie concentrée Acide concentrée Effet corrosif %P2O2 30 à 38 28 à 32 46 à 54 Impureté SO4 2-SO3% F-% Cl-% SiO2 % S- % Al2O3 % Fe2O3 % 2.88 à 3.64 1.5 à 3 2.5 à 4 0.002 à 0.25 0.5 à 3 0.005 à 0.15 0.2 à 1 0.2 à1 2.60 à 2.92 1.5 à 6.5 1.5 à 4 0.002 à 0.25 0.5 à 3 [H2S] = 0.0007 -0.5 -1.5 4.21 à 4.99 2.5 à 6.5 0.5 à1.5 0.0005 à 0.03 [H2S] =0.0007 -1.5 -1.5 + + ++ ++ Néant ++ - -
Tableau I-1 : Les principales impuretés (en % massique) déterminant le pouvoir corrosif des milieux phosphoriques industriels.
L’acide sulfurique est utilisé pour la production de H3PO4 via la voie humide, son
effet se traduit par une diminution de pH d’une part, et affecte d’autre part, l’équilibre entre F
-et Si4+, Al3+. Le procédé de désulfatation du milieu permet de palier à cet inconvénient. Mais s’il est utilisé en excès, H2SO4 diminue le pH et affecte l’équilibre ente F-, Si4+ et Al3+ [6].
L’ion F- se trouve sous forme des complexes forts avec beaucoup d’ions métalliques.
Les ions F- présents dans les apatites sont sources d’une corrosion généralisée dans une solution acide (dissolution uniforme de la surface passive) [7, 8,9].
L’ion chlorure provient du minerai de phosphate et également des eaux de lavage. Cet ion qui possède un grand rayon ionique est faiblement solvaté et peut donc être adsorbé à la surface du métal et inhiber le processus de passivation responsable de la résistance à la corrosion des aciers inoxydables.les ions chlorures provoquent une corrosion par piqures en raison leur mobilité et polarisabilité [10].
I.1.2 .2.Agressivité mécanique du milieu
:
La présence des particules solides dans un fluide corrosif en mouvement provoque une rupture mécanique du film passif, et par conséquent favorise l’adsorption des ions agressifs.
8
En effet, des essais industriels ont montré que les matériaux les plus attaqués sont ceux soumis à une forte abrasion (agitateurs, pompes,...).
Une augmentation de la vitesse de dissolution anodique des alliages, une modification de l’épaisseur des couches passives, et une corrosion localisée (piqûres), telles sont les résultats des études ayant mis en évidence l’impact de l’abrasion sur la tenue des matériaux en milieux corrosifs [11-12].
Dans le procédé de fabrication d’acide phosphorique par voie humide, une forte corrosion abrasion résulte essentiellement des fluorures, des chlorures et des particules de gypse en phase d’attaque. Le phénomène se poursuit en phase de filtration et les dommages subis dans les filtres et les pompes sont pris en considération.
Suite à tous ce qui a précédé sur l’agressivité du milieu phosphorique industriel (impuretés agressives, effet de l’abrasion, effet de la température..), Il faut signaler, qu’au niveau des unités de concentration, l’effet de transfert thermique s’ajoute au phénomène pré-cité [13].Le choix de matériaux de construction très résistants pour l’installation de production s’impose comme solution incontournable. Dans ce choix, la première contrainte à prendre en considération est la durabilité, donc une bonne résistance à la corrosion.
I-2. Aciers inoxydables
Les aciers inoxydables jouent un grand rôle dans d'innombrables domaines : vie quotidienne, industrie mécanique, agroalimentaire, chimie, transports, médecine et chirurgie, etc. [14,15] Comme les autres aciers, ce sont des alliages à base de fer auquel on vient ajouter du chrome (>12%) du nickel et bien d'autres éléments comme le molybdène, le cuivre et le tungstène, afin d'améliorer la résistance à la corrosion. L'élément d'alliage auquel les aciers inoxydables doivent leur principale caractéristique est le chrome.
Contrairement à ce que l'on croit généralement, ce métal est très réactif du point de vue chimique et il est en particulier très oxydable, mais son oxyde forme une véritable peau à la fois transparente et protectrice. Allié au fer et au nickel, il provoque la formation d'un composé de surface oxydé capable de ralentir efficacement la corrosion.
Le chrome et le nickel s'oxydent ainsi : 2 Cr + 3 O2 → 2 Cr2O3
2 Ni + O2 → 2 NiO
Il existe de très nombreuses nuances d'aciers inoxydables et le choix est parfois difficile, car ils n'ont pas tous le même comportement dans un milieu donné. On les désigne souvent par les pourcentages massiques en nickel et en chrome. Ainsi, un inox 18/10, tel que
9
ceux utilisés en coutellerie, pour les couverts et pour la cuisine en général, contient 18 % en masse de chrome et 10 % en masse de nickel. Cette désignation est en fait très insuffisante car elle ne préjuge en rien de la structure métallurgique.
En plus de la résistance à la corrosion qui caractérise les matériaux énumérés plus haut, les aciers inoxydables possèdent une qualité déterminante qui est la résistance mécanique [16].
Il existe ainsi une large gamme d’aciers inoxydables classés selon leurs teneurs en fer, chrome, nickel…On distingue alors des aciers martensitiques, ferritiques, austénitiques et austéno-ferritiques qui correspondent à des structures métallographiques bien particulières qui leurs confèrent des propriétés intéressantes.
I.2.1.Aciers inoxydables austénitiques
Les aciers inoxydables austénitiques sont les plus utilisé dans l’industrie chimique (plus de 70%). Ils contiennent généralement entre 0,02% et 0,1% carbone, 17 à 20% de chrome, 7 à 25% de nickel et 2 à 5% molybdène. Des additions de molybdène et d’azote ont permis d’améliorer considérablement le comportement de ces nuances vis-à-vis de la corrosion localisée. La résistance à la corrosion est très bonne dans de nombreux cas, surtout dans les milieux oxydants [17,18].
La teneur en nickel sert à donner et à conserver la structure austénitique à ces aciers même à température ambiante, en plus d'augmenter leur résistance à la corrosion. Des nuances à hautes teneurs en nickel (20 à 41%) ont été développées. Les nuances de cette famille, dites super-austénitiques, présentent la particularité d’avoir une structure totalement austénitique.
Les aciers austénitiques sont ductiles, résistants au choc et non-magnétiques; ils ne se trempent pas, mais peuvent acquérir une certaine dureté par déformation à froid. A l'état recuit, ils possèdent à ce moment une plus grande ductilité et une meilleure ténacité que les aciers ordinaires. Ils possèdent une très bonne résistance à la corrosion [14]. D’où leur utilisation dans l'industrie chimique, pharmaceutique et alimentaire. Ils sont également insensibles à la fragilité à basse température, ce qui permet leur utilisation dans des installations frigorifiques
Les avantages de cette structure sont liés à des paramètres mécaniques et métallurgiques issus de la structure même de l’austénite, à savoir :
-un allongement important (jusqu’à 60%) facilitant la mise en œuvre et facteur de sécurité en fabrication comme en service ;
10
-une résilience excellente, même à très basse température, en indépendance de l’épaisseur -une bonne stabilité structurale, liée aux vitesses de diffusion assez faibles dans l’austénite comparées à celle de la ferrite, T°=0 à 550°C.
Les exemples les plus connus sont les aciers : Z2NCDU25-20 (904L) et Z2NCDU31-27 (type sanicro 28).
I-3.Influence de la composition chimique des alliages
Outre la nature du milieu électrolytique, La résistance à la corrosion des alliages inoxydables dépend des éléments d’addition tels que : Cr, Mo, W, Cu et N. Ces derniers sont ajoutés en quantités différentes selon l’importance, le besoin et le coût de chacun d’entre eux. L'effet des principaux éléments d'addition sur les courbes de polarisation est illustré par la figure I-2 [19, 20]. Le chrome est considéré comme le principal agent anti-corrosion des aciers inoxydables. L’accroissement de la teneur en Cr augmente la vitesse de corrosion à l’état actif, par contre il la diminue lorsque l’alliage est à l’état passif [20]. C’est essentiellement pour cette dernière propriété que le chrome est ajouté dans l’alliage pour le rendre inoxydable.
Il peut être utilisé pour améliorer la résistance à la corrosion dans les milieux acides oxydants (HNO3 et H2CrO4) ainsi que dans l’acide phosphorique [21, 22].
Figure.I.2 : Influence des éléments d’addition dans les aciers sur l’allure des courbes potentiocinétiques [19,20].
11
Quant au molybdène, il doit son importance à l’effet bénéfique qu’il présente vis à vis de la résistance à la corrosion. Son action en corrosion généralisée (milieu acide) est positive sauf dans certains milieux très oxydants (HNO3 bouillant par exemple), correspondant à un
fonctionnement transpassif [20].
Le rôle essentiel de Mo est d'augmenter la stabilité de la couche passive en diminuant la cinétique de dissolution anodique [19,21]. Un autre élément, le tungstène en l’occurrence présente aussi une action bénéfique puisqu’il favorise l’établissement de l’état passif [22-23].
Selon N. Bui, A.Guenbour et coll [23], la présence de Mo et W sous forme d’oxydes conduit à un renforcement, par interaction, des liaisons entre les oxydes et à l’interface oxyde métal. Concernant le cuivre, son influence sur la transition active-passive est légèrement positive. Enfin il y a l’azote qui, durant ces dernières années, commence à être utilisé pour augmenter la résistance à la corrosion des matériaux.
Il contribue en présence du molybdène, au développement de la passivité de l’alliage 18%Cr-8%Ni dans des solutions d’acide sulfurique [24]. Sa présence dans la composition chimique des alliages inoxydables, aux côtés de Mo et Cr, améliore leur résistance à la corrosion généralisée en milieu phosphorique industriel [25].
I-4.Résistance des alliages à la corrosion :
La résistance des matériaux à la corrosion est un processus plus ou moins compliqué selon chaque cas rencontré. La résistance d’un matériau quelconque dépend de la nature même de ce matériau (métal, alliage, composite..), de sa propre composition chimique, des sollicitations extérieures et des changements qui peuvent survenir tout au long de sa durée de vie, de la nature de l’environnement corrosif (gaz, liquide, acide, base ...) et des mesures entreprises contre la corrosion [26].
Les aciers inoxydables se dotent d’une bonne résistance à la corrosion grâce à leurs compositions chimiques. C'est au chrome que l'on doit la résistance des aciers inoxydables aux agents oxydants. A une teneur minimale de l’ordre de 11 %, le Cr permet la passivité (un film passif que l’on trouve sous la forme d’oxyde complexe de type (Fe2O3, Cr2O3) et
d’hydroxyde Cr(OH)3[19,20].
Le nickel favorise la formation de structures homogènes de type austénitique, intéressantes pour éviter la corrosion mais à éviter soigneusement dans le domaine du frottement. Le molybdène accroît la stabilité des films de passivation. Le tungstène améliore la tenue aux températures élevées des aciers inoxydables austénitiques. Le titane doit être
12
utilisé à une teneur qui dépasse le quadruple de la teneur en carbone. Il évite l'altération des structures métallurgiques lors du travail à chaud, en particulier lors des travaux de soudure. Enfin, le silicium peut avoir un effet favorable dans certains milieux acides et fortement oxydants comme l’acide nitrique concentré et l’acide sulfurique concentré chaud. Au sens strict du terme, le silicium ne peut cependant pas être considéré comme un élément d’alliage car sa teneur est toujours limitée dans les aciers inoxydables [27].
D’un autre côté, les facteurs favorables à la lutte contre la corrosion sont également applicables aux aciers inoxydables :
- Décaper les surfaces pour éliminer tous les oxydes résultants du travail à chaud : laminage, forgeage, traitements thermiques, assemblages par soudure, etc.,
- Ne traiter thermiquement que des pièces propres et sèches, sans traces de graisses, de résidus de produits dégraissants.
- Éviter, lors de la conception des pièces, de créer des zones difficiles à nettoyer, plus encore pour les aciers inoxydables que pour les autres métaux, l'état de surface doit être particulièrement soigné car il conditionne l'établissement d'un film passivant.
Le phénomène de passivité présente une très grande importance dans la mesure où il constitue la base du mécanisme de résistance à la corrosion des aciers inoxydables. Le phénomène de passivité se caractérise par la présence d’un film très mince (épaisseur de l’ordre de 10 à 20 nm), appelé film passif ou couche passive, à la surface de l’alliage métallique qui rend sa vitesse de corrosion négligeable. Le film passif, fortement solidaire du substrat métallique, empêche plus ou moins le contact entre l’alliage et les agents agressifs du milieu environnant qui peuvent l’altérer dans certaines conditions [21,22].
Pour que le phénomène de passivité puisse s’établir, et se maintenir, il est nécessaire que l’alliage fer-chrome ait une teneur minimale en chrome de l’ordre de 11 %. Autrement dit, il existe un effet de seuil delà duquel le phénomène de passivité peut exister et au-dessous duquel il est impossible. De plus, si la couche passive devait être détruite localement par suite d’un endommagement accidentel (rayure par exemple), elle possède la propriété de pouvoir se reconstituer dans un grand nombre de milieux, ce qui traduit la propriété d’auto-passivation de l’alliage métallique dans ce milieu [17].
Le choix d'un alliage pour une application de résistance à la corrosion donnée est le résultat de la prise en compte d'un ensemble de données techniques et économiques :
*Caractéristiques du matériau, c'est-à-dire ses caractéristiques mécaniques et physiques et sa résistance à la corrosion dans le milieu considéré. La polyvalence d'un matériau, c'est-à-dire
13
sa résistance à plusieurs types de milieux corrosifs intervenant dans un matériel est un élément important.
* Coût du matériau et de sa mise en œuvre.
* Durée de vie prévue pour la pièce et le matériel dont elle fait partie. * Coût de l'entretien.
* Coût de réparation des pannes et du temps d'arrêt de service de l'appareil concerné.
La solution d'un problème concret demande une analyse précise des conditions d'emploi du matériau et leur examen avec les services techniques des fournisseurs. En effet, des facteurs comme l'aération du milieu, les phénomènes galvaniques, les contaminations ou l'érosion peuvent modifier fortement le comportement d'un matériau.
La connaissance des types d'alliages est essentielle pour les systèmes constitués d'éléments assemblés mécaniquement ou par soudage. Cependant, la mise en présence de deux alliages trop différents dans un électrolyte peut en effet provoquer des phénomènes de corrosion électrochimique très destructeurs.
I-5.Alliages soudés
:Le soudage des matériaux est une des méthodes de construction les plus communes utilisées partout en ingénierie. La réalisation possible de très gros profils a ouvert de nouvelles perspectives à la construction métallique à condition de pouvoir les assembler par soudage. Les techniques de soudage ont considérablement évolué depuis quelques années.
Malheureusement ce processus perturbe la microstructure des matériaux soudés et engendre de graves problèmes de corrosion ; ainsi, la compréhension des effets du processus de soudage sur les matériaux, est donc primordiale et nécessaire pour comprendre les implications d'une telle technique d’assemblage sur la performance à la corrosion des matériaux utilisés.
Dans les grandes installations comme celles de l’industrie phosphorique, les aciers inoxydables soudés sont souvent utilisés dans différentes unités de production et pour les canalisations. Cependant plusieurs types de corrosion ont été observés sur les soudures des aciers inoxydables dans différents milieux : corrosion inter-granulaire, par piqures et par crevasses [28].
Des précautions relatives à la qualité des soudures sont particulièrement importantes pour éviter la création de points faibles sur le matériau à souder qui peuvent affaiblir sa résistance à la corrosion, à citer :
14
-La propreté, ce qui implique l'élimination des contaminations par des corps gras ou des oxydes superficiels.
-Les défauts géométriques des produits assemblés et pénétrations incomplètes, ces deux types de défauts favorisant la corrosion par crevasses.
-Les précautions d'ordre thermique, en limitant autant que possible l'apport de chaleur.
Il existe trois méthodes principales pour créer la chaleur nécessaire au soudage : la flamme oxyacétylénique, la résistance au passage d’un courant et l’arc électrique.
Chaque méthode produit un bain d’acier en fusion que l’on doit protéger de la contamination atmosphérique. La méthode utilisée pour réaliser cette protection à une influence prépondérante sur les caractéristiques du mode opératoire. Le chalumeau oxyacétylénique est plutôt utilisé pour le découpage des éléments (bien qu’aujourd’hui les procédés au plasma deviennent de plus en plus courants) [28].
Il faut aussi noter que pour plusieurs alliages, le soudage se fait avec du métal d'apport de leur propre nuance, et dans le cas du soudage de nuances différentes, on utilise comme métal d'apport la plus noble des deux nuances.
Pour les aciers inoxydables austénitiques, la présence des éléments d'alliage (N, Mn, Cu) garantie une stabilisation de l'austénite à haute température. La présence de titane ou de niobium va limiter la formation de carbures du type Cr23C6 aux joints de grain qui peuvent
induire de la corrosion inter-granulaire.
Le processus de soudure peut conduire à une réduction de l’intégrité structurelle de point de vue de sa force structurelle et sa performance à la fatigue. Plus encore, le soudage affaiblit la résistance à la corrosion du joint [29].
Dans ce travail nous avons évalué l’impact de processus de soudage sur la corrosion de l’acier inoxydable 904L.
I-6.Inhibition de la corrosion des matériaux en milieux acides
La corrosion est la détérioration d’un métal par une attaque ou une réaction chimique avec son environnement. C'est un problème constant et continu, souvent difficile à éliminer complètement. Cette définition admet que la corrosion est un phénomène nuisible: elle détruit le matériau et réduit ses propriétés.
La corrosion affecte la plupart des secteurs industriels et peut coûter des milliards de dollars chaque année [30], par exemple dans le cas des procédés industriels les métaux sont exposés à l'action des acides, qui agissent comme agents corrosifs.
15
Ces acides jouent un rôle important dans l’industrie, surtout dans le raffinage du pétrole brut, le décapage à l'acide, le nettoyage industriel, le détartrage acide, et aussi dans les procédés pétrochimiques [31-32], etc...L'acide phosphorique est l’un des agents les plus largement utilisés dans le secteur industriel.
Il existe plusieurs méthodes disponibles pour protéger les métaux de la corrosion dans ce milieu, comme la protection cathodique, utilisation des solutions antirouille ou des inhibiteurs de corrosion.
L'utilisation des inhibiteurs pour empêcher le processus de dissolution des métaux reste une application très répandue.
Les inhibiteurs de corrosion sont des substances qui, lorsqu'elles sont ajoutées à de faibles concentrations dans des milieux corrosifs, diminuent ou empêchent la réaction du métal avec son environnement.
Un inhibiteur doit présenter plusieurs caractéristiques: abaisser la vitesse de corrosion d’un métal sans affecter les caractéristiques physiques, être efficace à faible concentration, être stable en présence des autres constituants du milieu ou à différentes températures d’utilisation. Comme les normes européennes sont très strictes en ce qui concerne la toxicité, un inhibiteur doit être aussi compatible avec celles-ci et, bien sûr, d’un point de vue économique, son prix doit être très intéressant
La plupart des composés synthétiques présentent une bonne action anti-corrosion, mais sont souvent hautement toxiques pour les êtres humains et l'environnement. Ces inhibiteurs peuvent causer des dommages temporaires ou permanents au système d'organes tels que les reins ou le foie, ou de perturber le système enzymatique de l’organisme [33,34].
Récemment, l’utilisation de ces composés a été critiquée, c’est ce qui a incité les chercheurs à s’orienter de plus en plus vers la préparation d’inhibiteurs non toxiques et biodégradables.
Par conséquent, en raison des préoccupations environnementales, les inhibiteurs écologiques que soit des extraits des plantes ou des composés inorganiques sont considérés de plus en plus comme une source d’inhibiteurs de corrosion verts. Ils sont utilisés pour la protection de métaux dans l'environnement acide, afin de remplacer les produits chimiques toxiques utilisés actuellement.
Une synthèse bibliographique de l’utilisation des différents extraits de plantes aussi bien les huiles essentielles que les extraits méthanoliques dans l’inhibition de la corrosion est résumée plus loin.
16
I-7.Généralités sur l'utilisation des inhibiteurs de corrosion
La définition d’un inhibiteur de corrosion n’est pas unique, néanmoins celle retenue par le National Association of Corrosion Engineers (NACE) est la suivante : un inhibiteur est « une substance qui retarde la corrosion lorsqu’elle est ajoutée à un environnement en faible concentration » [35].
Un inhibiteur de corrosion, selon les termes de la norme ISO 8044, est une substance chimique qui, présente à une concentration appropriée dans un système de corrosion, diminue la vitesse de corrosion sans changer notablement la concentration en agent corrosif.
I.7.1. Propriétés des inhibiteurs
D'une manière générale un inhibiteur doit être :
Stable en présence des autres constituants du milieu, en particulier vis-à-vis des oxydants ; Stable aux températures d'utilisation ;
Efficace à faible concentration ;
Compatible avec les normes de non-toxicité ; Peu onéreux.
I.7.2. Les classes d’inhibiteurs
Il existe plusieurs possibilités de classer les inhibiteurs, celles-ci se distinguent les unes des autres par [36] (figure I.3) ;
la formulation des produits (inhibiteurs organiques ou minéraux),
les mécanismes d’action électrochimique (inhibiteurs cathodiques, anodiques ou mixtes),
les mécanismes d’interface et principes d’action (adsorption à la surface du métal et/ou formation d’un film protecteur).
17
Figure I.3. Classement des inhibiteurs de la corrosion
I.7.3. Les inhibiteurs organiques
Les molécules organiques sont promises à un développement plus que certain en termes d’inhibiteur de corrosion : leur utilisation est actuellement préférée à celles d’inhibiteurs inorganiques pour des raisons d’écotoxicité essentiellement. Les inhibiteurs organiques sont généralement constitués de sous-produits de l’industrie pétrolière [36]. Ils possèdent au moins un atome servant de centre actif pour leur fixation sur le métal tel que l’azote (amines, ammoniums quaternaires, amides, imidazolines, triazoles…), l’oxygène (alcools acétyléniques, carboxylates, oxadiazoles…), le soufre (dérivé de la thiourée, mercaptans, sulfoxydes, thiazoles…) ou le phosphore (phosphonates). L’une des limitations dans l’utilisation de ces produits peut être l’élévation de la température, les molécules organiques étant souvent instables à haute température.
I.7.4. Les inhibiteurs minéraux
Les inhibiteurs inorganiques sont utilisés d’une manière générale dans des milieux voisins de la neutralité, alcalins et plus rarement en milieu acide. Les produits se dissocient en solution et ce sont leurs produits de dissociation (anions ou cations) qui assurent les phénomènes d’inhibition. Les principaux anions inhibiteurs sont les oxo-anions de types XO4n- tels les chromates, molybdates, phosphates et silicates… Les cations sont
essentiellement Ca2+, Zn2+ et Ce3+, c’est à dire ceux qui forment des sels insolubles avec des anions comme l’hydroxyde OH
18
Le nombre de molécules en usage à l’heure actuelle va en se restreignant, car la plupart des produits efficaces sont également néfastes pour l’environnement. Suivant qu’ils nécessitent plus ou moins d’oxygène dissous dans le milieu corrosif pour être efficaces, on les classe en inhibiteur passivant ou en inhibiteur non passivant. Les premiers aidant à la formation d’une couche d’oxyde homogène et isolante alors que les seconds agissent plutôt par formation d’un composé protecteur, précipité en surface. La quasi-totalité des molécules inorganiques inhibitrices contiennent de l’oxygène dans leur formulation.
En 1930, des ions chromates ont été identifiés comme les meilleurs inhibiteurs en solution aqueuse. Le comportement inhibiteur de ce composé peut être expliqué par sa forte capacité d’adsorption sur le métal [37] pour former un film protecteur. L’effet inhibiteur des ions chromates est dû à la réduction des Cr6+ en Cr3+ suivant la réaction suivante [38]:
2 CrO42- + 10 H+ + 6e- Cr2O3 + 5 H2O
La couche passive formée sur l’acier est essentiellement composée d’oxyde de fer et de chrome [39] améliorant ainsi la résistance vis-à-vis des espèces agressives.
Cependant, le chrome VI est un composé classé CMR (cancérigène, mutagène et reprotoxique) par la réglementation REACH, de nombreuses recherches ont tenté de mettre au point des solutions de substitution. Des inhibiteurs passivant comme MoO42-, MnO42-, SiO42-,
VO42- et WO42- ont été introduits en solution avec succès pour protéger l’aluminium et ses
alliages [40]. De plus, beaucoup d'inhibiteurs cathodiques et mixtes ont été testés toujours en tant que solution de substitution aux ions chromates. Les sels contenant Zn, Ca, Ba et Mn ont été étudiés et ont montré des performances acceptables. Dans ce contexte, les composés d'élément de terres rares ont montré des propriétés inhibitrices pour l'aluminium et ses alliages, le zinc, le nickel, le bronze, l’acier au carbone et l’acier [41,42].
L’utilisation des molybdates comme inhibiteur de corrosion est également étudiée depuis de nombreuses années pour l’inhibition de la corrosion par piqûres des aciers doux [43] ou inoxydables [44, 45,46].
I-8. Mécanismes d’action électrochimiques
Dans la classification relative au mécanisme d’action électrochimique, on peut distinguer les inhibiteurs anodique, cathodique ou mixte (regroupant alors les deux premières propriétés). L’inhibiteur de corrosion forme une couche barrière sur la surface métallique, qui modifie les réactions électrochimiques en bloquant soit les sites anodiques (siège de l’oxydation du métal) soit les sites cathodiques (siège de la réduction de l’oxygène en milieu neutre aéré ou siège de la réduction du proton H+ en milieu acide), voire les deux (figure I.4)
19
Figure I.4 : Formation des couches barrières a) cathodiques et b) anodiques interférant avec les réactions électrochimiques, dans le cas d’une étude en milieu acide
Les inhibiteurs anodiques doivent être utilisés avec précaution. En effet, si le film protecteur est altéré par une rayure ou par une dissolution, ou si la quantité d’inhibiteur est insuffisante pour restaurer le film, la partie exposée se corrode en piqûre profonde. En matière de corrosion localisée, la corrosion par piqûre est une forme particulièrement insidieuse : l’attaque se limite à des trous, très localisés et pouvant progresser très rapidement en profondeur tout en conservant le reste de la surface indemne.
I-9. Mécanismes d’action interraciale
.L’adsorption est un phénomène de surface universel car toute surface est constituée d’atomes n’ayant pas toutes leurs liaisons chimiques satisfaites. Cette surface a donc tendance à combler ce manque en captant atomes et molécules se trouvant à proximité. Deux types d’adsorption peuvent être distingués : la physisorption (formation de liaisons faibles) et la chimisorption. Ces deux types d'adsorption sont influencés par la nature et la charge du métal, la structure chimique du produit et le type d'électrolyte [47].
I.9.1 Adsorption physique
L'adsorption physique résulte d'une interaction électrostatique entre les ions ou les dipôles des molécules organiques et la surface du métal électriquement chargée. La charge du métal est définie par la position du potentiel de corrosion de ce métal par rapport à son potentiel de charge nulle (E0) [48].
Le potentiel de corrosion de ce métal à une valeur inférieure à E0, l'adsorption des
cations est favorisée. Les anions sont adsorbés aisément quand le potentiel de corrosion du métal se trouve dans la région de potentiel positif par rapport à E0.
Le phénomène de synergie [49] observé dans l'inhibition de la corrosion du fer en milieu acide sulfurique par les cations ammoniums quaternaires, en présence des ions
20
chlorures est interprété par la position d’E0. Dans ce cas, l'inhibition est plus importante en
présence des anions et des cations adsorbés que dans le cas où seuls les cations seraient adsorbés. Au potentiel de corrosion du fer en milieu H2SO4, la charge du métal est positive et
seule une très faible quantité des cations d'inhibiteurs s'adsorbe. Si on ajoute des ions chlorures à la solution acide, ils s'adsorbent à la surface du fer et déplacent E0 vers des valeurs
plus positives. Ainsi, l'anion Cl- facilite l'adsorption des cations d'inhibiteur.
Ce résultat explique la plus forte efficacité inhibitrice, de plusieurs cations organiques, de la corrosion du fer en milieu HCl comparée à celle obtenue en milieu H2SO4 [50].
I.9.2 Chimisorption
La chimisorption est le plus important type d'interaction entre l’inhibiteur et le métal. Dans ce cas, les espèces adsorbées entrent en contact direct avec la surface métallique. Il est en général admis que, le processus d'adsorption chimique met en jeu un transfert ou un partage d'électrons entre les molécules d'inhibiteur et les orbitales "d" vacantes de la surface du métal. Ceci permet de former des liaisons de coordination ou des liaisons covalentes.
La chimisorption est un phénomène irréversible et spécifique pour chaque métal. C'est un processus lent, dépendant de la température et caractérisé par une grande d'activation. La liaison covalente s’effectue par l’intermédiaire d’un centre actif de la molécule inhibitrice. Par son doublet électronique libre, ce centre actif de la molécule se comporte comme un donneur d’électrons vis-à-vis d’un atome métallique de la surface. Le paramètre important est alors la densité électronique autour du centre qui peut contribuer à renforcer l’effet donneur d’électrons de ce centre actif, donc renforcé la liaison de covalence entre atome donneur et atome métallique. Les principaux centres actifs sont les atomes N, S, P, O. La liaison est générée en présence de composés organiques insaturés, à double ou triple liaison, porteurs d’électrons capables de créer des liaisons avec des atomes métalliques. Une fois réalisée, elle ne sera pas différente de la liaison covalente.
I.9.3 Pouvoir protecteur des films formés
Quel que soit le type de mécanisme par lequel agit l’inhibiteur, le pouvoir protecteur de ce dernier caractérise le ralentissement de la corrosion, c’est à-dire la diminution du courant de corrosion (ou de la vitesse de corrosion). Le pouvoir protecteur d’un inhibiteur s’exprime par l’équation 2 :
21
icorr et icorr(inh) représentent respectivement les courants de corrosion en l’absence et en
présence d’inhibiteur. Il est possible d’accéder aux valeurs des courants de corrosion de manière expérimentale, plus précisément en se basant sur des dispositifs relevant d’études électrochimiques et structure moléculaire des inhibiteurs
Pour inhiber l’action de certains milieux à teneurs élevées en éléments agressifs, des ajouts d’inhibiteurs de corrosion, tel que l’argile à base d’aluminium et de silice ont été réalisé .Ceci a permis d’augmenter la durée de vie des équipements et en particulier dans l’industrie phosphoriques .
I.9.4 Structure moléculaire des inhibiteurs
Parmi les inhibiteurs pour les solutions acides, on trouve un grand nombre de substances organiques différentes, notamment des molécules aromatiques et des macromolécules à chaînes linéaires ou branchées [51,52]. Ils s'adsorbent sur les sites actifs de la surface métallique, sans altérer le mécanisme des réactions électrochimiques partielles. Ils bloquent les sites et réduisent la vitesse de la corrosion cathodique, anodique ou mixte en relation avec le pourcentage des sites actifs recouverts par l'inhibiteur. Leur efficacité dépend, entre autre, de leur structure moléculaire et de leur concentration.
Les molécules organiques utilisées comme inhibiteurs, contiennent une partie non polaire, hydrophobe et relativement volumineuse, constituée principalement d'atomes de carbone et d'hydrogène, et une partie polaire, hydrophile, constituée d'un ou plusieurs groupes fonctionnels, tels que -NH2 (amine), -SH (mercapto), -OH (hydroxyle), (phosphonate)...
La molécule se lie à la surface par son groupe fonctionnel, alors que sa partie non polaire, plus volumineuse, bloque partiellement la surface active (figure I.5).
Notons que les chélates peuvent être formés à la surface du métal lorsque le composé organique contient plus d'un groupement fonctionnel, pouvant chacun former des liaisons avec les atomes du métal [53].
Parmi les autres paramètres structuraux pouvant influencer l'efficacité des inhibiteurs, on peut citer:
- L'aire moléculaire de l'inhibiteur projetée sur la surface métallique. Cette projection dépend des différentes possibilités d'arrangement des ions organiques ou des molécules à l'interface métal/solution [54].
- L'influence exercée par le poids moléculaire [55]. - L'importance de la configuration moléculaire [56].