QjLieLcfrueé
c&nâeiU
aux Jeunes Professeurs de Sciences
Lorsqu'on demande à un jeune professeur deformation scientifique et mathématique s'il optera pour l'enseignement des sciences, sa réponse est trop souvent négative.
La raison de son choix est assez facile à discer-ner. Dans nos écoles techniques où le professeur n'est assisté d'aucun garçon de laboratoire, un enseignement exclusivement scientifique demande une préparation qui prend un temps considérable. Le montage des appareils d'une part, le nettoyage et la remise en place du matériel utilisé d'autre part peuvent absorber, à eux seuls, tous les loisirs que l'enseignement doit laisser au jeune maître pour parfaire sa culture, et ceux mêmes que, légitime-ment, il est en droit de réserver à la satisfaction de ses obligations humaines, sociales et familiales. Telle semble bien la raison de cette désaffection à l'égard des sciences expérimentales de la p a r t de jeunes gens qui, par ailleurs, ne manquent pas de dextérité.
Cet argument, dont on ne peut contester entiè-rement le bien fondé, ne laisse cependant pas d'être
Figure 1.
V / 7 / / 7 7 7 7 7
Il faut quatre appareils complètement équipés
( H2, C O2, CL, ...)
spécieux. Il tombe en partie de lui-même si le jeune professeur sait organiser méthodiquement son ensei-gnement et en particulier s'il aménage, dès le début
de sa carrière, un certain nombre d'appareils et de
dispositifs simples rationnellement établis,
soigneu-sement rangés, toujours en état, dont la mise en place est si rapide qu'elle réduit à un temps très court la durée des préparations.
Je sais bien qu'après quelques années de pra-tique mes collègues professeurs de physique et chimie réussissent à simplifier leur travail sans nuire pour autant à la qualité de leur enseignement. C'est donc aux jeunes que je m'adresse pour les guider, leur éviter les tâtonnements du début... et peut-être les garder de cette bouderie à l'égard de l'enseignement des sciences dont je parlais tout à l'heure.
Dans cette pensée, je crois intéressant de pré-senter quelques dispositifs permanents permettant la réalisation des expériences les plus importantes du cours de chimie. J'indiquerai, au passage, les précautions à prendre dans certaines manipulations. Je ne m'étendrai pas sur les appareils continus classiques, connus de tous, souvent t r è s chers (appa-reil de Kipp à 4 ou 5.000 francs par exemple).
TT7TT7
Figure 2 . — Générateur de vapeur. T o u s les tubes sont réglés à la hauteur a pour un montage aisé
Je signale simplement qu'il faut toujours avoir, montés et prêts,, les appareils à préparation de chlore (au chlorure de chaux), d'hydrogène, d'anhy-dride carbonique, d'oxygène (fig. 1). Ajoutons un générateur de vapeur d'eau (fig. 2). Voici, enfin, un autre appareil utile.
I. — LE GAZOMETRE (fig. 3) •i Ouur Ox\j^èn-e ... s ;, s ;,
fi
Figure 3C'est un flacon de huit litres environ muni, de préférence, d'une tubulure inférieure. Il sert de réservoir à gaz et d'aspirateur. La figure 3 le représente monté.
a) Expérience sur l'oxygène.
La préparation en grand, devant les élèves, de l'oxygène par l'oxylithe (produit cher) par le chlorate de potassium, par le chlorure de chaux (préparation excellente), outre qu'elle absorbe l'attention du professeur, lui demande un certain temps pris sur le cours. Quand on n'a pas la bonne fortune de posséder un tube à oxygène sous pression, le gazomètre est commode pour emmagasiner ce gaz. Le poste de soudure à l'arc de l'école en effectue le remplissage par déplacement de l'air. Avec des bouchons de caoutchouc, l'oxygène s'y conserve longtemps (ne pas oublier de s'assurer de la qualité du caoutchouc des raccords). On recueille le gaz par envoi d'eau sous pression dans le vase. Le réglage du débit est très facile.
b) Oxydation de l'ammoniac.
Elle conduit à la synthèse de l'acide nitrique (procédé Ostwald). Le gazomètre envoie l'air (ou l'oxygène) et l'ammoniac sur un tube à mousse de platine (1) (fig. 4). On conservera ce tube préparé.
Figure 4
( I ) L e tube catalyseur est représenté à plus grande échelle que le reste du montage.
50
On évite une perte du produit cher... et une perte de temps. Ce tube, fermé par deux tétines de caout-chouc, doit être soigneusement rangé. Chauffage léger. Solution ammoniacale du commerce diluée à
10 %.
c) Préparation du gaz à l'air (gaz de gazogène). L'appareil est utilisé comme aspirateur. Préala-blement rempli d'eau, il est vidé dans un cristal-lisoir plein d'eau, ce qui évite les rentrées — peu probables, d'ailleurs — d'air (fig. 5).
. CLOpi r^ LLO n_
Figure 5
L'air aspiré passe sur du charbon au rouge. Le gaz emmagasiné est ensuite recueilli comme le fut, tout à l'heure, l'oxygène.
II. — EXPERIENCE A HAUTE TEMPERATURE a) Réduction de l'eau.
Paire couper plusieurs tubes en acier (tubes de chauffage central, par exemple), de 2 à 3 cm de diamètre et de 55 à 60 cm de longueur.
Le premier tube sera rempli de fer — utiliser les copeaux fins, de la paille de fer ou, mieux
- E z r
C , Fer ou Houille
Figure 6
touriV-iol encore, la brosse de fer tissé utilisé pour l'entretien des parquets (fig. 6). Il servira à réduire l'eau et donnera une préparation industrielle de l'hydrogène (Messerschmidt). Dans le second, on tas-sera du charbon de bois. Il fournira, par réduction de l'eau, du gaz à l'eau.
Ces tubes peuvent servir plusieurs années sans re-charge en fournissant quelques litres de gaz à chaque opération. On s'évite même le remplacement du fer du premier tube en le régénérant, par
réduc-lion rapids à l'aide du gaz de ville, de l'oxyde chauffé à 700 ou 800".
La fermeture de ces tubes doit être parfaite. Elle est assurée par des bouchons de caoutchouc
synthétique, plus résistants à la chaleur. Les tubes,
intentionnellement longs, peuvent être refroidis par un. chiffon humecté d'eau. Très robustes, ils sont préférables à tous autres, en particulier à ceux de porcelaine que brise la moindre condensation de vapeur d'eau. Les bouchons de liège joignent mal. La plus petite fuite permet l'effusion de l'hydrogène. Dans ce cas, la réduction de l'eau par le fer se solde par un échec : il n'y a aucun dégagement. b) Gaz à l'air.
Un troisième tube rempli de charbon, dont une extrémité est à l'air libre, permet, par aspiration d'air (§ I - c), de préparer le gaz de gazogène. Un tube de 5 cm de diamètre, de 40 cm de longueur, serait préférable (fig. 7), mais le bouchage en est
F i g u r e 7
plus difficile. L'allumage du charbon peut alors se faire par aspiration d'air à la trompe à eau. c) Gaz d'éclairage.
Un quatrième tube, garni de houille grasse à longue flamme (une houille maréchale suffit sou-vent), permet de préparer le gaz d'éclairage (fig. 8).
L'installation : barillet (1), épurateur
mécani-que (2) (formé d'un flacon rempli de paille de fer
tassée, dont l'efficacité est, en l'occurrence, plus théorique que réelle), la cuve à ammoniaque (3) (la réaction basique est manifeste), Pépurateur
chi-mique (4) (mélange de Lamming) , peut être
conservée d'une année à l'autre.
Tous ces tubes sont chauffés par un four muni d'une rampe à gaz à brûleurs ou un four électrique ouvert aux deux extrémités.
III. REDUCTION D'OXYDES
a) Exemple : Réduction de l'oxyde de cuivre.
Avoir quelques tubes à dégagement munis de
leur bouchon, toujours prêts à être utilisés, aux
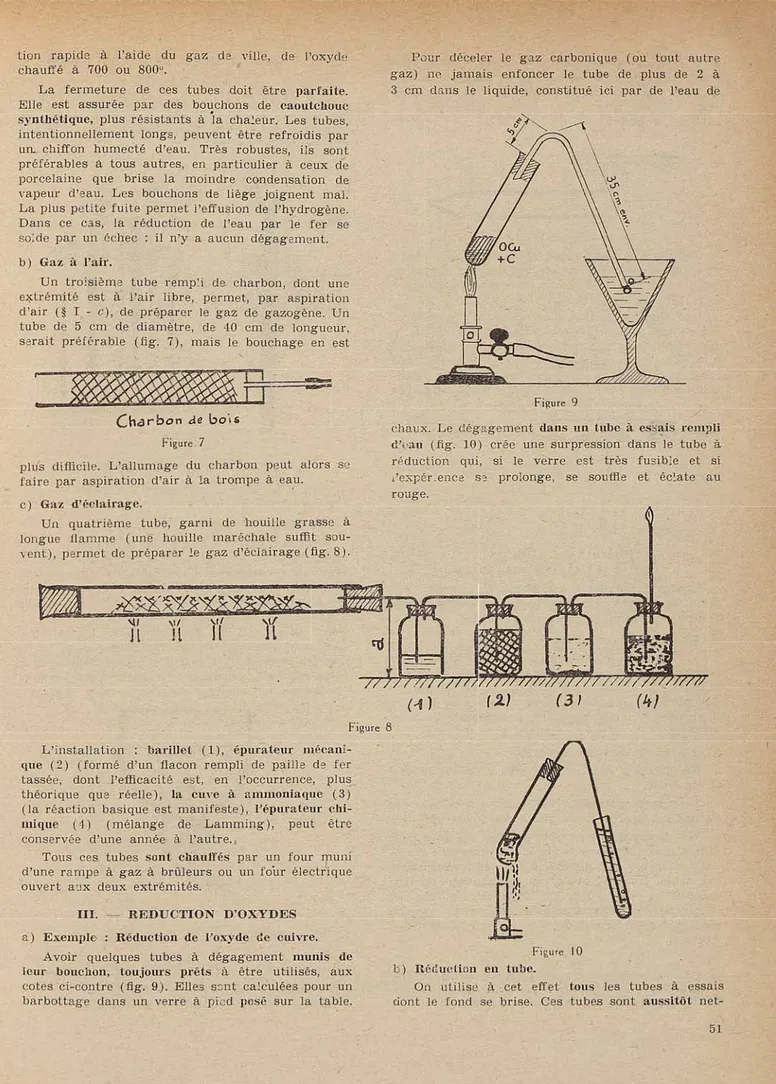
cotes ci-contre (fig. 9). Elles sont calculées pour un barbottage dans un verre à pied posé sur la table.
Pour déceler le gaz carbonique (ou tout autre gaz) ne jamais enfoncer le tube de plus de 2 à 3 cm dans le liquide, constitué ici par de l'eau de
chaux. Le dégagement dans un tube à essais rempli
d'oau (fig. 10) crée une surpression dans le tube à
réduction qui, si le verre est très fusible et si l'expér.en-ce ss prolonge, se souffle et éclate au rouge.
uj
(3i
(ki
Figure 10 b) Réduction en tube.
On utilise à . cet effet tous les tubes à essais dont le fond se brise. Ces tubes sont aussitôt
net-toyés, étirés, mis en réserve. Quatre à cinq bou-chons de caoutchouc toujours prêts, munis d'un tube
de verre (aux extrémités bordées) et d'un raccord
(fig. 11) permettent de monter l'expérience en quelques secondes.
V///))H N
i
vjum*
Figure 1 1
Signalons que les tubes ébréchés dans le h a u t sont conservés pour les expériences sur le soufre (sulfuration du fer, du cuivre). Ils sont brisés" après ces expériences, pour l'examen du produit formé.
Une variante de l'accident classique signalé pré-cédemment peut se produire dans ces tubes. On y pare aisément si la vapeur d'eau ou tout autre gaz f u s e à la sortie en brisant le bec trop effilé du tube. Une légère surpression (quelque dix
centi-mètres d'eau) ouvre les tubes au rouge (fig. 12).
IV. — FLACONS LAVEURS
Quatre flacons laveurs suffisent. Deux sont vides, prêts à recevoir une solution quelconque. Deux autres, sont remplis. Ce sont :
a) Un flacon laveur à soude.
Y introduire la soude de l'oxylithe utilisée pour les petites préparations d'oxygène. Les flacons à soude à bouchon de verre rodé (à rejeter parce que non réglables) se cimentent au col. Je suis parvenu à éviter cet inconvénient en paraffinant bouchons et robinets de verre en contact avec la soude.
b) Un flacon à acide sulfurique.
Le flacon à bouchon de verre rodé est le seul à conseiller.
Le nom du produit utilisé, marqu é à la base des flacons, est aperçu distinctement par toute la classe. Les tubes de sortie sont réglés une fois pour toutes à une hauteur a (1) qui permet une intro-duction rapide de l'appareil dans tous les montages
sur table. Ils sont munis en permanence de leur raccord en caoutchouc. On adjoindra, si cela est
nécessaire, au flacon à acide sulfurique, un support rigoureusement calculé qui élèvera ses tubes à bonne hauteur.
( 1 ) Cette hauteur peut être choisie en fonction des cotes du four de chauffage que I on possède. Il faut éviter, autant que pos-sible, les appareils sur support dans une installation.
V. — EXPERIENCE DE DISSOLUTION
DE CLH ou NH:1
Ces expériences sont classiques' (fig. 13). Elles se réalisent en une minute si on a pris soin de conserver, toujours munis de leur bouchon, les tubes représentés ci-contre.
Figure 13
VI. — ELECTROLYSE
Une expérience d'électrolyse ne donne pas tou-jours les résultats escomptés.
a) Electrolyse de l'eau.
Le voltamètre à électrodes de platine (eau acidulée) est le meilleur... quand il ne f u i t pas. Ce d é f a u t le rend souvent inutilisable ; d'autres ennuis proviennent du lut utilisé : il f a u t en construire un soi-même. Rejeter les électrodes de charbon ; l'anode s'oxyde... et donne un gaz inflammable (CO) ! Deux tiges de nickel de 4 à 5 m m de diamètre, dont une extrémité filetée est munie d'un écrou, introduites dans un bouchon de caoutchouc à deux trous, donnent satisfaction avec la sonde comme électrolyte. Le vase est un flacon coupé (fig. 14).
b) Electrolyse du chlorure de sodium.
L'électrolyse de Cl Na fondu est difficilement réalisable. Celle de Cl Na dissous est satisfaisante avec l'appareil représenté ci-dessous (fig. 15). Elle permet de recueillir le chlore et l'hydrogène ou de 52
fabriquer (sans diaphragme) de l'eau de Javel. Attention alors au mélange CI, +.' H., qui f u t la cause, dans l'industrie, de terribles catastrophes ! Opérer une électrolyse modérée, à l'ombre, avec un diaphragme raccourci, isolant le chlore dégagé de l'hydrogène.
Les tubes en U parfois emplo3'és sont trop sou-vent d'une fragilité décevante.
VII.
Figure 15
LES ACCIDENTS CLASSIQUES
Méfiez-vous toujours de l'hydrogène ! (...et de l'acétylène). Voici deux accidents que leur inexpé-rience a valus à des chimistes néophytes :
a) Essai d'un appareil à hydrogène.
Le jeune professeur hésite quelque peu lorsqu'il s'agit d'enflammer l'hydrogène à l'extrémité du tube à dégagement. Il s'assure consciencieusement de la purge totale d'air en recueillant le gaz dans une éprouvette qu'il soumet à l'épreuve de la flamme. Une explosion — même faible — se pro-duit-elle ? Il doit retourner l'éprouvette, l'ouverture vers le h a u t et attendre un instant avant de recommencer l'essai. Il m'est arrivé de voir sauter un appareil qui avait été enflammé prématurément par l'hydrogène continuant — après une légère explosion — sa combustion dans le fond de l'éprouvette.
b) Réduction de l'eau par le sodium.
Lorsqu'on veut recueillir l'hydrogène pour le brûler ensuite, je conseille l'appareil simple repré-senté ci-contre (fig. 16). Il se prépare une fois pour toutes, je dirai même pour toute une carrière de professeur ! Mais il f a u t avoir bien soin, avant
d'introduire le sodium fixé à la pointe d'un couteau, de purger totalement l'entonnoir d'air (par immer-sion complète ou aspiration de l'eau par le tube à dégagement). Cette omission psut coûter pour le moins la vie... à l'entonnoir et au cristallisoir.
eau Co\oree
<3v t o u r n e s o l
Z T T T T T T T T T T T ^
Figure 1 6
VIII. - - CONCLUSION
J'ai insisté tout au long de cet exposé sur l'im-portance du tube, du flacon... toujours prêts à être utilisés. De nombreux collègues n'ayant pu préparer à temps une expérience hésitent à faire, au détri-ment de leur cours, la mise en place de leurs appareils. D'autres abandonnent une expérience plutôt que de perdre les précieuses minutes que demande une réparation immédiate du dispositif. Ces ennuis disparaissent, en général, si l'on s'est confectionné une riche collection de tubes préparés aux dimensions voulues et montés sur bouchons. Il est facile d'avoir des flacons, des ballons, des tubes aux diamètres d'ouverture peu variables. Les appa-reils se montent alors, au pied levé, aussi vite qu'on les décrit. Pour terminer, je conseillerai comme tube à dégagement, non pas le tube d'une pièce que sa rigidité rend peu maniable, mais un dispo-sitif souple, formé d'un tube de caoutchouc (de 6 mm) terminé par une extrémité en tube de verre recourbé (fig. 3).
Je n'ai pas eu, en donnant ces quelques conseils, la prétention d'épuiser le sujet, mais il m'a semblé qu'en montrant les gains de temps qu'un peu de méthode aide à réaliser, on pourrait peut-être contribuer à lever une hypothèque qui pèse injus-tement sur l'enseignement des sciences.
R. ROUILLON,.