THESE
UNIVERSITE PAUL SABATIER - TOULOUSE III En vue de l’obtention du grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Spécialité : CHIMIE MACROMOLECULAIRE ET SUPRAMOLECULAIRE
par
Elodie SOUSSAN
Ingénieur ESCOM
CONCEPTION DE VESICULES CATANIONIQUES
DERIVEES DE SUCRE ET ETUDE DE LEUR
MECANISME DE DELIVRANCE DE PRINCIPES ACTIFS
Soutenue le 18 septembre 2007 devant la commission d’examen
M. S. Perez, Directeur de recherche CERMAV, Grenoble Rapporteur M. T. Zemb, Directeur de recherche ICSM, Montpellier Rapporteur Mme M. P. Rols, Directeur de recherche IPBS, Toulouse Examinateur M. P. Barthelemy, Professeur à l’Université V. Segalen, Bordeaux Examinateur M. A. Lattes, Professeur Emérite à l’Université P. Sabatier, Toulouse Examinateur Mme I. Rico-Lattes, Directeur de recherche IMRCP, Toulouse Directeur de thèse Mme V. Cabuil Professeur à l’Université P. et M. Curie, Paris Invitée M. A. Mavon Responsable de laboratoire (Pierre Fabre Dermo-cosmétiques) Invité
Laboratoire des Interactions Moléculaires et Réactivité Chimique et Photochimique, UMR 5623 Université Paul Sabatier, 118 route de Narbonne, 31062 Toulouse Cedex 04
Remerciements
Ces travaux de recherches ont été réalisés au laboratoire des Interactions Moléculaires et Réactivité Chimique et Photochimique dirigé successivement par Isabelle Rico-Lattes et Monique Mauzac. Merci de m’avoir reçue au sein du laboratoire durant ces trois années de thèse.
Ces travaux ont été encadrés par Isabelle Rico-Lattes, que je souhaite remercier très chaleureusement pour m’avoir accueillie au sein de son équipe ainsi que pour m’avoir donné sa confiance et son appui pour la réalisation de ces travaux. Merci Isabelle, pour votre dynamisme et vos compétences scientifiques qui m’ont permis de mener à bien ces études.
J’exprime toute ma gratitude à Muriel Blanzat, pour tout le temps qu’elle m’a accordé, ainsi que pour l’aide et les conseils qu’elle m’a prodigué. Soit assurée, Muriel, de tout mon respect et toute mon amitié.
J’exprime toute ma reconnaissance à Armand Lattes, pour avoir présidé admirablement le jury de cette thèse ainsi que pour sa bonne humeur de tous les jours.
Je tiens à remercier Messieurs Serge Perez (Directeur de recherche au Centre de Recherche sur les Macromolécules Végétales) et Thomas Zemb (Professeur INSTN à l’Institut de Chimie Séparative de Marcoule) pour avoir accepté de juger ce travail en tant que rapporteurs.
Mes remerciements s’adressent aussi à Madame Marie-Pierre Rols (Directrice de recherche à L’institut de Pharmacologie et Biologie Structurale), ainsi qu’à Messieurs Philippe Barthélémy (Professeur à l’INSERM, Bordeaux 2) et Alain Mavon (Responsable du service pharmacocinétique cutanée au sein des laboratoires Pierre Fabre Dermo-Cosmétiques) pour avoir participé à ce jury de thèse.
Je tiens à remercier également Madame Valérie Cabuil (Professeur au laboratoire des Liquides Ioniques et Interfaces Chargées) pour avoir accepté de faire parti de ce jury ainsi que pour m’avoir accueillie au sein de son laboratoire dans le cadre d’une collaboration. Merci également à toute son équipe.
Je tiens à remercier Pascal Bordat, pour avoir accepté de financer ces travaux de recherches ainsi que pour la collaboration fructueuse mise en place avec les laboratoires Pierre Fabre.
Toujours dans le cadre des collaborations qui m’ont permis de mener à bien ces travaux de recherche, je tiens à remercier Madame Reiko Oda (Institut Européen de Chimie et de Biologie, Pessac), Monsieur Bruno Peyre et Madame Florence Tortosa (service de neurologie du CHU Rangueil, INSERM U858, Toulouse) ainsi que Monsieur Christian Amatore (laboratoire PASTEUR à l’ENS Ulm, Paris) et toute son équipe.
J’exprime aussi ma reconnaissance à toute l’équipe : Emile Pérez, Stéphanie Cassel et Sophie Franceschi ainsi qu’aux nombreux étudiants que j’ai pu rencontrer : Marlénouse, Kouky, Kamalou, Clem, Romain, Sabrina, Cristina, Plamen, Cécile, Rolland, Denis, Hugo, K-ro… De part leur attention et l’ambiance sympathique qu’ils ont su créer, ils ont largement contribué au bon déroulement de ces travaux de recherche.
Je remercie également toutes les personnes qui m’ont aidé dans mes recherches, pour leur disponibilité ainsi que pour leur grande gentillesse (Florence, Fernanda, Josiane, Jean-Christophe, Richard… ainsi que Christiane Vidal et Maurice Comtat).
Enfin, merci à Floc et John, mes « voipins » pour la relecture finale de cette thèse… ainsi qu’à mes amis et ma famille pour leur soutien durant ces trois années de thèse.
Liste des abréviations
ADE : Area Difference Elasticity
ADN : Acide DeoxyriboNucleique
BiBola : Tensioactif catanionique dérivé de bolaformes
C : Concentration
CAC : Concentration d’Agrégation Critique
CMC : Concentration Micellaire Critique
CTAB : Bromure de céthyltriméthylammonium
CTAHNC : Céthyltryméthylammonium hydroxynaphtalènecarboxylate
CTAOH : Hydroxyle de céthyltriméthylammonium
CVFF : Consistent Valence Force Field (champ de force)
DLS : Diffusion quasi-élastique de la lumière
DOPC : 1,2-Dioleoyl-sn-glycero-3-phosphocholine
FluoCat : Tensioactif catanionique fluorescent
ENS : Ecole Normale Supérieure
FT-IR : Infra-Rouge à Transformée de Fourrier
GUV : Vésicule Unilamellaire Géante
HA : Hémagglutinine
LCC : Laboratoire de Chimie de Coordination
LI2C : Laboratoire des Liquides Ioniques et Interfaces Chargées
m : Masse
MET : Microscopie Electronique à Transmission
NSL : Nanoparticules Solides de Lipides
PAMAM : Polyamidoamide
PBD : Poly(butadiène)
PEG : Polyéthylène glycol
PEO : Oxyde de polyéthylène
PLA : Poly(acide lactique)
PNIPAAm : Poly(N-isopropylacrylamide)
TriCat : Tensioactif catanionique tricaténaire
UV : Ultraviolet
Introduction générale________________________________________________________ 1
CHAPITRE I : Mise au point bibliographique sur la vectorisation
I Introduction ______________________________________________________________ 7 II Les systèmes matriciels_____________________________________________________ 8
II.1 Les micelles________________________________________________________________ 8
II.1.1 Structure et propriétés ____________________________________________________________ 8 II.1.2 Utilisation en vectorisation ________________________________________________________ 9
II.2 Les émulsions _____________________________________________________________ 11
II.2.1 Structure et propriétés ___________________________________________________________ 11 II.2.2 Utilisation en vectorisation _______________________________________________________ 12
II.3 Les dendrimères ___________________________________________________________ 13
II.3.1 Structure et propriétés ___________________________________________________________ 13 II.3.2 Utilisation en vectorisation _______________________________________________________ 15
II.4 Les hydrogels _____________________________________________________________ 16
II.4.1 Structure et propriétés ___________________________________________________________ 16 II.4.2 Utilisation en vectorisation _______________________________________________________ 17
II.5 Les nanosphères ___________________________________________________________ 20
II.5.1 Structure et propriétés ___________________________________________________________ 20 II.5.2 Utilisation en vectorisation _______________________________________________________ 20
II.6 Les nanoparticules solides formées de lipides (NSL) _____________________________ 22
II.6.1 Structure et propriétés ___________________________________________________________ 22 II.6.2 Utilisation en vectorisation _______________________________________________________ 22
III Les vésicules ___________________________________________________________ 24
III.1 Les nanocapsules et les polymersomes ________________________________________ 24
III.1.1 Structure et propriétés___________________________________________________________ 24 III.1.2 Utilisation en vectorisation _______________________________________________________ 25
III.2 Les liposomes ____________________________________________________________ 27
III.2.1 Structure et propriétés___________________________________________________________ 27 III.2.2 Utilisation en vectorisation _______________________________________________________ 28
III.3 Les niosomes _____________________________________________________________ 30
III.4 Les vésicules catanioniques _________________________________________________ 32
III.4.1 Structure et propriétés___________________________________________________________ 32 III.4.2 Pourquoi envisager ces systèmes dans le domaine de la vectorisation ? ____________________ 35
IV Conclusion_____________________________________________________________ 38 V Références bibliographiques _______________________________________________ 40
CHAPITRE II : Design, synthèse et propriétés d'auto-agrégation de tensioactifs catanioniques
I Introduction _____________________________________________________________ 47 II Conception, synthèse et propriétés d’agrégation d’un tensioactif catanionique
tricaténaire _______________________________________________________________ 48
II.1 Conception _______________________________________________________________ 48 II.2 Synthèse et caractérisation du N-hexadecylammonium-1-deoxylactitol
bis-(α-hydroxydodecyl)phosphinate ____________________________________________________ 49 II.3 Modélisation Moléculaire du tensioactif _______________________________________ 52 II.4 Etude des propriétés d’auto-agrégation du TriCat ______________________________ 55
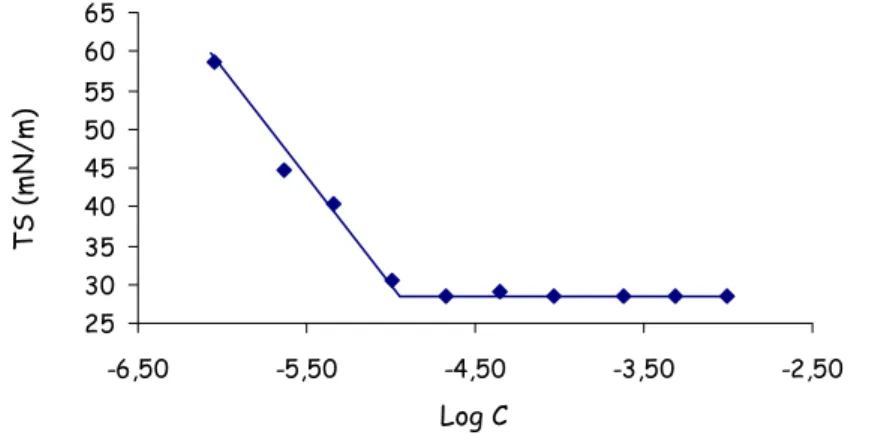
II.4.1 Détermination de la concentration d’agrégation critique _________________________________ 56 II.4.2 Détermination de la géométrie et de la taille des agrégats supramoléculaires _________________ 57 II.4.3 Etude de la stabilité des vésicules formées par le TriCat _________________________________ 59
III Conception, synthèse et propriétés d’agrégation de tensioactifs catanioniques
bolaformes _______________________________________________________________ 62
III.1 Conception ______________________________________________________________ 62 III.2 Synthèse et caractérisation des BiBola ________________________________________ 63 III.3 Modélisation Moléculaire __________________________________________________ 64 III.4 Etude des propriétés d’auto-agrégation des BiBola _____________________________ 66
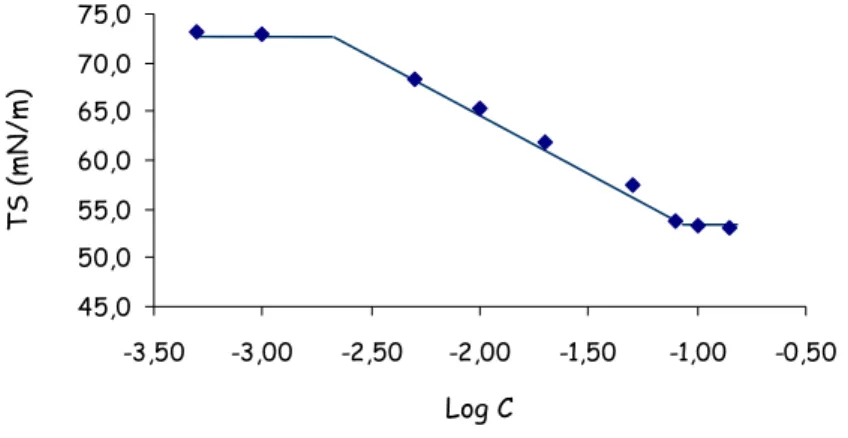
III.4.1 Détermination de la concentration d’agrégation critique ________________________________ 67 III.4.2 Détermination de la géométrie et de la taille des agrégats supramoléculaires ________________ 68
IV Conclusion_____________________________________________________________ 70 V Références bibliographiques _______________________________________________ 71
CHAPITRE III : Etude de l'interaction entre les vésicules catanioniques et des modèles de membranes cellulaires
I Introduction _____________________________________________________________ 75 II Interaction entre les magnétoliposomes et les vésicules catanioniques______________ 77
II.1 Les systèmes étudiés________________________________________________________ 77
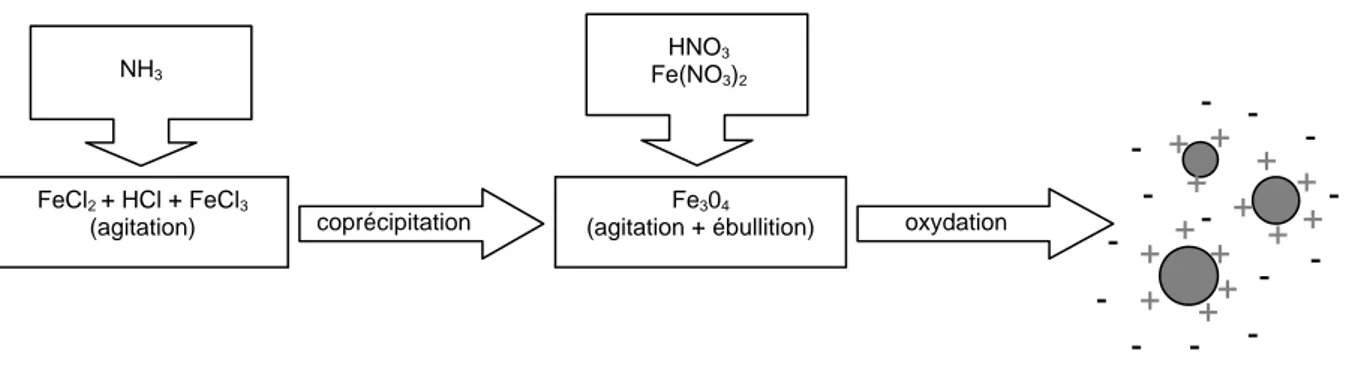
II.1.1 Les ferrofluides ________________________________________________________________ 77 II.1.2 Les particules de maghémite citratées _______________________________________________ 78 II.1.3 Les magnétoliposomes___________________________________________________________ 80
II.2 Etude de l’interaction entre les vésicules catanioniques et les magnétoliposomes _____ 81
II.2.1 Etudes préliminaires_____________________________________________________________ 82 II.2.2 Observation par microscopie optique de l’interaction vésicules catanioniques/magnétoliposomes 84 II.2.3 Etude des caractéristiques membranaires des magnétoliposomes sous champ magnétique ______ 87 II.2.4 Détermination du mécanisme d’interaction entre les liposomes et les vésicules catanioniques ___ 93
III Mesure de la capacité d’un patch de membrane en présence de vésicules catanioniques _________________________________________________________________________ 99
III.1 Les systèmes étudies _______________________________________________________ 99
III.1.1 Le patch clamp ________________________________________________________________ 99 III.1.2 La capacité membranaire _______________________________________________________ 101
III.2 Mesure de la capacité membranaire_________________________________________ 102
III.2.1 Mesure de la capacité membranaire à blanc _________________________________________ 102 III.2.2 Mesure de la capacité membranaire en présence de vésicules catanioniques________________ 104
IV Conclusion____________________________________________________________ 107 V Références bibliographiques ______________________________________________ 109
CHAPITRE IV : Evaluation de l'efficacité de délivrance de principes actifs hydrophiles et lipophiles par les vésicules catanioniques
I Introduction ____________________________________________________________ 113 II Evaluation de la délivrance d’une molécule hydrophile au sein des cellules par les
vésicules catanioniques ____________________________________________________ 115
II.1 Encapsulation d’un marqueur hydrophile ____________________________________ 115
II.1.1 Choix de la molécule sonde ______________________________________________________ 115 II.1.2 Efficacité d’encapsulation par les vésicules catanioniques dans l’eau et en milieu tampon _____ 117
II.1.4 Isolement des vésicules contenant de l’arbutine ______________________________________ 121
II.2 Délivrance des molécules encapsulées par les vésicules catanioniques ______________ 123
II.2.1 Vérification de la détection du relargage de molécules intravésiculaires ___________________ 124 II.2.2 Vérification de la détection de l’arbutine____________________________________________ 127 II.2.3 Etude ampérométrique du relargage de l’arbutine _____________________________________ 128
III Evaluation de la délivrance d’une molécule lipophile au sein des cellules par les
vésicules catanioniques ____________________________________________________ 132
III.1 Synthèse et caractérisation d’un tensioactif catanionique fluorescent _____________ 132 III.2 Insertion du marqueur FluoCat au sein de la bicouche des vésicules catanioniques formées par le TriCat _________________________________________________________ 134 III.3 Mise en présence des vésicules catanioniques marquées avec des cellules et observation par microscopie confocale _____________________________________________________ 137
III.3.1 Principe de la microscopie confocale ______________________________________________ 137 III.3.2 Mise en contact des vésicules catanioniques marquées avec les cellules et observation par
microscopie confocale _______________________________________________________________ 139
IV Conclusion____________________________________________________________ 147 V Références bibliographiques ______________________________________________ 149 Conclusion générale_______________________________________________________ 153
Partie expérimentale
I Produits et techniques de caractérisation structurale utilisés _____________________ 159
I.1 Produits commerciaux _____________________________________________________ 159 I.2 Techniques de caractérisation structurale _____________________________________ 159
II Synthèse ______________________________________________________________ 161
II.1 Synthèse du tensioactif catanionique tricaténaire TriCat ________________________ 161 II.2 Synthèse des tensioactifs catanioniques bolaformes BiBola_______________________ 161
II.2.1 Synthèse du bolaamhiphile ______________________________________________________ 161 II.2.2 Synthèse des associations catanioniques ____________________________________________ 162
II.3 Synthèse du tensioactif catanionique FluoCat__________________________________ 163
III.1 Détermination de la concentration d’agrégation critique________________________ 164 III.2 Evaluation de la distribution de tailles des agrégats ____________________________ 164 III.3 Observation de la morphologie des agrégats __________________________________ 165 III.4 Détermination de l’efficacité d’encapsulation _________________________________ 166 III.5 Isolement des agrégats ____________________________________________________ 167
IV Etude des vésicules catanioniques en interaction avec les magnétoliposomes_______ 169
IV.1 Synthèse du ferrofluide citraté _____________________________________________ 169 IV.2 Préparation des GUV magnétiques__________________________________________ 170 IV.3 Cellules d’observation en microscopie optique ________________________________ 170 IV.4 Montage sous microscope et observation _____________________________________ 172
V Etude des vésicules catanioniques en interaction avec les patchs de membrane de cellules chromaffines_____________________________________________________________ 174
V.1 Préparation des cellules chromaffines ________________________________________ 174 V.2 Méthode du patch clamp ___________________________________________________ 174 V.3 Mesure de capacité membranaire____________________________________________ 175 V.4 Voltamétrie cyclique ______________________________________________________ 175 V.5 Ampérométrie à potentiel constant __________________________________________ 176
VI Etude des vésicules catanioniques en interaction avec les cellules chromaffines par microscopie confocale _____________________________________________________ 177
VI.1 Préparation des cellules chromaffines _______________________________________ 177 VI.2 Analyse spectrophotométrique _____________________________________________ 177 VI.3 Microscopie confocale ____________________________________________________ 178
Introduction générale
De nos jours, une part grandissante des activités en biotechnologie est consacrée à l'innovation thérapeutique. Malgré l’efficacité prouvée de certains principes actifs in vitro, des contraintes sont rencontrées lors de la mise en place d’une application in vivo. En effet, en milieu biologique, une concentration optimale en molécules actives doit être délivrée sur le site d’action désiré pour que la thérapie soit bénéfique au patient. Une concentration trop faible en substances actives, due généralement à leur dégradation ou à leur biodisponibilité insuffisante ne permet pas d’atteindre l’efficacité espérée pour le traitement. Au contraire, une concentration trop élevée, ou une accumulation de principes actifs dans les tissus sains peut rendre la thérapie toxique, ce qui conduit à l’arrêt du traitement malgré l’efficacité des molécules sur les tissus malades.
La vectorisation de principes actifs est par conséquent devenue un aspect essentiel dans le domaine thérapeutique. La pharmacie galénique moderne développe donc des systèmes d'administration susceptibles de promouvoir le passage transmembranaire et/ou intracellulaire vers la cible souhaitée tout en protégeant le principe actif de la dégradation par les enzymes.
De nombreux systèmes de délivrance de molécules actives, possédant des propriétés spécifiques avantageuses pour des applications dans le domaine de la vectorisation, ont été élaborés depuis une vingtaine d’années. Cependant, de nombreux problèmes limitent l’application de ces vecteurs, l’inconvénient majeur étant généralement la complexité des systèmes, nécessitant d’être systématiquement adaptés en fonction du principe actif à vectoriser et de la cible à atteindre. Ces systèmes sont donc difficiles à mettre en œuvre industriellement.
Le challenge de cette étude, menée dans le cadre d’une collaboration avec le centre de recherche Pierre Fabre Dermo-Cosmétique, a donc été de mettre au point un nouveau système de délivrance de principes actifs, simple à mettre en oeuvre et pouvant s’adapter aux différents principes actifs à vectoriser. Ces systèmes devraient donc permettre d’étendre le champ d’applications dans le domaine de la vectorisation.
Dans un premier chapitre, des rappels bibliographiques nous permettront de mieux cerner les différents modes de vectorisation, leurs avantages mais également leurs
inconvénients afin de répondre au mieux aux difficultés rencontrées dans le domaine de la délivrance de substances actives.
Nous verrons également, dans ce chapitre, que la famille des tensioactifs occupe une place privilégiée dans le domaine de la vectorisation grâce à leur grande variété de structure, modulable selon l’application souhaitée.
Pourtant, bien que la famille des tensioactifs catanioniques soit reconnue pour former spontanément des agrégats, et notamment des vésicules en solution aqueuse, ces systèmes n’ont pas été largement exploités dans le domaine de la vectorisation. Leurs propriétés d’auto-assemblage originales offrent donc une nouvelle perspective dans le domaine de la vectorisation. En effet, les tensioactifs catanioniques peuvent encapsuler des molécules hydrophiles au sein de la cavité aqueuse des vésicules formées. La bicouche hydrophobe de ces vecteurs offre quant à elle la possibilité de solubiliser des molécules lipophiles. Ce type de vecteur, formé spontanément, doit donc pouvoir conduire à des applications industrielles versatiles.
Selon cette approche, nous nous sommes focalisés, dans un second chapitre, sur la conception et la synthèse de tensioactifs catanioniques en mettant à profit cette aptitude à former spontanément des vésicules dans l’eau.
D’une part, afin que les tensioactifs utilisés soient biocompatibles, biodégradables et non-toxiques, nous avons choisi de nous intéresser aux tensioactifs catanioniques dérivés de sucre. De plus, une grande diversité chimique est accessible et la nature du sucre utilisé peut être modulée en fonction du site où le principe actif doit être délivré.
D’autre part, afin que les vésicules formées par ces tensioactifs catanioniques possèdent les propriétés requises pour vectoriser des composés, nous avons joué sur la géométrie et l’hydrophobie des associations catanioniques. En effet, ces paramètres permettent de contrôler la structure des agrégats formés ainsi que la stabilité du système.
Puis, une étude physico-chimique des paires d’ions en solution a été abordée afin de caractériser au mieux le comportement des vecteurs potentiels ainsi formés.
Le troisième chapitre a été consacré à l’étude du mécanisme impliqué lors de l’interaction entre ce nouveau type de vecteurs catanioniques et des modèles de membranes cellulaires. La connaissance du type de processus mis en jeu entre les vésicules catanioniques et les membranes cellulaires est en effet fondamentale pour, à terme, optimiser ces systèmes pour la vectorisation de principes actifs.
Dans une première partie, nous avons exploré, dans le cadre d’une collaboration avec le laboratoire LI2C (Paris 6) le type d’interaction mis en jeu entre les vésicules catanioniques et des magnétoliposomes géants, utilisés comme modèles de cellule.
Dans une seconde partie, nous avons étudié, dans le cadre d’une collaboration avec le laboratoire Pasteur à l’ENS Paris, le mécanisme impliqué entre les vésicules catanioniques et une fraction de membrane cellulaire en milieu tampon afin de se rapprocher au maximum des conditions d’utilisation des vésicules dans un environnement biologique.
L’étude du mécanisme d’interaction entre les vésicules catanioniques et les cellules a été poursuivie, lors d’un quatrième chapitre, en se focalisant sur le devenir du cœur aqueux et de la bicouche des vésicules après interaction avec la membrane cellulaire afin d’envisager tous les modes de vectorisation possibles et de confirmer ainsi les propriétés de transport versatiles des systèmes catanioniques.
Tout d’abord, la délivrance au travers d’une fraction de membrane cellulaire, d’une sonde hydrophile encapsulée dans le cœur aqueux des vésicules catanioniques, a été évaluée par une technique ampérométrique mise en place dans le laboratoire Pasteur. Puis, nous nous sommes intéressés au devenir de la bicouche des vésicules, marquée par une sonde fluorescente et mise en contact avec des cellules, afin d’évaluer la possibilité de vectorisation de principes actifs hydrophobes insérés dans la membrane vésiculaire. Ce suivi a pu être réalisé par microscopie confocale dans le cadre d’une collaboration avec le laboratoire de thérapie cellulaire des douleurs chroniques (service de neurologie) à Toulouse.
Lors d’une dernière partie, nous présenterons une description des modes opératoires ainsi que les caractéristiques des produits décrits dans ce mémoire.
Chapitre I
Mise au point bibliographique sur la
vectorisation
I Introduction
La vectorisation, ou délivrance spécifique de principes actifs vers un organe, un tissu ou une cellule malade grâce à des transporteurs est un des défis majeurs de la recherche thérapeutique. En effet, de nombreux principes actifs présentent des caractéristiques physico-chimiques peu favorables au passage des barrières biologiques, qui séparent le site d’administration du site d’action. Certains médicaments se heurtent aussi à des barrières enzymatiques entraînant leur dégradation et métabolisation rapide. La distribution de ces molécules actives vers les zones cibles malades peut donc être déficiente. De plus, une accumulation de thérapeutiques dans les tissus sains peut entraîner une toxicité rédhibitoire, entraînant l’abandon du traitement malgré son efficacité.
Un des aspects les plus importants de la vectorisation réside donc dans l’efficacité thérapeutique et la sécurité du traitement par le contrôle de la concentration en principe actif libéré et sa délivrance spécifique vers le site d’action.
Le développement de vecteurs de principes actifs connaît un essor considérable depuis une vingtaine d’années. Cette partie bibliographique fait un état de l’art sur les avancées dans ce domaine. Nous avons choisi de présenter plus particulièrement deux grandes familles de vecteurs que sont les systèmes matriciels et les vésicules, ayant fait l’objet de nombreuses études. Soulignons que nous ne discuterons pas de l’interaction entre les vecteurs et les cellules, puisque le mécanisme n’est pas élucidé dans tous les cas.
Enfin, nous développerons le cas particulier de la délivrance de principes actifs par les vésicules formées de tensioactifs catanioniques afin de mieux situer l’apport de nos travaux dans ce contexte.
II Les systèmes matriciels
Les systèmes matriciels désignent ici des réseaux tridimensionnels formés par des polymères, des tensioactifs ou encore des dendrimères, et dans lesquels sont piégés les principes actifs. Cette partie est axée sur l’étude des micelles, des émulsions, des hydrogels, des dendrimères, des nanosphères ainsi que des particules solides de lipides.
II.1 Les micelles
II.1.1 Structure et propriétés
Les micelles sont des agrégats de molécules amphiphiles dont la tête hydrophile est au contact de l’eau tandis que les parties hydrophobes sont regroupées afin de minimiser leur contact avec l’eau (Figure 1). L’hydrophobie constitue donc la principale force motrice de l’auto-association des tensioactifs, qui forment des micelles lorsque leur concentration est supérieure à leur concentration micellaire critique (CMC). La taille moyenne de ces objets varie en général de 1 à 100 nm. Il est à noter que ces objets sont dynamiques puisque les tensioactifs s’échangent librement et très rapidement entre la structure micellaire et la solution aqueuse.
Figure 1 Représentation d'une micelle formée par des tensioactifs
Outre les tensioactifs, les copolymères blocs (possédant une partie hydrophile et une partie hydrophobe) ou encore les polymères triblocs (possédant deux parties hydrophiles et une partie hydrophobe ou une partie hydrophile et deux parties hydrophobes) peuvent également s’auto-assembler pour former des micelles polymériques (Figure 2).
Tête polaire du tensioactif Queue hydrophobe
Figure 2 Représentation d'une micelle formée par un copolymère block
Ces micelles polymériques possèdent un diamètre moyen variant d’un à une dizaine de nanomètres et sont quasi-monodisperses[1]. Comparés aux micelles formées de tensioactifs,
les micelles polymériques sont généralement plus stables et se forment à des CMC remarquablement inférieures à celles des tensioactifs. Ces objets sont également beaucoup moins dynamiques que les micelles formées de tensioactifs. Un des résultats étonnants, obtenus en séparant les polymères non micellisés (libres) des polymères formant les agrégats par chromatographie d’exclusion stérique, est que les micelles ne sont pas détruites même lorsque la concentration en polymère libre est au dessous de la CMC[2]. Les micelles polymériques offrent donc de nombreux avantages par rapport aux micelles formées de tensioactifs.
II.1.2 Utilisation en vectorisation
A la fin des années 60, les micelles ont suscité un intérêt grandissant dans le domaine de la vectorisation de principes actifs grâce au contrôle aisé de leurs propriétés ainsi que pour leurs caractéristiques pharmacologiques[3, 4].
La distribution anisotropique des molécules d’eau dans la structure de ces objets (la concentration en eau décroît de la surface des micelles à l’intérieur des agrégats d’où l’eau est exclue) permet de solubiliser de nombreux principes actifs hydrophobes[5] au sein de la micelle et de les rendre ainsi biodisponibles. Par ailleurs, les molécules actives sont protégées des enzymes pouvant entraîner leur dégradation et leur métabolisation en milieu biologique [6-8]. Selon la molécule à vectoriser, la taille, la charge ainsi que les propriétés de surface de ces
Partie hydrophile du copolymère
mélange d’amphiphiles formant les micelles (co-tensioactifs). De plus, les méthodes de préparation des micelles permettent d’en produire une grande quantité très facilement et de manière reproductible[9].
Les micelles polymériques sont plus fréquemment employées en vectorisation que les micelles à base de tensioactifs. En effet, la cinétique de dégradation lente des micelles polymériques a contribué à leur succès pour les applications en vectorisation, surtout dans le domaine de la délivrance de principes actifs anti-cancéreux hydrophobes (tel que le paclitaxel) vers les tumeurs.
De nombreuses études dans ce domaine ont été élaborées avec des micelles formées, pour la partie hydrophile, d’un polymère d’oxyde de polyéthylène (PEO), pour son taux d’hydratation important ainsi que pour l’importance des forces répulsives entre les chaînes, conduisant à des micelles de volume important et permettant ainsi leur stabilisation[9]. De
plus, les chaînes polymères de PEO préviennent la reconnaissance des micelles par le système réticuloendothélial et, par conséquent, minimisent l’élimination de ces vecteurs dans le sang. Les principes actifs peuvent donc être délivrés sur des périodes prolongées[10]. De nouveaux polymères hydrophiles ont également été développés au cours des dernières années tels que des polymères dérivés de sucre pour leur importante biocompatibilité[11].
Quant aux parties hydrophobes des copolymères utilisés pour la formation des vecteurs, les études ont été axées sur le développement de polymères biodégradables tels que les poly(lactate)[12]. Les micelles polymériques formées par ces parties hydrophobes biodégradables offrent en effet de nouvelles perspectives dans le domaine de la vectorisation car leur dégradation permet le contrôle de la cinétique de délivrance du principe actif et l’élimination du polymère in vivo est facilitée.
De plus, les micelles polymériques possèdent l’avantage de pouvoir délivrer un principe actif sur son site spécifique d’action en modulant la structure des chaînes polymères de façon à les rendre sensibles à un paramètre environnemental. Un bel exemple est illustré par le développement de copolymères sensibles au pH, par incorporation de fonctions amines[13] ou acides[14] dans le squelette du copolymère, ce qui altère la solubilité du polymère et donc la stabilité des vecteurs en fonction du pH. Les principes actifs peuvent donc être délivrés par déstabilisation de la micelle sur un site d’action possédant un pH spécifique.
Les micelles sont donc, en général, utilisées pour solubiliser des principes actifs hydrophobes afin de les rendre biodisponibles et de prolonger leur temps de circulation en milieu biologique. Il en est de même pour les micelles inverses qui permettent, en revanche, de solubiliser des principes actifs hydrophiles.
Cependant, l’inconvénient majeur des vecteurs micellaires, surtout ceux formés par les tensioactifs, sont leur sensibilité à la dilution. Quant aux vecteurs polymériques, la synthèse des polymères peut parfois se révéler difficile par rapport aux critères requis pour une utilisation biologique (non toxique, biocompatible, dégradable, masse moléculaire précise…). Notamment, la mise en place de micelles sensibles au pH et à visée thérapeutique est souvent laborieuse car les variations de pH sont très faibles en milieu biologique (par exemple, le pH au sein d’une tumeur est de 7 alors que les tissus sains ont un pH de 7,4).
II.2 Les émulsions
II.2.1 Structure et propriétés
Les émulsions sont des dispersions hétérogènes de deux liquides immiscibles (huile dans eau H/E ou eau dans huile E/H) et sont sujettes à une rapide déstabilisation par agrégation, coalescence ou floculation, conduisant à une ségrégation de phase. Cependant, la stabilité de ces émulsions peut être améliorée par la présence de molécules amphiphiles, capables de former une mono ou une multi-couche autour des gouttes de liquide dispersé, ce qui conduit à réduire la tension interfaciale entre les liquides immiscibles et à augmenter la répulsion entre les gouttelettes.
Selon la concentration des trois composants (eau-huile-tensioactif(s)) et la méthode de préparation de l’émulsion (tailles des gouttelettes), le mélange obtenu peut être une émulsion classique (taille des gouttes de 100 nm à 10 µm), une nanoémulsion ou microémulsion (taille des gouttes de 10 nm à 100 nm) ou encore une émulsion multiple (H/E/H ou E/H/E)[15] (Figure 3).
Figure 3 Représentation des différents types d'émulsions (en bleu : phase aqueuse ; en rouge : phase huileuse)
Contrairement aux émulsions classiques et aux émulsions multiples, seules les
microémulsions sont des systèmes thermodynamiquement stables et transparents[2].
II.2.2 Utilisation en vectorisation
Les émulsions sont des systèmes de formulation de médicament flexibles (le principe actif peut être hydrophile, dans ce cas, on utilise une émulsion E/H, ou hydrophobe et dans ce cas une émulsion H/E est alors employée) dont les caractéristiques peuvent être facilement modifiées en ajustant des paramètres tels que la fraction volumique de phase dispersée, la taille des gouttes et le gradient osmotique[16]. De plus, les émulsions peuvent être produites en très grande quantité moyennant l’utilisation d’une technologie adéquate[17].
Dès 1960, A. Wretlind et coll. ont développé la première émulsion H/E injectable (par voie intraveineuse), source de nutriments pour les patients ne pouvant plus se nourrir oralement ou ne pouvant plus métaboliser la nourriture. Depuis, de nombreux médicaments à base de principes actifs hydrophobes (comme le diazepam, un barbiturique) ont été formulés à l’aide d’émulsions H/E afin de les rendre biodisponibles[18].
Les microémulsions sont également très fréquemment utilisées dans le domaine de la vectorisation, pour leur grande stabilité. Beaucoup d’études ont été développées dans le domaine de la délivrance de principes actifs anti-cancéreux, tels que la vincristine, solubilisée dans une phase huileuse de vitamine E et d’acide oléique. L’émulsion H/E obtenue par mélange de cette phase huileuse, d’eau, de lipide PEG (polyéthylène glycol) et de cholestérol est très stable et seulement 7,5 % de vincristine se décompose au bout d’un an de stockage.
Emulsion H/E Emulsion E/H Emulsion multiple E/H/E
Emulsion multiple H/E/H
De plus, la biodistribution du médicament est accrue vers les tumeurs tandis que la toxicité du principe actif est considérablement diminuée[19].
Quant aux émulsions multiples, et plus particulièrement les émulsions E/H/E, celles-ci se sont révélées être d’excellentes candidates pour vectoriser des principes actifs hydrophiles grâce à l’existence d’une couche intermédiaire huileuse qui joue le rôle d’une membrane et permet le relargage contrôlé des substances actives. La performance des émulsions doubles a notamment été validée pour l’encapsulation et la délivrance d’antibiotiques[20], de protéines[21], de substances anti-cancéreuses[22]…
Bien que les émulsions offrent de nombreuses possibilités dans le domaine de la délivrance de principes actifs, quelques difficultés freinent leur utilisation. Notamment, la concentration en tensioactifs élevée (surtout dans les microémulsions) peut entraîner des risques de toxicité importants.
Enfin, dans le cas de formulation à administrer par voie intraveineuse, des précautions doivent être prises car sous l’effet de la dilution, un risque de séparation de phase de l’émulsion est encouru, pouvant entraîner une embolie chez le patient.
II.3 Les dendrimères
II.3.1 Structure et propriétés
Le terme dendrimère provient des deux mots « dendrite » et « polymère ». Le premier évoque la structure ramifiée des molécules (en grec « dendron » signifie arbre) alors que le second se réfère à la répétition d’un même motif (en grec « meros » signifie partie).
Un dendrimère est une molécule constituée de monomères qui s’associent selon un processus arborescent autour d’un cœur central plurifonctionnel. La structure de ces macromolécules globulaires (Figure 4), hautement ordonnées et régulièrement branchées, est divisée en trois régions distinctes : un cœur (C), des couches répétitives émanant du cœur ou branches (B) ainsi que des groupes terminaux sur la couche externe des unités répétitives (T). Les dendrimères sont classés selon leur génération, qui correspond au nombre d’ajouts de la
C B B B B T B B B B B B B B B B B B B B B B B T T T T T T T T T T T T T T T T T T T T T T T
Figure 4 Représentation d'un dendrimère de génération 3
Les dendrimères peuvent être synthétisés par une méthode de synthèse divergente[23], dans ce cas, le dendrimère est construit à partir du cœur vers la périphérie par répétition d’une même séquence de réactions, ce qui permet l’augmentation rapide de la taille et du nombre de fonctions terminales du dendrimère. La seconde méthode de synthèse, ou synthèse convergente[24], installe le cœur dans l’étape finale de construction du dendrimère. Cette dernière méthode est couramment employée lorsque les fonctionnalités du cœur ne peuvent pas résister aux conditions requises pour la croissance du dendrimère.
Quelle que soit la synthèse, le produit obtenu est une macromolécule qui possède un nombre défini de fonctions de surface.
II.3.2 Utilisation en vectorisation
Grâce à leur nombre élevé de groupements de surface, les dendrimères ont la capacité de créer des interactions multivalentes. Ces interactions polyvalentes peuvent être collectivement plus fortes et plus spécifiques que le même nombre d’interactions monovalentes correspondantes[25]. Comparés aux monomères, les dendrimères sont donc plus performants dans le domaine de la vectorisation, c’est ce que l’on appelle « l’effet dendritique »[26].
Cette propriété a conduit de nombreux groupes de recherche à étudier les applications possibles des dendrimères en vectorisation, en modulant les fonctions de surface du dendrimère afin de permettre une interaction de type électrostatique avec des principes actifs.
Par exemple, les chaînes d’ADN, chargées négativement, peuvent être complexées sur les dendrimères chargés positivement. Il a été démontré par plusieurs groupes de recherche que les complexes dendrimères/ADN, très compacts, pénètrent facilement dans les cellules par endocytose et améliorent par conséquent la transfection[27-29]. Des vecteurs dendritiques, tel que le Superfect® sont d’ailleurs commercialisés pour cette application.
Par ailleurs, les dendrimères peuvent également être structurés de façon à pouvoir encapsuler un principe actif au sein de leurs cavités internes. Cette méthode permet notamment d’améliorer la stabilité et donc la biodisponibilité de certains principes actifs.
En effet, la structure des dendrimères (cœur apolaire et périphérie polaire) permet de les comparer à des « micelles unimoléculaires », avec le net avantage pour la structure dendritique de ne pas dépendre de la concentration en dendrimère. Ainsi, des molécules telles que l’indométhacine, un anti-inflammatoire, ont pu être encapsulées au sein de dendrimères formés par des unités hydrophobes de 4,4-bis(4’-hydroxyphenyl)pentanol et dont les fonctions périphériques ont été liées de façon covalente à du poly(éthylèneglycol) afin de rendre l’ensemble de la structure plus hydrosoluble et donc biocompatible[30, 31].
Les boîtes dendritiques peuvent également permettre l’encapsulation de substances actives. Le groupe de Meijer et coll. a notamment synthétisé des dendrimères de poly(propylèneimine) formant ces types de structures. Les molécules actives peuvent être encapsulées dans les cavités des boîtes dendritiques pendant la synthèse du dendrimère possédant, en fin de réaction, une couche périphérique très dense de manière à ne pas relarguer les principes actifs avant l’hydrolyse de cette couche en milieu biologique[32-35].
Les dendrimères offrent donc de nombreuses possibilités pour la vectorisation de principes actifs hydrophobes ou hydrophiles[36] grâce à leur structure globulaire et à leur nombre élevé de fonctions de surface.
Cependant, la synthèse de dendrimères est délicate et très onéreuse. Un autre inconvénient majeur de ce type de vecteurs réside dans le relargage des principes actifs en milieu biologique. En effet, dans certains cas, la gêne stérique associée au dendrimère, de structure dense, rend difficile le clivage des liaisons hydrosolubles et biodégradables de la couche périphérique par les enzymes et donc la délivrance des principes actifs[34]. Dans d’autres cas, les molécules encapsulées ne sont pas idéalement retenues et sont relarguées très rapidement[31].
II.4 Les hydrogels
II.4.1 Structure et propriétés
Les hydrogels sont formés par un réseau tridimensionnel de chaînes polymères hydrophiles, qui ont la propriété de gonfler dans l’eau sans se solubiliser[37]. Il existe de nombreux types d’hydrogels qui peuvent être classés selon leurs propriétés physico-chimiques et leurs méthodes de préparation[38].
Les hydrogels peuvent être constitués de polymères naturels ou synthétiques. La classe des polymères naturels regroupe notamment les protéines, les polysaccharides ainsi que les acides désoxyribonucléiques (ADN). Les hydrogels à base de polymères synthétiques sont quant à eux préparés par polymérisation de monomères synthétiques. Il existe également des hydrogels biohybrides résultant d’un mélange de polymères synthétiques (pour leur fonctionnalité) et naturels (pour leur biocompatibilité)[39, 40].
La nature de la réticulation, permettant aux chaînes polymères de former un réseau tridimensionnel, peut être chimique ou physique. On parle de gels chimiques lorsque les chaînes sont connectées les unes aux autres par des liaisons covalentes, et de gels physiques lorsque les chaînes s’auto-assemblent spontanément en réseau tridimensionnel désordonné[41] par des liaisons faibles telles que les liaisons hydrogènes, les interactions hydrophobes... Les hydrogels physiques sont donc formés par un processus réversible dépendant du choix du solvant, du pH ou de la température.
Ces réseaux tridimensionnels de polymères possèdent une grande affinité pour l’eau, qui peut pénétrer entre les chaînes de polymère et causer ainsi le gonflement du matériau et la formation d’un hydrogel.
II.4.2 Utilisation en vectorisation
La délivrance spécifique de principes actifs est un domaine dans lequel les hydrogels jouent un rôle important. En effet, leur haute teneur en eau conduit à une biocompatabilité importante[42]. De plus, leurs propriétés physico-chimiques, mécaniques et biologiques peuvent être contrôlées selon le type de polymère et les méthodes de préparation employées.
Depuis la première étude portant sur l’application biomédicale d’un hydrogel, formé par le poly(2-hydroxyéthyl méthacrylate), par le groupe de Wichterle et Lim[43] en 1960, de nombreux hydrogels à visée thérapeutique ont été développés.
En effet, l’encapsulation de molécules actives hydrophiles se réalise simplement par mélange de ces molécules avec les monomères, suivi d’une polymérisation, ou bien par gonflement du gel dans un milieu aqueux contenant les substances à encapsuler. Les principes actifs peuvent ensuite être relargués en milieu biologique par diffusion (suivant la loi de Fick), par dissolution de l’hydrogel, par différences de forces osmotiques ou encore par échange d’ions[38].
Tout comme pour les micelles polymériques, on trouve également des hydrogels sensibles à certains facteurs environnementaux (pH, température, lumière…). Les modifications de ces facteurs entraînent alors une compression ou un gonflement de l’hydrogel conduisant au relargage des molécules encapsulées (Figure 5).
Figure 5 Représentation du relargage de principes actifs par les hydrogels sensibles aux facteurs environnementaux
Par exemple, les poly(N-isopropylacrylamide) sont fréquemment utilisés pour former des hydrogels sensibles à la température car la solubilité de ce polymère dans l’eau change dramatiquement en fonction de la température[44] du fait de la compétition entre la formation de liaisons hydrogènes ou d’interactions hydrophobes. La formation de liaisons hydrogènes entre les parties polaires du polymère sont dominantes à basse température, ce qui permet un gonflement de l’hydrogel. Lorsque la température augmente, les interactions hydrophobes deviennent dominantes et l’hydrogel se contracte. Ces propriétés ont été utilisées pour l’élaboration de vecteur dit « on/off »[45, 46].
En vue d’une application biomédicale importante, des hydrogels sensibles à la concentration en glucose en milieu biologique ont été élaborés. Ces hydrogels sont capables de délivrer de l’insuline lorsque la concentration en glucose devient trop élevée chez les personnes diabétiques (Figure 6). La méthode consiste à ajouter une enzyme, la glucose oxydase, à des hydrogels sensibles au pH. Lorsque le glucose présent dans le milieu est métabolisé en acide gluconique par la glucose oxydase au sein des hydrogels, le pH décroît, provoquant un gonflement de l’hydrogel et le relargage d’une quantité importante d’insuline[47]. Principe actif Hydrogel Changement de T° entraînant la compression de l’hydrogel Changement de pH entraînant le gonflement de l’hydrogel
Figure 6 Représentation de la régulation de la délivrance d'insuline par des hydrogels sensibles à la concentration en glucose
De nombreuses autres propriétés ont pu être attribuées aux hydrogels par synthèse de nouveaux polymères (propriétés bioadhésives[48], propriétés de reconnaissance par empreinte moléculaire[49]…). Ces vecteurs vont donc continuer à jouer un rôle important dans le domaine de la délivrance spécifique de principes actifs.
Cependant, bien que le taux d’hydratation des hydrogels soit un des paramètres les plus importants à prendre en compte pour les applications en vectorisation, son contrôle peut s’avérer difficile car il dépend, pour un même polymère, de la longueur des chaînes, de la masse du polymère ainsi que du degré et de la densité de réticulation[50].
Malgré les avantages évidents des hydrogels, procurés par leur sensibilité à certains paramètres biologiques, des améliorations doivent encore être apportées à ces vecteurs pour une utilisation pratique. Notamment, le relargage de l’insuline par les hydrogels en réponse à une augmentation de la concentration en glucose n’est pas encore assez rapide[38].
Réservoir d’insuline
Hydrogel contenant la glucose oxydase (en vert)
+ Glucose
- Glucose
Diffusion de l’insuline à travers la membrane d’hydrogel gonflée
II.5 Les nanosphères
II.5.1 Structure et propriétés
Les nanosphères sont des particules colloïdales solides, de diamètre généralement compris entre 100 et 200 nm, et formées par une matrice polymérique. Plusieurs types de polymères peuvent être utilisés pour la préparation de ces nanosphères : des polymères naturels (ou biopolymères), des polymères synthétiques dégradables ou des polymères synthétiques non dégradables. Les nanosphères peuvent être formées par deux types de méthodes[51] en fonction du polymère utilisé.
Lorsqu’une polymérisation des monomères est nécessaire, par exemple dans le cas de poly(méthylméthacrylate) et de poly(éthylcyanoacrylate), la méthode de préparation des nanosphères requiert généralement une première étape d’émulsification ou de dispersion du monomère dans l’eau, suivi d’une polymérisation.
Si le polymère est préformé, une méthode de nanoprécipitation est généralement employée. Cette dernière méthode consiste à dissoudre le polymère dans un solvant organique miscible à l’eau (acétone, éthanol, DMSO), puis d’ajouter goutte à goutte ce mélange à un milieu aqueux (contenant ou non des tensioactifs). Le solvant organique diffuse alors dans toute la solution aqueuse, ce qui conduit à une précipitation du polymère, et donc à la formation de nanosphères. Cette technique, permettant d’obtenir facilement des nanosphères sans préparation d’une émulsion, est une des plus utilisées parmi toutes les méthodes existantes pour former ces objets à partir d’un polymère préformé (émulsion-évaporation, effet de sel, émulsion-diffusion).
L’obtention de ces nanosphères de polymère est souvent suivie, à l’heure actuelle, d’une fonctionnalisation de leur surface qui dépend de l’application désirée.
II.5.2 Utilisation en vectorisation
L’intérêt des nanosphères dans le domaine de la vectorisation réside dans la nature solide de la matrice polymérique, leur conférant une grande stabilité[52]. Dans ce type de système polymérique solide, des principes actifs peuvent être dispersés à l’intérieur de la nanosphère ou bien adsorbés à leur surface. La délivrance des substances actives par les nanosphères se fait généralement par diffusion de l’espèce à travers la matrice ou par
dégradation de la matrice. Les nanosphères sont donc des systèmes à libération continue dont la cinétique de délivrance dépend du type de polymère utilisé, du processus de fabrication (et donc de la porosité de la matrice polymérique obtenue) et de la nature de la substance active.
Cependant, l’utilisation de ces nanosphères solides est limitée du fait de leur capture massive par les macrophages en milieu biologique. Récemment, des particules de seconde génération, « invisibles » pour les macrophages ont été développées afin de pallier ce problème et d’augmenter leur temps de circulation dans le sang[53]. Il a été démontré que la diminution de la taille des nanosphères (< 100 nm) et /ou une augmentation de l’hydrophilie de la surface des particules (généralement hydrophobe) permet d’éviter la capture de ces vecteurs par les macrophages. Ces nanosphères de seconde génération ont notamment été étudiées dans le domaine de la vectorisation de principes actifs anti-cancéreux[54].
Par exemple, le Taxol®, incorporé dans des nanosphères formées de
polyvinylpyrrolidone de 50 à 60 nm de diamètre, a une efficacité accrue (temps de circulation dans le sang augmenté) et est moins toxique que sous sa forme libre[55]. Les mêmes conclusions ont pu être tirées quant à l’efficacité d’un complexe dextran (polymère hydrophile)-doxorubicine (principe actif hydrophile), incorporé dans des nanosphères formées de chitosan (100 nm de diamètre)[56].
Des ligands spécifiques peuvent ensuite être ajoutés à ces nanosphères de surface hydrophile afin de cibler un site d’action particulier. Ainsi, le groupe de Jain et coll. a développé en 2007 des nanosphères formées de dextran et dont la surface a été fonctionnalisée par de la vitamine B12. Ces vecteurs sont capables de vectoriser l’insuline, incorporée dans les nanosphères, par voie orale jusqu’au sein de la circulation systémique (grâce à la vitamine B12), en limitant donc les dégradations provoquées par l’environnement hostile du tube gastrointestinal. L’activité anti-diabétique est prolongée tout en administrant des doses d’insuline faibles[57].
Les nanosphères de polymère ont donc un grand potentiel d’application dans le domaine de la vectorisation pharmaceutique mais la principale limite de ces vecteurs réside dans leur mode de préparation, pouvant être contraignante à l’échelle industrielle et limitant donc les applications de ces vecteurs. De plus, la formation de ces systèmes nécessite l’utilisation de solvants et de monomères parfois toxiques et difficiles à éliminer.
II.6 Les nanoparticules solides formées de lipides (NSL)
II.6.1 Structure et propriétésLes NSL sont des particules solides formées par des lipides (pour la plupart de glycérides) ayant un diamètre généralement compris entre 50 et 1000 nm. Ces nanoparticules peuvent être obtenues par diverses méthodes :
- Homogénéisation à haute pression[58] : les lipides sont portés à une température de 5 à 10°C au dessus de leur température de fusion puis ceux-ci sont dispersés sous agitation dans une solution aqueuse de tensioactifs à la même température. La pré-émulsion ainsi obtenue est homogénéisée à haute pression puis refroidie, les lipides cristallisent pour former les nanoparticules solides. Une adaptation de cette technique permet également l’homogénéisation à froid pour obtenir les particules.
- Technique de la microémulsion[59] : une microémulsion de lipides (au dessus de leur température de fusion) dispersés dans une phase continue aqueuse contenant des tensioactifs est réalisée. Le système formé, thermodynamiquement stable et transparent, est alors mélangé mécaniquement à une solution aqueuse froide (2-3°C) et la précipitation de la phase lipidique dispersée entraîne la formation des nanoparticules solides.
- Nanoprécipitation : cette méthode est identique à celle employée pour former des nanosphères de polymères et nécessite l’utilisation d’un solvant organique.
Selon les méthodes de préparation utilisées pour former les NSL, le degré de cristallinité du lipide employé peut être modifié. Le polymorphisme cristallin, étant directement corrélé à la densité et la stabilité colloïdale de ces systèmes, est un paramètre important à prendre en compte lors de l’utilisation des NSL.
II.6.2 Utilisation en vectorisation
Depuis 1990, plusieurs groupes de recherches se sont focalisés sur l’utilisation des NSL, alternative intéressante aux nanosphères de polymères dans le domaine de la vectorisation[60,
61]. Généralement, les lipides tels que les glycérides sont bien tolérés par l’organisme. De plus,
la production de ces nanoparticules est plus simple que celle des nanosphères et peut être réalisée à une échelle industrielle à moindre coût.
Les principes actifs requis pour l’application souhaitée sont dissous ou dispersés dans la phase lipidique fondue, puis une des méthodes de formation des NSL est employée pour obtenir les nanovecteurs contenant la substance active. Suite au refroidissement rapide des glycérides, une structure cristalline α, instable et peu ordonnée, est obtenue[62]. Les molécules actives se localisent alors préférentiellement dans les zones amorphes de la matrice cristalline. Cependant, la structure cristalline α adoptée par les lipides évolue au cours du stockage vers une forme cristalline β stable et présentant une meilleure organisation[63]. Lors de ce réarrangement, l’augmentation de la structure lipidique organisée conduit à une expulsion des substances actives dispersées dans les zones amorphes[64]. Un contrôle de la transformation de la matrice lipidique de la forme α à la forme β (en fonction de la température par exemple) pourrait donc permettre un relargage « sur commande » des substances actives[58]. A l’heure actuelle, ces NSL à transformation cristalline contrôlée n’ont pas été mises au point.
La capacité de charge en molécules actives dans les particules dépendant principalement de la structure et du polymorphisme du lipide formant les nanoparticules lipidiques, de nouveaux types de particules lipidiques, présentant des zones amorphes, ont été élaborés[65-67]. Ces particules lipidiques, partiellement cristallines, peuvent être constituées d’un mélange de glycérides aux acides gras très différents (longueur de chaînes, insaturation) conduisant à un type de matériau appelé « imparfait » et offrant donc un meilleur taux de charge en principes actifs. Un deuxième type de particules lipidiques, appelé « multiple », est obtenu en mélangeant des lipides liquides à des lipides solides lors de la préparation des nanoparticules. Les substances actives se localisent donc dans les compartiments huileux contenus au sein des particules lipidiques solides. Enfin, un système « amorphe » peut être obtenu grâce à un mélange particulier de lipides. L’incorporation de molécules actives dans ce dernier type de nanoparticules solides s’avère la plus efficace.
L’utilisation de ces nanoparticules solides dans le domaine de la vectorisation de principes actifs à visée thérapeutique est en développement actuellement, la bonne tolérance de ces vecteurs ayant été prouvée par des études menées in vitro et in vivo.
Pourtant, le polymorphisme de ces matrices lipidiques ainsi que les réarrangements cristallins peuvent conduire à des problèmes de stabilité de ces vecteurs (gélification[68]). De plus, l’expulsion des molécules actives incorporées dans ces nanoparticules solides n’est pas toujours contrôlée, ce qui limite les applications de ces particules dans le domaine de la
III Les vésicules
Les vésicules désignent des systèmes colloïdaux de tailles inférieures au micron pouvant être formés de polymères, de tensioactifs ou encore de lipides, et dans lesquels le principe actif est confiné dans une cavité aqueuse ou huileuse entourée d’une membrane. Les vésicules permettent donc généralement d’encapsuler une quantité de principes actifs plus importante que les systèmes matriciels, ce qui permet de diminuer la concentration en vecteurs à administrer. De plus, la plupart de ces systèmes ont des propriétés de transport versatiles, permettant de vectoriser des substances hydrophiles comme hydrophobes.
III.1 Les nanocapsules et les polymersomes
III.1.1 Structure et propriétésLes nanocapsules et les polymersomes sont des systèmes réservoirs constitués d’un noyau central liquide entouré par une mince paroi de polymère dont l’épaisseur ne dépasse pas quelques nanomètres[51]. Les principales différences entre ces deux vecteurs résident dans la structure de la membrane de polymère et l’hydrophilie de leur cavité interne (Figure 7).
Figure 7 Représentation d'une nanocapsule et d'un polymersome
La membrane des nanocapsules est une mince monocouche formée par un homopolymère ou un copolymère bloc (dont les parties hydrophiles se placent alors vers
Cœur huileux Cœur aqueux
Copolymère bloc amphiphile (en rouge : partie hydrophobe, en
bleue : partie hydrophile) Monocouche formée par un
homopolymère
l’extérieur de la membrane). Le cœur de ces nanocapsules est généralement huileux (mais des nanocapsules à cavité aqueuse ont également été mises au point[54]).
Comme pour les nanosphères, les nanocapsules peuvent être obtenues par des polymères préformés ou par polymérisation de monomères. La technique de déposition interfaciale peut être appliquée dans les deux cas. La procédure consiste à mélanger une huile, contenant un solvant organique miscible à l’eau et dans lequel est dissous le polymère ou le monomère, à une phase aqueuse contenant des tensioactifs. Après dispersion de la phase huileuse dans l’eau, le polymère, ou le monomère, s’agrège autour des gouttelettes d’huile tandis que le solvant organique diffuse dans l’eau, conduisant ainsi à la formation de nanocapsules (après polymérisation dans le cas des monomères[69]).
La membrane des polymersomes est quant à elle formée par un copolymère bloc qui est organisé en bicouche (analogue à celle des liposomes). Ces polymersomes renferment une cavité aqueuse.
La technique permettant d’obtenir des polymersomes est basée sur la méthode de réhydratation de film. Le copolymère est dissous dans un solvant organique volatile qui est évaporé pour obtenir un film de polymère. Ce film est ensuite réhydraté avec une phase aqueuse puis redispersé par agitation, sonication ou extrusion afin d’obtenir les polymersomes.
III.1.2 Utilisation en vectorisation
Dans le domaine de la vectorisation, les nanocapsules sont généralement utilisées pour retenir des principes actifs lipophiles au sein de leur cavité huileuse et les polymersomes pour encapsuler des principes actifs hydrophiles dans leur cœur aqueux. L’encapsulation des substances actives est réalisée durant le procédé de formation de ces vecteurs : le principe actif hydrophobe est préalablement solubilisé dans l’huile lors de la méthode de formation des nanocapsules par déposition interfaciale et une encapsulation dite passive, où le film de polymère est réhydraté en présence de la substance active à encapsuler, est réalisée lors de la formation des polymersomes.
Ces deux types de vésicules, à base de polymère, permettent de protéger une substance active, de diminuer sa toxicité et de la délivrer par diffusion ou par dégradation de la
L’encapsulation d’halofantrine par des nanocapsules a ainsi été réalisée par le groupe de Mosqueira et coll. lors d’une étude récente[70]. L’halofantrine est un principe actif très efficace pour soigner l’infection parasitaire appelée malaria lorsque les substances actives communément utilisées (chloroquinine et quinine) ne sont plus efficaces. Cependant, l’halofantrine, hydrophobe, est très peu biodisponible et surtout très toxique (possibilité d’arrêt cardiaque chez le patient). L’encapsulation de cette substance active dans des nanocapsules formées par le poly-ε-caprolactone a permis de réduire considérablement les risques cardiaques, et la dose léthale de ce médicament est passée de 200 mg/kg à 300 mg/kg. Ces résultats prouvent donc que la délivrance de ce principe actif est modifiée par l’utilisation des nanocapsules formées de poly-ε-caprolactone, polymère choisi entre autre pour sa vitesse de dégradation très lente in vivo (comparée à celle des polymères généralement employés pour former des nanocapsules, tel que le PLA (poly(acide lactique))-PEG).
De plus, comme pour les nanosphères, la surface des nanocapsules peut être fonctionnalisée par des ligands comme le PEG, permettant un temps de circulation prolongé en milieu biologique ou par des ligands spécifiques permettant de cibler un site d’action particulier.
Contrairement aux nanocapsules à cœur huileux, les polymersomes possèdent des propriétés de transport versatiles puisque des principes actifs hydrophobes peuvent être insérés dans la membrane des vecteurs tandis que des principes actifs hydrophiles peuvent être encapsulés au sein de la cavité aqueuse des polymersomes. Cette propriété a récemment été exploitée dans le domaine de la délivrance d’anti-cancéreux tels que le paclitaxel (hydrophobe) et la doxorubicine (hydrophile)[71]. La doxorubicine a été encapsulée dans la cavité interne des polymersomes tandis que le paclitaxel a été incorporé au sein de la bicouche de polymère (pendant la formation du film polymérique) pour maximiser l’efficacité anti-cancéreuse par un « cocktail » de substances actives.
Les polymersomes ont été obtenus par un mélange de deux copolymères blocs : le PLA-PEG, biodégradable et le PEG-PBD (poly(butadiène)), copolymère inerte afin de contrôler la délivrance des deux principes actifs par la formation de pores dans la membrane, due à l’hydrolisation du PLA-PEG. En comparaison avec les deux principes actifs sous leur forme libre, deux fois plus d’apoptoses dans les tumeurs ont été provoquées par le système polymersome-principes actifs au bout de deux jours.
Malgré leur efficacité, le désavantage majeur des polymersomes reste leur instabilité, pouvant provoquer des fuites de substances actives encapsulées. De plus, l’encapsulation passive utilisée pour les polymersomes requiert une quantité importante de substances actives puisque la concentration encapsulée par les polymersomes est identique à celle contenue dans tout le milieu aqueux servant à la réhydratation du film de polymère.
Les méthodes de préparation des nanocapsules et des polymersomes sont contraignantes à l’échelle industrielle et les résidus provenant de leur synthèse, difficiles à éliminer en totalité, peuvent être toxiques.
III.2 Les liposomes
III.2.1 Structure et propriétés
Les liposomes sont des vésicules formées par auto-association d’une ou plusieurs bicouches phospholipidiques, renfermant un compartiment aqueux. Ils ont attiré l’attention de nombreux groupes de recherche dans différents domaines (physico-chimie, biophysique, pharmaceutique) pour leur structure similaire aux membranes phospholipidiques des cellules vivantes.
La structure des liposomes dépend de leur composition, mais également de leur mode de préparation. Dans la grande majorité des cas, les étapes générales d’obtention des liposomes sont les suivantes[72]:
- dissolution des lipides dans un solvant organique - évaporation du solvant organique
- dispersion des lipides séchés dans une solution aqueuse
Les différences de préparation résident surtout dans les méthodes employées pour disperser les lipides séchés. La dispersion peut en effet être provoquée par l’hydratation du film phospholipidique, par utilisation d’ultrasons, par microfluidisation, par extrusion, par évaporation en phase inverse, par infusion d’éther, par injection d’une solution éthanolique, par lyophilisation/réhydratation, par congélation/décongélation, par élimination de détergent ainsi que par électroformation.