ETUDE DE LA REGULATION DU TRANSCRIPTOME DU
MUSCLE SQUELETTIQUE PAR L'ESTRADIOL ET PAR
L'ENTRAÎNEMENT PHYSIQUE À INTENSITÉ MODÉRÉE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval
dans le cadre du programme de maîtrise en physiologie-endocrinologie pour l'obtention du grade maître es science (M.Se.)
Département de Médecine Moléculaire FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL QUÉBEC
2010
Le vieillissement et la sédentarité peuvent contribuer à aggraver les facteurs de risque des maladies cardiovasculaires (MCV) et métaboliques. En raison de l'importante influence du muscle squelettique sur le métabolisme énergétique, de la détérioration du profil métabolique et de l'administration de la thérapie hormonale (TH) chez la femme postménopausée, il s'avère impératif de comprendre comment la prise de TH peut modifier le métabolisme énergétique du tissu musculaire à l'intérieur de cette population. Aussi, l'entraînement en endurance permet l'amélioration de plusieurs facteurs de risque modifiables rattachés aux MCV, à l'obésité et au syndrome métabolique. La compréhension des mécanismes moléculaires responsables de ces adaptations bénéfiques, particulièrement chez la personne âgée, demeure toutefois incomplète. Le premier objectif de cette maîtrise était de caractériser les effets aigus d'une injection d'estradiol sur le transcriptome du muscle squelettique de souris femelles ovariectomisées. L'analyse de l'expression génique a montré une modulation distincte à 3 h et 18 h vs. 6 h et 24 h suivant l'injection. Principalement, cette étude suggère la modulation concomitante de transcrits fonctionnellement rattachés à la détermination de la typologie musculaire, à la structure et à la croissance de la fibre musculaire, ainsi qu'au métabolisme énergétique. Le second objectif de cette maîtrise était de caractériser les effets de six semaines d'entraînement à intensité modérée, fixée au seuil lactique (SL), sur le transcriptome du muscle squelettique d'hommes âgés. Cet entraînement a eu pour effet d'améliorer plusieurs paramètres métaboliques tels la capacité aérobie et le taux de lipoprotéines de haute densité (HDL-cholestérol). L'analyse transcriptomique a aussi révélé une transition de la typologie musculaire allant du type rapide vers le type lent, une augmentation du nombre de transcrits codés par l'ADN mitochondrial, ainsi que l'induction de transcrits associés à la matrice extracellulaire et à la phosphorylation oxydative. Ces résultats suggèrent une amélioration du métabolisme des glucides et des lipides chez les hommes âgés suite à l'entraînement en endurance à intensité SL. Finalement, ces deux études ont montré la modulation de transcrits partiellement caractérisés ou non caractérisés à ce jour. Elles contribuent également à l'amélioration de la connaissance des mécanismes d'adaptations du
transcriptome du muscle squelettique face à la TH et à l'entraînement en endurance chez
l'individu âgé.
Remerciements
Je tiens à remercier ici plusieurs personnes qui ont contribué au bon déroulement de ma maîtrise.
En premier lieu, je remercie le Dr. Jonny St-Amand de m'avoir accepté comme étudiante à la maîtrise. Merci beaucoup d'avoir eu confiance en moi, de m'avoir accordé autonomie et liberté, et de m'avoir offert plusieurs opportunités de congrès. Mon directeur de recherche a savamment été secondé par la Dr. Mayumi Yoshioka, coordonatrice de recherche, qui a été très patiente et généreuse à mon égard. Tout au long de ces deux années, elle m'a aidé et encouragé constamment. Grâce à Jonny et Mayumi, j'ai appris énormément sur la rédaction d'articles scientifiques, la rigueur du travail de laboratoire et du travail académique, l'éthique de travail et de la recherche. Je remercie aussi chaleureusement ma collègue de travail et précieuse amie, Maria Rita De Giorgio, M.Se, sans qui beaucoup d'heures n'auraient pas été si agréables. Merci pour ton soutien sans fin, ta bonne humeur et ton humanisme. Je désire aussi remercier d'autres personnes que j'ai côtoyé et qui ont tous, de près ou de loin, contribué à mon parcours: Diala El Husseini, M.Se; Cari Bolduc, M.Se; Cindia Careau, TSA; Dr. Manon Gaudreault, Dr. Ping Ye, Dr. Ming Zhou. Merci à René Paradis et Jean-Philippe Dionne, pour leur précieuse collaboration. Je souhaite aussi remercier les Drs. Philippe Corbeil, Guy Thibault, Claude Labrie, André Tchernof et Denis Joanisse pour leur aide, leur soutien et leur participation à l'évaluation de mes travaux.
L'aventure de mes études de deuxième cycle ne se serait avérée aussi positive sans le soutien indéfectible de mes parents. Merci mille fois pour votre appui et votre générosité sans fin, je vous dois beaucoup. Merci aussi à : mes amis d'avoir été présents pour moi lors de mes bons (et moins bons) moments, en particulier Evelyne, Marjorie, Marie-Ève et Cari; à mon frère et ma sœur; à ma famille de Lévis. Finalement, un merci spécial à mon amoureux, Pierre-Luc, et à sa famille merveilleuse. Merci à tous de m'encourager à poursuivre mes études de troisième cycle.
Au début de ma maîtrise, j'ai commencé à travailler sur l'analyse des données obtenues par notre laboratoire suite à la réalisation de la méthode d'analyse sérielle de l'expression génique (SAGE) sur le muscle squelettique de souris ovariectomisées. Ce travail a mené à la publication d'un premier article. Après quelques mois, j'ai aussi commencé à travailler sur mon deuxième projet, l'analyse des données obtenues suite à la réalisation de la méthode SAGE sur le muscle squelettique d'hommes âgés ayant suivi six semaines d'entraînement en endurance. L'article faisant foi de ce travail est présentement en révision afin d'être publié. En plus de la méthode SAGE, j'ai eu l'occasion d'apprendre quelques méthodes de laboratoire telles l'amplification en chaîne par polymerase (ou PCR pour polymerase chain reaction), l'électrophorèse par gel d'agarose, ainsi que l'extraction d'ARN et de protéines. Finalement, en parallèle avec mes deux principaux projets, le laboratoire m'a offert la possibilité d'assister ma collègue au doctorat, Maria Rita de Giorgio, dans son projet de la caractérisation fonctionnelle du gène treefoil factor 2 (Tff2). Mon rôle a principalement consisté à l'assister dans les manipulations sur les souris.
Table des matières
Résumé ii Remerciements iv
Avant-propos v Table des matières vi Liste des abréviations viii
Liste des figures x I. Revue de littérature 1
1. Le muscle squelettique et le phénomène du vieillissement 1
1.1. Généralités 1 1.2. Les changements dans le métabolisme énergétique causés par le vieillissement 2
1.3. Les effets du vieillissement sur le transcriptome du muscle squelettique 5
1.4. Conclusion 6 2. Les estrogènes 7
2.1. Le vieillissement et la ménopause 7
2.2. La thérapie hormonale 7 2.3. Les effets des estrogènes sur le transcriptome du muscle squelettique et sur la
typologie musculaire 9 2.4. Conclusion 10 3. Adaptations à l'entraînement en endurance 12
3.1. Généralités 12 3.2. Adaptations métaboliques à l'entraînement en endurance 12
3.3. Les effets de l'entraînement en endurance sur le transcriptome du muscle
squelettique 14 3.4. Le seuil lactique 16
3.5. Conclusion 19 4. La méthode d'analyse sérielle d'expression génique 21
4.1. Choix de la méthode SAGE 21 4.2. Description de la méthode SAGE 21 4.3. Limites de la méthode SAGE 24 5. Hypothèses et objectifs de recherche 26
5.1. Étude 1 26 5.1.1. Hypothèse de recherche 26 5.1.2. Objectif de recherche 26 5.2. Étude 2 26 5.2.1. Hypothèse de recherche 26 5.2.2. Objectif de recherche 27 II. Résultats 28
1. Étude de la modulation du transcriptome du muscle squelettique de souris
femelles ovariectomisées suivant une injection d'estradiol par la méthode de
l'analyse sérielle de l'expression génique 28
1.1. Résumé en français 28
1.2. Participation à l'étude présentée 29
1.3. Corps de texte 29
2. Étude de la modulation du transcriptome du muscle squelettique par l'activité
physique à intensité modérée chez les hommes âgés 74
2.1. Résumé en français 74
2.2. Participation à l'étude présentée 75
2.3. Corps de texte 75
III. Conclusion 105
Bibliographie 107
Liste des abréviations
ACSM American College of Sports Medicine ADN acide désoxyribonucléique
ADNc ADN complémentaire ADNmt ADN mitochondrial AGL acides gras libres
AMPK 5' -activated protein kinase ARN acide ribonucléique ARNm ARN messager
AMP adenosine monophosphate ATP adenosine triphosphate
CaMK kinases calcium-calmoduline-dépendantes CPT1 carnitine palmitoyltransferase 1
DRO dérivés réactifs de l'oxygène DP double produit
DPBP point de cassure du double produit E2 estradiol
GLUT4 transporteur de glucose de type 4 HDL lipoprotéine de haute densité HR fréquence cardiaque
LDL lipoprotéine de faible densité LPL lipoprotéine lipase
MCV maladies cardiovasculaires MEC matrice extracellulaire MHC chaîne lourde de myosine NRF nuclear respiratory factor OVX ovariectomie, ovariectomisée(s) OXPHOS phosphorylation oxydative
pb paires de bases
PCR polymerase chain reaction PDK4 pyruvate déshydrogénase 4
PGC-1 a peroxisome proliferator-activated receptor gamma coactivator 1 alpha PP AR peroxisome proliferator-activated receptor
poly-A queue polyadénylée RE récepteur des estrogènes
SAGE analyse sérielle de l'expression génique SBP pression (tension) artérielle systolique SL seuil lactique
SM syndrome métabolique
TFAM transcription factor A mitochondrial TFF2 treefoil factor 2
TH thérapie hormonale V02max capacité aérobie maximale
Figure 1 : Calcul du double produit et correspondance avec la capacité aérobie.
Figure 2 : Correspondance entre le double produit, la lactatémie, et l'intensité de travail.
Figure 3 : Représentation schématique des étapes de la méthode d'analyse sérielle de
l'expression génique.
1. Le muscle squelettique et le phénomène du vieillissement 1.1. Généralités
Le muscle squelettique humain est un tissu qui constitue approximativement 40% du poids corporel, s'insère sur les os, transforme l'énergie chimique en énergie mécanique, et permet le mouvement volontaire1. Chez l'humain, le tissu musculaire se compose de trois
types de cellules musculaires, couramment appelées « fibres musculaires ». La classification de ces fibres repose sur le type d'isoforme constituant la chaîne lourde de myosine (MHC), la principale protéine contractile contenue dans la cellule musculaire et responsable de plusieurs paramètres fonctionnels de la fibre musculaire2. Les fibres
musculaires à contraction lente, aussi appelées les fibres de type I, possèdent un métabolisme énergétique oxydatif (de type aérobie) et présentent conséquemment une aptitude marquée pour l'effort aérobie ou l'endurance musculaire. Les fibres musculaires à contraction rapide, aussi appelées les fibres de type II, sont pour leur part divisées en deux groupes : les fibres à contraction rapide à métabolisme oxydatif-glycolytique (fibres de type lia) et les fibres à contraction rapide à métabolisme glycolytique (fibres de type Hx). À l'opposé des fibres de type I, les fibres de type II présentent une aptitude marquée pour l'effort anaérobie1" . Ainsi, en général, les athlètes spécialisés en endurance présentent un
nombre élevé de fibres de type I dans les groupes musculaires entraînés, tandis que chez les athlètes pratiquant des sports de type sprint, il y a plutôt prédominance des fibres de type Ila/IIx . Par le passé, la littérature scientifique référait aussi aux fibres de type Hb et Ild. On sait aujourd'hui que, chez l'humain, celles-ci correspondent aux fibres de type Ux2.
Les MCV constituent la première cause de décès au Canada4. De plus, neuf
personnes sur dix au pays présentent au moins un facteur de risque associé aux MCV (tabagisme, alcool, sédentarité, obésité, hypertension artérielle, hypercholestérolémie, diabète)5. Il est à noter qu'avec l'avancée en âge, le pourcentage de personnes vivant avec
une forme ou une autre de maladie du cœur augmente de façon marquée. Il est de 6,9 % pour les 54 à 64 ans, passe à 17,6 % chez les 65 à 79 ans, et à 28,0 % chez les personnes âgées de plus de 80 ans". L'âge fait donc figure d'un important facteur de risque non
à une détérioration, à une limitation fonctionnelle, puis à une incapacité, pour aboutir à la mort » . Il s'agit d'un processus physiologique normal et inévitable auquel tous les êtres humains sont confrontés. Toutefois, le rythme de la baisse des capacités associé à ce phénomène est différent pour chaque individu. Encore aujourd'hui, il est relativement difficile de distinguer les effets uniquement dus à l'avancée en âge per se de ceux qui sont plutôt attribuables au déclin marqué du niveau d'activité physique rencontré avec l'âge. La compréhension des causes et des conséquences du vieillissement, tant au niveau moléculaire que fonctionnel, est néanmoins primordiale afin de parvenir à développer les interventions nécessaires et optimales pour diminuer la morbidité et la mortalité, améliorer la qualité de vie des personnes du troisième âge et repousser davantage le seuil de l'incapacité et le moment où les aînés perdent leur autonomie fonctionnelle.
1.2. Les changements dans le métabolisme énergétique causés par le vieillissement Au cours du vieillissement, des changements majeurs dans la composition corporelle surviennent. En effet, avec l'âge, il y a une accumulation graduelle de gras corporel et une redistribution centrale et viscérale de celui-ci ' . L'augmentation de la masse grasse s'explique, en partie, par le fait que les personnes âgées dépensent moins d'énergie quotidiennement. Bien qu'on ne sache pas encore exactement à quoi attribuer cette baisse, il y a, avec l'âge, une diminution de la dépense énergétique totale". Ainsi, le taux auquel la dépense énergétique diminue est disproportionnellement plus grand que celui du déclin de l'apport énergétique. La dépense énergétique totale d'un individu se compose de la dépense énergétique de base (ou de repos), de l'effet thermique des aliments et de la dépense énergétique associée à l'activité physique. Cette dernière peut constituer 10 à 50 % de la dépense énergétique totale . La dépense énergétique de base quotidienne diminue de 1 à 2% par année' et le déclin marqué du niveau d'activité physique associé au vieillissement joue certainement un rôle important dans cette diminution générale1". Il
semble aussi que l'effet thermique des aliments soit diminué de 20% chez les hommes âgés en comparaison avec de plus jeunes individus14. L'atrophie musculaire est un autre
musculaire reliée à l'âge et à la diminution du niveau d'activité physique. Cette perte de masse musculaire débute dès l'âge de 30 ans et se poursuit à un rythme de 5 à 6% par décennie15"17. La diminution de la taille des muscles est due à la diminution du nombre et
de l'aire de surface des fibres musculaires de type II par rapport aux fibres de type I. La taille de ces dernières demeure pour sa part inchangée ou très peu diminuée. Cela résulte en une diminution du ratio de fibres musculaire 11:1. L'âge entraîne aussi une grande perte de la contractilité musculaire rapide à cause de la diminution du nombre et de la taille des fibres de type II15'18.
De l'augmentation de la masse grasse peuvent découler plusieurs troubles du métabolisme, dont le syndrome métabolique (SM), une constellation de facteurs de risques augmentant les chances de développer MCV et diabète de type II19. Selon la Fédération
Internationale du Diabète, les cinq caractéristiques permettant son diagnostic sont basées sur la circonférence de la taille, les taux de triglycérides et de lipoprotéines de haute densité plasmatiques, la glycémie à jeun et la tension artérielle. Le diagnostic du SM s'obtient lorsque l'on répond au critère de la circonférence de taille trop élevée et que l'on souscrit également à au moins deux des autres critères20. Chez la personne âgée, la prévalence de
l'une de ces caractéristiques, l'hypertension, est particulièrement à prendre au sérieux puisqu'elle touche 65% de la population des États-Unis âgée de plus de 60 ans21. Toujours
chez nos voisins du sud, la prévalence du SM, ajustée pour l'âge, atteint 23,7 % pour la population générale. Si, chez les 20-29 ans, la prévalence du SM est de 6,7 %, ce chiffre grimpe remarquablement à 43,5 % et 42,0 % chez les 60-69 ans et les 70 ans et plus, respectivement" . Tel que mentionné, les caractéristiques propres au SM favorisent le développement du diabète de type II, pour lequel la résistance à l'insuline fait office de figure emblématique. Dans les tissus normalement sensibles à l'insuline, la résistance à l'insuline se manifeste par une capacité réduite à répondre aux effets de cette hormone23.
Chez les individus sédentaires, on rapporte une détérioration progressive de la tolérance au glucose et de l'efficacité de l'insuline avec l'avancée en âge24""6. On observe également
que, lors de tests de tolérance au glucose, les niveaux de glucose et d'insuline sont de plus en plus élevés avec l'âge" . De plus, le pourcentage d'individus sédentaires présentant un
tolérance au glucose normale 7. Toutefois, la littérature scientifique présente aussi
l'évidence que l'augmentation de l'intolérance au glucose et la diminution de l'action de l'insuline rencontrée lors du vieillissement seraient davantage une conséquence de l'inactivité physique, de la sédentarité et du gain de poids qui en résulte au lieu de n'être attribuable qu'au vieillissement per se21'29.
L'une des mesures caractérisant le mieux la fonction cardiovasculaire et le niveau de forme physique d'un individu est la capacité aérobie maximale (V02max). Cette valeur représente la quantité maximale d'oxygène que le corps capte, distribue et utilise durant un exercice physique de type aérobie. Par exemple, on rapporte qu'un minimum de 13 ml/kg/min est requis afin de vivre de manière autonome et indépendante30. Chez l'adulte
vieillissant en général, le VÛ2max chute d'environ 10 % par décennie (0,4 à 0,5 ml/kg/min par année chez l'homme et de 0,2 à 0,35 ml/kg/min par année chez la femme) et ce, dès la troisième décennie30"32. En concordance avec cette diminution de la consommation
d'oxygène, on rapporte également une diminution de la fonction mitochondriale. Principalement, cette dernière se manifeste par une diminution de l'activité de la chaîne de transport des électrons et de la production d'adénosine triphosphate (ATP) mitochondrial ainsi que par l'accumulation de nombreuses mutations dans l'acide désoxyribonucléique mitochondrial (ADNmt)33'34. Ces dernières sont d'ailleurs à la base de la théorie
mitochondriale du vieillissement. Cette théorie stipule qu'avec l'âge, des mutations s'accumulent dans F ADNmt et contribuent à augmenter la production des dérivés réactifs de l'oxygène (DRO), mieux connus sous leur appellation anglophone, les reactive oxygen species. Les DRO endommagent et causent à leur tour des mutations dans l'ADNmt. Elles réduisent ainsi l'efficacité de la phosphorylation oxydative et la production d'ATP. Puis, les mitochondries, dont le processus de production d'énergie est ainsi handicapé contribuent à leur tour à produire davantage de DRO, le tout résultant en un cercle vicieux3 . Ainsi, les DRO et la théorie mitochondriale du vieillissement se retrouvent
tous deux de plus en plus souvent associés aux modifications du métabolisme énergétique et aux changements dans la cellule musculaire dus à l'avancée en âge, tels que la sarcopénie36,38 et la diminution du V02max34.
Les études ayant pour but de caractériser le profil d'expression génique du muscle squelettique de la personne âgée en comparaison avec celui du jeune individu ont majoritairement utilisé la technologie des micropuces d'ADN (microarray) 6, afin
d'atteindre cet objectif. Une étude a aussi utilisé la méthode SAGE47. Ces études ont été
réalisées sur des modèles animaux39"44 et chez des humains45"47. Cette littérature a comme
caractéristique commune majeure d'observer une diminution de l'expression des gènes rattachés au métabolisme énergétique du muscle squelettique. Plus précisément, il y a une diminution de l'expression des gènes codant pour des protéines et des enzymes impliquées dans la glycolyse et le métabolisme du glycogène, dans la phosphorylation oxydative et dans la synthèse de l'ATP, la synthèse des protéines mitochondriales, le cycle tricarboxylique et la chaîne de transport des électrons39"42,44"47. Ainsi, ces études suggèrent
que le vieillissement entraîne, à l'échelle transcriptomique, une inhibition du métabolisme énergétique, ce qui se confirme au niveau protéomique42. Par la suite, certaines de ces
études pratiquées sur les animaux rapportent aussi une surexpression des gènes rattachés à la réponse inflammatoire et immunitaire4 ainsi qu'à la défense contre le stress oxydatif40'44
et la réparation de l'ADN endommagé . Ces patrons d'expression ne sont toutefois pas encore rapportés de manière évidente chez l'humain45. En ce qui concerne les modifications
dans les différents types de fibres musculaires rencontrés avec l'âge, la littérature scientifique confirme les changements mentionnés précédemment. En effet, Welle et al.41
rapportent une diminution significative de 30% de l'abondance de l'acide ribonucléique messager (ARNm) des MHC (tous types confondus). Ces observations suggèrent une diminution du nombre de fibres musculaires dans le muscle âgé en comparaison avec le muscle déjeunes individus. On a aussi observé l'induction de plusieurs transcrits rattachés à la differentiation de la cellule musculaire et favorisant une transformation allant du type rapide vers le type lent dans le muscle âgé42. Finalement, dans le muscle âgé, Pattison et
al. ont rapporté la sous-expression de plusieurs transcrits jouant un rôle important au niveau de la matrice extracellulaire (MEC) et dans l'adhésion cellulaire. Cette diminution de l'expression génique pourrait être causée par la diminution de la mise en charge, elle-même due à la perte de masse et de force musculaire43. En accord avec la théorie
codant pour des protéines mitochondriales34. Cela renforce l'affirmation selon laquelle il se
produit un déclin de la fonction mitochondriale dans le muscle squelettique âgé et confirme la diminution du rythme de production mitochondriale d'ATP 4 tel que proposé par cette
théorie. Malgré l'abondance relative de la littérature sur le sujet et les progrès de la caractérisation fonctionnelle du profil de l'expression génique du muscle squelettique de l'individu âgé, les bases moléculaires caractérisant la réponse de ce tissu au processus du vieillissement demeurent encore incomplètes et incomprises. La perte de la masse, de l'endurance et de la force musculaires n'est pas nécessairement une conséquence normale du vieillissement. Elle semble résulter en grande partie de l'inactivité physique chronique qui accompagne habituellement l'avancée en âge, d'où l'importance de clarifier les effets uniquement dus à celle-ci et ceux qui sont plutôt dus au déclin marqué du niveau d'activité physique.
1.4. Conclusion
L'association du vieillissement à d'importants changements physiologiques et à l'inactivité physique chronique résulte en une diminution de la capacité fonctionnelle. En effet, une fonction musculaire compromise par l'âge et la sarcopénie, jumelée à un niveau d'activité physique réduit, mène à une plus faible dépense énergétique de base et contribue ainsi aux changements dans la composition corporelle pouvant mener à l'embonpoint et à l'obésité. De plus, ces importants changements risquent d'entraîner le développement de la résistance à l'insuline et un mauvais profil lipidique, favorisant l'émergence de maladies chroniques et métaboliques chez l'individu vieillissant tels que le diabète de type II, les dyslipidémies, l'hypertension, le SM et la MCV. L'élucidation des mécanismes moléculaires et des changements dans l'expression génique du muscle squelettique peuvent aider à développer des stratégies thérapeutiques afin d'améliorer la qualité et l'espérance de vie des personnes du troisième âge.
2.1. Le vieillissement et la ménopause
Chez la femme, l'une des caractéristiques majeures du phénomène du vieillissement est la ménopause, soit la cessation permanente des menstruations. Cet état peut être diagnostiqué après douze mois consécutifs d'aménorrhée48. Les ovaires ne sont plus en
mesure de produire d'estrogènes car les follicules ovariens sont épuisés. La ménopause se caractérise donc par une depletion des niveaux d'estrogènes, qui, à son tour, influence profondément le métabolisme des différents systèmes du corps humain. Les estrogènes et la progestérone sont les principales hormones stéroïdiennes sécrétées par les ovaires en réponse à la stimulation par l'hormone folliculo-stimulante et l'hormone lutéinisante. Parmi les estrogènes, l'hormone la plus active est l'estradiol (E2). Celle-ci dérive de la testosterone via l'action enzymatique de l'aromatase4 . Pour beaucoup de femmes, la
période de la ménopause et la depletion des niveaux d'estrogènes coïncide avec l'émergence et la progression de certaines composantes du SM, dont l'augmentation de l'obésité abdominale, la détérioration du profil lipidique et l'augmentation de la résistance à l'insuline49'50. Rappelons que la prévalence du SM est particulièrement élevée chez les
personnes de plus de 60 ans. De plus, le statut de femme postménopausée est associé à un risque de SM augmenté de 60% .
Chez l'homme, le vieillissement, du point de vue hormonal, se manifeste principalement par le déclin progressif des androgènes. L'hypogonadisme de survenue tardive chez l'homme (ou late-onset hypogonadism) est aussi connue sous le terme d'andropause, bien que cette appellation fait l'objet de débats dans le monde scientifique52'53.
2.2. La thérapie hormonale
D'importants symptômes s'adjoignent à la diminution des niveaux des hormones reproductrices qui survient lors de la ménopause. La depletion des niveaux d'estrogènes s'accompagne notamment de bouffées de chaleur, le symptôme vasomoteur le plus fréquemment rencontré chez les femmes en ménopause ; 70 à 80% des femmes en souffrent49-54. Ce chiffre grimpe à 90% chez les femmes ovariectomisées55 (OVX). D'autres
symptômes principaux, dont plusieurs découlent en fait du premier, sont les troubles du sommeil, la sudation excessive, les sautes d'humeurs, la fatigue, la perte du désir sexuel, la sécheresse et l'atrophie vaginale. Conséquemment, suite à la ménopause, l'administration de la TH permet de soulager les femmes de ces importants et inconfortables symptômes. De plus, toujours chez la femme postménopausée, la TH s'est avérée efficace pour améliorer plusieurs facteurs de risque de la MCV, et plus particulièrement la maladie coronarienne56
et les composantes du SM, tels la pression sanguine, le profil lipidique, la résistance à l'insuline, la circonférence de la taille et l'obésité abdominale57. Toujours au sein de cette
population, la TH a montré qu'elle permettait de réduire le risque de développer le diabète de type II . Finalement, il est aussi à noter que la TH, chez la femme postménopausée, permet la préservation de la masse osseuse et prévient les fractures dues à l'ostéoporose49.
Les effets de la TH sont à prendre particulièrement au sérieux puisque le SM s'accompagne fréquemment d'obésité et du diabète de type II, deux facteurs de risque majeurs de la MCV, la première cause de décès chez la femme au Canada et dans les pays développés59.
Toutefois, plusieurs études ont montré que la TH comportait d'importants effets secondaires indésirables. L'étude conduite par le Writing Group for the Women's Health Initiative Investigators en est une des plus connues60. Elle vient à la conclusion que, chez la
femme postménopausée, l'utilisation de la TH combinée comporte davantage de risques pour la santé que de bénéfices. En fait, l'étude démontre que la TH augmente les risques d'accident vasculaire cérébral, de thromboembolisme veineux, des cancers du sein et de l'endomètre. Les auteurs en viennent à la conclusion que la TH ne devrait pas être utilisée comme un moyen de prévention pour le syndrome métabolique et les MCV.
Ainsi, la TH soulève non seulement la controverse, mais ses effets précis au niveau moléculaire sur certains organes ou tissus particuliers demeurent inconnus. Une grande quantité d'information est disponible sur le sujet des estrogènes et de leurs effets sur les systèmes reproducteur, cardiovasculaire, osseux et nerveux central. Par contre, dans le muscle squelettique, ces effets demeurent peu documentés. Compte tenu du fait que la dépense énergétique totale diminue avec l'âge et étant donné l'importance de la contribution du muscle squelettique à la dépense énergétique associée à l'activité physique, il est d'une grande importance de comprendre les mécanismes d'action de la TH sur le muscle squelettique.
On dresse le profil de l'expression génique d'un tissu ou d'un organe en particulier à l'aide de la transcriptomique, c'est-à-dire en analysant l'expression génique globale (le transcriptome) du tissu soumis à certaines conditions, comme une injection d'estradiol, par exemple. Afin d'examiner les effets de la TH sur la régulation de l'expression génique dans le contexte du vieillissement et de la ménopause, quelques études se sont penchées sur les effets des estrogènes sur le transcriptome du muscle squelettique.
Les effets de la TH ont notamment été caractérisés dans le transcriptome de la glande mammaire61 et du tissu adipeux62. On dispose toutefois de moins d'information au
sujet des effets des estrogènes sur le muscle squelettique, particulièrement en ce qui concerne les effets aigus de ces hormones et leurs effets sur l'expression génique et sur la typologie musculaire. Pourtant, à l'aide du petit nombre d'études disponibles, on sait que durant les premières années de la ménopause, le transcriptome du muscle squelettique est en proie à plusieurs changements, tant chez la femme qui utilise de la TH que chez celle qui n'en utilise pas63. Le muscle squelettique exprime deux récepteurs aux estrogènes, le
récepteur alpha (REa), et le récepteur beta (REP) '65. Le REa est celui qui est
majoritairement exprimé dans le muscle squelettique. Barros et al. 4 ont suggéré que, dans
les cellules musculaires exprimant ERa et ERp, les effets des deux récepteurs seraient antagonistes et que c'est le ratio ERa/ERp qui déterminerait l'action que l'estradiol a sur le tissu. Également, ces mêmes auteurs ont démontré qu'un niveau d'expression réduit du transporteur de glucose de type 4 (Glut4) dans le muscle squelettique de souris knock-out pour ERa pouvait contribuer à augmenter la résistance à l'insuline. Leurs résultats suggèrent que ERP jouerait plutôt un rôle suppresseur en ce qui concerne le niveau d'expression de Glut4 dans le muscle64. Jusqu'à présent, on ne rapporte aucun changement
dans les niveaux d'expression d'ARNm des récepteurs aux estrogènes dans le muscle squelettique suivant l'administration de la TH6'. Ainsi, si la présence des récepteurs aux
estrogènes dans le muscle squelettique humain est pour sa part bel et bien confirmée, les effets précis des estrogènes sur ce tissu demeurent encore incompris. De plus, le peu
d'études réalisées sur le sujet se sont principalement penchées sur les effets à long terme de ces hormones stéroïdiennes. À notre connaissance, les effets aigus n'ont pas encore fait l'objet d'études scientifiques. Deux études à long terme de 4 semaines ont tout de même montré que chez la ratte OVX, l'administration d'E2 entraîne une diminution de l'expression des fibres de type lib dans le muscle plantaire66, alors que dans le muscle
soléaire, aucun changement n'est rapporté67. Initialement, les muscles plantaire et soléaire
possèdent une typologie musculaire très différente. Le premier est composé à 92% de fibres rapides de type II66 alors que le second est composé à 85% de fibres lentes de type I67.
Ainsi, il a été suggéré que les effets de l'E2 pourraient dépendre de la composition initiale des fibres musculaires .
D'autres analyses transcriptomiques ont pour leur part montré que, suite à l'administration d'E2 pendant 14 ou 60 jours, il y a respectivement surexpression de peroxisome proliferator-activated receptor (PPAR) a6 et ô6 . Ceux-ci sont des facteurs de
transcription bien connus pour leur implication dans le métabolisme des lipides et contribuent à la régulation de l'expression de plusieurs gènes requis pour la captation des lipides et leur oxydation dans la cellule musculaire70'71. Notamment, la surexpression de
PPAR-ô dans le muscle améliore la capacité oxydative des acides gras libres (AGL) dans le muscle71'72. Ainsi, l'administration d'E2 pendant 60 jours a aussi entraîné la surexpression
de plusieurs gènes cibles de PPAR-ô, soit lipoprotéine lipase (LPL), pyruvate déshydrogénase 4 (PDK4), acyl-CoA oxydase, et uncoupling protein 2 et 3, suggérant une augmentation de la capacité oxydative du muscle squelettique6 . L'administration d'E2
pendant 14 jours a pour sa part aussi provoqué la surexpression de Pdk4 ainsi que celle de carnitine palmitoyltransferase 1 (CPT1)68. La surexpression de ces gènes facilite la
captation et l'entrée des AGL dans la mitochondrie, améliore la dissipation de l'énergie et l'oxydation des lipides. Finalement, l'analyse transcriptomique du muscle quadriceps chez des femmes de 50 à 57 ans, postménopausées, et sous TH quotidiennement pendant un an, a notamment rapporté la modulation de plusieurs gènes, dont la surexpression de O-linked N-acetylglucosamine transferase, qui pourrait jouer un rôle dans la régulation de la structure du muscle squelettique63.
tenu de l'important rôle du muscle squelettique dans la dépense et le bilan énergétiques, des
différentes voies métaboliques énergétiques empruntées selon la composition des fibres
musculaires et, finalement, des changements dans le style de vie des personnes âgées
(sédentarité, prise de médicaments, etc.), il est de première importance de comprendre
comment la TH peut influencer la structure et le métabolisme énergétique du tissu
musculaire. Par l'identification des changements transcriptomiques aigus suivant
l'administration de la TH, on peut aspirer à mieux cerner les événements moléculaires
responsables des modifications métaboliques et structurales à long terme survenant dans le
muscle squelettique.
3. Les adaptations à l'entraînement en endurance chez l'individu âgé 3.1. Généralités
Le muscle squelettique est un tissu qui démontre une plasticité remarquable et qui possède la capacité de modifier le profil de son expression génique afin de s'adapter à la demande imposée par différents stimuli tels la contraction musculaire et l'entraînement en endurance . Les conséquences fonctionnelles de l'entraînement physique dépendent des modalités d'entraînement, soit le mode d'exercice, le volume, l'intensité et la fréquence de l'entraînement74'75. En effet, la pratique régulière de l'activité physique de type aérobie
entraîne une série d'adaptations métaboliques et morphologiques qui favorisent la mise en place d'un profil phénotypique axé sur l'endurance74. En général, il se produit les mêmes
adaptations bénéfiques en réponse à l'entraînement en endurance chez la personne âgée et chez le jeune individu76. De plus, chez la personne âgée, ce type d'entraînement permet de
prévenir les maladies chroniques et métaboliques, d'améliorer considérablement plusieurs facteurs de risque qui s'y rattachent, de préserver la capacité fonctionnelle, et d'augmenter l'espérance de vie9. La littérature scientifique a montré que même les personnes très âgées
répondent favorablement à l'activité physique quand celle-ci est prescrite et supervisée de façon adéquate77'78. À ce sujet, l'American College of Sports Medicine (ACSM) a
récemment mis à jour les recommandations s'adressant spécifiquement à la population âgée . L'ACSM précise que la personne âgée devrait s'astreindre à un minimum de 150 minutes d'activité physique par semaine. De plus, celle-ci est invitée à dépasser ce minimum prescrit afin d'améliorer sa forme physique. L'activité physique doit notamment inclure de l'exercice en endurance d'une intensité modérée à vigoureuse, des exercices de musculation, de flexibilité, d'équilibre, et d'agilité. Notons aussi qu'il y est indiqué que la pratique de l'activité physique peut être adaptée à presque tous les types de personnes âgées, que celles-ci soient en excellente ou bonne condition physique, et même déconditionnées, frêles, et aux prises avec une limitation fonctionnelle ou avec certaines maladies chroniques9.
3.2. Adaptations métaboliques à l'entraînement en endurance
l'entraînement en endurance chez la personne âgée, la littérature s'est principalement attardée à deux types de population. Des études ont utilisé comme sujets des individus âgés déjà en excellente condition physique et conséquemment performants sur le plan sportif puisqu'ils sont d'anciens athlètes, s'entraînent régulièrement, ou n'ont pas cessé d'exercer un métier ou de pratiquer des activités exigeantes physiquement76'7 . D'autres travaux ont
mesuré les effets de l'entraînement en endurance, pratiqué de manière aiguë ou chronique, directement chez des personnes âgées (ou sur des modèles animaux) inactives, sédentaires, ou affectées par un problème métabolique, tel l'hypertension artérielle.
Chez l'aîné, tout comme chez le l'individu jeune, il se produit des changements métaboliques et cardiovasculaires qui améliorent la capacité oxydative et la production d'ATP de la cellule musculaire, résultant en une plus grande résistance à la fatigue musculaire ' ' ' ' ' . L'entraînement en endurance augmente la quantité d'ARNm codant pour les protéines mitochondriales et stimule la biogénèse mitochondriale, soit l'augmentation du contenu mitochondrial73'74. Chez la personne âgée, la pratique régulière
et appropriée de l'exercice en endurance permet de ralentir la diminution anticipée du VÛ2max et permet même d'en améliorer la valeur de 16,3 % ' ' . De plus, il se produit aussi une importante augmentation de la capillarité du tissu musculaire, résultant en une plus grande disponibilité de l'oxygène et une augmentation de l'aire de surface pour le transport des AGL dans le muscle . La dyslipidémie et l'hypertension sont tous deux des facteurs de risque majeurs de la MCV7. L'entraînement en endurance permet d'améliorer le
bilan lipidique en augmentant le HDL-cholestérol et en diminuant le taux plasmatique de triglycérides. Les anciens athlètes présentent aussi des valeurs de cholestérol total et de lipoprotéines de faible densité (LDL-cholestérol) plus basses. Toutefois, ces deux dernières améliorations ne semblent pas se retrouver suite à l'entraînement chez la personne âgée initialement sédentaire76. L'entraînement en endurance à intensité faible, modérée ou élevée
provoque aussi une diminution de la tension artérielle, systolique et diastolique, chez les jeunes, comme chez les aînés ' ' . Finalement, l'entraînement en endurance augmente
Q C
l'utilisation des lipides comme substrat énergétique . Chez les sujets entraînés en endurance en comparaison avec des sujets non-entraînés, on retrouve une meilleure utilisation des lipides pour une même intensité d'effort7 . Le métabolisme des glucides est
le muscle squelettique. Puisque la contraction musculaire permet de mimer l'effet de l'insuline sur les GLUT4, permettant ainsi leur translocation vers la membrane cellulaire, la captation du glucose dans la cellule musculaire s'améliore et requiert moins d'insuline . L'exercice en endurance permet donc d'améliorer significativement la tolérance au glucose, la sensibilité à l'insuline et la résistance périphérique à l'insuline, en plus de prévenir la détérioration de ces paramètres chez les jeunes individus, comme chez les personnes
* ' 87-89
agees
Ainsi, à l'aide d'une série d'adaptations métaboliques, l'entraînement en endurance augmente la capacité des muscles à produire et à utiliser de l'énergie, améliore la tension artérielle, le profil lipidique et le métabolisme du glucose. Ensemble, ces changements permettent l'amélioration de la capacité aérobie et la forme physique du jeune individu et de l'aîné.
3.3. Les effets de l'entraînement en endurance sur le transcriptome du muscle squelettique
Les conséquences de l'activité physique sur l'expression génique demeurent encore à ce jour peu investiguées et conséquemment incertaines. L'étude des mécanismes d'adaptation à l'entraînement en endurance s'avère complexe en raison de l'impact important du mode, de la fréquence et de l'intensité de l'exercice sur l'activation des voies métaboliques et des messagers moléculaires impliqués. L'activité contractile génère des signaux cellulaires qui sont responsables de l'activation de facteurs de transcription. Ceux-ci induisent à leur tour la transcription de gènes, incluant les gènes mitochondriaux et nucléaires, qui sont pour leur part à l'origine de l'induction de la biogénèse mitochondriale et des adaptations à l'entraînement en endurance ' ' .
Parmi les signaux cellulaires à l'origine des adaptations à l'exercice, on retrouve la depletion de l'ATP dans la cellule musculaire. À cause de celle-ci, le ratio adenosine monophosphate adenosine triphosphate (AMP:ATP) augmente et active la protéine 5' -activated protein kinase (AMPK.) ' . Son activité, tout comme son expression protéique, se trouvent augmentées en réponse à l'entraînement en endurance91. Bien que quelques
l'induction de la biogénèse mitochondriale73'74'92, les fonctions précises de cette molécule
dans le muscle squelettique ne font pas encore l'unanimité. Un autre signal cellulaire enclenché par la contraction musculaire et menant notamment à la biogénèse mitochondriale est le relâchement du calcium par le reticulum sarcoplasmique. Les changements dans les niveaux intracellulaires de calcium dépendent des modalités d'entraînement et modifient l'activité de kinases et de phosphatases, dont le groupe des kinases calcium-calmoduline-dépendantes (CaMK)73'74. Alors que CaMKII est surexprimée
suite à l'entraînement en endurance93, CaMKIV serait pour sa part liée à l'expression
génique de protéines mitochondriales94.
Parmi les facteurs de transcription d'importance modulés par l'activité physique, on retrouve notamment peroxisome proliferator-activated receptor gamma coactivator 1 alpha (PGC-la), nuclear respiratory factor-1 et -2 (NRF-1/2), et transcription factor A mitochondrial (TFAM)74'90. L'activation de PGC-la stimule l'activation de 1 et
NRF-295. La régulation de l'expression de PGC-la dépendrait de l'intensité de l'exercice96. Cet
important régulateur du contenu protéique mitochondrial semblerait aussi jouer un rôle dans la détermination du type de fibre musculaire97'98. À leur tour, NRF-1 et NRF-2 sont
responsables de l'activation de la transcription de nombreux gènes mitochondriaux, et du facteur de transcription TFAM97. Enfin, TFAM est pour sa part également responsable de
l'activation de la transcription de l'ADN mitochondrial73'95.
Lors de la période de récupération suivant l'entraînement en endurance, il y a surexpression temporaire de plusieurs gènes reliés au métabolisme énergétique. Notamment, il y a surexpression des niveaux d'ARNm pour des gènes codant pour des enzymes (CPT1, PDK4, LPL) jouant un rôle dans les métabolismes des glucides et des lipides ' . Il semble que l'expression de ces gènes atteint un pic quelques heures après la séance d'entraînement, puis diminue pour enfin revenir à son niveau initial99'100. Suivant
cette observation, Pilegaard et al. ont suggéré que les adaptations métaboliques spécifiques à l'entraînement en endurance pouvaient notamment résulter de l'accumulation de cette modulation particulière de l'expression génique.
Suite à l'entraînement en endurance, et en concordance avec les changements précédemment énumérés dans le métabolisme énergétique, il se produit une transformation
dans l'expression génique du type de MHC, responsable de la typologie musculaire. Cette forme d'entraînement, chez les rongeurs1 1102 et chez les humains102, jeunes et âgés34'103,
induit une transformation du type de fibre rapide vers le type lent. À l'échelle transcriptomique, suivant un programme d'entraînement en endurance, l'expression de gènes caractérisant des fibres de type I augmente, alors qu'il y a répression de l'expression de gènes caractérisant des fibres de type IIx et Hb34'101'103. Les transformations induites par
l'entraînement semblent toutefois dépendre de la composition initiale du muscle et de la durée du stimulus101,102. On constate aussi que, chez les individus âgés, il y a une plus
grande proportion de fibres musculaires de type I chez les aînés qui se sont entraînés en endurance pendant de nombreuses années que chez les aînés sédentaires du même groupe d'âge104. Ainsi, on observe une transition allant du type rapide vers le type lent non
seulement avec le vieillissement, mais aussi avec l'entraînement en endurance.
3.4. Le seuil lactique
Les effets de l'entraînement en endurance sont notamment fonction de l'intensité de l'activité pratiquée7 '75. À travers la littérature scientifique, les modalités d'entraînement en
endurance minimales requises pour induire des adaptations physiologiques bénéfiques, chez les jeunes individus comme chez les aînés, varient d'une étude à l'autre. Néanmoins, dans les récentes recommandations de l'ACSM s'adressant aux aînés , il est affirmé que l'exercice en endurance doit être d'une intensité modérée à vigoureuse. L'ACSM suggère de fixer l'intensité d'un programme d'entraînement aérobie efficace à 60% du V02max. On y utilise également l'échelle de perception de l'effort de 1 à 10 pour mieux quantifier l'intensité. L'intensité modérée est de 5 à 6 sur 10 alors que l'intensité élevée ou vigoureuse est de 7 à 8 sur 109.
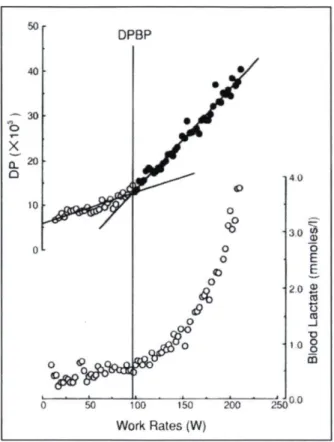
Le SL est une intensité d'exercice modérée permettant d'induire des adaptations bénéfiques sur la santé1 " . Cette intensité correspond au moment où le niveau de lactate
sanguin (la lactatémie) augmente au-dessus de la valeur de repos, lors d'un exercice d'une intensité croissante ou d'un test à l'effort progressif109'110 (Figures 1 et 2). Le SL s'établit à
l'aide d'un test à l'effort progressif au cours duquel on mesure régulièrement la lactatémie. Puis, on utilise la méthode du point de cassure du double produit (BPDP) entre la fréquence
cardiaque et la pression artérielle systolique pour fixer précisément le seuil " '. En déterminant ce repère, qui corrèle avec le SL, l'intensité appropriée peut être facilement prescrite au patient et de manière sécuritaire. Il est très important d'individualiser les modalités d'entraînement pour chaque individu. De plus, pour les personnes sédentaires et peu habituées à la pratique de l'entraînement en endurance, il importe d'adopter une attitude conservatrice face à ces modalités9. Pour déterminer le SL, un test progressif sous-maximal
est nécessaire. Il devient possible de fixer et d'utiliser une intensité de travail modérée, spécifique et personnalisée sans avoir à recourir à un test maximal afin de déterminer celle-ci. Exprimé en pourcentage du V02max, chez les personnes sédentaires et non entraînées, ce seuil se situe généralement à environ 50 à 60% de leur V02inax. Chez les sujets entraînés en endurance et chez les athlètes, il peut atteindre 70 à 80% du V02max110. Il a
été démontré que l'entraînement en endurance à intensité SL, à raison de 3 à 5 séances de 60 minutes par semaine, totalisant entre 30 et 60 séances, permet d'améliorer la forme physique, le profil lipidique et la sensibilité à l'insuline1 5'' . Ce type d'entraînement a été éprouvé
chez les patients souffrant de maladie coronarienne, d'hypertension et d'obésité, leur permettant d'améliorer leur forme physique105. De même, chez les individus âgés, souffrant
ou non d'hypertension, ce type d'entraînement a permis d'améliorer la pression sanguine et le profil lipidique ' . L'entraînement à intensité SL s'avère approprié pour un large éventail d'individus, incluant les personnes âgées et celles aux prises avec des maladies chroniques, leur permettant d'améliorer leur santé. Certains ouvrages scientifiques utilisent aussi le terme « seuil aérobie » comme synonyme du SL puisque c'est à cette intensité que se situe la limite supérieure de l'utilisation exclusive du métabolisme aérobie110''12.
150r 140 130 a 120 r m 110 os 1 0 0 o r r 90 x 80 TQ 8 0 5o' OU o 30
■ ft'
i
,+i
»—O—* 2 2 0 2 0 0 180 C» X E 1 6 0 e Q . m 140 CO 1^'v V -~4f"
1 2 V02(l/min)Le double produit est le produit de la multiplication entre la fréquence cardiaque et la pression artérielle systolique, en fonction de la capacité aérobie. Légende : DP :double produit; HR : Fréquence cardiaque (battements/minute); SBP : pression artérielle systolique (mmHg); VO? : capacité aérobie (l/minute). Source
Figure 2 Correspondance entre le double produit, la lactatémie, et l'intensité de travail. 5 0 r DF »BP 40 ■*■" 3° • Jm O r X a 2° Q p>^^"^ o 4 0 10 o tf 3 0 !& 0 o o 0 E © § o
4
■ 2 0 ® 2 «9 t3 o _ j O ® çx 3*i rL 9?°° 3&T .0 g mi f r f W
1 Jtftas 0 50 100 150 200 Work Rates (W) 2 5 0u uLes cercles blancs montrent les données localisées sous le SL et les cercles noirs montrent les données localisées au-dessus du SL. Légende : DP : double produit; Blood lactate : lactatémie (mmoles/l); Work Rates : intensité de travail (W); DPBP : point de cassure du double produit; SL : seuil de lactate. Source :
Tanaka et al. 1997.
3.5. Conclusion
Finalement, il est à noter qu'il y a peu d'information de disponible au sujet de l'influence des différentes intensités d'exercice en endurance sur les changements dans le transcriptome du muscle squelettique96'113. Les études scientifiques utilisent un large
éventail de différentes intensités de travail. Par la suite, les changements induits par ce type d'entraînement qui sont rapportés dans cette section ont principalement été vérifiés chez les
jeunes individus. Pourtant, mettre en lumière ces événements moléculaires chez l'individu
du troisième âge permettrait de faire le lien avec les adaptations fonctionnelles et
bénéfiques qui permettent la diminution du risque de maladies chroniques et métaboliques
dans cette population.
4. La méthode d'analyse sérielle d'expression génique 4.1. Choix de la méthode SAGE
La plupart des études citées dans cette revue de littérature et ayant pour but d'analyser le transcriptome du muscle ont utilisé la technologie de microréseau d'ADN (mieux connue sous son terme anglophone, microarray). Notre équipe a choisi d'utiliser la méthode SAGE, décrite à l'origine par Velculescu et a/."4, une technique transcriptomique
à haut débit qui permet de caractériser l'expression génique de manière qualitative et quantitative. La méthode SAGE s'avère particulièrement intéressante pour dresser le profil de l'expression génique globale puisque, contrairement à la technologie de microréseau d'ADN, elle n'exige pas une connaissance préalable des gènes à identifier. Elle recèle ainsi un potentiel de découverte de nouveaux gènes et permet l'identification de nouveaux transcrits n'ayant pas encore été caractérisés à ce jour, enrichissant de cette façon les bases de données actuelles et améliorant l'annotation du génome. Cette technique représente aussi une avenue digne d'intérêt parce qu'elle permet littéralement de quantifier l'expression génique" . La technologie de microréseau d'ADN décrit l'intensité de l'expression génique par fluorescence et ne permet pas une quantification numérique de celle-ci.
À la base, la méthode SAGE repose sur le principe qu'une courte séquence d'ADN, appelée « tag », longue de 9 à 11 paires de bases (pb), contient assez d'information pour identifier un transcrit unique codant pour un gène. Par la suite, on forme de longues molécules avec ces tags, appelées « concatémères », qui sont séquences de manière sérielle, à l'aide d'un seul clone" .
4.2. Description de la méthode SAGE
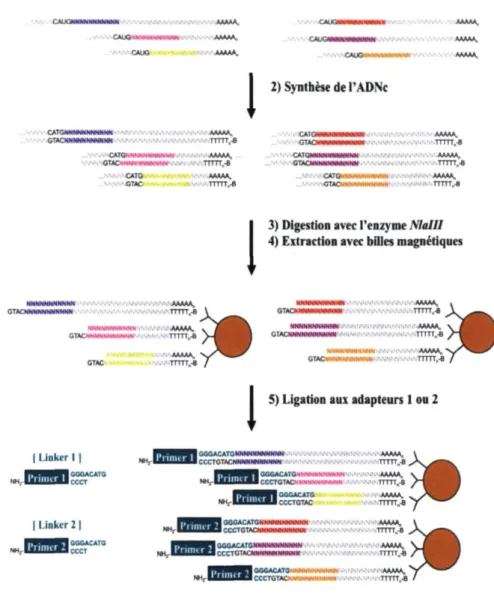
En détails, voici comment se déroule la méthode SAGE (Figure 3). L'ARNm est extrait d'un tissu ou d'une population de cellules à l'aide d'amorces oligo-(dT) biotinylées. Ensuite, l'ADN complémentaire (ADNc) est synthétisé. La banque d'ADNc ainsi obtenue est digérée à l'aide d'une endonuclease de restriction faisant également office d'enzyme d'ancrage, soit l'enzyme Molli. Molli coupe chaque fois qu'elle rencontre la séquence
CATG. Par la suite, suivant la digestion de la banque d'ADNc, l'extrémité 3' (queue polyadénylée (poly-A)) est isolée de chaque transcrit par sa liaison à des billes magnétiques de streptavidine. La streptavidine se lie de manière covalente à la biotine et l'extraction des brins se réalise à l'aide d'un aimant. Ainsi, ceci procure, sur chaque transcrit, un site unique correspondant au site de restriction localisé le plus près de la queue poly-A. La population d'ADNc est ensuite séparée en deux parties. La première est liée à un adapteur A et la seconde à un adapteur B. Il est à noter que les adapteurs contiennent les séquences complémentaires aux amorces de PCR ainsi que le site de restriction pour l'enzyme d'étiquetage de type II, BsmFl, qui permettra le relâchement de ces adapteurs. Les brins sont alors digérés par BsmF\ qui coupe plus loin que son site de reconnaissance. Selon le protocole expérimental, à 37°C, BsmFl génère habituellement un tag de 15 pb, contenant la séquence CATG. Suite à la digestion, il y a création d'extrémités franches par l'ajout de nucleotides aux extrémités cohésives. On place ensuite les tags liés à l'adapteur A et les tags liés à l'adapteur B en présence les uns des autres afin de former des ditags par ligation. Ces ditags seront amplifiés par PCR grâce aux séquences présentes dans les adapteurs qui sont complémentaires aux amorces de PCR. Suite à l'amplification par PCR, Molli digère les ditags et les libère des adapteurs. Puis, les ditags sont liés les uns aux autres pour obtenir de longues molécules, les concatémères"4. Ces longues molécules seront clonées à leur
tour via Escherichia coli et les clones contenant un long insère seront séquences. Finalement, les séquences obtenues seront comparées par bio-informatique aux bases de données UniGene et GenBank afin d'identifier les transcrits.
Figure 3. Représentation schématique des étapes de la méthode d'analyse sérielle
de l'expression génique.
1) Extraction de l'ARNmI
CATGMNNNNNMMNN GTACNMNNNMMNNN TTTTT,8 CATG > GTACM MMN t h t m WNN CATG GTAC TTTTT.S TTTTTre ■ 2) Synthèse de l'ADNc ! 1111,-8 IkNMNMNNNr* AAAAA, TTTTT.ê AAAAA. IN'ANNNNNf.'.TTTTT.* NNNNMNNNNNN ',\\k.V.V. V.V.V, V.v,V. GTACNNNMNNNNMMM | Linker I | GGGACATG CCCT (Linker 2 | GGGACATG CCCTI
1
3) Digestion avec l'en/) me Mal I I 4) Extraction avec billes magnétiques
I TTTTT„-B
HHNMWHHHWt AAAAA.
GTACMNHMMHHHMUlINNNSNN'.NNNMNNNNNN'.TTTn.B
> »
5) Ligation aux adapteurs 1 ou 2GGGACATGNMNMNNNMNNN AAAAA, CCCTGTACNNNNNNNNNNH T T T T T „ * i n f l | B | GGGACATGMMWtMMMMttNN . ' W AAAAA. N H ; U U l U É l B l c C C T G T A r > N N M N N M * N K N TTTTT.e GGGACATG M N CCCTGTAC GGGACATGMNNNNNMNNNN CCCTGTACNNNNNNNNNMN . TTTTTBB GGGACATG MNMMNNNNNNN AAAAA, C C C T G T A C N H N N N N N N N N N TTTTT.fl V i N W HNNNNNKNV. TTTTT(,B
Figure 3. (Suite)
I
6) Libération par l'enzyme BsmFl 7) Extrémités franches N M , " ODajCMMNMtoNNNNMN N H - , Hrv| GGATGCATG1
8) Ligation des tags 9) Amplification par PCR GGATGCATG GTAC GGATGCATG cOTAC C o n d i t i o n c o n t r ô l e10) Isolation des ditags
11) Production des concatémères 12) Clonage des concatémères 13) Séquençage
I
14) Analyse des données » C o n d i t i o n e x p é r i m e n t a l eif.
h
B C D E FJ
Transcrits
4.3. Limites de la méthode SAGE
Malgré sa puissance et ses avantages, la méthode SAGE présente toutefois quelques
limites. Premièrement, cette méthode n'est pas en mesure de détecter les transcrits un peu
plus courts qui pourraient ne pas contenir le site de restriction de l'enzyme d'ancrage
(MalII). Théoriquement, puisqu'il s'agit d'une séquence de 4 pb, l'enzyme de restriction
devrait couper environ une fois chaque transcrit ayant une longueur de 256 pb (4
4=256).
Toutefois, il peut arriver que certains transcrits soient trop courts pour contenir la séquence
CATG. Ceux-ci ne seront donc pas détectés par la méthode SAGE. Ensuite, il peut arriver
qu'un tag corresponde à plus d'un transcrit, c'est ce qu'on appelle un multiple match. Finalement, tout comme pour les résultats obtenus par microréseau d'ADN, il s'avère important de contre-vérifier les résultats de la SAGE. Pour ce faire, on utilise une méthode dont la sensibilité et la spécificité sont plus élevées, tel le PCR quantitatif en temps réel115.
Les niveaux d'expression génique de l'ARNm correspondent aux niveaux des protéines et avec l'activité de celles-ci (r =0,94 en ce qui concerne la méthode SAGE et le niveau des protéines correspondantes)116"118. En terminant, mentionnons également que la
littérature a rapporté une très bonne reproductibilité (r2=0,96)"9 et une fiabilité
1 JO
raisonnable de la part de la SAGE. On fait aussi état d'une sensibilité similaire entre la méthode SAGE et la technologie de microréseau d'ADN121"12 ainsi que d'une
5. Hypothèses et objectifs de recherche.
Les deux études sur lesquelles j'ai travaillé avaient respectivement pour but de permettre l'amélioration de la compréhension des événements moléculaires induits dans le muscle squelettique par la TH et par l'activité physique à intensité modérée.
5.1. Étude 1
5.1.1. Hypothèse de recherche
Compte tenu de l'importance du rôle du muscle squelettique dans la dépense énergétique, l'administration de la TH peut moduler la typologie musculaire et le métabolisme énergétique du muscle au niveau du transcriptome. L'identification et la caractérisation des mécanismes moléculaires régissant la modulation de ce tissu par l'estradiol permettront de mieux comprendre l'influence de la TH sur le développement de maladies métaboliques et chroniques chez la femme post ménopausée.
5.1.2. Objectif de recherche
Caractériser les effets aigus de l'estradiol sur l'expression génique du muscle squelettique en identifiant les gènes modulés par une injection unique d'estradiol.
5.2. Étude 2
5.2.1. Hypothèse de recherche
L'identification et la caractérisation des mécanismes moléculaires régissant les adaptations à l'effort dans le muscle squelettique âgé peuvent fournir le lien entre l'entraînement en endurance et l'amélioration des facteurs de risques des MCV chez la personne âgée. Plus précisément, notre équipe s'attendait à ce que l'entraînement en endurance pratiqué à intensité SL module l'expression de gènes en lien avec le métabolisme énergétique (favorisant l'amélioration de la capacité oxydative du muscle), et
avec la détermination de la typologie musculaire (suggérant une transformation allant du
type rapide vers le type lent).
5.2.2. Objectif de recherche
Caractériser, pour la première fois, les effets de l'entraînement en endurance à
intensité modérée (SL) sur le transcriptome du muscle squelettique chez la personne âgée
en identifiant les gènes modulés par l'entraînement.
II. Résultats.
1. Étude de la modulation du transcriptome du muscle squelettique de souris femelles ovariectomisées suivant une injection d'estradiol par la méthode de l'analyse sérielle de l'expression génique.
Article accepté pour publication: « Concomitant modulation of transcripts related to fiber type determination and energy metabolism in skeletal muscle of female ovariectomized mice by estradiol injection ». Isabelle Riedl, Mayumi Yoshioka et Jonny St-Amand. J. Steroid Biochem. Mol. Biol. 2009 (Sous presse).
1.1. Résumé en français.
La prévalence du SM est de 40% chez la femme post-ménopausée. L'avancée en âge est également associée à une diminution de la dépense énergétique de base et à d'importantes modifications de la composition corporelle, contribuant ainsi au développement du SM. La TH s'est avérée avoir un impact positif sur plusieurs caractéristiques propres au SM. Toutefois, les effets aigus de la TH sur le muscle squelettique vieillissant demeurent inconnus. Nous avons donc, à l'aide de la méthode d'analyse sérielle de l'expression génique, examiné les effets d'une injection unique et physiologique d'estradiol sur le profil de l'expression génique du muscle squelettique de souris femelles ovariectomisées. Les souris étaient séparées en 6 groupes de 14 animaux chacun : un groupe contrôle (OVX) et 5 groupes expérimentaux auxquels on a injecté l'estradiol 1, 3, 6, 18 ou 24 heures avant le sacrifice. Cette injection d'estradiol a modulé
177 transcrits, dont 11 transcrits partiellement caractérisés et 52 transcrits non caractérisés. Les transcrits modulés connus étaient rattachés à la structure et à la croissance du muscle squelettique, à la distribution et à la composition de la typologie musculaire ainsi qu'au métabolisme énergétique de la cellule musculaire. Principalement, ces résultats suggèrent qu'une dose unique et physiologique d'estradiol est suffisante pour moduler d'une manière concomitante des transcrits associés à la détermination du type de fibre musculaire et au métabolisme énergétique du muscle. Cela pourrait en retour affecter le développement du SM et de ses facteurs de risques associés.
1.2. Participation à l'étude présentée
Pour ce projet, j'ai principalement participé à l'analyse des données et j'étais responsable de la rédaction de l'article scientifique.
1.3. Corps de texte
Concomitant modulation of transcripts related to fiber type determination and energy metabolism in skeletal muscle of female ovariectomized mice by estradiol injection.
Isabelle Riedl, Mayumi Yoshioka and Jonny St-Amand.
Molecular Endocrinology and Oncology Research Center, Laval University Medical Center and Department of Anatomy and Physiology, Laval University, Québec, Canada.
Abstract
In postmenopausal women, prevalence of metabolic syndrome (MS) is 40%. Aging is associated with a decline in basal metabolic rate and an alteration in tissue metabolism, leading to MS. Hormonal therapy has been shown to be effective against some of the MS-related features but its effects on sarcopenia and skeletal muscle metabolism remain unclear. We have analyzed the effects of estradiol (E2) on global gene expression in skeletal muscle of ovariectomized (OVX) female C57BL6 mice using the serial analysis of gene expression method. Animals were randomly assigned to six groups of each 14 mice: the vehicle group (OVX), and five groups in which E2 was injected 1, 3, 6, 18 or 24 h prior to sacrifice. E2 modulated 177 transcripts, including 11 partially characterized transcripts and 52 potentially novel transcripts. Most of the differentially expressed transcripts were up-regulated at E23h and E218h, while down-regulated transcripts were observed at E26h and
E224h, illustrating two cycles of up and down E2 responsive genes. Modulated transcripts were involved in skeletal muscle structure/growth, fiber type distribution and energy metabolism. These results suggest that a single physiological dose of E2 can concomitantly modulate transcripts determining skeletal muscle type and energy metabolism, which may in turn affect sarcopenia and MS.
Introduction
Aging is a natural process that every human being must go through. In women, hormonal changes and menopause are hallmarks of the aging phenomenon. Since life expectancy is increasing, the time a woman spends after menopause can constitute one third of her life. Menopause is defined as the permanent cessation of menses, which results in a state of estrogen deficiency. In the USA, more than 20% adults suffer from metabolic syndrome (MS), whereas in elderly and postmenopausal women, the prevalence of MS has reached 40%'. Moreover, the postmenopausal status is associated with 60% increased risk of MS . MS is a constellation of risk factors increasing the risk of developing cardiovascular heart disease (CVD) and diabetes. In women, estrogen depletion is partially responsible for the emergence of some of the MS-related features, such as abdominal adiposity, insulin resistance and dyslipidemia . With the aging process, women tend to lose lean body mass, gain fat mass, and develop more abdominal obesity, the latter being associated with increased insulin resistance and atherosclerotic vascular disease.
Hormonal therapy (HT) taken following menopause has been shown to be effective to reduce waist circumference, visceral adipose tissue (VAT) and insulin resistance, as well as to improve lipoprotein profile, stabilize bone mass and prevent osteoporotic fractures3.
However, several studies show that HT has important undesirable secondary effects. The well-known study conducted by the Writing Group for the Women's Health Initiative (WHI) Investigators stated that overall health risks exceeded benefits from use of combined HT for healthy postmenopausal women. Indeed, HT increases risks of stroke, venous thromboembolism, breast cancer and endometrial cancer. Therefore, the authors concluded that it should not be given as preventive therapy for treating MS and preventing CVD.
Human skeletal muscle tissue comprises approximately 40 to 45% of total body weight, and is one of the most metabolically active tissues in the body. Thus, skeletal muscle accounts for more than 30% of basal metabolic rate (BMR). In women, fat-free mass remains relatively stable during premenopausal years whereas loss of muscle mass, sarcopenia, increases rapidly after menopausal transition . Consequently, postmenopausal women display decreased 24h energy expenditure and an increased VAT6. In addition to
the sarcopenia, aging affects muscle fiber type composition, which in turn influences fuel utilization in the tissue and, consequently, insulin sensitivity7. The classification of muscle
fiber type is based on the myosin heavy chain (MHC) isoform. In human adult skeletal muscle, three MHC isoforms can be found: MHC-I (slow or type I muscle fiber), MHC-IIa (fast oxidative or type Ha) and MHC-IIx/IId (fast glycolytic or type Ilx/IId), in which the
o
latter being the fastest myosin . Type IIx muscle fiber was previously called type lib in human8, although it coexists with IIx in other mammals such as rodents. With aging, there
is a reduction of number and size of type II muscle fibers as opposed to type I muscle fibers9, which results in a relatively higher percentage of type I muscle fibers7'10. It is also
known that obese individuals and diabetic patients show relatively lower type I muscle fiber11'12, and individuals with relatively higher type II muscle fibers show lower body fat
oxidation and higher insulin resistance12. Therefore, the changes in muscle fiber
composition induced by aging appear to favor an increase in oxidative capacity. However, aging reduces muscle mitochondrial oxidative capacity and ATP production7. Moreover,
skeletal muscle from elderly individuals shows a common phénotype, an impaired skeletal muscle oxidation, as seen from Duchenne muscular dystrophy13, probably in part due to the
sarcopenia. To our knowledge, no study has been conducted to investigate the early effects of HT on muscle fiber type composition in human. In ovariectomized (OVX) rats as a model of estrogen deficiency, 17p-estradiol (E2) replacement for 4 weeks decreases type lib muscle fibers in the plantaris (composed at 92% of fiber type II)14 whereas no effect is
seen in the soleus (composed at 85% of fiber type I)15, thus suggesting that the response to
E2 appears to vary depending on the initial fiber type composition of the muscle14. Up to
date, the effects of HT on sarcopenia still remain with controversy, and the molecular mechanisms of E2-induced changes in skeletal muscle metabolism as well as its relation to muscle fiber composition are poorly understood. We have focused on gene regulation occurring within 24 h since genes responding to E2 within this time period would be enriched in direct estrogen targets before cell growth.
With the advent of the serial analysis of gene expression (SAGE) strategy16, we
have been investigating the transcriptomic changes induced by sex steroids in skeletal muscle and VAT in order to identify direct target genes of the steroid hormones ' ' ' . These studies have illustrated the molecular mechanisms responsible for the steroids