THÈSE DE DOCTORAT
Présentée par
Najla EL AAFI
Discipline : Biologie
Spécialité : Microbiologie et Biologie moléculaire
Titre
Potentialités de bioremédiation par l’utilisation des associations
rhizobactéries métallo-résistantes / légumineuses : vers une nouvelle
approche de rhizoremédiation des sols contaminés par les métaux
Soutenue le : 23 Janvier 2016 devant le jury composé de :
Président :
Mr. Abdelkarim FILALI MALTOUF Professeur de l’enseignement supérieur, Faculté des
Sciences de Rabat.
Examinateurs :
Mr. Mohammed ATER Professeur de l’enseignement supérieur, Faculté des
Sciences de Tétouan
Mr. Mustapha ARAHOU Professeur de l’enseignement supérieur, Faculté des
Sciences de Rabat.
Mme Eloisa PAJUELO DOMINGUEZ Professeur de l’enseignement supérieur, Faculté de
Pharmacie, Université de Séville, Espagne
Mr. El Bekkay BERRAHO Professeur de l’enseignement supérieur, Faculté des
Sciences de Rabat
Mr. Jamal AURAG Professeur de l’enseignement supérieur, Faculté des
soi ; tout étudiant (…) peut l’appréhender
sans trop de difficulté. Mais les longues
années de tâtonnements, de recherches
dans le noir, avec leur lancinante tension,
l’alternance des périodes de confiance et de
découragement, puis finalement la sortie
vers la lumière, seuls ceux qui ont éprouvé
cela peuvent le comprendre. »
A ma mère, en témoignage d’un grand respect et ses immenses
sacrifices qu’elle a consentis pour mon éducation et mon bien être. Elle a
cru en moi et m’a donné tous les moyens pour arriver jusqu’ici. Elle m’a
appris à ne pas me contenter du minimum mais à viser l’Excellence. Que
Dieu vous garde et vous procure longévité et santé.
A mon père que Dieu aie son âme et l’accueille en sa sainte
miséricorde.
A mon frère Nabil, ma sœur Souad et mon frère Merouane qui
étaient et qui restent pour moi une source de reconnaissance et d’espoir.
Qu’ils trouvent ici l’expression de mon amour fraternel.
A ma famille.
A mes amies et amis.
Vous qui m’a ouvert la voie et la passion de la science
A vous que je n’oublierai jamais
A vous Professeur Fatiha Brhada,
Vous resterez inoubliable et toujours là, même si vous nous avez quitté trop tôt.
Que le Grand Dieu ait votre âme dans sa miséricorde
Je tiens à vous témoigner et vous exprimer ma plus vive reconnaissance.
J’avais toujours l’espoir que vous surmontez l’épreuve de la maladie mais
hélas vous nous avez quitté trop tôt. Vous avez encadré ce travail en
déployant de grands efforts et en apportant votre excellente expérience
scientifique et vos précieuses qualités humaines. Vous avez su me guider,
me former, m’encourager, vous m’avez appris à vivre la science comme une
passion. Votre départ nous a tous bouleversé et beaucoup touché, vous
nous manquez et nous manquerez toujours.
Au défunt et regrettable
Professeur Antonio José PALOMARES DIAS
Ex Directeur du Laboratoire de Génétique Moléculaire de l’Interaction
Rhizobium–Légumineuse
A la Faculté de Pharmacie, Université de Séville, Espagne
Ma profonde gratitude, il m’a accueilli dans son laboratoire et m’a donné
la possibilité de mener à bien mes recherches. Son humanisme et sa grande
expérience dans le domaine de la bioremédiation m’ont été d’une aide
précieuse. Que son âme repose en paix.
Les travaux représentés dans cette thèse ont été réalisés au Laboratoire de Microbiologie et Biologie Moléculaire de la Faculté des Sciences de Rabat, sous la direction de en collaboration avec le Laboratoire de Génétique Moléculaire de l’Interaction Rhizobium– Légumineuse à la Faculté de Pharmacie, Université de Séville en Espagne.
Le travail a été précédemment suivi et encadré par Professeur Fatiha BRHADA et actuellement suivi et encadré par Professeur Abdelkarim FILALI MALTOUF.
Mes sincères remerciements et ma gratitude à Monsieur Abdelkarim FILALI-MALTOUF, Professeur de l’enseignement supérieur et Directeur du Laboratoire de Microbiologie et Biologie Moléculaire à la Faculté des Sciences de Rabat, pour m’avoir accueilli dans son laboratoire pour la réalisation de ce travail, pour avoir accepté d’assurer la continuité de mon encadrement et diriger ce travail, pour son soutien scientifique et matériel, pour ses compétences, ses conseils avisés, et ses encouragements incessants, et pour me faire l’honneur de présider le jury de soutenance. Qu’il trouve ici le témoignage de ma reconnaissance et ma haute considération.
Mes sincères remerciements à Mme Eloisa PAJUELO DOMINGUEZ, Professeur à la Faculté de la pharmacie de l’Université de Séville, Espagne, pour m’avoir accueilli au Laboratoire de Génétique Moléculaire de l’Interaction Rhizobium–Légumineuse, pour avoir mis à ma disposition son savoir et le tout support technique. Elle n’a jamais hésité à me soutenir et m’accorder toutes les facilités pour mener à bien ce travail. Mes remerciements pour la lecture et la correction des publications, pour les remarques pertinentes qui ont permis d’enrichir ce manuscrit et pour toute son aide et sa disponibilité permanente qui n’ont jamais cessé malgré sa responsabilité et ses taches multiples. Qu’elle soit remerciée pour son énergie débordante et sa généreuse collaboration.
Je tiens à remercier et à exprimer ma sincère gratitude à Monsieur Mohamed ATER, Professeur de l’enseignement supérieur à la Faculté des Sciences de Tétouan, pour avoir accepté d’être rapporteur de mes travaux et pour l’honneur qu’il me fait en participant à ce jury.
Je remercie également Monsieur Mustapha ARAHOU, Professeur de l’enseignement supérieur à la Faculté des Sciences de Rabat, pour avoir aimablement accepté d’être rapporteur de mes travaux et de faire partie de ce jury et de juger la qualité de ce travail.
Je tiens particulièrement à remercier Monsieur Jamal AURAG, Professeur de l’enseignement supérieur à la Faculté des Sciences de Rabat, pour la rapidité avec laquelle il a lu mon manuscrit malgré son emploi très chargé. Je suis très reconnaissante pour l’intérêt qu’il a porté à mes travaux de recherche, pour son esprit scientifique, ses nombreux conseils et ses remarques pertinentes et réfléchies qui ont contribué à l’amélioration du manuscrit. C’est avec un grand plaisir de le voir siéger parmi les membres de jury. Qu’il trouve ici toute ma considération et ma reconnaissance.
Mes remerciements vont aussi à l’IRD (projet: 01/2 – MAR – 28 – 1), l’action intégrée Maroco–espagnole (n°152/P/03), et à l’agence espagnole de la coopération internationale (AECI) (Projets n A/6232/06 et A/014772/07) pour avoir soutenu financièrement ce travail.
Je remercie également Monsieur El Bekkay BERRAHO Professeur de l’enseignement supérieur à la faculté des Sciences de Rabat, qu’il veuille trouver ici l’expression de ma reconnaissance pour l’intérêt qu’il porte à mon travail en consacrant une partie de son temps à le juger.
Je tiens également à remercier Monsieur Miguel Angel CAVIEDES Professeur et Directeur du Laboratoire de Génétique Moléculaire de l’Interaction Rhizobium– Légumineuse à la Faculté de Pharmacie, Université de Séville, Espagne, qui m’a accueilli dans son laboratoire et m’a permis de travailler dans les meilleures conditions.
Mes sincères remerciements vont également à toute l’équipe du Laboratoire de Génétique Moléculaire de l’Interaction Rhizobium–Légumineuse à la Faculté de Pharmacie, Espagne, spécialement, Mohamed DARY pour son aide administrative et ses contributions.
J’adresse une pensée particulière à Kaoutar ELMOUNADI et Jamila GAMANE pour être de bonnes amies et pour l’aide qu’elles m’ont apporté dans les situations d’urgence et pour m’avoir remotivé dans les moments difficiles. Qu’elles soient assurées de ma profonde reconnaissance.
Je ne saurais terminer sans exprimer mon amitié loyale à mes collègues et amis(es) spécialement Siham BRHADA, Loubna TEMSAMANI, Salwa MOUSSAID, Farah AIT OUHMANE, Nargisse BENNANI, Nezha EL MLAIJI et Jamaleddine ELJAMALI, qui m’ont apporté leur aide et m’ont témoigné leur sympathie, sans oublier l’ambiance fraternelle qu’ils ont toujours su maintenir au sein du laboratoire. Qu’ils trouvent ici l’expression de ma sincère reconnaissance.
Mes vifs remerciements reviennent aussi à Ibtissam EL-HILALI, Amal BERKIA et Ibrahim KONATE qui ont toujours été là pour permettre une ambiance sereine de travail, pour leur soutien, leurs conseils et leur bonne humeur.
Mes remerciements s’adressent également à l’équipe du Laboratoire de Microbiologie et Biologie Moléculaire, Faculté des Sciences de Rabat, particulièrement Leila MEDRAOUI, Fatiha et Charki ZERIF, pour leur soutien et leur encouragement.
Les travaux réalisés au cours de cette thèse ont contribué aux publications et communications orales et affichées suivantes :
PUBLICATIONS
EL AAFI N, BRHADA F, DARY M, FILALI MALTOUF A, PAJUELO E, 2012, « Rhizostabilization of metals in soils using Lupinus luteus inoculated with the metal resistant rhizobacterium Serratia sp. MSMC541 », International Journal of Phytoremediation. 14: 261-74.
EL AAFI N, SAIDI N, FILALI MALTOUF A, PEREZ-PALACIOS P, DARY M, BRHADA F, PAJUELO E, 2015, « Prospecting metal-tolerant rhizobia for phytoremediation of mining soils from Morocco using Anthyllis vulneraria L.», Environmental Science Pollution Research International. 22: 4500–4512.
COMMUNICATIONS ORALES
N. EL AAFI, E. PAJUELO, M DARY, A J PALOMARES DIAZ, A FILALI MALTOUF & F. BRHADA, Novembre 2008, « Bioremédiation au niveau de sols miniers du Maroc », présenté dans le 4ème Congrès International de génétique et Biologie Moléculaire de
Biotechnologie. Ouarzazate – Maroc.
N. EL AAFI, E. PAJUELO, M DARY, A J PALOMARES DIAZ, A FILALI MALTOUF & F. BRHADA, Décembre 2008, « The potential of legumes – rhizobia symbioses in bioremediation of mining soils », 13ème congrès de l’Association Africane pour la Fixation
Biologique de l’Azote. Hammamet – Tunisia.
COMMUNICATIONS AFFICHEES
N. EL AAFI, N. SAIDI, A. FILALI MALTOUF, E. PAJUELO, M. DARY, AJ. PALOMARES DIAZ & F. BRHADA, Juillet 2006, « The potential of Anthyllis vulneraria rhizobia symbiosis in bioremediation of mining areas », 7ème Conférence Européenne de la
Fixation de l’azote, Université d’Aarhus – Danemark.
EL AAFI N., SAIDI N., FILALI MALTOUF A., PAJUELO E., DARY M., PALOMARES DIAZ AJ. & BRHADA F., Août 2007, «The potential of Anthyllis vulneraria and rhizospheric bacteria in bioremediation of mining soils», la conference internationale, Rhizosphere 2, Montpellier – France.
N. EL AAFI, F. BRHADA, M. DARY, A. FILALI MALTOUF, AJ. PALOMARES & E. PAJUELO, Septembre 2007, « Isolation and characterisation of Rhizobium resistant to arsenic and heavy metals from contaminated soils in Morocco », Congrès SEM-Seville XXI Microbiological National 2007, Université de Seville, Faculté de Pharmacie, Seville – Espagne.
N. EL AAFI, E. PAJUELO, M. DARY, AJ. PALOMARES DIAZ, A. FILALI MALTOUF & F. BRHADA, Mars 2008, « Characterisation of Lupinus rhizobia resistant to heavy metals : Potential in Bioremediation process of contaminated soils », Advanced Summer School on The Molecular and Cellular Basis of Infection. Hermanus – cape Town – South Africa.
B. DOUKKALI, F. PÉREZ-PANIAGUA, M. DARY, N. EL AAFI, F. BRHADA, A. FILALI MALTOUF, D. GAMANE, MA. CAVIEDES, AJ. PALOMARES & E. PAJUELO, Juin 2008, « Bacterial diversity of heavy metal contaminated soils », Congrès Luso-espagnole de la Fixation de l’azote, 12 National Reunion of SEFIN. Estoril – Portugal. N. EL AAFI, E. PAJUELO, M. DARY, AJ. PALOMARES DIAZ, A. FILALI MALTOUF & F. BRHADA, Décembre 2008, « The potential of legumes – rhizobia symbioses in bioremediation of mining soils », 13ème Congrès de l’Association Africane pour
la Fixation Biologique de l’Azote. Hammamet – Tunisia.
N. EL AAFI, E. PAJUELO, M. DARY, AJ. PALOMARES DIAZ, A. FILALI MALTOUF & F. BRHADA, Décembre 2009, « le potentiel des symbioses rhizobiums – légumineuses dans la bioremédiation des sols miniers au Maroc », Symposium international sur les Biotechnologies environnementales : potentialités et enjeux pour le Maroc, ENCG – El Jadida – Maroc.
PRIX REÇU
Prix du meilleur poster, Décembre 2008, 13ème Congrès de l’Association Africaine pour la
Ce travail vise l’exploration du potentiel de bioremédiation des
légumineuses et des rhizobactéries qui leur sont associées pour la
réhabilitation des sols du district minier de Midelt.
Nous avons isolé des souches rhizosphériques et nodulaires depuis les
racines d’Anthyllis poussant sur des substrats miniers. Leur tolérance
aux ETM (éléments traces métalliques) a montré une remarquable
résistance. L’analyse par PCR/RFLP de l’ADNr16S des souches
nodulaires a montré un niveau élevé de polymorphisme moléculaire.
Le séquençage de l’ADNr16S des souches représentatives suggère une
grande diversité de bactéries non-rhizobium qui colonisent les nodules
d’Anthyllis dans les sols contaminés.
Aussi, nous avons caractérisé la tolérance d’une souche MSMC541
isolée des nodosités racinaires du lupin, et nous l’avons utilisé dans un
essai de rhizoremédiation avec la plante Lupinus luteus. Les résultats
ont montré que l’inoculation avec cette souche améliore la tolérance de
la plante vis-à-vis des métaux testés et réduit significativement la
translocation du métal vers les parties aériennes. Ceci suggère que
Lupinus luteus et la souche Serratia sp. MSMC541 peuvent être des
candidats pour la phytostabilisation des sols miniers de Midelt.
Mots-clefs : Sols miniers ; Métaux lourds ; Bactéries du sol minier ;
Résistance aux métaux lourds ; Rhizoremédiation ;
Anthyllis vulneraria ; Lupinus luteus.
The aim of this work was exploring the bioremediation potential of
leguminous plants and the associated rhizobacteria in order to propose a
bioprocess to restore heavy metals contaminated soils of Midelt.
We have isolated rhizospheric and nodules strains from root of Anthyllis
vulneraria growing on contaminated soil substrates. The heavy metals
resistance of all bacteria has been evaluated. The bacteria showed great
heavy metals-tolerant abilities. Amplification and restriction analysis of
ribosomal 16S rDNA (ARDRA) and 16S ribosomal DNA (rDNA)
sequencing were used to assess biodiversity and phylogenetic position
among bacteria present in nodules. Our results suggest that a great
diversity of non-rhizobial bacteria colonize nodules of Anthyllis plants in
contaminated soils.
Also, phenotypic and molecular characterization of heavy metal tolerance
was made for the strain MSMC541 isolated from the root nodules of
lupine. A rhizoremediation pot experiment was conducted using Lupinus
luteus grown on sand supplemented with heavy metals. The results
showed that inoculation with MSMC541 improved the plant tolerance to
metals. At the same time, metal translocation to the shoot was
significantly reduced upon inoculation. These results suggest that Lupinus
luteus plants, inoculated with the metal resistant strain Serratia sp.
MSMC541, have a great potential for phytostabilization of metal
contaminated soils.
Key words : Contaminated soils ; Heavy metals ; Soil bacteria ; Heavy
metal resistance ; Rhizoremediation ; Anthyllis vulneraria ; Lupinus luteus.
16S rDNA DNA coding for ribosomal 16S RNA
AFLP Amplified fragment length polymorphism
ARDRA Amplified ribosomal DNA restriction analysis
ARNase Enzyme qui coupe l’ARN
Au Or
Be Beryllium
BET Bromure d’éthidium
BSA Sérum Albumine Bovine
CdCl2.7H2O Chlorure du cadmium
CTM Concentration maximale tolérable
CuSO4. 5H2O Sulfate de cuivre pentahydrique
dNTP Désoxyribonucléotides triphosphate
F Fluore
EDTA Acide éthylène-diamino-tétra-acétique
Ethylene-diamino tetraacetic acid
ETM Élement trace métallique
HgCl2 Chlorure mercurique
H2O2 Eau oxygénée
HNO3 Acide nitrique
ICP-MS Inducted coupled plasma mass spectrometry
Spectrométrie de masse à plasma couplé par induction
ICP–OES Couplage plasma induit par haute fréquence – spectrométrie optique
IP Index de Pollution
Kb Kilo base
LCO Oligosaccharide de Lipo-chitine
MO Matière organique
MMSB Moroccan Mine Symbiotic Bacteria
MMFB Moroccan Mine Free Bacteria
MSMC Moroccan Symbiotic Microorganisms Collection
MS Matière sèche
NaAsO2 Arsenate de sodium
Pb Paire de bases
Pb(NO3)2 Nitrate de plomb
PCR Réaction en chaine par polymérase
PGPR Plant growth-promoting rhizobactérie
pmol Picomole
PS Poids sec
RFLP Restriction fragment length polymorphism
Polymorphisme de la longueur des fragments de restriction
ROS Reactive oxygen species ou dérivés réactifs de l’oxygène
rpm Rotation par minute
Sb Antimoine
SDS Sodium dodecyl sulfate
Se Sélénium
Taq De « thermus aquaticus » (bactérie qui vit dans les sources chaudes) : Enzyme
TBE Tris – Borate – EDTA
Tr Tour
TE Tris – EDTA
TY Tryptone yeast extract
w/v Poids par volume
U Uranium
ZnSO4.7H2O Sulfate du zinc
Tableau 1. Les sources anthropiques de certains métaux lourds spécifiques
dans l'environnement ………... 9
Tableau 2. Les taux annuels des émissions……… 9
Tableau 3. Les métaux et les concentrations utilisés pour l’évaluation de la
résistance intrinsèque aux métaux des isolats………. 44
Tableau 4. Les sites de clivage de la séquence nucléotidique spécifique
reconnue par les cinq enzymes de restriction utilisées ………. 46 Tableau 5. Profils de restriction du gène ADNr 16S et génotypes des
souches isolées d’Anthyllis vulneraria déterminés par analyse PCR/RFLP… 59 Tableau 6. Les propriétés biochimiques des dix souches représentantes des
clusters……… 62
Tableau 7. Numéros d’accession, % d’identité et identification des séquences
nucléotidiques nouvellement déterminées……… 64
Tableau 8. CMT et bioaccumulation des ETM par les souches MMSB60
(Rhizobium radiobacter) et MMSB72 (Ensifer adhaerens)……… 70
Tableau 9. Concentrations en métaux testés pour la détermination de la
concentration de métal tolérable par la plante ……… 81
Tableau 10. Concentrations maximales tolérables (mM) des 3 souches
isolées du lupin et cultivées sur TY solide……… 84
Tableau 11. Effet des métaux (As, Cd, Cu, Pb, Zn) sur le temps de latence, le
temps de génération (G) et la DO à 600 nm……….. 88
Tableau12. Le facteur de translocation et le taux de l’accumulation des
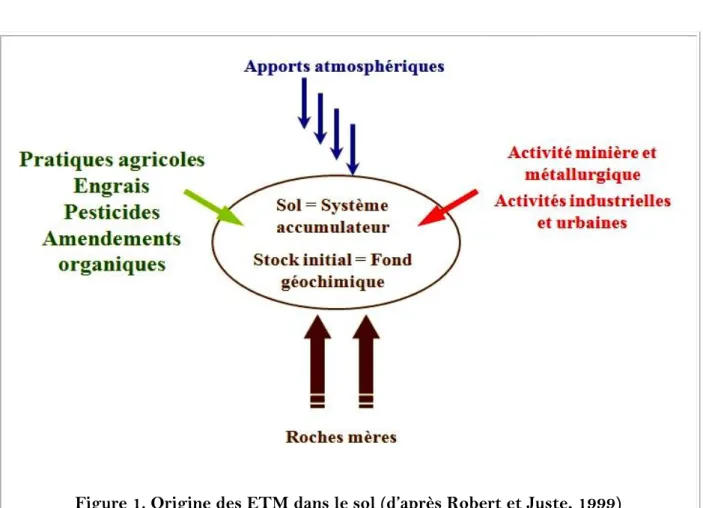
Figure 1. Origine des ETM dans le sol ………. 7
Figure 2. Exploitation à ciel ouvert à Riotinto, sud–ouest-Espagne……….. 17
Figure 3. Résidus miniers..………. 17
Figure 4. Les déchets miniers………. 18
Figure 5. Eaux acides ………... 18
Figure 6. Représentation schématique des différentes stratégies de phytoremédiation……….. 23
Figure 7. Schématisation des interactions entre les ETM et les bactéries………... 30
Figure 8. La structure de l’opéron ars chez Escherichia coli R773……… 34
Figure 9. Les différentes stratégies rencontrées chez les plantes en réponse à une augmentation des concentrations en métal dans le sol ……… 35
Figure 10. Résumé des mécanismes cellulaires connus potentiellement impliqués dans la détoxification des métaux et la tolérance des plantes……….. 37
Figure 11. Installations métallurgiques abandonnées……… 39
Figure12. Galeries abandonnées (la fonderie de Mibladen)……….. 39
Figure13. Les déchets et terrils abandonnés et l’absence de couvert végétal ….. 39
Figure14. Anthyllis vulneraria L………. 40
Figure15. Position des mines Aouli et Zeida et la fonderie de Mibladen………. 41
Figure 16. Protocole de détermination de la bioaccumulation des métaux par les bactéries………. 50
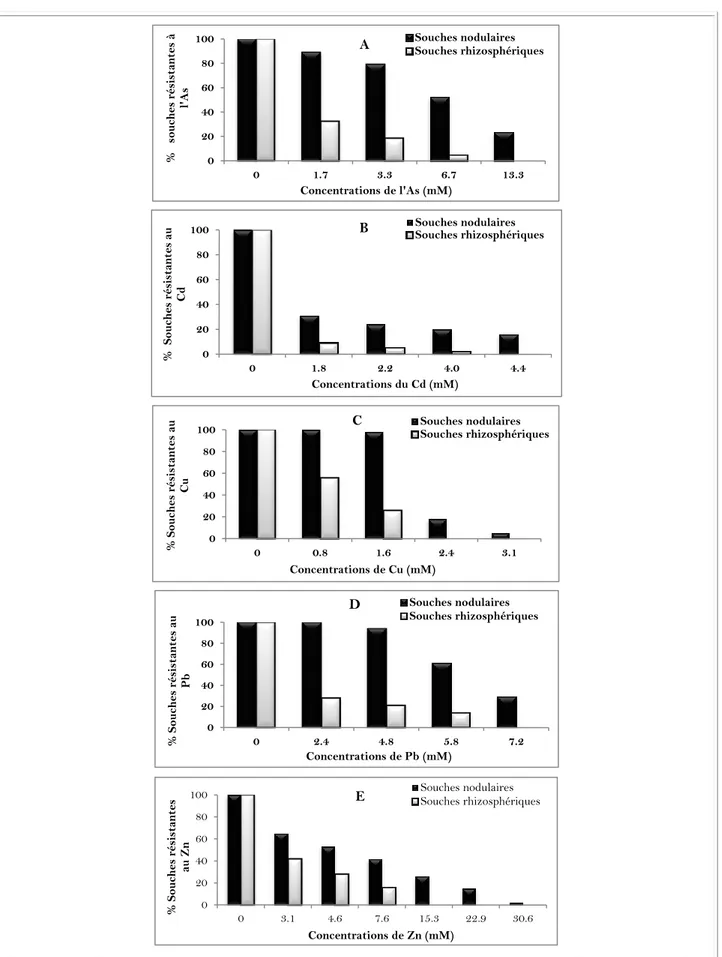
Figure 17. Pourcentage des souches rhizosphériques et des souches isolées à partir des nodosités d’Anthyllis vulneraria résistantes à l’As, au Cd, au Cu, au Pb et au Zn ………..……… 51
Figure 18. Extraction de l’ADN génomique par la méthode de la lyse alcaline…. 54 Figure 19. Profil de la bande de l’ADNr 16S de quelques souches isolées à partir des nodosités racinaires d’Anthyllis vulneraria ………... 54
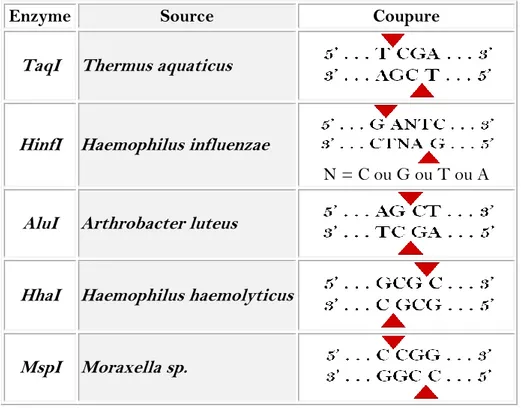
Figure 20. Profils électrophorètiques de restriction de l’ADNr 16S des souches isolées à partir des nodosités racinaires d’Anthyllis vulneraria après sa digestion par les endonucléases AluI, HhaI, HinfI, MspI, TaqI……… 56
Figure 21. Dendrogramme des souches isolées d’Anthyllis vulneraria basé sur l’analyse PCR/RFLP de l’ADNr 16S construit par le programme Gel Compare II 60 Figure 22. L’arbre phylogénétique construite sur la base des séquences Forward de l’ADNr 16S des souches tolérantes isolées à partir des nodosités racinaires d’Anthyllis par le programme EzTaxon ……… 66
Figure 23. Lupinus luteus L... 72
Figure 24. Protocole de l’étude de la croissance chez MSMC541 en présence de métaux……….... 75
Figure 25. Visualisation aux UV d’une migration électrophorètique sur un gel d’agarose de trois échantillons d’ADN génomique de la MSMC541 digérés respectivement par des enzymes de restriction BamHI, EcoRI, HindIII.……….. 77
Figure 26. méthode de transfert de l’ADN par capillarité sur une membrane nylon……… 78
Figure 27. Schéma représentant l’effet du stress métallique sur Lupinus luteus en absence et en présence de la souche MSMC541……….. 83
Figure 28. Effet de différentes concentrations en métaux sur la croissance de la souche MSMC541………. 87
Figure 30. (A). Autoradiographie obtenue après hybridation de l’ADN total de la souche MSMC541 avec la sonde radioactive de l’opéron de résistance à l’arsenic d’E. coli R773. (B). L’amplification par PCR du fragment correspondant à l’opéron de résistance à l’As de la souche MSMC541………. 93 Figure 31. Effet de la concentration de l’As (10–20ppm), le Cd (4–6ppm), le Cu (25–50ppm), le Pb (50–100ppm) et le Zn (100–200ppm) sur le poids sec de la partie aérienne (A) et la partie racinaire (B) de Lupinus luteus………. 95 Figure 32. Les effets nocifs du stress métallique observés au cours de la
croissance de Lupinus luteus……… 97
Figure 33. Effet de l’inoculation par MSMC541 sur le poids sec de la partie aérienne (A) et la partie racinaire (B) de Lupinus luteus cultivée en présence de
l’As, le Cd, le Cu, le Pb ou le Zn……….. 99
Figure 34. L’effet de l’inoculation par MSMC541 sur la croissance de Lupinus luteus cultivée en présence de 20ppm de l’As. (A) Lupinus luteus non inoculée
(B) Lupinus luteus inoculée………. 101
Figure 35. Effet de l’inoculation par MSMC541 sur l’accumulation des ETM dans la partie aérienne (A) et la partie racinaire (B) de Lupinus luteus cultivée en présence de l’As, le Cd, le Cu, le Pb ou le Zn………... 102
Résumé Abstract Dédicace Remerciements Avant propos Sigles et abréviations Liste des Figures Liste des Tableaux
Introduction générale ……… 1
Chapitre I : Revue de la littérature
I. Généralités sur les métaux lourds………. 5I.1. Définition des métaux lourds ………. 5
I.2. L’origine des ETM……… 6
I.2.1. Les sources naturelles……….……….. 6
I.2.2. Les sources anthropiques ………. 8
I.3. Principaux ETM étudiés : origine et toxicité... 10
I.3.1. L’arsenic……….. 10
I.3.2. Le cadmium………. 11
I.3.3. Le cuivre……….. 13
I.3.4. Le plomb……….. 14
I.3.5. Le zinc……….. 15
II. L’exploitation minière : les mines actives, les mines abandonnées et les sols contaminés par les ETM………. 17
II.1. Problématique ………. 17
II.2. Impact des ETM sur l’environnement……….. 19
II.2.1. Impact sur le sol ………... 19
II.2.2. Impact sur la microflore du sol……… 19
II.2.3. Impact sur la végétation……….. 20
III. Les technologies de réhabilitation des sols contaminés par les ETM ………….. 21
III.1. Les méthodes conventionnelles……… 21
III.1.1. Les techniques physico–chimiques ……….. 21
III.1.2. Les techniques thermiques ……… 21
III.1.3. Les techniques de confinement et d’encapsulation……… 21
III.2. Les méthodes biologiques ……….... 22
III.2.1. La phytoremédiation ………. 22 III.2.1.1. La phytostabilisation ………. 24 III.2.1.2. La phytoextraction……….. 24 III.2.1.3. La phytodégradation ……….. 25 III.2.1.4. La phytovolatilisation ……… 25 III.2.1.5. La phytostimulation ……… 25
III.2.1.6. La rhizofiltration (rhizodégradation)……….. 26
III.2.2. La bioremédiation ……….. 26
III.2.2.1. L’atténuation naturelle ……… 26
III.2.2.2. La bioaugmentation………. 26
III.2.2.3. La biostimulation………. 27
III.2.2.4. Le traitement biologique par aération de sol (ou bioventing)……….. 27
III.2.2.5. Le traitement des sols par injection d’eau oxygénée……… 27
III.2.2.7. Le compostage……….. 28
III.2.2.8. Le biotertre……… 28
III.2.2.9. L’épandage contrôlé (ou landfarming)……….. 29
III.2.2.10. La technique des zones humides ou « lagunage »………. 29
IV. Mécanismes de résistance aux ETM impliqués chez les bactéries……… 30
IV.1. La bioaccumulation ……… 31
IV.2. La complexation ………. 31
IV.3. La précipitation………... 32
IV.4. La Conversion enzymatique……….. 32
IV.5. Les systèmes d’efflux……….. 33
IV.6. Les systèmes intégrés………... 33
V. Les stratégies d’adaptation et de tolérance des plantes ……… 35
Chapitre II :
Caractérisation des bactéries nodulaires d'
Anthyllis
vulneraria
poussant dans des sols contaminés par les ETM
Introduction ……….. 38I. Présentation de la région d’étude………... 41
II. Matériel et méthodes ………. 42
II.1. Collection de souches bactériennes ……… 42
II.1.1. Isolement et purification des bactéries à partir des nodosités racinaires d’Anthyllis vulneraria ……….. 42
II.1.2. Isolement et purification des souches à partir de la rhizosphère des plantes………. 42
II.2. Résistance intrinsèque des souches rhizosphériques et des souches nodulaires aux ETM………. 43
II.3. Etude phylogénétique par PCR/RFLP de l’ADNr16S des souches nodulaires… 44 II.3.1. Extraction de l’ADN ………. 44
II.3.2. Amplification de l’ADNr 16S par PCR……… 45
II.3.3. Digestion enzymatique des amplifiats par les enzymes de restriction (RFLP) 46 II.4. Caractérisation biochimique des souches représentatives des clusters………... 47
II.5. Séquençage de l’ADNr 16S des souches représentatives des clusters……….….. 47
II.6. Bioaccumulation des ETM par les souches résistantes………. 49
III. Résultats et discussion ……….. 52
III.1. Résistance intrinsèque des souches rhizosphériques et des souches nodulaires 52 III.2. Analyse par PCR/RFLP de l’ADNr16S des souches isolées à partir des nodosités racinaires d’Anthyllis vulneraria……….. 54
III.2.1. Qualité de l’ADN……….. 54
III.2.2. Amplification par PCR de l’ADNr 16S………. 54
III.2.3. Analyse de la digestion enzymatique du gène ADNr 16s……….. 55
III.2.4. Ribotypes déterminés par PCR/RFLP de l’ADNr 16S……….. 57
III.2.5. Groupements phylogénétiques établis par le programme Gel compare II…. 59 III.3. Caractérisation biochimique des souches résistantes représentatives des clusters ………... 61
III.4. Analyse des séquences du gène ADNr 16S et identification des souches…….. 63
III.5. Bioaccumulation des ETM par les souches résistantes………... 69
Chapitre III : Etude de potentialités de bioremédiation d’une souche
métallo-résistante en association avec
Lupinus luteus
………
Introduction………... 71I. Matériels et méthodes ……….. 73
I.1. Souches bactériennes………. 73
I.2. Résistance intrinsèque aux ETM………. 73
I.3. Séquençage de l’ADNr 16S de la souche MSMC541……… 74
I.4. Effet des ETM sur la cinétique de croissance de MSMC541……… 74
I.5. Bioaccumulation des ETM par la souche MSMC541 ………. 76
I.6. Détection de gènes de résistance à l’arsenic………. 76
I.6.1. Southern blot et hybridation ……… 76
I.6.1.1. Digestion de l’ADN……….. 76
I.6.1.2. Transfert de l’ADN……….. 77
I.6.1.3. Marquage de la sonde……….. 78
I.6.1.4. Hybridation ……….. 79
I.6.2. Amplification du gène de résistance de l’As de la souche MSMC541………… 79
I.7. Essai de rhizoremédiation ……… 80
I.7.1. Germination aseptique des graines ………. 80
I.7.2. Détermination de la concentration de métal tolérable par la plante…………. 81
I.7.3. Essai et conditions de culture ……….. 81
I.7.4. Analyses statistiques des résultats ……….. 83
II. Résultats et discussion………. 84
II.1. Test de tolérance aux ETM ……….... 84
II.2. Identification de la souche MSMC541 par séquençage……….. 85
II.3. Effet des métaux sur la cinétique de croissance de MSMC541 ……… 86
II.4. Potentiel de Bioaccumulation des ETM par la souche MSMC541………... 90
II.5. Caractérisation moléculaire de la résistance à l’arsenic de la souche MSMC541………. 92
II.6. Essai de rhizoremédiation ………... 94
II.6.1. Effet de la concentration des ETM sur la Biomasse de Lupinus luteus………. 94
II.6.2.Effet de l’inoculation avec la souche MSMC541 sur la biomasse de la plante Lupinus luteus cultivée en présence des ETM ……… 98
II.6.3. L’effet de l’inoculation avec la souche MSMC541 sur l’accumulation des ETM dans les parties aériennes et racinaires de Lupinus luteus ………. 101
Conclusion générale et perspectives………... 106
Références bibliographiques……… 110
Annexe ……….... 126 Publications
Article 1: Prospecting metal-tolerant rhizobia for phytoremediation of mining soils from Morocco using Anthyllis vulneraria L.
Article 2: Rhizostabilization of metals in soils using Lupinus luteus inoculated with the metal resistant rhizobacterium Serratia sp. MSMC541
Au fil des siècles, les activités anthropiques telles que les procédés métallurgiques, la combustion de combustibles fossiles, la production industrielle, les activités agricoles et l'exploitation minière, ont entraîné une élévation des teneurs en métaux lourds et donc une vaste contamination qui menace le bien-être de l'environnement mondial d'aujourd'hui. L'industrie minière est parmi les principaux contributeurs qui a conduit à un fort accroissement de la pollution métallique des terres, des rivières et de l'air dans de nombreuses parties du monde (Wuana and Okieimen, 2011 ; Akpor et al., 2014 ; Cinnirella et al., 2014). Cette contamination métallique, et particulièrement celle des sols, est devenue un problème majeur et préoccupant, en terme de risques pour la santé humaine et environnementale (Cinnirella et al., 2014). En effet, les métaux lourds, sont des composés stables, non dégradables et donc hautement persistants, ils peuvent avoir des répercussions négatives sur le comportement des organismes vivants présents sur le site ou dans les zones environnantes. A compter d’une certaine concentration même les oligoélements tels que le Zn, le Cu…deviennent toxiques pour la vie animale et végétale (Young, 1992), même à l’échelle microscopique, les métaux lourds ont des effets néfastes sur les populations bactériennes, ils conduisent à l’élimination directe de nombreuses espèces sensibles, à l’implantation de nouvelles espèces et éventuellement à une diminution de la diversité biologique (Amaral Zettler et al., 2002). Les métaux lourds peuvent également être accumulés ou transférés vers les nappes souterraines et vers la chaîne trophique entraînant de sérieux problèmes écologiques et de santé publique (DeForest et al., 2007).
Le Maroc ne fait pas exception aux effets néfastes de l'exploitation minière. Les mines à travers le pays, qu'elles soient actives ou à l'abandon, sont devenues une source persistante de contamination par les métaux lourds. Le district plombifère de Midelt, situé dans le bassin de la haute Moulouya, est l'un des exemples des zones minières qui ont été exploitées dans les années soixante dix et désormais, délaissés sans aucune procédure de réhabilitation. Le district abandonné a déjà été reconnu dans des études antérieures comme étant très pollué et les déchets du district sont soupçonnés d'être la source probable de la contamination métallique des zones environnantes (Saidi et al., 2002 ; El Hachimi et al., 2005). Sa réhabilitation paraît donc essentielle et ce afin de limiter l’impact des métaux lourds et de faire disparaître les nuisances et les risques vis à vis de l’environnement, ou au moins les faire baisser en dessous d’un niveau
maximum acceptable. Pour cela, il existe des techniques conventionnelles de dépollution qui font appel aux procédés physico-chimiques et thermiques. Elles sont efficaces pour certains types de contaminants mais elles sont très onéreuses et très lourdes à mettre en œuvre car elles nécessitent l’excavation des sols, le transport, et le lavage. De plus, ces procédés génèrent des déchets à enfouir en décharges classées et laissent en général un sol stérile et occasionnent un très fort impact environnemental. Par ailleurs, d’autres techniques de dépollution innovantes appelées bioremédiation ont été envisagées. Elles présentent l’avantage d’être moins onéreuses et plus écologiques faisant appel à des procédés biologiques qui peuvent impliquer des micro–organismes (Gaur et al., 2014). En effet, de nombreux travaux de recherche démontrent les capacités dépolluantes de certains microorganismes. Ils sont capables de fixer, d’accumuler voire de transformer le métal le rendant moins mobile et moins biodisponible pour la faune et la flore (Garbisu and Alkorta, 2003 ; Gadd, 2010 ; Ahemad, 2012).
D’autres techniques par contre font appel à des plantes on parle alors de la phytoremédiation (Vangrosveld et al., 2009 ; Ali et al., 2013). Elle consiste à utiliser des plantes pour réduire le niveau de pollution présent dans le sol. Plusieurs approches peuvent être envisagées, entre autres la phytoextraction qui consiste en l’utilisation de plantes hyperaccumulatrices ayant la capacité d’accumuler de fortes teneurs en métaux lourds (1% - 2%) dans leurs parties aériennes (Pilon-Smits, 2005 ; Callahan et al., 2006). Toute-fois, pour une phytoextraction réussie, les plantes idéales devraient non seulement avoir une forte capacité d’accumulation mais aussi produire une forte biomasse, avoir une vitesse de croissance élevée, et être tolérantes aux concentrations métalliques du sol. Pourtant, aucune plante hyperaccumulatrice ne présente l’ensemble de ces caractéristiques, ce qui limite l'utilisation des plantes hyperaccumulatrices pour la décontamination des sols contaminés par les métaux lourds. Aussi, un autre inconvénient de la phytoextraction est le temps de décontamination qui peut parfois atteindre plusieurs dizaines d’années (McGrath et al., 2002 ; McIntyre, 2003). L’alternative est la phytostabilisation qui consiste à utiliser certaines plantes tolérantes à des teneurs en métaux lourds et non hyperaccumulatrices afin de contribuer à la stabilisation des déchets miniers et éventuellement de limiter l’érosion et de réduire la mobilité des métaux lourds et par conséquent d’éviter leur passage dans la chaine alimentaire (Mendez and Maier, 2008).
Evidement, la rhizosphère qui est une interface importante entre le sol et les plantes joue un rôle important dans l’amélioration du processus de la phytoremédiation, spécialement les rhizobactéries promotrices de la croissance des plantes ou PGPR. En effet, elles affectent la mobilité des métaux lourds et leur disponibilité vis-à-vis des plantes par la libération d'agents chélateurs, l'acidification, la solubilisation du phosphate et des changements redox (Lasat, 2002 ; Glick 2012 ; de Bashan et al., 2012). Aussi, elles exercent une influence importante sur la croissance et le rendement des plantes par la production de phytohormones lorsqu’elles sont cultivées sur des milieux hostiles comme les sites miniers. De plus, elles produisent des enzymes permettant de résister à plusieurs stress (Glick, 2012 ; Gontia-Mishra et al., 2014). En ce sens, la rhizoremédiation a été proposée comme une nouvelle technique en émergence pour la décontamination des sols contaminés par les métaux lourds faisant intervenir les plantes, les rhizobactéries et leur interaction (Glick, 2003 ; Abou-Shanab et al, 2003). En particulier, l'utilisation de l’interaction symbiotique Rhizobium – légumineuses tolérants devrait fournir une grande efficacité pour la phytoremédiation (Sriprang et al, 2002 ; Kuiper et al, 2003 ; Carrasco et al, 2005 ; Ike et al, 2007) et également fournir des composés azotés dans le sol participant ainsi à un enrichissement du sol suite à la fixation biologique de l’azote dans les nodules des légumineuses (Vance and Lamb, 2001). Dans ce contexte, l’objectif global de cette thèse est de proposer un bioprocédé visant la décontamination progressive et l’arrêt de la dissémination des métaux lourds à partir de sites miniers désaffectés au Maroc. Pour y parvenir trois moyens seront proposés :
Une bioremédiation par décontamination en exploitant le potentiel de décontamination de la microflore bactérienne issue de sols contaminés par les métaux lourds ;
Une rhizoremédiation en utilisant des plantes légumineuses et des bactéries
Rhizobium ou rhizosphériques tolérantes aux métaux lourds.
Pour envisager ces applications, dans un premier temps, nous nous sommes intéressés à l’isolement, la purification, la culture des bactéries tolérant des conditions extrêmes à partir des sols de l’ancien district minier de Midelt. L’isolement des bactéries a été fait
depuis la rhizosphère et les nodosités racinaires d’une légumineuse métallicole Anthyllis
vulneraria cultivée sur des échantillons de sol prélevés dans ces sites miniers.
Nous avons procédé à une caractérisation physiologique des isolats via des tests de tolérance aux métaux lourds pour déterminer leur potentiel de bioremédiation et une caractérisation moléculaire par analyse PCR/RFLP pour étudier leur diversité génétique.
Dans un deuxième temps, et dans une vision de rhizoremédiation, nous avons envisagé d’étudier les potentialités d’utilisation d’une souche multirésistante en association avec une plante symbiotique Lupinus luteus pour la restauration des sols des sites miniers contaminées par les ETM. Pour y parvenir une étude de tolérance aux métaux lourds a été effectuée sur trois souches isolées des nodosités racinaires du lupin provenant d’un site non contaminé. De même, une caractérisation phénotypique et moléculaire a été réalisée pour la souche la plus résistante, MSMC541, pour déterminer ses potentiels de croissance et de bioaccumulation et détecter les mécanismes impliqués dans cette tolérance. Enfin, un essai de rhizoremédiation en chambre de culture a été effectué pour examiner les potentialités d’utilisation de la souche multirésistante en association avec la légumineuse Lupinus luteus.
I. Généralités sur les métaux lourds
I.1. Définition des métaux lourds
Appelé aussi, éléments toxiques, métaux en traces ou encore éléments traces métalliques (ETM), les définitions des métaux lourds sont multiples et dépendent du contexte dans lequel on se situe.
Du point de vue chimique, les métaux sont les éléments de la classification périodique formant des cations en solution.
Du point de vue physique, les métaux lourds sont définis comme étant des éléments métalliques naturels, métaux ou dans certains cas métalloïdes (arsenic) provenant le plus souvent d'un minerai ou d'un autre métal, ayant une masse volumique élevée, supérieure à 5g/cm3 (Minear and Keith, 1982). Cependant, certains métaux lourds, tel que le Zinc,
présentent une masse volumique relativement faible, inférieure à 5g/cm3 (Miquel, 2001).
Du point de vue science de la terre, les métaux lourds sont les éléments traces qui se présentent dans tous les compartiments de l’environnement mais en très faibles concentrations (inférieure à 0,1%). On connait soixante-huit éléments métalliques parmi quatre – vingt composants qui présentent une concentration dans la croûte terrestre qui ne dépasse pas 0,1% pour chacun d’eux (Cambier and Mench, 1998). Ils sont présents en traces d’où l’appellation éléments traces. Et se trouvent dans le sol sous forme d’ions libres ou de complexes solubles ou insolubles. L’ensemble de ces métaux constitue les métaux totaux du sol. Généralement, les métaux sont peu mobiles, mais ils se transportent, changent de forme chimique et ne se biodégradent pas. En conséquence, ils persistent longtemps dans les sols et s’y accumulent parfois jusqu’à représenter un important pourcentage du sol (Friendland, 1990).
Du point de vue science de la vie, les métaux lourds se trouvent par définition en concentration inférieure à 100 mg/Kg de matière sèche dans les organismes vivants, végétaux ou animaux, non affectés par des carences ou des toxicités (Nieboer and Richardson, 1980 ; Coïc and Coppenet, 1989 ; Loué, 1993). Ainsi, on distingue deux catégories de métaux en fonction de leurs effets physiologiques et toxiques : les métaux essentiels tels que le calcium, le cobalt, le cuivre, le fer, le potassium, le magnésium, le manganèse, le nickel et le zinc. Ils jouent un rôle biologique important et servent comme des micronutriments, des cofacteurs d’enzymes, des biocatalyseurs ou encore des constituants de
molécules comme l’hémoglobine. Ce sont des oligo-éléments essentiels et nécessaires à de faibles doses. En quantité insuffisante, ils peuvent entraîner des carences qui provoquent des maladies (Nies, 1999 ; Bruins et al., 2000). Le deuxième type sont les métaux toxiques qui par contre n’ont aucun rôle biologique et sont non essentiels et éventuellement toxiques (plomb, cadmium, mercure, …) d’où l’appellation éléments toxiques. En effet, souvent la notion de métaux lourds est associée aux notions de pollution et de toxicité. Ainsi, les métaux lourds sont des éléments métalliques potentiellement toxiques à des teneurs élevées pour les systèmes biologiques (Dudka and Miller, 1999 ; Wilkinson et al., 2001). Cependant, même les métaux essentiels peuvent s’avérer toxiques pour diverses formes de vie, à des teneurs plus élevées. Ils ont la propriété de s’intégrer et de s’accumuler dans la chaîne alimentaire, et ainsi de devenir toxique pour l’homme, consommateur final (Hu, 2000 ; Ibrahim et al., 2006).
I.2. L’origine des ETM
Les ETM sont des éléments naturellement présents dans les roches et les sols. Leur présence dans les milieux tels que l’air ou l’eau, résulte des processus naturels mais aussi des activités humaines qui les utilisent pour leurs propriétés particulières ou les rejettent indirectement dans l’environnement (Figure 1).
I.2.1. Les sources naturelles
La plupart des ETM sont présents naturellement dans les roches et les sols. Leur altération naturelle, surtout lors de la pédogenèse, sous l’influence des processus physiques, chimiques et biologiques, entraîne la libération des ETM dans les sols, les lacs et les rivières et l’air (Järup, 2003 ; Mohamed et al., 2011 ; Wuana and Okieimen, 2011). Aussi, les apports aériens dont se trouvent des particules très fines d’origine naturelle, c’est le cas des poussières libérées dans l’atmosphère par l’activité des volcans, des embruns maritimes. On pourrait y ajouter les poussières et les fragments de météorites très riches en métaux lourds. Ces apports se déposent soit sur les plantes qui peuvent les absorber soit pénétrer dans les sols à partir de leur surface (Baize, 1997). Parmi les autres sources naturelles, on peut citer la décomposition des végétaux et des détritus animaux, l'érosion par le vent, la fumée des incendies de forêt, les exsudats végétaux, les pulvérisations océaniques et l’activité des sources thermales (Galloway et al., 1982 ; Schulz and Schulz, 2000).
I.2.2. Les sources anthropiques
Une quantité importante des ETM est introduite dans l’environnement par l’intermédiaire des sources anthropiques (Mohamed et al., 2011 ; Wuana and Okieimen, 2011). Par ses diverses activités (Tableau 1) l’homme modifie les cycles biogéochimiques des métaux en faisant varier leurs flux naturels entre les compartiments et en transformant leur forme physico-chimique. Parmi les sources anthropiques, on trouve l’exploitation minière qui est l’un des premiers contributeurs qui a conduit à un accroissement de la pollution par les ETM. En fait, elle génère des résidus de minerais, sous forme de fragments finement moulus ou de particules résiduelles qui se transportent par le vent ou par l’eau. Ils contaminent ainsi les sols environnants et les sols alluviaux en aval. L’altération de ces fragments libère des ions métalliques dans le sol, qui, sous cette forme, deviennent potentiellement bio-disponibles (Mansor, 2008).
D’autres sources anthropiques sont les industries, principalement métallurgiques, pétrochimiques et électroniques (Tableau 1). Elles émettent de nombreux types de produits polluants, de poussières et des aérosols, résidus de processus de transformation, notamment des processus de combustion incomplète ou de refonte de matériaux utilisés. Aussi, l'introduction de technologies à haute température dans les processus de fusion et de la combustion de combustibles fossiles (charbon, fuels…) a augmenté considérablement le taux de libération pour certains métaux qui sont susceptibles de parcourir des centaines, voir des milliers de kilomètres à partir de leur source (Mansor, 2008).
Une autre source de pollution par les ETM, les amendements agricoles incluant les engrais organiques, les pesticides et les fertilisants en oligo-éléments (cuivre, zinc, manganèse…), les fumiers, les lisiers, les épandages divers, les boues de stations d’épuration, les composts urbains, les produits de traitement phytosanitaires (sels de cuivre, arséniate de plomb), etc. Ils apportent des métaux dans des sols qui en contiennent déjà. Même si les additions à l’origine ne sont pas à des concentrations suffisamment élevées pour être toxiques, les seuils critiques peuvent être atteints avec les applications répétées (Saidi, 2004).
Les processus naturels ne conduisent que rarement à des concentrations élevées des ETM dans l'environnement contrairement aux apports anthropiques qui s’ajoutent aux apports naturels et font augmenter d’autant les concentrations dans les sols, les eaux et l’air (Tableau 2) (Galloway et al., 1982). Leur forme chimique est souvent plus disponible pour les êtres vivants que celle des éléments d’origine naturelle. Ils présentent donc, plus de risque pour les écosystèmes (Tremel-Schaud and Feix, 2005).
Tableau 1. Les sources anthropogéniques de certains métaux lourds spécifiques dans l'environnement (Ali et al., 2013)
ETM Sources Références
As Pesticides, préservation du bois Thangavel and Subbhuraam (2004)
Cd Peinture, pigments, stabilisateurs plastiques, incinération de matières plastiques contenant du cadmium, engrais phosphatés…
Salem et al. (2000) ; Pulford and Watson (2003)
Cr Tanneries, industries de l'acier, cendres… Khan et al. (2007)
Cu Pesticides, engrais… Khan et al. (2007)
Hg Libération à partir de l’exploitation minière Au-Ag, la combustion du charbon, les déchets médicaux… Memon et al. (2001) ; Wuana and Okieimen (2011) ; Rodrigues et al. (2012)
Ni Les effluents industriels, les appareils de cuisine, les instruments chirurgicaux, les alliages d'acier, les
automobiles, les batteries… Tariq et al. (2006)
Pb Émission aérienne de la combustion des combustibles au plomb, fabrication des batteries, herbicides et insecticides… Thangavel and Subbhuraam (2004) ; Wuana and Okieimen (2011)
Tableau 2. Les taux annuels des émissions (Galloway et al., 1982)
Métaux Emissions (108 g/an) Naturels Anthropiques Antimoine (Sb) 9,8 380 Arsenic (As) 28 780 Cadmium (Cd) 2,9 55 Chrome (Cr) 580 940 Cobalt (Co) 70 44 Cuivre (Cu) 190 2600 Plomb (Pb) 59 20 000 Manganèse (Mn) 6100 3200 Mercure (Hg) 0,40 110 Molybdène (Mo) 11 510 Nickel (Ni) 280 980 Sélenium (Se) 4,1 140 Argent (Ag) 0,6 50 Vanadium (V) 650 2100 Zinc (Zn) 360 8400
Note: Emissions naturelles = Sol + poussières volcaniques
I.3. Principaux ETM étudiés: origine et toxicité
Les éléments traces sélectionnés pour ce travail sont parmi les polluants métalliques les plus fréquemment rencontrés dans les sols contaminés et étudiés.
I.3.1. L’arsenic
C’est un élément ubiquiste et quasi universel que l’on trouve dans chacun des réservoirs de l’environnement : roches, sols, atmosphère, hydrosphère et biosphère. C’est le 51ème en terme
d’abondance dans la couche terrestre (Dictor et al., 2004) où sa teneur moyenne est de 1,5 à 3 mg/kg (Leonard, 1991). Néanmoins certains charbons peuvent atteindre des taux allant jusqu’à 1500 mg/kg (Piver, 1983).
a- Origine
Il existe plusieurs sources de contamination par l’arsenic :
L’agriculture : On le retrouve dans certains sols agricoles suite à des traitements antifongiques pour les semences et l’application d’insecticides sur les cultures, notamment en viticulture et arboriculture (Tremel-Schaud and Feix, 2005).
L’industrie en particulier l’industrie minière et métallurgique de cuivre, de plomb, de zinc et de l’or, rejette des quantités notables d’arsenic dans la nature. Aussi, l’arsenic et ses dérivés sont employés dans le traitement du bois sous pression, la fabrication d’émail et de céramique en verrerie, le durcissement des alliages de cuivre et de plomb en métallurgie. L’arsenic peut être utilisé aussi dans les feux d’artifice, les micropuces et les éléments photoélectriques dans l’industrie de l’électronique où l’arséniure de gallium représente un nouveau semi-conducteur très prometteur (Tremel-Schaud and Feix, 2005).
Les mines : L’arsenic est naturellement présent dans les roches et les minerais d’arsenic et les minerais d’autres métaux comme le Fer, le Cu, l’Ag, l’Au, le Zn, le Cd, le Hg, l’U, le Sn, le Pb, le Se, le Ni, le Co (Boyle and Jonasson, 1973 ; Criddle and Stanley, 1993 ; Fournier, 2004). Pendant l’extraction minière de ces éléments, l’arsenic est mobilisé sous forme gazeuse ou solide en tant que produit secondaire et peut entrer dans un autre compartiment de l’environnement. Même sur les sols où les activités ont cessé, l’érosion éolienne et hydrique des roches, des minerais et des résidus miniers, le lessivage de gisements et de déblais abandonnés contenant l’arsenic, font que la pollution perdure.
b- Toxicité
L’arsenic est l’un des composés les plus toxiques puisqu’il occupe la première position dans la liste des éléments toxiques élaborés par l’agence des substances toxiques (Agency for Toxic Substances and Disease Registry) (ASTDR), sur la base de sa prévalence dans les sites pollués et de sa toxicité potentielle élevée pour l’homme du fait qu’il est facilement absorbé par la voie digestive. La toxicité de l’arsenic dépend de sa nature chimique : l'arsenic inorganique (pure ou quand il est lié à l’oxygène, au chlore ou au soufre) est beaucoup plus toxique que l'arsenic organique (quand il est chimiquement lié au carbone ou à l'hydrogène). L’exposition chronique à l’arsenic entraîne des troubles cutanés à type d’hyperkératose palmaire et plantaire et de pigmentation noirâtre des plantes de pieds (maladie des pieds noirs). L’arsenic est aussi classifié comme une substance cancérigène pour l’homme (Tremel-Schaud and Feix, 2005).
Chez les plantes, l’arsenic est phytotoxique, l’ion arsénite étant plus phytotoxique que l’ion arséniate (Oremland and Stolz, 2003). Ce dernier est un analogue chimique du phosphate, et il est incorporé dans les cellules racinaires à travers les transporteurs de phosphate (Zhao et al., 2009). Une fois à l'intérieur, l'arséniate peut inhiber la phosphorylation au niveau des membranes mitochondriales (Finnegan and Chen, 2012). A des concentrations élevées, l’As réduit la photosynthèse et le rendement des cultures en influençant la capacité reproductive de la plante et la production du fruit (Garg and Singla, 2011). Aussi, il s’accumule dans les parties racinaires et foliaires (Bergquist and Greger, 2012).
I.3.2. Le cadmium
Le cadmium est un métal relativement rare dans la croûte terrestre (0,2 mg/kg), 67ème
élément par ordre d’abondance dans la lithosphère. C’est un élément naturel présent dans certains minerais sous forme d’impuretés. Il ne se trouve pas à l’état élémentaire dans la nature ; il est généralement présent dans des minerais de zinc ou de plomb. Il peut se constituer suite à une altération et une érosion des roches cadmifères et constituer également un produit de raffinage d’autres métaux tel que le Cu, le Pb et le Zn.
La concentration normale en cadmium dans l’air et dans l’eau est de 0,001µg/m3 et 1µg/l
respectivement (Haguenoer and Furon, 1981). Dans les sols, la concentration en cadmium est de 0,1 à 11ppm selon qu’il dérive des roches éruptives, métamorphiques ou sédimentaires (Weissenhorn, 1994).
a- Origine
Le cadmium est introduit dans l’environnement à partir des sources naturelles par libération d’une grande partie du cadmium dans les rivières lors de l'usure de la roche ou par sa libération lors des feux de forêts.
En plus des apports naturels, les apports anthropiques de cadmium dans les sols sont importants (Wuana and Okieimen, 2011). Il est très utilisé en électronique suite à sa forte résistance contre la corrosion et son apparence brillante. Il est utilisé dans l’industrie des automobiles, des avions, des navires, dans le domaine des constructions et des moyens de communications…etc. Les sulfures de cadmium sont utilisés comme colorants dans les diverses industries : plastiques, céramique, peintures et textiles. Le cadmium est aussi un produit de base dans l’industrie des batteries grâce à sa parfaite réversibilité lors des réactions électrochimiques sur un large intervalle de température, sa faible vitesse d’autodécharge et sa récupération facile à partir des batteries usées. Aussi dans l’industrie minière de plomb et de zinc, car les teneurs en cadmium sont élevées dans les sols de surface voisins de mines de plomb et de zinc et plus particulièrement près des fonderies (Valerio et al., 1995). Aussi, on peut trouver le cadmium dans les sols agricoles suite à des traitements par des engrais phosphatés (Tremel-Schaud and Feix, 2005).
b- Toxicité
Le cadmium occupe la septième position dans la liste des substances toxiques (ASTRD, 2012). Le cadmium n’est essentiel pour aucune fonction biologique et a une toxicité élevée pour l’homme (Perronnet et al., 2000 ; ASTDR, 2012), l’exposition chronique excessive au cadmium peut entrainer une insuffisance rénale, une pathologie osseuse (Itaï Itaï, décrit au Japon), voire favoriser une hypertension artérielle. Le cadmium est bioaccumulable et répertorié comme toxique, il est considéré comme cancérigène pour l’homme et il présente des effets génotoxiques (ASTDR, 2012).
Il est assez mobile et facilement disponible, il risque soit de passer dans la chaîne alimentaire par l’intermédiaire des végétaux pour lesquelles il présente une forte phytodisponibilité, il peut s’accumuler dans les racines ou les parties aériennes (Grant et al., 1998), comme il peut migrer en profondeur pour aller contaminer les nappes phréatiques (Jacobs and Foreman, 2005).
I.3.3. Le cuivre
Le cuivre est assez fréquemment retrouvé dans la nature, par exemple sous forme de chalcopyrite. Ses caractéristiques chimiques n’autorisent cependant pas l’existence de fortes concentrations dans les eaux naturelles. La composition moyenne de la croûte terrestre en cuivre serait comprise entre 45 et 70 mg/kg selon les auteurs (Baize, 1997).
a- Origine
Le cuivre est présent dans l’environnement suite aux processus naturels tels que les éruptions volcaniques, les incendies de forêts et l'érosion naturelle comme la désagrégation par les intempéries et l'abrasion des roches, des sols et des sédiments par le vent et l'eau. Une fraction faible mais néanmoins significative de cuivre naturel est constamment en mouvement et transportée dans l'environnement. Outre les apports naturels, le cuivre peut provenir des utilisations anthropiques, ils résultent de trois groupes d’activités.
Sources agricoles : Les traitements fongicides sous forme de sulfate et lisiers, pesticides, et engrais ;
Sources industrielles : Le cuivre est un contaminant qui accompagne notamment le zinc, le plomb et le cadmium dans les activités métallurgiques des métaux non ferreux. Les activités d’extraction et d’exploitation du minerai de cuivre. Les sels de cuivre sont utilisés dans l’industrie de la photographie, les tanneries, l’industrie textile, les traitements de surface (circuits imprimés, galvanoplastie, dépôts chimiques...) (Goyer, 1981 ; Young, 1992) ;
Sources urbaines : Boues de station d’épuration, composts d’ordures ménagères (Baize, 1997).
b- Toxicité
Le cuivre est un élément essentiel aussi bien pour l’homme que pour la plante (Welch, 1995). Il semble poser plus de problèmes de carence chez les végétaux, le bétail et l’homme, que de toxicité. L’intoxication n’est atteinte qu’à des doses beaucoup plus importantes. Les manifestations pathologiques chez l’homme sont plutôt liées à une carence en cuivre qui entraîne une anémie résistante au traitement par le fer, des retards de croissance associés à des troubles du métabolisme osseux, des lésions cardiaques, des troubles du système nerveux, etc. (Bourrelier and Berthelin, 1998).
Cependant, chez les plantes, le cuivre peut provoquer une phytotoxicité dans certains cas. Il induit des symptômes de la chlorose ferrique et une diminution de l’absorption du fer et du
phosphore (Loué, 1986). Il induit également une réduction de la photosynthèse et une réduction de la croissance des feuilles et des racines (Pedersen et al., 2000 ; Mateos-Naranjo et al., 2008) et diminue la nodulation des légumineuses même à faible concentration (Kopittke et al., 2007a). Aussi, le cuivre s’accumule dans les racines (Pedersen et al., 2000 ; Kopittke et al., 2009). Pour cette raison, la concentration de Cu dans les plantes est très bien réglementée (Peñarrubia et al., 2010).
I.3.4. Le plomb
Le plomb est présent dans la croûte terrestre et dans tous les compartiments de la biosphère. On le trouve principalement dans des minerais comme la galène (PbS). La concentration moyenne en plomb de la croûte terrestre serait de l’ordre de 13 à 16 mg/kg.
D’après Juste et al., (1995) de nombreux auteurs s’accorderaient pour affirmer que les sols non contaminés contiendraient 10 à 30 mg/kg, tandis que les sols situés loin des centres urbains et industriels mais affectés par des contaminations diffuses présenteraient des concentrations comprises entre 30 et 100 mg/kg. Des concentrations supérieures à 110ppm de plomb traduiraient l’existence d’une source polluante à proximité.
a- Origine
Les émissions de plomb peuvent provenir de poussières volcaniques véhiculées par le vent, elles sont reconnues d'une importance mineure. D’autres processus naturels, comme la dégradation et l'érosion du sol et les feux de forêt, contribuent de façon significative à la libération de plomb. Mais généralement, ces processus naturels ne conduisent que rarement à des concentrations élevées de plomb dans l'environnement contrairement aux apports anthropogènes qui résultent de quatre groupes d’activités :
Les sources principales sont liées à l’utilisation de composés organométalliques comme anti- détonants dans les moteurs à explosion. Le métal est rejeté par les gaz d’échappement sous forme d’aérosols ou de poussières associant le plomb, le brome et le chlore. Une partie de ces composés se dépose sur les couches supérieures de l’atmosphère. On estime que plus de 95% du plomb susceptible de contaminer l’environnement par retombées atmosphériques aurait pour origine le trafic automobile ;
Les sources industrielles : le plomb peut être libéré dans leur environnement par des usines traitant le minerai ou réalisant la récupération des batteries ou encore pratiquant l’affinage du plomb ;
Les sources urbaines : boues de stations d’épuration. Aussi dans les eaux de distribution, le plomb peut provenir de la corrosion des canalisations ;
Sources agricoles : Certains pesticides à base de plomb (arséniates) ont été employés autrefois dans des terrains agricoles (Baize, 1997).
b- Toxicité
Le plomb n’est ni essentiel ni bénéfique pour les êtres vivants. Il est très toxique pour l’homme, car il occupe la deuxième position dans la liste des substances toxiques (ASTDR, 2004). Ses effets concernent le système cardio-vasculaire, le système nerveux central et périphérique et le rein, voire le système auditif et visuel (Fergusson, 1990 ; Plumlee and Ziegler, 2003). Le fœtus et le jeune enfant sont particulièrement sensibles à l’effet toxique neurocomportemental du plomb, caractérisé par une baisse peu ou pas réversible des facultés cognitives (Goyer and Clarkson, 2001).
Chez les plantes, le plomb diminue la croissance des racines spécialement les racines principales même en présence de faibles concentrations. Elles deviennent épaisses, courtes et très ramifiées. Aussi, des précipitations de plomb on été observées dans les zones apicales chez les plantes traitées par le plomb (Kopittke et al., 2007b, c).
I.3.5. Le zinc
Le zinc fait partie de la nature. La plupart des roches et de nombreux minéraux en contiennent dans des proportions diverses. Le zinc est également présent de façon naturelle dans l'air, l'eau et le sol. La concentration naturelle en zinc dans la croûte terrestre varie entre 10 et 300 mg/kg (Malle, 1992), pour une valeur moyenne de 70 mg/kg (de matière sèche). À certains endroits, le zinc a été concentré à des niveaux beaucoup plus importants sous l'influence de procédés géologiques et géochimiques. De telles concentrations, que l'on retrouve à la surface de la terre et dans le sous-sol, font l'objet d'une exploitation sous forme d’extraction de minerais. Le minéral le plus courant à base de zinc est la sphalérite (ZnS). Le zinc métallique est produit à la fois à partir de minerais et du recyclage des produits contenant du zinc.