Études spectroscopiques du mécanisme d’action de
peptides synthétiques à potentiel antimicrobien
Thèse
Matthieu Fillion
Doctorat en chimie
Philosophiae doctor (Ph. D.)
Québec, Canada
© Matthieu Fillion, 2017
iii
Résumé
Cette thèse porte sur l’élucidation du mode d’action de peptides synthétiques qui sont des analogues cationiques du peptide modèle 14-mère. À l’instar des peptides antimicrobiens naturels, ces peptides synthétiques induisent des perturbations membranaires et une meilleure connaissance de leur mode d’action s’avère un élément déterminant pour le design de nouveaux peptides synthétiques qui présenteront une activité antibactérienne maximale et une activité hémolytique moindre. Afin de mieux caractériser le rôle de certains déterminants moléculaires sur l’interaction membranaire, nous avons sélectionné deux catégories de peptides, soit des analogues qui ont une structure secondaire en hélice α et qui sont non sélectifs à l’égard des membranes mimétiques de bactérie et des analogues qui forment des feuillets β intermoléculaires et qui sont sélectifs à l’endroit des membranes mimétiques de bactérie. Les études réalisées ont fait intervenir plusieurs techniques spectroscopiques comme la spectroscopie infrarouge, la spectroscopie RMN des solides et la spectroscopie de fluorescence.
Tout d’abord, nous avons vérifié le rôle des interactions électrostatiques sur l’interaction membranaire, et ce, en effectuant une étude comparative entre des analogues cationiques et anioniques. Les résultats obtenus démontrent que les peptides anioniques et cationiques ont un impact similaire sur la dynamique des têtes polaires des phospholipides et l’ordre conformationnel des chaînes acyle. Cependant, les tests de relargage ont démontré que seuls les peptides cationiques formant des feuillets β intermoléculaires sont sélectifs alors que les homologues anioniques qui forment des feuillets β intermoléculaires sont inactifs en présence des membranes mimétiques de bactéries et de cellules eucaryotes.
Ensuite, pour mieux comprendre le mode de perturbation membranaire des peptides cationiques qui sont non sélectifs et sélectifs, nous avons effectué des études par spectroscopie RMN des solides sur des échantillons de peptides reconstitués dans des bicouches lipidiques mécaniquement orientées entre des lamelles de verre ainsi que échantillons bicellaires. Les résultats ont démontré que les peptides sélectifs perturbaient davantage l’orientation des phospholipides zwitterioniques en comparaison avec les peptides non sélectifs. De plus, les simulations spectrales réalisées sur les spectres
iv
expérimentaux suggèrent que les peptides non sélectifs induisent la formation de pores ayant une géométrie toroïdale.
En terminant, nous avons étudié la topologie membranaire et la localisation dans la membrane d’un peptide ayant une conformation en hélice α (R5R10) et d’un peptide formant des feuillets β intermoléculaires (R4R11). Les résultats obtenus par RMN de l’azote-15 indiquent que le peptide R5R10 est localisé au niveau de la surface membranaire avec une certaine hétérogénéité dans l’orientation. Cette conclusion est soutenue par des expériences réalisées par spectroscopie infrarouge en mode ATR. Des mesures de distances à partir de la technique REDOR entre les phospholipides et les peptides ont permis de constater que le peptide en hélice α est localisé à proximité du noyau phosphore alors que le peptide en feuillets β agrégés est localisé plus superficiellement au niveau de la surface membranaire. Cette différence de pénétration dans la région interfaciale pourrait expliquer la différence de sélectivité entre le peptide R5R10 (non sélectif) et R4R11 (sélectif). De plus, les tests de relargage de la calcéine ont démontré que les deux peptides induisent une contrainte de courbure positive à la membrane lipidique. Ainsi, l’alliance des résultats suggèrent que le mode de perturbation membranaire des peptides R5R10 et R4R11 est similaire au mécanisme modèle du type sinking-raft.
v
Abstract
This thesis is related to the determination of the mode of action of synthetic peptides that are cationic derivatives of the model 14-mer peptide. Similarly to the natural antimicrobial peptides, these synthetic peptides induce membrane perturbations and a better understanding of their mechanism of action is of primary importance to design new synthetic derivatives displaying higher antimicrobial and lower hemolytic activities. In order to characterize the role of certain molecular determinants on the membrane interactions, we have focused on two categories of peptides, namely peptides adopting an α-helical conformation which are non-selective towards bacterial mimetic membranes and peptides forming intermolecular β-sheet structures which are selective towards bacterial mimetic membranes. The experiments were carried out with several spectroscopic techniques such as infrared spectroscopy, solid-state NMR spectroscopy and fluorescence spectroscopy.
First, we have studied the effect of electrostatic interactions on the membrane interactions by doing a comparative study between cationic and anionic analogs. The results show that both the anionic and the cationic derivatives have a similar impact on the dynamics of the phospholipid polar headgroups and on the conformational order of the acyl chains. However, dye-release experiments have shown that only the cationic derivatives forming intermolecular β-sheet structures are selective whereas their homologous β-sheet aggregated anionic peptides are inactive in the presence of both bacterial and eukaryotic mimetic membranes
Then, to better understand the mode of membrane perturbation of non-selective and selective peptides, we have performed solid-state NMR experiments on peptides reconstituted in oriented samples of phospholipids. The results have shown that the selective peptides disrupt even more the orientation of zwitterionic phospholipids than the non selective peptides. In addition, the spectral simulations performed on experimental spectra suggest that the non-selective peptides induce the formation of pores having a toroidal geometry.
vi
To conclude, we have studied the membrane topology and the location into the membrane of the α-helical peptide R5R10 and the β-sheet aggregated peptide R4R11. The results obtained using 15N NMR indicate that the α-helical peptide is located on the
membrane surface with a certain degree of heterogeneity. This conclusion is also supported by experiments performed using ATR spectroscopy. Distance measurements between phospholipids and peptides using the REDOR technique indicate that the α-helical peptide is near the phosphate nucleus of phospholipids whereas the β-sheet aggregated peptide is superficially located on the membrane surface. The difference of penetration into the interfacial region could explain the difference of selectivity between the R5R10 peptide (non selective) and the R4R11 peptide (selective). In addition, dye-release experiments have shown that both peptides induce a negative curvature strain to the membrane. Therefore, by taking into account all the results, it seems that the mechanism of action of these peptides is similar to the sinking-raft model mechanism.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xiii
Liste des figures ... xv
Liste des abréviations ... xxi
Remerciements ... xxvii
Avant-propos ... xxix
Chapitre I : Introduction ... 1
1.1 Résistance aux antibiotiques ... 1
1.2 Peptides antimicrobiens naturels ... 2
1.3 Classifications des peptides antimicrobiens naturels... 3
1.3.1 Bactéries ... 3 1.3.2 Insectes ... 4 1.3.3 Plantes ... 5 1.3.4 Amphibiens ... 6 1.3.5 Mammifères ... 8 1.3.6 Peptides anioniques ... 9 1.4 Sélectivité membranaire ... 11 1.5 Mécanismes d’action ... 12 1.6 Membranes biologiques ... 15 1.6.1 Dynamique membranaire ... 17 1.6.2 Membrane bactérienne ... 18 1.6.3 Polymorphisme lipidique ... 21
1.7 Membranes lipidiques modèles ... 22
1.7.1 Bicelles ... 24
1.7.1.1 Domaine d’existence ... 25
1.7.1.2 Morphologie ... 26
1.7.1.3 Alignement dans le champ magnétique ... 27
1.7.2 Bicouches mécaniquement orientées entre des lamelles de verre... 29
viii
1.9 Déterminants moléculaires de l’interaction membranaire ... 31
1.9.1 Conformation (hélicité) ... 31
1.9.2 Charge ... 31
1.9.3 Caractère amphiphile et moment hydrophobe ... 33
1.9.4 Hydrophobicité ... 34
1.9.5 Angle polaire ... 35
1.10 Précédents sur le projet ... 36
1.11 Objectifs du projet ... 38
1.12 Références ... 39
Chapitre 2 : Méthodes d’analyses ... 47
2.1 Spectroscopie RMN des solides ... 47
2.1.1 Aspects théoriques et fondamentaux de la RMN ... 47
2.1.2 Mouvement de précession... 51 2.1.3 À l’équilibre ... 52 2.1.4 Expérience de RMN ... 53 2.1.4.1 Excitation ... 53 2.1.4.2 Relaxation ... 54 2.1.5 Interactions en RMN ... 55
2.1.5.1 Interaction de déplacement chimique ... 56
2.1.5.2 Interaction dipolaire ... 58
2.1.6 RMN du phosphore-31 ... 59
2.1.6.1 RMN du phosphore-31 en milieu orienté... 62
2.1.6.2 RMN du phosphore-31 : séquence d’impulsions ... 64
2.1.7 RMN de l’azote-15 ... 65
2.1.7.1 RMN de l’azote-15 : séquence d’impulsions ... 67
2.1.8 REDOR ... 69
2.1.8.1 Réintroduction du couplage dipolaire ... 70
2.2 Spectroscopie infrarouge en mode transmission ... 73
2.2.1 Région des chaînes acyle... 74
2.2.2 Vibration du groupement amide des protéines... 76
2.2.3 Considérations expérimentales ... 78
2.3 Spectroscopie infrarouge de réflexion totale atténuée (ATR) ... 79
2.3.1 Orientation moléculaire ... 81
ix
2.3.2.1 Orientation moléculaire : hélice α et chaînes acyle ... 85
2.3.2.2 Orientation moléculaire : feuillet β ... 86
2.4 Tests de relargage ... 87 Chapitre 3 ... 93 3.1 Résumé ... 93 3.2 Abstract ... 94 3.3 Introduction ... 95 3.4 Phosphorus-31 ... 98 3.5 Nitrogen-15 ... 99 3.6 Fluorine-19 ... 102 3.7 Deuterium ... 103 3.8 Concluding remarks ... 105 3.9 References ... 106 Chapitre 4 ... 111 4.1 Résumé ... 111 4.2 Abstract ... 112 4.3 Introduction ... 113
4.4 Materials and methods ... 114
4.4.1 Materials... 114
4.4.2 Peptide synthesis ... 115
4.4.3 Sample preparation ... 115
4.4.3.1 Multilamellar vesicles ... 115
4.4.3.2 Unilamellar vesicles for fluorescence assay ... 115
4.4.4 Spectroscopic techniques ... 116
4.4.4.1 Infrared spectroscopy ... 116
4.4.4.2 Fluorescence measurements... 116
4.4.4.3 31P NMR experiments ... 117
4.5 Results and discussion ... 118
4.5.1 Infrared spectroscopy ... 118 4.5.2 Fluorescence spectroscopy ... 122 4.5.3 31P solid-state NMR ... 123 4.6 Conclusions ... 126 4.7 Acknowledgements ... 126 4.8 References ... 126
x
Chapitre 5 ... 129
5.1 Résumé ... 129
5.2 Abstract ... 130
5.3 Introduction ... 131
5.4 Materials and methods ... 134
5.4.1 Materials ... 134
5.4.2 Peptide synthesis ... 134
5.4.3 Sample preparation ... 134
5.4.3.1 Lipid bilayers oriented between glass plates ... 134
5.4.3.2 DMPC/DHPC and TBBPC/DHPC bicelles ... 135
5.4.4 31P NMR experiments ... 135
5.5 Results and discussion ... 136
5.5.1 Lipids macroscopically oriented between glass plates ... 136
5.5.2 Spectral simulations ... 139
5.5.3 Comparison between non-selective and selective peptides ... 140
5.5.4 DMPC/DHPC and TBBPC/DHPC bicelles ... 141 5.6 Conclusions ... 144 5.7 Acknowledgements ... 144 5.8 Références ... 145 Chapitre 6 ... 147 6.1 Résumé ... 147 6.2 Abstract ... 148 6.3 Introduction ... 149
6.4 Materials and methods ... 152
6.4.1 Materials ... 152
6.4.2 Peptide synthesis ... 152
6.4.3 Sample preparation ... 153
6.4.3.1 Oriented samples – glass plates ... 153
6.4.3.2 Lyophilized samples – REDOR ... 153
6.4.3.3 Multilamellar vesicles – ATR-FTIR ... 154
6.4.3.4 Unilamellar vesicles – dye-release assay ... 154
6.4.4 Solid-state NMR experiment ... 154
6.4.4.1 31P NMR experiments – glass plates ... 154
xi
6.4.4.3 REDOR experiments ... 155
6.4.4.4 Attenuated total reflectance FTIR spectroscopy ... 156
6.4.4.5 Fluorescence measurements... 157
6.5 Results... 158
6.5.1 31P and 15N solid-state NMR ... 158
6.5.2 REDOR measurements ... 160
6.5.3 ATR-FTIR studies ... 162
6.5.3.1 Acyl chain orientation ... 162
6.5.3.2 Peptide orientation ... 163 6.5.4 Dye-release assay ... 165 6.6 Discussion ... 167 6.7 Conclusion ... 173 6.8 Acknowledgements ... 173 6.9 References ... 174 6.10 Supporting information ... 177 6.10.1 Solid-state NMR (REDOR) ... 177 6.10.2 ATR spectroscopy ... 178 6.10.3 Dye-leakage experiments ... 179 6.10.3.1 Calcein leakage ... 179 6.10.3.2 Dextran leakage ... 181
Chapitre 7 : Conclusions et perspectives... 183
7.1 Interactions électrostatiques ... 183
7.2 Mode de perturbation membranaire ... 184
7.3 Topologie membranaire ... 184
7.4 Mécanisme d’action ... 185
7.5 Perspectives ... 186
7.6 Design rationnel à partir des peptides R4R11 et R5R10 ... 188
xiii
Liste des tableaux
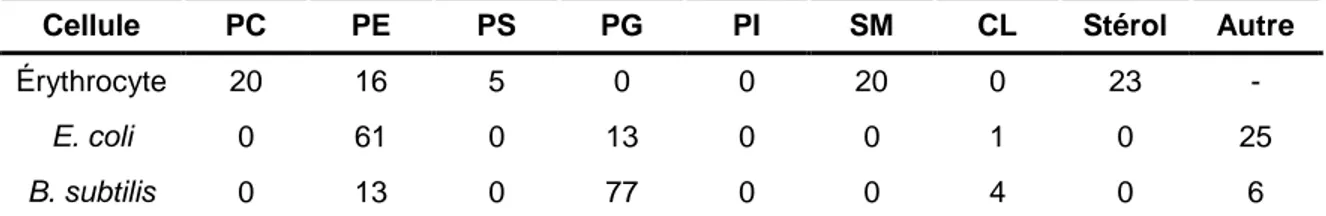
Tableau 1.1 : Composition lipidique de la membrane des érythrocytes et des bactéries Escherichia coli (membrane externe) et Bacillus subtilis exprimée en pourcentage massique
moyen. Les données sont tirées de la référence 150………...20
Tableau 2.1 : Principales propriétés magnétiques des noyaux d’importance pour l’étude des
protéines………...52
Tableau 2.2 : Intervalles de nombre d’onde de la bande amide I et I’ associées à chacun
des éléments de structure secondaire………...77
Table 5.1: Peptides investigated in the present study………133
Table 6.1: ATR studies of R5R10 and R4R11 peptides in interaction with the germanium
crystal, DMPC multilayers, and DMPG multilayers at a phospholipid/peptide molar ratio of 60/1. Spectra are reported in the supplementary information (Figures S6.2 and S6.3)...…163
xv
Liste des figures
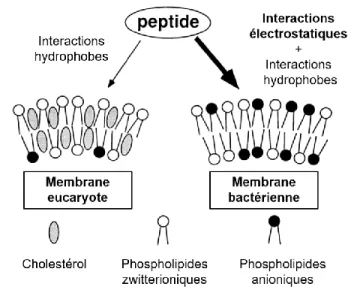
Figure 1.1 : Influence de la composition membranaire sur la sélectivité membranaire. Figure
adaptée et traduite de la référence 98………..12
Figure 1.2 : Illustration des principaux mécanismes d’action des peptides antimicrobiens
cationiques. Figure adaptée et traduite de la référence 124………..13
Figure 1.3 : Illustration schématique d’une membrane lipidique et de ses principaux
constituants. Figure adaptée et traduite de la référence 134………..…..15
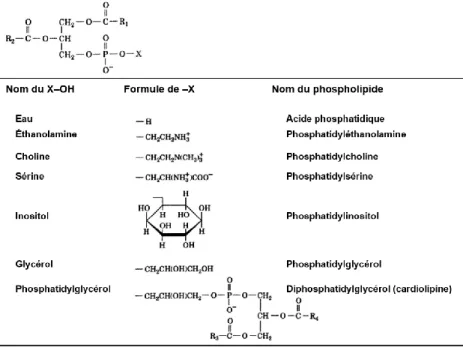
Figure 1.4 : Structure chimique et nomenclature des principaux phospholipides. Figure
adaptée et traduite de la référence 133………...…….16
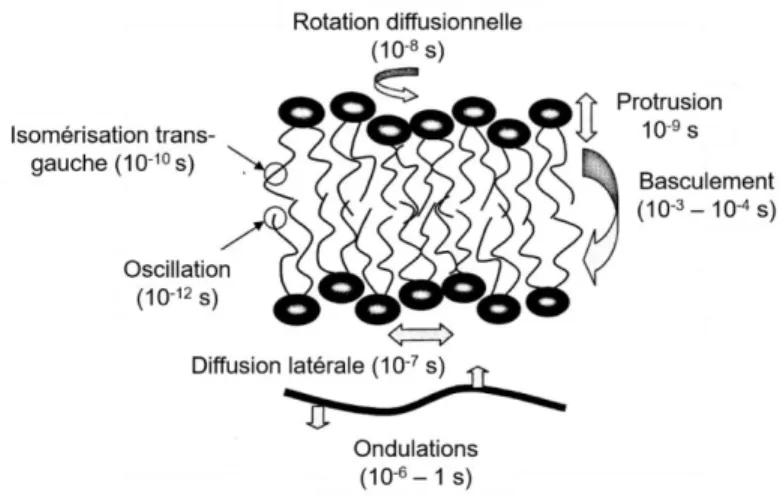
Figure 1.5 : Mouvements des phospholipides dans une membrane lipidique ainsi que les
temps de corrélations approximatifs qui les caractérisent. Figure adaptée et traduite de la référence 140………...……18
Figure 1.6 : Illustration schématique des parois cellulaires des bactéries à Gram négatif en
A) et à Gram positif en B). La structure générale d’un lipopolysaccharide est également représentée en A). Figure adaptée et traduite de la référence 147………....…………..19
Figure 1.7 : Illustration de la géométrie des phospholipides et du polymorphisme lipidique.
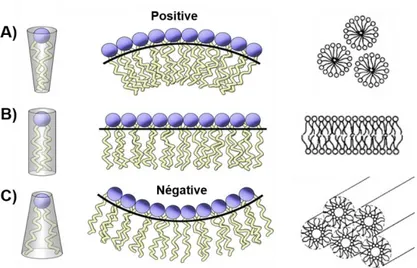
Les phospholipides ayant une géométrie de forme conique inverse adoptent des structures ayant une courbure positive comme les micelles A), les phospholipides ayant une géométrie cylindrique forment des phases lamellaires B) et les phospholipides ayant une forme conique adoptent des structures ayant une courbure négative comme les phases hexagonales C). Figure adaptée et traduite de la référence 155………..22
Figure 1.8 : Structure chimique des phospholipides utilisés pour former les membranes
lipidiques modèles………..…….23
Figure 1.9 : Principale classification des vésicules. Représentation d’une vésicule
multilamellaire en A), d’une large vésicule unilamellaire en B) et d’une petite vésicule unilamellaire en C). Figure adaptée et traduite de la référence 134……….24
Figure 1.10 : Diagrammes de phases mettant en relation la composition lipidique en
fonction de la température. DMPC (%) représente le pourcentage molaire soit le pourcentage associé au rapport entre la quantité molaire de DMPC et la quantité molaire totale de lipides. Diagramme A) : bicelles de DMPC/DHPC orientées dans un champ magnétique pour un taux d’hydratation de 80 % et en présence de 100 mM de KCl (triangles). Diagramme B) : bicelles de DMPC/DHPC orientées dans un champ magnétique pour un taux d’hydratation de 80 % et en l’absence de sel (triangles). Figure adaptée de la référence 162………...………25
Figure 1.11 : Morphologies proposées pour les bicelles de DMPC/DHPC. Structures en
forme de disques s’alignant avec leur normale perpendiculaire par rapport au champ magnétique externe en A), en forme de rubans en B) et en forme de lamelles perforées en C). Figure tirée de la référence 163………..……….27
xvi
Figure 1.12 : Structure moléculaire du peptide 14-mère en A) et la représentation en roue
hélicoïdale en B)………..………37
Figure 2.1 : Représentation de la projection du vecteur moment angulaire I⃗ le long de l’axe z en A) et représentation de la projection du vecteur moment magnétique μ⃗⃗ le long de l’axe z en B) pour un noyau de spin ½………49
Figure 2.2 : Représentation de la transition énergétique pour un noyau de spin ½ placé
dans un champ magnétique stationnaire B0. L’énergie de la transition correspond à la
différence d’énergie entre le niveau supérieur, qui est associé à l’état de spin β (m = -½), et le niveau inférieur, qui est associé à l’état de spin α (m = +½). N représente la population du niveau d’énergie……….………50
Figure 2.3 : Représentation dans le modèle classique d’un noyau en précession dans un
champ magnétique stationnaire B0………51
Figure 2.4 : Ensemble de noyaux en précession en A) et l’aimantation macroscopique
résultante (M0) alignée dans la même direction que le champ magnétique stationnaire B0 en
B)………...53
Figure 2.5 : Principaux axes du tenseur d’anisotropie de déplacement chimique pour
l’atome de phosphore des lipides. Les valeurs de déplacement chimique associées aux principaux éléments σ11, σ22 et σ33 sont celles pour un groupement phosphodiester statique………..…...59
Figure 2.6 : Spectres de RMN 31P pour des phospholipides en phase gel (L
β’) en vésicules
multilamellaires en A), pour des phospholipides en phase fluide (Lα’) en vésicules
multilamellaires en B) pour des phospholipides sous forme de micelles en C)…...62
Figure 2.7 : Spectres RMN 31P caractéristiques pour des lipides mécaniquement orientés
entre des lamelles de verre avec leur normale orientée parallèle par rapport au champ magnétique B0 en A), pour des bicelles du type DMPC/DHPC orientées avec leur normale
perpendiculaire par rapport au champ magnétique B0 en B) et pour des bicelles du type
TBBPC/DMPC orientées avec leur normale parallèle par rapport au champ magnétique B0
en C)………..…64
Figure 2.8 : Illustration de la séquence d’impulsions écho de Hahn………..……...65 Figure 2.9 : Principaux axes du tenseur d’anisotropie de déplacement chimique en
azote-15 du groupement amide d’un acide aminé et les valeurs moyennes des principaux éléments σ11, σ22 et σ33………..…………66
Figure 2.10 : Simulation d’un spectre RMN 15N avec découplage proton pour un peptide
ayant une conformation en hélice α et une topologie transmembranaire en A) et un peptide ayant une conformation en hélice α localisé sur la surface membranaire en B)………….….67
Figure 2.11 : Illustration de la séquence d’impulsions d’une polarisation croisée………...68 Figure 2.12 : Illustration de la séquence d’impulsions pour la technique REDOR intégrant
xvii
Figure 2.13 : Illustration de l’évolution du module du champ magnétique induit (BL) pour une
expérience sans qu’il y ait réintroduction du couplage dipolaire (contrôle) et pour celle avec réintroduction du couplage dipolaire (déphasage), et ce, pour une période de rotor……….71
Figure 2.14 : Illustration d’une courbe de déphase universelle théorique REDOR pour une
paire de noyaux ayant des spins ½. Figure tirée et adaptée de la référence 22………..72
Figure 2.15 : Région spectrale associée aux modes normaux d’élongation antisymétriques
et symétriques des phospholipides de même que la valeur de nombre d’onde attribuée à chacune des bandes………..………….74
Figure 2.16 : Illustration d’une membrane lipidique en phase gel (Lβ’) et en phase fluide (Lα).
Les projections de Newman illustrent un conformère anti et les deux types de conformères
gauche………..75
Figure 2.17 : Exemple d’une courbe de thermotropisme pour le phospholipide DMPC. La
température de transition de phase est visible aux alentours de 25°C et elle correspond au point d’inflexion de la courbe………..76
Figure 2.18 : Exemple de bandes amide I’ pour un peptide ayant une structure secondaire
en hélice en A) et un peptide formant des feuillets β intermoléculaires en B)………..77
Figure 2.19 : Illustration schématique d’un cristal ATR et le parcours emprunté par la
radiation incidente ayant une polarisation parallèle et perpendiculaire par rapport au plan d’incidence. Les composantes cartésiennes du champ électrique sont illustrées le long des axes x, y et z. Le rayon incident est orienté à un angle θ par rapport à la normale définie par la surface du cristal. Figure tirée de la référence 41………..…..80
Figure 2.20 : Représentation cartésienne pour l’étude de l’orientation d’un axe moléculaire
C incliné à un angle θ par rapport à l’axe de référence z. Le moment de transition S est orienté à un angle β par rapport à l’axe moléculaire C et un angle γ par rapport à l’axe de référence z. Les distributions d’orientations de C par rapport à l’axe z et celle de S par rapport à l’axe moléculaire C sont de symétrie cylindrique. Figure tirée de la référence 45………....85
Figure 2.21 : Structure chimique de la calcéine………...87
Figure 2.22 : Illustration de la méthode expérimentale pour l’étude de l’activité membranaire
de peptides antimicrobiens par spectroscopie de fluorescence………...88
Figure 2.23 : Exemple d’une expérience de relargage de calcéine pour le peptide E3E12
en interaction avec des liposomes de DMPG. L’encadré bleu représente le signal minimal de fluorescence correspondant à l’étape à laquelle la calcéine est confinée à l’intérieur des liposomes. L’encadré jaune représente l’étape à laquelle le peptide a été ajouté. L’augmentation du signal de fluorescence signifie que le peptide est actif et entraîne la libération de la calcéine hors des liposomes. L’encadré rouge correspond à l’étape où le détergent a été ajouté pour briser les liposomes. La calcéine est alors diluée dans le milieu aqueux et l’intensité de fluorescence est maximale………....89
Figure 3.1: Examples of mechanisms of action proposed for natural antimicrobial peptides.
Peptides can either destroy the bacterial cell membrane by micellization or induce pore formation. Adapted from Chan et al. 2006 and reproduced with permissions……….96
xviii
Figure 3.2: A) Disk-shaped bicelles aligned with their normal perpendicular relative to the
external magnetic field. The long-chain phospholipids (DMPC) are localized in the flat region whereas the short-chain phospholipids (DHPC) are localized in the rim region. B) Phospholipids mechanically oriented between glass plates. There are thousands of bilayers of lipids between two glass plates and there is a water layer between the bilayers…………98
Figure 3.3: A) 15N chemical shift tensor elements σ
11, σ22 and σ33 for an amino acid. B) 15N chemical shift value for a α-helical peptide that adopts a transmembrane topology and 15N
chemical shift value for a α-helical peptide that sits on the membrane surface. Adapted from Bechinger and Sizun 2003 and reproduced with permissions……….100
Figure 3.4: A) Resonance patterns in 2D PISEMA experiments for a α-helical peptide tilted
at different angles relative to the bilayer normal. B) Resonance patterns in 2D PISEMA experiments for a peptide adopting a β-sheet conformation tilted at different angles relative to the bilayer normal. Adapted from Franzin and Marassi 2005 and reproduced with permissions………101
Figure 4.1: Structure of the model 14-mer peptide in A). Sequences of the cationic and
anionic analogs investigated in the present study………....118
Figure 4.2: Infrared spectra in the amide I’ region of A) DMPC MLVs in the presence of
cationic and anionic analogs and B) DMPG MLVs in the presence of cationic and anionic analogs. The experiments were conducted at 37°C……….……...….119
Figure 4.3: Wavenumber of the CH2 symmetric stretching vibration as a function of
temperature for A) DMPC MLVs in the presence of cationic and anionic analogs and B) DMPG MLVs in the presence of cationic and anionic analogs………120
Figure 4.4: Percentage of calcein leakage of A) DMPC vesicles in the presence of cationic
and anionic peptides and B) DMPG vesicles in the presence of cationic and anionic peptides. The experiments were conducted at 37°C……….…..…………..122
Figure 4.5: 31P solid-state NMR spectra of A) DMPC MLVs in the presence of X5X10
peptides, B) DMPC MLVs in the presence of X4X11 peptides, C) DMPG MLVs in the presence of X5X10 peptides, and D) DMPG MLVs in the presence of X4X11, where X is a lysine residue in the case of cationic peptides and a glutamic acid residue in the case of anionic peptides. The experiments were conducted at 37°C………..……124
Figure 5.1: A) Sequence of the neutral base 14-mer peptide and B) examples of positively charged analogues used in this study……….…………132
Figure 5.2: 31P NMR spectra of DMPC bilayers macroscopically oriented between glass
plates in A) the absence and B) the presence of the peptide K3 (lipids/peptide molar ratio of 20:1). The measurements were performed at 37°C. The signals located to the right of the dashed line are due to membrane perturbations………...137
Figure 5.3: 31P NMR spectra of DMPC bilayers macroscopically oriented between glass
plates A) in the absence (black) and presence of two nonselective peptides, K3 (yellow) and K5K10 (red); and B) in the absence (black) and presence of two selective peptides, K4 (green) and K4K11 (blue). The measurements were performed at 37°C and at a lipid/peptide molar ratio of 20:1. Adapted from and reproduced with permissions……….………..….138
xix
Figure 5.4: A) 31P NMR spectrum of DMPC bilayers macroscopically oriented between glass
plates in the presence of the non-selective peptide K3 (lipid/peptide molar ratio of 20:1) (black) and simulated spectra (purple) of toroidal pores with a radius of 10 Å. B) 31P NMR
spectrum of DMPC bilayers macroscopically oriented between glass plates in the presence of the selective peptide K4 (lipid/peptide molar ratio of 20:1) and simulated spectrum (purple) of an ellipsoid deformation. The spectra resulting from the subtraction of simulated spectra are presented in blue. The shape of the simulated deformation is also represented in each case. Schematic representation of disorder induced by C) pore formation and D) peptide aggregation in oriented bilayers. Panels C and D adapted from and reproduced with permissions………....140
Figure 5.5: 31P NMR spectra of DMPC/DHPC (3.5:1) bicelles A) in the absence (black) and
presence of a nonselective peptide, K5K10 (red); and B) in the absence (black) and presence of a selective peptides, K4K11 (blue). The measurements were performed at 37°C and at a lipid/peptide molar ratio of 60:1………...142
Figure 5.6: 31P NMR spectra of TBBPC/DHPC (6.7:1) bicelles A) in the absence (black) and
presence of a nonselective peptide, K5K10 (red); and B) in the absence (black) and presence of a selective peptides, K4K11 (blue). The measurements were performed at 37°C and at a lipid/peptide molar ratio of 60:1………...143
Figure 6.1: A) Structure of the 14-mer template peptide. B) Primary sequences of the
arginine-containing analogs investigated in the present study………151
Figure 6.2: 31P solid-state NMR spectra of POPC mechanically oriented between glass
plates in the presence of R5R10 peptide at phospholipid/peptide molar ratios of A) 60/1 and B) 100/1. 15N solid-state NMR spectra of POPC mechanically oriented between glass plates
in the presence of R5R10 peptide at phospholipid/peptide molar ratios of C) 60/1 and D) 100/1. All spectra were acquired at 37°C…….………..…159
Figure 6.3: 15N{31P} REDOR dephasing curves for A) R5R10 peptide and B) R4R11 peptide
reconstituted into lyophilized DMPC multilamellar vesicles at a phospholipid/peptide molar ratio of 20/1. The spinning speed was kept constant at 5000 Hz and experiments were carried out at -10°C. The red solid line in A) is the REDOR universal curve calculated using the Bessel function method. It represents the best-fit of the experimental values of ΔS/S0
and corresponds to a mean 15N-31P internuclear distance of 7.6 ± 0.7 Å and a dipolar
coupling constant of 11.2 Hz. The dotted lines illustrate the distribution of distances……..161
Figure 6.4: ATR spectra of the amide I’ spectral region of A) R5R10 peptide and B) R4R11
peptide in the absence of lipids and in the presence of DMPC and DMPG multilayers. The spectra displayed have been acquired with parallel polarized light (P) at a phospholipid/peptide molar ratio of 60/1. All measurements were done at ambient temperature………164
Figure 6.5: Percentage of calcein leakage of A) R5R10 peptide and B) R4R11 peptide in
the presence of POPC, POPC/POPE (7/3), POPG, POPG/POPE (7/3), and POPG/POPE (3/7) SUVs at a phospholipid/peptide molar ratio of 60/1,120/1, and 240/1 in A) and 60/1 and 120/1 in B). All measurements were done at 37°C. Kinetics measurements are reported in the supplementary information (Figures S6.4 and S6.5)………..166
xx
Figure S6.1: 15N{31P} REDOR dephasing curve for 15N-Leu
3-R4R11 peptide reconstituted
into lyophilized DMPC multilamellar vesicles at a phospholipid/peptide molar ratio of 20/1.
The spinning speed was kept constant at 5000 Hz and experiment was carried out at -10°C……….………...……….177
Figure S6.2: Amide I’ spectral region of ATR spectra acquired with parallel (P) and
perpendicular (S) polarized lights for the R5R10 peptide interacting with DMPC multilayers, DMPG multilayers, and in the absence of phospholipids. The phospholipid/peptide molar ratio was 60/1………...…..178
Figure S6.3: Amide I’ spectral region of ATR spectra acquired with parallel (P) and
perpendicular (S) polarized lights for the R4R11 peptide interacting with DMPC multilayers, DMPG multilayers, and in the absence of phospholipids. The phospholipid/peptide molar ratio was 60/1……….…178
Figure S6.4: Kinetic measurements of calcein leakage induced by the presence of the
R5R10 peptide in POPC, POPG, POPC/POPE (7/3), POPG/POPE (7/3), and POPG/POPE (3/7) SUVs. Triton X-100 has been added after 400 s to induce the complete disruption of the membranes. All measurements were done at 37°C……….………..179
Figure S6.5: Kinetic measurements of calcein leakage induced by the R4R11 peptide in
POPC, POPG, POPC/POPE (7/3), POPG/POPE (7/3), and POPG/POPE (3/7) SUVs. Triton X-100 has been added after 400 s to induce the complete disruption of the membranes All measurements were done at 37°C……….…….180
Figure S6.6: Kinetic measurements of the 3 kDa FITC-dextran leakage induced by the
R4R11 peptide in POPC/POPG 1/1 SUVs. The measurement was done at 37°C………...181
xxi
Liste des abréviations
ADC Anisotropie de déplacement chimique AMP Antimicrobial peptide
APD Antimicrobial Peptide Database
Ara4N 4-aminoarabinose
ATR Attenuated total reflectance ; réflexion totale atténuée
CDC Centers for Disease Control and Prevention
CE Crown ether
CL Cardiolipine
CMI Concentration minimale inhibitrice CODEX Center-band only detection of exchange
CP Cross polarization ; polarisation croisée
CSA Chemical shift anisotropy
DHPC 1,2-dihexanoyl-sn-glycéro-3-phosphocholine DMPC 1,2-dimyristoyl-sn-glycéro-3-phosphocholine DMPG 1,2-dimyristoyl-sn-glycéro-3-phosphoglycérol
DPI Dual polarization interferometry ; interférométrie par double polarisation
EC Éther en couronne
EDTA N,N’-1,2-éthanediylbis-[N-(carboxyméthyl)glycine] ERV Enterococcus résistant à la vancomycine
FDA Food and Drug Administration
FMOC 9-fluorénylméthyloxycarbonyle
FRPA Fluoroquinolone-resistant Pseudomonas aeruginosa
FT-IR Fourier transform infrared ; infrarouge à transformée de Fourier
xxii
HFIP 1,1,1,3,3,3-hexafluoro-2-propanol
HPLC High-performance liquid chromatography, chromatographie liquide à haute
performance LPS Lipopolysaccharide LTA Acide lipotéicoïque
LUV Large unilamellar vesicle ; grande vésicule unilamellaire
MAS Magic angle spinning ; rotation à l’angle magique
MCT Mercure-cadmium-tellurium
MLV Multilamellar vesicle ; vésicule multilamellaire
MRSA Methicillin-resistant Staphylococcus aureus MS Mass spectrometry ; spectrométrie de masse
NMR Nuclear magnetic resonance
ODC Oriented circular dichroism ; dichroïsme circulaire orienté PARF Pseudomonas aeruginosa résistant aux fluoroquinolones
PAS Principal axis system ; système d’axes principal
PC Phosphatidylcholine PE Phosphatidyléthanolamine PEA Phosphoéthanolamine PG Phosphatidylglycérol PI Phosphatidylinositol
PISEMA Polarization inversion spin exchange at the magic angle
POPC 1-palmitoyl-2-oléoyl-sn-glycéro-3-phosphocholine
POPE 1-palmitoyl-2-oléoyl-sn-glycéro-3-phosphoéthanolamine POPG 1-palmitoyl-2-oléoyl-sn-glycéro-3-phosphoglycérol PS Phosphatidylsérine
xxiii RMN Résonance magnétique nucléaire
RR Rotational resonance ; résonance rotationnelle
SARM Staphylococcus aureus résistant à la méticilline
SLF Separated-local-field
SM Sphingomyéline
SPR Surface plasmon resonance ; résonance de plasmon de surface
SUV Small unilamellar vesicle ; petite vésicule unilamellaire
TBBPC 1-myristoyl-2-[4-(4-biphényl)butanoyl]-sn-glycéro-3-phosphocholine
TEM Transmission electron microscopy ; microscopie électronique à transmission
TFA 2,2,2-trifluoroacetic acid ; acide 2,2,2-trifluoroacétique TFE 2,2,2-trifluoroethanol ; 2,2,2-trifluoroéthanol
Tm Phase transition temperature ; température de transition de phase
TPPM Two-pulse phase modulation
xxv « La vérité scientifique sera toujours plus belle que les créations de notre imagination et que les illusions de notre ignorance. » Claude Bernard (1813-1878)
xxvii
Remerciements
Tout d’abord, je tiens à remercier du fond du cœur ma directrice de thèse Michèle Auger pour tout le dévouement et l’attention dont tu as fait preuve, et ce, malgré les circonstances que nous connaissons. Tu as été une vraie source d’inspiration et de motivation autant pour moi que pour l’ensemble du groupe. Je me rappellerai toujours de cette soirée des affiches en 2010 durant laquelle je t’avais demandé d’effectuer un stage de recherche dans ton groupe. À cette époque, je ne me doutais pas que c’était le commencement d’une grande aventure qui allait prendre la forme d’un doctorat. Ce fut un réel plaisir d’apprendre à devenir un chercheur à tes côtés et je te remercie également de m’avoir fait confiance et de m’avoir accordé une grande autonomie dans la réalisation de mes travaux. J’ai énormément apprécié le côté humain de ton approche et ça explique sans doute la si belle ambiance qui régnait dans notre groupe de recherche. Sans même te consulter, je pense que je peux affirmer que nous formions une équipe du tonnerre ! J’aimerais aussi remercier mon co-directeur Normand Voyer pour son implication constante dans le projet. Ta personnalité enflammée et ta passion contagieuse pour la recherche sont
sans le moindre doute le meilleur remède pour nous sortir des périodes de découragement ! Un gros merci également au professeur Burkhard Bechinger de m’avoir
accueilli dans son laboratoire de recherche à l’Université de Strasbourg dans le cadre d’un stage à l’international.
Bien sûr, cette réalisation n’est pas le fruit des efforts d’une seule personne. Je tiens à remercier infiniment tous les professionnels de recherche qui m’ont donné un coup de main pour la mise en œuvre de plusieurs expériences. Ces individus indispensables travaillent souvent dans l’ombre et je profite de cette tribune pour les remercier personnellement. Un grand merci à Pierre Audet pour ton aide en RMN, Jean-François Rioux-Dubé pour ton aide en spectroscopie infrarouge, Thierry Lefèvre pour ton expertise et tes précieux conseils en spectroscopie infrarouge et François Otis pour ton aide relativement à la synthèse peptidique ainsi que les tests de relargage. Je tiens également à remercier mes deux stagiaires de premier cycle Maxime Goudreault et Justine Dionne pour leur excellent travail et leur contribution significative pour certains travaux de cette thèse.
xxviii
Évidemment, je ne peux pas omettre la rédaction d’une petite dédicace à tous les collègues que j’ai côtoyés pendant ces années. Votre présence a été un élément motivateur dans mon cheminement en plus de rendre ce périple des plus agréables. Je garderai un bon souvenir de tous les beaux moments que nous avons partagés que ce soit au bureau, au labo ou bien en congrès. Toutefois, certains individus auront droit à une petite mention spéciale. D’abord, Ève, qui est devenue une grande amie, je suis convaincu que tu as adoré notre séjour dans le coqueron de même que tous les fous rires que nous avons eus. Par la suite, Marc-André Breton, qui est devenu un ami et partenaire de tennis, je me rappellerai de nos matchs de tennis à couper le souffle et de ton côté compétitif bien développé. Nos matchs de tennis étaient une excellente occasion de décompresser vis-à-vis des grosses journées de labo. Marie-Claude, nous ne nous sommes jamais lâchés depuis le commencement du bac ! Nos éternelles causeries ont été aussi enrichissantes que tout ce parcours académique. Aussi, je tiens à remercier Kim pour toutes les discussions à haute teneur scientifique que nous avons eues afin de mieux comprendre la super technique de RMN ! Évidemment, je garde le meilleur pour la fin soit Justine Dionne aussi connue sous l’appellation Gorgeous. Dès les premières minutes, j’ai su que ça allait cliquer entre nous de par ton dynamisme, ta fougue et ton intelligence. Je garderai un bon souvenir de notre complicité inégalée et de nos excitations sporadiques ! Je dois aussi inclure Pierre-Dan, un fier membre de notre trio infernal. Il ne faut surtout pas oublier nos petits cousins français tant adorés qui sont venus nous rejoindre. Votre présence a insufflé un vent de fraîcheur dans l’atmosphère du groupe.
Les derniers remerciements, je les réserve pour ma précieuse famille. Mes parents, Serge et Johanne, je vous remercie mille fois pour tout le soutien que vous m’avez donné pendant tout ce périple universitaire. Vous êtes extraordinaires et je ne serai jamais assez redevable pour tout ce que vous avez fait pour me faciliter la tâche. Un gros merci également à mes frères, Pascal et Nicolas, qui ont toujours su m’encourager et me donner une petite dose d’énergie dans les moments plus difficiles. Un gros merci à tous mes autres amis qui m’ont soutenu et m’ont entendu parler du doctorat à maintes et maintes reprises !
xxix
Avant-propos
Les travaux de cette thèse portent sur l’étude du mécanisme d’action de peptides synthétiques dérivant du peptide modèle 14-mère. Pour ce faire, nous avons étudié l’influence de certains déterminants moléculaires sur l’interaction membranaire en plus de déterminer la localisation des peptides dans la membrane. De manière plus précise, le premier chapitre énonce la problématique de même que les éléments de base reliés aux peptides antimicrobiens naturels, les membranes lipidiques modèles et les peptides synthétiques d’intérêt pour cette étude. Pour ce qui est du deuxième chapitre, il contient une description théorique et pratique des techniques à la base des expériences réalisées. Le troisième chapitre est un article de revue que j’ai rédigé et qui présente des applications courantes en spectroscopie RMN des solides afin d’étudier le mécanisme d’action de peptides antimicrobiens reconstitués dans des échantillons orientés. Les résultats obtenus sont présentés dans les chapitre 4 à 6 sous la forme d’articles scientifiques. L’élaboration de ces articles a été réalisée en étroite collaboration avec la directrice et le co-directeur de la thèse ainsi qu’un collaborateur international pour l’article correspondant au chapitre 6. La contribution des co-auteurs est décrite ci-dessous pour chacun des articles.
Le premier article, qui constitue le chapitre 3, est un article de revue publié dans la revue Biophysical Reviews à l’hiver 2015 (Fillion, M. et Auger, M. (2015) Biophys. Rev. 7, 311-320). Cet article de revue dont j’ai effectué la rédaction complète présente des applications courantes de la spectroscopie RMN des solides pour l’étude des peptides antimicrobiens cationiques à partir d’échantillons d’orientés. Le contenu porte sur l’étude des noyaux phosphore-31, azote-15, deutérium et fluor-19. En plus des applications possibles, de nombreux exemples récents de la littérature sont cités et décrits. La directrice de thèse a participé au processus de révision du manuscrit avant la soumission au journal.
Le deuxième article, qui constitue le chapitre 4, est un article publié dans la revue
Probiotics and Antimicrobial Proteins à l’hiver 2015 (Fillion, M., Valois-Paillard, G., Lorin, A.,
Noël, M., Voyer, N. et Auger, M. (2015) Probiotics Antimicrob. Proteins 7, 66-74). Cet article dont j’ai effectué la rédaction complète présente l’influence des interactions électrostatiques et du caractère amphiphile sur l’interaction membranaire de dérivés cationiques et anioniques du peptide modèle 14-mère. La synthèse des analogues cationiques et
xxx
anioniques a été réalisée dans le laboratoire du professeur N. Voyer par Mathieu Noël et Geneviève Valois-Paillard. Aurélien Lorin a effectué les expériences de spectroscopie infrarouge et de relargage de la calcéine sur les dérivés cationiques. Pour ma part, j’ai effectué l’ensemble des expériences impliquant les dérivés anioniques par spectroscopie infrarouge et de relargage de la calcéine en plus d’effectuer l’analyse des résultats. Pour ce qui est de la spectroscopie RMN des solides du phosphore-31, j’ai effectué les expériences et l’analyse des résultats, et ce, pour les dérivés anioniques et cationiques. Ces travaux ont été réalisés sous la supervision de la directrice et du co-directeur de la thèse.
Le troisième article, qui constitue le chapitre 5, est un article publié dans la revue
Biochimica et Biophysica Acta à l’automne 2014 (Fillion, M., Lorin, A., Noël, M., Voyer, N.
et Auger, M. (2014) Biochim. Biophys. Acta 1838, 2173-2179). Cet article dont j’ai effectué la rédaction partielle présente une investigation par spectroscopie RMN des solides du mécanisme d’action d’analogues cationiques du peptide modèle 14-mère ayant été reconstitués dans des échantillons orientés. La synthèse des analogues cationiques a été réalisée dans la laboratoire du professeur N. Voyer par Mathieu Noël. Pour ma part, j’ai effectué les expériences et l’analyse des résultats pour les peptides cationiques bisubstitués reconstitués dans des échantillons de lipides mécaniquement orientés entre des plaques de verre. Mathieu Noël et Aurélien Lorin ont effectué les simulations spectrales sur les spectres expérimentaux. J’ai également peaufiné le protocole expérimental pour la préparation des bicelles et des bicelles biphényle en plus de réaliser les expériences et l’analyse des résultats. Ces travaux ont été réalisés sous la supervision de la directrice et du co-directeur de la thèse.
Le quatrième article, qui constitue le chapitre 6, est un article accepté dans la revue
Biochemistry à l’automne 2016 (Fillion, M., Goudreault, M., Voyer, N., Bechinger, B. et
Auger, M. (2016) Biochemistry 55, 6919-6930). Cet article dont j’ai effectué la rédaction complète présente une investigation par diverses méthodes spectroscopiques du mécanisme d’action d’analogues cationiques du peptide modèle 14-mère, soit les peptides R5R10 et R4R11. La synthèse des analogues cationiques a été réalisée dans la laboratoire du professeur N. Voyer par moi-même. J’ai effectué les expériences de spectroscopie RMN des solides du phosphore-31 et de l’azote-15 à l’Université de Strasbourg sous la supervision du professeur Burkhard Bechinger. Les expériences de réflexion totale atténuée
xxxi ont été réalisées par Maxime Goudreault, un étudiant au premier cycle en chimie sous ma supervision. À l’exception des travaux réalisés à l’Université de Strasbourg, ils ont été réalisés sous la supervision de la directrice et du co-directeur de la thèse.
En parallèle, j’ai également contribué à des travaux portant sur un peptide antimicrobien naturel qui est la thanatine. J’ai effectué des mesures en spectroscopie infrarouge et en dichroïsme circulaire afin d’étudier la structure secondaire de ce peptide en interaction avec des membranes lipidiques. J’ai également contribué partiellement à la rédaction de cet article paru dans le journal Biochemistry à l’hiver 2015 (Robert, É., Lefèvre, T., Fillion, M., Martial, B., Dionne, J. et Auger, M. (2015) Biochemistry 54, 3932-3941). Ces travaux ont été réalisés sous la supervision de la directrice de thèse. J’ai collaboré à la rédaction d’un chapitre faisant partie du livre Advances in Biological Solid-State NMR:
Proteins and Membrane-Active Peptides ayant paru à l’automne 2014 (Fillion, M., Voyer, N.
et Auger, M. (2014) Membrane interactions of amphiphilic peptides with antimicrobial potential: A solid-state NMR study, Advances in Biological Solid-State NMR: Proteins and
Membrane-Active Peptides (Separovic, F. et Naito, A., Éds), The Royal Society of
Chemistry, pp. 200-213). Ce chapitre résume les principaux résultats obtenus avec le peptide modèle 14-mer de même que les analogues cationiques par spectroscopie RMN des solides. J’ai également rédigé pour la majeure partie un article de revue qui fera partie de la deuxième édition du livre Modern Magnetic Resonance dont la parution est prévue pour l’hiver 2017 (Fillion, M., Ouellet, M. et Auger, M. (2017) Solid-state NMR studies of the interactions and structure of antimicrobial peptides in model membranes, Modern Magnetic
Resonance (Webb, G. A., Éd.), pp. 1-18). Comme il s’agit d’une réédition, une partie du
texte de la première édition, qui a été rédigée par Marise Ouellet, a été conservée. Cet article de revue est construit de manière à présenter des exemples de la littérature concernant les principales techniques de la spectroscopie RMN des solides permettant, d’une part, d’étudier la topologie membranaire des peptides antimicrobiens cationiques reconstitués dans des membranes modèles et, d’autre part, d’étudier leur structure. J’ai donc mis à jour le contenu du chapitre en remplaçant les anciens exemples décrits par des exemples plus récents de la littérature. La directrice de thèse a participé au processus de révision du manuscrit avant la soumission à l’éditeur.
1
Chapitre I : Introduction
1.1 Résistance aux antibiotiques
En 1928, la découverte de la pénicilline par Fleming été un événement marquant dans la lutte contre les agents pathogènes puisqu’elle permettait le traitement d’infections qui pouvaient s’avérer létales.1 De plus, cette découverte a été un élément déclencheur pour la mise au point de nouveaux agents antibactériens. Cependant, l’utilisation clinique de cet antibiotique a rapidement entraîné l’apparition de souches bactériennes résistantes. Effectivement, une étude publiée en 1944 démontrait que plusieurs souches bactériennes présentaient déjà une résistance à la pénicilline.2 Le phénomène de résistance aux antibiotiques se manifeste par l’acquisition de mécanismes par les bactéries. Entre autres, il peut s’agir de la mutation de la cible de l’antibiotique, de la désactivation ou dégradation de l’antibiotique par un enzyme, de la diminution de l’accès de l’antibiotique à la cible ou de l’expulsion de l’antibiotique par l’intermédiaire de pompes à efflux.3 De manière générale, le problème de la résistance bactérienne peut être vu comme une équation dont les deux principales composantes sont l’agent antibactérien, qui entraîne la destruction des bactéries susceptibles et la sélection des bactéries résistantes, et les déterminants génétiques de la résistance bactérienne sélectionnés par les antibiotiques.4-6 Par conséquent, la résistance bactérienne émerge seulement lorsque les deux composantes sont présentes simultanément dans un environnement donné.
Au fil du temps, le problème de la résistance bactérienne s’est amplifié principalement en raison de l’utilisation abusive et inappropriée des antibiotiques. Par ailleurs, la situation ne va pas en s’améliorant étant donné la constante augmentation de la prévalence d’infections impliquant des bactéries résistantes aux antibiotiques comme
Staphylococcus aureus résistant à la méticilline (SARM), Enterococcus résistant à la
vancomycine (ERV) et Pseudomonas aeruginosa résistant aux fluoroquinolone depuis le début des années 1980.7 Il s’agit désormais d’un problème clinique et communautaire important avec l’apparition de bactéries dites multirésistantes, c’est-à-dire des bactéries qui sont résistantes à plus d’une classe d’antibiotiques. À titre indicatif, un rapport émis en 2013 par l’agence américaine Centers for Disease Control and Prevention (CDC) rapporte qu’il y a au moins 2 millions de cas d’infection par année aux États-Unis impliquant des bactéries
2
résistantes à un ou plusieurs antibiotiques, et de ce nombre, 23 000 individus en décèdent.8 De plus, ce rapport souligne le lourd fardeau fiscal rattacher à la problématique de la résistance bactérienne pour le système hospitalier. En parallèle, le nombre d’agents antimicrobiens approuvés par la Food Drug and Administration (FDA) est en constant déclin. Effectivement, entre 1983 et 1987, 16 nouveaux agents antimicrobiens ont été introduits sur le marché alors qu’entre 2008 et 2012, il n’y en avait que deux.9 De plus, depuis les trente dernières années, on dénombre très peu de nouvelles classes d’antibiotiques qui ont été commercialisées. En effet, deux nouvelles classes d’antibiotiques ont fait leur apparition sur le marché soit les oxazolidinones et les lipopeptides.10 Un autre élément important à souligner est que les nouveaux agents antibactériens sont souvent des analogues d’antibiotiques connus. Ainsi, le mécanisme d’action de ces nouvelles molécules est généralement le même ou similaire à celui de l’antibiotique ayant servi de modèle, ce qui fait en sorte que le processus d’acquisition de résistance est rapide. La combinaison de l’ensemble des faits préalablement exposés démontre l’importance de développer de nouveaux agents antibactériens faisant intervenir des mécanismes d’action inédits.
1.2 Peptides antimicrobiens naturels
Les peptides antimicrobiens naturels sont une classe de molécules faisant partie intégrante du système immunitaire de plusieurs organismes comme les mammifères, les plantes, les insectes, les amphibiens et les bactéries.11 Malgré la grande diversité de ces peptides, on constate qu’ils partagent des caractéristiques communes.12 Effectivement, ils possèdent une courte chaîne d’acides aminés (12 à 45 acides aminés), une charge nette positive (variant de +2 à +9) ainsi qu’un caractère amphiphile marqué. De plus, ces peptides antimicrobiens présentent plusieurs avantages vis-à-vis des antibiotiques utilisés en clinique. En fait, ils entraînent une destruction rapide de l’agent pathogène, ils ont un large spectre d’activité (bactéries à Gram positif et à Gram négatif), ils ont une tendance moindre à induire des mécanismes de résistance et ils présentent une action synergique avec certains antibiotiques.13 En plus de l’activité antibactérienne, certains peptides vont détenir une activité antifongique, antiparasitaire, antivirale et/ou anticancéreuse.14, 15 Toutefois, ils sont parfois toxiques envers les cellules eucaryotes. Ces derniers sont dits hémolytiques, c’est-à-dire qu’ils provoquent la lyse des érythrocytes ou globules rouges.16, 17 Le développement pharmaceutique des peptides antimicrobiens a également été ralenti en raison de leur faible stabilité dans les conditions physiologiques de même que le coût de
3 production qui est relativement élevé. En plus de leur activité antibactérienne, des études ont mis en évidence les propriétés immunomodulatrices de certains peptides antimicrobiens naturels.18-20 En outre, ils peuvent participer au recrutement et à l’activation des cellules immunitaires, à la neutralisation des endotoxines comme les lipopolysaccharides (LPS) et les acides lipothéicoïques (LTA), à la libération de l’histamine par les macrophages, à la cicatrisation des plaies, à l’inhibition des protéases libérées par les tissus, etc.
À ce jour, plus de 2600 peptides antimicrobiens sont répertoriés dans la banque de données : Antimicrobial Peptide Database (APD).21 Il existe principalement deux façons de classifier les peptides antimicrobiens naturels. Nous pouvons les classifier en fonction de leur conformation ou bien de leur provenance. Ainsi, seront exposées dans la prochaine section les différentes catégories de peptides antimicrobiens et des exemples de peptides antimicrobiens naturels pour chacun. Il est à noter que cette description ne sera pas exhaustive, mais elle se veut un portrait d'ensemble sur les peptides antimicrobiens naturels.
1.3 Classifications des peptides antimicrobiens naturels
1.3.1 Bactéries
Les bactéries à Gram positif et négatif font également usage des peptides antimicrobiens pour se défendre face aux autres bactéries environnantes qui pourraient leur faire compétition.22-26 La grande majorité des peptides antimicrobiens isolés des bactéries sont regroupés sous la dénomination de bactériocine. Les bactériocines sont des peptides antimicrobiens synthétisés par les ribosomes qui ont soit un spectre d’activité antibactérien étroit ou large. De manière générale, les bactériocines sont divisées en deux grandes catégories, c’est-à-dire les peptides qui subissent plusieurs modifications post-traductionnelles (classe I) ou les peptides non modifiés (classe II). De manière plus spécifique, les bactériocines produites par les bactéries à Gram négatif sont classifiées comme étant des peptides courts, comme les microcines, ou bien des protéines, comme les colicines. En ce qui a trait aux bactéries à Gram positif, nous retrouvons les peptides dits lantibiotiques, qui intègrent dans leur séquence primaire la lanthionine, un acide aminé constitué de deux alanines qui sont réticulés sur leur atome de carbone en position β par
4
un lien thioéther, la β-méthyl-lanthionine et des acides aminés ayant subi une déshydratation. Dans cette catégorie, il y a la nisine, un peptide qui a fait l’objet de nombreuses études et qui est produit par la bactérie Lactococcus lactis.27, 28 Entre autres, la nisine est doté d’un large spectre d’activité plus spécifiquement à l’endroit des bactéries à Gram positif et présente une activité antibactérienne élevée qui se situe dans l’ordre du nanomolaire. Elle est d’ailleurs utilisée dans l’industrie alimentaire comme additif alimentaire pour assurer la préservation et l’innocuité de certains aliments comme les produits laitiers. Dans la famille des lantibiotiques, nous retrouvons également la mersacidine, qui est sécrétée par les bactéries du genre Bacillus, et qui a démontré une activité antibactérienne comparable à la vancomycine lorsqu’elle était administrée à des souris infectées par la bactérie Staphylococcus aureus résistante à la méthicilline.29 Bien qu’ils ne fassent pas partie intégrante de la famille des bactériocines, il faut mentionner la gramicidine, qui est sécrétée par Bacillus brevis et qui est le premier agent antibactérien à avoir été testé cliniquement, la bacitracine, qui origine de l’espèce bactérienne Bacillus subtilis de même que les polymyxines, qui ont été isolées d’une souche bactérienne de Bacillus
polymyxa.30-33
1.3.2 Insectes
34-37La première défense chez les insectes est assurée par la barrière physique que représente l’exosquelette. Dans l’éventualité où les agents pathogènes réussissent à traverser cette barrière, d’autres mécanismes plus sophistiqués vont entrer en action. Parmi ceux-ci, il y a la synthèse et la libération de peptides antimicrobiens dans l’hémolymphe par le corps gras, qui est un organe interne similaire au foie chez les mammifères, et par les cellules épithéliales.38 Cette libération de peptides antimicrobiens permet de combattre efficacement les agents pathogènes en raison de l’effet synergique entre les différentes molécules bactéricides. En ce qui concerne la classification, nous retrouvons trois grandes catégories de peptides soit les peptides linéaires en hélice α, les peptides en feuillets β dont la structure est maintenue par des ponts disulfure et ceux dont la séquence primaire est enrichie en proline et/ou glycines. Dans la première catégorie, les cécropines représentent la famille la plus abondante et les premières cécropines provenant du règne des insectes ont été isolées dans un stade larvaire du papillon Hyalophora cecropia.39 Les cécropines sont exprimées dans plusieurs autres insectes faisant partie de l’ordre des diptères et lépidoptères. Ces peptides se caractérisent par la présence d’un résidu tryptophane en
5 position 1 ou 2 et une amidation de l’acide aminé en position C-terminale.38 Il y a aussi la mélittine, un peptide de 26 résidus ayant été isolé dans le venin de l’abeille européenne
Apis mellifera, qui présente à la fois une activité hémolytique et antibactérienne.40 Ce peptide a fait l’objet de nombreuses études biophysiques afin de mieux comprendre son mécanisme de perturbation membranaire.41, 42 En termes d’activité antimicrobienne, les peptides antimicrobiens en hélice α isolés des insectes sont particulièrement sélectifs aux bactéries à Gram négatif et ne sont pas hémolytiques lorsque des tests in vitro sont effectués à des concentrations dans l’ordre de grandeur de la concentration minimale inhibitrice (MIC). Pour ce qui des peptides ayant une conformation en feuillet-β, nous retrouvons les peptides de la famille des défensines. Les défensines sont impliquées dans le système immunitaire de la quasi-totalité des insectes et sont actives en présence de la majorité des bactéries à Gram positif, et ce, à des concentrations dans l’ordre du μM. Dans cette même catégorie, nous retrouvons également la thanatine, un peptide antimicrobien produit par la punaise Podisus maculiventris.43 Ce peptide de 21 acides aminés à une structure en épingle à cheveux (β-hairpin) stabilisée par un pont disulfure.44 Ce peptide a un excellent potentiel thérapeutique en raison du fait qu’il n’est pas toxique envers les cellules eucaryotes et qu’il possède un large spectre d’activité contre les bactéries à Gram positif et négatif de même que les fongi. Quant à la troisième catégorie qui est associée aux peptides linéaires enrichis en prolines, ils ont été principalement isolés chez les abeilles et les guêpes (abaecines et apidaecines), les fourmis (formaecines), Drosophila melanogaster (drosocines et metchnikowines), et le ver à soie de Bombyx mori (moricines), etc.38, 45 La séquence primaire de ces peptides comprend entre 14 et 39 acides aminés acides aminés dont 25 % ou plus sont des résidus proline. De manière générale, ces résidus proline font partie intégrante de motifs dans lesquels deux résidus proline sont séparés par un résidu basique comme l’arginine ou l’histidine.
1.3.3 Plantes
46-48Les peptides antimicrobiens sont un élément important du système immunitaire des plantes puisqu’elles sont seulement dotées d’une réponse immunitaire non spécifique. Ainsi, nous retrouvons les peptides antimicrobiens dans plusieurs structures des plantes comme les graines (période de germination), les feuilles et les fleurs. Les deux plus grandes classes de peptides antimicrobiens chez les plantes sont les thionines et les défensines. Les thionines, une famille de peptides seulement retrouvée chez les plantes, ont une activité
6
contre plusieurs organismes soit les bactéries à Gram positif et négatif, les fungi, les levures et certaines sont toxiques contre les cellules des insectes et des mammifères.49 D’un point de vue structural, elles contiennent plusieurs résidus cystéines impliqués dans des ponts disulfures (3 ou 4) et des résidus basiques comme l’arginine et la lysine. De plus, les thionines partagent un motif structural commun en forme de L qui consiste en 2 hélices α antiparallèles formant le long bras et deux feuillets β antiparallèles formant le court bras et ces deux segments sont séparés par une zone creuse.49, 50 Les thionines α/β sont divisées en 5 catégories (I, II, III, IV et V) et ce sont les différences au niveau de la charge, du nombre de cystéines et le patron pour la formation des ponts disulfures qui permettent d’attribuer une catégorie à une thionine.51 Le premier peptide antimicrobien isolé dans le règne des plantes fut isolé dans l’endosperme du blé et il consistait en un mélange de α-et β-purothionines.52, 53 Ces deux peptides ont démontré une activité antibactérienne à l’endroit des bactéries, des insectes et des levures. En plus des thionines, un grand nombre de peptides de la famille des défensines interviennent également dans l’immunité des plantes. De manière générale, les défensines des plantes possèdent une structure tertiaire similaire qui est stabilisée par la formation de 4 ponts disulfures.54 De manière plus précise, cette structure tertiaire est constituée d’une hélice α et trois brins organisés en feuillets β antiparallèles du type βαββ alors que pour les défensines des animaux, l’hélice α est localisée au niveau de la région N-terminale pour générer une structure du type αβββ.49, 50 Dans le cas des plantes, elles sont plus susceptibles aux attaques fongiques que par les attaques bactériennes, ce qui expliquent l’activité antifongique plus importante des peptides isolés en comparaison avec l’activité antibactérienne.55 Certaines défensines répertoriées ont une activité antibactérienne comme Pp-AMP1 et Pp-AMP2, deux peptides isolés des racines du bambou Phyllostachys pubescences.56 Il est à noter qu’il existe d’autres familles de peptides qui exercent une activité antimicrobienne soit les peptides macrocycliques (cyclotides), les snakines, les protéines de transfert des lipides et les peptides s’apparentant aux hévéines, vicilines ainsi que les knottines.57
1.3.4 Amphibiens
58-61La peau des amphibiens renferme une grande quantité de glandes granulaires et ces derniers sécrètent un ensemble de molécules actives comme des molécules bactéricides. La libération de ces biomolécules est contrôlée par le système nerveux et elle survient lorsque l’organisme est soumis à des stimuli externes.62 La grande diversité de