L’ÉTUDE DE LA FONCTION BIOLOGIQUE ET DE LA CRISTALLOGENÈSE DE LA 17β-HYDROXYSTÉROÏDE DÉSHYDROGÉNASE TYPE 7 Mémoire Jean-François Thériault Maîtrise en physiologie-endocrinologie Maître ès sciences (M. Sc.) Québec, Canada © Jean-François Thériault, 2016
L’ÉTUDE DE LA FONCTION BIOLOGIQUE ET DE LA CRISTALLOGENÈSE DE LA 17β-HYDROXYSTÉROÏDE DÉSHYDROGÉNASE TYPE 7
Mémoire
Jean-François ThériaultSous la direction de :
iii Résumé
L’estrogène le plus actif, soit l’œstradiol (E2), stimule la prolifération des cellules du cancer du sein, alors que la dihydrotestostérone (DHT), qui est l’androgène le plus actif, prévient la croissance des cellules du cancer du sein
hormonodépendant dans certaines concentrations et conditions
physiologiques. Il a été rapporté que la 17β-hydroxystéroïde déshydrogénase de type 7 (17β-HSD7) détient deux activités enzymatiques. La première activité est la réduction de l’E1 en E2 et la seconde activité est l’inactivation
de la DHT en 3β-diol qui pourrait permettre de jouer un rôle dans la
cancérogenèse des cellules tumorales du cancer du sein hormonodépendants. À ce jour, très peu d’informations sont disponibles à propos des activités catalytiques de cette protéine et aucune structure tridimensionnelle n’est disponible pour mieux comprendre l’implication et les mécanismes enzymatiques de la 17β-HSD7 dans la stéroïdogenèse.
Dans cette étude, nous avons développé un protocole permettant l’expression et la purification de la 17β-HSD7 active et stable à partir d’un système bactérien. Nous avons aussi déterminé les paramètres de cinétique enzymatique à l’état stationnaire et nous avons obtenu des conditions de cristallisation qui ont permis d’obtenir des cristaux préliminaires. Les résultats de cinétique enzymatique ont démontré que la 17β-HSD7 réduit l’E1 en E2 et la DHT en 3β-diol à des vitesses de conversion et des spécificités de même ordre.
De plus, nous avons confirmé que l’inhibition de la 17β-HSD7 avait un impact aussi important dans la diminution de la vitesse de conversion de l’E1 en E2 que l’inhibition de la 17β-HSD1 dans des lignées cellulaires de tumeurs du sein hormonodépendant. Aussi, la 17β-HSD7 est beaucoup plus spécifique pour la réduction de la DHT que la 17β-HSD1 a une activité réductrice de la DHT. Ces résultats mettent en évidence le rôle de la 17β-HSD7 dans la carcinogenèse du cancer du sein.
iv Abstract
The most potent estrogen, estradiol (E2), stimulates proliferation, while the dihydrotestosterone (DHT) prevents it in estrogen dependent breast cancer cells. It brought reported that 17ß-HSD7 has two major reduction activities which can reduce E1 to E2 and inactivate the DHT to 3ß-diol. To this day, the detailed kinetic parameters and crystalline structure of the 17ß-HSD7 are unknown and theses knowledge allow a better understand of is implication in steroidogenesis.
In this study, a purification protocol was developed to obtain pure 17ß-HSD7 in bacterial system to determine the steady state kinetic parameters of the 17ß-HSD7, and also its crystallization condition. Firstly, we were able to express and purify the 17ß-HSD7 in E. coli at purity over 95%. Secondly, the results of enzymatic kinetics demonstrated that the 17ß-HSD7 reduced both steroids at similar rates. Finally, the crystallization conditions were determined to growth some preliminary crystals of the 17ß-HSD7.
Furthermore, we were able to confirm that the inhibition of the 17ß-HSD7 had a higher impact in to decrease the conversion of E1 in E2 than the inhibition of the 17ß-HSD1 in breast cancer cell lines. At the same time the 17ß-HSD7 demonstrates an effect on DHT reduction much more important than the 17ß-HSD1. These results highlight the role of the 17ß-HSD7 in the carcinogenesis of the breast cancer.
v Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations et symboles ... x
Remerciements ... xv
Avant-propos... xvii
Chapitre I: Introduction ... 1
1.1. Les hormones stéroïdiennes ... 1
1.1.1. Généralité ... 1
1.1.2 Les hormones sexuelles ... 2
1.1.2 Les hormones sexuelles non stéroïdiennes... 6
1.2 Les récepteurs nucléaires (NR) ... 9
1.2.1 Le récepteur des androgènes (AR) ... 12
1.2.2 Le récepteur des estrogènes (ER) ... 13
1.3 Les cancers hormonodépendants ... 14
1.3.1 Le cancer de l’endomètre ... 15
1.3.2 Le cancer de la prostate ... 16
1.3.3 Le cancer du sein ... 16
1.4 La biosynthèse des hormones sexuelles ... 18
1.4.1 L’intracrinologie ... 19
1.4.2 La stéroïde sulfatase (STS) ... 21
1.4.3 L’aromatase ... 22
1.4.4 Les 17β-hydroxystéroïde déshydrogénases (17β-HSD) ... 22
1.5 Projet de recherche ... 27
1.5.1 Les hypothèses de recherche ... 28
1.5.2 Les objectifs de recherche ... 28
Chapitre II: Purification, cristallisation et mesure de l’activité enzymatique spécifique de la 17β-HSD7. ... 29
vi
2.1.1. Expression de la 17β-HSD7 recombinante ... 29
2.1.2. Purification de la 17β-HSD7 ... 30
2.1.3. Test de solubilisation ... 32
2.1.4. Séquençage par spectrométrie de masse ... 33
2.1.5. Évaluation quantitative des protéines ... 33
2.1.6. Test de cristallisation préliminaire ... 34
2.1.7. Essai enzymatique ... 35
2.1.8. Étude de cinétique à l’état stationnaire ... 36
2.2 Résultats et discussion ... 37
2.2.1 Expression bactérienne et test de solubilité de la 17β-HSD7 ... 37
2.2.2 Purification de la 17β-HSD7 ... 40
2.2.3 Cristaux préliminaires de la 17β-HSD7 ... 43
2.2.4 Détermination de l’activité enzymatique de la 17β-HSD7 ... 46
Chapitre III: Effet d’inhibiteur sur la vitesse de conversion en estradiol de la 17β-HSD7 ... 51
3.1. Introduction ... 51
3.2. Méthodologie ... 51
3.2.1. Les inhibiteurs et les produits chimiques ... 51
3.2.1. Culture cellulaire ... 52
3.2.2. Essai enzymatique ... 53
3.3. Résultats et discussion ... 54
3.3.1 Détermination de la conversion de l’E1 en E2 dans les cellules MCF7 ... 54
Chapitre IV: Conclusions et perspectives ... 57
4.1. Conclusions ... 57
4.2. Perspectives ... 58
vii
Liste des tableaux
Tableau 1. Résumé des substrats et des cofacteurs de la famille des 17HSD. 14 des 15
membres des HSDs sont représentées (Moeller G. et al. 2009) ... 24
Tableau 2. Paramètres de cinétique à l’état stationnaire de la 17β-HSD7 recombinante
purifiée. ... 50
viii
Liste des figures
Figure 1. Reproduction d’un stérane et de sa nomenclature. La structure des différentes
hormones stéroïdiennes provient de cette structure. ... 2
Figure 2. Représentation de l’effet des hormones gonadotropes sur les caractéristiques
sexuelles (Smith, et al. 1995) ... 9
Figure 3. Classification des NR selon l’arbre phylogénétique des 65 NR découverts (Nuclear
Receptors Nomenclature Committee, 1999). ... 11
Figure 4. Représentation de l’effet de l’E2 et d’autres stéroïdes dans le cancer du sein. Les
stéroïdes conduisent à la prolifération cellulaire qui augmente le risque d’erreur génétique
emmenant au phénotype malin. (Brian E. Henderson et al 1999). ... 15
Figure 5. Représentation schématique de la double fonction de l’E2 dans le cancer du sein
agissant comme facteur de prolifération et d’agent procarcinogène. (Yang et al. 2007). ... 18
Figure 6. Illustration schématique de la stéroïdogenèse des androgènes et des estrogènes
dans les tissus intracrines humains (Aka JA, et al. 2009). ... 21
Figure 7. Séquence en acide aminé de la 17β-HSD7expriméeà partir de la construction
plasmidique. En rouge, l’étiquette d’His rajoutée. ... 29
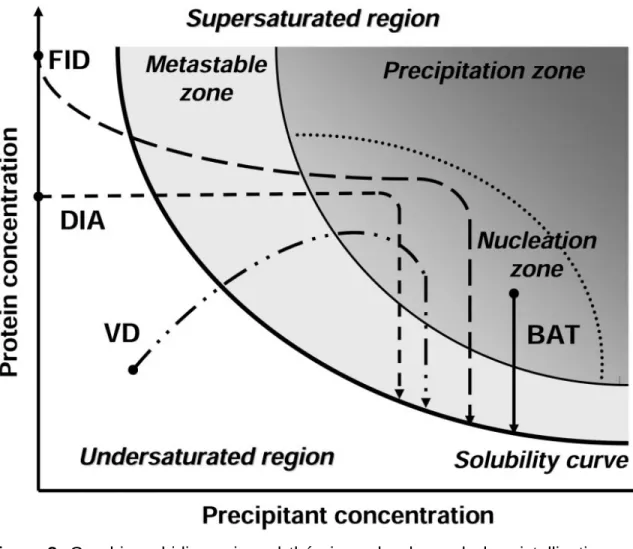
Figure 8. Graphique bidimensionnel théorique de phase de la cristallisation démontrant
comment obtenir la sursaturation nécessaire dans le but de cristalliser des protéines en
variant les facteurs. (A. Vergara et al., 2002). ... 35
Figure 9. Expression de la 17β-HSD7 dans les cellules BL21 (DE3). Électrophorèse sur gel
SDS_PAGE 12 % avec 20 µL et 8 µL du milieu de culture avant et après expression
respectivement avec 0,5 mM d’IPTG durant 4 h. Les différents puits représentent l’expression de la 17β-HSD7avant et après l’ajout d’IPTG dans différents tubes de culture. Le gel a été coloré avec le bleu de Commassie. Lignes : M) Marqueurs protéiques : 97,4 kDa, 66,2 kDa, 45,0 kDa, 31,0 kDa, 21,5 kDa et 14,4 kDa : 1) Tube 1 avant ajout IPTG ; 2) Tube 1 après 4 h de l’ajout IPTG ; 3) Tube 2 avant ajout IPTG ; 4) Tube 2 après 4 h de l’ajout IPTG ; 5) Tube 3 avant ajout IPTG ; 6) Tube 3 après 4 h de l’ajout IPTG ; 7) Tube 4 avant ajout IPTG ; 8)
Tube 2 après 4 h de l’ajout IPTG. ... 39
Figure 10. Graphique de l’absorbance durant la purification par filtration sur gel. La ligne
bleue correspond à l’absorbance à 280 nm et la ligne rouge à 254 nm. Un gel de SDS_PAGE à 12 % d’acrylamide coloré au bleu de Coomassie dans le coin supérieur représentant les fractions obtenues après cette purification. 20 µL de chacune des fractions ont étant ajouté dans chacun des puits. Un marqueur standard avec les poids moléculaires est indiqué sur le gel. ... Erreur ! Signet non défini. Figure 11. Analyse peptidique par spectrométrie de masse de la bande correspondante à
la17β-HSD7. ... 42
Figure 12. Gel de SDS-PAGE à 12 % coloré au Lucy 506 pour analyser de la pureté
peptidique. Puit 1 : Marqueur ; 2 : 0,1 µg échantillon ; 3 : 0,5 µg échantillon ; 4 : 1 µg
échantillon ; 5 : 2 µg échantillon. ... 43
Figure 13. Photographies des cristaux préliminaires obtenues dans deux conditions
modifiées du kit de cristallisation MembFac. Photo de gauche représente des cristaux après 14 jours de croissance avec un agrandissement optique de 60X. La photo de droite
représente des cristaux en forme d’aiguille avec un agrandissement optique de 40X. ... 45
Figure 14. Graphique de Lineweaver–Burk de la réduction de l’E1 catalysé par la 17β-HSD7
ix
concentration de l’E1 pour la même réaction. La réaction suit une cinétique Michaelis-Menten normale. ... 49
Figure 15. Graphique de Lineweaver–Burk plot de la réduction de la DHT catalysé par la
17β-HSD7 utilisant le NADPH comme cofacteur. L’insertion contient la vélocité par rapport à la concentration de DHT pour la même réaction. La réaction suit une cinétique
Michaelis-Menten normale. ... 50
Figure 16. Vitesse de conversion de l’E1 en E2 dans les cellules MCF-7. Les vélocités ont
été calculées à partir de l’E2 produit en h à partir de trois concentrations ajoutées d’’E1 radioactif. Chacune des barres représente la moyenne de l’expérience en triplicata
x
Liste des abréviations et symboles
Chimie et biologie3β-diol 5α-androstane-3 β, 17β-diol
4-dione Androstènedione
5-diol Androstènediol
3-HSD 3 β-hydroxystéroïde déshydrogénase
17βHSD 17β -hydroxystéroïde déshydrogénase
17β-HSD1 17β -hydroxystéroïde déshydrogénase de type 1
17β-HSD7 17β -hydroxystéroïde déshydrogénase de type 7
17β-HSD12 17β -hydroxystéroïde déshydrogénase de type 12
17α-OH-P 17α-hydroxyprogestérone
17α-OH-PREG 17α-hydroxyprégnénolone
20 α-OH-P 20a-dihydroprogestérone
aa Acide aminé
ACTH Hormone corticotropine
A-dione Androstanedione
ADN Acide désoxyribonucléique
ADNc ADN complémentaire
ADT Androstérone
AMPc Adénosine monophosphate cyclique
AR Récepteur des androgènes
ARE Élément de réponse aux androgènes
ARN Acideribonucléique
ARNm ARN messager
ATP Adénosine triphosphate
C12E8 Octaéthylène glycol monododecyléther
DHEA Déhydroépiandrostérone
DHEA-S Sulfate de déhydroépiandrostérone
DHT 5α-Dihydrotestostérone
xi
El Estrone
E2 Estradiol
E3 Estriol
EDTA Acide éthylène diamine tétraacétique
epi-ADT epi-androstérone
ER Récepteur des estrogènes
Erα Récepteur des estrogènes de type alpha
Erβ Récepteur des estrogènes de type beta
ERE Élément de réponse aux estrogènes
FBS Sérum de veau fœtal
FSH Hormone folliculo-stimulante
GnRH Hormone de libération des gonadotrophines
hypophysaires
GR Récepteur des glucocorticoïdes
His Histidine
HRE Élément de réponse aux hormones
HSP Protéine de choc thermique
IL-6 Interleukine 6
LDL Lipoprotéines de basses densités
LH Lutéotropine
Lys Lysine
MR Récepteur des minéralocorticoïdes
NAD+ Nicotinamide adénine dinucléotide
NAD(H) Nicotinamide adénine dinucléotide réduite
NADP+ Nicotinamide adénine dinucléotide phosphate
NADP(H) Nicotinamide adénine dinucléotide phosphate
réduite
P Progestérone
p21 Inhibiteur de kinase cycline dépendant de type 1
P450aro P450 aromatase
xii
P450scc L’enzyme de clivage de la chaîne latérale du
cholestérol
PCR Réaction de polymérisation en chaîne
PK-A Protéine kinase A
PR Récepteur de la progestérone
PRL Prolactine
T Testostérone
TRE Élément de réponse aux hormones thyroïdiennes
Tris-HCl Tris(hydroxyméthyle) aminométhane hydrochloride
Tyr Tyrosine
Mathématique et unité de mesure
°C Degré Celsius Mg Milligramme µg Microgramme ng Nanogramme M Molaire mM Millimolaire µM Micromolaire hr Heure min Minute sec Seconde pb Paire de bases kb Kilobases ml Millilitre µl Microlitre Da Dalton kDa KiloDalton
kcat Constante catalytique de l’enzyme
xiii
xiv
Les humains sont le résultat d’un chemin évolutif d’une exquise complexité, plein de faux départs,
d’impasses et d’accidents statistiques. Carl Sagan
xv Remerciements
Je voudrais tout d’abord remercier professeur Sheng-Xiang Lin pour m’avoir accueilli à bras ouvert comme stagiaire et me permettre de continuer mes études dans son groupe. Grâce à vous, j’ai pu apprendre plusieurs techniques et connaissances en enzymologie et en cristallographie. Votre aide et votre support m’ont permis de continuer dans ce fabuleux univers qui est la science.
J’aimerais remercier M. Dao-Wei Zhu et Bo Zhang pour la formation prodiguer durant mon stage et ma maitrise. Vos précieux conseils et votre expérience en biologie structurale m’ont permis d’obtenir les connaissances à l’avancement de mon projet de recherche. Je voudrais aussi remercier Xiao-Qiang Wang pour les conseils qu’il m’a prodigués sur la biologie cellulaire. Je voudrais aussi remercier tous les autres membres du groupe actuels et anciens pour leur support, leur aide et les diverses discussions à propos de la science et de tout : Stephen Preyesh, Tang Lee, Jian Song, Xiaoye Sang, Han Hui, Ruixuan Wang, Xu Dan, Mouna Zeradi, Ming Zhou, Leyi Lin, Alessander Ramos, Ali Lopez Sarmiento, Chenyan Zhang et Gauri Misra. Je tiens aussi à souligner les discussions scientifiques ou pas avec Martin Perrault et Maxime Lespérance au CHUL.
Un remerciement spécial pour Ronald Maheux et Martin Thibault, pour leur aide dans l’analyse des images, mais aussi pour tout le soutien technique et logistique que vous m’avez donné. Sans vous, il aurait impossible de mettre mon projet à terme. Je tiens à remercier l’équipe du Dr Donald Poirier d’avoir fourni et synthétisé les inhibiteurs.
Je tiens à remercier tous mes amis spécialement Mathieu et Franky pour le bon temps que l’on a eu durant nos études. Vous m’avez permis de passer discuter ouvertement de tout et de rien. Toutes les différentes activités m’ont permis de me libérer l’esprit et de relâcher la pression.
xvi
Enfin, je voudrais dire un gros merci à mes parents pour tout le support que vous m’avez donné durant mes études. Mais, aussi pour tout l’amour, l’attention et les sacrifices qui mon permis de me rendre à ce niveau. Sans votre dévouement et encouragement, il aurait été impossible pour moi de faire ces études graduées.
xvii Avant-propos
J’ai réalisé mes études à la maitrise au centre de recherche en endocrinologie et néphrologie du CHUL (CHU de Québec) et à l’université Laval. Mes travaux de recherche se sont concentrés surtout sur la biologie structurale et l’enzymologie de protéines reliées à la stéroïdogenèse. Plus précisément, j’ai étudié et j’ai appris les techniques pour l’expression des protéines impliquées dans la stéroïdogenèse à partir des techniques de biologie moléculaire, mais aussi les méthodes pour leur purification, leur cristallisation et leur cinétique enzymatique. J’ai acquis durant mes études d’autres techniques comme l’étude d’affinité, la culture cellulaire d’eucaryote et le clonage bactérien. J’ai commencé mes travaux comme stagiaire dans le groupe de Dr Lin en assistant les recherches de Bo Zhang, ancien étudiant au doctorat, sur le projet de purification et de cristallisation du récepteur estrogénique. Par la suite, j’ai été impliqué sur les projets de la biologie structurale de la 17β-HSD7 et aussi d’autres protéines avec l’assistance de Dao-Wei Zhu, un professionnel de recherche. Au courant de mes études à la maitrise, j’ai été impliqué dans plusieurs projets de cristallisation tels que la 17βHSD-12 et la rLCN6. Cependant, j’ai concentré mes recherches sur la 17β-HSD7.
Ce mémoire contient quatre chapitres sur l’étude de la 17β-HSD7. Le premier chapitre correspond à une introduction générale sur les connaissances de la stéroïdogenèse accentuée sur celles reliées au cancer du sein hormonodépendant. Dans l’introduction, il est expliqué en détail les fonctions et les rôles de certaines protéines impliquées dans cette pathologie plus spécifiquement la 17β-HSD1 et 17β-HSD7. Enfin, les hypothèses de recherche et les objectifs sont aussi décrits à la fin de ce chapitre.
Le second chapitre représente les résultats de cinétique enzymatique de la 17β-HSD7 et de la cristallisation préliminaire qui reprend les travaux débutés par Dao-Wei Zhu. Durant mes études, j’ai modifié le protocole qu’il a établi pour la purification et la cristallisation de cette enzyme. J’ai aussi réalisé les
xviii
études de cinétique in vitro de cette protéine en comparant les valeurs de conversion enzymatique de l’activation de l’E2 à partir de l’E1 et de l’inactivation de la DHT en 3β-diol.
Le chapitre 3 présente des résultats complémentaires à ceux présentés dans l’article de Xiao-Qiang Wang publié le Journal of Molecular Cell Biology, dont je suis coauteur, au sujet du rôle de la 17β-HSD7 dans les cellules tumorales mammaires. Mes travaux dans cet article sur la détermination de l’impact d’inhibiteurs ciblant spécifiquement la 17β-HSD1 et la 17β-HSD7 dans la vitesse de conversion de l’E1 en E2 ont permis de confirmer les résultats de Xiao-Qiang Wang. Les expériences de cet article mon permis d’apprendre les techniques de culture cellulaire de lignées reliées aux tumeurs du sein et d’appliquer les techniques de cinétique enzymatique que j’ai appris auparavant.
Enfin, le chapitre 4 de ce mémoire comporte les conclusions de ces travaux et les perspectives découlant des résultats et discussions des chapitres 2 et 3.
1 Chapitre I Introduction
1.1. Les hormones stéroïdiennes 1.1.1. Généralité
Les hormones stéroïdiennes sont des molécules de signalisation produites par des glandes. Dans la majorité des cas ces hormones sont transportées par un système de transport vers un organe cible pour se lier à un récepteur spécifique, soit membranaire ou nucléaire selon le type d’hormone [1]. Suite à la liaison de l’hormone à son récepteur, la transduction du signal peut se faire selon différentes voies. Dans le cas des récepteurs membranaires qui lient une hormone hydrosoluble, la transduction se fait via l’AMPc ou la phospholipase C. En ce qui concerne les hormones liposolubles, la transduction s’effectue par leur liaison à un récepteur nucléaire situé dans le cytosol qui par la suite est transporté dans le noyau pour se lier à des régions spécifiques de l’ADN [2]. Lors de la liaison de l’hormone à son récepteur plusieurs effets sur la cellule sont observés produits par des mécanismes génomiques étant lents et/ou des mécanismes non génomiques qui sont rapides [3].
Les hormones stéroïdiennes proviennent du cholestérol soit exogène ou endogène et ils partagent tous un centre perhydrocyclopentanophénanthrène contenant trois cycles à six carbones et un cycle à cinq carbones (Figure 1). Les molécules de cette famille d’hormone sont très hydrophobes leur permettant de passer à travers la membrane cellulaire sans l’aide d’un transporteur. Cette hydrophobicité permet d’entrer facilement dans la cellule afin qu’ils exercent leurs différentes activités biologiques par leurs récepteurs respectifs [4]. Les hormones stéroïdiennes sont classifiées en cinq différents groupes selon le récepteur, tous étant nucléaires, qu’elles peuvent lier soit les
2
glucocorticoïdes, les minéralocorticoïdes, les androgènes, les estrogènes et les progestatifs.
Plusieurs fonctions ont été rattachées à ces molécules telles que le contrôle du métabolisme, de l’inflammation, des fonctions immunitaires, de la balance osmotique, du développement des caractéristiques sexuelles et de l’habileté de résister à la maladie et à la douleur [1, 3].
Figure 1. Reproduction d’un stérane et de sa nomenclature. La structure des différentes hormones stéroïdiennes provient de cette structure.
1.1.2 Les hormones sexuelles
Les hormones sexuelles qui regroupent trois classes d’hormones stéroïdiennes soit les estrogènes, les androgènes et les progestines sont les molécules détenant des rôles dans les fonctions reliées aux caractéristiques sexuelles, de la reproduction et de la fertilité [5]. Elles sont synthétisées soit par les gonades, les glandes surrénales ou par la conversion à partir de stéroïdes sexuels dans les tissus périphériques [6].
1.1.1.1 Les estrogènes
Les estrogènes, provenant du grec « oistros » qui désigne figurativement la passion sexuelle et avec le suffixe –gène signifiant producteur de [7], sont les hormones principalement reliées au développement du système de
3
reproduction et des caractéristiques sexuelles secondaires chez les femelles telles que les comportements et les traits physiques. Les estrogènes sont divisés en deux types les stéroïdiens et les non-stéroïdiens. Ils sont caractérisés pour leur affinité au récepteur des estrogènes (ER) qui est responsable de la modulation de l’expression de plusieurs gènes reliée aux traits féminins décrits plus haut [8].
Les estrogènes sont produits chez tous les vertébrés, mais aussi chez certains insectes démontrant un rôle ancestral important [9, 10]. Ce type d’hormone contient 18 atomes de carbone et une aromatisation dans le cycle A du stérane. Il existe aussi des estrogènes de types non-stéroïdiens qui ne sont pas nécessairement des stéroïdes et ne sont pas synthétisés chez les
mammifères [11]. Ces molécules non-stéroïdiennes pouvant être
synthétiques ou naturelles possèdent une activité estrogénique pouvant être faible à élevé. Les estrogènes synthétiques sont appelés xénoestrogènes et les estrogènes produits par les plantes sont nommés phytoestrogènes. Les estrogènes provenant des champignons sont nommés mycoestrogènes. Trois différents estrogènes stéroïdiens sont retrouvés naturellement chez l’humain soit l’estrone (E1), l’estradiol (E2) et l’œstriol (E3) et leurs concentrations varient selon la période du cycle menstruel et la ménopause. De ces trois hormones, c’est l’estradiol qui détient la plus grande affinité pour le récepteur des estrogènes [12].
En plus du rôle important des estrogènes au développement du système reproductif et aux caractéristiques sexuelles féminines, ils stimulent le développement de la muqueuse utérine et au processus de fécondation [2]. À l’intérieur des glandes mammaires, les estrogènes avec la progestérone sont nécessaires à la préparation de la glande pour la lactation [13]. Les estrogènes sont aussi importants à la régulation du cycle menstruel par l’action de l’estradiol favorisant la maturation du follicule et de l’ovule. Cette maturation stimule la prolifération de la muqueuse utérine pendant les deux premières phases du cycle menstruel, soit la phase folliculaire et l’ovulation
4
provoquant l’épaississement de la muqueuse vaginale et la desquamation des cellules épithéliales riches en glycogène du vagin [2]. Les estrogènes ont aussi comme rôle de modifier la consistance de la glaire cervicale afin de favoriser la migration des spermatozoïdes à travers le col de l’utérus et leur survie en période d’ovulation. De plus, ils permettent de régler la vitesse de migration de l’ovule dans l’oviducte et de jouer un rôle dans la capacitation [14-18]. D’autres fonctions sont reliées aux estrogènes, par exemple, ils sont actifs dans le système nerveux central et ils influencent différents comportements sexuels et sociaux. De plus, il a été démontré que les estrogènes modulent la sécrétion de LH et de FSH pouvant même modifier la concentration du ER [19].
1.1.1.2 Les androgènes
Les androgènes sont des molécules généralement des hormones stéroïdiennes pouvant être naturelles ou synthétiques liant le récepteur des androgènes. Ce type de stéroïde joue un rôle dans les traits et les organes reproductifs masculins. Le nom de ce type d’hormones sexuelles provient du grec « andro » signifiant masculin et il a été découvert en 1936 par Leopold Ruzicka en étudiant la structure chimique du « androgenic principle » [20]. Les androgènes contiennent 19 atomes de carbone et ils sont les précurseurs des estrogènes stéroïdiens. Les androgènes les plus actifs sont la testostérone (T) et la dihydrotestostérone (DHT). Ces deux androgènes ont une très forte affinité pour le récepteur des androgènes à des constantes de dissociation similaire situées au niveau du nanomolaire [21]. Outre ces deux molécules, il existe d’autres androgènes tels que la DHEA, l’androstènedione, le 5-androstènediol et l’androstérone fonctionnant comme des stéroïdes faibles qui sont plutôt associés à des précurseurs ou métabolites de la T ou de la DHT. Même si chez les femmes, il y a une production des androgènes qui module par exemple les comportements sexuels, la production est beaucoup plus élevée chez le mâle et plusieurs effets y sont reliés.
5
Les principaux effets des androgènes sont l’induction et le maintien de la différenciation, le développement des organes génitaux et des caractères sexuels secondaires mâles telles la pilosité, la musculature et la mue de la voix. La T est responsable du développement du système génital interne, de l’épididyme, des vésicules séminales et du canal déférent, mais aussi elle permet de stimuler la différenciation sexuelle, la spermatogénèse et les pulsions sexuelles. Tandis que la DHT est responsable du développement des organes génitaux externes et de la prostate [2].
Les androgènes ont aussi un effet sur le développement des canaux de Wolff pendant le développement embryonnaire, la différenciation fonctionnelle de l’hypothalamus et sur le comportement [22]. Les androgènes régulent aussi plusieurs autres fonctions dans le corps humain, dont l’augmentation du métabolisme des lipides, la stimulation de l’érythropoïèse, et ils ont un effet anabolique sur le muscle squelettique et les os [23, 24].
1.1.1.3 Les progestatifs
Les progestatifs constituent la troisième classe d’hormones stéroïdiennes sexuelles ayant comme caractéristique de se lier au récepteur de la progestérone. Tous les progestatifs contiennent un squelette de 21 atomes de carbones nommé prégnane. Il existe différentes molécules dans cette catégorie, mais c’est la progestérone (P) qui possède la plus grande activité.
Ils existent d’autres progestatifs endogènes comme la 20-
α-dihydroprogestérone, la 17-hydroxyprogestérone, la 5α-dihydroprogestérone et la 11-deoxycorticostérone, mais leurs effets et leurs fonctions sont d’une importance moindre. Les progestérones synthétiques sont généralement référées sous le nom de progestines. Les progestatifs ont un rôle important chez la femme dans le maintien de la grossesse, mais aussi dans les cycles de menstruation et dans le cycle de l’œstrus chez certains animaux [25, 26]. Les progestatifs permettent lors de la fécondation de l’ovule de préparer le tractus génital à son implantation, mais aussi au développement et au
6
maintien du fœtus dans le tractus génital lors de la grossesse afin d’éviter le rejet par la mère. Ce maintien est causé par de fortes concentrations en P sur le myomètre qui crée un effet relaxant permettant d’empêcher la contraction de cette paroi [27, 28]. Lorsque la concentration de cette hormone diminue, il y a le déclenchement des contractions utérines provoquant l’accouchement, mais aussi l’évacuation de l’ovule lorsqu’il n’est pas fécondé.
La P joue un rôle important dans le développement des glandes mammaires. En conjugaison avec la prolactine, une petite protéine hormonale, il induit la maturation du lobulo-alvéolaire des seins pendant la grossesse permettent la production du lait après la naissance [29]. De plus, cette maturation doit se faire en présence de l’E2, car cet estrogène permet d’augmenter l’expression du récepteur de la progestérone [30]. Certaines études ont démontré que la P peut agir comme un neuroprotecteur en réduisant l’inflammation à la suite d’un trauma au cerveau [31, 32].
1.1.2 Les hormones sexuelles non stéroïdiennes
Il existe certaines hormones classées comme des hormones sexuelles, mais qui ne sont pas des stéroïdes. Ces hormones sont des glycoprotéines ou des peptides telles que l’hormone lutéinisante (LH), l’hormone folliculo-stimulante (FSH), adrénocorticotrophine (ACTH) et l’hormone de libération des gonadotrophines hypophysaires (GnRH). Contrairement aux stéroïdes, ils sont hydrophiles et ils ne traversent pas la membrane cellulaire, mais ils se lient plutôt à un récepteur membranaire générant un signal chimique dans la cellule dans le but de produire une réponse [33].
1.1.2.1 L’ hormone folliculo-stimulante (FSH)
La FSH est synthétisée et sécrétée par les gonadotropes de la glande pituitaire antérieure et elle régule la croissance, le développement, la puberté et les processus reproductifs du corps. Avec la LH, ils travaillent en synergie dans les fonctions reproductives [34].
7
La FSH détient plusieurs rôles dans les ovaires. La FSH stimule la croissance et le recrutement des follicules ovariens immatures dans les ovaires. Dans les petits follicules antraux, la FSH est le facteur majeur de survie empêchant leur apoptose. Lors du cycle menstruel, la paroi des ovaires est fragilisée par la forte concentration en FSH permettant le détachement de l’ovule [35].
Chez l’homme, la FSH stimule les spermatocytes primaires permettant la première division de la méiose créant les spermatocytes secondaires. La FSH stimule la production de plusieurs protéines dans les cellules de Sertoli telles que l’inhibine B en se liant au récepteur de la FSH sur leur membrane basolatérale. Les cellules de Sertoli situées au sein des tubes séminifères sont cruciales pour l’initiation de la spermatogénèse et elles permettent de contrôler la production des spermatozoïdes à un niveau stable [36].
1.1.2.2 L’hormone lutéinisante (LH)
La LH, comme la FSH, est produite par les cellules gonadotropiques dans les glandes pituitaires antérieures. Elle est une hétéroglycoprotéine avec une structure semblable à la FSH, cependant son temps de demi-vie est beaucoup plus court qui est situé autour de 60 min comparativement à 170 min [37]. Chez les deux sexes, la LH est importante pour la reproduction. Chez la femme, elle permet le déclenchement de l’ovulation qui survient entre 36 et 48 h après le pic de LH qui est provoquée par une rétroaction positive de l’E2 [38]. Ce pic va aussi amorcer la conversion des follicules résiduels en un corps jaune qui, à son tour, produit de la progestérone pour préparer l’endomètre à une possible implantation. La LH est aussi nécessaire au maintien des fonctions lutéales lors des deux premières semaines du cycle menstruel [2].
Chez le mâle, la LH agit sur la régulation de la T dans les cellules de Leydig des testicules. Cette régulation s’effectue par l’action de la LH sur l’expression de 17βHSD qui catalyse la réaction de l’A-dione vers la T. Ce
8
dernier stéroïde fait une rétroaction négative lorsque son niveau est trop élevé en diminuant l’expression de la GnRH qui par la suite diminue les niveaux de LH [2, 39].
1.1.2.3 L’hormone de libération des gonadotrophines
hypophysaires (GnRH)
La GnRH est un peptide dont la séquence est pyroGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2 et elle est produite par les neurones GnRH dans l’hypothalamus. Ce peptide détient un rôle initial dans la stéroïdogenèse puisque lors de la liaison de cette hormone à son récepteur la GnRHr dans les cellules de l’hypophyse, elle stimule la production de LH et de FSH déclenchant la production des hormones sexuelles [2]. La sécrétion de la GnRH est régulée par une rétroaction des androgènes et des estrogènes. Chez le mâle, elle est secrétée avec une pulsation régulière. Cependant, chez la femelle, la variation des pulsations change dépendamment du cycle menstruel [40].
9
Figure 2. Représentation de l’effet des hormones gonadotropes sur les caractéristiques sexuelles (Smith, et al. 1995)
1.2 Les récepteurs nucléaires (NR)
Les NR sont une classe de protéine retrouvée dans la cellule et ils sont responsables avec l’aide d’autres protéines de la régulation de l’expression de certains gènes reliés au développement, à l’homéostasie et au métabolisme de l’organisme. Lors de la liaison de son ligand, une modification de la conformation du récepteur s’effectue pour permettre son activation [41, 42]. Le ligand pouvant être une hormone stéroïdienne, une hormone thyroïdienne ou une autre molécule dépendamment du type de récepteur. Jusqu’à ce jour, 48 membres ont été répertoriés comme récepteur nucléaire chez l’humain et ils sont divisés en 6 sous-familles.
Les NR sont classifiés comme facteurs de transcriptions, car ils ont l’habilité de se lier directement à l’ADN et de réguler l’expression des gènes adjacents.
10
Cette propriété est unique au NR comparativement aux autres classes de récepteurs leur permettant d’avoir un rôle clé dans le développement embryonnaire et au maintien de l’homéostasie à l’âge adulte [43].
Tous les membres ont une structure protéinique primaire composée de 6 domaines nommés A en N-terminale jusqu‘à F en C-terminale. Les domaines les plus importants sont le domaine C qui a comme fonction de lier la protéine à l’ADN (DBD) et le domaine E qui est responsable de la liaison du ligand (LBD) [44]. Les NR sont divisés selon leur mécanisme d’action nommé type I à type IV [45]. Cependant, il existe d’autres mécanismes d’action qui ont été caractérisés ne sollicitant pas directement l’ADN nommé le mécanisme de transrépression et le mécanisme non-génomique [46, 47]. Il existe aussi une seconde classification des NR selon leur homologie de séquence (Figure 3) [45].
11
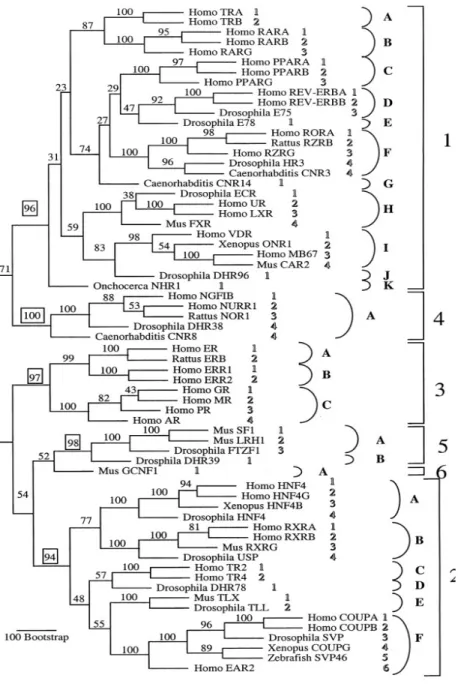
Figure 3. Classification des NR selon l’arbre phylogénétique des 65 NR découverts (Nuclear Receptors Nomenclature Committee, 1999).
Plusieurs NR sont rattachés à la stéroïdogenèse et ils sont responsables de l’activation de l’expression des gènes suite à la liaison du stéroïde actif. Ces récepteurs sont répertoriés à l’intérieur de la sous-famille 3 des NR et leur principal mécanisme d’action est de type I. Dans ce mécanisme d’action, le NR, situé dans le cytoplasme, se dimérise lors de la liaison du stéroïde et il
12
est transloqué dans le noyau pour se lier aux éléments de réponse aux hormones (HRE) dans l’ADN [48].
1.2.1 Le récepteur des androgènes (AR)
Le AR, un membre de la superfamille des NR, est activé par la liaison de la DHT, mais aussi par la T qui a une affinité de 5 à 10 fois moindre pour ce récepteur [49]. Il est responsable dans la régulation de plusieurs fonctions reliées au développement et au fonctionnement des organes reproductifs masculins. Plus précisément, lors de la liaison de la T sur le AR dans le canal de Wolff, des rôles au développement des caractéristiques sexuelles primaires lui sont attribués tels que la différentiation des organes reproducteurs du fœtus, mais aussi à la taille musculaire. Pour ce qui est de la liaison du DHT avec le AR, des rôles ont attribué au développement des caractéristiques sexuelles secondaires comme la croissance des organes génitaux et des poils, mais aussi aux fonctions de la prostate. Le AR est aussi relié à d’autres fonctions essentielles comme le maintien de l’intégrité squelettique [50].
Comme pour la majorité des NR, le AR a un mécanisme d’action de type I. Lorsqu’il est activé par la liaison de l’androgène actif, le récepteur est transloqué dans le noyau pour agir comme facteur de transcription à des gènes [51].
Même si le AR est surtout relié au développement du cancer de la prostate, certaines études ont démontré qu’il pourrait avoir un rôle dans le cancer du sein. Le AR est exprimé dans 80 % des cas de cancer du sein primaire, ce qui est un peu plus élevé que le niveau d’expression du ER qui est d’environ 70 % comparativement au AR [52]. De plus, dans plus de 80 % des cas de cancer du sein ER+, le AR est coexprimé. Par la suite, il est estimé que le ER et le AR servent de comédiateurs dans le cancer du sein basé sur leurs niveaux d’expression [53]. Cependant, un rôle antiprolifératif a été attribué au AR lorsque le DHT, à des concentrations physiologiques, y est lié en activant
13
le p21waf1/cip1 et/ou inhibant la CyclinD1 dans des essais in vitro [54, 55].
Depuis les années 1930s, des traitements à partir d’androgènes ont été testés pour traiter le cancer du sein, mais à cause des effets secondaires et l’avènement des anti-estrogènes et de la privation des estrogènes, ces projets furent arrêtés [56]. Néanmoins, un nouveau traitement combinant la réduction de l’E2 et la restauration de la DHT émerge [57, 58].
1.2.2 Le récepteur des estrogènes (ER)
Le ER qui est un membre de la superfamille des NR a comme ligand naturel l’E2. Ce récepteur a comme rôle de réguler l’expression des gènes ayant des fonctions reliées au développement sexuel et reproductif chez les femelles, mais il détient aussi des fonctions pour le maintien des os, du système cardiovasculaire, du système immunitaire et du système nerveux central [59]. Chez les mammifères, il existe deux formes de ce récepteur nommé le récepteur des estrogènes alpha (ERα) et le récepteur des estrogènes bêta (ERβ) qui partagent des domaines structurels communs. Cependant, il existe plusieurs distinctions entre ces deux récepteurs. Le ERα est situé sur le chromosome 6 comparativement au ERβ qui est situé sur le chromosome 14. De plus, des études ont démontré que le ERα a des effets prolifératifs contrairement au ERβ qui aurait des effets antiprolifératifs [60, 61]. Les niveaux d’expression de ces deux récepteurs sont aussi différents dans les tissus [62]. Le ERα chez la femme est exprimé dans l’endomètre, les cellules épithéliales du sein, les cellules stromales ovariennes et dans l’hypothalamus et chez l’homme dans l’épithélium du canal déférent. Mais pour le ERβ, il est exprimé dans les cellules du granulosa ovarien, des reins, du cerveau, des os, du cœur, des poumons, de la muqueuse intestinale, de la prostate et endothéliales.
Dans 70 % des cas de cancer du sein, le ER est exprimé, discuté plus en détail à la section 1.4.3, démontrant l’importance de ce récepteur dans cette pathologie. Plusieurs inhibiteurs de ER ont été développés pour le traitement
14
des cancers dépendant de l’expression de ER et certains sont actuellement sur le marché tel que le tamoxifène pour le traitement du cancer du sein [63]. Cependant, plusieurs effets secondaires ont été reliés à ces antagonistes comme l’augmentation des risques du cancer de l’endomètre, la réduction de la cognition [64]. Ces effets indésirables ont poussé la recherche d’inhibiteur d’enzymes de la stéroïdogenèse pour le traitement du cancer du sein afin d’empêcher la production d’E2 et ainsi empêcher l’activation du ER. Les inhibiteurs de l’aromatase tels que l’anastrozole et le letrozole sont des exemples de médicaments mis sur le marché pour empêcher la synthèse d’E2 à partir de la T.
1.3 Les cancers hormonodépendants
Les cancers reliés aux hormones représentent environ 30 % de tous les cancers aux États-Unis. De plus, il est possible qu’une hormone individuelle contrôlant la croissance normale d’un organe cible puisse aussi créer les conditions nécessaires pour une transformation néoplasique.
Le concept que les hormones peuvent causer ou augmenter l’incidence de cancer chez l’humain a été développé par ces quatre types de cancers reliés aux hormones numériquement les plus importants : du sein, de la prostate, de l’endomètre et de l’ovaire.
Les stéroïdes, étant de puissantes molécules provoquant la stimulation de la division cellulaire et de la prolifération, peuvent causer des phénotypes malins déclenchant un cancer lorsqu’il y a un débalancement de leur concentration [65-67]. Ces cancers partagent un mécanisme de cancérogenèse unique du fait que contrairement aux cancers reliés aux substances chimiques ou aux virus, le débalancement hormonal augmente la prolifération cellulaire qui multiplie les probabilités de mutations somatiques durant la division cellulaire (Figure 4). L’émergence du phénotype malin va dépendre sur cette série de mutations somatiques sur des gènes candidats comme ceux reliés aux voies de l’endocrinologie, de la réparation de l’ADN,
15
de la répression des tumeurs et des oncogènes. Au cours des années, des thérapies antihormonales ont été développées et elles ont démontré une grande efficacité dans l’arrêt de la progression du cancer permettant d’augmenter le temps de récurrence.
Figure 4. Représentation de l’effet de l’E2 et d’autres stéroïdes dans le cancer du sein. Les stéroïdes conduisent à la prolifération cellulaire qui augmente le risque d’erreur génétique emmenant au phénotype malin. (Brian E. Henderson et al 1999).
1.3.1 Le cancer de l’endomètre
L’importance de l’estrogène dans l’étiologie du cancer de l’endomètre a été depuis longtemps reconnue. Une surexposition aux estrogènes ou une absence de progestérone lors de la première moitié du cycle menstruel a été démontrée comme un risque de cancer de l’endomètre attribué à l’activité mitotique [68]. L’usage de contraceptifs séquentiels, contrairement aux contraceptifs oraux combinés, double le risque de ce cancer [69]. Une expérience chez le lapin avec un haut dosage d’estrone sulfaté a démontré aussi une augmentation des taux de cancer de l’endomètre [70]. L’obésité a été aussi démontrée comme un autre facteur de risque pour ce cancer causé par une augmentation des niveaux d’estrogènes en circulation [71].
16
L’utilisation de progestérone a des effets profonds sur l’endomètre et il est utilisé, d’un point vu thérapeutique, pour traiter l’hyperplasie et le carcinome de l’endomètre [72].
1.3.2 Le cancer de la prostate
Selon la société du cancer américaine, le cancer de la prostate est la seconde cause de mortalité causée par les cancers chez les mâles américains. De plus, environ 17 % des hommes américains vont développer
ce type de cancer et plus de 200 000 nouveaux cas sont diagnostiqués
chaque année.
Dans la prostate, les androgènes surtout la T et la DHT jouent un rôle important pour son développement, mais ils ont été démontrés comme étant des facteurs de risque du cancer de la prostate [73]. Une étude a démontré que le cancer de la prostate est inhibé par une thérapie de dépravation des androgènes et il est activé lors de l’ajout d’androgènes [74]. De plus, Noble a observé que la T peut à elle seule produire des adénocarcinomes prostatiques [75].
Autres que les androgènes, des faibles estrogènes peuvent avoir un rôle dans le carcinogène prostatique [76]. Cette idée est suggérée du fait que la thérapie estrogénique produit des atténuations dans les cancers avancés de la prostate et que le plus faible taux de cancer de la prostate chez les gros consommateurs d’alcool ayant des hépatopathies comparativement aux personnes ne consommant pas d’alcool peut être causé par l’hyperoestrogénisme [71, 74].
1.3.3 Le cancer du sein
Il a été rapporté en 2015 que le cancer du sein est le type de cancer le plus diagnostiqué et il est la seconde cause de décès relié au cancer chez les femmes après le cancer du poumon [76]. La société canadienne du cancer a
17
publié en 2015 qu’une 1 femme sur 9 développera un cancer du sein et qu’une 1 femme sur 30 en mourra au Canada.
L’émergence du cancer du sein peut être causée par différents facteurs. Les altérations génétiques compromettant l’amplification d’oncogènes et la mutation ou la perte de suppresseur de cancer sont des facteurs pouvant émerger ce type de cancer. La dérégulation du niveau de certaines hormones comme l’E2, la P et la prolactine ou de leurs récepteurs et le changement de l’interaction avec différents facteurs de croissance et de cytokines sont les autres principaux facteurs dans cette émergence [77].
Les cancers du sein dépendant de l’estrogène, référé au sous-type luminal, représentent pour environ 60 % des cas de cancer du sein chez les femmes pré-ménopausées et 75 % chez les femmes post ménopausées [78]. Ce sous-type de cancer est caractérisé par l’expression du ER et pour cette raison aussi nommée le cancer du sein ER positive. Des évidences épidémiologiques indiquent que l’exposition prolongée des glandes mammaires à un niveau élevé d’E2 représente un facteur de risque plus élevé [76]. Dans la carcinogenèse du sein, l’E2 détient deux rôles distincts. Premièrement, il agit comme un facteur de croissance nommé précarcinogène en se liant au ER activant la transcription de gènes reliés à la transcription [79]. Deuxièmement, l’E2 est un procarcinogène de la 4-OH E2. Cette dernière molécule induit des dommages et des mutations à l’ADN, qui entrainera l’initiation et la progression du cancer du sein (Figure 5) [80].
18
Figure 5. Représentation schématique de la double fonction de l’E2 dans le cancer du sein agissant comme facteur de prolifération et d’agent procarcinogène. (Yang et al. 2007).
1.4 La biosynthèse des hormones sexuelles
Plusieurs enzymes sont impliquées dans la production des hormones sexuelles et elles sont hautement régulées pour contrôler les niveaux nécessaires de ces hormones dans les tissus stéroïdogéniques. La biosynthèse des hormones sexuelles débute par le précurseur de toutes les classes de stéroïdes, soit le cholestérol provenant en grande partie de la circulation sanguine. Il contient 27 atomes de carbone dans lequel il est véhiculé sous forme de lipoprotéines [81]. Après son internalisation dans les cellules, le cholestérol est relâché et il peut-être utilisé immédiatement ou emmagasiné sous la forme d’esters de cholestérol à l’intérieur de gouttelettes de lipides cytoplasmiques.
19
Dans les gonades, la transformation du cholestérol est régulée par les niveaux de LH et de FSH. Dans les cellules de Leydig des testicules, le cholestérol est transformé par une série de réactions en T. Dans les ovaires, le cholestérol est transformé en Δ4-dione dans les cellules thécales et il migre, par la suite, dans les cellules du granulosa pour être transformé en E2 par l’aromatase. Chez les surrénales, le cholestérol subit des modifications successives par les enzymes P450scc pour former la PREG et P450cl7 pour donner la 17-OH-PREG. Cette dernière hormone est par la suite convertie en DHEA qui peut avoir un groupement sulfate d’ajouté en position 3 pour donner du DHEA-S, une forme plus soluble dans le sang, par l’action de la DHEA sulfotransférase [82, 83].
1.4.1 L’intracrinologie
Les stéroïdes sexuels peuvent être synthétisés dans les gonades tel que les testicules et les ovaires, qui sont relâché dans la circulation sanguine sous forme de T et d’E2 respectivement et ils sont transférés à des cellules cibles par des voies endocrines [84]. Cependant, une large concentration de ces hormones actives est synthétisée dans des tissus périphériques à partir de la DHEA et la DHEA-S provenant des surrénales [84]. Ce concept nommé intracrinologie a été introduit par Labrie, F en 1991 pour décrire un nouveau mécanisme de formation des stéroïdes sexuels et leurs actions [85]. Il a été reconnu que chez l’homme, 40 % des androgènes, et chez les femmes, 75 % avant la ménopause et 100 % à la suite de la ménopause des estrogènes, sont synthétisés dans les tissus périphériques à partir de ces deux précurseurs androgéniques inactifs. Ce système endocrinien est unique à l’homme et aux autres primates. Chez les autres mammifères tels que le rat, la souris et le cochon d’Inde, la formation des stéroïdes sexuels est seulement reliée aux gonades [85].
La synthèse des stéroïdes sexuels mentionnée plus haut dépend de la DHEA et la DHEA-S sécrétées par les surrénales. Chez l’humain, la sécrétion de la DHEA augmente durant l’adrénarche chez les enfants âgés entre 6 et 8 ans
20
jusqu’à atteindre des niveaux maximaux à l’âge adulte de 20 à 30 ans et elle est maintenue par la suite. À l’âge adulte, la DHEA devient la seconde hormone, le cholestérol étant le premier, la plus présente dans la circulation sanguine à des concentrations de 100 à 500 fois plus élevées que la T chez l’homme et de 1000 à 10 000 fois supérieures que l’E2 chez la femme [84]. Cette forte concentration constitue un grand réservoir pour la formation des stéroïdes sexuels actifs dans les tissus périphériques [85]. Ce mode d’action intracrine représente une voie économique pour qu’un minimum de stéroïdes actifs soit produit tout en ayant une fonction maximale, mais en empêchant leurs actions chez d’autres cellules non ciblées. De plus, cela permet une autonomie aux tissus périphériques cibles pour ajuster la formation et le métabolisme des stéroïdes actifs selon leurs besoins grâce à la régulation des enzymes par divers facteurs de façon spécifique [85].
La formation de la DHT et de l’E2, à partir de la DHEA, implique plusieurs enzymes et réactions (Figure 6). Les principales enzymes impliquées sont les 3-bêta-hydroxystéroïde déshydrogénases/A5-A4 isomérase (3β-HSD), les 17-bêta hydroxystéroïde déshydrogénases (17β-HSD), 5α-réductase et l’aromatase. Dans la formation de ces stéroïdes actifs, la DHEA-S est transformée en DHEA par l’action de la sulfatase. La DHEA est, ensuite, oxydée par l’action de la 3β-HSD ou de la 17β-HSD en 4-dione ou 5-diol, respectivement [85]. La 4-dione est ensuite transformée par l’action soit de l’aromatase pour obtenir de l’E1 ou par la 17β-HSD 3 ou 5 pour obtenir de la T. En ce qui concerne le 5-dione, la 3β-HSD réduit ce stéroïde en T. La T produite par l’une des deux voies est transformée en DHT par l’action de la 5α-réductase ou en E2 par l’aromatase. L’E1 qui a été obtenu par la voie de la 4-dione est réduite en E2 par une 17β-HSD soit de type 1 ou 7 [85].
21
Figure 6. Illustration schématique de la stéroïdogenèse des androgènes et des estrogènes dans les tissus intracrines humains (Aka JA, et al. 2009).
1.4.2 La stéroïde sulfatase (STS)
La STS est responsable de l’hydrolyse des stéroïdes sulfatés tels que la DHEA-S et l’E1-S, et elle a un rôle pivot dans la formation des stéroïdes biologiquement actifs [86]. Cette enzyme est grandement distribuée dans le corps et son action est impliquée dans les processus physiologiques normaux et certaines pathologies telles que le cancer du sein y sont reliées lors d’un débalancement de son activité. Même s’il y a peu de connaissances sur la régulation de son expression et de son activité, sa structure cristalline a été déterminée [87].
Il a été démontré que la STS est exprimée dans les tissus des seins normaux et tumoraux [88]. Une augmentation de l’expression de la STS a été reliée avec l’augmentation de l’E2 dans les tumeurs du sein, permettant à l’enzyme d’avoir une signification lors du pronostique. À cause de son implication dans la croissance des tumeurs du sein, différents inhibiteurs ont été développés.
22
Un de ces inhibiteurs, le 667-Coumate, a été un candidat pour un traitement alternatif au cancer du sein hormonodépendant. Cependant, même après des résultats positifs en essai clinique de phase I, les résultats en phase II pour cet inhibiteur ont été très décevants ce qui a mené à l’arrêt des essais cliniques [89, 90]. Même à la suite de l’échec en phase clinique, d’autres inhibiteurs tels que le EM-1913 démontrent un effet inhibiteur de la STS à cause de son implication dans le cancer de la prostate [91].
1.4.3 L’aromatase
L’aromatase est une enzyme impliquée dans la stéroïdogenèse qui catalyse la réaction des stéroïdes à 19 atomes de carbone soit l’androstènedione et la testostérone en estrogène soit le E1 et le E2 irréversiblement en faisant l’aromatisation du cycle A de ces stéroïdes [92]. Cette protéine qui est le produit du gène CYP19 est un complexe enzymatique comprenant une flavoprotéine et une hémoprotéine cytochrome P450 localisée dans le réticulum endoplasmique [93]. L’expression tissu-spécifique du gène CYP19 est régulée par des promoteurs comme les hormones stéroïdiennes, les facteurs de croissance et les gonadotrophines dans l’ovaire, le placenta et les tissus adipeux [94, 95]. L’aromatase est aussi exprimée dans d’autres tissus incluant les testicules, le foie, l’utérus, les muscles, l’endomètre, les seins, les fibroblastes de la peau, le cerveau et à l’intérieur des tissus fœtaux [96]. La surexpression de l’aromatase a été démontrée comme étant cruciale dans le cancer du sein depuis que l’efficacité des inhibiteurs de l’aromatase a été utilisée en thérapie avec un succès significatif [97, 98]. Cette découverte confère à l’aromatase un excellent exemple de la translation d’une cible thérapeutique vers le développement d’un médicament utilisé en thérapie pour le traitement du cancer du sein [99].
23
Les 17β-HSD forment une famille qui à ce jour contient 15 membres désignés de 1 à 15 selon l’ordre chronologique du clonage de leur ADNc. Ces protéines sont essentielles à l’activation des hormones sexuelles actives pour la dernière étape et de leur l’inactivation des hormones sexuelles. De ce fait, elles catalysent les étapes finales de la biosynthèse des androgènes et des estrogènes permettant d’activer ces stéroïdes. En plus de ce rôle, certains membres sont responsables de l’inactivation de ces hormones. Ces deux fonctions leur confèrent un rôle important dans la régulation des hormones actives et aux effets physiologiques reliés [100]. Chez l’humain, 12 membres des 17β-HSD sont exprimés et 3 d’entre eux ont un rôle seulement relié à la stéroïdogenèse [101]. Pour être dans cette famille, une 17β-HSD doit avoir la capacité de faire la réduction des 17β-hydroxystéroïdes ou l’oxydation des 17β-cétostéroïdes. De plus, elles sont des enzymes NAD(H) ou NADP(H) dépendantes. Dans le tableau 1, les préférences de cofacteur et de substrat de 14 des 15 membres des 17β-HSDs sont présentées.
Les 17β-HSD font partie de la superfamille des déshydrogénases/réductases à courte chaine (SDR), sauf celui de type 5 qui fait partie des aldo-cétoréductases (AKR) [102]. Comme les SDR, les 17β-HSDs ont comme caractéristiques d’être des non-métallos oxydoréductases et d’avoir une similarité de séquence de seulement 15 à 30 %. Donc les 17β-HSD sont plus semblables à cause de leur similarité enzymatique que de leur structure protéique primaire et ils démontrent une évolution convergente des activités [103, 104]. Cependant, ces protéines contiennent deux régions hautement conservées, soit un motif catalytique Tyr-X-X-X-Lys et un site « Rossmann fold βαβ » liant le cofacteur composé de régions de feuillets β et d’hélices α en alternance situées à l’extrémité N-terminale.
En plus de leur rôle dans l’activation des stéroïdes sexuels, plusieurs autres fonctions ont été attribuées à certains membres de cette famille. Des rôles dans le métabolisme des alcools, des acides biliaires, des acides gras et des rétinoïdes ont été associés aux 17β-HSD [105].
24
Tableau 1. Résumé des substrats et des cofacteurs de la famille des 17HSD. 14 des 15 membres des HSDs sont représentées (Moeller G. et al. 2009)
1.4.4.1 La 17β-hydroxystéroïde déshydrogénases de type 1
(17β-HSD1)
La 17β-HSD de type 1 humaine est un homodimère qui catalyse principalement la réaction de réduction du E1 en E2 en utilisant comme cofacteur la NADPH [106, 107]. Elle a été le premier membre de la famille des 17β-HSDs à être découverte [104] et aussi la structure cristalline de l’enzyme humain a été la première à être résolue parmi les enzymes de la stéroïdogenèse humaine [108, 109]. Cette enzyme catalyse plusieurs autres réactions à une vélocité et à une spécificité bien moindre comme la conversion de la 16α-hydroxyestrone en E3, de la DHEA en 5-diol, de la P en
25
20α-OH-P, du 4-dione en T et de la DHT en 3-diol [110-112]. Le gène de la 17β-HSD-1 contient 3,2 kb chez l’humain et 2,2 kb chez le rat, contient 6 exons et est localisé sur le chromosome 17q21 à proximité du gène BRCA1 impliqué dans la prédisposition héréditaire au cancer du sein et de l’ovaire [113]. Le produit de ce gène est une protéine cytosolique de 327 aa d’une masse moléculaire de 35 kDa. Cette protéine est exprimée dans les tissus stéroïdogéniques comme les cellules du granulosa folliculaire en développement des ovaires, le placenta et les testicules, mais aussi dans les tissus périphériques comme les seins, l’utérus, la peau, l’endomètre, le myomètre, la muqueuse vaginale, la prostate et le foie [114]. Cette large distribution tissulaire de la 17β-HSD1 démontre son rôle important dans la régulation de l’activité des stéroïdes sexuels.
Des maladies comme l’endométriose, le syndrome métabolique de même que les cancers du sein, de l’endomètre, du côlon, de l’ovaire et de la prostate ont été associées à la 17β-HSD1 [101]. Dans le cancer du sein, la surexpression de la 17β-HSD1 joue un rôle important dans le maintien de la production de l’E2 intratumorale [115]. Son expression est principalement régulée par l’IL-6 et le TNFα dérivés du fibroblaste et des cellules immunitaires dans les tumeurs stomates. Pour ces raisons, la 17β-HSD1 est considérée comme un joueur clé additionnel dans la déposition d’E2 intratumorale et une cible thérapeutique additionnelle à l’aromatase pour le traitement du cancer du sein [116]. De plus, il a été démontré que cette enzyme détient une double activité dans les cellules du cancer du sein en activant les estrogènes et en inactivant les androgènes [112, 117, 118]. Au cours des dernières années, plusieurs inhibiteurs de la 17β-HSD1 ont été développés à partir de la structure de l’E2 et des non-stéroïdes, mais aussi sur la conception d’un inhibiteur basé sur la structure tridimensionnelle de la protéine pour le traitement du cancer du sein [119]. Cependant, malgré tous ces efforts dans la conception d’un inhibiteur aucun d’entre eux n’est en
26
phase clinique présentement due en partie à l’activité estrogénique résiduelle des analogues des estrogènes développés.
1.4.4.2 La 17β-hydroxystéroïde déshydrogénases de type 7
(17β-HSD7)
La 17β-HSD7 a d’abord été identifiée à l’origine comme étant une protéine associée au récepteur de la prolactine (PRAP) [120]. Son gène se situe sur le chromosome 10p11.2 et il s’étend sur 21,8 kb contenant 9 exons. Chez l’humain, son expression a été rapportée dans les ovaires, le placenta, les glandes mammaires, mais aussi dans le foie et le cerveau [121]. Il a été longtemps considéré que cette protéine était plutôt reliée à la cholestérogénèse que dans la stéroïdogenèse. Cette hypothèse a été développée à cause d’une étude qui a démontré que lors de l’inhibition de la transduction du gène de la 17β-HSD7, les souris demeuraient fertiles, mais leurs fœtus ne sont pas viables dû à la biosynthèse des cholestérols défective dans leur cerveau [122]. Cependant, la détection de haut niveau d’expression dans le corps jaune des souris enceintes supporte le rôle de la 17β-HSD7 dans la stéroïdogenèse [123]. De plus, la 17β-HSD7 est la seule enzyme caractérisée qui est exprimée à la hausse par les niveaux d’E2 [124]. En utilisant des cellules HEK-293 transfectées, il a été démontré que la 17β-HSD7 transforme l’E1 en E2 avec comme cofacteur le NADPH [123]. De plus, elle catalyse la réduction de DHT en 3β-diol. Cette double activité lui confère un rôle dans la régulation intracrine pour les androgènes et les estrogènes les plus actifs [121]. Dans le cancer du sein, il a été démontré par des études
d’immunohistochimie que la 17β-HSD7 est exprimée dans les carcinomes
canalaires avec une expression plus élevée dans les canaux pathologiques invasifs ou in situ que les canaux normaux adjacents [124]. De surcroit, la 17β-HSD7 est surexprimée d’un facteur de 3,5 dans les carcinomes en comparaison aux tissus normaux contribuant à une déposition de l’E2 qui a été corrélée à l’augmentation du ratio d’E2 sur E1 dans les tumeurs mammaires [125]. La rétroaction positive de l’E2 dans l’expression
27
de la 17β-HSD7 joue aussi un rôle dans la croissance des tumeurs
mammaires hormonodépendantes en augmentant la concentration de cet estrogène [124].
1.5 Projet de recherche
Des recherches précédentes dans notre groupe ont démontré que l’E2 a un effet prolifératif dans les tumeurs du cancer du sein et que la DHT à un effet inhibiteur [112, 118]. Plusieurs enzymes et récepteurs dans la stéroïdogenèse ont un impact sur la formation et la dégradation de ces
stéroïdes hormonaux, spécialement les 17β-HSDs qui ont des rôles
importants dans l’activation et l’inactivation des estrogènes et des androgènes les plus actifs. Dans la biosynthèse des stéroïdes, il a été démontré que la 17β-HSD7 catalyse deux réactions soit l’activation de l’E2 à partir de l’E1 et l’inactivation de la DHT en 3β-diol pouvant jouer un double rôle dans la régulation intracine.
Quand j’ai commencé mes études, l’impact de la 17β-HSD7 n’était pas clair dans la stéroïdogenèse et plusieurs questions sont toujours en suspens pour son rôle dans le cancer du sein hormonodépendant. Dans ce projet de recherche, dans un premier temps, je vais décrire la procédure pour la purification et la cristallisation de la 17β-HSD7 d’isoforme 1 humaine surexprimée dans des cellules bactériennes dans le but d’obtenir une protéine stable et active. Une étude des activités enzymatiques par la cinétique à l’état stationnaire de l’activation de l’E2 et de l’inactivation de DHT plus complète a été effectuée pour confirmer les rôles de la protéine dans la stéroïdogenèse, mais aussi pour démontrer le maintien des activités enzymatiques obtenues à partir d’un système bactérien. Des tests de cristallisation préliminaire ont aussi été effectués. Ce protocole servira à l’élaboration d’une structure cristalline tridimensionnelle de la protéine dans un futur projet pour mieux comprendre cette dualité enzymatique, mais aussi pour faciliter le développement d’inhibiteurs en se basant sur cette structure. Dans un second temps, une étude a été réalisée sur l’impact d’inhibiteurs
28
spécifiques à la 17βHSD-1 et à la 17β-HSD7 sur la catalyse de l’E1 en E2 dans un modèle cellulaire de tumeur mammaire hormonodépendant pour démontrer l’impact de la 17β-HSD7 dans l’activation de cet estrogène. 1.5.1 Les hypothèses de recherche
1.5.1.1.1 Il est possible d’exprimer la 17β-HSD7 dans un système
bactérien qui sera active et cristallisable.
1.5.1.1.2 La 17β-HSD7 déteint un rôle dans la stéroïdogenèse en produisant l’estrogène le plus actif et en inactivant l’androgène le plus actif.
1.5.1.1.3 La 17β-HSD7 a un rôle dans l’activation des estrogènes et dans l’inactivation des androgènes dans les cellules du cancer du sein et son effet est plus remarquable que la 17βHSD-1.
1.5.2 Les objectifs de recherche
1.5.2.1.1 Développer une méthodologie permettant la purification et la cristallisation de la 17β-HSD7 dans un système bactérien.
1.5.2.1.2 Obtenir les données de cinétique à l’état stationnaire complète de la 17β-HSD7 purifiée et les comparer avec d’autres enzymes catalysant les mêmes réactions pour valider son rôle dans la stéroïdogenèse.
1.5.2.1.3 Confirmer que la 17β-HSD7 détient un rôle aussi important que la 17β-HSD1 dans la réduction de l’E1 en E2 dans un modèle de cellule du cancer du sein.
29 Chapitre II
Purification, cristallisation et mesure de l’activité enzymatique spécifique de la 17β-HSD7.
2.1. Méthodologies
2.1.1. Expression de la 17β-HSD7 recombinante 2.1.1.1. Préparation du vecteur bactérien
Le plasmide pET-28a(+) (Novagen) cloné avec le gène 17β-HSD7_1 a été
obtenu par l’équipe du Dr Van Luu-The. Une séquence codant pour 6 His à la position N-terminale (His-tag) a été rajoutée au gène 17β-HSD7_1 permettant l’utilisation de colonne d’affinité au nickel (Figure 7). Cette construction plasmidique a été transformée dans les souches bactériennes compétentes
E. coli BL21(DE3) (New England Biolabs) par un protocole standard de choc
thermique à 42oC. M G S H HHHHH S S G L V P R G S H M A S M T G G Q Q M G R G S Q F E L R R M R K V V L I T G A S S G I G L A L C K R L L A E D D E L H L C L A C R N M S K A E A V C A A L L A S H P T A E V T I V Q V D V S N L Q S V F R A S K E L K Q R F Q R L D C I Y L N A G I M P N P Q L N I K A L F F G L F S R K V I H M F S T A E G L L T Q G D K I T A D G L Q E V F E T N V F G H F I L I R E L E P L L C H S D N P S Q L I W T S S R S A R K S N F S L E D F Q H S K G K E P Y S SS K Y A T D L L S V A L N R N F N Q Q G L Y S N V A C P G T A L T N L T Y G I L P P F I W T L LM P A I L LL R F F A N A F T L T P Y N G T E A L V W L F H Q K P E S L N P L I K Y L S A T T G F G R N Y I M T Q K M D L D E D T A E K F Y Q K L L E L E K H I R V T I Q K T D N Q A R L S G S C L
Figure 7. Séquence en acide aminé de la 17β-HSD7 exprimée à partir de la construction plasmidique. En rouge, l’étiquette d’His rajoutée.