HAL Id: hal-02592725
https://hal.inrae.fr/hal-02592725
Submitted on 15 May 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
proposition d’une grille qualité pour la température,
l’oxygène dissous, la salinité et la transparence
C. Taverny, Pierre Elie, Philippe Boët
To cite this version:
C. Taverny, Pierre Elie, Philippe Boët. La vie piscicole dans les masse d’eau de transition : proposition d’une grille qualité pour la température, l’oxygène dissous, la salinité et la transparence. [Rapport de recherche] irstea. 2009, pp.51. �hal-02592725�
LA VIE PISCICOLE DANS LES MASSES
D’EAU DE TRANSITION :
PROPOSITION D’UNE GRILLE DE
QUALITÉ POUR LA TEMPÉRATURE,
L’OXYGÈNE DISSOUS, LA SALINITÉ ET
LA TRANSPARENCE
MARS 2009
Catherine TAVERNY
Pierre ÉLIE
Philippe BOËT
Étude CEMAGREF BORDEAUX n° 131
MARS 2009
CemOA : archive ouverte d'Irstea / CemagrefCemOA
: archive
ouverte
LA VIE PISCICOLE DANS LES MASSES D’EAU DE TRANSITION
PROPOSITION D’UNE GRILLE DE QUALITÉ POUR LA TEMPÉRATURE,
L’OXYGÈNE DISSOUS, LA SALINITÉ ET LA TRANSPARENCE
INTRODUCTION--- 1
1 LES MASSES D’EAU --- 1
1.1 DÉFINITIONS--- 1
1.1.1 Eaux de transition --- 1
1.1.2 Eaux côtières --- 3
1.1.3 Eaux intérieures --- 3
1.2 LES EAUX DE TRANSITION EN FRANCE--- 3
1.2.1 Les systèmes estuariens --- 3
1.2.2 Aspects hydrodynamiques --- 3
1.2.3 Les systèmes lagunaires --- 4
2 LES PARAMÈTRES PHYSICO-CHIMIQUES --- 4
2.1 LA TEMPÉRATURE--- 4
2.2 LA SALINITÉ--- 4
2.3 LA TRANSPARENCE, LA TURBIDITÉ ET LES MATIÈRES EN SUSPENSION--- 5
2.4 L’OXYGÈNE DISSOUS--- 5
2.5 INTERACTION DES PARAMÈTRES ENTRE EUX--- 7
2.5.1 Turbidité, température et oxygène --- 7
2.5.2 L’oxygène, l’ammoniaque et la salinité--- 8
3 LES POISSONS CONCERNÉS PAR LES MASSES D’EAU DE TRANSITION --- 9
3.1 LES ESPÈCES LES PLUS OBSERVÉES EN EUROPE--- 9
3.2 LES POISSONS RETENUS COMME ÉTANT INDICATIFS--- 9
4 EFFETS DES PARAMÈTRES SUR LES POISSONS ---12
4.1 TEMPÉRATURE---12
4.2 SALINITÉ---12
4.3 TURBIDITÉ---12
4.4 OXYGÈNE---13
4.4.1 Besoins physiologiques---13
4.4.2 Stress hypoxique et anoxique ---13
Effets sur le comportement --- 13
L’évitement ---13
Effets sur la croissance --- 14
4.5 SENSIBILITÉ DES POISSONS PAR ESPÈCE, GENRE OU FAMILLE---14
4.5.1 Les espèces estuariennes ---14
Gobiidae ---14
Atherinidae---15
4.5.2 Les espèces d’origine marine ---15
Mugilidae ---15
Moronidae (la famille des bars) ---16
Sprattus sprattus--- 17
4.5.3 Les poissons plats ---18
Platichthys flesus --- 18 Solea solea ---19 4.5.4 Les diadromes ---19 Salmonidae ---20 Alosinae ---21 CemOA : archive ouverte d'Irstea / Cemagref
Osmeridae ---22
4.6 RÉCAPITULATIF DES SENSIBILITÉS DES POISSONS VIS-À-VIS DE CHAQUE FACTEUR---22
4.6.1 Température ---23
4.6.2 Salinité ---24
4.6.3 Oxygène ---24
4.6.4 Turbidité ---25
5 VALEURS SEUILS DES PARAMÈTRES ---25
5.1 DISCUSSION---25
NB --- 27
5.2 PROPOSITIONS DE GRILLES RÉCAPITULATIVES DES DESCRIPTEURS PHYSICO-CHIMIQUES---28
5.2.1 Propositions britanniques ---28
L’Oxygène ---28
La température --- 30
5.2.2 Notre proposition pour la surveillance et le classement de la qualité des MET françaises ---31
L’oxygène ---31
La température --- 31
La turbidité ---32
La salinité ---32
6 PROPOSITIONS D’ÉCHANTILLONNAGE ET DE MÉTRIQUE ---33
6.1 RÈGLES GÉNÉRALES D’ÉCHANTILLONNAGE---33
6.2 ÉCHANTILLONNAGE EN PÉRIODE D’ÉTIAGE (JUIN À OCTOBRE)---33
6.3 ÉCHANTILLONNAGE HORS PÉRIODE D’ÉTIAGE---34
6.4 MÉTRIQUE---35 GLOSSAIRE ---36 Anoxie---36 Arctic-Boreal (En)--- 36 Bouchon vaseux --- 36 Cohorte 0+ ---36 Hypoxie ---36 Lusitanean (En) --- 36 Masse d’eau--- 36 Oxygène---36 Tidal--- 36 BIBLIOGRAPHIE ---37 CemOA : archive ouverte d'Irstea / Cemagref
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
INTRODUCTION
Les estuaires sont des embouchures fluviales sous la dépendance de la marée. Sur le littoral français, ces systèmes sont spécifiques des côtes de la Mer du Nord, de la Manche et de l’Atlantique, alors que les côtes méditerranéennes sont d’autres types d’hydrosystèmes particuliers comme les deltas, les lagunes et leurs zones de marais annexes, qui prévalent.
Les masses d'eau de transition (MET) constituent une zone d'échange et une zone de transition entre les eaux continentales et les eaux marines. À ce titre, en considérant ses caractéristiques hydrosédimentaires, faunistiques et floristiques, c’est un écosystème à part entière.
Les MET ont des rôles écologiques majeurs pour de nombreuses espèces de poissons (de passage des espèces migratrices, d'espaces de nourricerie), ce sont également des milieux tampons à haut pouvoir d'auto-épuration pour le milieu marin.
Ce rapport est une contribution à l’élaboration et au calage des grilles de valeurs pour les éléments de qualité physico-chimiques suivants : température, oxygène dissous, salinité et transparence.
L’élément biologique « poissons » est utilisé dans ce document comme référence à la fois pour les masses d'eau de type estuarien et lagunaire et se rapporte essentiellement au cas du territoire national français.
1 LES MASSES D’EAU
1.1 Définitions
1.1.1 Eaux de transition
L’expression « Eaux de transition » s’est imposée en 2000 avec la publication de la Directive Cadre sur l'Eau (DCE) de l’Union Européenne, afin de créer un continuum entre les eaux douces et les eaux côtières et de prendre en compte ces types de milieux particuliers.
Selon le Journal Officiel de l’Union Européenne (EUROPEAN COMMUNITIES, 2000), les eaux de transition sont définies comme des « masses d'eau de surface à proximité des embouchures de rivière ». Elles sont plus ou moins salées, ceci en raison de leur proximité avec les eaux côtières marines en provenance de bassins versants, mais elles sont fondamentalement influencées par des flux d'eau douce.
C'est une zone de dilution des éléments dissous apportés par la rivière. Les conditions hydrologiques et hydrodynamiques y sont généralement très fluctuantes à l’échelle d’une journée d’une marée. Leur rôle écologique est important pour différentes espèces animales notamment les poissons : lieu de passage, d’alimentation, de préparation physiologique et de croissance (ÉLIE & MARCHAND,1983 ; ÉLIE et al.,1990).
En termes scientifiques, on parle aussi de milieux paraliques1. Ces milieux sont extrêmement diversifiés par leurs dimensions, leur morphologie ainsi que leurs conditions hydrologiques et climatiques. Ils subissent également des fluctuations importantes de la
1zone naturelle proche du sel
CemOA
: archive
ouverte
d'Irstea
composition physico-chimique de leurs eaux (salinité, température,...). Quelques caractéristiques communes permettent d'identifier clairement ces milieux :
- milieux aquatiques pouvant s'assécher temporairement ; - en communication avec le milieu marin ;
- production biologique importante ;
- réceptacle physique délimité où ont tendance à s’accumuler les apports extérieurs (sédiments, nutriments, ...) ;
- biocénoses organisées en zones en fonction de la salinité et du type de sédiment La typologie des eaux de transition est consignée dans le Tableau 1. Elle va de l’estuaire tidal jusqu’à la lagune saumâtre fermée et de grandes étendues d’eau saumâtre.
Tableau 1. Typologie des eaux de transition (MACLUSKY & ELLIOTT, 2007)
Type Caractéristiques
Estuaire classique Partie aval dominée par la marée ; la salinité est notablement réduite par les apports fluviaux d'eau douce ; partie amont dominée par l’eau douce - front d’onde et de salinité se meuvent avec les marées et varient selon leurs coefficients et le débit du fleuve Fjord Zone d’infiltration d'eau douce ou d’apports fluviaux nettement
saisonniers ; influence des marées limitée ; stratifiée ; longue et étroite, érodée à l’entrée par la glace de mer, côtes escarpées, seuil à l’embouchure
Lagune non tidale lentique Échanges limités avec la zone côtière à travers une embouchure réduite (grau) ; séparation d’avec la mer par des bancs sablonneux, ou graveleux, des barres rocheuses, des coraux, hauts-fonds, étendue du marnage inférieure ou égale à 50 cm
Lagune microtidale lentique Comme ci-dessus mais étendue du marnage supérieure ou égale à 50 cm
Ria Vallée d’inondation ; quelques apports d'eau douce; échanges limités
Fjard Zone sculptée par la glace, entrée aval, plus petite qu’un fjord ; apports d'eau douce limités
Embouchure de fleuve Sortie de fleuve
Delta Basse énergie, forme caractéristique, sédiments dominants, zone d’embouchure d’un fleuve ; sortie de l’estuaire
Eau douce côtière / panache d’eaux saumâtres
Sortie de l'estuaire ou de la lagune, salinité notablement diluée, biotes différents de ceux entourant la côte
La masse d'eau de transition est une entité unique et indissociable ayant des caractéristiques physiques et des cortèges faunistiques qui lui sont propres (REMANE & SCHLIEPER, 1958) et qui la différencient du reste du cours d'eau et du milieu marin littoral. Ces caractéristiques et cortèges faunistiques qui lui sont propres sont conditionnés par l’hydrologie et l’hydraulicité, l’amplitude des variations des paramètres, la présence ou non d’un bouchon vaseux ainsi que les flux de pollutions.
En France, ce travail de typologie a fait l’objet d’une première publication et est en cours de finalisation (LEPAGE et al., 2004 ; GIRARDIN et al., 2007).
CemOA
: archive
ouverte
d'Irstea
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
1.1.2 Eaux côtières
Les eaux côtières sont des « eaux de surface situées entre la ligne de base servant pour la mesure de la largeur des eaux territoriales et une distance d'un mille marin ». Ces eaux peuvent s'étendre, le cas échéant, jusqu'à la limite extérieure d'une eau de transition. Au titre des dispositions de la DCE concernant le littoral, les eaux côtières sont rattachées au district hydrographique le plus proche, district qui correspond à un regroupement de bassins hydrographiques du territoire national.
1.1.3 Eaux intérieures
Les eaux intérieures, appelées aussi eaux continentales, correspondent à toutes les eaux courantes à la surface du sol, celles stagnantes et toutes les eaux souterraines, ceci en amont de la ligne de base servant pour la délimitation des eaux territoriales.
1.2 Les eaux de transition en France
1.2.1 Les systèmes estuariens
La France présente sur ses façades ouest et nord, Atlantique, Manche et Mer du Nord, un très grand nombre de systèmes estuariens. La notion d'estuaire concerne uniquement les façades soumises à des marées importantes (prédominance de l’intrusion saline). Les fleuves Méditerranéens forment à leur embouchure (prédominance de l’eau douce) des deltas (ROMANA, 1994).
Le long de la façade atlantique, les estuaires sont en grande partie de type macrotidal. La France possède trois estuaires de grande taille qui sont, par ordre décroissant, la Gironde, la Loire et la Seine. À elle seule, la Bretagne regroupe environ quarante des soixante estuaires recensés.
Les estuaires constituent la partie inférieure des fleuves et des cours d’eau côtiers, soumise à l’influence de la marée : leur limite amont correspondant à la limite d’influence de la marée dynamique.
Ils subissent de très forts marnages (dénivelés entre haute mer et basse mer) ce qui peut induire des temps très longs de résidence des eaux et des matières en suspension. Selon la dynamique fluviale (période de fort débit) un panache des eaux estuariennes vers l’extérieur de l’estuaire peut se produire en raison d’une forte décharge d'eau douce ; l'eau de transition peut alors s’étendre en zone marine. Au contraire, en période d'étiage, le noyau le plus turbide tend à stagner de manière plus prononcée vers l'amont voire à remonter dans le système.
1.2.2 Aspects hydrodynamiques
L'hydrodynamisme des estuaires résulte de la superposition ou du conflit de deux types de phénomènes : les débits des affluents et la marée. Des écarts importants peuvent exister entre la crue et l'étiage. À la force du fleuve s'oppose ou se conjugue, au cours de la marée, la puissance du flot ou du jusant. En France, en vives eaux, l'amplitude maximale aux embouchures varie entre 5 et 7 mètres selon l'estuaire considéré.
La conjonction du débit et de la marée induit une circulation résiduelle des eaux en deux couches avec un point nodal qui marque la pénétration maximale de la salinité. C'est de part et d’autre du point nodal que se forme un stock sédimentaire ou « bouchon vaseux » ou « maximum de turbidité » qui peut intéresser de grandes distances (plusieurs dizaines de kilomètres). CemOA : archive ouverte d'Irstea / Cemagref
1.2.3 Les systèmes lagunaires
Les lagunes sont présentes dans trois régions françaises du Sud-Est (Languedoc-Roussillon, Provence-Alpes-Côte d'Azur, Corse). L'étang de Thau, l'étang de Berre, l'étang de l'Or, sont parmi les lagunes les plus connues. Ce sont des plans d'eau, allongés parallèlement au littoral, peu profonds, isolés de la mer par un cordon meuble de sables et de galets. La communication avec la mer se fait par des ouvertures plus ou moins nombreuses dans ce cordon dit sédimentaire ou littoral (tombolo, lido...). Comprises entre terre et mer, les lagunes entretiennent tout naturellement des relations étroites avec les zones humides qui les entourent (marais, etc.) et reçoivent des apports du ou des bassins versants qui sont souvent marqués par leur irrégularité.
2 LES PARAMÈTRES PHYSICO-CHIMIQUES
2.1 La température
En règle générale, les eaux fluviales sont plus chaudes l'été que les eaux océaniques, et plus froides l'hiver. Outre les influences de la marée, de son coefficient et du débit fluvial, les variations de la température de l'air ont des répercussions sur l'évolution de la température de l'eau. L'amplitude saisonnière de la température est plus importante que celles tidale et nycthémérale.
En milieu estuarien, les variations spatiales s'organisent essentiellement selon un gradient longitudinal dû à la différence de température entre les eaux fluviales et marines. Le mélange plus ou moins complet des eaux et l'ensoleillement déterminent également un gradient vertical souvent de peu d’amplitude pour un site donné.
Les valeurs minimales et maximales enregistrées au sein des masses d’eau de transition vont de 3 °C en période hivernale à 32 °C en période estivale (PEREZ-RUZAFA et al., 2007).
2.2 La salinité
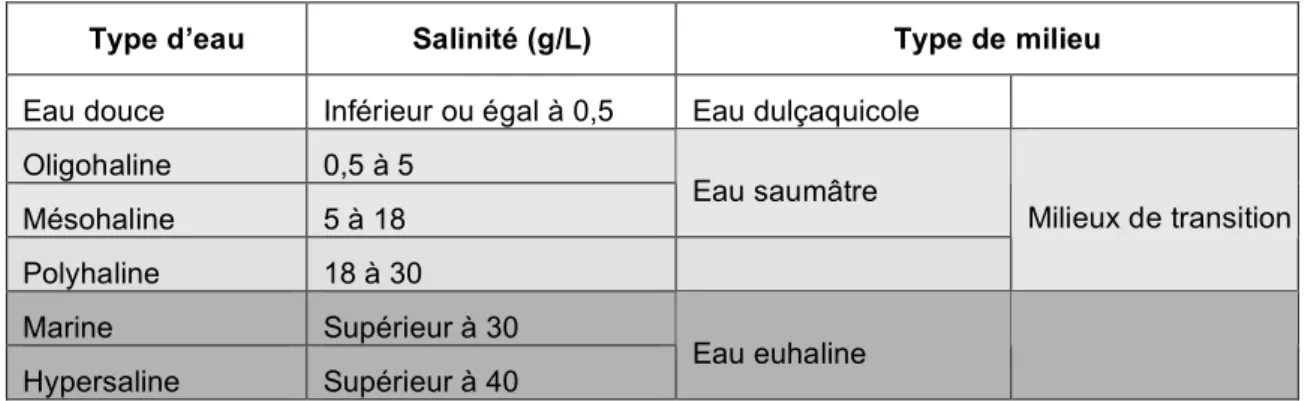
Le volume d'eau douce introduit détermine un gradient longitudinal marquant l'étendue de l'intrusion saline. En fonction des conditions moyennes annuelles, les masses d'eau peuvent être découpées en différents secteurs suivant leur salinité (Tableau 2).
Tableau 2. Caractéristiques de salinité des différents types de masse d’eau
Type d’eau Salinité (g/L) Type de milieu
Eau douce Inférieur ou égal à 0,5 Eau dulçaquicole Oligohaline 0,5 à 5
Mésohaline 5 à 18 Eau saumâtre
Polyhaline 18 à 30
Milieux de transition
Marine Supérieur à 30
Hypersaline Supérieur à 40 Eau euhaline
En milieu estuarien, la salinité est certainement le facteur physique dont les variations sont les plus rapides. Elle varie au cours du temps selon :
CemOA
: archive
ouverte
d'Irstea
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
- le cycle de marée ; le maximum est observé à l'étale de pleine mer, le minimum à l’étale de basse mer ;
- le coefficient de marée ; le maximum atteint dans mes deux cas est plus élevé lors des marées de vives eaux ;
- le cycle annuel ; les maxima de salinité sont relevés lors des marées de vives eaux pendant l’étiage, la valeur de la salinité dépend du volume d'eau douce ou d’eau de mer introduit dans l'estuaire.
En milieu lagunaire méridional, les valeurs minimales et maximales enregistrées vont de 1,9 à 78,9 g.L-1 (ou PSU) (PEREZ-RUZAFA et al., 2007). Elles sont généralement très élevées en période estivale et plus faibles en période hivernale.
2.3 La transparence, la turbidité et les matières en suspension
La transparence est utilisée couramment en eau douce afin de mesurer le niveau trophique du milieu.
La turbidité mesure la transparence et la présence de très fines particules dans l’eau appelées matières en suspension (MES), telles que les argiles, le limon, la matière organique et minérale en fines particules et le plancton. Les MES sont définies comme étant l'ensemble du matériel particulaire entraîné passivement dans l'eau (vivant ou détritique, minéral ou organique). Indirectement, la turbidité renseigne aussi sur la présence de microorganismes car plus la teneur en particules de l’eau est élevée, plus il est probable d'y trouver des microorganismes.
Dans les zones où le transport de solides est prépondérant, comme dans les estuaires macrotidaux, la transparence n’est plus un indicateur pertinent pour caractériser le niveau de trophie de la masse d’eau. En effet, la dynamique de la marée et les débits fluviaux influent sur les turbidités ainsi que sur les zones de dépôt et la remise en suspension des particules fines. Les pics de turbidité coïncident avec les périodes de mi-jusant et mi-flot, qui sont les périodes où les vitesses des courants sont les plus intenses (CASTAING, 1981). Le débit fluvial règle la position longitudinale du bouchon vaseux. Il ne se déplace que sur un segment d'estuaire plus ou moins long selon l'estuaire. Le transport des sédiments en suspension est caractérisé par la formation d’un maximum de turbidité près de l’interface eau douce / eau salée (MATHY, 2006). Les concentrations de MES rencontrées au sein du bouchon vaseux sont de 100 à 500 fois plus importantes que celles que l'on peut trouver dans un cours d'eau ou en mer (ROMANA, 1994).
L’unité de turbidité prescrite par l’Environmental Protection Agency (EPA – USA) est le NTU (Nephelometric Turbidity Unit) unité que l’on retrouve dans la littérature anglo-saxone. En première approximation, on peut corréler la turbidité à la concentration en matières en suspension (MES) :
- Turbidités inférieures à 10 – 20 NTU : MES = 2 NTU - Turbidités supérieures à 20 NTU : MES = 3,3 NTU.
En Gironde par exemple, la turbidité est en moyenne près du fond de l’ordre de 10 g.L-1 de MES (∼ 3000 NTU) et en surface de 1 g.L-1 (∼ 300 NTU) (Sottolichio et Castaing 1999).
2.4 L’oxygène dissous
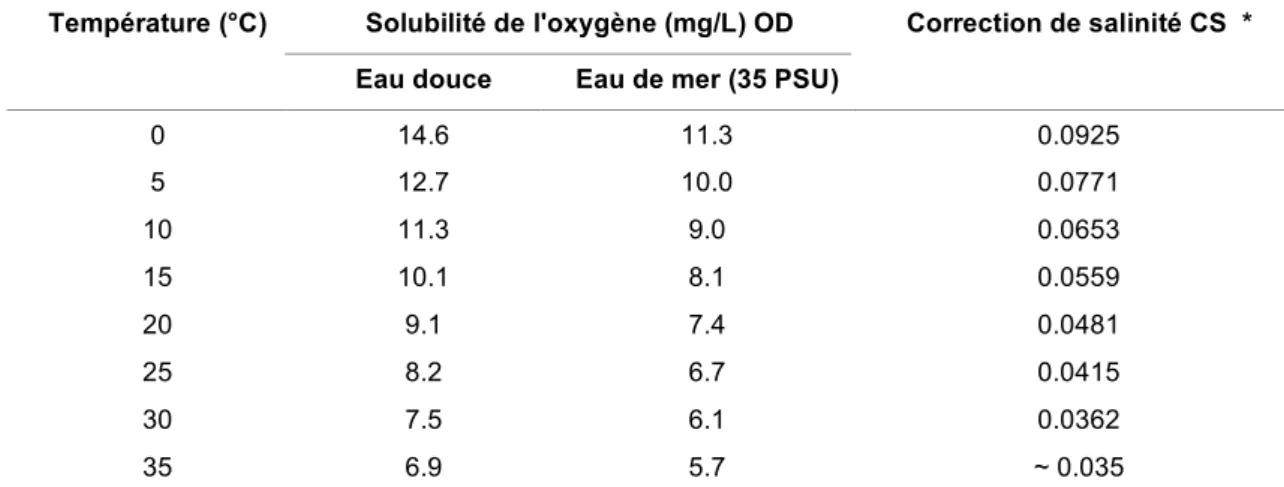
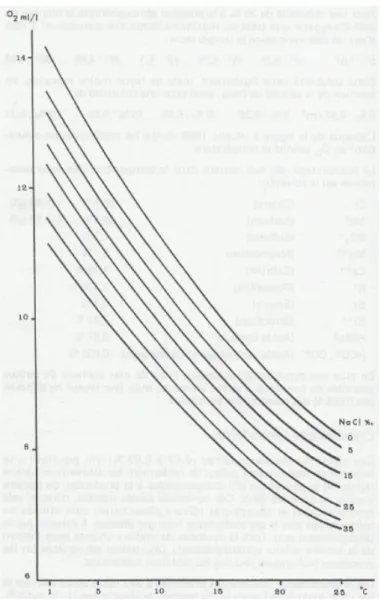
Dans le milieu aquatique l'oxygène se trouve sous forme dissoute. La solubilité de l'oxygène dans l'eau varie selon la température et également, mais de façon moins marquée, en fonction de la salinité de l'eau (Tableau 3 et Figure 1). Sa dissolution dépend aussi de la pression atmosphérique. Pour une valeur donnée de chacun de ces
CemOA
: archive
ouverte
d'Irstea
paramètres, la solubilité maximale de l’oxygène dans l’eau est appelée saturation. La saturation est plus importante à basse température et supérieure en eau douce.
L’oxygène dissous (OD) dans l’eau provient des échanges avec l’atmosphère, mais aussi lors de la photosynthèse réalisée par le phytoplancton et les macrophytes. Il est aussi consommé par la respiration des bactéries (libres ou attachées aux particules). Il s’ensuit des réactions biochimiques et chimiques de dégradation de la matière organique et d’oxydation de substances chimiques.
Tableau 3. Solubilité de l'oxygène dans l'eau (à 100% de saturation, 760 mm de pression atmosphérique et 100% d'humidité ; d’après TURNPENNY & LINEY, 2006)
Solubilité de l'oxygène (mg/L) OD Température (°C)
Eau douce Eau de mer (35 PSU)
Correction de salinité CS * 0 14.6 11.3 0.0925 5 12.7 10.0 0.0771 10 11.3 9.0 0.0653 15 10.1 8.1 0.0559 20 9.1 7.4 0.0481 25 8.2 6.7 0.0415 30 7.5 6.1 0.0362 35 6.9 5.7 ~ 0.035
* pour une température donnée multiplier le CS correspondant avec la valeur de salinité S retenue pour laquelle on calcule l'OD - le produit obtenu est à soustraire à la valeur en OD en eau douce correspondante
Dans les eaux peu profondes des systèmes estuariens, de faibles concentrations en OD peuvent se produire selon deux grandes catégories : un modèle oscillant journalier résultant en hypoxies nocturnes répétées en raison du cycle de la photosynthèse-respiration des populations d'algues, ou comme une hypoxie ou anoxie, prolongée, en eau profonde causée par la stratification (TAYLOR et MILLER, 2001).
L'oxygène dissous peut s'exprimer en mg.L-1 et en pourcentage de saturation. La quantité
dissoute permet de savoir si la vie ou la survie des espèces est ou non menacée. Le pourcentage met en évidence les déséquilibres observés aussi bien par sursaturation que par déficit. Un taux d’oxygène favorable dans les couches d’eau de surface peut parfois masquer un déficit dans les couches d’eau profonde.
CemOA
: archive
ouverte
d'Irstea
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
Figure 1. Taux de saturation en oxygène en fonction de la salinité et de la température (in Barnabé 1991)
2.5 Interaction des paramètres entre eux
2.5.1 Turbidité, température et oxygène
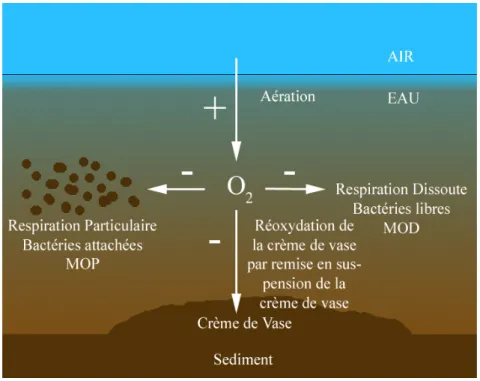
En milieu estuarien, une forte courantologie provoque une bonne ré-aération des eaux et une hausse des teneurs en O2 (COMMARIEU, 2007). Cependant, une hydrodynamique forte engendre aussi la remise en suspension de particules déposées sur le fond lors des épisodes de moindre énergie autour des étales. Toute remobilisation provoque une augmentation des teneurs en MES dans l’eau et s’accompagne d’une consommation d’O2 supplémentaire, car la crème de vase déposée au fond est connue pour être anoxique. Elle se ré-oxyde donc en pleine eau (Figure 2) (THOUVENIN et al. 1994 ; ABRIL et al. 1999).
Les minima de taux de saturation en oxygène correspondent aux maxima de turbidité et, inversement, les valeurs élevées en oxygène sont enregistrées lors des valeurs basses de turbidité (ABRIL et al., 1999).
En France, de nombreux estuaires comme la Seine, la Loire et La Gironde présentent des zones d’hypoxie, voire d’anoxie chronique, souvent situées en aval d’agglomération
CemOA
: archive
ouverte
d'Irstea
(CHAUDON, 2005). Elles peuvent occuper des surfaces très importantes qui ne laissent aucune chance aux diverses espèces de poissons. Ces déficits d’oxygène sont liés à la température élevée des eaux et à la présence d’un bouchon vaseux. D’autres facteurs peuvent jouer et s’avérer primordiaux comme la stagnation des eaux, liée aux débits d’étiage, et la nature de la fraction organique présente dans les MES (QUERNEAU, 2008).
Figure 2. Postulat de base des processus affectant le paramètre oxygène dans un estuaire hyperturbide ; cas de la Gironde (d’après COMMARIEU, 2007). (MOP matières organiques particulaires ; MOD matières organiques dissoutes).
2.5.2 L’oxygène, l’ammoniaque et la salinité
En milieu aquatique, l’azote minéral peut se présenter sous 4 formes principales : l’ammoniaque NH4+, en équilibre avec la forme gazeuse NH3, les nitrites NO2- et les nitrates NO3-.
En conditions aérobies, la nitrification est rapide (passage de l’azote ammoniacal vers la forme nitrate). La réaction est réversible en anaérobiose. L’altération de la nitrification commence à se produire au-dessous de 3 mg.L-1.
C’est l’azote ammoniacal sous la forme NH3, qui est toxique pour la vie aquatique. L’équilibre entre NH4 et NH3 est sous dépendance du pH, de la température et secondairement de la salinité. CemOA : archive ouverte d'Irstea / Cemagref
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
3 LES POISSONS CONCERNÉS PAR LES MASSES D’EAU DE
TRANSITION
3.1 Les espèces les plus observées en Europe
FRANCO et al. (2008b) ont analysé 38 masses d’eau de transition, estuaires, deltas, rias, fjords et lagunes, situées le long des côtes européennes, de la Méditerranée, de l'Atlantique, de la mer du Nord et des régions de la Baltique. Les espèces de poissons qui y ont été observées ont été affectées à des guildes fonctionnelles, selon leur stratégie de reproduction et leur mode d'alimentation, afin de décrire l'usage de ces eaux de transition par les poissons. En effet, les masses d’eau de transition peuvent être utilisées par les poissons comme des zones pouponnières ou de nourricerie, des aires de ponte, des voies de migration ou des milieux de vie pour la réalisation complète du cycle biologique chez certaines espèces autochtones à ces hydrosystèmes (ÉLIE & MARCHAND, 1983 ; ÉLIE et al., 1990 ; ELLIOTT & HEMMINGWAY, 2002 ; KOUTRAKIS
et al., 2005).
Dans ces hydrosystèmes, les poissons susceptibles d’être présents sont représentés par 313 espèces (FRANCO et al. 2008). La richesse des assemblages des espèces de poissons va de 16 (lagune de Canet-Saint-Nazaire) à 110 (estuaire de la Tamise) avec une moyenne (± SD) de 53 ± 20. En termes d'utilisation de l'habitat, la dominance va aux espèces marines (58%), puis aux espèces estuariennes, aux poissons migrateurs amphihalins (anadromes ou catadromes) et aux espèces dulçaquicoles.
3.2 Les poissons retenus comme étant indicatifs
Parmi les espèces utilisant les masses d'eau de transition, nous avons retenu celles très fréquemment rencontrées dans ce type de milieu (occurrence > 0,6) selon (FRANCO et
al., 2008b). Ces espèces fréquentent également les trois écorégions françaises : Manche,
Golfe de Gascogne et Méditerranée (GIRARDIN et al., 2007 ; cf. Annexe 1). Parmi ces espèces, certaines sont souvent inféodées au fond (benthiques), par leur mode d'alimentation et/ou de reproduction.
Nous avons retenu des espèces estuariennes stricto sensu (ES) comme celles du genre
Pomatoschistus présentes toute l’année (Figure 3). D'autres sont d’origine marine
migrante comme celle de la famille des mugilidae (genres Chelon et Liza), le bar
Dicentrarchus labrax, le flet Platichthys flesus, la sole Solea solea et le sprat Sprattus sprattus. Ces espèces effectuent également des déplacements vers l’amont et vers l’aval
en période estivale (Figure 3).
Nous avons également intégré des espèces amphihalines diadromes car les espèces migratrices, pour une grande partie de leur population, sont obligées de migrer à travers les eaux de transition. Elles sont donc susceptibles de transiter par les zones en hypoxie (Figure 3). Elles sont moins résistantes que les espèces estuariennes aux conditions d’hypoxie (PERSON-LE RUYET, 1986) et sont aussi les plus menacées (COSTELLO et
al., 2002). Parmi ces poissons anadromes, nous avons particulièrement retenu la famille
des Salmonidae et la sous famille des Alosinae dont les espèces dans ce groupe sont les plus sensibles aux paramètres du milieu. Ce sont aussi des espèces à conserver au titre de la Directive Habitats.
D'autres espèces, plus sporadiques en comparaison, s'avèrent intéressantes car elles peuvent être indicatrices de certaines masses d'eau de transition selon leur latitude. C'est le cas de l’éperlan Osmerus eperlanus, espèce anadrome (occ = 0,34 d’après FRANCO
et al., 2008b) qui peut être très abondante dans les estuaires du Nord de l'Europe (THIEL et al., 2003). Dans le Sud de l'Europe, l'athérine Atherina presbyter est une espèce dite
CemOA
: archive
ouverte
d'Irstea
estuarienne (occ = 0,45 ; FRANCO et al., 2008b) ; Atherina boyeri est très fréquente dans les lagunes (occ = 0,73 ; PEREZ-RUZAFA et al., 2007).
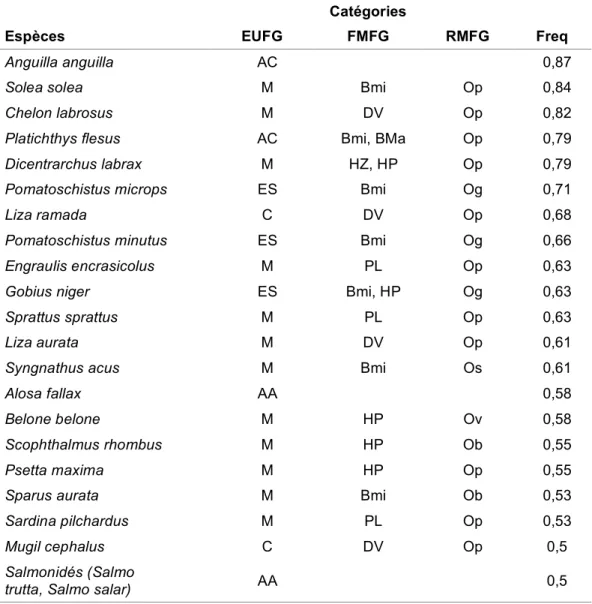
Tableau 4. Espèces les plus fréquentes actuellement dans les masses d'eau de transition européennes et leurs guildes écologique, trophique et de reproduction (d'après FRANCO et al., 2008b modifié)
Catégories
Espèces EUFG FMFG RMFG Freq
Anguilla anguilla AC 0,87
Solea solea M Bmi Op 0,84
Chelon labrosus M DV Op 0,82
Platichthys flesus AC Bmi, BMa Op 0,79
Dicentrarchus labrax M HZ, HP Op 0,79
Pomatoschistus microps ES Bmi Og 0,71
Liza ramada C DV Op 0,68
Pomatoschistus minutus ES Bmi Og 0,66
Engraulis encrasicolus M PL Op 0,63
Gobius niger ES Bmi, HP Og 0,63
Sprattus sprattus M PL Op 0,63
Liza aurata M DV Op 0,61
Syngnathus acus M Bmi Os 0,61
Alosa fallax AA 0,58
Belone belone M HP Ov 0,58
Scophthalmus rhombus M HP Ob 0,55
Psetta maxima M HP Op 0,55
Sparus aurata M Bmi Ob 0,53
Sardina pilchardus M PL Op 0,53
Mugil cephalus C DV Op 0,5
Salmonidés (Salmo
trutta, Salmo salar) AA 0,5
EUFG groupe fonctionnel d'utilisation de l'estuaire, FMFG groupe fonctionnel du mode d'alimentation, RMFG groupe fonctionnel du mode de reproduction ; ES espèces estuariennes, M espèces marines migrantes, AA amphihalin anadrome, AC amphihalin catadrome ;
Bmi microbenthivore, BMa macrobenthivore, PL planctivore, HZ hyperbenthivore / zooplanctivore, HP hyperbenthivore / piscivore, DV détritivore ;
Op ovipare avec des œufs pélagiques, Ob ovipare avec des œufs benthiques, Ov ovipare avec des oeufs adhésifs, Og ovipares qui gardent, Os ovipare hébergeur.
En milieu tempéré, le passage de ces différentes espèces de poissons entre l’eau douce et le milieu marin leur permet soit, d’atteindre des habitats plus productifs (GROSS et al., 1988) et donc plus favorables à la croissance, soit, leur zone de reproduction.
En outre, en changeant d’habitat, un individu peut se soustraire à des conditions environnementales défavorables. Pour beaucoup d’espèces, le changement de milieu
CemOA
: archive
ouverte
d'Irstea
La vie piscicole dansles Masses d’Eau de Transition: proposition d’une grille de qualité pourlatempérature,l’oxygène dissous,la salinité etlatransparence
dépend en premier lieu de la température (ELLIOT, 1991), mais aussi des zones défavorables àleur survie.
Migrations de dévalaison et de montaison - mouvements amont aval – milieu de vie Période de crises d’hypoxie et d’anoxiefréquemment observées en estuaire
(en rougeles poissons migrateurs non considérés comme sensibles mais dontla période de présence au sein des masses d’eau detransition etle statut de vulnérabilitéjustifient delesintégrer)
A : Poissons amphihalins potamotoques (reproduction en eau douce)
Famille Ecophase J F M A M J J A S O N D Adult Salmonidae* Juv Adult Clupeidae Alosa sp.* Juv Adult Osmeridae* Juv Adult A Petromyzontidae * Juv
B : Poissons amphihalins thalassotoques (reproduction en mer)
Famille Ecophase J F M A M J J A S O N D Argentée Jaunejuv.
Anguillidae Civelle Adult Juv Flet B Mulet Adult
C : Poissons d’origine marine (reproduction en mer)
Famille J F M A M J J A S O N D Sole
Bar C
Sprat
D : Poisson estuarien autochtone – (cycle de vie et donc reproduction en estuaire)
Famille J F M A M J J A S O N D D
Gobie
Figure 3. Calendriers d’occupation des masses d’eaux detransition parles espèces de poissons considérées – présence et migrations (d’après ÉLIE, 1992) ; en rouge : espèces diadromes citées pour mémoire.
Ce m OA : a rc hi ve o uv ert e d'I rs te a / C e ma gr ef
4 EFFETS DES PARAMÈTRES SUR LES POISSONS
D'une manière générale, la sensibilité aux quatre paramètres listés ci-après varie selon les écophases des poissons (larves - alevins nouvellement éclos - juvéniles - adultes migrants – géniteurs). En général, les larves et les juvéniles de poissons sont plus sensibles que les subadultes et les adultes. La sensibilité se décline aussi de manière différente selon les espèces.
Les indices qui permettent d’évaluer les effets à court terme de ces paramètres sont les tests de létalité calculés pour des temps d’exposition variables (24, 48, 96h). Les seuils de sublétalité permettent d’évaluer les effets à long terme. Ils sont basés soit sur un état physiologique défaillant (croissance, vitesse de nage, métabolisme …), soit sur une réaction comportementale susceptible de jouer un rôle capital dans le cycle biologique et la survie de l’espèce (blocage de migrations, évitement, nage anarchique).
4.1 Température
La température influence l'activité biologique des poissons et leurs distributions spatio-temporelles.
Les températures maximales que les poissons parviennent à tolérer varient avec les espèces, l'ontogénèse au sein d'une espèce, s’il y a eu acclimatation ou non, en fonction du stress, de la salinité, des effets synergiques avec des polluants et de la disponibilité en oxygène. Ainsi, un état hypoxique empêche les augmentations de la capacité d'acclimatation (résistance à la chaleur). Au contraire, une augmentation de l'OD induit une résistance notable à la chaleur (in HOUSTON, 1983). Cependant, l’acclimatation nécessite des délais.
4.2 Salinité
Les effets de la salinité sur les poissons sont variés selon la tolérance de chaque individu mais aussi selon les facteurs environnementaux. Ainsi la réponse d'un poisson peut être différente à diverses températures et en fonction de son écophase (POXTON & ALLOUSE, 1982).
4.3 Turbidité
La turbidité joue sur la distribution des poissons. Elle peut faciliter la prise d’alimentation et l’échappement en créant une source de nourriture supplémentaire et une protection visuelle contre les prédateurs (MAES et al., 1998).
Les effets des MES s’expliquent à la fois par un niveau de concentration et un temps d’exposition (WILBER & CLARKE, 2001). Ils peuvent avoir un effet bloquant (échange de gaz ou érosif) sur les branchies des animaux. Les effets subléthaux sont similaires à ceux produits par une privation d'oxygène (CYRUS & BLABER, 1987). À de hautes concentrations, les particules fines recouvrent l’épithélium des branchies, ce qui coupe l'échange des gaz et provoque une hyperventilation. Les plus grandes particules peuvent être piégées dans les lamelles branchiales et bloquer le passage de l’eau conduisant à l'asphyxie.
Dans un estuaire macrotidal, le maximum de turbidité peut dépasser 1000 mg.L-1 (SANCHEZ & DELANOË, 2006).
CemOA
: archive
ouverte
d'Irstea
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
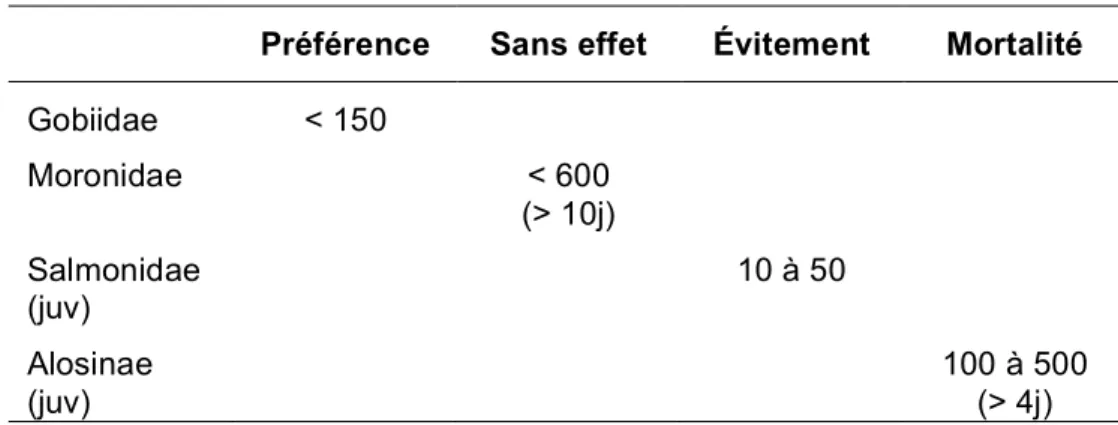
Globalement, sur des œufs et des larves de poissons estuariens, des effets sublétaux et des mortalités peuvent survenir en moins de 24h à partir de plus de 100 mg.L-1 de MES2 en raison d’un effet abrasif sur la membrane externe des lamelles branchiales. Les œufs de poissons démersaux seraient moins sensibles, la durée d’exposition, pour avoir un effet, devant atteindre 3 à 4 jours (WILBER & CLARKE, 2001). Au stade adulte, il faut atteindre des niveaux de turbidité élevés, autour de 600 mg.L-1, pour constater un début d’impact sur les poissons estuariens (WILBER & CLARKE, 2001).
4.4 Oxygène
4.4.1 Besoins physiologiques
Les besoins des poissons en oxygène varient selon les espèces auxquelles on s’intéresse, au sein d’une espèce selon les individus, selon l’écophase, s’il y a eu acclimatation ou non, avec la température, selon la qualité de l’environnement, etc. Le métabolisme d’activité se divise en deux zones : l’une d’indépendance respiratoire et l’autre de dépendance respiratoire départagée par une valeur critique en OD. En dessous de ce seuil, plus la concentration en OD diminue et plus la consommation apparente du poisson diminue, alors que ses besoins physiologiques en oxygène ne diminuent pas pour autant. Le poisson connaît une situation de souffrance physiologique qui va jusqu’à la mort lorsque l’OD atteint le seuil létal (SAURIAU, 1991).
4.4.2 Stress hypoxique et anoxique
Les poissons peuvent tolérer des conditions hypoxiques pendant de courtes périodes. Si les conditions de stress se prolongent, des réponses physiologiques, biochimiques et cytologiques se mettent en place. L’hyperventilation est une des modifications classiques observées chez les poissons.
Effets sur le comportement
Les principales réponses comportementales des poissons face à des concentrations en OD réduites sont le changement d'activité, l'augmentation de l'utilisation de la respiration de l'air et de la respiration aquatique de surface et enfin les changements d'habitats horizontal et vertical (KRAMER, 1987). Dans le cas de valeurs en OD limitantes, les adultes sont un peu moins vulnérables que les juvéniles (BEAUPOIL & BORNENS, 1997).
En présence d’une hypoxie qui se prolonge, PERSON-LE RUYET (1986) décrit trois phases : une période brève d’excitation, assimilée à un réflexe de fuite, une période de calme transitoire puis une surexcitation générale du poisson avec des mouvements désordonnés qui précèdent de peu son agonie.
L’évitement
Les conséquences de l'hypoxie sur les poissons dépendent de leur capacité à détecter et à éviter les zones de faibles concentrations d'oxygène dissous, s’ils le peuvent. L’évitement de l’hypoxie diffère entre les espèces, certaines espèces montrant un seuil d'évitement alors que d'autres présentent un comportement d'évitement graduel (WANNAMAKER & RICE, 2000).
Les poissons sont capables d'occuper des habitats de qualité inférieure, des zones où les concentrations d’oxygène sont faibles, lorsque les conditions se détériorent et que la taille des refuges correctement oxygénés rétrécit. Lorsque toute la masse d'eau est oxygénée, les poissons sont susceptibles d'occuper toutes les profondeurs. Durant les périodes d’hypoxie au contraire, les poissons sont restreints à fréquenter les zones oxygénées peu
2ou Environ 30 NTU CemOA : archive ouverte d'Irstea / Cemagref
profondes et souvent plus chaudes (EBY & CROWDER, 2002), ce qui ne convient qu’à certaines espèces.
Les poissons ne sont pas tous capables d'éviter les eaux ayant des concentrations potentiellement létales en OD. C'est par exemple le cas du gobie commun (P. microps) et du flet (Platichthys flesus) selon TURNPENNY & LINEY (2006).
Effets sur la croissance
L’oxygène dissous (OD) se révèle être, avec la température, l'un des plus importants facteurs abiotiques déterminant la croissance et la survie des juvéniles de poissons évoluant en estuaire (TAYLOR & MILLER, 2001).
Sous conditions d’hypoxie ou de variations en OD, le taux de croissance peut être notablement réduit (BEJDA et al., 1992). Il peut s’expliquer soit par un manque d’appétit (THETMEYER et al., 1999) soit par une prédation moins efficace (TALLQVIST et al., 1999). La mauvaise oxygénation de l’eau qui entraîne une hyperventilation chez le poisson augmente son taux de métabolisme : glycémie, décharges d’adrénaline et d’hormones corticoïdes, pression sanguine augmentées, etc. (PERSON-LE RUYET, 1986). Une augmentation rapide des pathologies est à prévoir (GIRARD & ÉLIE, 2007). Chez les juvéniles de poisson, ces réductions de taux de croissance se produisent à environ 2,2 fois la concentration en OD qui provoque 50% de la mortalité d’une espèce en 24 h à 96 h (BREITBURG, 2002).
La présence de zones hypoxiques modifie aussi l’utilisation de l’habitat pour les poissons. Une compression des aires habitables peut entraîner un accroissement des densités et un chevauchement plus important entre les compétiteurs et les prédateurs potentiels. Cela peut provoquer l'augmentation des coûts métaboliques au sein des organismes, et entraîner des effets sublétaux, tels qu’une croissance réduite et une condition physique diminuée (EBY & CROWDER, 2002) ou de mauvaise reproduction.
4.5 Sensibilité des poissons par espèce, genre ou famille
Les champs de tolérance par espèce vis-à-vis de la température, de la turbidité et de l’hypoxie sont plus ou moins bien connus selon les espèces de poissons. Aussi, dans ce travail, les études réalisées sur des espèces proches de celles que nous avons retenues sont utilisées. Il s'agit d'espèces qui appartiennent au moins à la même famille et présentent un cycle de vie similaire.
Souvent, la sensibilité face à la turbidité n’est pas renseignée, les informations étant rares ou absentes.
4.5.1 Les espèces estuariennes
Gobiidae
Les trois espèces Pomatoschistus minutus, P. microps et Gobius niger sont présentes sur les façades atlantiques et méditérranéennes. Les deux premières sont dominantes (BOUCHEREAU, 2001).
En milieu estuarien, P. minutus a la plus large distribution et se retrouve dans les zones de faibles salinités (5-7 PSU). Il pond en zone littorale (estuaire externe) et parfois aussi en estuaire interne (FONDS & VELDHUIS, 1973 ; MARCHAND & ÉLIE, 1983).
Dans les lagunes méditerranéennes, les espèces de gobies ont différentes stratégies d’occupation. P. minutus est une espèce annuelle qui entreprend des migrations depuis la lagune jusqu’à la mer (PAMPOULIE et al., 2001) bien qu’elle puisse aussi effectuer l’ensemble de son cycle de vie dans ce milieu de haute productivité (BERREBI et al., 2005). P. microps est une espèce sédentaire annuelle présente quasiment tous les ans et
CemOA
: archive
ouverte
d'Irstea
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
G. niger une sédentaire pluriannuelle présente de temps à autres (BOUCHEREAU &
GUÉLORGET, 1998).
- Température : FONDS & VAN BUURT (1974) ont montré expérimentalement que les œufs de P. minutus ne survivent pas dans une eau à 25°C. Selon le degré d’acclimatation, l’adulte peut résister à une valeur maximale critique de 30-31°C avec beaucoup de difficulté (HESTHAGEN, 1970). Son optimum se situe entre 17 et 22°C (JOBLING, 1981).
- Salinité : P. minutus est extrêmement euryhalin, puisque c’est une espèce autochtone de systèmes d’interface
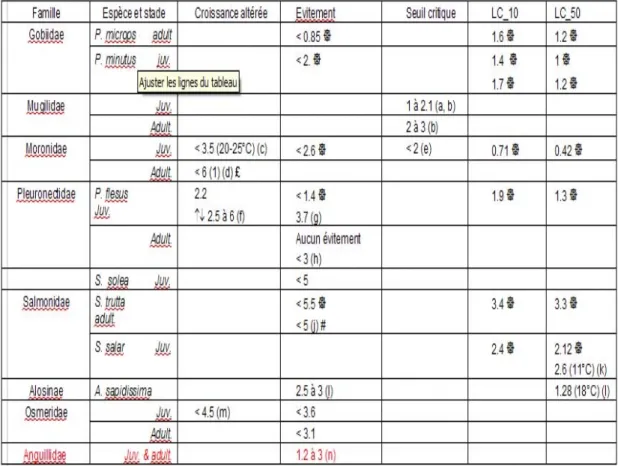
- Oxygène : P. microps pond ses œufs sous les coquilles de bivalves et le mâle garde le nid et les oeufs pendant l'incubation. Il les abandonne seulement lorsque la teneur en OD est 0,1 mg.L-1 au-dessus de sa valeur limite létale qui est de 0,25 mg.L-1 selon BREITBURG (1992) et qui correspond chez TURNPENNY & CLOUGH (2006) à une LC90 en 6h. Ce comportement expose particulièrement ces poissons durant leur saison de reproduction. TURNPENNY et al. (2004) obtiennent un seuil d’évitement pour cette espèce à moins de 0.85 mg.L-1 (LC50, en 24h, avec 1.2 mg.L-1).
Atherinidae
D’une manière générale, les atherinidae sont capables d’osmoréguler dans une gamme de salinité supérieure à celle des autres espèces de poissons que l’on trouve dans les lagunes (THOMPSON et WITHERS, 1992).
Atherina presbyter se répartit essentiellement le long des côtes atlantiques. Cette espèce
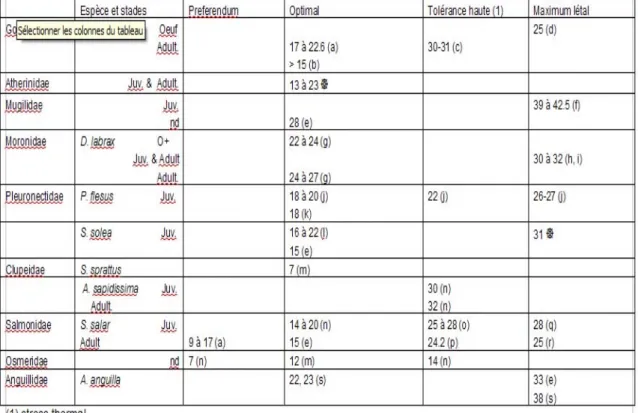
est plus occasionnelle en Méditerranée par rapport à Atherina boyeri, caractéristique des lagunes côtières. Cette dernière est très euryhaline. Elle peut effectuer des migrations en eau douce pour se reproduire ou bien migrer entre mer et lagune. La reproduction a lieu au printemps, de mars à juin (ROSECCHI, 2001). Cette espèce présente des périodes de faible activité trophique en été et deux fortes au printemps et en automne (MARFIN, 1981). Les étendues des paramètres associés avec la plus forte abondance de juvéniles et d’adultes A. boyeri sont pour la température 13 à 23°C, la salinité 2 à 19 PSU, l’oxygène 6 à 12 mg.L-1 et la transparence 38 à 58% (REBELO, 1992).
4.5.2 Les espèces d’origine marine
Mugilidae
Les espèces de Mugilidae effectuent de véritables migrations entre le milieu marin et le milieu fluvial. Nous ne les traitons pas dans le paragraphe concernant les migrateurs amphihalins, car certaines espèces comme L. annata sont très marines, ce qui nous conduit à les décrire ici. Ils se reproduisent en milieu marin côtier, la migration massive en vue du frai se situant de la fin de l'été jusqu'au début de l'hiver (CARDONA, 2000). Le moment du recrutement des larves et des alevins vers les zones littorales varie selon les espèces. Globalement, elle se produit de l’hiver jusqu’au début de l’été.
Les juvéniles des espèces C . labrosus, L. ramado et M. cephalus se concentrent tout au long de l’année en eaux douce, oligohaline et mésohaline, où ils atteignent leur meilleure performance de croissance (CARDONA, 2000). Ceux de L. aurata préfèrent les zones polyhalines à euhalines (CARDONA, 2006), dans les lagunes, les baies saumâtres et salées (LAFAILLE, 2001). En automne, ou sous l’action d’un bouleversement environnemental, abaissement de la température ou de la salinité, crises dytrophiques ou anoxiques), les mulets quittent ces milieux devenus défavorables et retournent en mer. Leur osmorégulation s’effectue mal lorsque la température est trop basse (LAFAILLE et
al., 2001). CemOA : archive ouverte d'Irstea / Cemagref
- Température : Dans des eaux allant de 0,15 et 34 PSU, les juvéniles de M.
Cephalus sont capables de fréquenter des zones où les valeurs des températures
peuvent atteindre 34 et 37,2°C. Leur niveau létal se situe entre 39 et 42.5°C (MAJOR, 1978).
- Salinité : Les Mugilidae sont euryhalins, donc tolérants à une large gamme de salinité. Les adultes des deux espèces C . labrosus et M. cephalus peuvent résister à des changements brusques de salinité en passant d’une eau de 20 à 40 PSU (HOTOS et VLAHOS, 1998). Si la salinité augmente progressivement, ils sont capables de s’acclimater à une salinité de plus de 100 PSU.
- Turbidité : Les mulets sont classés comme des espèces préférant des eaux claires à partiellement turbides (< 50 NTU3 ) (CYRUS et BLABER, 1987).
- Oxygène : Les larves ont besoin d’eaux bien oxygénées pour survivre. Dans le cas de Mugil cephalus, leur taux de survie dans des eaux contenant entre 8 mg.L-1 et 4 mg.L-1 d’OD chute de 84% à 0 - 8% (SYLVESTER et al., 1975).
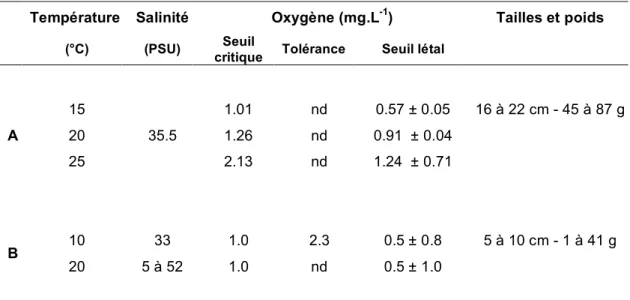
Chez les juvéniles de Liza ramada, la consommation en oxygène augmente avec la température. Elle double lorsque l’eau passe de 9 à 13°C. Pour une température inférieure ou égale à 20°C, le seuil critique en oxygène à ce stade se situe aux alentours de 1 mg.L-1 et passe à 2 mg.L-1 à 25°C (Tableau 5). En dessous de ce
seuil critique, les juvéniles ne résistent pas plus de 1 à 5 heures selon les études (SAURIAU, 1991).
En dessous de 4 mg.L-1 d’oxygène, les juvéniles de mulet recherchent de manière
significative la plus grande concentration en oxygène et évitent les zones hypoxiques de 2 mg.L-1, si cela est possible (WANNAMAKER & RICE, 2000).
Tableau 5. Détermination des seuils critiques, de tolérance et létal de l'oxygène pour des juvéniles Liza ramada (d’après SAURIAU, 1991).
Température Salinité Oxygène (mg.L-1) Tailles et poids
(°C) (PSU) Seuil
critique Tolérance Seuil létal
A 15 20 25 35.5 1.01 1.26 2.13 nd nd nd 0.57 ± 0.05 0.91 ± 0.04 1.24 ± 0.71 16 à 22 cm - 45 à 87 g B 10 20 33 5 à 52 1.0 1.0 2.3 nd 0.5 ± 0.8 0.5 ± 1.0 5 à 10 cm - 1 à 41 g
A : TRITAR et al, 1977 ; B : Cladas 1984 ; nd non défini
Les mulets adultes présentent un seuil critique de l’ordre de 2 à 3 mg.L-1 . En dessous de ce seuil, leur résistance est en moyenne de 2 à 3 heures pour 95% d’entre eux (1h30 au minimum et 6h au maximum) (SAURIAU, 1991).
Moronidae (la famille des bars)
3ou < 165 mg.L-1 de MES CemOA : archive ouverte d'Irstea / Cemagref
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
Les bars sont des poissons littoraux qui se reproduisent en mer et qui recherchent des eaux bien oxygénées. Les postlarves et les alevins habitent les lagunes tidales et les estuaires. Celles de Dicentrarchus labrax (5 à 15 mm de long) rentrent dans les estuaires en mai juin, un mois ou deux après la ponte qui a lieu sur la côte. Le bar gagne les eaux littorales plus profondes avec l’âge et durant les 4 à 5 premières années de sa vie reste fortement dépendant du milieu estuarien (KELLEY, 1988) au moins pour une partie de ses populations.
- Température : La cohorte des 0+ est très inféodée à certaines gammes de température de l'eau. La croissance des juvéniles est maximale entre 22 et 25°C (CECH et al., 1984 ; BARNABÉ, 1991). Les jeunes D. labrax ne se rencontrent pas au-delà de températures supérieures à 34°C (COUTANT, 1977). Ils sont peu fréquents au-dessus de 28°.
L’adulte est aussi tolérant avec une valeur seuil qui atteint 30-32°C (CLAIREAUX & LAGARDÈRE, 1999).
- Salinité : Le bar est euryhalin et supporte des salinités de 0,5 à 40 PSU. À tous les âges, le bar est capable de tolérer l’eau douce (CLAIREAUX & LAGARDÈRE, 1999). Les plus fortes densités en 0+ sont observées dans les zones oligohalines, sur les hauts-fonds sablo-vaseux riches en invertébrés benthiques (MARTINHO et
al., 2007). Cependant, les subadultes et les adultes sont plutôt majoritairement
présents en zone mésohaline, polyhaline et marine (ÉLIE Com. Pers.).
À tous les âges, en conditions expérimentales, cette espèce est capable de tolérer l’eau douce – pour des temps variables – et une étendue de température aussi large que 2 à 32°C (CLAIREAUX & LAGARDÈRE, 1999).
- Turbidité : Le bar recherche, à certains moments, des zones matières en suspension élevées (ARAUJO et al., 2000). Les adultes peuvent évoluer plusieurs jours dans une eau à 600 mg/L de MES sans effet apparent (WILBER & CLARKE, 2001).
- Oxygène : Une hypoxie inférieure à 3.5 mg.L-1 diminue la croissance des juvéniles
M. saxatilis à 20 et 25°C mais ce n'est plus le cas à 15°C (CECH et al., 1984). En
dessous de 3 mg.L-1, l’activité de nage se réduit (BREITBURG D.L. et al., 1994).
Le niveau létal est atteint, pour l’ensemble des individus, vers 2 mg.L-1 d’OD
(COUTANT, 1985).
Les seuils en oxygène de D. labrax sont donnés entre 45% et 54% du niveau de saturation respectivement à 20° et 25°C (DALLA VIA et al., 1998 ; THETMEYER et
al., 1999). D’après (PERSON-LE RUYET, 2003) les performances de croissance
des juvéniles de bar sont affectées dès que le niveau d’oxygène devient inférieur à 6 mg.L-1. La baisse de croissance est de 40 % pour des niveaux en O2 stabilisés
autour de 5 mg.L-1. Les baisses de performances de croissance en hypoxie s’expliquent principalement par une réduction de la prise alimentaire.
D'après les données issues du travail de REBELO (1992), les étendues des paramètres associés avec la plus forte abondance de juvéniles et d’adultes D.
labrax, sont pour la température 12°C, la salinité 1 à 20 PSU, l’oxygène 9 à 10
mg.L-1.
Sprattus sprattus
Le sprat est un petit clupéïdé répandu sur toutes les côtes européennes de l'Atlantique. Il est également présent dans la partie septentrionale de la Méditerranée occidentale (LEE, 1963). C'est une espèce des eaux côtières. Les juvéniles entrent dans les estuaires
CemOA
: archive
ouverte
d'Irstea
parfois jusqu'aux zones oligohalines4, cependant, ils sont surtout inféodés aux secteurs mésohalin et polyhalin (ÉLIE & MARCHAND, 1983). Les fortes abondances en sprat sont associées à une haute teneur en OD (> 6 mg.L-1), et des températures basses <15°C
(ARAUJO et al., 2000).
4.5.3 Les poissons plats
Les systèmes estuariens sont particulièrement vitaux comme zones de nourricerie pour les poissons plats. Dans l'Atlantique Nord, ces poissons sont à la fois abondants et commercialement importants. Leur mode de vie présente plusieurs caractéristiques communes, telles que les zones de frai au niveau du plateau continental, la migration passive des œufs puis celle plus ou moins active des larves vers les zones côtières et enfin une concentration dans les zones littorales et estuariennes (CABRAL et al., 2007).
Platichthys flesus
Les jeunes P. flesus de l’année pénètrent dans les estuaires et se concentrent dans les zones de nourricerie à la fin du printemps. Ils y restent jusqu’à la fin de l’automne puis se dispersent vers les zones plus profondes (KELLEY, 1988). La plupart des juvéniles de flet 0+ et 1+ peuvent rester dans le milieu estuarien pendant 2 ans environ (ÉLIE & MARCHAND, 1983 ; MARTINHO et al., 2007).
- Température : En dehors des larves avant version somatique qui sont très fragiles, les juvéniles de l’année ont une étendue de température optimum pour leur croissance de 18-20°C. Le taux de croissance chute vite lorsque la température dépasse 20 à 22°C. Elle devient létale au-delà de 27°C (JAGER et al., 1993). - Salinité : Entre l'éclosion et la postlarve, la tolérance à la salinité la plus faible est
de 0-1 PSU (YIN & BLAXTER, 1987). Les juvéniles de l’année continuent à préférer les eaux où la salinité est la plus faible alors que les individus plus âgés ont une distribution très étendue au sein de l’estuaire (KERSTENS et al., 1979 ; JAGER et al., 1993) avec des juvéniles qui tendent à se concentrer, à un moment donné, dans les aires mésohalines plutôt qu’oligohalines (MARCHAND, 1993). Dans une gamme de 1 à 25 PSU, ils se montrent très tolérants vis-à-vis de la salinité (POWER et al., 2000b). Dans les grands bassins versants français, nous pouvons rencontrer de grandes concentrations de flets O+ bien au-delà de la limite de marée dynamique.
- Oxygène : En milieu expérimental, la croissance des flets nouvellement métamorphosés peut être réduite en l’espace de 10 à 14 jours à des concentrations en OD allant de 1,8 à 4,49 mg.L-1 (KARNA, 2003). Les post larves
de flet répondent négativement à des eaux pauvres en oxygène quand l’opportunité leur est donnée de choisir entre des eaux peu et bien oxygénées. Les mouvements de retraits des juvéniles débutent quand la concentration descend sous 3,7 mg.L-1 (DEUBLER & POSNER, 1963). Leurs taux de croissance sont notablement réduits lorsqu’ils sont soumis à des concentrations constantes et faibles en OD de 2,2 mg.L-1 ou à des fluctuations diurnes allant de 2,5 à 6,4 mg.L-1
(BEJDA et al., 1992 ; HOWELL & SIMPSON, 1994) même si des valeurs de 3-4 mg.L-1 permettent de les observer en abondance (MOELLER & SCHOLZ, 1991), mais peut être pas à leur niveau d’abondance maximum. Des saturations en oxygène sub-létales de 30–40% provoquent des changements dans leur comportement de prédation (TALLQVIST et al., 1999).
4 http://www.fishbase.ca/Summary/speciesSummary.php?ID=1357&genusname=Sprattus&speciesname=sprattus+sprattus CemOA : archive ouverte d'Irstea / Cemagref
La vie piscicole dans les Masses d’Eau de Transition : proposition d’une grille de qualité pour la température, l’oxygène dissous, la salinité et la transparence
Afin qu’un jeune flet puisse s’acclimater et que son taux de croissance augmente, même dans un milieu modérément hypoxique (3-5 mg.L-1), les conditions de milieu ne doivent pas être fluctuantes (TAYLOR & MILLER, 2001). À un niveau constant d’OD de 6,7 mg.L-1, les taux de croissance sont deux fois supérieurs à ceux
d’individus maintenus en conditions de concentration faible ou fluctuante. Il ressort qu’à la suite d’une exposition hypoxique, même si le flet évolue par la suite dans des eaux normoxiques à 7,2 mg.L-1 pendant plusieurs semaines, il lui faut plus de
deux mois pour rattraper la taille des témoins qui ont été élevés dans des eaux toujours bien oxygénées. Les effets des altérations de la croissance, qui sont déjà des effets résultant d’un stress sous-jacent important, se font sentir durablement chez ces poissons (BEJDA et al., 1992). Dans la Loire, des valeurs inférieures à 5 mg.L-1 constituent déjà une barrière à la migration du flet qui n’est plus rencontré en dessous de ce seuil (POMFRET et al., 1991 ; MARCHAND, 1993).
Les adultes cherchent à éviter des eaux dont les teneurs sont inférieures ou égales à 3 mg/L (ELLIOTT et HEMMINGWAY, 2002).
Solea solea
Les zones de nourricerie des soles se situent le long du littoral, ainsi que dans les estuaires (ÉLIE & MARCHAND, 1983 ; ÉLIE et al., 1991 ; AMARA et al., 2000), habituellement en zone mésohaline (CABRAL & COSTA, 1999). Les zones estuariennes offrent un potentiel de croissance élevé pour les juvéniles et une zone d’abri contre la prédation supérieure à celui du littoral (LE PAPE et al., 2003). La migration des adultes vers les zones de reproduction côtière se produit en début de l'année jusqu’à la fin du mois d'avril, selon les conditions hydroclimatiques. Les juvéniles de soles sont observés dans l'estuaire quand la salinité au fond varie entre 25 et 30 PSU et la température dépasse 11°C. Au printemps, elles se localisent à l’entrée de l'estuaire (polyhalin et mésohalin), puis se concentrent dans les parties amont, mésohaline et oligohaline (ÉLIE & MARCHAND, 1983 ;MARCHAND, 1991).
- Température : En condition expérimentale, le taux de croissance des larves nouvellement écloses est maximum à 23-24°C (COLCLOUGH & COATES, 2004). Sur le terrain, les températures de bien-être sont beaucoup moins importantes. Le régime des températures qu’elles subissent au début de leur vie détermine le niveau d'abondance des 0+ au cours de leur premier hiver (HENDERSON & SEABY, 1994). Les juvéniles ont un optimum de croissance entre 16 et 22°C (FONDS M., 1979).
- Salinité : Les juvéniles de l’année (Cohorte 0+) préfèreraient les zones de salinité allant de 10 à 33 PSU (MARCHAND & MASSON, 1988). Cependant, de fortes densités en 0+ ont aussi été observées dans les zones oligohalines, sur les fonds vaseux riches en invertébrés benthiques (MARTINHO et al., 2007). Comme le flet, la sole peut tolérer de grandes plages de salinité allant de 1 à 25 PSU (POWER et
al., 2000b).
- Oxygène : En dessous de 5 mg.L-1, et comme pour le flet, les juvéniles de sole (Cohorte 0+) ne sont plus rencontrés (MARCHAND, 1993).
4.5.4 Les diadromes
Pour les poissons migrateurs amphihalins, l'estuaire est la clef des hydrosystèmes mer-bassin versant, et de la réalisation du cycle biologique. Sa dégradation peut devenir le facteur de stérilisation principal du bassin versant pour une population de poissons migrateurs donnée (ÉLIE, 1992). En effet, chez les poissons migrateurs amphihalins, il existe des phénomènes de retour à la rivière natale chez les géniteurs produits par ce
CemOA
: archive
ouverte
d'Irstea
bassin versant (aloses, salmonidés, esturgeon) (STABELL, 1984 ; WILLIOT et al., 1997 ; TOMAS et al., 2005).
Salmonidae
En France, le saumon atlantique Salmo salar ne fréquente que les cours d’eau du littoral atlantique et de la Manche. Il ne supporte pas les mers à salure trop élevée et à température importante. Il est donc absent des tributaires de la Méditerranée.
Les Salmonidés réalisent l'essentiel de leur croissance en mer, et migrent dans les rivières pour se reproduire. Les juvéniles arrivent plus ou moins tôt dans les masses d’eau de transition selon l'espèce et leur croissance. La durée de résidence dépend de la taille du milieu, de sa productivité, de son hydrodynamisme, de la salinité et de la température qui y règnent. Les eaux de transition semblent offrir pour les juvéniles dévalants trois types d’avantages : la production de nourriture, un refuge contre les prédateurs et un environnement tampon, d’un point de vue de la préparation physiologique à la vie marine.
La dévalaison des smolts dans la zone de balancement des marées est composée de petites progressions entrecoupées de longues pauses. Ils peuvent ainsi rester plusieurs jours dans un estuaire avant d’atteindre l’embouchure (TYTLER et al., 1978).
Le rythme de montaison des géniteurs est très variable en fonction des individus comme des populations. Dans la partie sud de son aire de distribution (France, Royaume-Uni), les entrées en rivière sont observées tout au long de l’année (CROZE, 2008). Dans un estuaire, la vitesse de migration d’un saumon adulte peut atteindre 11km en 5h et plus typiquement elle serait de l’ordre de 16km en une journée (STASKO, 1975).
En milieu estuarien, le saumon adulte montre une dépendance dans ses mouvements vis-à-vis de la marée. Il peut rester au repos pendant un nombre d’heures considérable et adopte un comportement d’évitement quand il rencontre une eau de faible qualité (CURRAN & HENDERSON, 1988). Cette eau de transition est utilisée comme une zone d’attente, selon THORPE (1994). Elle joue un rôle dans la préparation des géniteurs au passage en eau douce.
- Température : En France, dans les eaux de l’Adour, l’effet inhibiteur d’une température supérieure à 20°C a déjà été constaté sur les adultes en montaison (BÉGOUT ANRAS et al., 2003). Au Royaume-Uni, les adultes migrent dans des eaux de la Tee dont les valeurs s’étendent entre 11 et 23°C (ALABASTER, 1990). Les captures de saumons qui migrent dans la Tamise entre les mois de juin à septembre sont négativement reliées avec la température de l’eau. Au-delà d’une valeur maximale de 24.2°C aucune migration n’existe (ALABASTER et al., 1991). La température létale du saumon est donnée à 25°C (POXTON & ALLOUSE, 1982).
Chez les juvéniles, le stress thermique est donné comme débutant entre 25 et 28°C, d’après ELLIOT (1991), mais cela nous semble beaucoup trop élevé pour des juvéniles.
- Turbidité : En eau douce, la vitesse d'évitement ou réaction d'alarme augmente face à des concentrations de MES allant de 60 à 180 mg.L-1 (22-42 NTU) (ROBERTSON et al., 2007). Des concentrations de plus de 10 mg.L-1 pendant plus
de 6 jours ou de plus de 50 mg.L-1 pendant une journée sont susceptibles de créer un stress chez les salmonidés adultes comme chez des juvéniles (NEWCOMBE & JENSEN, 1996). De fortes turbidités peuvent aussi retarder la migration anadrome des futurs géniteurs, sans pour autant que le homing semble affecté (WHITMAN et
al., 1982). Elles peuvent aussi causer des dommages aux branchies pouvant
conduire jusqu’à la mort (CROZE, 2008).
CemOA
: archive
ouverte
d'Irstea