Biodiversité des pollinisateurs dans les
cannebergières : effets des pratiques culturales, du type
de sol et de l’habitat naturel.
Mémoire
Amélie Gervais
Maitrise en biologie végétale
Maître ès sciences (M.Sc)
Québec, Canada
iii
Résumé
Les pollinisateurs indigènes sont importants pour la production de canneberges. Ils sont pourtant menacés par les pratiques agricoles qui s'intensifient. Pour établir un plan de conservation efficace, une meilleure connaissance des facteurs intrinsèques aux exploitations est essentielle. L’objectif principal de cette étude était de déterminer la diversité et abondance des abeilles et syrphes retrouvées en cannebergières. Quinze fermes ont été échantillonnées selon la régie de culture, le type de sol et le type d’habitat naturel retrouvé près des cannebergières. Des pièges-bols disposés en transect ainsi que l’utilisation de filet entomologique ont été utilisés pour échantillonner les pollinisateurs. Au total, 135 espèces de pollinisateurs indigènes ont été capturées en 2013 et 2014. Le type de sol ainsi que l’habitat naturel influençaient les communautés de pollinisateurs, alors que la régie de culture ne les affectait pas. L’abeille Melitta americana, spécialiste du pollen de canneberge, a été capturée plus souvent dans les tourbières.
v
Abstract
Cranberry flowers greatly benefit from insect pollination, increasing fruit production. Recently, there has been a growing interest in wild pollinators. The main objective of this study was to document the diversity and abundance of Hymenopteran and Dipteran pollinators found in cranberries grown in Quebec. A total of 15 farms were sampled. Pollinator biodiversity was compared according to crop management (organic vs. conventional), soil type (sand vs. peat) and natural habitats (meadow, forest and bog). A combination of netting and pan traps was used to sample pollinator before, during and after cranberry blooming period. A total of 135 wild pollinator species were identified in 2013 and 2014. The soil type and the natural habitat influenced the bee community, while the management type did not affect the flies nor the bees. The bee Melitta americana, a cranberry specialist, was more prevalent in bogs.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Remerciements ... xvii
Avant-Propos ... xix
Introduction générale... i
Chapitre I : État des connaissances ... 3
1.1. La canneberge ... 5
1.2. Pollinisation et diversité des pollinisateurs dans la culture de canneberge ... 10
1.2.2. Apoidea (apiformes, apoïdes) ... 11
1.2.2.1. Nids (Sites de nidification) ... 11
1.2.2.2. Relations avec les fleurs (anthophilie) ... 12
1.2.3. Diptera ... 14
1.2.4. Facteurs environnementaux et agricoles importants pour les espèces de pollinisateurs indigènes ... 15
1.2.4.1. Régie de culture ... 15
1.2.4.2. Importance du type de sol ... 16
1.2.4.3. Habitat naturel et semi-naturel... 16
1.3. Études antérieures portant sur les pollinisateurs des cannebergières ... 17
1.4. Problématique ... 18
1.5. Hypothèse générale et objectifs du projet ... 19
Chapitre II: Diversity of native pollinators in cranberry crops: Impact of farm management and soil type ... 23
Résumé ... 24
Abstract ... 25
2.1. Introduction ... 27
2.2. Methodology ... 30
2.2.1. Study area ... 30
2.2.2. Native pollinator survey ... 30
2.2.3. Statistical approach ... 32
2.3.1. Native pollinator diversity ... 33
2.3.2. Site Clustering ... 33
2.3.3. Soil type and farm management impacts ... 34
2.4. Discussion ... 35
2.4.1. Bee biodiversity ... 35
2.4.2. Hover fly biodiversity ... 36
2.4.3. Impact of farm management ... 37
2.4.4. Impact of soil type and year ... 38
2.5. Conclusion ... 39
2.6. Acknowledgements ... 39
2.7. References ... 39
Chapitre III: The contributions of natural habitat to wild bee biodiversity in cranberry agroecosystems ... 49
Résumé ... 50 Abstract ... 51 3.1. Introduction ... 53 3.2. Methodology ... 55 3.2.1. Study Area ... 55 3.2.2. Pollinator survey ... 55
3.2.3. Environmental data survey ... 56
3.2.4. Statistical analysis ... 57
3.3. Results ... 58
3.3.1. Bee diversity in the three natural habitats: meadow, bog and forest ... 58
3.3.2. Environmental factors of the natural habitat ... 58
3.3.3. Comparing field and natural habitat bee communities ... 59
3.4. Discussion ... 60
3.4.1. Bee diversity in three natural habitats: natural meadow, bog and forest ... 60
3.4.2. Environmental factors of the natural habitats ... 61
3.4.3. Comparing field and natural habitat bee communities ... 62
3.5. Conclusion ... 63
3.6. Acknowledgements ... 64
3.7. References ... 64
Chapitre IV: Cranberry pollination potential and habitat preference of Melitta americana (Hymenoptera: Melittidae) in Canada ... 73
ix Résumé ... 74 Abstract ... 75 4.1. Introduction ... 77 4.2. Methodology ... 78 4.3. Results ... 78 4.4. Discussion ... 79 4.5. Conclusion ... 80 4.6. Acknowledgements ... 80 4.7. References ... 80
Chapitre V : Conclusion générale ... 85
Bibliographie ... 93
Annexe I ... 99
xi
Liste des tableaux
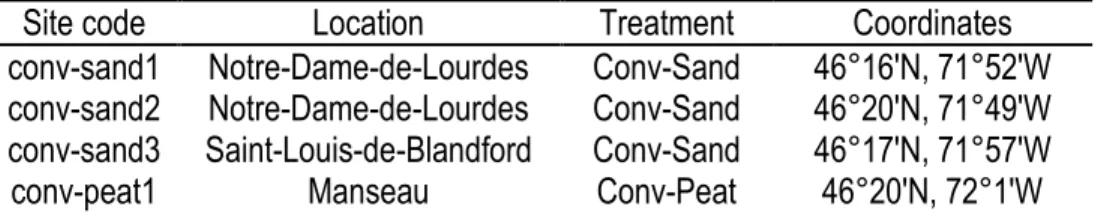
Tableau 1. Produits et techniques utilisés par les deux régies au Québec. ... 7 Tableau 2. Insectes ravageurs de la canneberge retrouvés dans l'Est Canadien ... 7 Table 3. Summary of site location, treatment and coordinates used in 2013-2014. (conv: conventional
management; org: organic management; sand: sandy soil; peat: peat soil). ... 44 Table 4. Rarified estimates of the number of species expected for samplings of 300 individuals from each habitat (±95% CI) based on Hurlbert's (1971) formulation; and Heck et al. (1975) standard errors. ... 45 Table 5. Rarified estimates of the number of species expected for samplings of 80 individuals from each habitat (±95% CI) based on Hurlbert's (1971) formulation; and Heck et al. (1975) standard errors. ... 45 Table 6. Local Contribution to Beta Diversity (LCBD) for each site for bees and syrphid flies. NS:
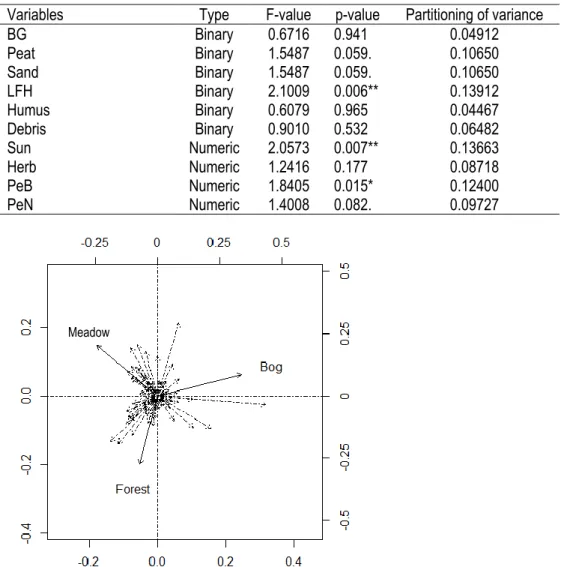
Non-significant; (.) : Tendency (P<0.1); (*): Significant (P<0.05). ... 45 Table 7. Redundancy analyses executed by R. ... 46 Table 8. Preference order for the three natural habitats among 25 most common bee species. Fa: Meadow; Fo: Forest and B: Bog (Chi-square test, order of importance). Quebec, Canada, 2013-2014. ... 68 Table 9. Partial RDA analysis of the bee community as a function of tested factors. asterisks indicate
significance **, *, . ... 69 Table 10. Number of specimens of M. americana captured in cranberry fields during flowering in 2013-14. Bees captured within the natural habitat in 2013 were not included in this table. ... 82 Table 11. Number of Melitta americana captured during the 2014 blooming period on the one farm where sampling was conducted at distances of 75 and 120 meters from a natural habitat. ... 82 Table 12. Number of Melitta captured according to the different type of habitats sampled. ... 82
xiii
Liste des figures
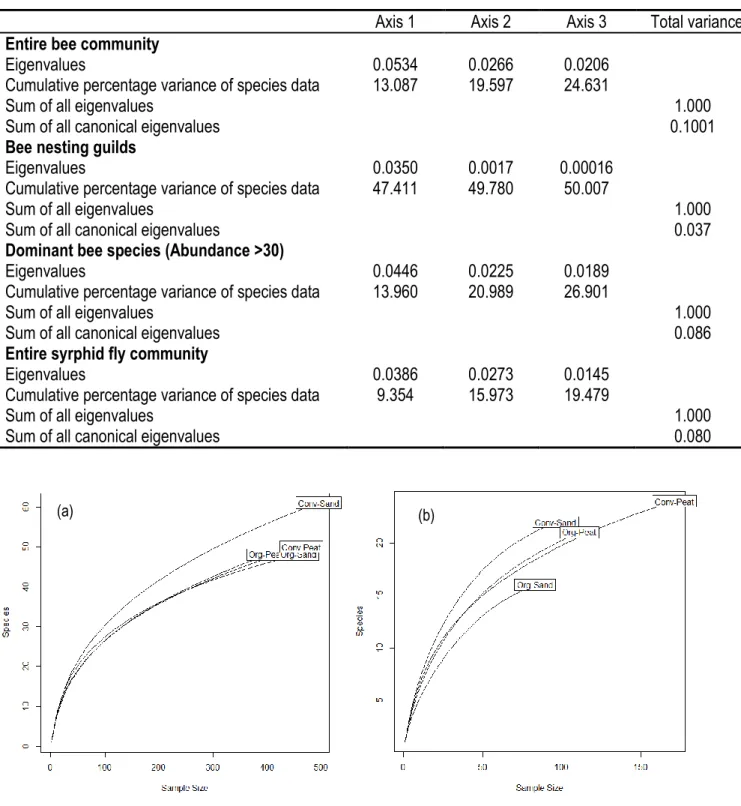
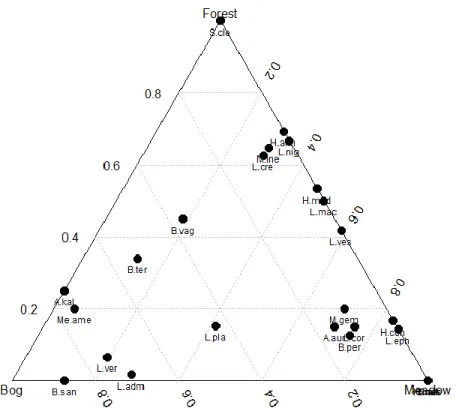
Figure 1. Stades de croissance végétative (Tiré de Workmaster et al. 1995) ... 8 Figure 2. Stades de croissance reproductive de la canneberge. ... 8 Figure 3. (a) Anatomie du fruit de la canneberge avec vue sur les alvéoles; (b) Récolte de la canneberge par inondation des champs de la ferme Cyprès, St-Louis-de-Blandford. Crédit photo : (a) This life Delicious Life; (b) Amélie Gervais... 9 Figure 4. (a) Cellule de l’abeille Augochloropsis sparsilis (Halictidae) illustrant la larve et sa réserve de pollen. (b) Diagramme de trois nids d’une abeille sociale : Halictus ligatus. Tirées de Michener (2007). ... 13 Figure 5. (a) Bee rarefaction curves for each treatment for the years 2013–2014. (b) Syrphid fly rarefaction curves for each treatment for the years 2013–2014 ... 46 Figure 6. (a) Results of cluster analysis for Bees (b) Syrphid flies; average linkage dendrograms of dissimilarity (Ward index) for the twelve sites. ... 47 Figure 7. Redundancy analysis biplots showing correlation between species and studied factors (Management and Soil) for: (a) the entire bee community (91 species); (b) bee nesting guilds; (c) the dominant 16 species within the community; (d) the entire hover fly community.. ... 48 Figure 8. Redundancy analysis biplots showing correlation between species and natural habitats for the entire bee community (106 species). Solid line vectors represent factors as defined prior to study; dashed line vectors represent species. ... 69 Figure 9. Ternary plot of the distribution frequency of 25 species in three natural habitats adjacent ot cranberry crops. ... 70 Figure 10. Redundancy analysis biplots showing correlation between species and studied factors (Sunlight intensity and Soil compaction at the field border (PeB)) for the entire bee community (106 species). ... 71 Figure 11. Mean numbers of species in common between natural habitat and cranberry fields for each type of natural habitat surrounding cranberry farms in Quebec, Canada, in 2013-2014.. ... 71 Figure 12. Differences (y= Field - Natural habitat) in number of species and total abundance for each of the fifteen cranberry sites in Quebec, in 2013-2014. ... 72 Figure 13. Map representing M. americana captures in cranberry qrowing study area, Centre-du-Quebec region. Melitta americana (Smith) captured during (a) 2005-2012 pollinators survey by André Payette (Payette, 2013), its presence was confirmed on only one site; (b) 2013-2014 pollinators survey, its presence was confirmed on 13 of the 15 sites.. ... 83 Figure 14. Box plot. Number of Melitta americana (Smith) captured according to (a) the presence or absence of woody debris, (b) the three natural habitats compared in this study. ... 83
xv
À Manon et Guy
«Pour prendre son envol, il faut découvrir ce qui nous donne des ailes» Auteur inconnu
xvii
Remerciements
Pour débuter, j’aimerais remercier ma directrice, Valérie Fournier, ainsi que mes codirecteurs, Madeleine Chagnon et Cory S. Sheffield de m’avoir permis de vivre cette expérience unique qu’est la maitrise et d’avoir su me guider à travers ce processus.
Ce projet n’aurait pas pu être aussi complet sans les aides de terrain qui m’ont aidée au courant de ces deux dernières années, je les nomme ici : Audrée Dufour, merci pour ton immense patience; Mathieu Heitzmann et Théo Constant, deux stagiaires français, qui ont su m’encourager, peu importe la montagne d’insectes à identifier; Frédéric McCune, pour ton sourire contagieux et souvent fluorescent; Manon Bellanger, pour ton excellent travail autant sur le terrain qu’en laboratoire. J’aimerais aussi remercier Ann-Catherine Laliberté, professionnelle de recherche, pour avoir monté des tonnes de lames de pollen pour moi.
J’aimerais remercier Mélissa Girard, qui a su prendre le temps et la patience pour m’enseigner l’art qu’est l’identification du pollen. J’aimerais également remercier Joseph Moisan-DeSerres et Étienne Normandin pour leur précieux support quant à l’identification des insectes. Pour une seconde fois, un gros merci à mon codirecteur Cory Sheffield de m’avoir transmis sa passion pour la taxonomie et du fait même, de m’avoir transmis une infime partie (énorme pour moi) de toutes ses connaissances. Merci également à Jeffrey Skevington d’avoir pris de son temps pour valider mes spécimens de syrphes. Un merci tout spécial à Gaétan Daigle et Pierre Legendre pour leurs précieux conseils statistiques. Un très grand merci à Brigitte Larose et Karen Grislis pour m’avoir guidée dans la traduction des articles. J’aimerais également remercier le réseau CRSNG CANPOLIN d’avoir ouvert mes horizons sur les problématiques de la pollinisation et de m’avoir permis de vivre des expériences inoubliables, de Vancouver jusqu’au Brésil.
Ce projet n’aurait pu avoir lieu sans la participation et l’appui des producteurs de canneberge de la région du Centre-du-Québec. Dans un même ordre d’idée, j’aimerais remercier Isabelle Drolet du CÉTAQ et Jean-Pierre Deland pour l’aide apportée dans la sélection des fermes et de la logistique auprès des producteurs. Un merci tout particulier à Rémi Asselin de m’avoir permis d’assister à une de ses récoltes à l’automne 2013.
Je tiens à remercier mes amis, mais tout spécialement Olivier de m’avoir soutenu, appuyer, endurer et tout ces autres synonymes pour ces deux dernières années et encore plus. Merci d’être là pour moi Oli. Un merci également à Simon, Gab et Charlou d’avoir su me sortir de mon état d’ermite certains soirs. Même si vous êtes loin, Virginie et Maryse, votre support m’a été très important, merci d’avoir été là à distance. Je tiens à remercier ma gang de volley, qui en plus de m’avoir changé les idées deux soirs par semaine, n’ont eu d’autres choix que devenir expert d’abeilles bien malgré eux.
Je ne pourrais passer la section des remerciements sans souligner la personne qui partage ma vie depuis ces cinq dernières années. Merci Louis-Philippe d’avoir été là pour moi, d’avoir su m’épauler et de m’avoir fait rire même dans les moments plus difficiles. Particulièrement, merci de m’avoir ramenée les pieds sur terre lorsque besoin était, moi qui suis souvent perdue la tête dans la brume et les pieds sur la lune, je t’aime.
Finalement, j’aimerais chaudement remercier les personnes qui contribuent directement à qui je suis, à mes passions, à mes valeurs et à mes réussites : ma famille. Isa, je suis très choyée de t’avoir comme sœur, je t’adore. Maman et Papa, merci de m’avoir poussé à me dépasser comme vous l’avez toujours fait. Merci de ne demander que le meilleur de moi-même, je suis ainsi devenue une meilleure personne grâce à vous. Ma reconnaissance pour vous est sans limite, merci.
xix
Avant-Propos
Les chapitres II, III et IV de ce mémoire sont présentés sous formes d’articles scientifiques en anglais et ont été soumis pour publication dans des revues avec révision par les pairs. L’ensemble des éléments nécessaires à la production de ce mémoire, tel que la récolte des données, l’identification des spécimens récoltés, l’analyse des résultats ainsi que la rédaction de l’ensemble des textes sont issus du candidat. Valérie Fournier (directrice), Madeleine Chagnon (co-directrice) et Cory S. Sheffield (co-directeur) ont collaboré aux manuscrits par leurs corrections et suggestions, permettant l’amélioration des textes présentés dans ce mémoire.
1
Introduction générale
Certains insectes, tels que les abeilles (Hymenoptera: Apoidae) et les syrphes (Diptera : Syrphidae), fournissent un service écosystémique essentiel au maintien de la sécurité alimentaire mondiale : la pollinisation. Ce service est très important pour les agro-écosystèmes, particulièrement pour les cultures autostériles qui nécessitent la pollinisation entomophile pour assurer la production de fruits. Les abeilles à miel, plus faciles à gérer, sont plus souvent utilisées et considérées comme pollinisateurs principaux. Cependant, elles ne sont pas efficientes pour certaines cultures qui possèdent des structures de fleurs particulières telles que la fleur de canneberge (Broussard et al., 2011; Cane & Schiffhauer, 2003). Les pollinisateurs indigènes possèdent des caractéristiques particulières, comme la capacité de sonication, qui leur permettent d’être plus efficaces pour polliniser la fleur particulière de la canneberge. Plusieurs facteurs sont reconnus pour affecter la biodiversité de ces pollinisateurs indigènes dans différents agro-systèmes : la régie de culture, la présence de ressources florales et de niches et la proportion d’habitat naturel entourant les champs.
Au Québec, depuis les vingt dernières années, le nombre de producteurs ainsi que la superficie associée à la canneberge ont été multipliés par 30, positionnant le Québec comme troisième producteur mondial de canneberge derrière le Wisconsin et le Massachusetts et premier producteur biologique au monde (APCQ, 2014). La canneberge québécoise est cultivée sur deux types de sol, tourbeux et sableux, et selon deux types de régie de culture, soit biologique et conventionnelle.
Le premier objectif de l’étude est d’inventorier la biodiversité des pollinisateurs indigènes retrouvée à l’intérieur des champs de canneberges et de déterminer si certains facteurs intrinsèques à la ferme, comme la régie de culture ou le type de sol utilisé, peuvent expliquer partiellement ou entièrement cette même biodiversité. Le deuxième objectif consiste à décrire la biodiversité des pollinisateurs indigènes retrouvée dans l’habitat naturel (prairie naturelle, forêt et tourbière), l’importance des éléments intrinsèques (sol, ensoleillement, plante retrouvées etc.) de l’habitat naturel et la similarité des communautés de pollinisateurs indigènes entre le champ et les habitats naturels. Finalement, le dernier objectif se voulait une description des habitudes de pollinisation et des facteurs qui influencent la présence et l’abondance de l’abeille spécialiste Melitta americana (Smith) retrouvée dans les champs de canneberge et dans les différents habitats naturels.
3
5
1.1. La canneberge
Au Québec, la culture de la canneberge (Vaccinium macrocarpon, Ericaceae) connait un essor fulgurant depuis les 20 dernières années. La superficie allouée à la production a été multipliée par 30 entre 1992 et 2014, passant de 125 à 3900 ha, de même que le nombre de producteurs, passant de 3 à 84. De plus, le Québec est devenu, depuis quelques années, un chef de file dans la production de canneberges biologiques, accédant au titre du plus important producteur de canneberge biologique au monde. En 2014, la province a produit au total 109 566 923 kg de canneberges, dont 12 504 779 kg étaient certifiées biologiques (APCQ, 2014).
La canneberge (Vaccinium macrocapon Aiton), une plante native des tourbières de l’est de l’Amérique du Nord, était déjà connue des Amérindiens pour ses vertus médicinales (Vander Kloet, 1988). Aujourd’hui, on reconnait ce fruit pour ses propriétés antioxydantes dues à sa grande concentration d’anthocyanine et de flavonol (Côté et al., 2010). Sa production commerciale canadienne a débuté en 1872 en Nouvelle-Écosse par un dénommé William McNeil, qui testa la culture sur une petite parcelle de terrain. Des décennies plus tard, la culture s’est étendue à tout le nord du continent. La canneberge est présentement cultivée dans plusieurs provinces canadiennes : Colombie-Britannique, Québec, Nouveau-Brunswick, Nouvelle-Écosse, Terre-Neuve, Ontario et Île-du-Prince-Édouard (Agriculture Canada, 2007). Au Québec, la principale région productrice se trouve au Centre-de-Québec, grâce à son environnement dominé par les tourbières.
La canneberge est une plante pérenne qui, à l’état naturel, peut vivre très longtemps. Au New-Jersey et à Cape Cod, certaines productions commerciales ont produit des fruits pour plus de 75 ans (Vander Kloet, 1988). Lorsqu’implantée, sa croissance est relativement lente et elle tarde à produire suffisamment de fruits pour que sa culture puisse être considérée comme rentable. Les nouvelles implantations mettent environ trois ans avant de produire une quantité exploitable de fruits. Cette plante fut cultivée originellement sur sol tourbeux, mais l’industrie de la canneberge se tourne peu à peu vers la culture sur sols sableux (Communications personnelles; Isabelle Drolet, agr. CETAQ). Ce phénomène s’explique par plusieurs facteurs qui avantagent le producteur. Le sable permet un meilleur drainage, plus efficace et uniforme, ce qui offre un rendement plus constant (Elmi et al., 2010). Il permet aussi une meilleure gestion des mauvaises herbes, puisque les herbicides anti-germinatifs fonctionnent mieux sur les sols sableux (Sandler & DeMoranville, 1999; Sandler et al.,
2004). Le contrôle de la fertilisation est beaucoup plus facile à faire, étant donné la faible teneur en éléments nutritifs du sable (Davenport et al., 1997). Du point de vue environemental, l’implantation des cannebergières sur sol sableux s’avère plus favorisée que sur sol tourbeux, puisque de nombreuses tourbières du Québec sont sous la protection du Ministère du Développement Durable, de l’Environnement et de la Lutte contre les changements climatiques (MDDELCC). Bien qu’il y ait beaucoup d’avantages à cultiver sur sol sableux, les producteurs sur sol tourbeux profitent d’un recours moindre à l’irrigation et à la fertilisation et d’une nappe phréatique plus adéquate pour la culture.
Pour ce qui est des différents types de régie de culture, les producteurs biologiques et les producteurs conventionnels diffèrent généralement dans les produits et les techniques utilisés. Les producteurs en régie biologique ont à leur disposition moins de ressources phytosanitaires pour contrôler les populations d’insectes ravageurs et surtout les plantes compétitrices (Tableau 1).
Le plant et le fruit de la canneberge sont attaqués par de nombreux ravageurs appartenant à plusieurs familles d’insectes et ce, à différents stades phénologiques du plant. Une connaissance appropriée des stades de vie des insectes ravageurs permet de bien contrôler leur population à l’aide des divers modes de répression (Tableau 1). Ces insectes ravageurs appartiennent principalement à trois ordres, les Coléoptères (4), Diptères (1) et Lépidoptères (25) (Agriculture Canada, 2007) (Tableau 2). Aussi, les cannebergières sont souvent envahies de mauvaises herbes plus tenaces les unes que les autres. On y retrouve notamment un nombre important de graminées, dont le phragmite (Phragmites australis), qui devient actuellement un véritable fléau pour les producteurs sous régie biologique. Un bon nombre de mousses, de prêles, de sphaignes et de fougères envahissent les champs, en plus du phragmite, particulièrement chez les producteurs en sol tourbeux sous régime biologique.
Quant aux maladies, le Québec est privilégié par un hiver rigoureux puisque plusieurs microorganismes phytopathogènes retrouvés dans les productions de canneberge implantées chez nos voisins américains ne survivent pas au climat québécois. Ainsi, bien que des précautions soient prises, très peu de cas de maladies ont été répertoriés au Québec. Les seules maladies sont des cas de pourritures (visqueuses, tardives, hâtives) et de tâches (annulaires, proto-venturia, rouges)
7
(Agriculture Canada, 2007). En général, les produits phytosanitaires disponibles permettent de bien gérer ces problématiques.
Tableau 1. Produits et techniques utilisés par les deux régies de culture de la canneberge au Québec.
Problématique Régie biologique Régie conventionnelle
Insectes ravageurs Pyréthrines(Trounce®)
Spinosad (Entrust®) Inondation printanière Inondation automnale Tébufénozide (Confirm®) Méthoxyfenozide (Intrepid®) Chlorantraniliprole (Altacor®) Spinosad (Success®) Spinétorame (Delegate®) Thiaméthoxame (Actara®) Diazinon (Diazinon®) Carbaryl (Sévin®)
Mauvaises herbes Vinaigre
Désherbage manuel Herbicides chimiques
Maladies Aucun problème Fongicides chimiques
Fertilisation Fumier de volailles
Potassium minéral Engrais minéral par industrie chimique ou par gisement naturel
Tableau 2. Insectes ravageurs de la canneberge retrouvés dans l'Est Canadien
Ordre Famille Nom scientifique Nom commun
Coleoptera Chrysomelidae Systena frontalis (Fabricus) Altise à tête rouge
Coleoptera Curculionidae Anthonomus musculus (Say) Charançons des atocas
Coleoptera Curculionidae Otiorhynchus ovatus ( Linnaeus) Charançons de la racine du fraisier Coleoptera Curculionidae Otiorhynchus sulcatus (Fabricus) Charançon noir de la vigne
Diptera Cecidomyiidae Dasineura oxycoccana (Johnson) Cécidomyie des atocas
Lepidoptera Geometridae Macaria sulphurea (Packard) Arpenteuse verte
Lepidoptera Geometridae Macaria brunneata (Thunberg) Arpenteuse brune
Lepidoptera Geometridae Eutrapela clemataria (J.E. Smith) Arpenteuse bituberculée
Lepidoptera Geometridae Phigalia titea ( Cramer) Arpenteuse épineuse
Lepidoptera Geometridae Lycia ursuria (Walker) Arpenteuse piquée jaune
Lepidoptera Geometridae Biston betularia (Linnaeus) Arpenteuse cornue
Lepidoptera Geometridae Macaria argillacearia (Packard) Arpenteuse noire
Lepidoptera Geometridae Nematocampa resistaria (Herrich-Schäffer) Arpenteuse à pointe
Lepidoptera Geometridae Iridopsis ephyraria (Walker) Arpenteuse à tâches
Lepidoptera Geometridae Ectropis crepuscularia (D. & S.) Arpenteuse bossue
Lepidoptera Geometridae Cingilia catenaria (Drury) Arpenteuse caténaire
Lepidoptera Geometridae Lambdina fiscellaria (Guenée) Arpenteuse de la pruche
Lepidoptera Erebidae Orgyia antiqua (Linnaeus) Chenille à houppes rousses
Lepidoptera Erebidae Lymantria dispar (Linnaeus) Spongieuse
Lepidoptera Noctuidae Xylena nupera (Lintner) Fausse legionnaire
Lepidoptera Noctuidae Epiglaea apiata (Grote) Vers-gris des fleurs d’atocas
Lepidoptera Noctuidae Orthosia hibisci (Guenée) Orthosie verte
Lepidoptera Noctuidae Acronicta impressa (Walker) Acronicte impressionnée
Lepidoptera Noctuidae Amphipyra pyramidoides (Guenée) Ver-gros bossu
Lepidoptera Noctuidae Melanchra picta (Harris) Chenille zébrée
Lepidoptera Crambidae Chrysoteuchia topiaria (Zeller) Anneleur de la canneberge
Lepidoptera Pyralidae Acrobasis vaccinii (Riley) Pyrale des atocas
Lepidoptera Tortricidae Rhopobota naevana (Hübner) Tordeuse des canneberges
Lepidoptera Tortricidae Sparganothis sulfureana (Clemens) Tordeuse soufrée
Figure 1. Stades de croissance végétative (Tiré de Workmaster et al. 1995)
Figure 2. Stades de croissance reproductive de la canneberge.
La canneberge comprend plusieurs stades phénologiques, passant du bourgeon foliaire (figure 1) aux fruits (figure 2). Bien connaitre les stades de croissance permet de cibler le moment opportun pour traiter contre les insectes ravageurs, puisque ces derniers s’attaquent souvent à un seul stade précis de la plante. De plus, le développement de la plante lui permet d’acquérir des propriétés nutraceutiques recherchées. Le fruit contient effectivement plusieurs molécules aux propriétés antioxydantes et antibactériennes (Côté et al., 2010). En plus d’être un antioxydant, l’anthocyanine donne la couleur rouge au fruit (Francis, 1995). Aussi, l’intensité de la couleur des baies à la récolte est très importante pour les producteurs, puisqu’elle indique aux acheteurs la qualité du fruit et donc, module leur prix. Finalement, la morphologie du fruit est très spéciale avec des alvéoles remplis d’air (Figure 3a), lui permettant de flotter et facilitant la récolte par inondation des champs (figure 3b).
Dormance
gonflement-début Éclatement
Élongation-début Élongation-fin
9
Figure 3. (a) Anatomie du fruit de la canneberge avec vue sur les alvéoles; (b) Récolte de la canneberge par inondation des champs de la ferme Cyprès, St-Louis-de-Blandford. Crédit photo : (a) This life Delicious Life; (b) Amélie Gervais.
La fleur de canneberge se distingue elle aussi par ses particularités. C’est une fleur de petite taille (0.6-0.8 cm) possédant 5-8 étamines compactes qui forment un tube autour de l’unique style (Delaphane & Mayer, 2000). La canneberge est une plante très peu apte à l’autopollinisation, puisque les fleurs d’un même plant ne sont pas toutes matures en même temps et les fruits produits sont souvent avortés par la plante. Toutefois, certains botanistes considèrent tout de même cette fleur comme auto-fertile (Mackenzie, 2009). Cela dit, les tétrades de pollen produites par les anthères sont lourdes et peu adaptées à s’envoler au vent, désignant ainsi les insectes comme principaux pollinisateurs (Delaphane & Mayer, 2000). Contrairement à la fleur du bleuetier, la fleur de la canneberge ne produit pas, ou très peu, de nectar. Cette caractéristique semble être contrôlée par l’héritage génétique de la plante. En effet, certaines variétés produisent légèrement plus de nectar que d’autres. Par exemple, la variété Stevens produit 25% plus de nectar que la variété Early Black, et ce, même si ces deux cultivars sont soumis aux mêmes conditions environnementales (Cane & Schiffhauer, 1997). La présence de nectar est essentielle pour inciter la visite des abeilles, et donc favorise la pollination de la fleur. Aussi, tout comme la fleur de bleuet, la fleur de la canneberge possède des anthères tubulaires et poricides, avec une ou deux ouvertures au travers desquelles les grains de pollen s’échappent. Ces anthères ont la caractéristique de ne pas laisser échapper le pollen librement, supposément pour le protéger de la pluie ou pour tout simplement restreindre l’accès aux pollinisateurs (Harder & Barclay, 1994). Pour libérer le pollen efficacement, un processus de vibration doit être effectué par l’insecte pollinisateur. Ce type de pollinisation se nomme «buzz pollinisation» en anglais, pollinisation vibratile ou sonication en français. La vibration est produite par
le mouvement des muscles dans ailes de l’insecte, induisant ainsi la sortie du pollen (De Luca & Vallejo-Marin, 2013). Ce comportement est retrouvé chez un vaste nombre d’espèces d’abeilles.
1.2. Pollinisation et diversité des pollinisateurs
dans la culture de canneberge
Les abeilles capables de faire de la sonication sont celles qui offrent une pollinisation optimale de la fleur de canneberge (Michener, 2007). Plusieurs pollinisateurs bien connus font la sonication, tels les bourdons Bombus spp., mais aussi des abeilles appartenant à des genres moins connus, tels
Andrena spp. ou Agapostemon spp. (De Luca & Vallejo-Marin, 2013; Michener, 2007). L’abeille à
miel ou abeille domestique (Apis mellifera) ne fait pas de sonication, réduisant automatiquement la qualité et l’optimalité de la pollinisation des fleurs de canneberge (King & Buchmann, 2003). L’abeille à miel est le pollinisateur le plus souvent introduit en cannebergière car les colonies sont disponibles en grand nombre. Ainsi, cette espèce assure tout de même une bonne pollinisation malgré son efficacité individuelle plus faible comparé aux bourdons (Javorek et al, 2002). La quantité optimale de colonies d’abeilles domestiques à introduire dans une cannebergière devrait être de 3 par acre, selon la moyenne retrouvée en littérature (Delaphane & Mayer, 2000). Les producteurs louent des ruches lors de la floraison pour assurer les services de pollinisation qui, bien souvent, pourraient alternativement être effectué par les pollinisateurs indigènes retrouvés naturellement autour de la cannebergière.
Les insectes qui composent la communauté de pollinisateurs de la canneberge proviennent de plusieurs ordres, les Hyménoptères, les Diptères, les Coléoptères et les Lépidoptères (Broussard et al., 2011; Mackenzie, 2009). Les pollinisateurs les plus importants se trouvent dans l’ordre des Hyménoptères, dans la superfamille des Apoidea, c’est-à-dire les apiformes. En deuxième position, plusieurs familles de diptères, telles les Syrphidea et Bombyliidae, effectuent des services de pollinisation mais de façon moins efficace que les Apoidea (Ssymank et al., 2008). Les autres groupes d’insectes (ex. papillons, coccinelles) effectuent une pollinisation qui s’avère plutôt aléatoire (Kevan & Baker, 1983).
11
L’importance de la diversité fonctionnelle des pollinisateurs a récemment été documenté dans la culture de la pomme (Martins et al., 2015) et de l’amande (Brittain et al. 2013). De plus, l’étude de Brittain et al. (2013) a démontré que la présence combinée des pollinisateurs indigènes et des abeilles domestiques améliore significativement les rendements. Une meilleure connaissance des pollinisateurs retrouvés dans les cannebergières pourra contribuer à outiller les producteurs en regard des exigences de la pollinisation de leur culture et ainsi, ultimement, aider à améliorer leurs rendements.
1.2.2. Apoidea (apiformes, apoïdes)
Au Canada, 409 espèces d’abeilles sauvages sont répertoriées et réparties dans les six familles suivantes: Andrenidae, Apidae, Colletidae, Halictidae, Megachilidae et Mellitidae. (Packer et al., 2007). Des représentants de chacune de ces six familles sont présents en cannebergières (Loose et al., 2002.; Payette, 2013a). Ces abeilles se divisent en plusieurs niches écologiques, selon le type de nidification qu’elles requièrent, leur niveau de socialité et les relations qu’elles entretiennent avec les fleurs.
1.2.2.1. Nids
Les différentes espèces d’abeilles indigènes n’utilisent pas toutes le même type de nid. La majorité des espèces vont nicher au sol. La forme des nids souterrains va varier selon le genre de l’espèce et selon son mode de socialité. En majorité, les nids contiennent tous les mêmes composantes : une entrée creusée à même le sol, des chambres à couvain et des chambres libres pour l’entreposage et/ou pour la ponte (Figure 4 b; Michener, 2007). Les femelles vont sécréter un liquide similaire à de la cire et l’apposer aux parois internes du nid pour en assurer la solidité et la perméabilité (Cane, 1991). D’autres espèces d’abeilles vont exploiter ou aménager d’autres types de cavités naturelles ou de ressources pour nicher tel que le bois, des tiges creuses, des racines et des fissures de rochers. Certaines d’entre elles, comme les mégachiles, vont utiliser des feuilles pour tapisser les parois du nid dans lequel elles enveloppent leurs œufs avec de la nourriture pour les larves, alors que d’autres vont nicher directement sous une roche, tel que les osmies. Encore, d’autres espèces, tel que les bourdons, vont tout simplement trouver une ouverture naturelle assez importante pour y abriter la colonie, comme par ex. un trou de rongeur (Packer et al., 2007). Quoi qu’il en soit, on
retrouve dans tous les nids, des cellules pour les œufs, les larves et les pupes, ainsi que des réserves de pollen et parfois de nectar (Figure 4a).
1.2.2.2. Relations avec les fleurs (anthophilie)
Les plantes sont à la base du réseau trophique des abeilles. En effet, le nectar et le pollen des plantes sont leurs sources de nourriture principales (Krenn et al., 2005). Peu d’études concernant les besoins alimentaires des abeilles indigènes ont été effectuées. La plupart des études orientées sur la diète des abeilles concernent principalement Apis mellifera, mais celle-ci peut servir de guide, jusqu’à un certain degré, pour les espèces indigènes. La plante fournit aux abeilles du nectar et des grains de pollen. Le nectar est la principale source de glucides alors que le pollen constitue un aliment habituellement riche en minéraux, acides aminés, vitamines et lipides, i.e une nourriture plus complète propre à l’élevage des larves (De Groot, 1953). Certaines abeilles, comme l’abeille à miel, vont utiliser différentes espèces de plantes pour se nourrir et subvenir à leurs besoins. Ces abeilles sont appelées généralistes ou polylectiques. À l’inverse, les abeilles qui se spécialisent sur le pollen d’un taxon de plante en particulier (que ce soit pour une espèce, un genre ou une famille), sont appelées spécialistes ou oligolectiques. Aussi, le contenu en nutriments des grains de pollen varie en fonction des plantes. Donc, pour avoir une diète saine et complète, du moins pour Apis mellifera et probablement la plupart des abeilles polylectiques, une importante diversité florale est un atout pour leur survie et leur reproduction (Schmidt et al.,1987; Pernal et Currie, 2000; Keller et al., 2005, Girard et al., 2012; Wray et al., 2014). Connaitre la spécificité d’une abeille pour son espèce florale fleur peut devenir être une connaissance important pour plusieurs domaines d’étude; mentionnons, entre autres, l’agriculture, l’étude des espèces menacées et l’écologie de la conservation. On peut déterminer la spécificité florale d’une abeille en observant la proportion de pollen, de la charge pollinique qu’elle transporte, qui appartient à une espèce ou à un genre de plantes. Selon la désignation proposée par Müller (1996), chez une espèce oligolectique, au moins 95 % du pollen provient d’espèces d’une seule famille, genre ou espèce de plante; chez une polylectique avec préférence, on retrouve de 70 à 94 % et chez une espèce polylectique stricte, 69 % ou moins. Une étude de Moisan-DeSerres (2014), effectuée dans des bleuetières québécoises, a démontré que 80% de 19 espèces indigènes utilisaient le pollen de bleuet comme source primaire de nourriture, mais que seulement deux espèces étaient considérées comme oligolectiques du bleuet. Cette
13
information est très utile aux producteurs, car ils peuvent ensuite favoriser la présence de ces espèces sur le terrain.
a)
b)
Figure 4. (a) Cellule de l’abeille Augochloropsis sparsilis (Halictidae) illustrant la larve et sa réserve de pollen. (b) Diagramme de trois nids d’une abeille sociale : Halictus ligatus. Tirées de Michener (2007).
1.2.3. Diptera
Les diptères se retrouvent en deuxième place comme groupe d’importance pour la pollinisation (Ssymank et al., 2008). Les familles suivantes de Diptères sont considérées comme étant des pollinisateurs potentiellement importants : Syrphidae, Bombyliidae et Stratiomyidae. Les deux premières familles sont des insectes très intéressants pour les producteurs, puisque leur stade larvaire fait généralement d’eux des agents de lutte biologique. En effet, chez la famille des Syrphidae, le stade larvaire et le stade adulte ne se nourrissent pas des mêmes composantes (Vockeroth & Thompson, 1987). Les larves de syrphes possèdent une vaste gamme d’habitats et de choix de nourriture différents. La plupart des larves sont prédatrices d’une diversité assez impressionnante d’insectes immatures ou non : Hemiptera- Aphidoidea; Thysanoptera, Coleoptera et Lepidoptera (Vockeroth & Thompson, 1987). Plusieurs syrphes agissent comme agents de lutte biologique importants pour le contrôle des homoptères ravageurs. D’autres se nourrissent de champignons, de plantes et d’éléments en décomposition (Vockeroth & Thompson, 1987). Les habitats choisis par les larves sont également assez variés, allant du milieu aquatique, à la matière organique retrouvée dans la litière du sol. Cependant, au stade adulte, la très grande majorité des espèces se nourrissent du pollen et du nectar des plantes (Vockeroth & Thompson, 1987). Leur importance économique en tant que pollinisateurs n’est pas très connue, mais elle n’est probablement pas à sous-estimer. Leur mimétisme représentant souvent les différents membres de l’ordre des Hyménoptères a supposément évolué pour les protéger de leur mode d’alimentation extrêmement exposé (Vockeroth & Thompson, 1987). Également, plusieurs recherches démontrent que les syrphes continuent d’être actifs et visitent des fleurs même sous des conditions météorologiques adverses et dans des habitats considérés comme hostiles (Ssymank et al., 2008).
Du côté des Bombyliidae, très peu est connu de leur biologie. Jusqu’à présent, toutes les larves connues des espèces de bombyles s’avèrent être prédatrices sur les œufs des sauterelles (Acrididae) ou parasitoïdes des pupes et/ou larves de plusieurs espèces bénéfiques ou ravageuses : Lepidoptera, Hymenoptera, Coleoptera, Diptera et Neuroptera. Les adultes se nourrissent généralement du pollen et du nectar des fleurs (Hall, 1987).
15
Grâce à leur environnement entouré généralement de cours d’eau et de fossés, les cannebergières fournissent un habitat très adéquat pour la dernière famille de diptères importante pour la pollinisation : les Stratiomyidae. La larve de cette famille est généralement aquatique et se nourrit d’autres larves d’insectes, de plantes aquatiques ou de déchets (James, 1987). Les adultes se nourrissent également de pollen et de nectar, bien que leur importance en tant que pollinisateurs soit tout-à-fait inconnue (James, 1987). Leur capacité à transporter du pollen viable a été évaluée, mais aucune preuve n’a été obtenue quant à leur aptitude polliniser (Rader et al., 2011). Malgré leur abondance et leur grande valeur écologique, cette famille est très mal décrite au niveau biologique et taxonomique, ce qui en fait un groupe difficile à étudier.
Dans le cadre d’études sur la pollinisation des cultures, ces trois familles de diptères sont souvent oubliées. Pourtant, elles peuvent fournir un service de pollinisation gratuit et devraient être prises en compte lors d’un recensement de l’entomofaune pollinisatrice des fleurs d’une culture.
1.2.4. Facteurs environnementaux et agricoles importants pour
les espèces de pollinisateurs indigènes
La diversité spécifique des pollinisateurs indigènes présents à l’intérieur des bassins d’exploitation des cannebergières varie selon plusieurs facteurs environnementaux et agricoles. Des études concernant d’autres cultures ont fait ressortir plusieurs facteurs qui semblent généralement affecter les communautés de pollinisateurs indigènes (Gabriel et al., 2013; Klein et al., 2012; Sardiñas & kremen, 2014; Wray et al., 2014). Au Québec, l’importance de ces facteurs environnementaux n’a pas été déterminée pour les paysages agricoles des cannebergières.
1.2.4.1. Régie de culture
Tout d’abord, un nombre important d’études dans plusieurs types de culture a démontré que la biodiversité des pollinisateurs indigènes, particulièrement des abeilles, est généralement influencée par la régie de culture : régie biologique versus régie conventionnelle. Les produits phytosanitaires utilisés en régie conventionnelle et des pratiques agricoles souvent plus intensives influenceraient négativement la biodiversité des pollinisateurs retrouvée dans les cultures de canola (Morandin & Winston, 2005), de blé (Clough et al., 2007; Gabriel et al., 2013) des jachères (Holzschuh et al., 2008) et des prairies (Power et al., 2012).
1.2.4.2. Importance du type de sol
Le type de sol est un facteur important qui fut soulevé par Cane (1991) dans le cadre de son étude sur l’impact de la texture du sol sur la présence/abondance des espèces d’abeilles nicheuses de sol. Ce dernier a démontré que les abeilles préféraient les sols sableux aux sols argileux. Ce facteur peut avoir un réel impact sur la biodiversité des espèces retrouvées puisqu’une grande majorité des espèces d’abeilles nichent au sol. Des études plus récentes ont également comparé l’impact de plusieurs attributs du sol tels que la compaction, la pente, et la présence de sol nu, sur la diversité des abeilles. Une étude de Potts et al. (2005) a démontré que la présence de sol nu, la présence de cavités et la pente affectaient l’entière communauté d’abeilles, alors que les nicheurs de cavités étaient positivement corrélés avec l’abondance de cavités, les nicheurs de sol étaient corrélés positivement avec la présence de sol nu et négativement avec la compaction du sol. Sardinas & Kremen (2014), ont effectué une étude exclusivement sur les nicheurs de sol et conclurent également, par l’examen de leurs captures, que la pente, la compaction du sol, la présence de nids préexistants et la présence de sol nu étaient corrélés avec la diversité des nicheurs de cavités. Aucune étude n’a encore examiné si les sols tourbeux, tels que ceux retrouvés dans les cannebergières, avaient un impact sur les pollinisateurs nicheurs de sol.
1.2.4.3. Habitat naturel et semi-naturel
Plusieurs recherches scientifiques ont démontré que la superficie relative d’habitat naturel et semi-naturel (bandes riveraines, haies brise-vent) à proximité des champs influençait grandement l’abondance et la diversité des pollinisateurs. L’habitat naturel fournit aux pollinisateurs différents éléments qui influencent leur nidification, tel qu’un type de sol particulier (recouvrement, densité, texture), la présence de débris ligneux, la présence de cavités préexistantes et la présence d’ensoleillement. Ces éléments du paysage sont utilisés par les pollinisateurs pour nicher et s’alimenter, d’où l’importance de la présence d’un habitat naturel à proximité. Une méta-analyse incluant 29 différentes études de 21 cultures dans quinze différents pays a démontré que la diversité des pollinisateurs capturés au champ diminuait selon son isolation de l’habitat naturel (Garibaldi et al., 2013). Une autre étude de Kremen et al. (2004) a déterminé que la présence de plus de 30% d’habitat naturel ou semi-naturel dans un rayon de 2.5 km d’un champ augmentait significativement la diversité des pollinisateurs indigènes retrouvée dans ces cultures. Des résultats similaires ont été obtenus par Kremen et al., (2007); Ricketts et al., (2008); LeFéon et al., (2010); Morandin et al.,
17
(2011); Moisan-DeSerres et al., (2014); Wray et al., (2014). Lors de ces travaux, l’habitat naturel était un facteur déterminant pour expliquer l’abondance et la diversité des pollinisateurs présents au champ.
1.3. Études antérieures portant sur les
pollinisateurs des cannebergières
La biodiversité des abeilles indigènes a déjà été étudiée dans les cannebergières du Maine et du Massachusetts, É.-U. (Loose et al., 2005). Cette étude a identifié 82 espèces d’abeilles associées aux cannebergières et 160 plantes potentiellement bénéfiques pour ces abeilles, en plus de mettre l’emphase sur l’importance d’avoir des ressources floristiques avant, pendant (pour le nectar) et après la floraison de la culture. Cependant, les diptères n’ont pas été échantilonnés durant cette étude. De plus, aucune démarche explicative n’est présentée concernant la répartition des espèces dans les différents sites à l’étude. L’étude de Loose et al. fait cependant un bon inventaire des espèces retrouvées, en plus d’offrir une liste des plantes utiles pour ces espèces. Finalement, cette étude suggère une liste de moyens à prendre pour conserver les abeilles dans l’habitat immédiat de la cannebergière, comme offrir des endroits ensoleillées pour permettre aux pollinisateurs de butiner, encourager la diversité florale près des champs, cesser de tondre le gazon en bordure des bassins et faire un usage intelligent des pesticides et herbicides.
Au Québec, quelques études ont également été effectuées sur les pollinisateurs en cannebergières. Une étude de Barette (2001) fournit une liste des 32 espèces d’abeilles et de syrphes retrouvées sur les fleurs de canneberges. De plus, l’introduction d’une espèce aménagée, Megachile rotundata, utilisée généralement dans les bleuetières, a été effectuée dans les cannebergière du Centre du Québec en 2004. L’étude confirme que la présence de cette espèce sur la culture peut augmenter la production des fruits (Chagnon, 2004). D’autres études ont aussi étudié l’efficacité d’Apis mellifera,
Bombus impatiens et Megachile rotundata, démontrant l’importance de la pollinisation entomophile
pour la production de fruits dans la culture de la canneberge (Chagnon et al., 2007; Girard, 2009). Plus récemment, Payette (2013a) a recensé plusieurs espèces (41 sp.) d’abeilles dans des cannebergières du centre du Québec et a fait état d’une nouvelle mention canadienne, Melitta
americana (Smith). Suite à une étude pollinique du contenu présent dans les cellules de leurs nids,
Payette (2013b) a trouvé que 100% des grains de pollen récoltés par M. americana provenaient de la canneberge. Selon Müller (1996), une espèce qui transporte plus de 70% de grains de pollen d’une espèce, d’un genre ou d’une famille est considérée comme olygolecte pour ce taxon. Le genre
Melitta est connu comme étant une abeille oligolectique des Ericaceae, une famille de plantes
souvent retrouvée dans les tourbières (Cane et al., 1985). Puisqu’il s’agit d’une première mention au Canada, très peu de connaissances sont accessibles à nos latitudes sur la présence de cette espèce possiblement intéressante pour la pollinisation de la canneberge. De plus, outre les études de Payette (2013ab) et Barette (2001), aucun autre travail n’a évalué, au niveau taxonomique, les pollinisateurs indigènes retrouvés dans les cannebergières du Québec. De surcroît, ces dernières études n’ont utilisé que le filet entomologique comme méthode de capture. Cette méthode permet de capturer une bonne richesse de pollinisateurs, mais peut cependant créer un biais, puisque les espèces de plus grande taille sont habituellement plus visibles et donc, plus souvent capturées (Grundel et al., 2011). L’usage combiné de filet entomologique et de pièges-bols permet habituellement de d’obternir un inventaire plus exhaustif de la communauté présente, puisque les petites abeilles sont également capturées par les pièges-bol (Grundel et al., 2011). Une étude utilisant donc ces deux méthodes complémentaires permettrait d’avoir un réel portrait exhaustif de la communauté des pollinisateurs retrouvée dans les cannebergières au Québec.
1.4. Problématique
La production de canneberge a pris une part croissante du marché agricole au sein de l’économie québécoise. Les services de pollinisation dans cette culture sont habituellement fournis par les abeilles à miel, alors que ces dernières ne procurent pas une pollinisation optimale de cette culture car elles sont mal adaptées à la morphologie des fleurs. Dans un contexte de production où la canneberge nécessite une pollinisation entomophile, une meilleure connaissance des pollinisateurs indigènes présents dans les bassins de production devient impérieuse. Favoriser la présence des pollinisateurs indigènes dans une production de canneberge pourrait assurer aux producteurs un meilleur rendement et possiblement une diminution des coûts en location de ruches, puisque les pollinisateurs indigènes offrent un service de pollinisation complémentaire à celui des abeilles à miel. Les différentes régies utilisées par les producteurs pourraient influencer les communautés naturelles
19
de pollinisateurs et faire grandement varier l’abondance et la diversité des insectes pollinisateurs retrouvés. Une meilleure connaissance de l’impact des types de sols, de la régie de la culture et des habitats naturels adjacents aux bassins de production pourrait permettre aux producteurs de prendre des décisions plus éclairées face à la protection des pollinisateurs indigènes présents sur leur ferme. Une meilleure connaissance des éléments du paysage qui favorisent la présence des pollinisateurs indigènes dans les pourtours des cannebergières pourrait encourager les producteurs à favoriser et protéger la présence ces éléments à proximité de leur ferme.
Il serait également intéressant de décrire les habitudes aux champs d’une espèce potentiellement importante au point de vue de la pollinisation des canneberges : Melitta americana. Sa répartition au sein des sites, les éléments qui sont corrélées avec son abondance et ses habitudes de pollinisation seraient des informations très intéressantes à obtenir pour les producteurs. Ces connaissances permettraient de cibler les aménagements prioritaires pour augmenter la présence de cette espèce dans les champs de canneberge.
1.5. Hypothèse générale et objectifs du projet
L’objectif principal de ce projet est de décrire la biodiversité des pollinisateurs indigènes dans les cannebergières et de déterminer comment les facteurs comme la régie de culture, le type de sol, le type d’habitat naturel et différents éléments du paysage influencent l’abondance et la diversité dans les communautés de pollinisateurs indigènes retrouvées dans les bassins de production.
Il s’agit de la première étude exhaustive effectuée au Québec sur 1) la biodiversité des pollinisateurs indigènes des cannebergières, 2) l’évaluation de l’impact de la régie de culture et du type de sol sur les communautés de pollinisateurs, 3) l’évaluation de l’impact de l’habitat naturel et des éléments du paysage adjacent au champ sur les communautés de pollinisateurs et 4) la préférence d’habitat de l’espèce Melitta americana.
Le premier volet vise donc tout d’abord à décrire la diversité et l’abondance des espèces retrouvées dans la région principale productrice de canneberge, le Centre-du-Québec. Il vise également à déterminer comment les différences agroenvironnementales entre les fermes (sol et régie) influent sur l’assemblage des communautés, les abondances et la diversité des espèces de pollinisateurs
indigènes retrouvées. Pour résoudre la question, douze fermes ont été échantillonnées lors de la floraison de la canneberge en 2013 et 2014. Les insectes ont été capturés à l’aide du filet entomologique et de pièges-bols et ont ensuite été épinglés puis identifiés à l’espèce.
Les hypothèses du premier volet sont :
Hypothèse 1: la régie biologique soutiendra une communauté de pollinisateurs plus abondante et diversifiée en comparaison à la régie conventionnelle.
Hypothèse 2: le sol sableux favorisera une communauté de pollinisateurs plus abondante et diversifiée comparativement au sol tourbeux.
En conséquence :
Hypothèse 3: les fermes en régie biologique sur sol sableux auront la biodiversité (abondance et richesse spécifique) de pollinisateurs la plus élevée.
Hypothèse 4: les fermes en régie conventionnelle sur sol tourbeux auront la biodiversité (abondance et richesse) la plus faible.
Le second volet de l’étude vise à déterminer, parmi les différents types d’habitat naturel retrouvé près des cannebergières, lequel est le plus corrélé à la présence des pollinisateurs dans les champs adjacents. Ce volet vise également à décrire quels éléments du paysage expliquent la présence des espèces de pollinisateurs dans l’habitat naturel.
Le but de ce deuxième volet est d’améliorer les connaissances générales quant à l’impact de l’habitat naturel sur les insectes pollinisateurs retrouvés au champ. Puisque la culture est en constante croissance depuis 20 ans, une ligne directrice sur les habitats naturels à conserver en plus des éléments de celui-ci utilisés par les pollinisateurs naturels pourrait être cruciale pour maintenir le service de pollinisation fourni par les espèces indigènes. Les habitats naturels sélectionnés ont été échantillonnés lors de la floraison de la canneberge. Les abeilles et les syrphes capturés ont été identifiés à l’espèce. Au même moment, des données sur le sol (compaction, présence de sol nu), l’ensoleillement et la hauteur des espèces végétales de chacun des habitats naturels ont été compilées puis analysées.
21
Hypothèse 5: La compaction du sol, l’ensoleillement et la quantité de sol nu sont les éléments du paysage qui déterminent la présence ou l’absence des espèces pollinisatrices dans l’habitat naturel.
Hypothèse 6: La tourbière, par sa grande concentration d’espèces éricacées, possèdera la communauté de pollinisateurs indigènes la plus similaire à celle retrouvée au champ. En conséquence :
Hypothèse 7: La tourbière, possédant une communauté de pollinisateurs indigènes semblable à celle retrouvée aux champs, se démarquera par une diversité et une abondance de pollinisateurs indigènes plus importantes que dans les deux autres types d’habitat naturel.
Le troisième volet de l’étude a comme objectif de décrire les préférences d’habitat de l’abeille Melitta
americana. Il s’agit d’une abeille potentiellement spécialiste de la canneberge (Payette, 2013b) et
des connaissances sur son histoire naturelle pourraient permettre de mieux la protéger et d’améliorer sa condition dans les cannebergières où elle est présente.
Ce dernier volet a pour but de mieux connaître cette récente mention. En plus des dispositifs utilisés pour les deux volets précédents, d’autres pièges bols ont été installés à différentes distances pour permettre un échantillonnage plus étendu.
Les hypothèses du troisième volet sont:
Hypothèse 8: M. americana se retrouve principalement dans les fermes sur sol tourbeux. Hypothèse 9: M. americana se retrouve principalement dans l’habitat naturel des tourbières. Hypothèse 10: Melitta americana se retrouve en plus grande quantité dans les bols blancs (couleur la plus près des fleurs de canneberge) comparés aux autres bols (bleus et jaunes). Hypothèse 11: M. americana se retrouve à une distance de la bordure suffisante (≈160 mètres) pour lui permettre de polliniser un champ complet.
Hypothèse 12: M. americana transporte majoritairement (≥70%) des grains de pollen de canneberge.
23
Chapitre II: Diversity of native pollinators in
cranberry crops: Impact of farm management and
soil type
Gervais, A., Chagnon, M., Sheffield, C. S., Fournier, V., submitted on March, 26 2015 to the journal Agriculture, Ecosystems & Environment.
Résumé
Les insectes assurent la pollinisation croisée et la production de fruit de la canneberge. Récemment, l’efficacité et la gratuité du service de pollinisation offert par les pollinisateurs indigènes suscitent l’intérêt des acteurs du milieu agricole. L’objectif principal de ce projet était de déterminer l’impact du type de sol (sableux ou tourbeux) et des régies de culture (conventionnelle ou biologique) sur la diversité et l’abondance des abeilles et syrphes retrouvés dans les canneberges du Québec, Canada. Un total de 12 fermes a été échantillonné en 2013 et 2014 dans la région du Centre-du-Québec. La diversité des pollinisateurs a été comparée en fonction du type de régie et du type de sol. Une combinaison d’échantillonnage par filet entomologique et par pièges-bols a été utilisée pour capturer les pollinisateurs indigènes pendant la floraison. Un total de 1814 abeilles réparties en 90 espèces et 461 syrphes, répartis en 33 espèces a été capturé. Des analyses de redondance canonique ont démontré que le type de régie n’affectait pas les communautés d’abeilles et de syrphes, alors que le type de sol avait un impact important sur les communautés d’abeilles seulement. Les espèces d’abeilles dominantes étaient: Bombus bimaculatus Cresson, Bombus
ternarius Say, Bombus vagans Smith, Halictus rubicondus (Christ), Lasioglossum leucozonium
(Schrank), Lasioglossum oblongum (Lovell), Lasioglossum pilosum (Smith), Lasioglossum versatum (Robertson), et Lasioglossum zonulum (Smith). Les espèces de syrphes dominants étaient : Syrphus
torvus Osten Sacken, Toxomerus geminatus (Say), Toxomerus marginatus (Say) and Xylota quadrimaculatus Loew. Il s’agit de l’étude la plus exhaustive effectuée à ce jour sur les pollinisateurs
25
Abstract
Insects are essential for ensuring cross-pollination and fruit production in self-sterile cranberry flowers. Recently, there has been increasing interest in wild pollinators due to their high efficacy and free pollination services. The main objective of our study was to determine the impact of soil type (peat, sand) and management practices (conventional, organic) on the diversity and abundance of bees and hover flies found on cranberry farms in Quebec, Canada. Twelve cranberry farms were sampled in 2013 and 2014. Pollinator diversity was compared according to crop management strategy and soil type. A combination of netting from flowers and pan-trap sampling were used to collect pollinators during the cranberry blooming period. A total of 1814 bees from 90 species, and 461 hover flies from 33 species were collected. Redundancy analyses show that management type affected neither bees nor hover flies, while soil type had an impact on pollinator community structure for bees only. Other dominant bee species found were: Bombus bimaculatus Cresson, Bombus
ternarius Say, Bombus vagans Smith, Halictus rubicondus (Christ), Lasioglossum leucozonium
(Schrank), Lasioglossum oblongum (Lovell), Lasioglossum pilosum (Smith), Lasioglossum versatum (Robertson), and Lasioglossum zonulum (Smith). Dominant hover flies species were: Syrphus torvus Osten Sacken, Toxomerus geminatus (Say), Toxomerus marginatus (Say) and Xylota
quadrimaculatus Loew. Our results represent the most exhaustive study conducted to date on
27
2.1. Introduction
Ecosystem services are recognized to be of global capital importance, particularly in the context of agro-ecosystems (Fish et al., 2014). In the United States, for instance, pest control and pollination by insects represent ca $60 billion per year of ecosystem services provided to fulfill human needs (Losey & Vaughan, 2006). Moreover, pollination services by insects alone result in 35% of our global food supply (Klein et al., 2007) and have a strong effect on crop yields even under conditions of reduced water and nutrient supplies (Klein et al., 2015). Additionally, recent studies have shown that functional diversity of pollinators (i.e diversity of pollinators’ traits and behaviors that are affecting ecosystems functionality) increases yield in numerous crops (Hoehn et al., 2008; Martin et al., 2015; Rogers et al. 2014). For instance, native pollinators display a wide range of lifestyles; some species of hoverflies (Diptera: Syrphidae) function as predators (i.e., biological control agents) when immature, and as pollinators as adults (Vockeroth & Thompson, 1987), while bees (Hymenoptera: Apoidea) vary greatly with respect to nesting preferences (e.g., soil, cavity, stem and wood nesters), pollen foragers or kleptoparasites, and with respect to sociality (Michener, 2000). As such, individual groups of pollinators will have different needs from the surrounding ecosystems, and unfortunately such functional diversity is endangered in some crop systems since both native and managed pollinators are experiencing global declines due to numerous factors including loss of natural habitat, increasing pesticide use, high proportion of monocultures in the landscape, introduction of alien species and climate change (Potts et al., 2010; Rader et al., 2014; Smith et al., 2014). In the light of these trends, it is important to understand which factors affect pollinator conservation in an agricultural context.
While many studies have compared the impact of organic vs. conventional farming on bee communities (rapeseed: Morandin & Winston, 2005; wheat: Gabriel et al., 2013; Clough et al., 2007; fallow: Holzschuh, Steffan-Dewenter & Tscharntke, 2008; grassland: Power, Kelly & Stout, 2012), to our knowledge, the impact of farm management on hover fly diversity and abundance has not been researched. Organic farming is generally correlated with a higher diversity and abundance of bees. In winter wheat, Holzschuh et al. (2008) found that an increase of 5-20% of organic fields in the landscape increased overall bee diversity by 50%. Gabriel et al. (2013) concluded that pollinator diversity is positively associated with organic management in the UK, where abundance and diversity of bumblebees were higher in organic winter cereals, at 20% and 7%, respectively, compared to
conventional ones. Comparable findings exist for solitary bees, with an increase of 26% and 18% in abundance and diversity, respectively, on organic farms (Gabriel et al., 2013). In canola crops, Morandin & Winston (2005) found that bee abundance was 48% higher in organic compared to conventional fields. More recently, Scheinder et al. (2014) found that bee diversity in organic farms increased by 12.5% over conventional farms at the field level, but no significant difference was found at the entire farm level. They (Scheinder et al. 2014) hypothesized that the higher species richness in organic production fields was mostly due to common species, which contribute relatively little to total farm species richness because they are frequently found in other habitats of each farm.
Soil composition can also be an important factor explaining pollinator diversity and bee community structure, as 70% of bees are soil nesters (Michener, 2000). Cane (1991) compared texture and composition (i.e., silt, sand and clay) of different soil types and found that most bees preferred to nest in sandy soil, as they were found in soil mixtures containing between 33% and 94% sand. Bee taxa found in soils containing 33% sand or greater were represented by many families and genera: Andrenidae (Andrena sp. and Perdita sp.), Apidae (Habropoda sp.), Colletidae (Colletes sp.), Halictidae (Halictus sp.) and Melittidae (Hesperapis sp.). Potts et al. (2005) also identified the important role of soil in explaining ground nesting bee diversity, including among numerous variables, area of bare ground and low soil compaction. Sardiñas & Kremen (2014) also found that bee abundance decreases with the increase of moderate slopes, soil compaction and of pre-existing holes, while it marginally increases with the increase of bare soil.
Cranberry (Vaccinium macrocarpon Laiton, Ericaceae) is native to the eastern North America and is cultivated in the United States (WI, MN, MA, NJ, WA, OR), in Canada (BC, QC, NL, NS, NB) and in Chile. In 2013, the area dedicated to cranberry crops grown in Canada and the United States was over 6084 ha and 16996 ha, respectively (Agriculture and Agri-Food Canada, 2015; Cranberry Marketing Committee, 2015). In the same year, the province of Quebec became the world’s largest producer of organically grown cranberries, with 516.65 ha cultivated by 20 farm owners. Although cranberry plants naturally grow in peat soils, and many managed bogs in Quebec are developed in these habitats, they can also be cultivated on sandy soils, which tend to offer more advantages for production. For instance, the lack of nutrients and water in farms with sandy soils facilitate precise calculations of fertilizer and water requirements for maximum production, which improves yields.