UNIVERSITÉ de CAEN NORMANDIE ---
FACULTÉ de MÉDECINE
Année 2017/2018
THÈSE POUR L’OBTENTION
DU GRADE DE DOCTEUR EN MÉDECINE
Présentée et soutenue publiquement le :23 Mars 2018
par
Mademoiselle Planque Hélène Née le 25 Mai 1988 à Saint-Omer (62)
:
Etude des facteurs prédictifs de l’absence d’envahissement métastatique axillaire après chimiothérapie néo adjuvante dans le
cancer du sein localisé et construction d’un nomogramme.
Président : Madame le Professeur FAUVET Raffaèle Membres : Monsieur le Professeur CLASSE Jean-Marc
Monsieur le Professeur BENOIST Guillaume Madame le Docteur LOAEC Cécile
U N I V E R S I T É D E C A E N · N O R M A N D I E
U F R S A N T É
Année Universitaire 2017 / 2018
Doyen
Professeur Emmanuel TOUZÉ
Assesseurs
Professeur Paul Milliez (pédagogie)
Professeur Guy LAUNOY (recherche)
Professeur Sonia Dollfus & Professeur Evelyne Emery (3ème cycle)
Responsable administrative
Madame Sarah CHEMTOB
PROFESSEURS DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. AOUBA Achille Médecine interne
M. AGOSTINI Denis Biophysique et médecine nucléaire
M. AIDE Nicolas Biophysique et médecine
nucléaire
M. ALLOUCHE Stéphane Biochimie et biologie moléculaire
M. ALVES Arnaud Chirurgie digestive
M. BABIN Emmanuel Oto-Rhino-Laryngologie M. BÉNATEAU Hervé Chirurgie maxillo-faciale et stomatologie
M. BENOIST Guillaume Gynécologie - Obstétrique M. BERGER Ludovic Chirurgie vasculaire
M. BERGOT Emmanuel Pneumologie
M. BIBEAU Frédéric Anatomie et cytologie pathologique Mme BRAZO Perrine Psychiatrie d’adultes
M. BUSTANY Pierre Pharmacologie
Mme CHAPON Françoise Histologie, Embryologie Mme CLIN-GODARD Bénédicte Médecine et santé au travail
M. COQUEREL Antoine Pharmacologie
M. DAO Manh Thông Hépatologie-Gastro-Entérologie M. DAMAJ Ghandi Laurent Hématologie
M. DEFER Gilles Neurologie
M. DELAMILLIEURE Pascal Psychiatrie d’adultes
M. DENISE Pierre Physiologie
M. DERLON Jean-Michel Éméritat jusqu’au 31/08/2018 Neurochirurgie Mme DOLLFUS Sonia Psychiatrie d'adultes M. DREYFUS Michel Gynécologie - Obstétrique M. DU CHEYRON Damien Réanimation médicale M. DUHAMEL Jean-François Éméritat jusqu’au 31/08/2018 Pédiatrie
Mme ÉMERY Evelyne Neurochirurgie
M. ESMAIL-BEYGUI Farzin Cardiologie
Mme FAUVET Raffaèle Gynécologie – Obstétrique M. FISCHER Marc-Olivier Anesthésiologie et réanimation M. GÉRARD Jean-Louis Anesthésiologie et réanimation
M. GUILLOIS Bernard Pédiatrie
Mme GUITTET-BAUD Lydia Epidémiologie, économie de la santé et prévention
M. HABRAND Jean-Louis Cancérologie option Radiothérapie
M. HAMON Martial Cardiologie
Mme HAMON Michèle Radiologie et imagerie médicale M. HANOUZ Jean-Luc Anesthésiologie et réanimation M. HÉRON Jean-François Éméritat jusqu’au 31/08/2018 Cancérologie
M. HULET Christophe Chirurgie orthopédique et traumatologique
M. HURAULT de LIGNY Bruno Éméritat jusqu’au 31/01/2020 Néphrologie
M. ICARD Philippe Chirurgie thoracique et cardio-vasculaire
Mme JOLY-LOBBEDEZ Florence Cancérologie
Mme KOTTLER Marie-Laure Biochimie et biologie moléculaire M. LAUNOY Guy Epidémiologie, économie de la santé et prévention
M. LE COUTOUR Xavier Epidémiologie, économie de la santé et prévention
Mme LE MAUFF Brigitte Immunologie
M. LEPORRIER Michel Éméritat jusqu’au 31/08/2020 Hématologie
M. LEROY François Rééducation fonctionnelle
M. LOBBEDEZ Thierry Néphrologie
M. MANRIQUE Alain Biophysique et médecine nucléaire
M. MARCÉLLI Christian Rhumatologie
M. MARTINAUD Olivier Neurologie
M. MAUREL Jean Chirurgie générale
M. MILLIEZ Paul Cardiologie
M. MOREAU Sylvain
Anatomie/Oto-Rhino-Laryngologie
M. MOUTEL Grégoire Médecine légale et droit de la santé
M. NORMAND Hervé Physiologie
M. PARIENTI Jean-Jacques Biostatistiques, info. médicale et tech. de communication
M. PELAGE Jean-Pierre Radiologie et imagerie médicale Mme PIQUET Marie-Astrid Nutrition
M. RAVASSE Philippe Chirurgie infantile
M. REZNIK Yves Endocrinologie
M. ROUPIE Eric Thérapeutique
Mme THARIAT Juliette Radiothérapie
M. TILLOU Xavier Urologie
M. TOUZÉ Emmanuel Neurologie
M. TROUSSARD Xavier Hématologie
Mme VABRET Astrid Bactériologie - Virologie M. VERDON Renaud Maladies infectieuses
Mme VERNEUIL Laurence Dermatologie
M. VIADER Fausto Neurologie
M. VIVIEN Denis Biologie cellulaire Mme ZALCMAN Emmanuèle Anatomie et cytologie pathologique
PROFESSEUR DES UNIVERSITÉS
M. LUET Jacques Éméritat jusqu’au 31/08/2018 Médecine générale PROFESSEUR ASSOCIÉ DES UNIVERSITÉS A TEMPS PLEIN
M. VABRET François Addictologie
PROFESSEURS ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
M. de la SAYETTE Vincent Neurologie Mme DOMPMARTIN-BLANCHÈRE Anne Dermatologie
Mme LESCURE Pascale Gériatrie et biologie du vieillissement
M. SABATIER Rémi Cardiologie
PRCE
U N I V E R S I T É D E C A E N · N O R M A N D I E
U F R S A N T É
Année Universitaire 2017 / 2018
Doyen
Professeur Emmanuel TOUZÉ
Assesseurs
Professeur Paul Milliez (pédagogie)
Professeur Guy LAUNOY (recherche)
Professeur Sonia Dollfus & Professeur Evelyne Emery (3ème cycle)
Responsable administrative
Madame Sarah CHEMTOB
MAITRES DE CONFERENCES DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. ALEXANDRE Joachim Pharmacologie clinique Mme BENHAÏM Annie Biologie cellulaire
M. BESNARD Stéphane Physiologie
Mme BONHOMME Julie Parasitologie et mycologie
M. BOUVIER Nicolas Néphrologie
M. COULBAULT Laurent Biochimie et Biologie moléculaire M. CREVEUIL Christian Biostatistiques, info. médicale et tech. de communication
Mme DEBRUYNE Danièle Éméritat jusqu’au 31/08/2019 Pharmacologie fondamentale Mme DERLON-BOREL Annie Éméritat jusqu’au 31/08/2020 Hématologie
Mme DINA Julia Bactériologie - Virologie
Mme DUPONT Claire Pédiatrie
M. ÉTARD Olivier Physiologie
M. GABEREL Thomas Neurochirurgie
M. GRUCHY Nicolas Génétique
M. HITIER Martin Anatomie - ORL Chirurgie Cervico-faciale
M. LANDEMORE Gérard sera en retraite à partir du 01/01/18 Histologie, embryologie, cytogénétique
M. LEGALLOIS Damien Cardiologie
Mme LELONG-BOULOUARD Véronique Pharmacologie fondamentale Mme LEPORRIER Nathalie Éméritat jusqu’au 31/10/2017 Génétique
Mme LEVALLET Guénaëlle Cytologie et Histologie
M. LUBRANO Jean Chirurgie générale
M. MITTRE Hervé Biologie cellulaire
M. REPESSÉ Yohann Hématologie
M. SESBOÜÉ Bruno Physiologie
M. TOUTIRAIS Olivier Immunologie
MAITRES DE CONFERENCES ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
Mme ABBATE-LERAY Pascale Médecine générale M. COUETTE Pierre-André Médecine générale M. GRUJARD Philippe Médecine générale
M. LE BAS François Médecine générale
Remerciements
A Monsieur le Professeur Jean-Marc Classe, merci pour vos enseignements lors mon stage en inter CHU à l’ICO et surtout un grand merci de m’avoir offert l’opportunité de travailler sur ce sujet.
A Madame le Dr Cécile Loaec, merci de m’avoir soutenue et aidée dans ce projet. Merci pour tes enseignements précieux autant en théorie qu’en pratique clinique durant mon stage à l’ICO.
A Madame le Professeur Raffaèle Fauvet, je vous remercie de me faire l’honneur de présider ce jury, et pour votre accompagnement durant mes dernières années d’internat.
A Monsieur le Professeur Guillaume Benoist, très sincèrement merci d’avoir accepté de participer à ce jury. Merci également pour ton enseignement, qui m’a donné le goût de l’échographie et ouvert le champ de mes possibles professionnels. A Monsieur le Dr Loïc Campion, pour votre aide précieuse à l’élaboration de cette thèse.
A Monsieur le Professeur Michel Dreyfus, pour votre accompagnement pendant mon internat.
A l’équipe du CH de Flers, Dr André, Dr Begorre, Dr Déon, Dr Bekkari, ainsi que l’équipe des sages femmes, pour m’avoir accompagnée pendant mes jeunes années d’interne, et pour l’accueil dans votre équipe que je suis ravie de rejoindre.
Aux Dr Martin Françoise, Dr Crouet, Dr Jamard et Dr Le Brun, merci de m’avoir accompagnée lors de mes premiers pas en cancérologie, et pour notre future collaboration qui me réjouie.
A mes parents, pour leur soutien constant et à toute épreuve durant ces dix longues années d’études, pour leur présence et leur amour si précieux.
A mes frangins et ma belle sœur, pour leur soutien. A Emma dont les sourires m’ont réconfortée.
A Etienne, pour son soutien sans faille durant ces épreuves, pour sa bienveillance, et pour tant d’autres choses qui me sont chères.
A Enora, ma co interne et amie, pour ces étapes traversées ensemble, notre beau parcours côté à côte.
A la family, Choulie et Nath, Annabelle et Benjamin, Sophie et JB, Maud et Laurent, Pauline et Christophe, Adeline et Pierre, pour nos moments partagés depuis le début de l’aventure Caennaise à Alençon et pour tous ceux à venir. Merci pour cette belle et sincère amitié à laquelle je tiens énormément.
A mes pastek, présentes depuis les bancs du collège, du lycée ou de la fac. Merci de rester ce que vous êtes, de me ramener aux sources. A notre folle et éternelle amitié
Abréviations
AUC : aire sous la courbe ROC CA : curage axillaire
CITNS : carcinome infiltrant de type non spécifique cN : classification ganglionnaire clinique
CNA : chimiothérapie néo adjuvante FN : faux négatif
GAS : ganglion axillaire sentinelle OR : odd ratio
pN : résultat histologique de la cytoponction ganglionnaire RE : récepteur aux œstrogènes
RH : récepteurs hormonaux RP : récepteur à la progestérone RPC : réponse pathologique complète rRC : réponse radiologique complète SBR : score de Scarff Bloom Richardson VPN : valeur prédictive négative
VPP : valeur prédictive positive
Tableaux et figures
Tableau 1 : Caractéristiques de la population
Tableau 2 : Stratégie chirurgicale de la tumeur mammaire et du creux axillaire Tableau 3 : Echographies et IRM avant et après CNA
Tableau 4 : Etude radiologique mammaire et axillaire en fonction de l’analyse histologique axillaire
Tableau 5 : Résultats anatomopathologiques mammaires et ganglionnaires axillaires après chimiothérapie néo adjuvante
Tableau 6: Facteurs prédictifs de la réponse axillaire après chimiothérapie néo adjuvante
Tableau 7 : Régression logistique univariée Tableau8 : Régression logistique multivariée
Tableau 9 : Analyse en bootstrap du nomogramme de l’ICO
Tableau 10 : Les scores prédictifs de la RPC axillaire chez les patientes ayant une atteinte axillaire prouvée avant la chimiothérapie néo adjuvante
Figure 1 : Diagramme de flux
Figure 2 : Courbe ROC du nomogramme de l’ICO Figure 3 : Nomogramme de l’ICO bootstrapé
Sommaire
Introduction ... 2
Matériel et méthodes... 6
1. Population ... 6
2. Recueil des données ... 6
3. Paramètres étudiés... 7
4. Analyse anatomopathologique ... 8
5. Définition de la réponse tumorale et axillaire en imagerie ... 9
6. Objectifs de l’étude ... 9
7. Analyse statistique ... 10
Résultats ... 11
1. Caractéristiques de la population et stratégie thérapeutique ... 11
2. Bilan d’imagerie avant et après CNA ... 13
3. Résultats anatomopathologiques ... 16
4. Facteurs prédictifs de la réponse pathologique complète axillaire ... 17
a) Analyse univariée des facteurs prédictifs ... 17
b) Analyse multivariée ... 20
5. Création du modèle ... 21
6. Validation interne par bootstrapping ... 22
Discussion... 24
1. Identification des patientes ayant un creux axillaire indemne après CNA ... 24
2. Les facteurs prédictifs d’absence d’atteinte axillaire après CNA ... 26
3. Notre modèle prédictif de probabilité de non atteinte axillaire après CNA ... 28
4. Points forts et limites de notre étude ... 31
Conclusion ... 33
Références ... 34
Introduction
Le cancer du sein est le premier cancer en termes d’incidence chez la femme en France. Selon le rapport de l’INCA 54 060 nouveaux cas et 11 913 décès par cancer du sein, soit 18,2% des décès par cancer chez les femmes, ont été diagnostiqués en 2015 (1). La survie globale actuelle est de 87% à 5 ans, et 76% à 10 ans tout stade confondu (1).
La chirurgie dans le cancer du sein localisé joue un rôle de contrôle local et de stadification de la maladie ; stadification tumorale par exérèse de la tumeur mammaire en place et stadification ganglionnaire par exérèse des ganglions axillaires. Le curage axillaire (CA) est le gold standard pour l’évaluation du statut ganglionnaire, facteur pronostic majeur dans la prise en charge du cancer du sein (2,3). Depuis les années 1990, la recherche du ganglion sentinelle axillaire (GAS) s’est développée puis imposée comme une alternative faisable et fiable au CA pour l’évaluation de l’envahissement ganglionnaire en réduisant la morbidité chirurgicale (4,5). La fiabilité du GAS pour la stadification des tumeurs de stade précoce et sans atteinte ganglionnaire clinique initiale (cN0) a largement été démontrée (4,6,7). La survie globale et la survie sans récidive n’étaient pas diminuées après GAS par rapport au CA (6). Depuis les recommandations de l’American Society of Clinical Oncology (ASCO) publiées en 2005, le GAS est la technique de référence pour la stadification axillaire en situation de chirurgie première dans le cancer du sein de stade précoce opérable, avec tumeur unifocale et sans atteinte clinique du creux axillaire (8).
Depuis 25 ans, la chimiothérapie néo adjuvante (CNA) est proposée comme une alternative thérapeutique pour les tumeurs localisées volumineuses, permettant de diminuer le taux de chirurgie radicale, sans impact négatif sur la survie globale et la survie sans récidive (9,10). L’étude américaine prospective NSABP B18, qui comparait 1523 patientes randomisées dans le groupe chimiothérapie néo adjuvante ou chimiothérapie adjuvante, mettait en évidence des taux de conservation mammaire supérieurs en situation de CNA, avec des taux respectivement de 68% contre 60 % (10,11). En plus de l’augmentation des chances de conservation
mammaire, la CNA permet d’évaluer la réponse tumorale au traitement systémique (9). Le taux de réponse pathologique à la CNA est un facteur pronostic (9). Le taux de survie globale à 9 ans des patientes ayant une réponse pathologique complète (RPC) de la tumeur mammaire après CNA est de 85% contre 73% pour les autres patientes, et le taux de survie sans récidive est de 75% contre 58% (10).
Depuis 2006, plusieurs études ont évalué le GAS après CNA. La méta analyse de Xing et al., publiée en 2006, analysait les données de 1273 patientes traitées pour un cancer du sein ayant eu une détection du GAS après CNA. Le taux de détection poolé était de 90% (IC95% : 88-91) et le taux de FN poolé de 12%. Ces taux d’identification et de faux négatifs étaient moins satisfaisants qu’en situation adjuvante, faisant naitre des controverses sur les performances du GAS après CNA (12). Dans les études différenciant le statut ganglionnaire axillaire clinique indemne (cN0) et suspect de métastase (cN1 ou cN2), prouvé ou non par cytoponction ganglionnaire, le taux d’identification du GAS était plus faible et le taux de FN plus élevé dans les groupes cN1-cN2. Le taux d’identification variait de 80 à 87 % et le taux de FN de 13 à 15% dans les études GANEA, SN FNAC et SENTINA (13–15). Ces résultats ont amené à ne pas recommander la technique du GAS après CNA pour la stadification axillaire chez les patientes ayant une atteinte ganglionnaire initiale, mais reste une option pour les patientes sans atteinte ganglionnaire initiale (N0) sous réserve de l’absence de données sur la survie globale (16).
L’étude NSABP B-27, évaluait à partir de 2411 patientes randomisées, les effets de la chimiothérapie sur les réponses cliniques et pathologiques des tumeurs mammaires de stade localisé (17). Après CNA, 50 à 58% des patientes opérées avaient un curage axillaire indemne. Il existe un downstaging ganglionnaire lié à la CNA, comme montré par Fisher et al., avec une moindre proportion de ganglions métastatiques chez les patientes ayant reçu une CNA en comparaison à celles ayant eu une chimiothérapie adjuvante (43% contre 60%, p <0,0001) (18).
Si l’on s’intéresse uniquement aux patientes ayant une atteinte axillaire prouvée avant CNA (pN+), 20 à 35 % d’entre elles obtiennent une réponse pathologique complète (RPC) ganglionnaire axillaire après CNA (19–21). Le but de la technique du GAS est de sélectionner ces patientes afin de leur éviter un curage axillaire inutile.
La procédure du GAS a été proposée avant la CNA. Kuehn et al., dans une étude prospective multicentrique (SENTINA), ont évalué les performances du GAS avant CNA sur 1022 patientes sans atteinte clinique axillaire initiale (15). En cas de GAS positif avant CNA, un GAS après CNA était réalisé. Les performances du GAS avant CNA étaient satisfaisantes avec un taux de détection de 99% et un taux de FN proche de zéro. Dans le groupe des patientes bénéficiant d’un GAS après CNA, les performances de ce GAS étaient médiocres avec un taux de détection de 60,8% et un taux de FN de 51,6%. Le curage axillaire restait donc retenu chez ces patientes. Or une grande partie de ces patientes ont un downstaging par la CNA. Aussi la réalisation du GAS avant CNA empêche d’obtenir l’information d’un éventuel downstaging ganglionnaire au décours de la CNA (16). La technique du GAS avant CNA n’est pas une technique satisfaisante pour réduire le nombre de curage inutile.
Dans l’objectif d’épargner des CA systématiques inutiles après CNA, il serait pertinent de pouvoir identifier, après la CNA et avant la chirurgie, les patientes indemnes de métastase ganglionnaire axillaire. Shen et al., évaluaient dans une étude prospective, les performances du GAS après CNA chez 69 patientes avec atteinte axillaire prouvée par cytoponction avant CNA (22). Les patientes bénéficiaient d’un examen clinique et échographique du creux axillaire avant la chirurgie qui consistait en la réalisation d’un GAS et CA concomitant. Il n’était pas retrouvé de corrélation entre l’évaluation clinique et échographique du creux axillaire après CNA et la présence ou non de métastases ganglionnaires sur l’analyse anatomopathologie finale (22). Schipper et al., en 2014, dans une revue de la littérature incluant quatre études, soit 572 patientes avec atteinte clinique axillaire initiale (cN+), confrontaient les performances diagnostiques des techniques non invasives pour le taux de RPC axillaire et les résultats du CA (23). Les auteurs concluaient que les performances des techniques d’imagerie non invasives telles que l’échographie, l’imagerie par résonnance magnétique (IRM) ou le PET scanner pour la restadification axillaire après CNA n’étaient pas suffisantes pour être fiables et sursoir à l’histologie (23).
Notre objectif principal était de déterminer les facteurs prédictifs de l’absence d’envahissement métastatique axillaire après CNA chez les patientes prises en charge pour un carcinome mammaire infiltrant, afin d’élaborer un nomogramme préopératoire prédictif de l’absence d’atteinte axillaire.
Matériel et méthodes
1. Population
Nous avons mené une étude uni centrique et rétrospective entre le 12 janvier 2011 et le 15 septembre 2015, à l’Institut de Cancérologie de l’Ouest (ICO) de Nantes-St Herblain.
Les critères d’inclusion étaient :
- les carcinomes mammaires infiltrants histologiquement prouvés, de stade tumoral T0 à T3,
- avec ou sans adénopathie axillaire cliniquement palpée (cN0-cN1-2), - avec une indication de CNA.
Les critères d’exclusion étaient :
- les tumeurs multifocales ou multicentriques découvertes à l’examen clinique ou lors du bilan d’imagerie,
- les carcinomes bilatéraux, - les tumeurs de stade T4,
- les stades métastatiques d’emblée, - le diagnostic lors de la grossesse, - les cas de récidive homolatérale,
- les antécédents de carcinome mammaire primitif controlatéral,
- les cas de prise en charge chirurgicale première de la tumeur mammaire ou du creux axillaire (GAS avant CNA),
- l’existence d’un cancer concomitant d’une autre étiologie.
2. Recueil des données
Les données démographiques, cliniques et histologiques pré et post opératoires étaient recueillies grâce à la base de données BERENIS (Base d’Evaluation et de REcherche du Néoplasme Infiltrant et In Situ). Cette base de données a été mise en place en 1997 avec l’objectif de recueillir les données des patientes, traitées à l’ICO,
pour un carcinome mammaire depuis 1985. L’information de l’inclusion des patientes dans la base était délivrée grâce au livret d’accueil de l’établissement. La base BERENIS bénéficie d’un accord de la CNIL.
3. Paramètres étudiés
Le stade clinique tumoral était déterminé selon la classification TNM de la 7e
édition de l’AJCC.
Les données anatomopathologiques pré et post opératoires concernaient le type histologique de la tumeur mammaire, le grade selon la classification de Scarff-Bloom Richardson, le statut des récepteurs hormonaux (RH) aux œstrogènes (RE) et à la progestérone (RP), l’expression ou non de l’antigène HER-2, la présence ou non d’emboles lymphovasculaires.
Les données du bilan d’imagerie avant et après CNA, et le statut ganglionnaire axillaire avant traitement, n’étaient pas disponibles dans la base BERENIS. Celles-ci ont été obtenues par recueil rétrospectif dans les dossiers médicaux.
Toute patiente prise en charge à l’ICO avait une relecture des clichés radiologiques. Un nouveau bilan était réalisé selon l’appréciation des radiologues. Une IRM mammaire était réalisée avant le début du traitement. Les IRM réalisées à l’ICO utilisaient un protocole d’acquisition et de traitement des images dédié à la pathologie mammaire. Les tailles tumorales en échographie et IRM mammaire avant et après CNA ont été recueillies en retenant la mesure du plus grand axe. Pour l’analyse du creux axillaire avant traitement, les données de l’imagerie par échographie axillaire et/ou IRM, et le résultat histologique de la cytoponction ganglionnaire étaient recueillies.
Un ganglion axillaire était considéré comme suspect en imagerie en cas de présence d’un des critères suivants :
- grand axe supérieur à 1 cm,
- épaississement de la corticale à plus de 3 mm, - perte du hile graisseux, œdème périnodulaire, - contours non nets,
Le protocole de chimiothérapie était laissé à l’appréciation des oncologues. L’équipe chirurgicale décidait des modalités de l’intervention selon l’évolution de la taille tumorale, selon le rapport de la taille tumorale persistante et du volume du sein et selon le souhait des patientes.
4. Analyse anatomopathologique
Le grade histologique était déterminé selon la classification de Scarff-Bloom Richardson. Le seuil de positivité des récepteurs hormonaux était fixé à 10%. L’expression de l’antigène HER-2, évaluée en immuno-histochimie, était considérée positive en cas de surexpression. En cas de situation équivoque, la FISH permettait de conclure sur le statut HER-2.
Seul le caractère infiltrant était pris en compte pour l’évaluation de la réponse anatomopathologique sur la pièce opératoire de la tumeur.
Le GAS et les ganglions du CA étaient analysés selon les recommandations internationales. Il n’y avait pas d’analyse extemporanée du ou des GAS. L’envahissement des ganglions axillaires était décrit selon les critères de l’AJCC :
- macro métastase si >2 mm,
- cellules métastatiques isolées si <0.2mm - micro métastase entre 0.2 et 2mm.
Pour un GAS métastatique, quelque soit la taille de la métastase, un CA complémentaire était réalisé. Seules les macro métastases au sein d’un CA étaient considérées comme métastatiques.
Deux groupes ont été définis selon le résultat anatomopathologique final du creux axillaire après geste axillaire:
- le groupe ypN0 définissait les patientes sans atteinte métastatique,
- le groupe ypN1 définissait les patientes avec atteinte axillaire métastatique. La réponse pathologique complète (RPC) mammaire était définie comme l’absence de carcinome infiltrant résiduel sur la pièce opératoire, qu’il y ait ou non présence de CIS isolé. La RPC axillaire était définie comme l’absence de métastase axillaire sur l’analyse anatomopathologique finale chez des patientes ayant une atteinte cytologique prouvée avant CNA.
5. Définition de la réponse tumorale et axillaire en imagerie
La réponse tumorale en imagerie a été évaluée selon des critères de la classification RECIST (Response Evaluation Criteria in Solid Tumors ver. 1.1) modifiés pour l’imagerie mammaire (25).
Nous avons défini comme suit :
- Une réponse radiologique complète comme la disparition complète ou quasi complète de tout signal évoquant la lésion tumorale, soit une régression tumorale de 80 à 100%.
- Une réponse radiologique bonne comme une régression de taille de 79 à 50%.
- Une réponse radiologique partielle comme une régression de taille > 25% de la lésion cible (25-49%).
- Une réponse radiologique médiocre ou stable comme une régression de taille ≤ 25% de la lésion cible.
- Une progression radiologique quand la lésion augmentait de taille par rapport à la lésion initiale.
Les réponses tumorales et axillaires en imagerie ont été comparées entre le groupe de patientes indemnes de métastase axillaire sur l’examen anatomopathologique définitif (ypN0) et celles ayant une atteinte axillaire métastatique sur l’examen anatomopathologique définitif (ypN1).
6. Objectifs de l’étude
L’objectif principal de notre étude était de déterminer les facteurs prédictifs de l’absence d’atteinte axillaire métastatique après chimiothérapie néo adjuvante, chez les patientes traitées pour un cancer du sein localisé.
Notre objectif secondaire était de construire, à partir de ces facteurs significatifs, un nomogramme prédictif de l’absence d’atteinte axillaire après CNA, utilisable avant la chirurgie afin de sélectionner les patientes ayant une forte probabilité d’avoir un creux axillaire indemne.
7. Analyse statistique
Les variables continues ont été décrites par leur moyenne écart-type. Les variables qualitatives ont été décrites par la fréquence de leurs modalités respectives. Les deux groupes d’intérêt ont été comparés grâce au test t de Student, ou le test de Mann-Whitney si nécessaire pour les variables continues, et grâce au test du Chi² de Pearson ou le test exact de Fisher pour les variables qualitatives. A l’étape univariée, la valeur pronostique des variables pour le statut « absence d’atteinte axillaire après CNA » a été calculée par la régression logistique univariée et décrite par l’odds-ratio et son intervalle de confiance à 95%. L’ensemble des variables qui avaient un degré de significativité p < 0,10 à l’étape univariée ont été introduites dans un modèle de régression logistique multivariée pas à pas descendant. Les critères de validité du modèle final ont été vérifiés par le test de Hosmer-Lemeshow. Afin d’augmenter la robustesse du modèle final, une validation interne par bootstrap (n=1000) a été effectuée et la médiane des 1000 valeurs des paramètres a été utilisée pour le nomogramme. La courbe ROC du modèle bootstrapé a été calculée. L’ensemble des tests a été fait en formulation bilatérale, avec un degré de significativité fixé à 5%. Les calculs ont été effectués par les logiciels SAS 9.4 (SAS Institute Inc., Cary, NC, USA) et Stata 13.1 SE (StataCorp LP, College Station, Texas, USA).
Résultats
1. Caractéristiques de la population et stratégie thérapeutique
Entre janvier 2011 et septembre 2015, 3110 patientes ont été traitées pour un carcinome infiltrant mammaire au Centre de Lutte Contre le Cancer de Nantes St Herblain. Parmi elles, 348 avaient reçu une CNA. Cent quatre-vingt-sept patientes avaient les critères d’inclusion pour notre étude (figure 1).
Figue 1 : Diagramme de flux
Les paramètres cliniques et histologiques décrivant notre population sont résumés dans le tableau 1. Soixante-quatre patientes avaient une suspicion clinique d’atteinte axillaire lors du bilan initial (cN1 et cN2), soit 34% de la cohorte.
348 patientes traitées par CNA 161 patientes exclues : - cancer bilatéral n= 11 - cancer multifocal n = 71 - stade T4 n = 47 - cancer concomitant n = 1 - parturiente n = 9
- geste axillaire pré CNA n= 1 - dossiers inexploitables n= 21
187 patientes incluses
Tableau 1 : Caractéristiques de la population
Caractéristiques N=187 (n) (%)
Age (moyenne en années et écart type) IMC (moyenne en kg/m² et écart type) Classification TNM T0 T1 T2 T3 N0 N1 N2 M0 50,4 ± 10,9 24,3 ± 4,6 4 15 128 40 123 52 12 187 - - 2,14 8,02 68,45 21,39 65,78 27,8 6,42 100 Biopsie pré opératoire CITNS CLI Autre Grade SBR I II III NR RE Positifs Négatifs RP Positifs Négatifs NR HER 2 Surexprimé Négatif NR Triple négatif Emboles Positifs Négatifs NR 174 11 2 2 113 71 1 110 77 97 89 1 43 143 1 56 14 125 48 93 5,9 1,1 1,07 60,43 37,97 0,53 58,82 41,18 51,88 47,59 0,53 23 76,47 0,53 29,9 7,49 66,84 25,67 Etude histologique post opératoire tumeur du sein
CITNS CLI CLI + CITNS CCIS isolé Autre Grade SBR I II III RE Positifs Négatifs RP Positifs Négatifs HER 2 Surexprimé Négatif NR Emboles Positifs Négatifs NR 169 11 1 4 2 2 114 71 110 77 98 89 44 142 1 23 163 1 90,37 5,88 0,53 2,14 1,07 1,07 60,96 37,97 58,82 41,18 52,41 47,59 23,53 75,94 0,53 12,3 87,16 0,53
CITNS : carcinome infiltrant de type non spécifique/ CLI : carcinome lobulaire infiltrant/ SBR : grade de Scarff Bloom Richardson/ RE : récepteur aux œstrogènes/ RP : récepteur à la progestérone
Le protocole de chimiothérapie, à base de FEC 100/Taxotère ou Taxol a été administré chez 169 patientes. Un traitement chirurgical conservateur a pu être réalisé après la CNA chez 66,8% des patientes (125/187). Un curage axillaire (CA) a été réalisé en première intention chez 57,7% des patientes (108/187). Une procédure du GAS a été réalisée en première intention chez 26,2% des patientes (49/187) (tableau 2).
Tableau 2 : Stratégie chirurgicale de la tumeur mammaire et du creux axillaire
Geste chirurgical N=187 (n) (%)
Chirurgie conservatrice Mastectomie
Chirurgie conservatrice puis reprise ou mastectomie CA seul GAS seul GAS et CA secondaire GAS et CA d’emblée 125 32 30 108 38 11 30 66,84 17,11 16,04 57,75 20,32 5,88 16,04
CA : curage axillaire/ GAS : ganglion sentinelle axillaire
2. Bilan d’imagerie avant et après CNA
Les examens réalisés pour le bilan d’imagerie de la tumeur mammaire et du creux axillaire sont présentés dans le tableau 3.
Après CNA aucune patiente n’a eu d’échographique du creux axillaire. Un bilan par échographie avant CNA et IRM mammaire avant et après la CNA a été réalisé pour 33,7% des patientes (63/187).
Tableau 3 : Echographies et IRM avant et après CNA Bilan initial N=187 (n) Bilan préopératoire N=187 (n) Echographie mammaire, n(%) 187 (100) 127 (68) Echographie axillaire, n(%) 148 (79,1) 0 IRM mammaire, n(%) 142 (76) 91 (48,7) IRM axillaire, n(%) 138 (73,8) 84 (44,9)
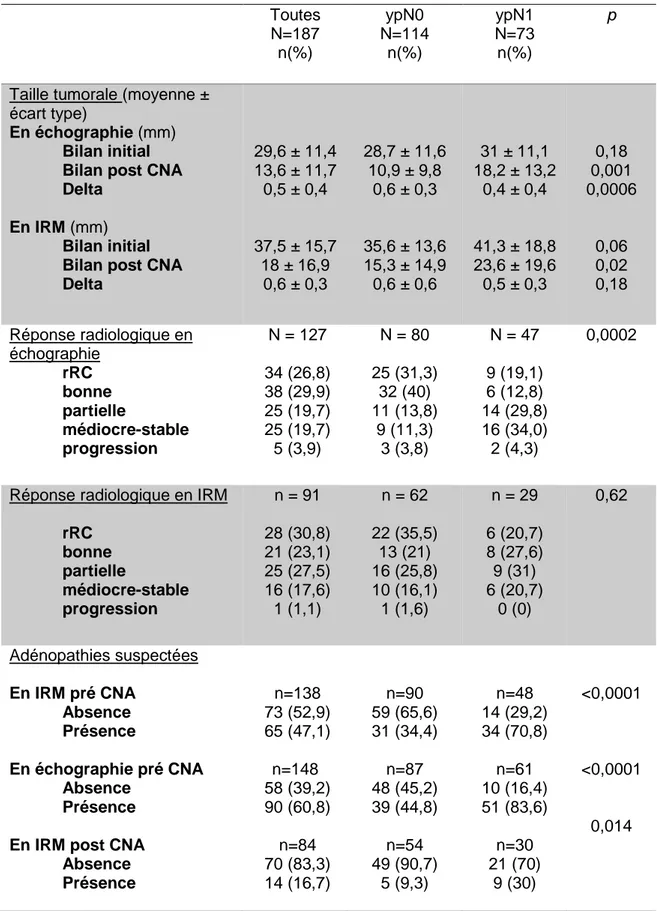
Avant la CNA, les tailles tumorales entre les deux groupes, ypN0 et ypN1, n’étaient pas significativement différentes sur l’échographie (p=0,18). La taille tumorale sur le bilan d’imagerie après CNA était significativement plus grande dans le groupe ypN1 que dans le groupe ypN0, avec respectivement 18,2 ± 13,2 mm versus 10,9 ± 9,8 mm en échographie (p=0,001) et 23,6 ± 19,6 mm versus 15,3 ± 14,9mm en IRM (p=0,02) (tableau 4). La réponse radiologique complète (rRC) était de 26,8% en échographie et de 30,8% en IRM indépendamment du groupe. La réponse radiologique complète ou bonne en échographie était significativement plus fréquente dans le groupe ypN0 que dans le groupe ypN1, avec respectivement 31,3% et 40% des patientes (p=0,0002).
Des adénopathies axillaires étaient suspectées en échographie et IRM avant CNA chez respectivement 60,8% (90/148) et 47,1% (65/138) des patientes. Après CNA, 16,7% (14/84) des patientes avaient une persistance d’adénopathies sur l’IRM. Parmi les patientes ypN1, 70,8% (34/48) et 83,6% (51/61) des patientes avaient des adénopathies visibles en IRM et en échographie avant CNA. De même parmi les patientes ypN1, 30% (9/30) avaient des adénopathies sur l’IRM après CNA. Parmi les patientes ypN0, l’étude radiologique du creux axillaire était normale sur 45,2% (48/87) des échographies avant CNA, 65,6% (59/90) des IRM avant CNA, et 90,7% (49/54) des IRM après CNA. En échographie et IRM avant CNA les taux de FN étaient respectivement de 16,4% et 29,17%. Le taux de FN en IRM après CNA était de 70% (tableau 4).
Cent patientes ont bénéficié d’une cytoponction ganglionnaire avant la CNA. Six résultats étaient non contributifs. L’analyse cytologique était positive chez 76,5% patientes bénéficiant de la cytoponction (72/94) (tableau 5).
Tableau 4 : Etude radiologique mammaire et axillaire en fonction de l’analyse
histologique axillaire Toutes N=187 n(%) ypN0 N=114 n(%) ypN1 N=73 n(%) p
Taille tumorale (moyenne ± écart type)
En échographie (mm) Bilan initial Bilan post CNA Delta
En IRM (mm) Bilan initial Bilan post CNA Delta 29,6 ± 11,4 13,6 ± 11,7 0,5 ± 0,4 37,5 ± 15,7 18 ± 16,9 0,6 ± 0,3 28,7 ± 11,6 10,9 ± 9,8 0,6 ± 0,3 35,6 ± 13,6 15,3 ± 14,9 0,6 ± 0,6 31 ± 11,1 18,2 ± 13,2 0,4 ± 0,4 41,3 ± 18,8 23,6 ± 19,6 0,5 ± 0,3 0,18 0,001 0,0006 0,06 0,02 0,18 Réponse radiologique en échographie rRC bonne partielle médiocre-stable progression N = 127 34 (26,8) 38 (29,9) 25 (19,7) 25 (19,7) 5 (3,9) N = 80 25 (31,3) 32 (40) 11 (13,8) 9 (11,3) 3 (3,8) N = 47 9 (19,1) 6 (12,8) 14 (29,8) 16 (34,0) 2 (4,3) 0,0002
Réponse radiologique en IRM
rRC bonne partielle médiocre-stable progression n = 91 28 (30,8) 21 (23,1) 25 (27,5) 16 (17,6) 1 (1,1) n = 62 22 (35,5) 13 (21) 16 (25,8) 10 (16,1) 1 (1,6) n = 29 6 (20,7) 8 (27,6) 9 (31) 6 (20,7) 0 (0) 0,62 Adénopathies suspectées En IRM pré CNA Absence Présence En échographie pré CNA Absence Présence En IRM post CNA
Absence Présence n=138 73 (52,9) 65 (47,1) n=148 58 (39,2) 90 (60,8) n=84 70 (83,3) 14 (16,7) n=90 59 (65,6) 31 (34,4) n=87 48 (45,2) 39 (44,8) n=54 49 (90,7) 5 (9,3) n=48 14 (29,2) 34 (70,8) n=61 10 (16,4) 51 (83,6) n=30 21 (70) 9 (30) <0,0001 <0,0001 0,014
3. Résultats anatomopathologiques
Une RPC de la tumeur mammaire était obtenue dans 17,6% des cas (33/187). Dans le groupe des patientes ayant une RPC de la tumeur mammaire, 96,97% des patientes avaient également un creux axillaire indemne (32/33). Parmi les patientes ayant eu une cytoponction positive avant la CNA (pN+), 37,5% obtenaient une RPC axillaire (27/72). Parmi les 22 patientes ayant eu une cytoponction négative avant la CNA (pN0), sept avaient une atteinte axillaire métastatique après CNA. Parmi les patientes sans adénopathie suspectée à l’examen d’imagerie initial (cN0), 22,6% avaient une atteinte métastatique ganglionnaire axillaire sur l’analyse finale (groupe ypN1) (21/93) (tableau 5).
Tableau 5 : Résultats anatomopathologiques mammaires et ganglionnaires axillaires après chimiothérapie néo adjuvante
RPC : réponse pathologique complète ypN0 N=114 n(%) ypN1 N=73 n(%) Toutes N=187 n(%) RPC tumeur 32 (97) 1 (3) 33 (17,6) Absence de RPC tumeur 82 (53,2) 72 (46,8) 154 (82,4) Cytologie positive 27 (37,5) 45 (62,5) 72 (38,5) Cytologie négative cN0 initial 15 (68,2) 72 (77,4) 7 (31,8) 21 (22,6) 22 (11,7) 93 (49,7)
4. Facteurs prédictifs de la réponse pathologique complète axillaire
a) Analyse univariée des facteurs prédictifs
Chaque variable recueillie a été étudiée afin de déterminer les facteurs prédictifs de l’absence de métastase axillaire. L’IMC, le statut négatif des RE et RP, la surexpression de l’antigène HER2, le statut triple négatif, la cytologie négative avant CNA, la taille tumorale de moins 15 mm en imagerie post CNA, la régression de plus de 50% du volume tumoral en imagerie et l’absence d’adénopathie en échographie ou en IRM avant et après CNA étaient des facteurs significativement associés à l’absence d’atteinte métastatique axillaire à l’issue de la CNA (tableaux 6).
La régression de la taille tumorale après CNA en échographie ou en IRM était associée à l’absence d’atteinte axillaire (respectivement p<0,001 et p<0,02). Pour une lésion tumorale après CNA inférieure à 15 mm, l’OR d’avoir une absence d’atteinte axillaire était de 3,20 (IC 95% : 1,61-6,34 ; p<0,001). En cas de régression de la taille tumorale de plus de 50%, l’OR d’avoir une absence d’atteinte axillaire est de 3,66 (IC 95% : 1,85-7,25 ; p<0,001). L’absence d’adénopathie en échographie et/ou IRM avant CNA est associée à un OR de 7,31 (IC 95% : 3,02-17,70). Les corrélations pour les paramètres histologiques tels que la négativité des récepteurs hormonaux RE et RP, l’expression de l’antigène HER2, le sous type triple négatif, sont détaillées dans le tableau 7.
Tableau 6 : Facteurs prédictifs de la réponse axillaire après chimiothérapie néo adjuvante ypN0 N=114 n (%) ypN1 N=73 n (%) p Critères démographiques
Age (moyenne ± EC) <35 ans >35ans IMC (moyenne ± EC)
49,3 ± 10 5 (4,4) 109 (95,6) 23,6 ± 4 52 ± 12,1 6 (8,2) 67 (91,8) 25,4 ± 5,2 0,12 0,34 0,01
Stade tumoral et axillaire clinique
T0-T1 T2 T3 N0 N1-N2 13 (11,4) 78 (68,4) 23 (20,2) 86 (75,4) 28 (24,6) 6 (8,2) 50 (68,5) 17 (23,3) 37 (50,7) 36 (49,3) 0,72 0,0005 Histologie initiale CITNS CLI-autre Grade SBR I II III RE Positifs Négatifs RP Positifs Négatifs HER 2 Surexprimé Négatif Triple négatif Oui Non Emboles Positifs Négatifs Cytologie pré CNA pN1 pN0 109 (95,6) 5 (4,4) 1 (0,9) 64 (56,1) 49 (43) 54 (47,4) 60 (52,6) 51 (44,7) 63 (55,3) 34 (29,8) 80 (70,2) 42 (36,8) 72 (63,2) 8 (9,2) 79 (90,8) 27 (64,3) 15 (35,7) 65 (89) 8 (11) 1 (1,4) 49 (68,1) 22 (30,6) 56 (76,7) 17 (23,3) 46 (63,9) 26 (36,1) 9 (12,5) 63 (87,5) 14 (19,2) 59 (80,8) 6 (11,5) 46 (88,5) 45 (86,5) 7 (13,5) 0,08 0,16 0,0001 0,02 0,0063 0,01 0,66 0,01
EC : écart type / IMC : indice de masse corporelle / CITNS : carcinome infiltrant de type non spécifique/ CLI : carcinome lobulaire infiltrant/ RE : récepteur aux œstrogènes/ RP : récepteur à la progestérone
Tableau 7 : Régression logistique univariée N OR OR 95% IC p Age au diagnostic ≥35 vs <35 187 1,95 0,57-6,65 0,285 IMC ≤25 vs >25 187 1,92 1,04-3,54 0,038 Stade T T2 vs T3 T0-T1 vs T3 187 1,15 1,60 0,56-2,37 0,51-5,07 0,698 0,423 Stade N N0 vs N1-N2 187 2,99 1,60-5,59 <0,001 Histologie
CITNS vs CLI- autre 187 2,68 0,12-1,19 0,095
Grade SBR 186 1,71 0,92-3,20 0,091 Emboles Absence vs présence 139 1,29 0,42-3,94 0,658 RE Négatifs vs positifs 187 3,66 1,90-7,05 <0,001 RP Négatifs vs positifs 186 2,19 1,19-4,01 0,011 HER 2 Positifs vs négatif 186 2,98 1,33-6,66 0,008 Triple négatif Oui vs non 187 2,46 1,23-4,93 0,011 Cytologie pré CNA pN0 vs pN1 94 3,57 1,29-9,87 0,014
Taille échographique et/ou IRM post CNA
≤15 mm vs > 15 mm 156 3,20 1,61-6,34 <0,001
Delta taille échographique et/ou IRM
≥50% vs <50% 156 3,66 1,85-7,25 <0,001
Adénopathie en échographie et/ou IRM pré CNA
Absence vs présence 157 7,31 3,02-17,70 <0,0001
OR : odd ratio / IMC : indice de masse corporelle/ CITNS : carcinome infiltrant de type non spécifique / CLI : carcinome lobulaire infiltrant/ RE : récepteur aux œstrogènes/ RP : récepteur à la progestérone
b) Analyse multivariée
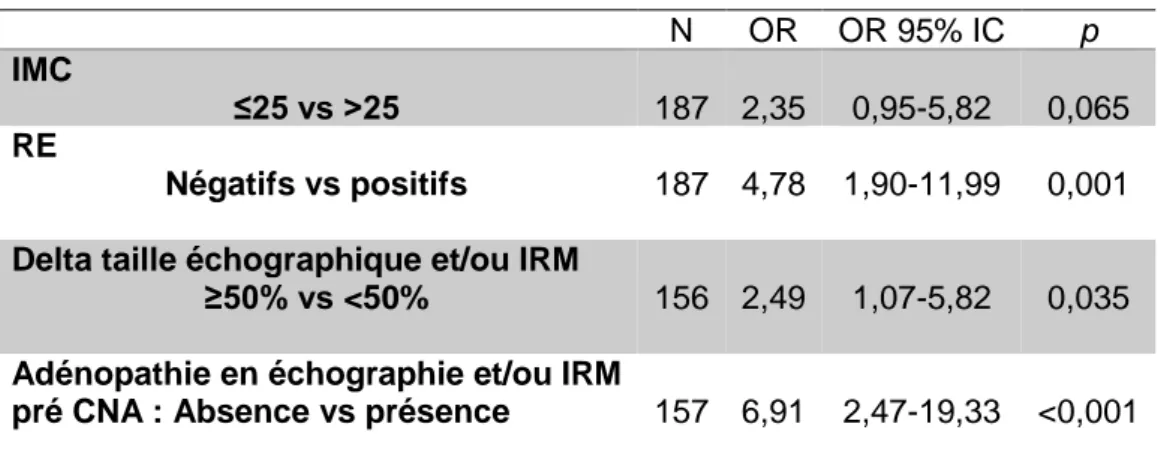
Les variables significatives dans le modèle univarié (p<0,10) ont été sélectionnées pour la régression logistique multivariée (tableau 8). La négativité des RE, la régression de la taille tumorale ≥ 50% et l’absence d’adénopathies sur l’échographie et/ou l’IRM sont des facteurs indépendants associés au statut de l’atteinte métastatique axillaire finale.
Tableau 8 : Régression logistique multivariée
N OR OR 95% IC p
IMC
≤25 vs >25 187 2,35 0,95-5,82 0,065
RE
Négatifs vs positifs 187 4,78 1,90-11,99 0,001
Delta taille échographique et/ou IRM
≥50% vs <50% 156 2,49 1,07-5,82 0,035
Adénopathie en échographie et/ou IRM
pré CNA : Absence vs présence 157 6,91 2,47-19,33 <0,001
5. Création du modèle
Le nomogramme a été créé sur un échantillon de 131 patientes. Les variables préopératoires statistiquement significatives en analyse univariée ont été incluses pour la construction du modèle prédictif ICO. Chaque variable était pondérée d’un nombre de points, que l’on additionnait pour obtenir un score de probabilité d’absence d’envahissement axillaire. Le seuil de significativité était fixé à 0,5. La sensibilité du test était de 85% (IC95% :0,79-0,91), la spécificité de 60% (IC95% :0,52-0,68), la valeur prédictive positive (VPP) de 77% (IC95% :0,70-0,85), et la valeur prédictive négative (VPN) de 71% (IC95% :0,64-0,79). L’aire sous la courbe ROC était de 0,81 (IC95% :0,738-0,889) (figure 2).
6. Validation interne par bootstrapping
La validation interne du score a été effectuée par bootstrap sur 1000 patientes. La médiane des odds-ratio (OR) pour chaque variable est présentée dans le tableau 9. La courbe des points du nomogramme bootstrapé est présentée par la figure 3.
Tableau 9 : Analyse en bootstrap du nomogramme de l’ICO
Médiane OR1000 Médiane b1000
IMC : ≤25 vs >25 2,42 0,883
RE : Négatifs vs positifs 5,20 1,648
Delta taille échographique et/ou IRM
≥50% vs <50% 2,55 0,938
Adénopathie en échographie et/ou IRM
pré CNA : absence vs présence 7,62 2,030
Pour chaque patiente :
• RE : négatifs = 81 points / positifs = 0 points
• Delta à l’IRM ou à l’échographie : 50% = 46 points / < 50% = 0 points • Adénopathie à l’IRM ou à l’Echographie : NON = 100 points / OUI = 0 points • IMC : < 25 = 43 points / 25 = 0 points
Points 0 43 46 81 89 100 124 127 143 146 170 181 189 224 227 270 Probabilité GG AX NEG du modèle 14,2 28,6 29,8 46,3 50,6 55,8 67,6 68,8 75,4 76,4 84,2 86,8 88,7 94,1 94,4 97,6
Discussion
Notre étude a permis de mettre en évidence des facteurs prédictifs de l’absence d’atteinte axillaire chez les patientes bénéficiant d’une CNA. A partir des facteurs significatifs et indépendants, nous avons élaboré le score ICO, utilisable en pré chirurgie, et prédictif de la probabilité d’obtenir un creux axillaire indemne de métastase après la CNA.
1. Identification des patientes ayant un creux axillaire indemne après CNA Dans notre étude 17,6% des patientes avaient une RPC mammaire après CNA (33/187), 37,5% avaient une RPC axillaire (27/72), et 28% les deux (32/114).
Le taux de RPC axillaire que nous retrouvons est concordant avec ce que retrouvaient Schipper et al., dans leur revue de la littérature (23). La RPC axillaire était comprise entre 22 et 38,5%. Les mêmes auteurs, dans une étude multicentrique rétrospective portant sur 291 patientes, avaient pour but d’élaborer un score prédictif de la RPC axillaire (26). Ils retrouvaient un taux de RPC axillaire après CNA de 33,7%, un taux de RPC mammaire de 25,8%, et 17,5% des patientes avaient à la fois une RPC mammaire et axillaire.
La restadification axillaire après CNA n’est pas abordée dans les recommandations nationales et internationales. Dans notre étude, alors que 80% des patientes bénéficiaient d’une évaluation échographique du creux axillaire avant la CNA, aucune n’avait de restadification avant la chirurgie. Hieken et al., dans un essai uni centrique et prospectif incluant 272 patientes, évaluaient les performances de l’échographie, de l’IRM et du PET scanner comme outil diagnostique de la persistance de métastase axillaire après CNA (24). L’échographie avant la CNA avait une sensibilité de 58%, une spécificité de 70%, une VPP de 57% et une VPN de 71%. Le taux de FN de l’échographie axillaire du bilan initial chez les patientes cN0 était de 25%.
Dans notre étude des adénopathies étaient suspectées sur l’échographie avant CNA chez 60,8% des patientes. Parmi les patientes indemnes d’atteinte axillaire après
curage (ypN0), 45% (39/87) avait une échographie axillaire suspecte avant la CNA. La proportion de patientes avec atteinte axillaire sur l’analyse finale (ypN1) et non identifiées en échographie axillaire avant CNA était de 16,4%. Dans notre étude l’échographie avant CNA avait une sensibilité pour la détection des métastases sur l’analyse finale de 83% (51/61) et une spécificité de 55% (48/87).
Lorsque des adénopathies sont suspectée sur l’échographie axillaire avant la CNA, il est recommandé de réaliser une cytoponction ganglionnaire sous guidage échographique (27). La cytoponction ganglionnaire a une sensibilité de 75% (IC95% : 67,6-81,1) et une spécificité de 98,5% (IC 95% : 97,3-99,1) (27). Parmi les 22 patientes de notre étude ayant eu une cytoponction négative avant la CNA, sept avaient une atteinte axillaire métastatique après CNA, soit 31,8% de faux négatifs, donc des patientes classées à tort pN0 avant CNA.
L’échographie axillaire après CNA permettrait une restadification axillaire qui serait une aide à la décision du type de geste chirurgical à effectuer.
Après CNA, dans l’essai de Hieken et al., où le taux de RPC axillaire était de 38,5%, la sensibilité de l’échographie axillaire était de 69%, celle de l’IRM de 61% (24). Dans la sous population pN+ prouvé par cytologie avant CNA, avec downstaging ganglionnaire secondaire à la CNA, une réponse radiologique complète axillaire était retrouvée dans 58,1% des cas en échographie et 58,6 % en IRM. Boughey et al., dans une étude rétrospective incluant 611 patientes de la cohorte de l’essai ALLIANCE, montraient qu’en cas d’adénopathie suspectée à l’échographie axillaire après CNA, l’atteinte axillaire était prouvée chez 71,8% des patientes (IC95% :64,7%-78,3%), alors que dans le groupe des patientes sans suspicion d’atteinte à l’échographie 56,5% avaient une atteinte axillaire métastatique (IC95% :51,6%-61,2%) (28).
L’essai de Ha et al., portait sur 157 patientes et évaluait les performances de l’échographie et de l’IRM pour la détection des adénopathies lors du bilan réalisé avant et après CNA (29). Réalisées avant la CNA, 100% des cas de suspicion d’adénopathie en échographie et 97,46% en IRM étaient positifs, prouvés par la cytoponction. Sur le bilan réalisé après CNA, l’échographie avait une sensibilité de 60% et l’IRM de 57,33%. La combinaison des deux examens augmentait la sensibilité à 65,33% pour la restadification après CNA.
La place de l’IRM dans le bilan initial et en cours de CNA a été évoquée mais n’est pas clairement recommandée (30,31). L’IRM n’est pas réalisée en routine dans le bilan préopératoire, alors que l’évaluation de la taille tumorale résiduelle après CNA pourrait guider le geste chirurgical (24,32). Dans notre cohorte, près de la moitié des patientes (48%) avaient bénéficié d’une IRM mammaire avant la CNA, le creux axillaire était étudié chez 92% d’entre elles. Javid et al., dans une étude rétrospective d’une cohorte de 74 patientes, avaient pour objectif d’évaluer la valeur prédictive de l’IRM dans la détection d’adénopathies avant CNA et leur persistance après CNA (32). Les auteurs rapportaient une sensibilité de l’IRM pour la détection des adénopathies axillaires avant CNA de 64,7%, une spécificité de 100%, une VPP de 100% et une VPN de 77,8%. Après CNA, la sensibilité et la VPN étaient meilleures avec respectivement 85,7% et 80,9%. Les auteurs concluaient pourtant que l’IRM ne pouvait devenir un examen de référence dans la détection d’adénopathies et la restadification ganglionnaire.
2. Les facteurs prédictifs d’absence d’atteinte axillaire après CNA
Dans notre étude, l’IMC inférieur à 25kg/m² est un facteur prédictif de l’absence d’atteinte axillaire métastatique après CNA (p=0,01). Dans l’analyse multivariée, une tendance statistique persiste (p=0,065), mais ce facteur prédictif n’est pas indépendant. Peu d’études ont évalué l’impact de l’IMC sur la réponse axillaire à la CNA, et les résultats sont discordants. Kim et al., ont évalué les facteurs prédictifs de la RPC axillaire dans une cohorte rétrospective de 415 patientes ayant une atteinte axillaire prouvée par cytologie avant CNA (33). Trente pourcent de la population avait un IMC > 25kg/m², soit la même proportion que dans notre cohorte. Les auteurs ne retrouvaient pas d’impact de l’IMC sur la RPC axillaire (p=0,86). A l’inverse, Litton et al., à partir d’une cohorte rétrospective de 1169 patientes, ont mis en évidence que le surpoids (32% de leur population) et l’obésité (30% de leur population) étaient associés à un taux de RPC mammaire et axillaire faible (OR = 0.67; IC95% :0,45-0,99 ) (34). Neuhouser et al., dans une étude de cohorte américaine coordonnée par la WHI (Women’s Health Initiative) sur plus de 67 000 femmes, avaient pour but de différencier les caractéristiques des cancers du sein chez les femmes obèses par rapport à celles de poids normal (35). Les tumeurs de sous types RE positifs étaient
plus fréquentes chez les patientes ayant un IMC > 35 kg/m² (HR=1,86 ; 95% CI 1,60–2,17, p<0,001). Or le statut négatif des RH est un facteur prédictif de la RPC axillaire, ceci pouvant expliquer la fréquence plus grande de métastases ganglionnaires axillaires après CNA chez les patientes obèses (26,33). Bonsang-Kitzis et al., mettaient aussi en évidence, à partir d’une cohorte rétrospective de 326 patientes ayant des tumeurs T1-T3,N1-3,M0 de type triple négatif, que l’IMC > 30kg/m² était associé à un sur risque de métastases axillaires (OR 2,64 ; IC95% 1,28- 5,55) (36).
Outre l’IMC, le statut négatif des RH, le statut HER2 surexprimé étaient significativement associés à un creux axillaire indemne après CNA dans notre étude. Les mêmes facteurs prédictifs étaient mis en évidence dans l’étude de Kim et al., (33). Cette étude rétrospective, sus citée, avait pour but d’élaborer un nomogramme prédictif à partir de facteur prédictifs de la RPC axillaire. D’autres facteurs prédictifs de la RPC axillaire étaient également mis en évidence dans cette étude: l’âge de moins de 35 ans (p=0,022), le stade clinique cT1 (p=0,025), le grade histologique (p<0,001), le type de chimiothérapie reçue (p=0,011), l’index de prolifération Ki67 bas (p=0,003). Mais tous ces facteurs n’étaient pas indépendants, car non significatifs dans l’analyse multivariée. L’étude prospective coréenne de Kim et al., portant sur 201 patientes cN+, montrait que le grade SBR 3 et le Ki67 élevé étaient des facteurs prédictifs d’une RPC axillaire (respectivement p=0,002 et p=0,031), mais le statut négatif des RE et l’expression de l’antigène HER 2 n’étaient pas différents entre les 2 groupes (respectivement p=0,086 et p=0,917) contrairement à nos résultats (37). Dans notre base de données le résultat du Ki 67 n’étant pas disponible pour toutes les patientes, nous n’avons pas pris en compte cette variable pour notre étude. Par ailleurs l’hétérogénéité de prolifération tumorale, et la variabilité de marquage du Ki67 interroge sur la pertinence et la fiabilité du marquage sur la pièce de biopsie (38). Les différences concernant les facteurs prédictifs d’absence de métastase ganglionnaire axillaire après CNA dans notre étude et celles de Kim YJ (33) et Kim HS (37) pourraient s’expliquer par la population étudiée. En effet nous avons évalué les facteurs prédictifs d’une absence de métastase ganglionnaire axillaire quelque soit le statut ganglionnaire initial, alors que dans ces études seules les patientes ayant une atteinte clinique initiale prouvée par cytologie avant de
débuter la CNA étaient incluses et l’objectif de leur étude était de déterminer les facteurs prédictifs d’un downstaging ganglionnaire complet.
Par ailleurs l’étude de Kim et al., montrait que la régression de la lésion mammaire, objectivée par échographie, était plus importante dans le groupe des patientes ayant une RPC axillaire (67% vs 42%,p>0,001) (37). Chez les patientes ayant une RPC axillaire complète, la proportion de patientes avec une réponse clinique mammaire complète était plus importante que dans le groupe des patientes ayant une atteinte axillaire métastatique persistante après CNA (24,5% vs 8,2%, p<0,001). Dans notre étude également, la réponse radiologique en échographie et ou IRM était associé à la réponse axillaire. Une taille tumorale mammaire inférieure à 15 mm après CNA était prédictive d’une absence d’atteinte axillaire avec un OR de 3,20 (IC 95% :1,61-6,34, p<0,001). De même une régression ≥ 50% en échographie et/ou IRM, était associée à une absence de métastase ganglionnaire axillaire avec un OR de 2,49 (IC 95% : 1,07-5,82, p=0,035). Kim et al., avaient fixé un seuil de régression tumorale en IRM ≥ 47.1% (OR = 3,21 ; IC 95%: 1,58-6,51, p<0.01) (37). Ainsi la taille tumorale initiale n’est pas prédictive de l’envahissement ganglionnaire final, contrairement à la régression tumorale sous CNA.
3. Notre modèle prédictif de probabilité de non atteinte axillaire après CNA Notre modèle a pour objectif d’identifier avant chirurgie les patientes ayant une forte probabilité d’absence d’atteinte métastatique axillaire après la CNA, afin de pourvoir diminuer les taux de CA. Plusieurs nomogrammes prédictifs de la RPC axillaire après CNA chez les patientes N+, prouvées avant CNA, ont été décrits et leurs performances sont illustrées dans le tableau 10 (26,37,39–41).
Schipper et al., ont publié en 2014, un score prédictif de la RPC axillaire après CNA chez les patientes ayant une atteinte axillaire clinique initiale prouvée par échographie et cytologie (26). Ce score était basé sur des caractéristiques cliniques et histologiques. L’aire sous la courbe était de 0,77 (95% IC : 0,71-0,81). Pour un seuil fixé à 0,5, le modèle avait une sensibilité de 43% et une VPP de 65%, avec une spécificité de 88% et une VPN de 75%. Les auteurs concluaient que leur score,
même si ses performances étaient satisfaisantes, ne pouvait permettre à lui seul de décider de la stratégie de traitement. En effet le nomogramme de Schipper possède une bonne spécificité mais une faible sensibilité, au risque de ne pas identifier les patientes ayant une RPC axillaire et de réaliser des curages axillaires par excès chez ces patientes. (Annexe 1)
De même, Kim et al., en 2015, élaboraient un score prédictif de RPC axillaire après CNA, en ajoutant aux critères cliniques et histologiques, la notion de réponse axillaire ou mammaire à l’échographie après CNA (40). L’âge de moins de 35 ans, le stade clinique tumoral et axillaire, le grade histologique, le régime de chimiothérapie, l’index de prolifération Ki67, le statut RE et HER 2 avec traitement par Trastuzumab étaient pris en compte pour le calcul de probabilité. Le test avait une bonne AUC, mais les performances n’étaient pas précisées dans la publication. (Annexe 2)
Xi Jin et al., ont élaboré en 2016 un score prédictif de la RPC axillaire après CNA chez les patientes ayant une atteinte axillaire clinique initiale prouvée par cytologie (41). Cette étude prospective incluait 426 patientes entre 2003 et 2015, randomisées entre un groupe pour la création du nomogramme et un groupe pour la validation externe. L’aire sous la courbe était de 0,80 (IC 95% 0,74-0,87) dans le groupe de training et de 0,75 (IC 95% : 0,68-0,82) dans le groupe de validation externe. Les variables retenues, et associées à la RPC axillaire, étaient : le statut tumoral, le statut négatif des RH, la surexpression de l’antigène HER2, le Ki67 supérieur à 20. La positivité des RH était associé à un OR de 0,162 pour la RPC axillaire (p<0,001), la surexpression de HER2 à un OR de 3,44 (p=0,024), le Ki67 > 20 à un OR de 2,258 (p=0,037). L’application de ce score sur une population française n’est pas possible car le taux de positivité retenu pour le statut des RH était fixé à 1% selon leurs critères anatomopathologiques. (Annexe 3)
Kantor et al., ont élaboré en 2018, à partir d’une cohorte de 13396 patientes, un modèle prédictif de la RPC axillaire après CNA (39). Les patientes ayant une atteinte axillaire clinique initiale puis un curage axillaire après la CNA ont été incluses pour l’étude. L’âge de moins de 50 ans (OR 1,41), le sous type tumoral (OR 2,8 pour les tumeurs RH négatif/HER2 négatif ; OR 3,67 pour les tumeurs RH positif/HER 2
1,68), le CITNS (OR 1,66) et le stade cN1 (OR 1,28) étaient des facteurs prédictifs et indépendants de la RPC axillaire. Chaque variable, ainsi que la réponse clinique mammaire était codée sous forme de points. Pour un score égal à 8, le taux de RPC axillaire était de 81,5% (76,4% dans la cohorte de validation). L’aire sous la courbe du test était de 0,78 dans le groupe test et dans la cohorte de validation. (Annexe 4)
Kim et al., ont publié en 2017 plusieurs nomogrammes à partir d’une cohorte prospective de 201 patientes ayant une atteinte clinique initiale (37). Le nomogramme le plus intéressant était celui prenant en compte la régression tumorale de la lésion mammaire sur l’IRM. (Annexe 5)
Tableau 10 : Les scores prédictifs de la RPC axillaire chez les patientes ayant une atteinte axillaire prouvée avant la chimiothérapie néo adjuvante
Auteur Type d’étude Population AUC (IC95%) Se Sp VPP VPN Schipper et al. (26) 2014 Rétrospectif 2005-2012 291 pN+ 0,77 (0,71-0,81) 43% 88% 65% 75% Xi Jin et al. (41) 2016 Prospectif 2003-2015 426 pN+ 0,80 (0,74-0,87) - - - - Kantor et al. (39) 2018 Rétrospectif 2010-2013 19115 cN+ 0,78 (DNC) - - - - HS Kim et al. (37) 2017 Rétrospectif 2010-2015 201 pN+ 0,73 (0,66-0,80) 43% 83% 56% 74% JY Kim et al. (40) 2015 Rétrospectif 2008-2012 415 pN+ 0,82 (0,78-0,86) - - - -
AUC : aire sous la courbe/ Se : sensibilité/ Sp : spécificité / VPP : valeur prédictive positive/ VPN : valeur prédictive négative / DNC : donnée non connue/ pN+ : atteinte axillaire prouvée par la cytoponction avant CNA/ cN+ : atteinte axillaire clinique
A notre connaissance aucun autre score prédictif applicable à toute patiente bénéficiant d’une CNA quelque soit leur statut ganglionnaire initial n’a été élaboré. Le nomogramme ICO possède une sensibilité de 85%, avec une VPP de 77,5%. Notre test possède une bonne performance pour identifier les patientes sans métastase axillaire après CNA mais n’est pas suffisante. En effet le risque est de méconnaitre les patientes pour lesquelles le test prédirait une forte probabilité de non envahissement axillaire après CNA alors qu’une atteinte axillaire métastatique est toujours présente. Ce taux de FN de notre test est de 15%. D’autre part, la spécificité de notre nomogramme n’est que de 60%, soit un risque de méconnaitre une absence d’envahissement axillaire pour 40% des patientes.
L’aire sous la courbe (AUC) de notre test était de 0,81 ((IC95% :0,738-0,889). Tout d’abord la valeur de l’AUC supérieure à 0,5 nous indique que notre test est bien informatif. Ensuite un test avec une AUC d’une valeur comprise entre 0,7 à 0,8 indique une discrimination du test satisfaisante, ce qui est notre cas. La performance du test est à contrôler et confirmer sur une population extérieure.
Le nomogramme doit être envisagé comme un outil d’évaluation du risque individuel, en complément des éléments utilisés actuellement en pratique courante. L’avantage de notre nomogramme est qu’il s’agit d’un test non invasif applicable en pré opératoire, à mettre en perspective par rapport à la réalisation du GAS après CNA. En effet, notre test de dépistage a un taux de FN identique à la technique diagnostique du GAS, compris entre 13 et 15% selon la littérature (13–15). L’avantage de notre nomogramme, associé à nos pratiques actuelles, serait donc de sélectionner les patientes avec une forte probabilité d’absence d’atteinte axillaire après CNA et de sursoir au CA chez ces patientes.
4. Points forts et limites de notre étude
Les nomogrammes publiés et cités ci-dessus ne s’appliquent qu’aux patientes avec atteinte axillaire connue avant la CNA, or les patientes N0 devraient également être au centre de la question de l’indication du curage axillaire. Nous avons montré que dans la population de patientes initialement N0, 22,6% se révélaient être ypN+ lors de l’exploration chirurgicale après CNA.
Notre score a l’avantage de considérer toutes les patientes recevant une CNA, sans distinction selon leur statut ganglionnaire supposé avant le traitement systémique. Par ailleurs, l’originalité de notre score était d’utiliser les données de l’évaluation radiologique de la réponse à la CNA.
Notre étude était uni centrique et rétrospective, limitant le nombre de patientes incluses et pouvant parfois être source de perte d’information. La performance de notre score a pu être limitée par la non mise en évidence de la significativité de certaines variables, soit à cause de la taille limitée de notre effectif, soit par les données manquantes en lien avec la méthode de recueil rétrospectif.
Une validation externe par bootstrap a été réalisée, mais il est important de tester notre score sur une cohorte externe en premier lieu puis lors d’un essai prospectif, afin de confirmer ses performances. Par ailleurs l’utilisation et la validité de ce score seront à comparer à l’analyse anatomopathologique ganglionnaire finale obtenue par curage axillaire, et d’apprécier son impact sur la survie et les complications évitées du geste axillaire.
Conclusion
Après réalisation des cures de CNA, la restadification axillaire par des examens non invasifs, tels que l’échographie et l’IRM, n’est pas satisfaisante. L’identification préopératoire des patientes sans envahissement ganglionnaire axillaire, par un outil fiable et performant, permettrait de réduire les indications de curage axillaire inutile. Le score ICO possède une bonne sensibilité et VPP permettant de sélectionner les patientes à faible risque d’atteinte ganglionnaire après la CNA.
Il sera nécessaire de tester notre score sur une population externe, et lors d’une étude prospective multicentrique et comparative avec les résultats du curage axillaire, afin de confirmer ses performances, de définir sa place dans la restadification axillaire, et d’évaluer l’impact de son utilisation sur la survie des patientes.