HAL Id: tel-01478433
https://tel.archives-ouvertes.fr/tel-01478433
Submitted on 28 Feb 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Comment améliorer la qualité de la prise en charge de
l’hémorragie du post-partum en Afrique de l’Ouest ?
Julie Tort
To cite this version:
Julie Tort. Comment améliorer la qualité de la prise en charge de l’hémorragie du post-partum en Afrique de l’Ouest ?. Gynécologie et obstétrique. Université Pierre et Marie Curie - Paris VI, 2016. Français. �NNT : 2016PA066348�. �tel-01478433�
THESE DE DOCTORAT DE L’UNIVERSITE PIERRE ET MARIE CURIE
Spécialité Epidémiologie clinique
Ecole doctorale Pierre Louis de Santé Publique
Epidémiologie et sciences de l’information biomédicale - 393
Présentée par Mme Julie TORT Pour obtenir le grade de
DOCTEUR de l’UNIVERSITÉ PIERRE ET MARIE CURIE
Comment améliorer la qualité de la prise en charge de l’hémorragie du post-partum en Afrique de l’Ouest ?
Soutenue le 19 septembre 2016
Devant le jury composé de :
M. le Docteur DUMONT Alexandre, Directeur de thèse Mme le Professeur Sophie ALEXANDER-KARLIN, Rapporteur Mme le Professeur Françoise VENDITTELLI, Rapporteur Mme Le Docteur Corinne DUPONT, Examinateur M. Le Professeur Jacky NIZARD, Examinateur
3
Remerciements
Pour tout doctorant, l’écriture de la thèse permet de synthétiser trois années intenses de travaux de recherche. Cette période est également l’occasion de faire le point sur ce que le doctorat a pu apporter.
Pour ma part, mes travaux centrés sur l’hémorragie du post-partum dans le contexte de l’Afrique de l’ouest m’ont permis d’une part de développer des compétences en recherche épidémiologique ; et d’autre part, de mobiliser mes compétences cliniques pour mieux appréhender les problématiques de recherches, les analyses statistiques et la discussion des résultats. Le fait de travailler dans le contexte de pays à ressources limitées m’a, en outre, permis de découvrir d’autres problématiques liées à la prise en charge de l’hémorragie du post-partum. Enfin, j’ai pu bénéficier d’un voyage d’étude au Bénin au début de ma thèse qui m’a permis de m’immerger dans mon contexte d’étude en participant à la mise en place d’une étude pilote.
Au-delà des connaissances scientifiques, le doctorat m’a apporté plus de rigueur, d’organisation, d’autonomie et de « débrouillardise ». Il m’a également permis d’aiguiser un esprit critique et de faire preuve d’une plus large ouverture d’esprit. Ces bienfaits sont tellement importants pour appréhender le monde qui nous entoure ! Ils me suivront tout au long de ma vie et je veillerai à continuer à les faire progresser.
Pour la suite, une évolution professionnelle me permettra de continuer à participer à des travaux de recherche en épidémiologie périnatale, en France, dans le contexte de la précarité.
4
Je tiens à exprimer ma reconnaissance envers tous ceux qui, de près ou de loin, ont contribué à me faire vivre cette formidable aventure.
Je tiens en premier lieu à remercier mon directeur de thèse, Alexandre Dumont, pour m’avoir fait confiance en me permettant de travailler auprès de lui, pour son encadrement et sa disponibilité tout au long de ces trois années. J’adresse également mes remerciements à mon co-directeur de thèse, Patrick Rozenberg, pour ses conseils avisés.
Je remercie Sophie Alexander-Karlin et Françoise Vendittelli pour l'attention qu'elles ont porté à mes travaux en me faisant l'honneur d'être rapporteurs de cette thèse. J'associe à ces remerciements Corinne Dupont et Jacky Nizard pour avoir accepté d’examiner mon travail.
Je remercie Philippe Deloron, directeur de l’UMR 216 – MERIT, ainsi que toute son équipe pour leur accueil.
Je remercie les membres de l’école doctorale 393 de m’avoir ouvert les portes du doctorat en m’accordant un contrat doctoral.
Je remercie Béatrice Blondel pour avoir accompagné mes premiers pas dans le monde de la recherche en m’inculquant des méthodes de travail qui me serviront toujours.
Je remercie mes compagnons de bureaux : Aline, Blandine, Géraud, Ghislain, Sylvain, Tania et Violeta pour avoir égayé cette, parfois, trop longue traversée du désert !
Je remercie mon réseau de sages-femmes chercheuses ou chercheuses en devenir qui m’ont permis de garder le cap et de croire en l’utilité de ce que je faisais. Un merci particulier à
5
mes amies, Elsa et Isabelle, qui ont écouté avec beaucoup de patience tous mes états d’âme et qui ont su me conseiller jusqu’au bout !
Je remercie tous mes amis et ma famille, notamment mon grand-père, qui m’ont permis de relativiser et de me dire qu’il n’y a pas que la thèse dans la vie…
A mes parents qui m’ont toujours poussé plus haut (je ne peux pas aller plus haut, là !), je dis Merci. Merci de m’avoir donné la rage de vaincre et de m’accompagner dans tout ce que j’entreprends. Plus largement, je vous remercie pour TOUT. J’espère continuer à vous rendre fiers, vous le méritez.
A Marine, ma sœur, qui ne sait que trop ce que j’ai vécu durant ces trois ans, et à Antonin, mon « petit » frère. Que nous soyons ensemble ou séparés par des océans, je sais que l’on pourra toujours compter sur les uns et les autres. Vous m’êtes précieux.
A Elodie, mon amie de toujours, merci de m’accompagner depuis toutes ces années.
A Nina, ma deuxième petite « thèse », ta longue existence a démarré en parallèle de ce doctorat. Je ne sais pas s’il t’en restera quelque chose, mais pour ma part, grâce à toi, j’ai gardé les pieds sur terre et j’ai découvert que le travail de maman était des plus exigeants !
A Antoine, mon Compagnon de Vie, franchement, je ne sais plus ce que je ferais sans toi. Tu m’as permis d’emprunter ce chemin que je n’aurais peut-être pas emprunté aussi facilement sans toi. Un Merci ne suffira pas…
7
Résumé
Le ratio de mortalité maternelle en Afrique de l’Ouest est le plus élevé au monde et l’hémorragie du post-partum (HPP) est la principale cause directe de mortalité maternelle. L’objectif général de ce travail était d’identifier les déterminants individuels et organisationnels de la morbi-mortalité maternelle liée à l’HPP en Afrique de l’Ouest. Il s’agissait également de mettre en place une étude pilote pour évaluer la faisabilité d’un essai contrôlé randomisé (ECR) dont l’objectif est de tester l’efficacité du tamponnement utérin, par un dispositif composé d’une sonde urinaire et d’un préservatif, dans la stratégie de prise en charge des hémorragies du post-partum dans cette région.
Pour atteindre ces objectifs, ce travail a utilisé les données recueillies dans plusieurs formations sanitaires au Sénégal, au Mali et au Bénin.
Dans un premier temps, nous avons montré que les résultats concernant les facteurs de risques maternels de morbi-mortalité liée à l’HPP retrouvés dans les pays à ressources élevées étaient généralisables à des contextes moins favorables, comme les pays d’Afrique de l’Ouest, dont nos données sont issues. De plus, nos analyses suggèrent que la qualification du médecin en charge du service de maternité (médecin généraliste versus gynécologue-obstétricien) a un impact déterminant sur la survie des femmes présentant une HPP dans ce contexte.
Dans un deuxième temps, nous avons montré que l'injection d'ocytocine dans les dix minutes qui suivent le diagnostic d’HPP était un facteur déterminant pour améliorer la santé
8
maternelle au Bénin et au Mali. Le diagnostic rapide de l’HPP et une meilleure surveillance du post-partum immédiat étaient également importants.
Enfin, dans un troisième temps, les résultats de l’étude pilote mise en place au Bénin ont montré que la mise en place d’un essai contrôlé randomisé était faisable, et ont apporté des connaissances supplémentaires pour optimiser le protocole de recherche.
Ainsi, nous avons identifié un certain nombre de facteurs sur lesquels des actions doivent être menées pour améliorer la qualité de la prise en charge de l’HPP, et ainsi contribuer à réduire la morbi-mortalité maternelle en Afrique de l’Ouest. Les résultats de l’ECR permettront de confirmer si le tamponnement intra-utérin par le dispositif sonde urinaire – préservatif doit faire partie de la stratégie thérapeutique de cette pathologie dans cette région.
Mots-clés : hémorragie du post-partum, Afrique de l’Ouest, morbi-mortalité maternelle, qualité des soins, ocytocine, tamponnement utérin.
9
How to improve the quality of postpartum hemorrhage management in
West Africa ?
Summary
The ratio of maternal mortality in West Africa is the highest in the world and postpartum hemorrhage (PPH) is the leading direct cause of maternal mortality.
The objective of this work was to analyze the characteristics of women, organization of health facilities and clinical management of PPH in West Africa associated with maternal morbidity and mortality. The objective was also to test the feasibility of a randomized controlled trial to assess the effectiveness of uterine tamponade with a device composed of a urinary catheter and a condom for the management of PPH in West Africa.
To achieve these objectives, data collected in several health facilities in Senegal, Mali and Benin have been analyzed.
We showed that the maternal risk factors for maternal morbidity and mortality related to the PPH found in high-resource countries were generalizable to the contexts of limited resources countries such as West African countries in which our data are from. In addition, our results suggest that the qualification of the doctor in charge of the maternity unit (general practitioner versus obstetrician) has a decisive impact on the survival of women with PPH in this context; and the rapid injection of oxytocin by health staff (within ten minutes after the diagnosis of PPH) is also decisive.
10
Furthermore, the results of the pilot study in Benin have stated that a large randomized controlled trial is feasible after adjusting the research protocol. In particular, additional centers should be included to recruit the required number of subjects on an acceptable time.
Thus, we have identified a number of factors on which action must be taken to improve the quality of the PPH management, and thus contribute to reduce maternal morbidity and mortality related to PPH in Africa. The results of the RCT will confirm or not whether tamponade intrauterine by the urinary catheter - condoms device should be part of the therapeutic strategy of PPHy in West Africa.
Keywords: postpartum hemorrhage, West Africa, maternal morbidity and mortality, quality of care, oxytocin, oxytocin, uterine tamponade.
11
Laboratoire d’accueil
IRD – Institut de Recherche pour le Développement UMR 216 « Mère et enfant face aux infections tropicales »
Adresse à Paris,
Université Paris Descartes
Faculté de pharmacie - Laboratoire de parasitologie 4, avenue de l’observatoire. 75006 Paris, FRANCE
Adresse à Cotonou,
Université d’Abomey-Calavi
Faculté des Sciences de la Santé – Institut des Sciences Biomédicales Appliquées 01 BP 188 Cotonou, BENIN
12
Listes des publications réalisées dans le cadre de cette thèse
1) Tort J, Hounkpatin B, Popowski T, Traore M, Bodin C, Perrin R, Rozenberg P, Dumont
A. A Randomized Controlled Trial to Test the Effectiveness of Intrauterine Balloon Tamponade with Condom Catheter in Severe Postpartum Hemorrhage Management: A Feasibility Study in Benin. J Women’s Health Care 2013; 2: 135.
2) Tort J, Rozenberg P, Traoré P, Fournier P, Dumont A. Factors associated with postpartum hemorrhage maternal death in referral hospitals in Senegal and Mali: a cross-sectional epidemiological survey. BMC Pregnancy and Childbirth 2015 ; 15:235
3) Tort J, Traore M, Hounkpatin B, Bodin C, Rozenberg P, Dumont A. Initial management
of postpartum hemorrhage: A cohort study in Benin and Mali. Int J Gynaecol Obstet.
13
Sommaire
Introduction générale et objectifs ... 17
Revue de la littérature et problématique de recherche ... 26
A. Définition et épidémiologie de l’hémorragie du post-partum en Afrique de l’Ouest ... 27
1. Définition de l’HPP... 27
2. Définition de l’HPP sévère ... 28
3. Incidence de l’hémorragie du post-partum en Afrique de l’Ouest ... 29
4. Etiologies et facteurs de risque de l’HPP ... 33
5. Conséquences : morbidité et mortalité ... 36
B. La qualité des soins de l’hémorragie du post-partum dans les structures de santé d’Afrique de l’Ouest ... 39
1. Pourquoi s’intéresser à la qualité des soins de l’hémorragie du post-partum dans les structures de santé d’Afrique de l’Ouest ? ... 39
2. Cadre conceptuel de la qualité des soins ... 43
3. Prise en charge de l’hémorragie du post-partum : procédures de soins et organisation des structures de santé ... 44
C. Problématique et objectifs ... 51
Méthodes et résultats ... 54
A. Présentation de l’essai contrôlé randomisé QUARITE ... 55
B. Première étude ... 62
1. Aspects méthodologiques ... 62
2. Résultats ... 67
3. Discussion ... 74
C. Présentation de l’essai TIUHPPI ... 81
D. Deuxième étude ... 88
1. Aspects méthodologiques ... 88
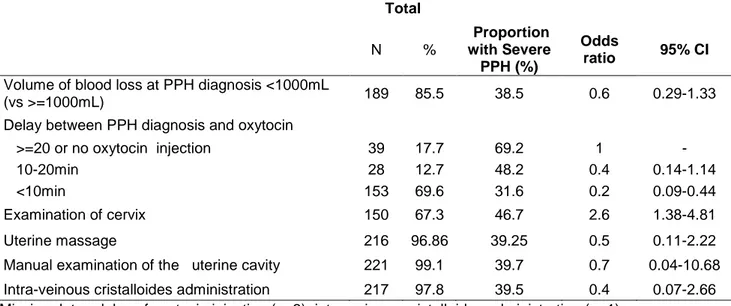
14 3. Discussion ... 98 E. Troisième étude ... 102 1. Aspects méthodologiques ... 102 2. Résultats ... 109 3. Discussion ... 116 Synthèse et perspectives ... 122 Bibliographie... 131 Annexes ... 145
15
Liste des abréviations
AIRD : Agence Inter-établissement de la Recherche pour le Développement ASS : Afrique Sub-Saharienne
ECR : Essai Contrôlé Randomisé EIG : Effet Indésirable Grave
Hb : Hémoglobine
HPP : Hémorragie du Post-Partum
HRP : Hématome rétro-placentaire
GATPA : Gestion Active de la Troisième Phase de l’Accouchement
IC : Intervalle de Confiance
OMD : Objectifs du Millénaire pour le Développement
OMS : Organisation Mondiale de sa Santé
ONU : Organisation des Nations Unies
OR : Odd Ratio
SAGO : Société Africaine des Gynécologues-Obstétriciens
16
UNICEF: United Nations International Children’s Emergency Fund
17
18
Selon l’Organisation Mondiale de la Santé (OMS), la mortalité maternelle se définit par « le décès d'une femme survenu au cours de la grossesse ou dans un délai de 42 jours après sa terminaison, quelle qu'en soit la durée ou la localisation, pour une cause quelconque déterminée ou aggravée par la grossesse ou les soins qu'elle a motivés, mais ni accidentelle ni fortuite »(Organisation Mondiale de la Santé 1977). On distingue les causes directes de décès maternel (liées à des complications obstétricales pendant la grossesse, l’accouchement ou le post-partum) et les causes indirectes (liées aux complications de pathologies préexistantes).
Le nombre de décès maternels dans le monde estimé par l’OMS en 2013 était de 289000,
soit un ratio de mortalité maternelle de 210 décès pour 100 000 naissances vivantes(WHO
2014). Près de 99% de ces décès se concentrent dans les régions où les ressources sont les plus limitées. La région de l’Afrique de l’Ouest, située dans la zone sub-saharienne du continent, est la plus touchée (figure 1). Son ratio de mortalité maternelle était de 468,9 (IC95%=[385,4-564,0]) décès maternels pour 100000 naissances vivantes en 2013 (Kassebaum et al 2014). En comparaison, ce ratio s’élevait à 16,0 décès maternels pour 100000 naissances vivantes (IC95%[14.9-17.0]) dans les pays à ressources élevées (Kassebaum et al 2014).
19 Figure 1: Ratio de mortalité maternelle dans le monde pour 100 000 naissances vivantes
(Organisation Mondiale de la Santé, 2014)
L’intérêt porté par la communauté internationale à la problématique de la mortalité maternelle dans les pays à ressources limitées n’est que relativement récente. En effet, la première estimation du nombre annuel de décès maternels dans ces régions a été faite en 1985 par l’OMS (Rosenfield and Maine 1985). Par la suite, plusieurs appels à une réduction substantielle de la mortalité maternelle ont été lancés et différentes stratégies ont été définies. Les connaissances sur les interventions efficaces se sont améliorées. En 2000, l’organisation des Nations Unies fixa huit « Objectifs du Millénaire pour le Développement », dont une des cibles était de baisser de trois quart la mortalité maternelle dans chaque pays
entre 1990 et 2015 (Objectifs du Millénaire pour le développement (OMD) 2014 )(objectif
5). En 2013, les estimations ont montré que la mortalité maternelle avait diminué globalement de 45% depuis 1990. Cependant, en Afrique de l’Ouest, l’évolution était moins
20
rapide que dans d’autres régions où le ratio de mortalité maternelle était également élevé en 1990, comme en Asie du sud (Kassebaum et al 2014). L’Objectif 5 du Millénaire pour le Développement ne sera pas atteint dans la plupart des pays d’Afrique occidentale.
Les principales causes de décès maternels sont : l’hémorragie ; les infections ; les troubles hypertensifs, notamment l’éclampsie ; les dystocies du travail ; et les complications de l’avortement. L’hémorragie est la principale cause directe de mortalité maternelle en Afrique de l’Ouest (Kassebaum et al 2014), avec les complications de l’avortement. Elle est responsable de 17% de ces décès dans cette région, ce qui représente environs 11990 décès maternels par an. Près des deux tiers de ces décès surviennent pendant la période du post-partum (Say et al. 2014).
L’hémorragie du post-partum (HPP) constitue une urgence obstétricale. Elle peut être prévenue et traitée en suivant des lignes directrices basées sur une évidence scientifique et des consensus d’experts nationaux et internationaux. En cas de prise en charge inefficace, le décès peut survenir dans les deux heures.
Le défi pour les pays à faibles ressources, et plus particulièrement pour ceux de l’Afrique de l’ouest, est de mettre en œuvre ces traitements en temps utile. Différents facteurs peuvent influencer les délais du traitement de l’HPP dans cette région. Un nombre important de femmes accouchent en dehors des structures de santé, en particulier dans les zones rurales (Crowe et al. 2012). Le risque de retard dans le diagnostic est donc très élevé. Ensuite, le manque de transport ainsi que le mauvais état des routes et les distances souvent très importantes, sont également à l’origine des retards dans la prise en charge. Les femmes
21
risquent d’arriver dans une structure de santé dans un état moribond et trop tardivement pour bénéficier de soins d’urgence salvateurs. Cependant, la majorité des femmes meurent dans les maternités (Ronsmans and Graham 2006). La qualité des soins hospitaliers jouent un rôle important dans la mortalité maternelle (Ronsmans and Graham 2006; Knight, Self, and Kennedy 2013)(Bouvier-Colle et al. 2001). En effet, La qualité des soins dans les structures de santé d’Afrique de l’Ouest est très hétérogène et souvent insuffisante (Manasyan et al. 2013; Pearson and Shoo 2005). Les ressources inconstamment disponibles (bloc opératoire, banque de sang, médicaments essentiels…), le manque de personnel qualifié, les pratiques cliniques hétérogènes et les traitements coûteux (Knight, Self, et Kennedy 2013) sont régulièrement mis en cause.
Parce que la plupart des décès par HPP sont dus à des soins sous-optimaux dans les structures de santé et sont donc évitables (Bouvier-Colle et al. 2001), l’amélioration de la qualité de la prise en charge de cette pathologie est un défi important pour les pays d’Afrique de l’Ouest. Peu de données épidémiologiques sur l’HPP sont disponibles dans cette région. Or, connaitre précisément les caractéristiques des femmes ; les ressources humaines et matérielles disponibles dans les maternités ; et les composants de la prise en charge clinique associées à une morbi-mortalité maternelle élevée en cas d’HPP permettrait, d’une part, un meilleur repérage des femmes à risque, et d’autre part, une amélioration de l’organisation des services de santé et de la qualité de la prise en charge clinique des HPP, et de ce fait, pourrait contribuer à une diminution de la mortalité maternelle.
Par ailleurs, l’évaluation de l’efficacité de nouveaux traitements adaptés au contexte des pays en développement est également importante. Le tamponnement utérin à l’aide d’un
22
ballonnet, utilisé dans certains pays développés, est intégré depuis quelques années à l’ensemble thérapeutique de la prise en charge des HPP dans les pays en développement. Il existe différents dispositifs. L’un d’entre eux est constitué d’une sonde urinaire et d’un préservatif, et est appelé «condom-catheter». Ce dernier représente un traitement prometteur avec un taux de succès de 91,7% (Tindell et al. 2013). Ce dispositif est, de plus, économique. Cette solution serait donc particulièrement adaptée aux pays à ressources limitées. Néanmoins, aucun essai contrôlé randomisé (ECR) n’a évalué son efficacité et l’OMS considère comme importantes les recherches sur ce sujet (World health Organization 2012).
Ainsi, l’objectif général de ce travail était d’analyser les caractéristiques des femmes ; de l’organisation des structures de santé ; et de la prise en charge clinique des HPP, dans trois pays d’Afrique de l’ouest (Bénin, Mali et Sénégal), associées au pronostic maternel, afin d’apporter des éléments d’aide à la décision concernant l’amélioration de la prise en charge de cette pathologie. Plus particulièrement, nous avons:
• Dans une première étude, étudié l’association entre les facteurs institutionnels et
maternels et la mortalité maternelle en cas d’HPP,
• Dans une deuxième étude, étudié l’association entre les facteurs de soins de la prise
en charge initiale de l’HPP et l’HPP sévère,
• Dans une troisième étude, évalué la faisabilité d’un essai contrôlé randomisé dont
23
urinaire-préservatif dans la stratégie de prise en charge des hémorragies du post-partum en Afrique sub-saharienne.
Pour atteindre ces objectifs, ce travail a utilisé les données recueillies par deux projets différents.
Le premier projet, nommé QUARITE (QUAlity of care, RIsk management, and TEchnology in obstetrics to reduce hospital-based maternal mortality in Senegal and Mali), était un essai contrôlé randomisé en grappes dont l’objectif était d’évaluer l’efficacité d’une intervention multiforme basée sur les revues de décès maternels et la formation continue aux gestes obstétricaux d’urgence. Le critère de jugement principal était la diminution de la mortalité maternelle hospitalière. Quarante-six hôpitaux de référence ont été inclus au Sénégal et au
Mali. La période d’étude s’étalait du 1er septembre 2007 au 30 octobre 2011, incluant une
année de pré-intervention et de post-intervention ainsi que deux années d’intervention. Toutes les femmes ayant accouché dans un des centres participant, durant la période d’étude étaient incluses et leur données étaient recueillies. Des données sur les ressources disponibles dans chaque centre étaient également recueillies.
J’ai utilisé les données recueillies lors de ce projet pour étudier les facteurs institutionnels et maternels associés au pronostic des HPP. Ceci a fait l’objet d’un premier article.
Le deuxième projet, dénommé TIUHPPI (Tamponnent Intra-Utérin pour l’Hémorragie du Post-Partum Immédiat), est un essai contrôlé randomisé individuel dont l’objectif était de tester l’efficacité du tamponnement utérin par « condom-catheter » dans la prise en charge des HPP réfractaires aux traitements de la première ligne. Il a été mené par l’équipe de
24
l’UMR 216 – MERIT dans quatre centres hospitaliers du Bénin, ainsi que dans trois centres hospitaliers du Mali. Tous les centres étaient situés en zone urbaine. Toutes les femmes ayant accouché par voie basse dans l’un de ces centres et chez qui une HPP était diagnostiquée étaient incluses dans l’étude, et leurs données épidémiologiques étaient recueillies à l’aide d’un questionnaire standardisé. Lorsque les saignements persistaient à la suite de l’administration des traitements de première ligne, les femmes étaient randomisées en deux bras d’intervention (i) misoprostol + tamponnement utérin, et (ii) misoprostol seul. l’analyse statistique des données collectées à mi-étude sur l’ensemble des femmes incluses, m’a permis d’étudier l’association entre les facteurs de soins de la prise en charge initiale des HPP et la sévérité des HPP. Ces résultats ont conduit à l’écriture d’un deuxième article.
Par ailleurs, j’ai été impliquée dans le projet TIUHPPI dès son début en participant, par le biais d’une mission sur le terrain, à la mise en place d’une phase pilote de 4 mois au Bénin, qui m’a permis d’évaluer la faisabilité de cet ECR dans un contexte de pays à ressources limitées. Il s’agissait d’identifier les problèmes concernant la capacité des cliniciens à recruter des femmes répondant aux critères d’inclusion, l’acceptabilité du dispositif « condom-catheter » par les cliniciens et la tolérance des femmes vis-à-vis de ce dispositif, et de proposer des solutions. Ce travail a donné lieu à l’écriture d’un troisième article.
Outre cette introduction, ce manuscrit comportera trois parties. Une première partie relatera les généralités sur l’épidémiologie de l’hémorragie du post-partum en Afrique sub-saharienne et la qualité des soins liés à l’hémorragie du post-partum dans ce contexte. Une deuxième partie présentera la méthodologie des projets QUARITE et TIUHPPI ; ainsi que les
25
aspects méthodologiques, les résultats, et la discussion de chacune des trois études menées pour répondre aux objectifs de cette thèse. Enfin, nous ferons une synthèse globale des résultats de notre travail, puis nous proposerons des perspectives de recherches.
26
Revue de la littérature et problématique de
recherche
27
A.
Définition et épidémiologie de l’hémorragie du post-partum en
Afrique de l’Ouest
1. Définition de l’HPP
L’Organisation Mondiale de la santé définit l’HPP par la perte d’un volume sanguin supérieur à 500mL dans les 24 heures suivant un accouchement (World health Organization 2012). Cette définition est la plus communément utilisée à travers le monde, et cela, depuis plus de 50 ans (Joyce and Lennon 1948). Cependant, elle comporte certaines limites. En effet, le seuil de 500mL, a été fixé arbitrairement à partir d’études de quantification des saignements après l’accouchement publiées dans les années cinquante qui évaluaient la pertes moyennes des saignements à 300-550mL après un accouchement vaginal et 500-1100mL après une césarienne (Pritchard 1965; Wilcox, Hunt, and Owens 1959; Newton et al. 1961). Cette définition implique qu’un volume de pertes sanguines plus faible est bien toléré par les femmes et sans risque. Or, l’impact des pertes sanguines sur la stabilité hémodynamique dépend de l’état de santé préexistant de la femme. En Afrique de l’Ouest, les prévalences de l’anémie sévère et des pathologies cardio-vasculaires sont particulièrement élevées (Stevens et al. 2013; Ikem and Sumpio 2011). Dans ces cas, les signes d’une mauvaise tolérance clinique (tachycardie, chute de la pression artérielle, pâleur, sudation…) peuvent se manifester avant que le volume des pertes sanguines n’atteigne le seuil de 500mL.
Certains auteurs se sont questionnés sur la possibilité d’associer à cette définition l’apparition des signes cliniques liés à l’instabilité hémodynamique (tachycardie, hypotension essentiellement) (Oyelese et al. 2007). La Société Africaine des Gynécologues et
28
Obstétriciens a d’ailleurs défini, dans ces recommandations pour la prise en charge des urgences obstétricales, l’HPP comme un saignement « de quantité supérieur à 500mL et/ou ayant un retentissent sur l’état de la mère » (OMS, SAGO, and UNFPA 2010). Cependant, les signes cliniques liés à l’instabilité hémodynamique apparaissent généralement après la perte d’un volume sanguin correspondant à 15-25% du volume sanguin total. Les saignements sont déjà importants et il peut être déjà trop tard pour intervenir efficacement afin de prévenir un épisode de morbidité sévère ou un décès.
Devant les limites d’une définition de l’HPP basée sur le volume des pertes sanguines, d’autres propositions de définition ont été faites. Parmi celles-ci, on retrouve une baisse de l’hémotacrite de plus de 10% (Combs, Murphy, et Laros 1991) ou une chute du taux d’hémogobine supérieure à 2g/dL (Dupont et al. 2014). Cependant, si ces définitions permettent un diagnostic objectif à des fins de recherches, leur utilité semble moins évidente dans un contexte d’urgence. Par ailleurs, la disponibilité d’un laboratoire pour doser ces deux marqueurs est souvent inconstante dans les structures de santé d’Afrique l’Ouest, et le coût pour effectuer ces analyses représente une barrière financière non négligeable pour les femmes dans ce contexte.
2. Définition de l’HPP sévère
Il n’y a pas de définition consensuelle de l’HPP sévère. Parmi les définitions recensées dans la littérature scientifique, différents éléments sont pris en comptes. Nous retrouvons le volume des pertes sanguines dont le seuil est variable (entre 1000 et 2000 mL) et parfois
29
combiné aux premiers signes de la décompensation cardio-vasculaire (Al-Zirqi et al. 2008; Briley et al. 2014; Calvert et al. 2012; Mousa, Cording, and Alfirevic 2008; Prick et al. 2015). La chute du taux d’hémoglobine de plus de 4g/dL peut également être considérée (Deneux-Tharaux et al. 2010). Les limites liées à ces éléments de définition sont les mêmes que ceux évoquées ci-dessus.
Enfin, le recours à une prise en charge invasive incluant la transfusion, les traitements chirurgicaux (ligatures vasculaires, hystérectomie), l’embolisation artérielle, l’hospitalisation en unité de réanimation ou l’existence d’un décès maternel peuvent également être pris en compte (Kramer et al. 2013; Al-Zirqi et al. 2008). Cependant, ses éléments sont dépendants des pratiques et de l’existence des ressources qui peuvent varier considérablement d’une structure de santé à une autre en Afrique de l’Ouest (Choo et al. 2010).
3. Incidence de l’hémorragie du post-partum en Afrique de l’Ouest
L’étude de l’incidence de l’HPP en Afrique de l’Ouest présente plusieurs difficultés. Tout d’abord, contrairement aux pays à ressources élevées, peu de données issues d’études en population, permettant une estimation fiable de l’incidence de l’HPP, y sont disponibles. De telles études sont difficiles à mettre en place dans cette région. Il existe peu d’enregistrements systématiques de données de santé à l’échelle d’un territoire, telles que les bases de données hospitalières des pays à ressources élevées. Par ailleurs, les femmes accouchent en grande partie en dehors des structures de santé, ce qui complique la mise en place d’un recueil de données.
30
Ensuite, certains facteurs peuvent entrainer une variation des estimations de l’incidence de l’HPP : l’hétérogénéité des définitions de l’HPP, que l’on vient d’évoquer ; l’hétérogénéité des méthodes de mesure du volume des pertes sanguines ; l’existence ou non d’une injection prophylactique d’ocytocine durant la troisième phase du travail. En Afrique de l’ouest, le volume des pertes sanguines après l’accouchement est le plus souvent estimé visuellement par les cliniciens. Or, cette méthode subjective entraine une sous-estimation des pertes sanguines les plus importantes et une surestimation des pertes sanguines les moins importantes, même par les cliniciens les plus expérimentés (Stafford et al. 2008; Yoong et al. 2010; Maslovitz et al. 2008; Dildy et al. 2004; Larsson et al. 2006; Toledo et al. 2007; Patel et al. 2006; Al Kadri, Al Anazi, and Tamim 2011; Razvi et al. 1996). Des méthodes plus objectives peuvent être utilisées en pratique clinique comme l’utilisation d’un sac de recueil, ou la pesée de textiles ou vêtements qui ont absorbé les saignements.
Par ailleurs, l’injection prophylactique d’ocytocine durant la troisième phase du travail permet une diminution de 50% de la survenue de l’HPP (Westhoff, Cotter, and Tolosa 2013). Cette intervention est recommandée mais n’est pas systématique dans les formations sanitaires ouest-africaines et peut donc entrainer une variation de l’incidence de l’HPP en fonction de sa prise en compte dans les études.
Une seule étude en population (Prual et al. 2000), publiée en 2000 dans cette région, a été retrouvée. Cette étude estimait uniquement l’incidence des HPP sévères définies par le recours à une transfusion sanguine, ou une hospitalisation de plus de 4 jours, ou une hystérectomie, ou un décès. L’incidence estimée était de 1.7 pour 100 femmes enceintes. Cette incidence était proche de celles retrouvées dans les études en population provenant
31
de pays à ressources élevées. En Norvège, l’incidence de l’HPP sévère, définit par la perte d’un volume sanguin supérieur à 1500mL ou le recours à une transfusion sanguine, était de 1,1% (Al-Zirqi et al. 2008). En France, l’incidence de l’HPP sévère, définit par la perte d’hémoglobine supérieure à 4 g/dL ou le recours à un traitement chirurgical ou une transfusion ou un transfert en réanimation ou le décès, était de 1,7% (Dupont et al. 2014). Enfin, aux Etats-Unis, l’estimation de l’incidence de l’HPP sévère, définit selon la 9e version de la Classification International des Maladies de l’OMS, était moins élevée et était de 4,2 pour 1000 (Kramer et al. 2013)
Une revue systématique a récemment étudié les incidences de l’HPP (>500mL) et de l’HPP sévère (> 1000mL) dans les différentes régions du monde (Calvert et al. 2012). Les méthodes de mesures des pertes sanguines et les méthodologies des études incluses étaient très hétérogènes. Parmi les bases de données incluses dans cette méta-analyse, 6 provenaient d’études menées en Afrique et incluaient 2738 femmes. Les données provenaient exclusivement d’essais contrôlés randomisés mis en place dans des centres de soins primaires ou à domicile. Les incidences africaines étaient plus élevées que celles des autres régions. L’incidence estimée de l’HPP en Afrique était de 25,7% (IC95% = [13,9% - 39,7%]) ; tandis que l’incidence de l’HPP sévère était de 5,1% (IC95%=[0,3-15,3]). En comparaison, dans les autres régions, l’incidence de l’HPP variait de 8,2% (IC95%=[6,1-10,4]) en Amérique Latine et dans les Caraïbes à 13,1% (IC95%=[6,3-21,7]) en Amérique du Nord. L’incidence de l’HPP sévère variait de 1,9% (IC95%=[1,2-2,8]) en Asie à 4,3%(IC95%=[3,9-4,7]) en Amérique du Nord.
Lorsque les pertes sanguines étaient mesurées par une méthode objective, l’incidence de l’HPP étaient plus élevée et était de 28,0% (IC95%= [2,7–24,5]) en Afrique. En comparaison,
32
dans les autres régions, l’incidence variait de 10,0% (IC95%=[8,2-12,0]) en Asie à 22,9% (IC95%=[6,3-21,7]) en Europe. Les pertes sanguines étaient toutes mesurées objectivement dans les études qui évaluaient l’incidence des HPP sévères en Afrique.
Il existait de grandes variations régionales qui sont demeurées en grande partie inexpliquées.
Une autre méta-analyse antérieure rapportait des incidences moins élevées pour l’Afrique (Carroli et al. 2008). L’incidence de l’HPP dans cette étude était de 10,45 % (IC95%=[9,95-10,95]) (8,57% (IC95%=[8,06-9,08] pour l’Afrique de l’ouest) ; celle de l’HPP sévère était de 2,21% (IC95%=[2,01-2,41]) (2,20% (IC95%=[1,93-2,46] pour l’Afrique de l’Ouest). Cependant, Les critères d’inclusions des études variaient entre ces deux méta-analyses ce qui peut expliquer ces différences.
Enfin, une analyse secondaire (Sheldon et al. 2014) des données issues d’une étude transversale mise en place par l’OMS entre 2010 et 2011, dans des structures de santé réalisant plus de 1000 accouchements par an et possédant un bloc opératoire, et incluant 5 pays d’ASS, a montré une incidence de l’HPP de 1,4%. Cependant, la définition de l’HPP utilisée n’était pas précisée.
33
4. Etiologies et facteurs de risque de l’HPP
Peu de données concernant la distribution des étiologies et des facteurs de risques de l’HPP sont issues des pays à ressources limitées contrairement aux pays à ressources élevées. Aucune donnée étiologique provenant d’études en population n’a été retrouvée en ASS.
Par ailleurs, différentes considérations méthodologiques peuvent faire varier la distribution des causes de l’HPP d’une étude à l’autre. Certaines étiologies peuvent être considérées comme étant des étiologies de l’hémorragie antépartum ou intrapartum, comme les anomalies d’insertion du placenta ou l’hématome rétro-placentaire. Ensuite, l’HPP peut avoir plusieurs causes, mais certaines études n’en considèrent qu’une. Enfin, l’origine des données peut avoir un impact important sur la distribution des causes de l’HPP. En effet, les études dont les données sont issues des dossiers médicaux peuvent inclure des HPP dont l’étiologie est inconnue, ce qui n’est pas le cas des études analysant les bases de données hospitalières renseignées avec les codes de la Classification Internationale des Maladie de l’OMS car il n’y a pas de code correspondant à ce cas.
Les causes de l’HPP peuvent être classées en quatre catégories (Oyelese and Ananth 2010) : • l’atonie utérine ;
• les anomalies placentaires : placenta prævia, placenta accrêta et percréta,
hématome rétro-placentaire, rétention placentaire ;
• les traumatismes de la filière génitale : épisiotomie, déchirures vaginales ou cervicales, saignements liés à l’hystérotomie ;
34
• les anomalies de la coagulation.
Les résultats de deux études en population issues de pays à ressources élevées (Brian T Bateman et al. 2010; Dupont et al. 2014) ont montré que l’atonie utérine est la cause la plus fréquente d’HPP, retrouvée dans 30 à 80% des cas. L’atonie utérine résulte d’un défaut de contraction du muscle utérin après le clivage entre le placenta et le myomètre ce qui empêche la compression des vaisseaux sanguins se situant au niveau de l’insertion placentaire. La rétention placentaire (10 à 30% des cas), les traumatismes de la filière génitale (8% des cas) et l’hémorragie liée à l’hystérotomie ou au décollement vésico-utérin ou des sinus en cas d’accouchement par césarienne (17%) sont les autres causes principales. Ces trois étiologies sont également principalement retrouvées dans des études provenant de pays d’ASS (Tsu 1993; Tebeu et al. 2013; Ajenifuja, Adepiti, and Ogunniyi 2010). L’atonie utérine est retrouvée dans 16 à 50% des HPP, les traumatismes de la filière génitale dans 10 à 36% des HPP et la rétention placentaire dans 8 à 40% des HPP.
Les facteurs de risques de la survenue d’une HPP retrouvés dans la littérature (Brian T. Bateman et al. 2010; Sheiner et al. 2005; Selo-Ojeme and Okonofua 1997; Wetta et al. 2013; Grotegut et al. 2011) sont généralement des facteurs de risque de l’atonie utérine, des traumatismes de la filière génitale et des coagulopathies. Ils peuvent être classés en deux catégories : 1) les facteurs de risque prénataux qui inclus les caractéristiques de la femme et de sa grossesse ; 2) et les facteurs de risque intrapartum qui inclus les caractéristiques liées à la prise en charge de l’accouchement. Dans la première catégorie l’âge maternel avancé, la primiparité et la grande multiparité, un BMI élevé, la grossesse multiple, l’antécédent d’HPP ou de césarienne, les pathologies hypertensives gestationnelles, l’anémie, les anomalies de
35
l’hémostase, les cardiopathies, l’hydramnios, la chorioamniotite et la macrosomie sont fréquemment retrouvés comme étant des facteurs de risques de l’HPP. Dans la deuxième catégorie, on retrouve fréquemment le déclenchement artificiel du travail, le travail prolongé, l’injection d’ocytocine pendant le travail, l’accouchement par césarienne ou par voie basse instrumentale, les déchirures cervico-vaginales et l’épisiotomie, l’absence de prévention de l’HPP durant la 3e phase du travail (l’injection d’ocytocine notamment) et enfin, un poids néonatal élevé.
Peu d’études, dont la méthodologie assure une validité externe importante des résultats, proviennent de pays d’Afrique de l’Ouest. Il est donc difficile de savoir si ces facteurs de risques se retrouvent dans cette région. Cependant l’âge maternel élevé, la primiparité et la grande multiparité, l’anémie, le travail prolongé et l’absence de geste de prévention de l’HPP durant la 3e phase du travail (injection d’ocytocine) sont également retrouvés dans des études unicentriques ou multicentriques d’Afrique sub-saharienne (Tsu 1993; Selo-Ojeme and Okonofua 1997; Ijaiya, Aboyeji, and Abubakar 2003) ; ainsi que dans une étude dont les données sont issues de plusieurs pays en développement et émergents (Sheldon et al. 2014). Par ailleurs, une étude de l’OMS, menée dans plusieurs pays d’Afrique sub-saharienne a montré que l’existence d’une mutilation sexuelle de 2e catégorie (excision) ou 3e catégorie (infibulation) augmentait significativement le risque de survenue d’une HPP (Eke and Nkanginieme 2006).
Concernant l’HPP sévère, les facteurs de risques prénataux et péripartum cités ci-dessus sont également retrouvés dans des études en population (Dupont et al. 2014; Kramer et al. 2013;
36
Khireddine et al. 2013; Le Ray et al. 2011; Belghiti et al. 2011; Driessen et al. 2011; Al-Zirqi et al. 2008). Deux autres catégories de facteurs de risque peuvent être incluses:
• la prise en charge initiale de l’HPP ; • les facteurs organisationnels.
Driessen et al ont étudié ces facteurs en France (Driessen et al. 2011) et ont montré que les retards dans la prise en charge initiale de l’HPP étaient associés à une augmentation du risque d’HPP sévère. Le statut de l’hôpital était également un facteur associé à la sévérité de l’HPP, car lié aux ressources humaines et matérielles disponibles pour la prise en charge de l’HPP. En revanche, il n’existe aucune étude sur les effets du traitement initial et des facteurs organisationnels en Afrique de l’Ouest.
Si de nombreux facteurs de risque sont donc bien identifiés et permettent de repérer les femmes les plus à risque pour les prendre en charge efficacement, une large proportion de femmes, chez qui va survenir une HPP, ne présente aucun facteur de risque identifiable.
5. Conséquences : morbidité et mortalité
L’HPP importante et qui perdure entraîne une perte de volume intra-vasculaire et une baisse de la distribution d’oxygène aux tissus et aux organes. Des mécanismes compensatoires physiologiques tels que la tachycardie réflexe, la vasoconstriction périphérique et une contractilité accrue du myocarde aident à maintenir l’irrigation des
37
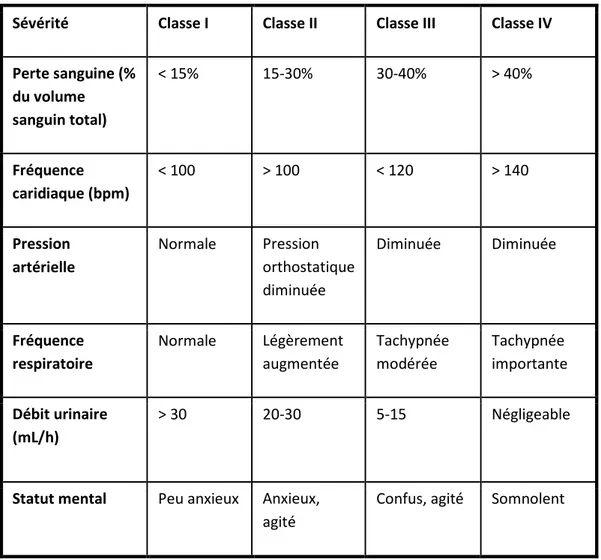
tissus. Le tableau 1 présente les symptômes cliniques en fonction de la quantité de sang perdu.
Sévérité Classe I Classe II Classe III Classe IV
Perte sanguine (% du volume sanguin total) < 15% 15-30% 30-40% > 40% Fréquence caridiaque (bpm) < 100 > 100 < 120 > 140 Pression artérielle Normale Pression orthostatique diminuée Diminuée Diminuée Fréquence respiratoire Normale Légèrement augmentée Tachypnée modérée Tachypnée importante Débit urinaire (mL/h) > 30 20-30 5-15 Négligeable
Statut mental Peu anxieux Anxieux, agité
Confus, agité Somnolent
Tableau 1 : Classification clinique des chocs hémorragiques de l’American College of Surgeon
(American College Of Surgeons Commitee on Trauma 1997)
La perte sanguine ininterrompue finit par entraîner un collapsus circulatoire, des lésions des organes vitaux et finalement la mort.
38
L’HPP est la principale cause directe de mortalité maternelle en Afrique de l’Ouest. La distribution de l’HPP dans les causes de décès maternels varie entre 8,0% (IC95%=[4,7-15,5]) dans les pays développés et 19,7% (IC95%=[12,9-29,0]) dans les pays à ressources limitées. Plus particulièrement, l’HPP est responsable de 15,2%(IC95%=[8,6-25,1]) des décès maternels en Afrique de l’Ouest (Say et al. 2014).
L’HPP peut également entrainer un décès évité de justesse (« near miss ») identifié par l’existence de signes cliniques, incluant les signes de choc hémorragique ; des marqueurs biologiques de dysfonctions organiques sévères ; ou par le recours à certains gestes cliniques pour le sauvetage maternel, incluant notamment la transfusion sanguine et l’hystérectomie (Pattinson et al. 2009). Une revues systématique a montré que l’hémorragie était une des causes principales des décès évités de justesse en Afrique Sub-saharienne (Kaye, Kakaire, and Osinde 2011).
L’HPP est également responsable d’un risque augmenté de thrombose et de sepsis grave, et d’une morbidité qui peut perdurer sur le long terme incluant l’anémie, la nécrose de l’hypophyse (syndrome de Sheehan), l’atteinte cardiaque.
Enfin, lors de la prise en charge de l’HPP, le recours à la transfusion sanguine comporte des risques infectieux et immunologiques, et l’hystérectomie aura des conséquences irréversibles sur la fertilité ultérieure de la femme.
39
B.
La qualité des soins de l’hémorragie du post-partum dans les structures de
santé d’Afrique de l’Ouest
1. Pourquoi s’intéresser à la qualité des soins de l’hémorragie du
post-partum dans les structures de santé d’Afrique de l’Ouest ?
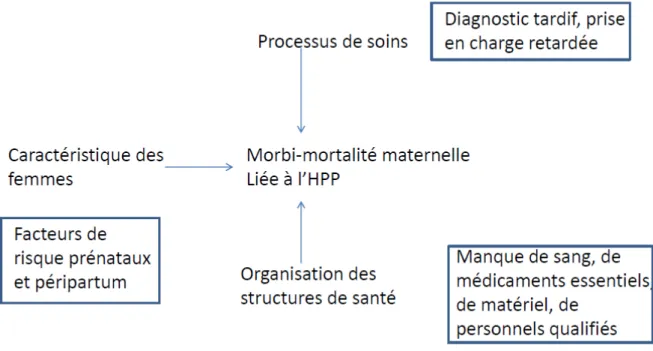
L’hémorragie du post-partum est une urgence obstétricale. Elle doit être diagnostiquée et prise en charge rapidement. Cependant, le diagnostic et la prise en charge peuvent être retardés à plusieurs niveaux. Thaddeus & Maine ont identifié trois principaux délais dans la prise en charge des complications obstétricales qui contribuent largement à la mortalité maternelle en Afrique de l’Ouest (Thaddeus and Maine 1994) :
• Délai 1 : délai lié à la décision de chercher à obtenir des soins;
• Délai 2 : délai lié à l’atteinte d’un établissement obstétrical approprié;
• Délai 3 : délai lié à l’obtention d’un traitement approprié une fois que l’on a atteint un tel établissement.
Différents facteurs peuvent influencer ces délais dans les pays à ressources limitées (figure 2) (Thaddeus and Maine 1994). Le premier délai est généralement associé aux coûts élevés des soins ; aux distances importantes à parcourir pour se rendre dans une structure de santé ; à un manque d’autonomie de la femme dans la société ; à un faible niveau socio-économique ; à une perception négative de la part des usagers de la qualité des soins délivrés dans les structures de santé ; et enfin, à un faible niveau d’éducation conduisant, entre autre, à une méconnaissance des complications obstétricales.
40
La présence de ces facteurs est responsable du nombre important d’accouchements sans professionnel qualifié. En effet, en 2012, près de la moitié des femmes (47%) ont accouché en l’absence de professionnel qualifié en Afrique Sub-saharienne (Objectifs du Millénaire pour le développement (OMD) 2014), engendrant un retard dans le diagnostic et la prise en charge d’une HPP.
Ensuite, le deuxième délai est allongé par : une mauvaise répartition géographique des structures de santé induisant des temps de transports souvent importants pour les rejoindre ; un manque de véhicules ; un coût du transport élevé ; et le mauvais état des routes.
Enfin, le manque de personnel compétent, de médicament, de sang et de matériel, ainsi que les prises en charges inadéquates aggravent le troisième délai. Ces facteurs reflètent la qualité des soins délivrés dans les structures de santé.
41 Figure 2 : Les trois délais et les facteurs qui leur sont associés
(Thaddeus and Maine 1994)
L’augmentation du nombre d’accouchements supervisés par du personnel qualifié est une stratégie recommandée par l’Organisation des Nations unies pour diminuer la mortalité maternelle. Elle constitue une des cibles des Objectifs du Millénaire pour le Développement (OMD) définie par les Nations Unies en 2000 pour réduire de trois-quarts le nombre de décès maternels dans le monde (OMD 5) entre 1990 et 2015. L’encadrement de l’accouchement par du personnel qualifié permettrait en effet de prévenir, de diagnostiquer et de prendre en charge plus rapidement les complications obstétricales, en particulier l’HPP, et ainsi de réduire les deux premiers délais.
42
Le dernier rapport examinant les progrès accomplis vers la réalisation des OMD en 2014 a montré que le nombre d’accouchements accompagnés par du personnel qualifié a augmenté en ASS passant de 40% à 53% entre 1990 et 2012 (Objectifs du Millénaire pour le développement (OMD) 2014). Ce pourcentage varie entre les pays même si la tendance à l’augmentation est assez générale. Il est passé de 74% en 2001 à 81% en 2012 au Bénin (Institut National de la Statistique et de l’Analyse Economique and INF International 2013) , 49% en 2006 à 59% en 2013 au Mali (Cellule de Planification et de Statistiques (CPS/SSDSPF), Institut National de la Statistique (INSTAT), and Centre d’Etudes et d'Information Statistique (INFO-STAT) 2014), et 52% en 2005 à 50% en 2013 au Sénégal (Agence Nationale de la Statistique et de la Démographie (ANSD) [Sénégal] and ICF International 2012).
Cependant, l’évidence scientifique a montré que l’augmentation des accouchements dans les structures de santé n’a pas été accompagnée d’une réduction aussi importante que prévue de la mortalité maternelle. Ce résultat suggère que si l’utilisation des services a augmenté, la qualité des soins dans les formations sanitaires ne s’est pas nécessairement améliorée. En effet, de nombreuses revues de la littérature (Ronsmans and Graham 2006; Knight, Self, and Kennedy 2013), études descriptives (Kongnyuy, Mlava, and van den Broek 2009; Walraven et al. 2000; Cham, Sundby, and Vangen 2005; Agan et al. 2010; Hoestermann et al. 1996) ont montré que les soins de mauvaise qualité jouaient un rôle prépondérant dans la mortalité maternelle. Plus particulièrement, une étude prospective menée en Afrique de l’Ouest a montré que 97% des décès causés par une hémorragie obstétricale étaient dus à des soins non optimaux (Bouvier-Colle et al. 2001).
Ainsi, il est urgent de s’intéresser à la qualité des soins dans les formations sanitaires en Afrique de l’Ouest si l’on veut accélérer la réduction de la mortalité maternelle.
43
2. Cadre conceptuel de la qualité des soins
Les définitions de la qualité des soins sont nombreuses et sont le fruit d’une approche multidimensionnelle. Selon Avedis Donabedian, qui a beaucoup contribué à la théorie de la qualité des soins depuis la fin des années 1960, la qualité des soins peut être approchée selon quatre dimensions : les caractéristiques techniques et relationnelles des soignants ; les installations utilisées dans le système de santé ; les processus de soins mis en œuvre ; et enfin, les dimensions d’accessibilité et d’équité du système de santé (Hurlimann 2001).
Avedis Donabedian a également conceptualisé l’évaluation de la qualité des soins qui est entreprise pour améliorer la prise en charge des patients. L’évaluation de la qualité des soins peut être conduite selon trois champs d’investigation : structures, procédures et résultats (Donabedian 1988). En effet, l’amélioration de la qualité des soins nécessite des ressources matérielles, humaines et organisationnelles et une utilisation appropriée des ces ressources pour mettre en œuvre des soins conduisant à des résultats optimaux de santé.
L’évaluation de la qualité des structures étudie l'environnement dans lequel les soins sont mis en œuvre : locaux, équipements, organisation, niveau de formation des soignants. L’évaluation de la qualité des procédures de soins analyse la façon dont les soins sont pratiqués en se basant sur des considérations telles que les performances des tests diagnostiques et des procédures thérapeutiques ; la coordination et la continuité des soins ; ou encore, l’acceptation des soins par les patients. Enfin, les indicateurs de morbidité ou de mortalité sont souvent utilisés pour évaluer la qualité des soins en termes de résultats des soins médicaux sur la santé des populations.
44
3. Prise en charge de l’hémorragie du post-partum : procédures de soins et
organisation des structures de santé
a. PREVENTION DE L’HEMORRAGIE DU POST-PARTUM
En 1988, l’essai contrôlé randomisé Bristol (Prendiville et al. 1988) a montré que la prise en charge active de la troisième phase du travail, incluant une injection d’ocytocine, une traction contrôlé du cordon et un clampage précoce du cordon 30 secondes après la naissance et avant la délivrance placentaire, permettait de diminuer significativement de 70% le risque de survenue d’une HPP par rapport à une prise en charge physiologique (aucune intervention).
La prévention de l’HPP est actuellement incluse dans toutes les recommandations nationales et internationales pour la prise en charge de l’HPP. Le recours aux trois gestes, évoqués ci-dessus, varie d’une recommandation à l’autre. L’injection d’ocytocine, qui est le médicament utérotonique de référence, est systématiquement recommandée. En cas d’indisponibilité de l’ocytocine, dont l’administration et la conservation requièrent des ressources qui peuvent être souvent indisponibles en Afrique Sub-saharienne (personnels qualifiés pour l’injection, réfrigérateur pour conserver au frais l’ocytocine), l’administration d’autres médicaments utérotoniques, comme le misoprostol (médicament de la famille des prostaglandines) et le méthylergométrine (dérivé de l’ergot de seigle), est recommandée.
Concernant la traction contrôlée du cordon, une revue de la Cochrane conclue sur le fait que ce geste permet de réduire le risque de délivrance artificielle du placenta et que l’évidence scientifique suggère qu’un professionnel qualifié et formé à ce geste peut y recourir en routine (Hofmeyr, Mshweshwe, and Gülmezoglu 2015). L’OMS considère ce geste comme
45
une option qui peut être envisagée seulement en présence d’un professionnel qualifié et formé à ce geste (Tunçalp, Souza, and Gülmezoglu 2013).
Le clampage précoce du cordon n’est plus recommandé par l’OMS dans ses dernières recommandations de 2012 au vu du bénéfice d’un clampage retardé apporté au nouveau-né, et en l’absence de preuve scientifique sur de potentiels effets négatifs sur la santé de la mère (McDonald and Middleton 2008).
Enfin, le massage utérin est un geste utilisé durant la troisième phase du travail et dans le post-partum immédiat pour stimuler les contractions utérines dans le but de limiter les saignements. Il n’existe actuellement aucune preuve scientifique suffisante pour conclure à l’efficacité de ce geste sur la prévention de l’HPP. Cependant, ce geste serait inefficace en cas d’injection préventive d’ocytocine (Hofmeyr, Abdel-Aleem, and Abdel-Aleem 2013). Ainsi, la prévention de l’HPP est basée essentiellement sur l’administration d’un médicament utérotonique. Cette mesure simple doit pouvoir être réalisée systématiquement à chaque accouchement.
Par ailleurs, l’identification des facteurs de risque de la survenue des HPP au sein des populations est importante, car elle permet d’identifier le plus tôt possible, de préférence dès le suivi prénatal, les femmes à risque élevé d’HPP afin de déterminer la stratégie la plus appropriée à mettre en œuvre pour prévenir une issue défavorable. Cela permet, notamment, de prendre en charge ces femmes avec précaution, de les orienter vers les structures de santé adaptées, et d’améliorer la qualité des prises en charge afin d’éviter la survenue d’une HPP ou d’en limiter son aggravation. Si de nombreux facteurs de risques sont maintenant bien identifiés avec de bons niveaux de preuve dans les pays à ressources
46
élevées, comme nous l’avons déjà vu ci-dessus, il n’en est pas de même pour l’ASS car très peu d’études ont été menées dans ce contexte.
b. METHODES DE DIAGNOSTIC DE L’HEMORRAGIE DU POST-PARTUM
Le diagnostic rapide de l’HPP joue un rôle central dans la bonne qualité de la prise en charge de cette pathologie, car il permet de mettre en œuvre rapidement les traitements pour limiter le volume des pertes sanguines et le retentissement sur l’état hémodynamique de la femme.
En Afrique de l’ouest, le diagnostic de l’hémorragie se fait essentiellement par la quantification visuelle du volume des pertes sanguines par le clinicien après l’accouchement. Plusieurs études ont montré que cette méthode n’était pas fiable et entrainait une sous-estimation des volumes importants et une sursous-estimation des volumes plus faibles inférieurs à 500mL (Patel et al. 2006; Larsson et al. 2006; Stafford et al. 2008) y compris en ASS (Kavle et al. 2006). Le diagnostic d’hémorragie est souvent retardé. L’identification des premiers signes cliniques de décompensation cardiovasculaire (tachycardie, hypotension, étourdissement, sudation) peut être associée à l’estimation visuelle du volume des pertes sanguines. Cependant, lorsque ces signes apparaissent, les pertes sanguines peuvent être déjà importantes comme nous l’avons déjà vu ci-dessus.
Des méthodes plus objectives et fiables peuvent être utilisées en pratique clinique comme l’utilisation d’un sac de recueil des pertes sanguines. Cette méthode peut être accessible aux pays à ressources limitées (Patel et al. 2006). Elle permet une mesure quantitative et objective du volume des pertes sanguines (Patel et al. 2006; Tourné et al. 2004). Pour
47
augmenter la fiabilité de cette méthode, il est nécessaire de recueillir les pertes sanguines après l’accouchement, car l’utilisation du sac pendant le travail et l’accouchement entraine la collecte d’autres liquides biologiques, comme le liquide amniotique. Un essai contrôlé randomisé mis en place dans plusieurs pays à ressources élevées a montré que cette méthode ne permet pas de diminuer l’incidence d’HPP sévère comparé à la méthode visuelle (Zhang et al. 2010). Ce résultat questionne donc les bénéfices de l’utilisation d’un tel dispositif.
c. PRISE EN CHARGE DE L’HEMORRAGIE DU POST-PARTUM
La prise en charge initiale comprend des gestes simples et des traitements médicamenteux peu invasifs qui doivent théoriquement être réalisés dans toute structure de santé réalisant des accouchements, y compris dans les structures les plus périphériques de la pyramide sanitaire. La délivrance artificielle du placenta est réalisée si celui-ci n’est pas délivré au moment du diagnostic d’HPP. La révision du col sous valve permet le diagnostic et la réparation des plaies cervico-vaginales. Ce dernier geste n’est pas inclus systématiquement dans les recommandations pour la prise en charge clinique de l’HPP, cependant, la Société Africaine des Gynécologues et Obstétriciens le recommande (OMS, SAGO, and UNFPA 2010). L’administration d’un médicament utérotonique joue un rôle central dans la prise en charge de l’HPP. L’ocytocine est le médicament utérotonique de référence (Mousa et al. 2014). Le misoprostol présente l’avantage d’une administration plus simple (voie orale ou intra-rectale) et peut être conservé à température ambiante. Il convient plus facilement à la pratique des pays à ressources limitées. Cependant, il est moins
48
efficace et entraine plus d’effets secondaires que l’ocytocine. Il représente, néanmoins une alternative efficace lorsque l’ocytocinee est indisponible et son utilisation est recommandé par l’OMS dans ce cas (Tunçalp, Souza, and Gülmezoglu 2013).
En cas d’échec de cette prise en charge initiale, les traitements utilisés sont plus invasifs et combinent plusieurs approches (figure 3). La compression bi-manuelle de l’utérus et la compression manuelle de l’aorte apparaissent efficaces mais sous-utilisés car invasifs ou peu confortables pour la femme et le clinicien (Weeks 2015). Le tamponnement intra-utérin par ballonnet a récemment été inclus dans les recommandations. Il est simple d’utilisation et peut traumatique et apparait comme une solution prometteuse (Georgiou 2009; Tindell et al. 2013). Il en existe plusieurs types dont le coût est variable. L’un d’entre eux est composé d’une sonde urinaire et d’un préservatif que l’on remplit progressivement d’eau stérile à l’aide d’une sonde urinaire. Son coût, peu élevé, est adapté aux pays à ressources limitées et son efficacité est prometteuse car les taux de succès relevés dans la littérature sont compris entre 96% et 100% (Tindell et al. 2013). Cependant, les études observationnelles disponibles sur ce sujet sont de faible niveau de preuve pour conclure à son efficacité. D’autres recherches sont donc nécessaires.
Enfin, les traitements chirurgicaux, plus invasifs, incluent la suture compressive de l’utérus, la ligature des artères hypogastriques ou utérines et l’hystérectomie d’hémostase.
En parallèle, une réanimation doit être débutée incluant la transfusion sanguine si les pertes sont importantes ou mal tolérées par la femme (World health Organization 2012).
49 Figure 3 : Présentation des différentes approches de la prise en charge de l’HPP sévère
(source (Mclintock and James 2011))
De nombreuses sociétés savantes nationales et internationales ont édité des recommandations pour la prise en charge de l’HPP. Si la littérature scientifique est abondante sur ce sujet, le niveau de preuve concernant les différentes approches recommandées est plutôt faible et les sociétés savantes ont souvent recours à des consensus d’experts pour établir leurs recommandations.
La prise en charge initiale, qui inclut des gestes simples et non invasifs, peut être réalisée par des sages-femmes dès le premier niveau de soin, alors qu’en cas d’aggravation de l’HPP, les étapes suivantes requièrent des moyens humains et matériels plus importants et doivent être réalisés dans les structures de santé de niveau supérieur. Une seule étude en population française a montré qu’un délai réduit de la prise en charge initiale était associé à une diminution du risque d’aggravation de l’HPP (Driessen et al. 2011).
50
d. FACTEURS RELATIFS AUX STRUCTURES DE SANTE
La prise en charge initiale de l’HPP doit pouvoir être réalisée au niveau le plus périphérique de la pyramide sanitaire. Selon la classification des formations sanitaires par l’OMS, ce niveau correspond aux services offrant des Soins Obstétricaux et Néonatals d’Urgence (SONU) de base qui incluent l’administration d’utérotoniques (de préférence l’ocytocine) par voie parentérale et l’extraction manuelle du placenta. En fonction de son état de santé et du résultat des traitements de première ligne, toute femme doit avoir accès rapidement à un service de SONU complet, offrant la possibilité d’une hystérectomie et d’une transfusion sanguine (UNICEF, WHO, UNFPA 1997). L’OMS recommande 4 structures délivrant des SONU de bases et 1 structure délivrant des SONU complets pour 500000 habitants (UNICEF, WHO, UNFPA 1997).
Cependant, plusieurs études (Wilunda, Putoto, et al. 2015; Wilunda, Oyerinde, et al. 2015; Holmer et al. 2015; Abegunde et al. 2015) ont montré que la distribution des soins d’urgence est insuffisante en Afrique Sub-saharienne, notamment en ce qui concerne la disponibilité des médicaments essentiels, incluant l’ocytocine, et la possibilité d’effectuer une transfusion sanguine. Une revue systématique a montré qu’aucun pays d’ASS, d’où étaient issues les données analysées, avait une couverture en soins obstétricaux de bases qui suivait les recommandations de l’OMS (Paxton et al. 2006).
Par ailleurs, une revue systématique a montré que plus de 25% des décès maternels liés à l’hémorragie en Afrique sub-saharienne étaient dus à un manque de sang (Bates et al. 2008). Les collectes insuffisantes de sang et la mauvaise utilisation du sang en ASS sont responsables du manque de sang important dans cette région.