© Valérie Coats, 2019
Composition corporelle et atteinte musculaire chez les
patients atteint d’un cancer du poumon : Mécanismes,
impacts fonctionnels et réversibilité
Thèse
Valérie Coats
Doctorat en médecine expérimentale
Philosophiæ doctor (Ph. D.)
ii
Résumé
Avec 1,6 million de nouveaux cas diagnostiqués chaque année et 1,3 million de décès, le cancer du poumon est un problème de santé important se classant au premier rang mondial des cancers en ce qui a trait à la mortalité. Conséquence de la maladie elle-même ou de son traitement, l’atteinte musculaire fait souvent partie du tableau clinique habituel des patients atteints d’un cancer et peut se produire précocement dans le continuum de la maladie. Par ailleurs, celle-ci peut avoir des répercussions sur la capacité fonctionnelle, la qualité de vie et la survie des patients. Cependant, malgré son importance clinique, l’atteinte musculaire et les mécanismes sous-jacents de même que sa relation avec la capacité fonctionnelle au moment du diagnostic demeurent relativement peu documentés dans le cancer du poumon.
Par conséquent, je me suis globalement intéressée dans cette thèse à étudier la composition corporelle, la fonction musculaire et la capacité fonctionnelle des patients atteints de cancer pulmonaire. De façon plus spécifique, j’ai voulu déterminer s’il y avait une atteinte de la composition corporelle et musculaire au moment du diagnostic chez les patients atteints de cancer du poumon et évaluer l’impact de cette atteinte sur la capacité fonctionnelle et la survie des patients. Ensuite, j’ai voulu aborder la problématique de l’atteinte musculaire des patients atteints de cancer du poumon en adoptant un point de vue plus fonctionnel et mécanistique en étudiant les voies de signalisation impliquées dans l’équilibre musculaire de ces patients au moment de leur diagnostic. En dernier lieu, je me suis intéressée au potentiel de réversibilité de l’atteinte musculaire en réponse à un programme de réadaptation dans le cadre d’un essai pilote de faisabilité de la téléréadaptation.
L’ensemble des travaux effectués dans le cadre de cette thèse ont permis, dans un premier temps, de mettre en lumière qu’au moment du diagnostic, une atteinte musculaire était déjà présente chez une majorité de patients souffrant de cancer du poumon. Par ailleurs, nous avons aussi établi que cette dernière se traduisait de façon longitudinale par une diminution de la survie des patients. Toutefois, il semblerait, qu’en dépit des altérations morphologiques présentent dans le muscle, la fonction contractile du muscle en tant que tel soit préservée au moment du diagnostic offrant ainsi une fenêtre d’opportunité pour adopter des mesures visant à maintenir ou améliorer
iii
la fonction musculaire. À ce propos, nous avons aussi pu établir que la réadaptation était une modalité thérapeutique faisable, sécuritaire et qui semble efficace pour maintenir la fonction musculaire chez les patients atteints de cancer du poumon.
Considérant le lien entre l’atteinte musculaire et les enjeux cliniques importants tels que la mortalité et la toxicité associée aux traitements antinéoplasiques, l'évaluation précoce de la composition corporelle et musculaire de même que des caractéristiques de la fonction musculaire peut permettre un dépistage plus efficace et une meilleure prise en charge des patients atteints de cancer du poumon.
iv
Abstract
With 1.6 million new cases diagnosed each year and 1.3 million deaths, lung cancer is a major health problem, ranking among the world's leading cancers in terms of mortality. As a consequence of the disease itself or its treatment, muscle impairment is often part of the usual clinical picture of cancer patients and may occur early in the disease continuum. In addition, it may have a significant clinical impact on muscle function, functional capacity, and decreased quality of life for patients. However, despite its clinical importance, muscle impairment and its underlying mechanisms as well as its relationship to muscle function remain relatively poorly documented in lung cancer particularly at diagnosis time.
Therefore, my interest in this thesis was to study muscle impairment, body composition, muscle function and functional capacity of patients with lung cancer. More specifically, I wanted to determine whether there was an impairment of body and muscle composition at the time of diagnosis in patients with lung cancer and assess the impact of this impairment on patients’ functional capacity as well as survival. Then, I wanted to address the issue of muscle impairment in lung cancer patients by adopting a more functional and mechanistic point of view by studying the signaling pathways involved in the muscle balance of these patients at the time of their diagnostic. Finally, I have been interested in the reversibility potential of body and muscle composition impairment in response to a rehabilitation program carried out as a pilot study on telerehabilitation.
First, our results highlighted that at the time of diagnosis, a muscle impairment was already present in a majority of patients suffering from lung cancer. In addition, we also established that the latter was manifested by a decrease in participation in physical activities and was reflected longitudinally by a decrease in patient survival. However, it would appear that, despite the morphological changes in the muscle, the contractile function of the muscle itself is preserved at the time of diagnosis providing a window of opportunity for adopting countermeasures to maintain or improve muscle function. In this regard, we have also been able to establish that rehabilitation is a feasible, safe and effective therapeutic modality for maintaining muscle function in patients with lung cancer.
v
Considering the link between muscle wasting and important clinical issues such as mortality and chemotherapy related toxicity, early assessment of body and muscle composition as well as features of muscle function may allow more effective screening and better management of patients with lung cancer
vi
Table des matières
Résumé ... ii
Abstract ... iv
Liste des tableaux ... xi
Liste des publications ... xv
Remerciements ... xviii
Avant-propos ... xx
INTRODUCTION GÉNÉRALE SECTION 1 :CANCER DU POUMON ... 2
1.1 Définition ... 2 1.2 Épidémiologie ... 3 1.2.1 Incidence ... 3 1.2.2 Mortalité ... 4 1.2.3 Survie ... 5 1.2.4 Impact financier ... 6
1.3 Types de cancer du poumon... 6
1.3.1 Cancer du poumon non à petites cellules : ... 6
1.3.2 Cancer du poumon à petites cellules ... 7
1.4 Pathogenèse ... 7
1.5 Facteurs de risque ... 8
1.5.1 Tabagisme ... 8
1.5.2 Autres causes du cancer du poumon ... 10
1.6 Diagnostic et stadification ... 12
1.6.1 Cancer du poumon non à petites cellules ... 13
1.6.2 Cancer du poumon à petites cellules ... 15
1.7 Traitements ... 15 1.7.1 Chirurgie ... 15 1.7.2 Chimiothérapie : ... 17 1.7.3 Radiothérapie ... 18 1.7.4 Thérapie ciblée ... 19 1.7.5 Immunothérapie ... 21 1.8 Tableau clinique ... 22 1.8.1 Symptomatologie ... 22 1.8.2 Conséquences multifactorielles ... 23
vii
SECTION 2 :CONTRÔLE DU POIDSET COMPOSITION CORPORELLE ... 27
2.2 Introduction ... 27
2.3 Contrôle du poids : le principe de la balance énergétique... 27
2.4 Mécanismes régulant l’équilibre énergétique ... 28
2.5 Modèles de composition corporelle ... 29
2.6 Évaluation de la composition corporelle ... 30
2.6.1 Mesures anthropométriques ... 31
2.6.2 Analyse de l’impédance bioélectrique (BIA) ... 31
2.6.3 Absorptiométrie Biophotonique (DEXA) ... 32
2.6.4 Imagerie par résonnance magnétique (IRM) ... 32
2.6.5 Tomodensitométrie (TDM) ... 32
2.7 Conclusion ... 33
SECTION 3 :LE MUSCLE SQUELETTIQUE ... 35
3.1 Introduction ... 35
3.2 Structure musculaire ... 35
3.2.1 Classification des fibres musculaires : ... 36
3.3 Régulation de la masse musculaire ... 38
3.4 Fonctions du muscle ... 40
3.5 Évaluation des caractéristiques de la fonction musculaire ... 42
3.5.1 Dynamométrie commandée par ordinateur ... 42
3.5.1 Répétition maximale ... 43
3.5.2 Dynamométrie manuelle ... 43
3.5.3 Force de préhension ... 44
3.5.4 Jauge de force et stimulation magnétique ... 44
3.6 Conclusion ... 45
SECTION 4 :ATTEINTE MUSCULAIREEN ONCOLOGIE CLINIQUE ... 46
4.1 Introduction ... 46
4.2 Définitions : ... 46
4.2.1 Fonction musculaire: ... 46
4.2.2 Atteinte musculaire: ... 47
4.3 Diagnostic différentiel entre cachexie et sarcopénie ... 48
4.3.1 Cachexie : ... 48
4.3.2 Sarcopénie :... 50
4.3.3 Chevauchement Cachexie/Sarcopénie : Atteinte musculaire ... 51
4.4 Causes ... 53
viii
4.4.2 Malnutrition ... 54
4.4.3 Inactivité... 54
4.4.4 Facteurs reliés à la tumeur ou à l’hôte ... 55
4.4.5 Thérapies contre le cancer ... 56
4.5 Implications cliniques de l’atteinte musculaire ... 57
4.5.1 Mortalité et progression tumorale : ... 57
4.5.2 Complications reliées aux traitements : ... 58
4.5.3 Fatigue ... 58
4.6 Réversibilité de l’atteinte musculaire : ... 59
4.6.1 Suppléments nutritionnels... 60
4.6.2 Stimulants de l’appétit ... 60
4.6.3 Activité physique ... 61
4.7 Conclusion ... 62
SECTION 5 : RÉADAPTATION FONCTIONNELLE CHEZ LES PATIENTS ATTEINTS DE CANCER ... 63
5.1 Introduction ... 63
5.2 Patients de faible stade de cancer ... 64
5.2.1 Phase préopératoire ... 64
5.2.2 Phase postopératoire ... 66
5.3 Patients de stades avancés ... 66
5.4 Modalités d’entraînement ... 67
5.5 Sécurité et faisabilité ... 68
5.6 Barrières à la réadaptation pulmonaire ... 69
5.7 Perspectives ... 70
5.7.1 Programme à domicile ... 71
5.7.2 Téléréadaptation ... 72
5.8 Conclusion ... 74
CHAPITRE I PROBLÉMATIQUE, OBJECTIFS ET HYPOTHÈSES DES TRAVAUX DE RECHERCHE ... 75
CHAPITRE II MÉTHODOLOGIE ... 82
2.1 Introduction générale ... 83
2.2 Analyse de la composition corporelle et musculaire via tomodensitométrie ... 83
2.2.1 Segmentation au niveau de l’abdomen ... 84
ix
2.3 Analyse de la fonction musculaire du quadriceps... 89
2.3.1 Dynamométrie isocinétique ... 89
CHAPITRE III Prognostic significance of computed tomography-derived body composition parameters and sarcopenia in lung cancer ... 92
3.1 Résumé ... 94 3.2 Abstract: ... 96 3.3 Introduction ... 98 3.4 Methods ... 99 3.5 Results ... 102 3.6 Discussion ... 105 3.7 Conclusion ... 108 3.8 Figure legends ... 109 3.9 References ... 119 CHAPITRE IV Characterization of limb muscle function in patients newly diagnosed with lung cancer ...123
4.1 Résumé: ... 125 4.2 Abstract: ... 127 4.3 Introduction ... 129 4.4 Methods ... 130 4.5 Results ... 135 4.6 Discussion ... 136 4.7 Conclusion ... 139 4.8 References ... 147 CHAPITRE V Comparison of abdominal and thigh muscle characteristics and their relationship to quadriceps muscle functions for patients with thoracic neoplasia ... 152
5.1 Résumé ... 154
5.2 Abstract: ... 156
5.3 Introduction ... 157
5.4 Materiels and methods ... 158
5.5 Results ... 160
5.6 Discussion ... 162
x CHAPITRE VI
Feasibility of an eight-week telerehabilitation intervention for patients with unresectable
thoracic neoplasia receiving chemotherapy: a pilot study ...175
6.1 Résumé : ... 177 6.2 Abstract: ... 179 6.3 Introduction ... 181 6.4 Methods ... 182 6.5 Results ... 188 6.6 Discussion ... 190 6.7 Conclusion ... 194 6.8 Figure legends ... 195 6.9 References ... 202 CHAPITRE VII DISCUSSION GÉNÉRALE ...206
7.1 Résumé des travaux de recherche ... 207
7.2 Forces et limitations ... 214
7.2.1 Forces ... 214
7.2.2 Limitations : ... 215
7.3 Perspectives ... 217
7.3.1 Évaluation de la composition corporelle et musculaire par tomodensitométrie ... 218
7.3.2 Toxicité ... 219
7.3.3 Évaluation fondamentale des prélèvements musculaires. ... 221
7.3.4 Intégration de la réadaptation dans la prise en charge des patients ... 222
CONCLUSION ...224
xi
Liste des tableaux
- Tableau 1 : Stadification du cancer du poumon non-à-petites-cellules en fonction de la classification TNM 58-60. ... 14
- Tableau 2 : Symptômes présents au diagnostic pour le cancer du poumon non à petites cellules ... 22 - Tableau 3 : Caractéristique des méthodes d'évaluation de la composition corporelle.
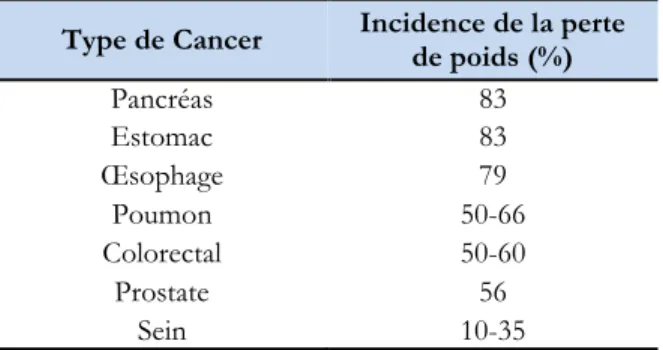
Adapté de Rubbieri 153. ... 30 - Tableau 4 : Incidence de la perte de poids au moment du diagnostic selon différents
xii
Liste des figures
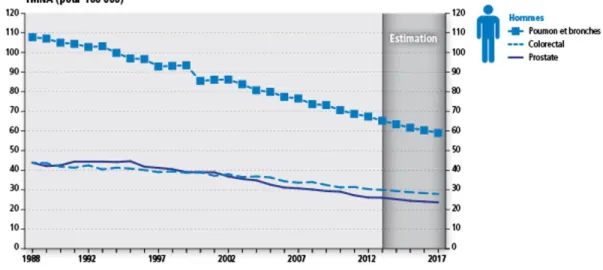
- Figure 1 Taux de mortalité normalisés selon l’âge (TMNA) pour certains cancers,
hommes, Canada, 1988–2017 4 ... 4
- Figure 2 Taux de mortalité normalisés selon l’âge (TMNA) pour certains cancers, femmes, Canada, 1988–2017 4 ... 5
- Figure 3. Modèles de composition corporelle, Adapté de Wilmore 152. ... 29
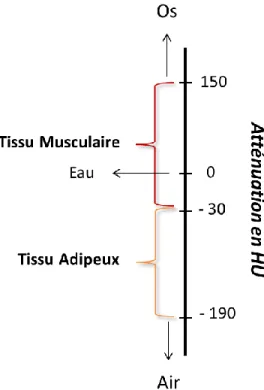
- Figure 4 : Densité de différentes matières en unité Hounsfield ... 33
- Figure 5: Le muscle squelettique. Adapté de ACSM' s Resource Manual for Guidelines for Exercise Testing and Prescription 5th edition 156 ... 37
- Figure 6 : Régulation de la masse musculaire. Adapté de Maltais 176. ... 38
- Figure 7: Stade de la cachexie. Adapté de Fearon 218. ... 50
- Figure 8 : Atteinte musculaire dans le cancer : chevauchement entre la cachexie et la sarcopénie. Adapté de Hall 246. ... 52
- Figure 9: Proportion de la distribution des différentes approches thérapeutiques répertoriées dans les essais cliniques de phase II-IV portant sur la cachexie associée au cancer. Adapté de Baracos, 2018 285. ... 59
- Figure 10 Tomodensitométrie thoracoabdominale vue de face (scout) ... 86
- Figure 11 Coupe sagittale à L3 non segmentée ... 86
- Figure 12 Coupe sagittale à L3 segmentée... 86
- Figure 13 Tomodensitométrie vue de face (scout) ... 88
- Figure 14 Coupe à la mi-cuisse non segmentée ... 88
- Figure 15 Coupe à la mi-cuisse segmentée ... 88
- Figure 16 Biodex, system pro 4, Biodex Medical System, ... 89
xiii
Liste des abréviations
- % préd : Pourcentage des valeurs prédites - 1 RM : Charge maximale pour une répétition - ACS : l’American Cancer Society
- ACSM : American College of Sport Medicine - ALK : Protéine kinase
- ATS : American Thoracic Society
- ASCO : American Society of Clinical Oncology (ASCO) - BIA : Analyse de l’impédance bioélectrique - CMV: Contraction maximale volontaire - CPT : Capacité pulmonaire totale - CRF : Capacité résiduelle fonctionnelle - CVF : Capacité vitale forcée
- DEXA : Absorptiométrie Biophotonique
- ECBC : Examen cythopatologique des expectorations - ECG : Électrocardiogramme
- EGFR : Epidermal growth factor receptor - ERS : European Respiratory Society - FC : Fréquence cardiaque
- FOXO : Forkhead box O - FR : Fréquence respiratoire
- GSK3b : glycogène synthase kinase-3 bêta - GRP : gastrin-releasing peptide
- HU : unité Hounsfield
- IGF-1 : Insulin-like growth factor-1 - IMC : Indice de masse corporelle
- IRM : Imagerie par résonance magnétique - L3 : troisième vertèbre lombaire
- MAFbx : muscle atrophy Fbox
- MAPK : mitogen-activated protein kinase - MI : Membres inférieurs
- MPOC : Maladie pulmonaire obstructive chronique - mTOR : cible de la rapamycine chez les mammifères - MuRF1 : muscle ring fingerl
- MyoD : facteur de différenciation myogénique-D - OMS : Organisation mondiale de la santé
- ONS : Ongology Nursing Society - PDL1 : Programmed death-ligand 1 - RM : Répétition maximale
- SpO2 : Saturation pulsée en oxygène
- TACO : tomographie axiale calculée par ordinateur - TDM : Tomodensitométrie
- TDM6 : Test de marche de 6 minutes
xiv
- TMNA : Taux de mortalité normalisés selon l’âge - VCO2 : Production de dioxyde de carbone
- VE : Ventilation
- VEGF : Facteur de croissance de l’endothélium vasculaire - VEMS : Volume expiratoire maximal en une seconde - VMV : Ventilation maximale volontaire
- VO2 : Consommation en oxygène
- VO2max : Consommation maximale en oxygène
- VPH : virus du papillome humain - VC : Volume courant
xv
Liste des publications
1. Coats V, Lacasse Y, Tremblay L, Labbé C, Maltais F and Saey D. Prognostic significance
of computed tomography-derived body composition parameters and sarcopenia in lung cancer. Article en processus de soumission au Journal of Cachexia, Sarcopenia and muscle -
Clinical Report.
2. Coats V, Ribeiro F, Dubé A, Patoine D, Tremblay L, Maltais F and Saey D.
Characterization of limb muscle function in patients newly diagnosed with lung cancer. Article en préparation pour soumission dans Clinical physiology and functional imaging.
3. Coats V, Boudreault S, Maltais F and Saey D, Comparison of abdominal and thigh muscle
characteristics and their relationship to quadriceps muscle functions for patients with thoracic neoplasia; Article en preparation pour soumission dans Acta Physiologica.
4. Coats V, Moffet H, Vincent C, Simard S, Tremblay L, Maltais F and Saey D. Feasibility
of an eight-week telerehabilitation intervention for patients with unresectable thoracic neoplasia receiving chemotherapy: a pilot study. Article accepté dans le Canadian Journal of
Respiratory, Critical Care and Sleep Medicine, 2018
5. Coats V, Després J-P, Alméras N, Martin M, Sin D, Rabasa-Lhoret R, Larose E, Tan W,
Bourbeau J, Maltais F, for the CanCOLD Collaborative Research group and the Canadian Respiratory Research Network Ectopic adiposity and cardiometabolic health in COPD, Article accepté dans le International Journal of Chronic Obstructive Pulmonary Disease, 2018
6. Coats V, Tremblay L, Saey D. Exercise-Based Rehabilitation for People with Lung
Cancer. J Pulm Respir Med. 2014;4(183).
7. Coats V, Maltais F, Simard S, Frechette E, Tremblay L, Ribeiro F and Saey D. Feasibility
and effectiveness of a home-based exercise training program before lung resection surgery.
Canadian respiratory journal : journal of the Canadian Thoracic Society. 2013
Mar-Apr;20(2):e10-16.
Co-Auteur :
1. Ribeiro F, Oueslati F, Saey D, Lepine PA, Chambah S, Coats V and Maltais.
Cardiorespiratory and muscle oxygenation responses to quadriceps isokinetic endurance test in COPD. Acticle en procesus de révision dans le Medicine and Science in Sports and
Exercise
2. Moffet H, Saey D, Coats V, Vincent C, Choinière F, Comeau F. Reliability and Usability
of the eChez-Soi In-home Telerehabilitation Platform: A New Internet-based Communication and Real-time Monitoring Software Solution Combined with Interactive Exercises - Results of a Longitudinal Pilot Study in Four Patients with Lung Cancer. 2015. p. 137-42.
xvi
3. Moffet H, Vincent C, Saey D, Coats V, Routhier F, Choiniere F, et al. Users' Perception
and Readiness of the eChez-Soi In-Home Telerehabilitation Platform. Studies in health
technology and informatics. 2015;217:782-7.
4. Ribeiro F, Lepine PA, Garceau-Bolduc C, Coats V, Allard E, Maltais F, et al. Test-retest
reliability of lower limb isokinetic endurance in COPD: A comparison of angular velocities. International journal of chronic obstructive pulmonary disease. 2015;10:1163-72.
5. Gagnon P, Maltais F, Bouyer L, Ribeiro F, Coats V, Brouillard C, et al. Distal leg muscle
function in patients with COPD. Copd. 2013 Apr;10(2):235-42.
6. Saey D, Bernard S, Gagnon P, Laviolette L, Soicher J, Maltais F, Desgagnés P, Coats V
and Devost A-A. Pulmonary rehabilitation in chronic obstructive pulmonary disease.
xvii
Only those who will risk going too far
can possibly find out how far one can go
Remerciements
C’est sous le soleil d’Amsterdam, un expresso à la main, que la décision d’entreprendre un doctorat a germé dans mon esprit. J’étais partie pour ce congrès avec un billet d’avion ouvert avec la ferme intention de voyager plusieurs mois suivant l’achèvement de ma maitrise. Finalement, mon long périple en Europe n’aura été que de trois semaines, mais les années de doctorat qui ont suivi m’ont quant à elles amenée plus loin que je ne l’aurais imaginé…
Je veux diriger mes premiers remerciements vers mon directeur de recherche Didier Saey. Merci pour ton soutien et tes conseils qui m’ont grandement aidé sur mon parcours et ce bien au-delà du doctorat. Tu es une personne exceptionnelle et je suis fière de pouvoir dire que j’étais ta première étudiante graduée. Nous étions déjà considérés comme un « vieux couple » dès nos débuts, mais maintenant 10 ans plus tard, je crois que nous ne pouvons plus le nier.
Ensuite, je veux remercier mon codirecteur François Maltais pour être une source d’inspiration constante par sa passion contagieuse et son dévouement professionnel. Je me considère choyée d’avoir eu l’opportunité de faire partie de la grande équipe Maltais et je te remercie sincèrement de ton temps et ta confiance. Je tiens aussi à remercier l’ensemble de l’équipe du centre de recherche, mais particulièrement les infirmières et coordonnatrices de recherche Dominique Auger, Marie-Josée
Breton, Josée Picard, Brigitte Jean, Marthe Bélanger et Cynthia Brouillard. Merci pour vos conseils
et toutes les discussions de corridors ! En plus d’être des ressources incroyables, votre dévouement envers vos patients est exemplaire. Vous êtes sincèrement des femmes extraordinaires.
Étant donné que le plaisir associé aux études graduées est directement proportionnel aux étudiants côtoyés, je souhaite dire un énorme merci aux 5 générations d’étudiants qui sont passées par le centre de recherche durant l’ensemble de mes études, mais spécialement à Marjo, Alex, Sauce et Fé qui ont ensoleillé plusieurs journées et qui ont rendues mes années aux études graduées inoubliables. Les filles, nous devrons célébrer sans faute le dépôt de cette thèse avec plusieurs mètres !
Aussi, je tiens à remercier particulièrement MES professionnels de recherche Annie et Dany. Merci pour les textos et les appels de panique. Merci de m’avoir souvent accueilli sur la chaise de Sylvie. Merci pour les fous rires durant les congrès et les commentaires déplacés. Merci de m’avoir aidé à concrétiser toutes ces visions !
xix
Par ailleurs, merci à mes anciens collègues étudiants maintenant retrouvés dans ma vie professionnelle,
Bruno et MAC, qui, en plus d’avoir été des sources d’inspirations lorsque j’étais étudiante, continuent
encore aujourd’hui à me soutenir et me conseiller. Vous êtes sincèrement des mentors incroyables.
Étant donné que je ne peux plus écouter certaines chansons sans penser à mon projet de téléréadaptation et aux patients qui y ont participé, je tiens à remercier tous les patients ayant contribué à mes études. Même si malheureusement plusieurs d’entre eux ne sont plus avec nous aujourd’hui, je leur dédie quand même le fruit de ce travail, puisque sans eux rien de tout cela n’aurait été possible.
À ma famille et ma belle-famille : merci pour vos encouragements et merci pour tout le gardiennage,
le ménage, le pliage de vêtement, la cuisine, etc. Bref merci d’avoir tout fait pour alléger notre quotidien au cours de la dernière année afin de nous aider à préserver notre santé mentale. C’est maintenant terminé, vous n’aurez plus à me souhaiter « bon succès dans tes études » dans vos vœux du Nouvel An !
À tous mes amis : Merci d’être encore dans ma vie depuis toutes ces années. Merci d’avoir servi de
« punching bag » dans les moments les plus difficiles. Merci d’avoir été là pour les excursions dans les montagnes, les promenades en ville, les milk-shakes, les brunchs, les vendredis « junk-food » et toutes les autres raisons visant à me faire décrocher un peu du petit diable de doctorat qui restait perché sur mon épaule. Je vous aime viscéralement. Un merci spécial à Alex et Renée qui ont eu à gérer la majorité de mes crises existentielles qu’elles aient été associées au doctorat… ou non, et à Adam pour m’avoir encouragé à me lancer dans la grande aventure doctorale.
À ma p’tite famille :
Kev… aucun mot ne peut décrire la profondeur des remerciements que je voudrais te dire. Merci d’être
le pilier sur lequel je peux m’appuyer pendant les tempêtes. Merci de ne jamais avoir cessé d’y croire et d’avoir tenu le fort, particulièrement durant la dernière année. Merci pour toutes les fausses commissions pour me laisser du temps de travailler, merci de ton soutien, de tes encouragements, de ta patience, de ton amour. Tu es un chum et un père exceptionnel et le doctorat maintenant terminé je suis des plus impatiente de te retrouver…
Finalement, à ma petite furie Olivier : Merci d’avoir fait de moi une maman comblée et de ne jamais cesser de m’émerveiller. Tu es un petit garçon brillant, souriant et espiègle et il n’y a pas de doute c’est toi ma plus grande fierté. Je t’aime ti-homme!
Avant-propos
Cette thèse constituée de quatre articles scientifiques a comme thème principal l’exploration de la composition corporelle, de la fonction musculaire, de la capacité fonctionnelle et de la réadaptation chez les patients atteints de cancer du poumon. Dans un premier temps, nous présenterons les notions d’épidémiologie, de pathogenèse, de facteurs de risques, de classification et les conséquences cliniques du cancer du poumon. Suite à la présentation de ces notions générales, nous nous attarderons sur les concepts et définitions de la composition corporelle et sur ses moyens d’exploration. Comme l’atteinte musculaire est au cœur de cette thèse, nous focaliserons ensuite sur les conséquences de cette pathologie sur la fonction musculaire et en présenterons les moyens d’investigation cliniques. Finalement, nous décrirons et discuterons des bienfaits de la réadaptation et les rôles de l’exercice dans le continuum de traitements de ces patients. L'introduction permettra donc aux lecteurs de se familiariser avec les notions essentielles à la compréhension de la problématique et des objectifs de recherche constituant cette thèse qui seront quant à eux énoncés dans le Chapitre I, Problématique, objectifs
et hypothèses des travaux de recherche.
Toutefois avant d’aller au cœur de cette thèse, voici une brève mise en contexte des différents articles scientifiques qui seront présentés dans cette thèse ainsi qu’une description de ma contribution au sein de ces études.
Article 1:
Prognostic significance of computed tomography-derived body composition parameters and sarcopenia in lung cancer
Malgré l’importance du processus cachectique et de la perte de masse musculaire chez les patients atteints de cancer du poumon, la composition corporelle de cette population a principalement été étudiée à partir de méthodes d’évaluation ne permettant habituellement pas de différencier le muscle des autres tissus. La tomodensitométrie est une approche d’imagerie possédant un haut niveau de spécificité permettant ainsi de discriminer les différents tissus. Cette technologie a été largement développée, validée et appliquée dans le cadre de nombreux protocoles de recherche
xxi
visant à évaluer la composition corporelle. Toutefois, son utilisation reste limitée en raison des doses de radiation, du coût élevé et du manque de disponibilité et d’accessibilité à cette ressource. Cependant, ces inconvénients méthodologiques ne s’appliquent pas dans un contexte d’oncologie clinique puisque les patients atteints de cancer subissent ces tests d’imagerie en routine dans une optique de diagnostic, de stadification ou de suivi de la progression de la tumeur. Par conséquent, la première étude proposée dans cette thèse visait à utiliser les images de tomodensitométries cliniques des patients atteints de cancer du poumon afin d’évaluer leur composition corporelle au moment du diagnostic et d’en déterminer l’impact sur la survie.
Cette étude a été réalisée sous la direction des Drs Didier Saey et François Maltais avec qui j'ai écrit le protocole, analysé les images de tomodensitométries, collecté les données cliniques, analysé les résultats et rédigé l’article scientifique. Les Drs Yves Lacasse, Lise Tremblay et Catherine Labbé ont participé aux discussions scientifiques qui ont permis la mise en place du protocole et/ou de l’écriture de l’article. Ces résultats sont en préparation pour soumission au
Journal of Cachexia, Sarcopenia and muscle - Clinical Report.
Article 2:
Characterization of limb muscle function in newly diagnosed patients with lung cancer
L’atrophie musculaire fait souvent partie du tableau clinique des patients atteints d’un cancer de stade avancé. Conséquence de la maladie elle-même ou de son traitement, cette atteinte musculaire peut se produire au début de la maladie et pourrait avoir des conséquences cliniques importantes sur la fonction musculaire, la capacité fonctionnelle et la diminution de la qualité de vie des patients. Cependant, malgré son importance clinique, l’atrophie musculaire et les mécanismes sous-jacents de même que sa relation avec la fonction musculaire au moment du diagnostic demeurent relativement peu documentés dans le cancer du poumon et cela encore moins au moment du diagnostic. Cette étude visait donc l’exploration de la fonction, de la composition et de la signalisation musculaire moléculaire impliquée dans la régulation de la masse musculaire du quadriceps des patients nouvellement diagnostiqué d’un cancer pulmonaire.
xxii
Cette étude a été réalisée sous la direction des Drs Didier Saey et François Maltais avec qui j'ai écrit le protocole, recruté les participants, réalisé l’expérimentation, analysé les résultats et rédigé l’article scientifique. Mme Fernanda Ribeiro a participé au recrutement des participants et à l’expérimentation. Le Dr. Maltais a procédé aux prélèvements des biopsies musculaires des patients et l’analyse histologique de ces dernières a été effectuée par Dre Annie Dubé et M. Dany Patoine. Les résultats de ce travail sont en préparation pour soumission prochainement au
Clinical physiology and functional imaging.
Article 3:
Comparison of abdominal and thigh muscle characteristics and their relationship to quadriceps muscle function in patients with thoracic neoplasia
Malgré l'importance clinique de l’intégrité de la structure et de la composition musculaire des membres inférieurs chez les patients ayant un cancer, la masse et la fonction musculaire ne sont pas systématiquement évaluées au moment du diagnostic. Puisque les images de tomodensitométries thoraco-abdominales sont systématiquement obtenues dans un contexte clinique et qu’elles permettent d’étudier les muscles paraspinaux, nous avons voulu vérifier si l'étude de ces dernières pourrait s’avérer utile pour détecter une atteinte musculaire des membres inférieurs. Le but de cette étude était donc i) de déterminer s’il y avait une association entre les caractéristiques de la composition musculaire mesurée dans la région de l'abdomen et celles mesurées à la mi-cuisse et ii) d'évaluer la relation de la composition musculaire abdominale avec la fonction du muscle du quadriceps de patients nouvellement diagnostiqués d’un cancer du poumon.
Cette sous-étude du projet Characterization of limb muscle function in newly diagnosed patients with lung
cancer a été réalisée dans le cadre de l’essai de fin d’études en physiothérapie de Mme Sarah
Boudreault. En collaboration avec cette dernière, j’ai effectué la collecte de donnée, réalisé l’analyse des images, analysé les résultats et rédigé l’article scientifique émanant de ces travaux. Le recrutement des participants et l’expérimentation ont été effectués dans le cadre de l’étude maîtresse supervisée par Dr Maltais et Dr Saey. Les résultats de ce travail sont en préparation pour soumission prochainement dans Acta Physiologica.
xxiii Article 4:
Feasibility of an eight-week telerehabilitation program for patients with unresectable thoracic neoplasia receiving chemotherapy: a pilot study
Les bénéfices d’un programme de réadaptation basé sur l’exercice ont été bien démontrés pour améliorer la tolérance à l’effort, la capacité fonctionnelle, la fatigue et la qualité de vie des patients atteints de cancer du poumon. Toutefois, la mise en œuvre de ce type d'intervention est limitée en raison de l’accessibilité aux ressources et de la mauvaise adhérence des patients. La téléréadaptation, définie comme une application de la télésanté qui utilise les technologies de la télécommunication afin de fournir des services de réadaptation à distance, semble être une alternative prometteuse pour améliorer l'accès aux services de réadaptation. Cette étude a donc été conçue pour vérifier la faisabilité d’un programme de téléréadaptation utilisant des séquences d’exercices réalisées à l’aide de composantes de consoles de jeu (Wii-balance et tapis de danse-XBox) chez les patients ayant un cancer pulmonaire et recevant un traitement de chimiothérapie.
Cette étude a été réalisée sous la direction des Drs Didier Saey et François Maltais avec qui j'ai écrit le protocole, recruté les patients, collecté les données, analysé les résultats et rédigé l’article scientifique. Le Dr Sébastien Simard a participé à la création des modules d’enseignement psychosocial. À titre de kinésiologue, j’ai élaboré les routines d’exercices et supervisé l’ensemble des séances d’entraînement des participants. L’équipe du Dre Hélène Moffet du Centre
interdisciplinaire de recherche en réadaptation et intégration sociale (CIRRIS) a développé la plate-forme de
téléréadaptation et a élaboré l’interface logiciel de cette dernière (eChez-Soi). De plus, le Dre Moffet a effectué l’analyse des données en provenance des capteurs physiologiques de la forme. Le Dre Claude Vincent a collaboré à l’analyse des données de satisfaction envers la plate-forme. La Dre Lise Tremblay a participé aux discussions scientifiques qui ont permis la mise en place du protocole et à l’écriture de l’article. Les résultats émanant de ce projet de recherche ont fait l’objet d’une présentation orale lors du congrès de « l’European Respiratory Society» en Septembre 2015 à Amsterdam et l’article scientifique a été accepté pour publication dans la revue
1
2
SECTION 1 :
CANCER DU POUMON
1.1 Définition
Ces dernières années, principalement en raison du changement de mode de vie et du vieillissement de la population, la notion de cancer s’est beaucoup développée et l’intérêt envers ces pathologies atteint un sommet. Selon l’Organisation mondiale de la santé (OMS), le fardeau mondial du cancer a doublé au cours des trente dernières années et l’on estime qu'il devrait doubler de nouveau entre 2000 et 2020 et presque tripler d'ici 2030 1. Par ailleurs, au Canada le
cancer, qui est responsable de 30 % de tous les décès, s’est hissé au premier rang en ce qui concerne les causes de mortalité surpassant désormais les maladies cardiovasculaires 2.
Le cancer n’est pas une pathologie en soi, mais est plutôt une terminologie qui identifie un groupe de maladies hétérogènes pouvant affecter n’importe quel tissu d’un organisme. Il est causé par l’accumulation, de changements dans la séquence normale de l’ADN résultant en altérations, pertes ou amplifications de gènes, tels que plusieurs proto-oncogènes (régulateur positif de la prolifération cellulaire) et gènes suppresseurs de tumeur 3. Les oncogènes sont
fréquemment des activateurs de la multiplication cellulaire ou des inhibiteurs de l'apoptose (mort cellulaire programmée) tandis que les gènes suppresseurs de tumeurs induisent l'apoptose ou bloquent le cycle cellulaire. Ainsi, une modification de ces gènes peut entraver les fonctions normales et les propriétés de croissance cellulaire 3. Le cancer se caractérise ensuite par une perte
de contrôle sur la division cellulaire au sein d'un tissu normal de l'organisme entraînant une croissance incontrôlée et une perte de différenciation cellulaire menaçant ainsi la survie de ce tissu. Les nouvelles cellules résultantes peuvent envahir les tissus locaux et former une tumeur maligne (un néoplasme) et potentiellement se propager à travers le corps sous forme de métastases.
La majorité des cancers sont nommés selon leur origine primaire (partie du corps dans laquelle ils ont pris naissance) tels que le cancer du sein ou le cancer du poumon. Toutefois, d’autres nomenclatures peuvent exister et ainsi certains types de cancer doivent leur nom à la personne qui les a découverts (Exemple : lymphome hodgkinien) ou ont été nommés en fonction du type de tissu duquel ils sont issus (Exemple : Carcinome, sarcome, mélanome etc.).
3
1.2 Épidémiologie
« Toutes les heures, environ vingt personnes recevront un diagnostic de cancer et huit personnes mourront de cette maladie au Canada. Le cancer du poumon, le cancer du côlon et du rectum, le cancer de la prostate et le cancer
du sein représenteront environ la moitié des nouveaux cas diagnostiqués » 4.
Avec 1,6 million de nouveaux cas diagnostiqués chaque année et 1,3 million de décès, le cancer du poumon se classe au premier rang mondial des cancers en ce qui a trait à la mortalité 4. Ces
chiffres continuent d’augmenter d’année en année et l'on estime qu’en 2020, 2,2 millions de personnes recevront un diagnostic de cancer du poumon 5.
De façon générale, la prévalence du cancer du poumon chez les femmes se situe derrière les hommes puisque ces dernières ont commencé à fumer massivement plusieurs décennies après ceux-ci 5. Par conséquent, les taux de cancer du poumon chez les femmes sont en augmentation
dans de nombreux pays à l'exception des États-Unis, du Canada, du Royaume-Uni et de l’Australie, où ils plafonnent 5.
1.2.1 Incidence
Au Canada, en 2017, environ 28 600 personnes ont reçu un diagnostic de cancer du poumon, soit 14 400 hommes et 14 200 femmes 4. Le cancer du poumon est ainsi le deuxième cancer le
plus fréquent, tant chez les hommes que chez les femmes, représentant 14,1 % de tous les cancers 4. C’est chez les personnes âgées de plus de 70 ans que plus de la moitié de tous les cas
de cancer du poumon sont diagnostiqués.
Chez l’homme, l’incidence pour le cancer du poumon a commencé à se stabiliser au milieu des années 1980 et est en déclin depuis (soit d’environ -1,8% par année). Toutefois, en ce qui concerne les femmes, l’incidence est en progression depuis 1982, et a connu une hausse majeure de 1,1 % par année entre 1998 et 2007. Les projections à plus long terme suggèrent toutefois que ce taux commence à se stabiliser 4.
4
Chez les hommes autant que chez les femmes, l’incidence est la plus faible en Colombie-Britannique et est la plus élevée au Québec 4. Ce fait peut notamment être expliqué par la
variation de la présence des facteurs de risque du cancer, tel que le taux de tabagisme qui était historiquement plus élevé au Québec et dans les provinces de l’Atlantique 4.
1.2.2 Mortalité
Selon les statistiques canadiennes, en 2017, plus du quart (26 %) de tous les décès par cancer ont été attribuables au cancer du poumon 4. Avec un taux de mortalité à cinq ans de 85-90 % 6, ce
dernier demeure la principale cause de décès par cancer, et ce, tant chez les hommes que chez les femmes. En moyenne, chaque semaine, 406 Canadiens décèdent des suites de cette maladie
4. Plus particulièrement, c’est au Québec que le cancer du poumon enregistre le taux de mortalité
le plus élevé au pays en comptant pour près du tiers des décès par cancer, soit 32,5 % 4. De plus,
bien que le taux de mortalité par cancer du poumon soit en baisse chez les hommes, ce dernier continue d’augmenter chez les femmes ayant plus que triplé depuis 1975. Conséquemment, en 2017, le cancer du poumon a fait environ deux fois plus de victimes que le cancer du sein (10008 cas contre 5000, respectivement) 4. (Voir Figure 1 et Figure 2)
Figure 1 Taux de mortalité normalisés selon l’âge (TMNA) pour certains cancers, hommes,
5
Figure 2 Taux de mortalité normalisés selon l’âge (TMNA) pour certains cancers, femmes,
Canada, 1988–2017 4
1.2.3 Survie
Comme discuté dans la section précédente, le cancer du poumon est une pathologie ayant une mortalité élevée et enregistre un taux de survie relative à 5 ans de seulement 16 %. Ce pourcentage indique qu’une personne diagnostiquée d’un cancer du poumon aurait en moyenne 16 % de chances d’être encore en vie à 5 ans suivant son diagnostic. De plus, la survie relative du cancer du poumon à 5 cinq ans diminue en général au fur et à mesure que l’âge augmente, passant de 38 % chez les personnes âgées de 15 à 39 ans au moment du diagnostic à 9 % chez celles qui avaient 80 à 99 ans à ce moment-là 4.
Bien que le cancer du poumon présente un faible taux de survie global, il y a une très grande hétérogénéité en fonction du stade et du type de cancer du poumon. Ainsi, au diagnostic, les cancers du poumon de stade Ia et Ib ont un taux de survie à 5 ans de 50 et 43%, respectivement
7. La survie relative diminue au fur et à mesure que le stade augmente, passant de 36% au stade
IIa à 25 % au stade IIb, puis à 19 et 7 % pour les stades IIIa et IIIb. Finalement, avec un taux de survie à 5 ans de 2% 7, le pronostic des cancers de stade IV sera le plus faible.
6 1.2.4 Impact financier
En se référant aux taux élevés de prévalence et de mortalité qui sont associés au cancer du poumon, il n’est pas surprenant de constater que cette pathologie se révèle être très onéreuse pour la société. Les coûts des soins hospitaliers à eux seuls peuvent s’élever à près de 228 millions de dollars, totalisant 13 % de l’ensemble des coûts associés aux soins hospitaliers pour tous les types de cancers confondus 8. De plus, ce bilan s’alourdit davantage en ce qui a trait aux coûts
indirects associés à la mortalité. Dans cette catégorie, le cancer du poumon est responsable à lui seul de plus du quart du coût de la mortalité dû au cancer engendrant un coût considérable d’approximativement 3 milliards de dollars 8.
1.3 Types de cancer du poumon
Basée sur des critères histologiques, on peut dénombrer deux principaux types de cancer du poumon : le cancer du poumon « non à petites cellules » et le cancer du poumon à petites cellules. Cette
classification a des implications importantes pour la conduite clinique et le pronostic de la maladie puisque ces cancers se forment et progressent différemment et seront ainsi traités de façon distincte.
1.3.1 Cancer du poumon non à petites cellules :
Le cancer du poumon « non à petites cellules » (NSCLC) est la forme de cancer du poumon
la plus répandue et représente environ 80 % des cas 7,9. Ce type de cancer progresse moins
rapidement et offre donc le meilleur pronostic. Il se divise en trois sous-groupes, l’adénocarcinome, le carcinome épidermoïde et le carcinome à grandes cellules.
Adénocarcinome
Un adénocarcinome est une tumeur maligne qui se développe aux dépens d’un épithélium glandulaire. Les adénocarcinomes forment des masses hétérogènes qui se retrouvent davantage en périphérie et qui métastasent rapidement 10. Ce type de tumeur est fréquent chez les individus
qui présentent une pathologie pulmonaire sous-jacente 11. Depuis quelques années, les
adénocarcinomes ont surpassé les carcinomes épidermoïdes et se sont ainsi hissés au premier rang des types histologiques du cancer du poumon représentant 40 % de ces derniers 10. Bien
7
que les adénocarcinomes se développent de façon prépondérante chez les fumeurs, les non-fumeurs et les femmes sont plus susceptibles de développer ce type de cancer en particulier 3,12.
Carcinome épidermoïde
Représentant 31,2 % des cancers du poumon, le carcinome épidermoïde débute généralement près d'une bronche majeure 11. On peut retrouver au centre de la tumeur une cavité creuse
contenant du tissu nécrosé. Contrairement aux adénocarcinomes, les carcinomes épidermoïdes bien différenciés croissent lentement et vont généralement métastaser vers la fin de la maladie
13. Les métastases vont aller se loger de façon prédominante au foie, dans les glandes surrénales,
au cerveau, aux reins et aux os 13.
Carcinome à grandes cellules
Le carcinome à grandes cellules représente moins de 10 % des cancers pulmonaires. La majorité de ces tumeurs se présente comme étant des masses assez larges (en moyenne 7 cm) aux contours mal définis et ayant tendance à apparaître en périphérie 3,14. Ces tumeurs vont aussi croître
rapidement et former des métastases précocement au niveau lymphatique et hématogène 11,14.
1.3.2 Cancer du poumon à petites cellules
Le cancer du poumon à petites cellules est quant à lui une forme de cancer du poumon plus
rare (15-20 % des cas) 9, mais progresse et métastase plus rapidement que celui « non à petites
cellules ». Au moment du diagnostic, le risque que ce dernier se soit déjà dispersé et ait atteint d’autres organes est très élevé, et ainsi environ 50 % des patients ont des métastases distantes lors du diagnostic 11. Le foie, la moelle osseuse, les glandes adrénergiques et le cerveau sont des
sites fréquents de ces métastases 13.
1.4 Pathogenèse
Au cours des cent dernières années, notre compréhension de la pathogenèse du cancer du poumon a progressé de façon impressionnante. Plusieurs cancérogènes environnementaux et changements génétiques ont notamment été identifiés comme étant des déterminants
8
considérables de la susceptibilité à développer un cancer du poumon. Depuis les 25 dernières
années, les changements cellulaires etmoléculaires sous-jacents au cancer du poumon ont été
mieux compris, toutefois la progression par laquelle un épithélium respiratoire normal passe à l’état néoplasique n'est pas encore bien définie. Cependant, il est clair que l’exposition à des carcinogènes environnementaux, tels que ceux contenus dans la fumée de cigarette ou dans les fibres d’amiante, induit ou facilite cette transformation 15. De plus, la contribution de ces
substances carcinogènes au développement du cancer est modulée par des variations génomiques intrinsèques qui vont affecter l’aspect de leur métabolisme tel que la conversion des proto-oncogènes en oncogènes ainsi que leur inactivation 16. Les facteurs environnementaux
ainsi modifiés affectent probablement certains gènes spécifiques en déréglant d’importantes voies de signalisation qui vont permettre au phénotype de cancer de se manifester 3. Dans le
cancer du poumon, des anomalies dans les gènes codants pour ras, Rb, p53, Akt, LKB, et BRAF sont acquises de façon prépondérante 17. Toutefois, les anomalies génétiques ayant une plus
grande importance clinique et pouvant être présentent dans cette pathologie sont la mutation de l'EGFR (Epidermal growth factor receptor) 18 de même que celle du gène de l’ALK 19-21. Le fait de
comprendre la biologie moléculaire sous-jacente au cancer du poumon est cliniquement pertinent puisque les récentes avancées technologiques dans la détection de mutations et dans la quantification de l'expression génique permettront que les décisions thérapeutiques futures soient basées sur l'expression de cibles thérapeutiques spécifiques. Ainsi dans l’avenir, une thérapie basée sur les caractéristiques phénotypiques ou génotypiques d’une tumeur en particulier pourra être employée permettant ainsi d’améliorer la survie des patients 3.
1.5 Facteurs de risque
1.5.1 TabagismeDepuis près de 70 ans, une puissante relation causale entre le tabagisme et le cancer du poumon est bien établie 22,23. Cette dernière met bien en évidence que les fumeurs ont un risque de
développer un cancer du poumon environ 20 fois plus élevé comparé aux non-fumeurs 24. En
fait, il est intéressant de constater que la prévalence de cancer du poumon varie précisément à travers le monde en fonction de la prévalence du tabagisme 25. Ainsi, dans les pays développés
comme aux États-Unis par exemple, on estime que l’usage du tabac serait responsable de
9
On estime que 10-20 % des fumeurs vont développer un cancer du poumon. Ce risque varie cependant en fonction de plusieurs facteurs tels que la durée du tabagisme, le nombre de cigarettes fumées par jour, l’âge du début de tabagisme, le type de cigarettes fumées, la profondeur des inhalations et la susceptibilité génétique.
Mécanisme d’implication dans la pathologie
La fumée de cigarette contient au-delà de 4 000 produits chimiques dangereux, dont une soixantaine sont considérés comme étant hautement cancérigènes, tels que le benzène, l’arsenic et le plomb 26. Le tabagisme fait pénétrer ces éléments chimiques cancérigènes dans le système
pulmonaire détruisant de ce fait le système naturel de nettoyage et de réparation cellulaire. D’année en année, ces éléments vont s’accumuler dans les poumons des fumeurs causant des dommages à l’ADN, de l’inflammation et du stress oxydatif favorisant ainsi l’initiation et la croissance tumorale. La division et la multiplication cellulaire anarchique qui va se développer en tumeur maligne résultent donc essentiellement de ces lésions de l’ADN, et de l’incapacité du corps à les reconnaître et à les réparer.
Cessation tabagique :
Plusieurs études démontrent que le risque de développer un cancer du poumon est de l’ordre de vingt fois plus élevé chez les fumeurs que les non-fumeurs 27-29. Cependant, ce risque tend à
diminuer de moitié chez les individus qui ont cessé de fumer 28,29. De surcroît, chez les individus
ayant déjà un diagnostic de cancer du poumon à un stade précoce, le fait d’arrêter de fumer suivant le diagnostic doublerait les chances de survie à 5 ans 30. De plus, en fonction du
traitement, le fait d’être encore un fumeur actif peut avoir d’importantes répercussions. En ce qui a trait à la chirurgie, notamment, il semblerait qu’il y ait une augmentation de l’incidence des complications postopératoires de l’ordre de six fois chez ces patients 31. Il y a ainsi plusieurs
évidences qui suggèrent que l’abstinence tabagique est nécessaire durant quelques semaines précédemment à la chirurgie (4 à 8 semaines) afin de réduire l’incidence de ces complications 31.
Au niveau de la chimiothérapie, le fait de continuer à fumer pourrait même interagir directement sur les substances chimiothérapiques altérant ainsi les bénéfices thérapeutiques de ces dernières
32. On peut donc voir l’importance de promouvoir la cessation tabagique, et ce, même après
10 1.5.2 Autres causes du cancer du poumon
Même si le tabagisme est de loin la cause principale du cancer du poumon, les statistiques globales estiment que chez 15 % des hommes et 53 % des femmes, les causes ne sont pas attribuables au tabagisme 35. Ainsi, mondialement pas moins de 25 % de tous les cas de cancers
pulmonaires sont répertoriés chez des non-fumeurs 35. Jusqu’à aujourd’hui, les études
épidémiologiques ont identifié plusieurs facteurs environnementaux, génétiques, hormonaux et viraux qui sont associés avec le cancer du poumon 36. Parmi ceux-ci, on peut dénombrer le
tabagisme secondaire, la pollution atmosphérique ainsi que les expositions professionnelles à l'amiante et à certains autres agents cancérigènes présents sur les lieux de travail 37. Par exemple,
l'arsenic, le nickel, le radon, l'éther, le chrome, et les hydrocarbures aromatiques polycycliques sont tous des agents professionnels reconnus comme étant des cancérogènes pulmonaires.
Tabagisme secondaire :
Chez les non-fumeurs, l’exposition à la fumée secondaire est sans contredit un facteur de risque important de développer un cancer du poumon. La fumée secondaire, soit la fumée produite à l’extrémité d’une cigarette et celle expirée par le fumeur, est un mélange complexe de produits chimiques provenant de la combustion du tabac. Certains de ces composés ont même été mesurés à de plus grandes concentrations que dans la fumée principale. De plus, basé sur la présence de cotinine (un métabolite de la nicotine) dans les prélèvements urinaires ou sanguins, il est estimé que les fumeurs involontaires absorbent environ 0,5 à 1 % de la nicotine des fumeurs, soit l’équivalent d’une demi-cigarette par jour 3. L’Agence internationale de recherches sur le
cancer estime qu’il y a un risque accru de développer un cancer du poumon en raison d’une
exposition à la fumée secondaire de l’ordre de 35 % chez les hommes et de 25 % chez les femmes comparativement aux individus non exposés à cette dernière 38. Ainsi, selon le rapport du
National Research Council le tabagisme secondaire serait responsable d’environ 20 % des cancers
du poumon chez les non-fumeurs 39.
Radon :
Le radon et un produit de la dégradation de l’uranium et est associé avec le cancer du poumon chez les individus travaillant dans les mines d’uranium 40. Bien que chimiquement inerte, le radon
11
lorsqu’inhalés, vont adhérer à l'épithélium respiratoire. Ces derniers vont émettre des rayonnements α qui vont endommager l’ADN de façon directe 36. La radiation de ces particules
α est associée avec l’inactivation du gène suppresseur de tumeur p16 41.
Amiante :
D’après l’Organisation mondiale de la santé, le mot « amiante » est un terme commercial recouvrant plusieurs minéraux de silicate dont les formes cristallines sont fibreuses 42. Au début des années
60, la communauté scientifique a reconnu le lien entre l’amiante et le cancer pulmonaire et a démontré que l’exposition à l’amiante augmente le risque de développer le cancer du poumon à petites cellules ou non à petites cellules de façon significative 43. Depuis le milieu du vingtième
siècle, le risque de développer un cancer pulmonaire en raison de l’amiante a été largement étudié avec de nombreuses cohortes de travailleurs de l’amiante. De ces études, il est ressorti que l’exposition à l’amiante multiplierait environ par deux le risque de développer un cancer du poumon chez les travailleurs. Le niveau de risque varie cependant selon le degré de l’exposition, le procédé industriel, les dimensions des fibres et possiblement le type d’amiante 44,45. De plus,
même si un carcinome pulmonaire peut apparaître chez les non-fumeurs qui ont été exposés à l’amiante, le risque est grandement accru par le tabagisme46,47.
Susceptibilité génétique :
Plusieurs études ont fait mention que, même dans un milieu familial non-fumeur, les patients ayant des antécédents familiaux de cancer du poumon ont un risque augmenté de développer cette pathologie 48,49. De plus, ce dernier serait plus grand chez les femmes versus les hommes 50.
Une cause potentielle de cette augmentation de la susceptibilité réside dans le facteur de croissance épidermique (EGFR). Alors que les mutations sur le gène suppresseur de tumeur p53, sur les récepteurs au GRP (gastrin-releasing peptide) et sur le K-ras sont vues de façon prédominante chez les fumeurs, les mutations sur le EGFR apparaissent quant à elles presque uniquement chez les non-fumeurs 51. Cette mutation se présente rarement dans les carcinomes épidermoïdes ou
chez ceux à grandes cellules, par contre on la retrouve dans 10% des adénocarcinomes 51. Par
ailleurs, elle est significativement plus commune chez les femmes, pouvant ainsi expliquer pourquoi les femmes non-fumeuses sont deux à quatre fois plus susceptibles que les hommes de développer ce type de cancer du poumon 51.
12 Facteurs viraux :
Chez l'homme, on estime que 15 à 25 % des cancers peuvent avoir une étiologie virale 36. Le
virus du papillome humain (VPH) est l’un des virus les plus répandus dans le monde
contemporain et est reconnu comme étant un agent carcinogène important 52. Ainsi, certains
chercheurs ont émis l'hypothèse que ce dernier pouvait jouer un rôle dans la pathogenèse du
cancer du poumon 36. Une étude taïwanaise a notamment révélé qu’il y avait une prévalence
significativement plus élevée d’infections au VPH16 et au VPH18 chez une cohorte de femmes âgées de 60 ans et plus, non-fumeuses ayant un cancer du poumon 53. Plusieurs articles de revue
de la littérature sur le VPH confirment qu’il y a en effet une importante incidence d’ADN de
VPH chez les patients d’origine asiatique qui sont atteints d’un cancer pulmonaire et ainsi on
retrouverait cette dernière dans 9 à 42 % des tissus pulmonaires analysés 54. Cependant, la
fréquence à laquelle le VPH est présent dans les cas des cancers pulmonaires varie largement d’une région géographique à l’autre 36.
1.6 Diagnostic et stadification
Étant donné que le cancer du poumon se présente souvent de façon asymptomatique, soit dans environ 10 % des cas 55, il arrive fréquemment que la découverte d’une masse suspecte se fasse
de façon fortuite. Par la suite s’enclenchera l’investigation pulmonaire proprement dite et les différents tests diagnostiques seront effectués pour i) confirmer la malignité et le type histologique et ii) déterminer le stade de cancer le cas échéant.
Les différentes épreuves diagnostiques peuvent comporter un examen physique, des épreuves de laboratoire (bilan sanguin, tests de fonction pulmonaire, analyse cytologique des expectorations) et des examens d’imageries (radiographie, échographie, tomodensitométrie (TDM), tomographie par émission de positrons (TEP-SCAN), imagerie par résonance magnétique (IRM). Le diagnostic officiel de cancer du poumon est habituellement effectué suite à une bronchoscopie ou une biopsie d’un tissu atteint, via l’analyse histologique des tissus prélevés par biopsie. S’il s’avère que les différents tests confirment la présence d’un cancer du poumon, d’autres examens cliniques devront potentiellement être effectués afin de déterminer jusqu’où la maladie s’est propagée et ainsi connaître plus précisément le stade et l’étendue du cancer.
13
Ce sont ces mêmes tests qui permettront de déterminer la stadification. Tout d’abord, les analyses biochimiques sanguines indiqueront la qualité de fonctionnement de certains organes et serviront à détecter des anomalies reflétant une atteinte de ceux-ci. Les tests d’imageries (ci-haut mentionnés) permettront de détecter si le cancer du poumon s’est propagé aux ganglions lymphatiques, aux tissus ou aux organes voisins. En dernier lieu, le prélèvement de ganglions lymphatiques et de tissus via une endoscopie et/ou une biopsie permettra de mettre en lumière la propagation du cancer et ainsi d’établir le stade. La stadification est une étape particulièrement importante, puisqu’elle diffère selon le type de cancer du poumon et qu’elle sera déterminante dans la prise en charge thérapeutique du patient.
1.6.1 Cancer du poumon non à petites cellules
Le cancer du poumon non à petites cellules peut se subdiviser en quatre stades en fonction de l’étendu de la maladie soit :
Stade I : Le cancer est présent dans une seule partie du poumon
Stade II : Le cancer s'est répandu dans les gites ganglionnaires à proximité ou les tissus
proches, par exemple dans la paroi de la cage thoracique
Stade III : Le cancer s'est répandu de manière considérable dans la poitrine,
généralement pour atteindre les sites ganglionnaires
Stade IV : Le cancer s'est répandu vers d'autres parties du corps, comme le foie ou les
os.
Le fait d’avoir une stadification précise est d’une importance primordiale pour évaluer l'étendue de la maladie chez les patients diagnostiqués avec un cancer du poumon afin d’opter pour le
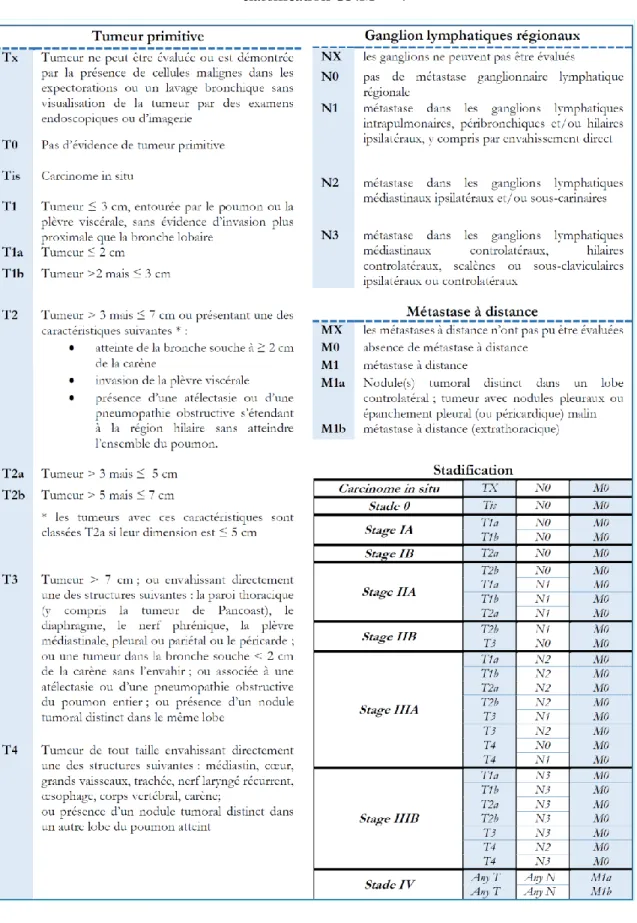
traitement approprié 56,57. L’utilisation du système TNM sert de fondement afin d’établir
cette stadification qui se base sur l’étendue anatomique du cancer. Les trois lettres
symbolisent la propagation de la maladie cancéreuse i) sur le site de la tumeur primitive (T), ii) dans les ganglions lymphatiques voisins (N pour node en anglais) et iii) à distance pour d’éventuelles métastases (M) 7. Chaque lettre est ensuite affectée d’un coefficient caractérisant le
volume, l’étendue ou le territoire touché par la lésion 58. Présenté au Tableau 1, la stadification
du cancer du poumon non-à-petites-cellules en fonction de la classification TNM a permis d’avoir une stratification améliorée de la survie parmi les sous-groupes de patients 58-60.
14
Tableau 1 Stadification du cancer du poumon non-à-petites-cellules en fonction de la
classification TNM 58-60.
15 1.6.2 Cancer du poumon à petites cellules
Puisque le cancer du poumon à petites cellules a tendance à se développer et à se propager rapidement, son évolution se divise uniquement en deux stades soit, le stade « limité » et le stade « étendu ».
Stade limité : Des cellules cancéreuses sont présentes dans un seul poumon et dans les ganglions lymphatiques voisins. Elles peuvent également être décelées dans le liquide pleural.
Stade étendu : Le cancer s’est propagé à l’extérieur du poumon dans la région thoracique ou d’autres parties du corps.
1.7 Traitements
Les traitements utilisés pour le cancer du poumon peuvent inclure la chirurgie, la chimiothérapie, la radiothérapie, la thérapie ciblée, et ce de manière individuelle ou en combinaison. Le choix du traitement sera effectué en fonction des objectifs thérapeutiques visés soit : pour traiter le cancer, pour prolonger l’espérance de vie ou pour améliorer la qualité de vie du patient. De plus, le traitement variera selon le type de cancer du poumon, le stade d’évolution de la maladie ainsi que l’état physiologique et psychologique du patient.
1.7.1 Chirurgie
Chez les individus atteints de cancer du poumon « non à petites cellules » (NSCLC) localisé, la résection pulmonaire demeure la meilleure option thérapeutique 61. Cependant, seulement 20 à
25 % des patients s’avèrent opérables puisque la chirurgie est habituellement indiquée uniquement pour les carcinomes de petite taille qui sont limités à un seul poumon et qui ne s’étendent pas au-delà du stade IIIA 7. En fonction de la position et de la taille de la tumeur,
l’intervention chirurgicale effectuée sera soit une résection cunéiforme périphérique (résection d'une partie d'un lobe), une segmentectomie (résection d'une division anatomique d'un lobe), une lobectomie (un lobe), une bilobectomie (deux lobes), ou une pneumonectomie (poumon entier).
Chez les patients atteints de cancer du poumon non à petites cellules résécables, la lobectomie avec ablation complète de la tumeur reste la procédure chirurgicale standard 62 . Toutefois, malgré
16
l’amélioration de la survie suite à cette chirurgie, il n’en demeure pas moins que le taux de morbidité et de mortalité résultant de complications cardio-pulmonaires reste considérable 63-67.
On estime que ces dernières vont se présenter chez environ 30 % des patients subissant une chirurgie de résection pulmonaire et vont engendrer un taux de mortalité dans les trente jours variant entre 0.6 % et 5 % dépendamment de l’étendue de la résection 68,69. L'opération
chirurgicale en elle-même a quant à elle un taux de décès d'environ 4,4 %, en fonction de l'état des poumons du patient et des autres facteurs de risque 70.
Le tabagisme actif, l’âge avancé, les maladies pulmonaires sous-jacentes, les symptômes physiques, la fatigue, la dépression et l’obésité sont tous des facteurs de risques de complications postopératoires connues 71,72. Même si la mesure des fonctions pulmonaires s’avère efficace pour
quantifier la sévérité des maladies pulmonaires, son efficacité pour établir le risque chirurgical reste néanmoins questionnable 73. Ce fait s’expliquerait notamment par l’incapacité de ce dernier
à prédire le statut fonctionnel 73. Dans cette optique, les épreuves d’effort ont été préconisées
chez les patients ayant des fonctions pulmonaires limites afin de déterminer les candidats pour une chirurgie de résection pulmonaire 74,75.
La mesure de la capacité à l’effort peut donc augmenter la sensibilité et la spécificité pour estimer la morbidité et la mortalité postopératoire 76,77. Le rôle des tests d’effort maximal est d’engendrer
un stress sur l’ensemble du système cardio-pulmonaire permettant ainsi d’estimer la réserve physiologique qui sera disponible suite à la chirurgie de résection pulmonaire 78. D’ailleurs, chez
les individus atteints de cancer du poumon, cette mesure est à ce jour considérée comme étant le meilleur moyen de prédire les complications cardio-pulmonaires suite à cette procédure
74,76,79,80. La détermination de la consommation maximale d’oxygène (V̇O
2max) fait donc partie
des recommandations pour stratifier le risque de complications postopératoires 81. Ainsi, on
estime que les patients avec un V̇O2max de 15-20 ml/kg/min peuvent subir la chirurgie de
résection pulmonaire avec un taux de mortalité acceptable 74,76,79,82, alors que ceux avec un
V̇O2max inférieur à 10 ml/kg/min ont un risque très élevé de décès suite à la procédure
chirurgicale 81,82. Les patients se situant entre 10 et 15 ml/kg/min ont quant à eux un risque de
mortalité postopératoire augmenté 67,74,80,82 et les options de traitements non chirurgicaux