CARACTÉRISATION DE LA PROTECTION CONFÉRÉE AUX CELLULES MAMMIFÈRES PAR DES PROTÉINES RECOMBINANTES DE BLÉ LORS DE
LA CRYOCONSERVATION
THÈSE PRÉSENTÉE
COMME EXIGENCE PARTIELLE DU DOCTORAT EN BIOCHIMIE
PAR
MÉLANIE CHOW-SHI-YÉE
I
Avertissement
La diffusion de cette thèse se fait dans le respect des droits de son auteur, qui a signé le formulaire Autorisation de reproduire et de diffuser un travail de recherche de cycles supérieurs (SDU-522 - Rév.07-2011). Cett~ autorisation stipule que «conformément à l'article 11 du Règlement no 8 des études' de cycles supérieurs, [l'auteur] concède à l'Université du Québec à Montréal une llicence non exclusive d'utilisation et de publication de la totalité ou d'une partie importante de [son] travail de recherche pour des fins pédagogiques et non commerciales. Plus précisément, [l'auteur] autorise l'Université du Québec à Montréal à reproduire, diffuser, prêter, distribuer ou vendre des copies de [son] travail de recherche à des fins non commerciales sur quelque support que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une renonciation de [la] part [de l'auteur] à [ses] droits moraux ni à [ses] droits de propriété intellectuelle. Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de commercialiser ou non ce travail dont [il] possède un exemplaire.»
Je voudrais tout d'abord remercier la Dre Diana Averill de m'avoir accueillie dans son laboratoire, de m'avoir permis de vivre cette belle et enrichissante expérience et de m'avoir fait confiance. Merci également au Dr François Ouellet d'avoir cru en moi et de m'avoir fait confiance que ce soit pour ma thèse mais aussi pour les charges de cours. Vous m'avez été d'un grand soutien dans ma vie professionnelle mais aussi personnelle et cela m'a permis d'avancer et d'achever cette thèse.
Je voudrais également remercier mes évaluateurs, Dre Ann English, Dre Catherine Jumarie et Dre Tatiana Scorza d'avoir accepté de mettre leur temps, leur expertise et leur savoir à ma disposition pour corriger ma thèse. Un merci particulier à Tatiana Scorza pour sa confiance, sa reconnaissance et ces années à collaborer dans les laboratoires d'enseignement.
Je souhaite également remercier mes collègues Claire Chabrol et Khadija Rezki, pour votre soutien dans ces derniers moments de ma thèse, de votre écoute malgré toutes mes plaintes et de votre bonne humeur et la Dre Mélanie Grondin de m'avoir formée, enc.adrée et àidée pendant toutes ces années. Merci également à Arnaud Cheuk et « le petit» William Bouard de m'avoir écoutée encore et encore me plaindre, de votre soutien mais également pour tous ces fous rires et parties de cartes.
Je tiens également à remercier mes anciennes collègues mais surtout amies: Audrey Glory, Maureen Redza, Bélinda Crobeddu, Marceline Tchouagé, Clara Lafortune pour
L_
leur présence même après leur départ, tous les fous rires, leur bonne humeur et leur aide. Vous avez toujours été là pour me soutenir et vous m'avez grandement aidée dans mes choix. Vous avez également écouté toutes mes blagues idiotes sans trop de jugement et j'apprécie grandement. Et un plus gros merci à Sarah Kassis, pour tout!
Je remercie également toutes les personnes du 3e étage, les techniciens, Denis Flipo ( et ses chocolats), Luc Dubé, Marie Josée Carbonneau, Maude Ethier-Chiasson pour votre expertise, de m'avoir aidée, d'avoir fait en sorte que mes années se déroulent bien et de votre bonne humeur.
Sur unè note plus personnelle, je voudrais remercier tous mes amis pour leur soutien, mes parents pour avoir toujours cru en moi, de m'avoir poussée et aidée à réaliser mes objectifs et faire en sorte que je le fasse dans les meilleures conditions. Un grand merci à ma petite sœur Émilie qui m'a toujours soutenue, écoutée et qui m'a fait prendre conscience que je suis bien plus capable que je ne le pensais. Et etifin merci à mon conjoint, Olivier Mornet, pour toutes ses attentions qui m'ont permis d'arriver jusque-là, de n'avoir jamais douté de· ma réussite et de me le rappeler constamment et surtout d'avoir supporté toutes mes périodes de stress.
LISTE DES FIGURES ... viii
LISTE DES TABLEAUX ... xi
LISTE DES ABRÉVIATIONS ... ; ... xii
RÉSUMÉ ... · ... XV CHAPITRE I REVUE DE LA LITTÉRATURE ... l 1.1 Le foie ... 1
1.1.1 Description ... ; ... 1
1.1.2 Rôle du foie ... ; ... 2
1.1.3 Importance des hépatocytes dans les domaines pharmaceutiques et médicaux 4 1.2 Le pancréas ... _ ... 6
1.2.1 Description···:··· ... , ... 6
1.2.2 Le diabète ... 7
1.2.3 Importance des cellules pancréatiques dans le domaine médical.. ... 9
1.3 La cryoconservatiqn ... 9
1.3-.1 Principe ... 9
1.3 .2 Effets négatifs de la cryoconservation ... 10
1.3.3 Diverses méthodes de cryoconservation ... ~ ... 11
1.4 Le stress oxydatif : induit lors de la cryoconservation ... 29
1.4.1 Les espèces réactives de l'oxygène (ROS) et de l'azote (RNS) ... 29
1.4.2 Sources cellulaires de ROS et RNS ... 32
1.4.3 Les fonctions cellulaires des ROS ... 34
1.4.4 Les défenses antioxydantes ... 35
1.4.5 Les antioxydants de nature enzymatique ... 36
1.4. 7 Le stress oxydatif et ses effets néfastes ... 40
1.5 L'apoptose ... , ... 46
1.5.1 Les caspases ... · ... : ... 47
1.5.2 La voie extrinsèque de l'apoptose ... 49
1.5.3 La voie mitochondriale de l'apoptose ... ; ... 50
1.5.4 La voie du RE ... 55
1.6 Autre voie de mort cellulaire: la nécrose ... 59
1.7 Présentation de projet ... · ... 63
1.7.1 Objectif général ... 65
1.7.2 Hypothèses ... 65
1.7.3 Objectifs spécifiques ... : ... 66
1. 7.4 Choix des modèles cellulaires ... 67
CHAPITRE II ARTICLE I: « Wheat enolase demonstrates potential as a non-toxic cryopreservation agent for li ver and pancreatic cells » ... 69
2.1 Résumé ... ~ ... 72
. 2.2 Abstract ...•... 73
2.3 Introduction ... 7 4 2.4 Materials and methods ... 77
2.5 Results ... 81
2.6 Discussion ... 86
2. 7 References ... 91
2.8 Figures ...•... 95
CHAPITRE III ARTICLE II:« Plant protein 2-Cys peroxiredoxin TaBAS1 alleviates oxidative and nitrosative stresses incurred during cryopreservation of mammalian cells » ... · ... .' ... 100
3.1 Résumé ... ; ... 103
3.2 Abstract ... : ... 104
3
.3 Introduction ... · ... 1053.4 Materials and methods ... 108
3.6 Discussion ... 116
3. 7 References ... ; ... 122
3.8 Figures ... : ... ; .... 127
CHAPITRE IV ARTICLE III:« Inhibition of ice recrystallization and cryoprotective activity ofwheat proteins in liver and pancreatic cells
» ...
1354.1 Résumé ...•... 137
4.2 Abstract ... · ... 138
4.3 Introduction ... 139
4.4 Results ... 142
4.5 Discussion ... 146
4.6 Materials and methods ... 152
4. 7 References ... 156
4.8 Figures ...•... 161
CHAPITRE V ARTICLE IV: « Control of apoptosis by wheat proteins during cryopreservation of rat hepatocytes » ... 1 72 5.1 Résumé ... 174
5.2 Abstract ... ; ... 175
5.3 Introduction ... 176
5.4 Materials and methods ... 180
5 .5 Results ... 183
5.6 Discussion ... 188
5. 7 References ... 196
5.8 Figures ... ~ ... _ ... 200
CHAPITRE VI DISCUSSION GÉNÉRALE ... 205
6.1 Nouvelles stratégies de cryoconservation utilisant des protéines de blé ... 207
6.2 Efficacité de cryoconservation des protéines de blé: WCS120 et TaIRI-2 ... 208
6.3 L'efficacité de cryoconservation des nouveHes protéines: TaENO et TaBASl 209 6.4 Mécanismes de protection des cellules par les protéines recombinantes de blé : stress oxydatif et nitrosatif ... 213
6.5 Mécanismes de protection des cellules par les protéines recombinantes de
blé : mort cellulaire ... 218 CONCLUSION ET PERSPECTIVES ... 226 BIBLIOGRAPHIE ... 229
Figure Page
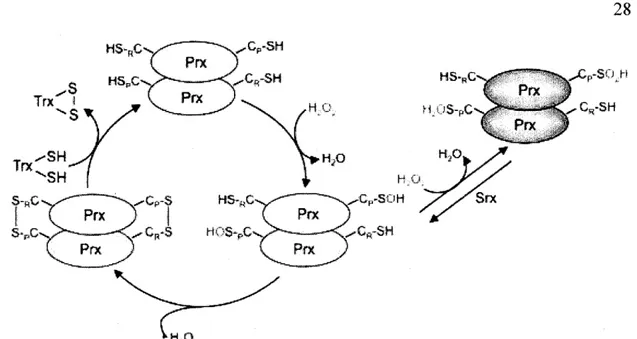
1.1 Cycle de peroxydation d'une 2-Cys Prx eucaryote ... 28
1.2 Types d'espèces réactives de l'oxygène et de l'azote produits dans les cellules ... 31
1.3 Voie de signalisation de la défense antioxydante cellulaire ... 41
1.4 Effets négatifs des ROS sur les fonctions cellulaires et induction de l'apoptose ... 42
1.5 La voie des récepteurs de mort de l'apoptose ... 51
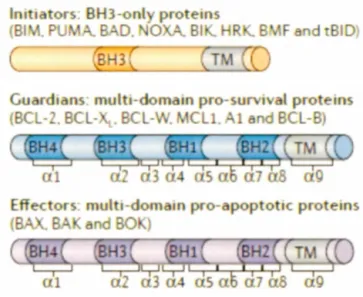
1.6 Classification des protéines de la famille Bcl-2 selon leur domaine BH ... 52
1. 7 Voie mitochondriale de l'apoptose ... 54
1.8 Voie de signalisation de l'UPR ... 58
1. 9 V oie de signalisation de l'apoptose induite par le stress du RE ... 61
1.10 Rôle du calcium et des ROS dans l'UPR ... 62
2.1 Chromatographie separation of wheat protein extract identifies enolase as a candidate cryoprotective agent for hepatocytes ... 95
2.2 Enolase is an efficient cryoprotectant for hepatocytes and INS832/13 cells .. 96
2.3 Cells cryopreserved with enolase retain good morphology and high levels of metabolic activity ... : ... 97
2.4 Enolase protects fresh, non-cryopreserved cells against oxidative and nitrosative stress ... ~ ... 98
2.5 Enolase prevents oxidative and nitrosative stress during cryopreservation
in hepatocytes ... : ... 99
3 .1 Wheat 2-Cys peroxiredoxin TaBAS 1 and humill?- 2-Cys peroxiredoxins PRD 1-4 share conserved residues involved in peroxidase activity ... 127
3 .2 The recombinant TaBAS 1 protein possesses peroxidase and holdase activities in vitro ... , ... 128
3.3 TaBAS 1 efficiently cryopreserved hepatocytes and INS832/13 cells ... 129
3.4 Cells cryopreserved with TaBASl show good morphology and adhesion properties post~thaw ... 130
3.5 Metabolic functions are well-maintained post-thaw in cells cryopreserved with TaBAS1 ... · ... 131
3 .6 TaBAS 1 protects fresh, non-cryopreserv~d cells against oxidative and nitrosative stress ... 13 3 3.7 TaBASl prevents oxidative and nitrosative stress incurred in cells during cryopreservation ... 134
4.1 Intemalization of recombinant wheat proteins in hepatocytes ... 161
4.2 Intemalization study ofrecombinant wheat proteins in INS832/13 ce~ls ... 162
4.3 Intemalization study of recombinant wheat proteins in hepatocytes after thawing .: ... ; ... ~ ... 163
4.4 Intemalization study of recombinant wheat proteins in INS832/13 cells after thawing ... 164
4.5 Wheat proteins modify ice recrystallization ... 165
4.6 IRI activity ofwheat proteins ... 166
4. 7 The wheat proteins do not possess thermal hysteresis capacity ... 167
4.8 Viability of rat hepatocytes following cryopreservation with different wheat pro teins ... : ... 168
5 .1 Induction of apoptosis during cryopreservation of hepatocytes with
DMSO: protective anti-apoptotic effects of plant proteins ... 200 5.2 Anti-apoptotic effects of plant proteins during cryopreservation of
hepatocytes: inhibition of effector caspases and cleavage of P ARP ... 201 5 .3 Plant proteins decrease activation of initiator caspases during
cryopreservation of hepatocytes ... 202 5.4 Plant proteins decrease the Bax/Bcl-2 protein ratio of Bcl-2 family
proteins during cryopreservation of hepatocytes ... 203 5 .5 Activation of ER pathway of apoptosis during cryopreservation of
Tableau Page 3.1 Activity of cytochrome P450 isofonn CYPiAl/2 in fresh and
ADN AFP Apafl
ARN
ATP BAK BASlBAX
Bcl-2 BHBid
BiP/GRP78 BSA CARD CHOP CYP450 DAF Acide désoxyribonucléiqueProtéine antigel « Antifreeze protein »
Facteur-1 d'activation des protéases apoptotiques « Apoptotic
protease activating factor 1 »
Acide ribonucléique Adénosine triphosphate
Tueur antagoniste homologue de Bcl-2 « Bcl-2homologous antagonist killer »
2-Cys peroxirédoxine BAS 1
Protéine X associée à Bcl-2 « Bcl-2-associated X protein »
Protéine de lymphome de cellules B 2 « B-cell lymphoma protein 2 »
Domaines d'homologie à Bcl-2 « Bcl-2 homology domain »
Agoniste des domaines de mort interagissant avec BH3
«
BH3
-interacting death domain agonis!
»
Protéine de liaison d'immunoglobuline « Binding
immunoglobulin protein »
Albumine de sérum bovin
Domaine de recrutement et d'activation des caspases « Caspase
recruitment domain »
Protéine homologue de C-EBP « C-EBP homologous protein »
Cytochrome P450 Diamino fluorescéine
DHE DISC DMSO eIF2a ERK EROla Gpx GSH GSSG H2DCFDA HSP ICAD INS IREl IRI MBPl MS/MS NFKB NOS NOX PARP PBS PERK Dihydroethidium
Complexe de signalisation induisant la mort « Death-inducing signaling complex »
Diméthyle sulfoxyde
Facteur d'initiation 2a eucaryote « Eukaryotic initiation factor 2a »
Kinase régulée par des signaux extracellulaire « Extracellular signal-regulated kinases » Oxydoréductase du RE la Glutathion peroxydase Glutathion Disulfure de glutathion 2'-7'-dihydrodichloro-fluoresceine diacétate
Protéines de choc thermique « Heat shock proteins »
Inhibiteur de la ADNase activée par caspase « caspase-activated DNase » (CAD)
Cellule sécrétrice d'insuline« Insulin secreting ce!!»
Enzyme 1 nécessitant l'inositol « lnositol-requiring protein 1 »
Inhibition de la recristallisation des cristaux de glace « !ce recrystallisation inhibition »
Protéine liant le promoteur Mye «
Mye
promoter-binding protein-1 »Spectrométrie de masse en tandem
Facteur nucléaire Kappa B « Nuclear factor Kappa B »
Oxyde nitrique synthase NAD(P)H oxydase
Poly (ADP-ribose) polymérase
Tampon phosphate. salin « phosphate-buffered saline »
PI Prx RE RNS ROS SOD TaBAS1 TaENO TaIRI TH TNFR UPR
wcs
WPEx·
XBPlxo
Iodure de propidium « Propidium iodide » Peroxirédoxines
Réticulum endoplasmique
Espèces réactives de l'azote« Reactive nitrogen species » Espèces réactive de l'àxygène « Reactive oxygen species » Superoxyde dismutase
2-Cys peroxirédoxine de Triticum aestivum Énolase de Triticum aestivum
Protéine inhibitrice de la recristallisation des cristaux de glace de Triticum aestivum
· Hystérèse thermique « Thermal hysteresis »
Récepteur des facteurs de nécrose tumorale « Tumor necrosis
factor receptor »
Réponse aux protéines dépliées/mal repliées « Unfolded
protein response »
Protéine de blé spécifique au froid « Wheat Cold Specific protein »
Extrait de protéine de blé « Wheat protein extract » Xanthine
Protéine de liaison à la X-box 1 «X-box binding protein 1 »
Les hépatocytes constituent un bon modèle physiologique en médicine et pharmacologie. Les îlots de Langherans sont également très utilisés dans ces domaines. De plus, ces deux éléments sont une alternative à la greffe d'un organe entier. Ces cellules sont isolées par chirurgie et le surplus est conservé grâce à la cryoconservation. Le cycle de gel et dégel peut causer des dommages qui sont évités ou diminués par l'utilisation d'agents de cryoconservation comme le diméthyle sulfoxyde (DMSO). L'inconvénient est qu'il est cytotoxique. L'objectif général du projet a été de développer de nouveaux agents de cryoconservation plus efficaces et moins toxiques afin d'améliorer les protocoles actuels de cryoconservation des hépatocytes et des cellules pancréatiques. Une alternative était d'utiliser des protéines de blé d'hiver
Triticum aestivum L., qui sont associées avec la tolérance au gel. Un extrait brut de
protéines de blé d'hiver a d'abord été testé comme agent de cryoconservation et il a permis de conserver efficacement des cellules de foie et une lignée cellulaire de pancréas. Afin d'identifier des protéines cryoactives individuelles, deux protéines déjà connues pour leurs rôles dans la tolérance au gel chez les plantes ont été testées comme agents de cryoconservation, seules ou en combinaison : la protéine de blé spécifique au froid WCS120, et la protéine de blé inhibitrice de la recristallisation de la glace TaIRI-2. Par la suite, deux autres protéines ont été identifiées dans l'extrait brut de protéines de blé: l'énolase (TaENO) et la 2-Cys peroxirédoxine (TaBAS1). Le premier objectif de ce projet était d'évaluer l'activité cryoprotectrice de TaENO et de TaBASl. Il a été
possible de voir, par marquage à l'iodure de propidium, que TaENO et TaBAS1
permettent d'obtenir des taux de viabilité cellulaire supérieurs à ceux des cellules congelées avec du DMSO. Le maintien des fonctionnalités cellulaire a également été vérifié. La sécrétion d'urée a été évaluée chez les hépatocytes et les tests démontrent que les cellules congelées avec TaENO ou TaBAS 1 sont plus fonctionnelles que celles congelées avec du DMSO. Concernant les cellules pancréatiques, l'évaluation de la sécrétion d'insuline induite par le glucose a permis de démontrer une meilleure efficacité des protéines. Lors de la congélation, du stress oxydatif peut être induit et pourrait causer la mort cellulaire. L'utilisation de sondes fluorescentes permettant de détecter certaines espèces réactives de l'oxygène et de l'azote a montré que TaENO et TaBAS1 n'induisent pas de stress aux cellules comparé au DMSO. Le second objectif a été de déterminer les mécanismes de protection des protéines. Dans un premier temps, nous avons déterminé, en marquant les protéines avec une sonde fluorescente Oregon
Green et en les observant par microscopie confocale, que seules TaIRI-2 et TaENO sont internalisées lors de la cryoconservation. Ensuite, nous avons déterminé si les protéines inhibent la recristallisation des cristaux de glace et/ou modifient l'hystérèse thermique (TH). Aucune des protéines ne possède une activité TH et seules TaIRI-2 et TaENO inhibent la recristallisation. Enfin, le troisième objectif était de déterminer le type de mort induit lors de la cryoconservation et de comprendre comment les protéines protègent les cellules contre celle-ci. Les cellules ont été marquées avec la sonde Annexine-V. Le clivage de la protéine poly (ADP-ribose) polymérase (PARP) et l'activation des caspases exécutrices, caspase 3 et caspase 7, ont été détectés. Les hépatocytes subissent principalement l'apoptose lors de la cryoconservation avec le . DMSO. En effet, le DMSO active les voies de la mitochondrie et du réticulum endoplasmique. Au contraire, les protéines de plantes atténuent l'activation d'au moins une de ces deux voies. En conclusion, cette recherche a permis le développement de nouveaux agents de cryoconservation plus efficaces que ceux déjà existants mais aussi la compréhension des mécanismes de protection des cellules par les protéines. De plus, la compréhension du processus de mort enclenché lors de la cryoconservation permettra d'améliorer les protocoles de conservation afin d'augmenter la disponibilité des cellules ainsi que leur qualité à des fins pharmacologiques ou médicales. Cette étude constitue une avancée importante dans le domaine de la cryobiologie.
Mots clés : cryoconservation, hépatocytes, cellules pancréatiques, protéines recombinantes de blé, apoptose, stress oxydatif
REVUE DE LA LITTÉRATURE
1.1 Le foie 1.1.1 Description
Le foie est un organe abdominal situé juste en dessous du diaphragme. C'est l'organe interne le plus volumineux du corps qui représente de 2 à 5% du poids d'un adulte. Il est formé de deux lobes principaux et de deux petits lobes accessoires. D'un point de vue fonctionnel et anatomique, la structure interne du foie est organisée en unités individuelles. Ces unités sont appelées lobules hépatiques et correspondent en fait à des subdivisions des lobes qui sont séparées par du tissu conjonctif. Ces espaces conjonctifs s'élargissent et se regroupent au niveau de ce qu'on appelle l'espace porte (Nguyen et Bourouina, 2008; Schulte et al., 2017). L'apport sanguin au foie se fait grâce à la veine porte qui amène le sang du tube digestif et de la rate, donc le sang riche en nutriment. L'artère hépatique apporte au foie le sang artériel donc oxygéné. L'organisation structurale du foie reflète ses fonctions remarquables (Hofmann, 1994; Schulte et al., 2017). Il est l'organe le plus important d'un point de vue métabolique et il remplit de nombreuses fonctions au sein de l'organisme.
Le foie est constitué de différents types cellulaires incluant les hépatocytes, les cellules endothéliales, les cellules éto~lées, de Kupffer ainsi que les cellules biliaires. La masse du foie est constituée à 80% des hépatocytes et des cellules parenchymateuses. Bien que d'autres cellules hépatiques jouent un rôle important dans divers aspects de la
physiologie du foie, les hépatocytes présentent une valeur inégalée de complexité et de diversité de fonctions (Guguen-Guillouzo et Guillouzo, 2010).
1.1.2 Rôle du foie
Le foie possède de nombreuses fonctions comme le contrôle du métabolisme des glucides qui permet de maintenir une concentration normale du glucose à la fois pour de courtes et longues périodes de temps (Postic et al., 2004). En effet, il permet de stocker le glucose sanguin sous forme de glycogène lors de la glycogénogenèse mais également à partir de précurseurs non glucidiques comme le lactate, les acides aminés et le glycérol grâce au processus de la néoglucogenèse. Ce glucose peut également être libéré grâce au mécanisme de glycogénolyse qui permet la lyse du glycogène (Hofmann, 1994; Postic et al., 2004). Pour ce faire, les hépatocytes possèdent une douzaine d'enzymes qui sont alternativement activées ou désactivées en fonction du niveau de glucose dans le sang. Après un repas le foie prend une partie des glucides ingérés pour restaurer les réserves de glycogène. Après l'étape d'absorption (pendant la nuit par exemple), la production de glucose hépatique assure un apport de glucose au système nerveux central et en même temps, le foie régule les concentrations de glucose dans le plasma à jeun. Ces mécanismes sont principalement régulés par l'insuline qui est une hormone hypoglycémiante (Saltiel et Kahn, 2001; Postic et al., 2004). De plus, la glycolyse dans le foie permet de fournir du carbone pour la synthèse lipidique (Postic et al., 2004). En plus d'être l'organe principal de la glycogenèse, le foie permet également la lipogenèse, le métabolisme du cholestérol (Hofmann, 1994; Bechmann et al., 2012) et l'entreposage des vitamines (Hofmann, 1994). La lipogenèse hépatique permet la synthèse d'acides gras.à partir d'acétyl-CoA ou de malonyl-CoA et le foie permet le traitement des triacylglycérols (Bechmann et al., 2012).
Le fole joue également un rôle important dans la dégradation de l'ammoniac grâce au cycle de l'urée. Les acides aminés issus de la'dégradation des protéines peuvent subir
deux sorts qui sont soit de produire de·nouvelles protéines, soit d'être dégradés. Ainsi l'ammoniac du groupement amine de ces acides aminés est pris en charge par les hépatocytes et est transformé en urée permettant ainsi de détoxifier l'organisme de cet élément potentiellement toxique (Hofmann, 1994; Weiner et al., 2015).
Le foie est le lieu de synthèse et de sécrétion de l'albumine qui est une protéine plasmatique jouant de no~breux rôles. En effet, celle-ci permet le transport de nombreuses molécules telles que les hormones, les acides gras, les médicaments, etc. Elle joue également un rôle dans la régulation de la pression osmotique et est antioxydante (Quinlan et al., 2005).
Le foie permet aussi la métabolisation des substances toxiques, des médicaments ainsi que des hormones stéroïdiennes. Il représente un site majeur de la biotransformation enzymatique des substances liposolubles. La biotransformation des substances endogènes et exogènes se· fait en deux phases. La phase I permet l'oxydation, la réduction et l'hydrolyse des substances. La famille du cytochrome P450 (CYP450) est un élément majeur de la phase I. Lors de la phase II, on observe la conjugaison des groupes polaires des métabolites de la phase I avec le glutathion, l'acétate, le glucuronate, le sulfate ou la glycine. Certains composés vont passer à la phase II sans
passer par la phase I. De ces phases résultent des métabolites très hydrosolubles pouvant être excrétés par les reins (Hofmann, 1994; Benet et al., 1996; Wolf et al., 2015).
Les CYP450 sont une famille de protéines essentielles pour la métabolisation des substances endogènes et exogènes permettant des changements d'oxydation, de réduction et de peroxydation sur des petites molécules de structures chimiques diverses telles que les acides gras, les vitamines, les stérols et stéroïdes, les acides biliaires, etc. Certains CYP450 vont pouvoir métaboliser les· substances exogènes comme les médicaments, les polluants et agents chimiques environnementaux ainsi que les
produits naturels de plantes (Nebert et Russell, 2002). Il existe plus de 50 enzymes CYP450 exprimées principalement dans le foie, mais certaines se trouvent dans le petit intestin (afin d'y réduire la biodisponibilité des médicaments), dans les poumons, le placenta ou encore les reins (Lynch et Price, 2007). Cependant, seulement une douzaine de ces enzymes appartenant à la famille des CYP 1, 2 et 3 sont responsables du
métabolisme de la majorité des mé~icaments et xénobiotiques (Nebert et Russell, 2002; Zanger et Schwab, 2013). Plus précisément, les CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 et CYP3A5 peuvent métaboliser 90% des médicaments (Lynch et Price, 2007).
1.1.3 Importance des hépatocytes dans les domaines pharmaceutiques et médicaux Les études de métabolisation et de toxicité des médicaments destinés aux humains sont en général effectuées sur des animaux de laboratoire. Cependant, il existe des différences métaboliques inter espèces, ce qui fait que le meilleur modèle physiologique pour ce genre de test est la culture primaire d'hépatocytes humains. Les· hépatocytes ont la capacité de se régénérer dans le corps lorsqu'il y a des pertes de cellules mais en culture, ils constituent une culture primaire dont la durée de vie est limitée. Ces cellules ne sont obtenues que par isolation à la suite d'une chirurgie et, une fois isolées ne vivent que quelques heures en suspension et quelques jours rattachées à un substrat (Guguen-Guillouzo et Guillouzo, 2010). Une des fonctions la plus importante et la plus sollicitée dans le domaine pharmacologique est la métabolisation des substances xénobiotiques (Diaz-Ramos et al., 2012). En effet, ils permettent de tester les médicaments avant que ceux-ci ne soient commercialisés, mais aussi de déterminer la toxicité de certains composés (G6mez-Lech6n et al., 2010). Les hépatocytes sont couramment utilisés pour analyser l'absorption des médicaments et les paramètres cinétiques, estimer la clairance hépatique, générer et identifier les métabolites, démontrer les différences inter espèces et prédire les potentielles interactions indésirables médicament-médicament (Guguen-Guillouzo et Guillouzo,
2010). Les hépatocytes sont également très utilisés en virologie car le foie est très sensible à de nombreux virus notamment au virus de l'hépatite B et C. Ainsi il est possible d'examiner les infections virales et leur processus de réplication. Le foie représente également un lieu obligatoire dans le cycle de vie de certains parasites comme par exemple Plasmodium falciparum qui cause la malaria. L'utilisation d'hépatocytes en parasitologie permet ainsi de mieux comprendre les mécanismes d'infection de ces parasites et de trouver des solutions (Guguen-Guillouzo et Guillouzo, 2010).
La transplantation hépatique est actuellement le traitement de choix pour. les maladies hépatiques dont les patients sont en phase terminale ainsi que pour les maladies et les troubles métaboliques hépatiques potentiellement mortels. Le remplacement de l'organe malade par transplantation est curatif, mais comporte des risques chirurgicaux tels que le rejet de greffe et doit être accompagné d'un traitement immunosuppresseur
à vie. De plus, la pénurie croissante d'organes de donneurs pour la transplantation encourage la recherche de thérapies alternatives pour les maladies du foie (Dhawan et al., 2010). La transplantation d'hépatocytes représente une alternative à la
transplantation de foie (Katenz et al., 2007a).
L'isolation d'hépatocytes pour la transplantation ou les tests pharmaceutiques génère un grand nombre de cellules. Les cellules ne sont pas toujours toutes utilisées et l'excès de cellules doit être conservé afin de pouvoir les utiliser ultérieurement. La technique principale permettant la conservation des cellules est la cryoconservation.
1.2 Le pancréas 1.2.1 Description
Le pancréas est un organe abdominal. D'un point de vue anatomique et fonctionnel, le pancréas est composé de deux parties : une partie exocrine et une partie endocrine. La partie exocrine est la plus abondante et est constituée de grappes de cellules épithéliales formant des acini. Le tissu endocrine forme les îlots de Langherans qui jouent un rôle dans la sécrétion d'hormones telles que l'insuline (Sherwood, 2015).
1.2.1.1 Tissu exocrine
Le tissu exocrine synthétise des enzymes qui vont jouer un rôle dans la digestion des aliments. La sécrétion des produits par cette partie du pancréas se. fait en deux parties. En effet, les cellules de la paroi des canaux pancréatiques produisent une sécrétion aqueuse alcaline riche en bicarbonate de sodium et les cellules acineuse permettent la sécrétion des enzymes pancréatiques. Trois catégories d'enzymes sont sécrétées par le pancréas : les enzymes protéolytiques, l'amylase pancréatique pour la digestion des polysaccarides et la lipase pancréatique qui est cruciale pour la digestion des lipides (Sherwood, 2015).
1.2.1.2 Tissu endocrine
Les îlots pancréatiques constituent un réseau .complexe de différents types cellulaires endocrines (Hogan et Hull, 2017). Ils sont composés de cellules alpha, beta et delta qui permettent la synthèse de différentes hormones. Les cellules alpha synthétisent l'enzyme hyperglycémiante, le glucagon. Les cellules delta ou D permettent la sécrétion de la somatostatine qui est une enzyme hyperglycémiante. Et enfin, les cellules bêta sécrètent de l'insuline en réponse à la présence de glucose. Le rôle de
l'insuline est d'abaisser la glycémie en permettant l'entrée du glucose dans les cellules afin que celui-ci soit stocké sous forme de glycogène, transformé en graisse ou utilisé comme source d'énergie (Fu et al., 2013; Sherwood, 2015). Les cellules bêta jouent un rôle dans la maladie du diabète.
1.2.2 Le diabète
Le diabète est une maladie chronique qui résulte en une concentration élevée de glucose dans le sang due à une incapacité du corps à produire suffisamment d'insuline ou à répondre adéquatement à celle-ci (Maritim et al., 2003; El-Abhar et Schaalan, 2014). Elle représente une des principales maladies qui causent la morbidité et la mortalité prématurée dans le monde (Janghorbani et al., 2007). On distingue deux types principaux de.diabète, le diabète de type .1 et de type 2.
Le diabète de type 1, aussi connu sous le nom de diabète auto-immune, consiste en la destruction des cellules bêta pancréatiques par le système immunitaire par la présence d'anticorps contre les protéines spécifiques à ces cellules. La destruction de ces cellules induit donc l'inhibition de la production d'insuline (Van den Driessche et al., 2009; American Diabetes Association, 2014). Dans cette forme de diabète, le taux de destruction des cellules bêta est assez variable selon les individus. Elle peut être rapide, principalement chez les. enfants et les jeunes adultes, ou plus lente comme chez les adultes (American Diabetes Association, 2014). Le traitement contre ce type de diabète est l'injection quotidienne d'insuline et la surveillance du taux de glycémie sanguine afin d'éviter des épisodes dangereux d'hypo- ou d'hyperglycémie. Il n'existe pas encore de traitement curateur.
Le diabète de type 2 est caractérisé par une déficience des cellules bêta à produire de l'insuline ou une résistance à cette hormone. Cette forme de diabète, qui compte pour 90 à 95% des diabétiques est également dénommé diabète non-insulinodépendant et
apparait le plus souvent chez l'adulte (American Diabetes Association, 2014). La résistance à l'insuJine est associée à une altération du métabolisme énergétique, entraînant une augmentation de la teneur en graisse intracellulaire dans les muscles squelettiques, le foie, le tissu adipeux ainsi que les îlots pancréatiques. Cette résistance, si elle n'est pas contrôlée, progressera en l'incapacité des cellules bêta à produire de l'insuline pour compenser la diminution à la sensibilité à l'insuline (Fu et al., 2013). Ce type de diabète est causé par une interaction compl~xe entre les facteurs génétiques et environnementaux tels que l'obésité, la sédentarité ou encore une mauvaise alimentation (Li et al., 2011 ). Sur la base de la physiopathologie et de la gravité de cette maladie, elle peut être contrôlée par une restriction alimentaire beaucoup plus stricte que les personnes atteintes du diabète de type 1, par de l'exercice et par différents types d'hypoglycémiants oraux synthétiques et / ou des injections d'insuline (El-Abhar et Schaalan, 2014).
Le diabète, peu importe le type, est une maladie qui ne se guérit pas mais qui se contrôle. Alors que l'insuline exogène et d'autres médicaments peuvent contrôler de nombreux aspects du diabète, de nombreuses complications affectant le système vasculaire, les reins, la rétine, le cristallin, les nerfs périphériques et la peau sont communes et sont extrêmement coûteuses en termes de longévité et qualité de vie (Maritim et al., 2003).
Comme dit précédemment, il n'existe pas de cure au diabète, mais il existe cependant deux alternatives possibles pour les patients gravement touchés. Ces alternatives consistent en la reconstitution des fonctions de
r
organe par une transplantation d'un pancréas ou par le remplacement des cellules bêta I?roductrices d'insuline (Kabelitz et al., 2008). La greffe d;un organe entier mène à la normalisation de la glycémie et à la stabilisation des complications secondaires. Cependant, comme pour beaucoup d'organes, la disponibilité est faible et la greffe peut impliquer des risques d'infections sévères (Kabelitz et al., 2008).1.2.3 Importance des cellules pancréatiques dans le domaine médical
La transplantation des îlots de Langherans représente une alternative moins invasive que la greffe d'un organe entier. L'allotransplantation d'îlots peut rétablir la production d'insuline endogène et la stabilité de la glycémie (Kabelitz et al., 2008). La transplantation d'îlots pancréatiques de Langerhans, qui hébergent les cellules ~ productrices d'insuline, est maintenant acceptée comme un traitement sûr et efficace pour les patients atteints gravement du diabète de type 1 (KabeHtz et al., 2008). Comme les cellules de source animale ne peuvent être utilisées avec l'humain, ils ·doivent être isolés d'organes de donneurs humains et conservés jusqu'à ce qu'ils soient utilisés pour la transplantation. Cependant, les organes de donneurs sont en pénurie et la viabilité et la fonction métabolique des cellules sont souvent compromises. De plus, les protocoles actuellement utilisés pour la cryoconservation des îlots pour les applications humaines sont sous-optimaux en raison de la toxicité des agents de cryoconservation, ce qui est particulièrement vrai pour le diméthylsulfoxide (DMSO). De plus, l'utilisation de cellules pancréatiques en culture permet d'étudier les mécanismes de fonctionnement et de dysfonctionnement des cellules pancréatiques. Ces étu~es mènent à la compréhension des maladies liées à cet organe comme le diabète (type 1 et 2).
1.3 La cryoconservation 1.3 .1 Principe
Le but principal de la cryoconservation est de conserver des cellules à de basses températures, tout en maintenant leur viabilité et leurs fonctions métaboliques suite à leur décongélation. Elle permet par la suite d'utiliser ces cellules pour divers tests et en clinique (Mazur, 1984). La cryoconservation permet de ralentir voire stopper l'activité biologique. Lorsque la température se situe entre -0 et -25°C, il y a ralentissement de l'activité enzymatique mais les enzymes restent actives. Cependant, lorsque l'on
descend en dessous de -40°C, les échanges physicochimiques sont figés. Des cellules congelées en dessous de -130°C ne subissent pas de changement car dans ces conditions, les réactions chimiques et enzymatiques sont arrêtées et les mouvements moléculaires réduits. L'utilisation d'azote liquide est idéale pour stocker les hépatocytes car celui-ci permet d'atteindre des températures de -l 96°C (Bakhach et al., 2007).
1.3 .2 Effets négatifs de la cryoconservation
Durant la procédure de congélation/décongélation, la membrane cellulaire est sujette à
des stress inchiant des perturbations thermiques, mécaniques et osmotiques qui peuvent mener à une lyse induite par l'expansion et/ou la perte de la réponse osmotique. La
formation de glace pendant la congélation est une conséquence de la déshydratation (Spindler et al., 2011 ). Lors du refroidissement, des cristaux de glace se forment dans l'environnement extracellulaire induisant une variation de la pression osmotique. Par mouvement d'osmose, l'eau va sortir des cellules, ce qui cause une augmentation de l' osmolarité intracellulaire et la déshydratation de la cellule. La déshydratation de la cellule est aussi marquée par le fait que la membrane cellulaire modifie son coefficient de perméabilité lorsqu'elle est soumise à de basses températures, ce .qui la rend semi-perméable. La glace extracellulaire génère aussi des dommages physiques à l'endroit où elle va entrer en contact avec la membrane cellulaire causant ainsi des lésions dues à des expansions dendritiques des cristaux. La formation. de glace intracellulaire est aussi un facteur très important durant la cryoconservation et cause un stress cellulaire sévère menant à des dommages irréversibles (Elliott et al., 2017).
Il existe un lien entre la . vitesse de congélation et ces effets néfastes sur la cellule (Bakhach et al., 2007). Un refroidissement trop lent lors de la congélation peut entraîner une déshydratation totale de la cellule, donc causer un rétrécissement de celle-ci et par conséquent sa mort. Il a aussi été suggéré . que pendant un refroidissement lent,
l'augmentation de la concentration en solutés intracellulaires pourrait être toxique pour la cellule, c'est ce qu'on appelle l' « effet solution» (Farrant et Morris, 1973; Bakhach et al., 2007). Lors d'un refroidissement rapide, des cristaux de glace se forment à
l'intérieur de la cellule à partir des éléments de nucléation dans le cytoplasme qui permettent ainsi la formation des premiers cristaux. Ces cristaux, généralement de petites tailles et instables, vont causer des dommages aux éléments de la cellule comme la mitochondrie, le réticulum endoplasmique, la membrane plasmique, et autres, et causeront éventuellement la mort de la cellule (Franks et al., 1983). Au cours du réchauffement, si celui-ci est lent, il peut y avoir une agrégation de cristaux qui vont devenir plus grands et par la suite nuire à la cellule; on parle ici de « phénomène de nucléation » (Bakhach et al., 2007).
Pour pouvoir congeler des cellules sans trop d'effets néfastes, il faut pouvoir prévenir la formation de cristaux de glace et maintenir un équilibre osmotique entre la cellule et le milieu externe. Un des éléments fondamentaux à la réponse d'une cellule aux basses températures est sa capacité à réagir osmotiquement à son environnement. De plus, il est nécessaire d'établir une vitesse de refroidissement optimale, spécifique au type cellulaire, qui permettrait à la cellule de se déshydrater suffisamment tout en évitant une cristallisation intracellulaire trop rapide.
1.3 .3 Diverses méthodes de cryoconservation
1.3 .3 .1 Méthodes physiques
Le principe des méthodes physiques de cryoconservation est de jouer sur la vitesse de congélation des cellules. La prévention de la formation de glace intracellulaire est un élément important à considérer dans l'élaboration de protocoles de cryoconservation. En effet, la glace intracellulaire est considérée comme la raison principale des dommages cellulaires lors de la cryoconservation (Maas et al., 2000). La formation de
glace intracellulaire peut être évitée en refroidissant suffisamment lentement les cellules afin de leur permettre de perdre leur eau en réponse à une augmentation de la concentration en solutés dans le milieu extracellulaire. Une vitesse de refroidissement lente permet alors aux cellules de se déshydrater en minimisant la formation de cristaux de glace intracellulaire (Maas et al., 2000). D'un -autre côté, la formation de glace intracellulaire peut · également être évitée en congelant les cellules rapidement en présence de fortes concentrations d'agents de cryoconservation. Un refroidissement lent ou rapide seraient donc l'un ou l'autre efficaces afin de congeler les cellules. Il a été montré que pour les hépatocytes, un refroidissement lent et contrôlé serait le meilleur moyen de congeler les ceHules. En effet, une congélation lente permet d'obtenir non seulement une meilleure viabilité mais également des cellules plus fonctionnelles comparé à une congélation rapide des cellules (Li et al., 1999; Maas et al., 2000).
1.3 .3 .2 Méthodes chimiques
Les agents cryoprotecteurs sont essentiels afin de conserver des cellules à des températures cryogéniques dans le but qu'elles gardent une bonne viabilité et un haut niveau de fonctionnalité (Elliott et al., 2017). Ils permettent de protéger la cellule contre les différents effets néfastes dus à la cryoconservation. En effet, leur principal effet est de contrôler la formation de la glace et la déshydratation cellulaire améliorant ainsi la survie post-congélation. Il a été montré que la capacité des agents de cryoconservation à faire des liens hydrogène avec les molécules d'eau est corrélée avec leur efficacité. En effet, ils permettraient d'influencer le mécanisme par lequel les molécules d'eau interagissent les unes avec les autres et avec les solutés dissous lorsque la nucléation de la glace progresse. Plus précisém~nt, les propriétés physiques des agents, comme par exemple l'augmentation de leur viscosité à de basses températures; influenceraient la nucléation de la glace et la croissance de la glace, qui sont une cause principale de mortalité ~ellulaire (Elliott et al., 2017).
Il existe deux types d'agent de cryoconservation. On retrouve les agents diffusibles qui possèdent une action intracellulaire. En effet, ceux-ci ont un faible poids moléculaire qui leur permet de traverser la membrane plasmique. On retrouve dans cette catégorie le diméthylsulfoxide (DMSO) et le g~ycérol. D'autres agents de cryoconservation, comme par exemple certains sucres, tels que de tréhalose, sont non diffusibles et leur action est donc.~ extracellulaire. Contrairement aux agents diffusibles, ils ont un poids moléculaire plus haut qui les empêche d'entrer dans la cellule (Bakhach et al., 2007). Cependant, les agents de cryoconservation peuvent potentiellement être nocifs, particulièrement les agents pénétrants, influençant ainsi une variété de processus biochimiques normaux. Ces effets toxiques peuvent être atténués en développant des protocoles où la concentration finale, la température et le temps d'exposition sont optimisés avant la cryoconservation (Elliott et al., 2017). De plus, les protocoles de cryoconservation utilisant des agents cryoprotecteurs doivent être adaptés au type cellulaire et l'efficacité de certains agents de cryoconservation est spécifique au type cellulaire utilisé. En effet, chaque type cellulaire va réagir différemment aux composés. De nos jours, un des agents les plus utilisés pour stocker les cellules est le DMSO.
1.3.3.3 Le diméthylsulfoxide
Le DMSO est une petite molécule amphiphile, avec un groupe sulfoxyde hydrophile et deux groupements méthyles hydrophobes, très utilisée en biologie cellulaire pour induire la fusion cellulaire, la différenciation cellulaire et très courammènt comme agent cryoprotecteur (Gurtovenko et Anwar, 2007). Il est, comme l'eau, un agent diffusant, c'est-à-dire qu'il ne traverse pas la membrane immédiatement. Son passage est contrôlé par la différence de concentration entre le milieu intra et extracellulaire.
Un des aspects clés du mécanisme d'action du DMSO est la formation de pores, ce qui explique l'amélioration de la perméabilité membranaire aux molécules hydrophiles ( caractéristique très· utile dans le domaine pharmacologique) ainsi que son activité
cryoprotectrice. En effet, en augmentant la perméabilité, le DMSO rend la membrane · plus. souple et lui permet ainsi de s'accommoder aux contraintes osmotiques· et mécaniques lors de la cryoconservation (Notman et al., 2006). Il permet également de retarder et diminuer la formation de cristaux de glace pendant la congélation. En pénétrant la cellule, le DMSO peut promouvoir la vitrification de l'eau en cas de refroidissement rapide, évitant ainsi la formation nuisible de glace intracellulaire (Hughes et al., 2012). D'autres effets du DMSO sont de prévenir une augmentation excessive de la concentration en sels pendant la congélation et de stabiliser les protéines par un mécanisme d'exclusion préférentielle (Spindler et al., 2011 ). La congélation· d'hépatocytes avec du DMSO permet également de maintenir un bon niveau d'enzyiµes importantes comme les cytochromes P450 et b5 ainsi que la NADPH-cytochrome c réductase (Novicki et al., 1982).
Tous ces avantages font du DMSO un bon agent cryoprotecteur. Cependant, il est connu pour être cytotoxique entre autres à cause de son interaction électrostatique avec la membrane phospholipidique (Sumida et al., 2011; Hughes et al., 20i2). Cette interaction est néfaste pour la stabilité de la membrane (Berry et Edwards, 2000). Spindler et ses collègues ont démontré que les effets du DMSO sur la membrane cellulaire dépendent de sa concentration (Spindler et al., 2011 ). À de faibles concentrations, les membranes resteraient relativement hydratées lorsque les cellules
)
sont congelées. L'eau à proximité pourrait donc geler résultant en la formation de glace intracellulaire. L'intégrité membranaire serait alors réduite. De plus, une expansion latérale, un amincissement simultané de la membrane ainsi qu'une augmentation de la fluidité du noyau hydrophobe de la membrane sont induits. À des concentrations intermédiaires, les membranes sont relativement déshydratées lors de la congélation et restent intactes après la décongélation. Cependant à de fortes concentrations, le DMSO cause un amincissement progressif de la membrane ainsi que la formation de pores. Les molécules lipidiques sont désorbées et cela mène à la désintégration de la bicouche lipidique (Gurtovenko et Anwar, 2007; Spindler et al., 2011). De ce fait, la
cryoconservation des hépatocytes avec du DMSO va diminuer la viabilité' cellulaire, certaines fonctions spécifiques aux hép.atocytes, telles que la sécrétion de l'urée, et la capacité d'attachement, qui est un élément essentiel pour les greffes (Li, 2007; Grondin et al.,. 2009a). Du fait de sa toxicité, il est préférable de l'utiliser la plus faible concentration permettant la prévention de glace (Hughes et al., 2012), mais aussi de minimiser son temps de contact avec les cellules (Terry et al., 2010). Les concentrations de DMSO habituellement utilisées dans les suspensions cellulaires sont de 10 à 20%. Pour les hépatocytes de rats, il a été montré que15% de DMSO permettait d'obtenir de meilleures viabilités après décongélation (Grondin et al., 2009).
Ce cryoprotecteur est également le plus couramment utilisé pour les cellules pancréatiques (10%). Cependant, le DMSO cause une forte perte de la masse des îlots ( environ 50% de survie) et compromet· les fonctions métaboliques en inhibant la sécrétion d'insuline induite par le glucose (Tayl~r et Baicu~ 2009). Ces îlots sont appropriés à des fins de recherche; cependant, ils ne conviennent pas pour transplantation humaine selon le protocole clinique d'Edmonton (Shapiro et al., 2006), en raison de la présence de sérum de veau fœtal. Par conséquent, l'amélioration des procédures de cryoconservation devient urgente pour augmenter la disponibilité d'îlots de meilleure qualité et un meilleur maintien de l'activité métabolique pour des applications cliniques et de recherche.
1.3.3.4 Le tréhalose
Le tréhalose est un disaccharide non réducteur composé de deux molécules de glucose reliées par un lien a 1, 1. Le tréhalose est retrouvé naturellement chez de nombreux organismes tels que les plantes, les champignons, les levures, les bactéries ou les insectes (Elbein et al., 2003; Katenz et al., 2007b ). Ces organismes accumulent de grandes quantités de tréhalose qui pourraient avoir un lien avec leur capacité à résister au gel et/ou à la sécheresse (Katenz et al., 2007b).
Le tréhalose peut également être synthétisé chimiquement et est utilisé comme agent de cryoconservation. Il est efficace pour la conservation de différents types cellulaires comme des hépatocytes, des cellules pancréatiques, des fibroblastes ou encore des plaquettes sanguines (Katenz et al., 2007b; Glatke et al., 2012). Contrairement au DMSO, il ne traverse pas la membrane plasmique dû à son haut poids moléculaire (Katenz et al., 2007b ).
La capacité du tréhalose à protéger les cellules pourrait s'expliquer par le fait que c'est une molécule avec de nombreuses fonctions et caractéristiques. En effet, comparé à d'autres sucres, il est stable, très résistant à l'hydrolyse et n'interagit pas avec les fonctions des protéines. De plus; il a été montré qu'il a la capacité de stabiliser les protéines et les phospholipides grâce à des interactions sucre-groupes polaires lors de la lyophilisation (Katenz et al., 2007b ). Il est également connu que le tréhalose permet de protéger les membranes et les protéines de la déshydratation (Elbein et al., 2003). Un lien entre l'accumulation de tréhalose chez certains organismes et leur capacité à résister à la déshydratation a été établi (Elbein et al., 2003). Lors de basses températures, le tréhalose empêcherait la dénaturation et l'agrégation des protéines mais aussi stabiliserait les membranes cellulaires dont la fluidité serait diminuée. Le tréhalose n'est pas produit chez l'humain mais des études concernant les effets mutagènes, tératogènes et toxiques n'ont montré aucun effet indésirable significatif chez l'humain, ce qui fait que son utilisation comme agent de cryoconservation pour les cellules humaines est possible (Katenz et al., 2007b ). Cependant le tréhalose est souvent utilisé comme additif au DMSO. Il a été montré que le tréhalose, lorsqu'il est utilisé seul, ne. permettait pas d'obtenir de meilleurs taux de viabilité mais que les cellules étaient plus fonctionnelles que les cellules congelées avec seulement du DMSO (Katenz et al., 2007b; Hewitt, 2010).
1.3.3.5 Le glycérol
Le glycérol est un petit soluté poly-hydroxylé avec une forte solubilité dans l'eau et une faible toxicité lorsque les cellules y sont exposées à court terme. Le glycérol est un agent diffusant et peut pénétrer la membrane cellulaire à une vitesse relativement lente (Fuller, 2004). Il a été montré que le glycérol s'accumule chez des insectes lors de basses températures leur conférant une résistance au froid (Lee, 1991; Yoder et al., 2006). En effet, dans la nature, le glycérol est utilisé à de hautes concentrations comme agent cryoprotecteur qui élève l' osmolarité des fluides corporels et réduit la disponibilité de l'eau pouvant former la glace extracellulaire. Il permet également de · maintenir la structure des macromolécules biologiques et de favoriser l' autoassemblage des protéines grâce à une hydratation préférentielle (Dashnau et al., 2006). Il a été suggéré que le glycérol éviterait à la cellule d'atteindre la concentration çritique en sels dommageable alors que le système serait suffisamment refroidi pour atteindre l'état de matrice vitreuse. De plus, la viscosité de plus en plus élevée du glycérol lors de la diminution de la température est une autre propriété qui permet d'inhiber ou retarder la croissance des cristaux de glace (Fuller, 2004). Rall et ses collègues ont montré que le glycérol avait bien un effet positif qui est de diminuer la concentration en sels lors de la cryoconservation des globules rouges mais également un effet délétère. En effet, celui-ci peut causer des dommages au moment de la décongélation en rendant les cellules sensibles à des chocs osmotiques (Rall et al., 1978). Une dilution rapide des globules rouges contenant une forte concentration intracellulaire de glycérol dans des solutions isotoniques peut mener à l'hémolyse une fois le sang transfusé. De ce fait, une fois décongelées, les cellules sanguines conservées avec du glycérol doivent être nettoyées avant d'être utilisées pour des tests de compatibilité in vitro ou des
transfusions (Wong et al., 2009). La méthode la plus utilisée afin d'éliminer le glycérol est une série de lavages avec une solution saline qui peut prendre environ une heure par unité de sang (Lusianti et al., 2013).
Afin d'éviter ces inconvénients, de nouvelles méthodes de cryoconservation du sang ont été développées telles que l'utilisation de petites molécules ayant une activité d'inhibition de recristallisation qui permet de diminuer la concentration de glycérol utilisée (40%) (Briard et al., 2016). Il a été montré que ces petits phénols glycosidiques sont également des additifs de cryoconservation capables de diminuer la quantité d'hémolyse post-décongélation des cellules sanguines permettant ainsi d'obtenir une meilleure viabilité cellulaire (Briard et al., 2016).
1.3.3.6 Nouvelles stratégies de cryoconservation
L'évolution a permis aux organismes vivant dans des environnements froids de développer des stratégies afin d'éviter les dommages générés par le gel. Ces stratégies incluent l'accumulation d'agents cryoprotecteurs de type glucidique comme le glycérol, des agents/protéines de nucléation qui contrôlent la croissance de la glace ou encore l'accumulation des protéines antigel (AFP) (Storey, 2004; Storey et Storey, 2013). En effet, ces protéines ou glycopeptides antigels font partie d'une catégorie d'agents de cryoconservation naturels utilisés par les animaux, les poissons et les plantes qui tolèrent le froid (Elliott et al., 2017). Les protéines AFPs sont caractérisées par leur capacité à empêcher la croissance des cristaux de glace ainsi que la recristallisation au-dessous du point de fusion. Ce déplacement de la température de congélation de l'eau est limité et à une température suffisamment basse, on observe une croissance rapide des cristaux. La différence entre la température de fonte/fusion des cristaux de glace et la température de congélation à laquelle on a une croissance rapide des cristaux est habituellement appelée l'hystérésis thermique (thermal hysteresis). Ce processus est le résultat d'une adsorption des protéines AFP à la surface de cristaux (Kristiansen et Zachariassen, 2005; Celik et al., 2013). Ces caractéristiques des AFPs suscitent un grand intérêt dans le domaine de la cryobiologie. Des études se sont donc basées sur les AFPs comme nouveaux agents de cryoconservation. Les études ont montré que ces molécules sont efficaces lorsqu'utilisées comme
complément à d'autres agents de cryoconservation comme le DMSO ou le glycérol permettant ainsi de diminuer leur concentration (Capicciotti et al., 2015a; Capicciotti et al., 2015b; Briard et al., 2016).
Les AFPs existent chez de nombreux insectes, poissons ainsi que chez les .plantes tolérantes au gel (Capicciotti etal., 2015b). Les plantes sont des organismes statiques· et doivent pouvoir s'adapter aux différents changements qui se produisent dans leur environnement pour survivre. Le gel est un facteur critique pour différentes espèces végétales car celui-ci peut induire la mort de la plante. Cependant, certaines plantes sont capables de tolérer le gel en ajustant leur métabolisme. L'exposition des plantes à
de basses températures entraîne chez celles-ci des changements aux niveaux morphologique, biochimique et physiologique. Ces changements sont associés à leur tolérance au gel, qui est déterminée génétiquement (Fowler et al., 1999). Les stratégies des plantes pour se protéger du gel sont multiples, comme l'accumulation de sucres, acides aminés. Parmi ces différentes stratégies, on observe aussi une accumulation de pro~éines parmi lesquelles on retrouve les protéines AFP. Ces protéines leur permettent une acclimatation aux basses températures et une tolérance au gel (Guy, 1990). Une des plantes ayant développé ces stratégies est le blé d'hiver Triticum aestivum L.
1.3.3.7 Le blé d'hiver Triticum aestivum L.
Contrairement aux animaux, les plantes ne peuvent se déplacer. Par conséquent, elles doivent sans cesse tolérer les conditions de température qui peuvent être extrêmes. Afin de contrer ces conditions, certaines plantes ont donc développé des mécanismes leur permettant d'acquérir une tolérance accrue au gel. L'acclimatation au froid passe premièrement par une acclimatation aux basses températures, puis l'acquisition de la tolérance au gel. Les plantes subissent donc des modifications comme des changements dans l'expression de certains gènes. Lors de l'acclimatation au froid, le blé accumule des protéines associées à la tolérance au froid (FTPs) qui leur permettent d'avoir une
certaine tolérance au gel (Sarhan et al., 1997; Ouellet et Charron, 2013). L'accumulation de protéines spécifiques au froid (WCS), des protéines régulées par le froid (WCOR), de protéines abondantes lors de la phase tardive de l'embryogenèse (LEA-3), de lipocalines induites par la température chez Triticum aestivum (TaTIL), ainsi que de protéines inhibitrices de la recristallisation des cristaux (TalRI) a été observée chez le blé tolérant au gel.
La stratégie naturelle du blé d'accumuler des protéines afin de tolérer les basses températures a inspiré des chercheurs. Un extrait brut de protéines de blé d'hiver (WPE) non acclimaté a été testé comme agent de cryoconservation. Les résultats ont montré que cet extrait possédait une activité cryoprotectrice puisqu'après décongélation des hépatocytes, une viabilité de 68,5% a été observée. Cette viabilité est à peu près semblable pour les hépatocytes congelés avec du DMSO ( 62,5%) et cela est aussi observable pour d'autres types cellulaires (Grondin et al., 2009b). Comparé au DMSO, le WPE permet également un meilleur maintien des principales activités métaboliques et une meilleure propriété d'attachement en culture des cellules (Hamel et al., 2006). Lors de la cryoconservation de cellules pancréatiques, le WPE permet d'obtenir une viabilité semblable aux cellules fraîches (proche de 90%) alors qu'avec le DMSO, la viabilité se situait autour de 70%. Il permet également un bon maintien des fonctions métaboliques des îlots de Langherans (Grondin et al., 2013). Cet extrait représente donc une alternative prometteuse à l'utilisation du DMSO comme agent de cryocons~rvation. Cet extrait contient principalement des protéines mais aussi d'autres molécules comme des sucres, des composés phénoliques ou encore des antioxydants. Il a été démontré en faisant bouillir l'extrait, donc en dénaturant les protéines, que l'activité cryoprotectrice était essentiellement due aux protéines présentes et non aux autres composés (Hamel et al., 2006). L'utilisation de protéines de blé comme agent de cryoconservation serait donc une bonne alternative aux agents déjà existants.
1.3.3.8 WCS120 et TaIRI-2: des protéines impliquées dans la tolérance aux basses températures chez le blé.
Afin d'améliorer le~ protocoles de cryoconservation des cellules, de nouveaux agents de cryoconservation d'origine végétale ont donc été testés (Grondin et al., 2009b). Différentes protéines de blé connues pour jouer un rôle dans la tolérance au gel chez le blé ont été utilisées pour congeler des hépatocytes et des cellules pancréatiques. Parmi celles-ci,l'utilisation d'une combinaison de deux protéines pour conserver les cellules a permis d'obtenir des résultats intéressants et prometteurs en cryoconservation (Grondin et al., 2009b; Grondin et al., 2013). Les deux protéines candidates sont la WCS120 (« Wheat Cold Specific protein »; protéine de blé spécifique au froid) et la protéine inhibitrice de la recristallisation de la glace, TaIRI-2 (Houde et. al., 1992; Tremblay et al., 2005).
La protéine WCS 120 est une protéine membre de la famille de gènes WCSJ 20 chez le
blé dont l'expression est positivement corrélée à la tolérance au gel (Sarhan et al., 1997). Elle a une masse moléculaire de 39 kDa et possède, comme les autres membres de cette famille, 2 domaines de répétition : un domaine riche en lysine et un domaine riche en glycine. Elle est aussi riche en thréonine et elle est fortement hydrophile (Sarhan et al., 1997). La WCS120 fait partie des déhydrines qui sont les protéines de stress les plus abondantes et qui sont induites dans les plantes lors de stress tels que la sécheresse, le gel et la salinité. En effet, cette déhydrine est connue comme étant une protéine dont l'expression est régulée par le froid et elle est la protéine la plus abondante dans les tissus de blé acclimaté au froid (Vitamvas et al., 2010). Cette protéine est localisée dans le cytoplasme et le noyau des cellules des plantes et il a été suggéré qu'elle serait impliquée dans la protection générale des cellules. Sa présence dans le noyau indique qu'elle pourrait protéger la machinerie transcriptionnelle. De plus, la présence de celle-ci dans ces compartiments où de la glace est susceptible de se former indique qu'elle peut atténuer le stress de déshydratation associé au gel
résultant en l'augmentation de la tolérance au gel du blé. Cette atténuation de la déshydratation pourrait être expliquée par le fait que la forte nature hydrophile de la WCS120 fournirait un micro-environnement, réduisant ainsi la dénaturation des protéines qui résulte de la perte des molécules d'eau. En entourant les protéines cellulaires importantes, la WCS120 protègerait contre la dénaturation ou l'agrégation de celles-ci (Houde et al., 1995). Cette même équipe a effectué des tests de cryoconservation avec les protéines de la famille des WCS120. Ils ont ainsi démontré que ces protéines, dont.la WCS 120, permettaient une protection contre la dénaturation de la lactate déshydrogénase pendant le gel (Houde et al., 1995; Breton et al., 2000). À molarité égale, la WCS 120 est plus efficace que le sucrose lors des tests de cryoconservation in vitro. En effet, il a été montré que pour obtenir une efficacité· de
protection semblable entre la WCS120 et le sucrose, il faut utiliser seulement 0,2 µM . de WCS120 contre 250 mM pour le sucrose (Houde et al., 1995).
La protéine TaIRI-2 d'un poids moléculaire de 43 kDa, possède une activité IRI. La protéine s'accumule dans les feuilles dès le début du traitement à de basses températures, et atteint un pic assez tôt durant l'acclimatation chez le blé. Ce profil d'accumulation permet de dire que TaIRI-2 est associée à la capacité de la plante à s'acclimater au froid mais aussi à la tolérance au gel (Tremblay et al., 2005). TaIRI-2 est une AFP qui a comme effet principal la diminution du point de congélation sans changer le point de fusion lors de la tolérance des plantes au gel (Jin et al., 2017). Ainsi elle maintient l'état de surfusion en inhibant la croissance des cristaux de glace (Da vies et Hew, 1990). Elle est composée de huit motifs riches en leucine (LRR) au niveau de son extrémité N-terminale qui est homologue au domaine RKD des protéines kinases de types récepteurs (RLK) mais qui ne lui confère pas d'activité kinase. Les RLK sont une classe de protéines transmembranaires composées d'un domaine de liaison à un ligand extracellulaire lié à un domaine cytoplasmique qui possède une activité kinase intrinsèque. Elles sont catégorisées selon leurs fonctions. Elles peuvent être impliquées dans le contrôle de la croissance et du développement des plantes ou encore dans les
interactions plante-microbe et dans les réponses aux stress (Tremblay et al., 2005). La présence de ce motif LRR laisse supposer que cette protéine pourrait jouer divers rôles, notamment lors d'attaque par des pathogènes (Tremblay et al., 2005; Gupta et Deswal, 2014). TaIRI-2 est également constituée d'une partie commune aux AFPs: le domaine RI, possédant 6 domaines de liaison à la glace au niveau de l'extrémité C-terminale , lui permettant d'inhiber la recristallisation de la glace. La glace se forme lors de la cristallisation des molécules d'eau. Par la suite, les cristaux de glace prennent de l'ampleur lors de la recristallisation, ce qui signifie que les plus gros cristaux de glace se développent au détriment des plus petits. Les gros cristaux de glaces sont létaux et imposent un stress physique au niveau de la membrane plasmique et peuvent créer une rupture, menant à la mort cellulaire (Steponkus, 1984). L'activité IRI permet ainsi de garder un contrôle sur la taille des cristaux de glace afin de prévenir. les dommages physiques (Gupta et Deswal, 2014).
Ces caractéristiques qui lient WCS 120 et TaIRI-2 à la tolérance au gel, et/ou à
l'acclimatation au froid font d'elles des candidates intéressantes comme agents de cryoconservation. De ce fait, des tests de ~ryoconservation utilisant ces protéines comme cryoprotectants ont été effectuées sur des cellules animales. Dans un premier temps, des protéines recombinantes de WCS120 et TaIRI-2 ont été produites dans E.
coli et elles ont ensuite été testées avec des hépatocytes de rat (Grondin et al., 2009b).
Les résultats ont montré qu'elles possédaient bien une activité de cryoconservation. Cependant, les viabilités obtenues après décongélation des cellules étaient assez faibles (23,5% pour la WCS120 et 43,9% avec la TaIRI-2) comparées aux cellules congelées avec du WPE (72,1%) ou même du DMSO (66,9 %). En revanche, une combinaison des deux protéines permet d'obtenir une viabilité de 91,3%, ce qui est largement supérieur à celle obtenue du DMSO. Outre cela, l'utilisation de cette combinaison de protéines pour congeler les hépatocytes permet d'obtenir une bonne capacité d'attachement des cellules après décongélation ainsi qu'un bon maintien des fonctions hépato spécifiques (Grondin et al., 2008). La capacité à maintenir les cellules vivantes
et fonctionnelles après décongélation a donc pu être démontrée pour ce mélange de protéines. Il serait intéressant de comprendre par quels mécanismes ces protéines protègent les cellules contre les dommages causés lors de la cryoconservation.
1.3.3.9 Énolase et BASl : des protéines prometteuses comme agents de cryoconservation
Dans le but d'identifier des protéines individuelles ayant une activité cryoprotectrice potentielle dans le WPE, l'extrait a été purifié par précipitation, suivie d'une série de chromatographies. Les fractions obtenues ont été testées comme agent de cryoconservation, et les fractions cryoactives ont par la suite été analysées par spectrométrie de masse afin d'identifier les différentes protéines qui composent ces fractions. La protéine énolase et la 2-Cys peroxirédoxine (BAS 1) ont été retrouvées dans la majorité des fractions cryoactives.
L'énolase, aussi connue sous le nom de 2-phosphoglycerate hydrolase est l'une des protéines cytosoliques les plus exprimées et est très conservée structuralement chez de nombreuses espèces (Diaz-Ramos et al., 2012). Elle est aussi présente à la surface des cellules, dans le noyau et la paroi cellulaire. L' énolase est une enzyme activée par un ion métallique. Son cofacteur naturel est le magnésium (Mg2+), mais elle peut aussi être
activée par 5 autres ions métalliques divalents: Zn2+, Mn2+, Fe2
+,
Cd2+ et Co2+Brewer et Ellis, 1983; Pancholi, 2001). Elle possède deux sites de liaisons qui contribuent àson activité catalytique faisant en sorte que le rôle du Mg2+ est double. La liaison au
premier site induit les changements conformationnels dans le site actif qui va permettre de lier le substrat ou ses analogues. Une fois le premier Mg2+ bien lié, un second Mg2+
se lie au deuxième site et sert de composant requis pour l'enzyme en permettant la fixation du substrat sur l'enzyme (Pancholi, 2001). Chez les vertébrés, on trouve trois isoformes de l'énolase: l'a-énolase qui se retrouve dans de nombreux tissus dont le