N° d’ordre : 2370
THESE DE DOCTORAT D’ETAT
Présentée par
EL MOSTAPHA LOTFI
Spécialité : Chimie des Matériaux
TITRE
Analyse de la corrélation entre structure et propriétés ferroélectriques
de phases non – stoechiométriques isolés au voisinage de LiTaO
3au
sein des diagrammes ternaires
Li
2O-Ta
2O
5-(CuO)
2et Li
2O-Ta
2O
5-(WO
3)
2Soutenue le 24 Juillet 2007
Devant le jury :
Président :
- Mr. B. ELOUADI, Professeur, Université de la Rochelle,……...……..France
Examinateurs :
-Patrice BOURSON, Professeur, Université Paul – Verlaine de Metz, …..France
-Mohammed ZRIOUIL, Professeur, Faculté des Sciences, Rabat,………...Maroc
-Jilali ARIDE, Professeur, Directeur Ecole Normale Supérieure,Tétouan.. Maroc
-Ali BOUKHARI, Professeur, Doyen Faculté des Sciences, Kénitra,…...Maroc
-Mohammed Es-SOUNI, Professeur IMST, Fachhoschule, Kiel,…… Allemagne
-Mohamed HAMDANI, Professeur, Faculté des Sciences, Agadir,……….Maroc
-Makoto WATANABE, Professeur, Chubu University, Kasugai,………….Japan
-ElMajid ZAYER, Professeur à l’ENSET de Mohammedia & Directeur de la
Technologie, Rabat………Maroc
Université Mohammed – V- Agdal
Faculté des Sciences
RABAT
AVANT PROPOS
Ce travail a été effectué au Laboratoire de Chimie du Solide Appliquée, Département de Chimie, Faculté des Sciences de Rabat.
Au moment où s’achève ce travail, il m’est particulièrement agréable d’exprimer mes vifs remerciements à Monsieur le Professeur Brahim ELOUADI pour l’intérêt bienveillant qu’il a porté à ce travail, il a dirigé mes travaux avec beaucoup de compétences, il m’a fait profiter de sa grande expérience, je lui suis très reconnaissant de la confiance qu’il m’a toujours témoignée.
Je tiens à remercier particulièrement Monsieur le Professeur Mohammed ZRIOUIL de m’avoir permis, par son soutien sans faille en de nombreuses circonstances, de mener à bien ce travail. Ses conseils et sa profonde humanité ont été pour moi une aide précieuse. Je lui suis reconnaissant d’avoir accepté d’être rapporteur de ma thèse et de participer à ce jury.
Je remercie vivement Monsieur le Professeur Ali BOUKHARI, Directeur du Laboratoire pour son soutien moral et ses conseils judicieux. Ses qualités humaines ont été pour moi une aide précieuse Il a bien voulu nous faire l’honneur de juger ce travail je lui exprime ma profonde gratitude.
Je suis très honoré de la présence dans ce jury de Monsieur le Professeur Patrice BOURSON de l’Université Paul-Verlaine de Metz-Supelec, Laboratoire LMOPS, qui m’a fait bénéficié de sa grande compétence et m’a entouré d’une amicale sollicitude, il a participé à ce travail avec la réalisation et l’interprétation des spectres de diffusion Raman. Je le remercie très vivement d’accepter d’être rapporteur et de participer à ce jury.
J’apprécie beaucoup l’honneur que me fait Monsieur le Professeur El Majid ZAYER, Directeur de la Technologie au Département de l’Enseignement Supérieur, de la Formation des Cadres et de la Recherche Scientifique, en acceptant d’étudier et de juger ce travail. Je tiens à le remercier pour ses compétences et son entraide dont il a toujours fait preuve.
J’exprime ma profonde gratitude à Monsieur le Professeur Jilali ARIDE, pour ses conseils tout au long de ce travail, pour la sympathie qu’il m’a toujours réservée et pour son esprit d’entraide. Il a accepté de participer à mon jury de thèse qu’il veuille trouver ici l’expression de mes respects les plus vifs.
Monsieur le Professeur Makoto WATANABE de l’Université de Chubu, Kasugai, Japan qui nous fera profiter de sa grande expérience et de ses compétences dans le domaine de la ferroélectricité a accepté de faire partie de notre jury de thèse. Qu’il nous soit permis de lui adresser nos plus vifs remerciements pour sa disponibilité.
Que Monsieur le Professeur Mohammed Es-SOUNI, IMST, Fachhoschule, Kiel, Allemagne, reçoive ici l’expression de nos remerciements les plus sincères pour accepter de siéger parmi le jury de ma thèse.
Je remercie vivement Monsieur le Professeur Mohamed HAMDANI, d’avoir accepté d’examiner ce travail.
Qu’il me soit permis de remercier Monsieur le Professeur J.M. CHEZEAU de l’Ecole Nationale de Chimie de Mulhouse qui m’a accueilli dans son Laboratoire et a su me faire profiter de sa grande expérience dans le domaine de la RMN.
Je suis très reconnaissant à Messieurs Bernard MEURER chargé de Recherches et Philipe GAVEAU Ingénieur à l’Institut Charles Sadron (ICS) à Strasbourg pour les intéressantes discussions que nous avons eues. Leurs importantes contributions dans la réalisation et les traitements des spectres RMN ont été pour moi très précieux et ont permis de faire avancer ce travail.
Il m’est agréable de remercier Monsieur le Professeur Marc FONTANA, Directeur du Laboratoire : Matériaux Optiques, Photoniques et systèmes (MOPS)-pour la collaboration et pour la participation aux études de diffusion Raman.
Plusieurs composantes contribuent à la réalisation d’un travail de recherche. Que tous ceux qui ont contribué à l’aboutissement de cette thèse trouvent ici l’expression de mes chaleureux remerciements.
Je suis très reconnaissant à Monsieur le Professeur Omar FASSI FIHRI Secrétaire Perpétuel de l’Académie des Sciences et Techniques du Royaume du Maroc, pour son encouragement et son soutien.
Je tiens à remercier particulièrement Monsieur le Professeur Abdellatif MOQINE, Directeur de L’Ecole Normale Supérieure de Takkadoum de Rabat, pour l’aide précieuse qu’il m’a toujours apportée et pour ses conseils amicaux tout au long de ce travail.
Je remercie sincèrement, Monsieur le Professeur Abdellilah Nadiri, Doyen de la FST de Settat pour son aide et sa courtoisie et pour son soutien moral et ses conseils judicieux
Je remercie vivement Monsieur le Professeur Driss ZAKARYA, Professeur à la FST Mohammedia, pour son soutien pour ses conseils et pour l’aide précieuse qu’il m’a toujours apportée.
Je remercie Mr Abderrazzak ASSANI pour son aide et pour les discussions que l’on a eues le long de notre parcours commun.
Qu’il me soit permis d’adresser mes sincères remerciements à tous le membres de mon Laboratoire LCSA particulièrement Monsieur le Professeur Lahcen EL AMMARI et Madame le Professeur Malika OUCHETTO.
J’exprime ma gratitude à Mesdames les Professeurs Naîma EL KHAYATI et Rajae CHERKAOUI et du Laboratoire de Physique Nucléaire pour leurs encouragements incessants et pour l’esprit de collaboration dont elles ont toujours fait preuve.
Je tiens à remercier vivement Madame le Professeur Françoise BOUREE du Laboratoire Léon Brillouin, CEA-Saclay, pour l’accueil chaleureux au cours de mon stage pour la réalisation de la Diffraction des Neutrons et également pour les discussions enrichissantes que l’on a eues et pour ses encouragements.
Mes vifs remerciements sont adressés également à mes amis et collègues de l’ENSET de Rabat de l’ENS Takkadoum Rabat.
S O M M A I R E Page
AVANT PROPOS……….1
INTRODUCTION………..…...7
Bibliographie………....9
Chapitre I : GENERALITES
I - 1 : Généralités sur la ferroélectricité
I.1.1 - Définition………..…12
I.1.2 - Propriétés des ferroélectriques……….…12
I.1.3 – Caractérisation des ferroélectriques……….……12
Bibliographie………..…14
I - 2 : Techniques d’élaboration du matériau LiTaO
3I. 2. 1 – Elaboration des monocristaux de LiTaO
3……..…………15
I. 2. 2 - Techniques de synthèses par gélation. ………...…16
I. 2. 3 – Techniques de préparation de couches minces. …...……16
I. 2. 4 - Techniques de synthèses sol-gel. ………...…16
I. 2. 5 - Techniques de synthèses de céramiques. ………...…17
Bibliographie………..18
I -3 : Propriétés structurales et ferroélectriques de LiTaO
3I. 3. 1 – Eude structurale. ………...…20
I. 3. 2 – Origine de la ferroélectricité dans LiTaO
3………...20
I. 3. 3 – Techniques liées à la ferroélectricité ……….23
I. 3. 4 – Applications technologiques de LiTaO
3………23
Bibliographie………..…25
I - 4 : Non- stoechiométrie dans LiTaO
3………..……...…27
Bibliographie………..……28
Chapitre II : TECHNIQUES EXPERIMENTALES
II - 1: Elaboration et caractérisation d’échantillons céramiques
II -1-1 : Méthodes de préparation. ………..30
II -1-2 : Méthodes d’analyses. ………30
II -1-2- 1 : Analyse radiocristallographique……….….30
II -1-2- 2 : Contrôle de poids……….30
II -1-2- 3 : Mesures de densités……….31
II – 2 : Spectroscopie d’impédance..………..…….31
II - 3 : Spectroscopie Raman……….…………....…...32
II - 4 : Spectroscopie RPE.………...………...…32
II – 5 : Spectroscopie RMN…….……….………...32
Chapitre III
IDENTIFICATION DES PHASES
AU VOISINAGE DE LiTaO
3DANS LES SYSTEMES
Li
2O - Ta
2O
5- (CuO)
2et Li
2O - Ta
2O
5- (WO
3)
2III - 1 : Identification des phases……….……34
III – 2 : Etudes radio cristallochimiques
III.2 - 1 : Système Li
2O - Ta
2O
5- (CuO)
2……….……35
III.2 - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2……….……35
III - 3: Analyse des résultats cristallochimiques :
III.3 - 1 : Système Li
2O - Ta
2O
5- (CuO)
2……….…35
III.3 - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2……….……42
III - 4 : Discussions et conclusions………..44
Bibliographie………48
Chapitre IV
ANALYSE DE LA NON-STOECHIOMETRIE
AU VOISINAGE DE LiTaO
3DANS LES SYSTEMES
Li
2O - Ta
2O
5- (CuO)
2et Li
2O - Ta
2O
5- (WO
3)
2IV - 1 : Prévisions théoriques de la non-stoechiométrie au voisinage de LiTaO
3IV - 1 - 1 : Système Li
2O - Ta
2O
5- (CuO)
2………..…51
IV - 1 - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2……….……52
IV - 2 : Détermination des formules réelles.
IV – 2 - 1 : Cas du Système Li
2O - Ta
2O
5- (CuO)
2………..…53
IV – 2 - 2 : cas du Système Li
2O - Ta
2O
5-
(WO
3)
2………...…53
IV - 3 : Discussions
IV - 3 - 1 : Système Li
2- Ta
2O
5- (CuO)
2………...…57
IV - 3 - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2………...60
IV - 3 - 3 : Effets des conditions de synthèses sur la non stoechiométrie………….65
IV - 4 : Conclusions………...66
Chapitre V
ETUDES DIELECTRIQUES DANS LES SYSTEMES
Li
2O - Ta
2O
5- (CuO)
2et Li
2O - Ta
2O
5- (WO
3)
2V - 1 : Système Li
2O - Ta
2O
5- (CuO)
2V - 1 - 1 : Phases synthétisées par refroidissement lent …………...……70
V - 1 - 2 : Phases synthétisées par trempe……….70
V - 1 - 3 : Discussions………...74
V - 1 – 4 : Interprétations et Conclusions ……….77
Bibliographie………80
V - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2V - 2 - 1 : Tests d’optique non linéaire. ………81
V - 2 - 2 : Etudes diélectriques………...84
V - 2 - 3 : Mesures de la conductivité. ………...91
V - 2 - 4 : Discussions………...95
V - 2 - 5 : Interprétations et conclusions……….100
Bibliographie………..103
Chapitre VI
SPECTROSCOPIE RPE D’UNE SONDE
PARAMAGNETIQUE Cu
2 +DANS LE SYSTEME
Li
2O - Ta
2O
5- (WO
3)
2Nos principaux résultats sont publiés dans les références suivantes …………105
- Comptes rendus du 10 ième Colloque « Optique Hertzienne et Diélectriques, (O.H.D) (Sous-Groupe Européen A.M.P.E.R.E.). 6, 7 et 8 Septembre 1989, Rennes, France. - Journal of Korean Physical Society, Vol.32, February 1998, pp. S1845-S1849.
Chapitre VII
SPECTROSCOPIE RMN DES NOYAUX
6Li et
7Li
DANS LE SYSTEME Li
2O - Ta
2O
5- (WO
3)
2VII - 1 : Phénomènes de la résonance magnétique nucléaire (RMN)
VII - 1 - 1 : Principes de la RMN ………...107
VII - 1 - 2 : Conditions d’enregistrement des spectres. ………..107
VII - 1 - 3 : RMN du solide ………108
VII - 2 : ANALYSE PAR RMN SOLIDE DES NOYAUX
7Li :
Les principaux résultats sont reportés dans la publication: ………..114
“CR YST AL CH EM IC AL D IEL ECT R IC AN D NM R ST U D IES OF SOL ID SOL UT IO NS ISO LAT ED CLO SE T O Li T aO3 INS ID E T H E T ER N AR Y S YST EM Li2O – T a2O5 – ( W O3)2”par B.Elouadi, EL M Lotfi, L. Delmotte and J. M.Chézeau, Ferroelectrics, Vol. 157, pp. 177 – 182 , 1994.
VII - 3 : SPECTROSCOPIE RMN DES NOYAUX
6Li
VII – 3 - 1 : Résultats analytiques. ………...….115
VII – 3 - 2 : Discussions et conclusions. ……….…...115
VII - 4 : DETERMINATIONS ET ANALYSES DES PARAMETRES
RMN STATIQUES ET DYNAMIQUES DES NOYAUX
7Li
VII – 4 – 1 : Position du problème………...122
VII – 4 – 2 : Conditions d’enregistrement des spectres…...122
VII – 4 – 3 : Démarches et procédure……….…122
VII – 4 - 4 : Résultats expérimentaux………...123
VII – 4 – 5 : Discussions………...………..129
VII – 4 – 6 : Conclusions. ………..….134
Bibliographie………..134
Chapitre VIII
SPECTROSCOPIE DE DIFFUSION RAMAN
DANS LE SYSTEME Li
2O - Ta
2O
5- (WO
3)
2Les principaux résultats sont reportés dans le projet de publication intitulée
“Raman investigation of the LiTaO
3related solid solutions
isolated inside the ternary diagram Li
2O-Ta
2O
5-(WO
3)
2’’...135
INTRODUCTION GENERALE
Les niobates et tantalates de lithium sont très étudiés et trouvent beaucoup
d’applications pour leurs propriétés piézoélectriques, pyroélectriques,
electro-optiques, et acousto-optiques Les récents développements de l’optique intégrée
et ses applications pour le traitement du signal (guides d’ondes pour
télécommunications, technologies d’enregistrement…) (1 - 4), a suscité un vif
recours à ces matériaux qui présentent les meilleurs compromis des valeurs des
coefficients électro-optiques et piézo-électriques (stockage de l’information par
holographie,…) (5 – 11).
LiMO
3(M=Nb, Ta) possède un réseau cristallin capable d’accueillir des ions par
un mécanisme d’insertion ou de substitution, chaque élément introduit dans le
réseau favorise une perturbation qui induit une nouvelle mise en ordre des ions
de la matrice et par conséquent les propriétés ferroélectriques se voient
modifiées. La majeure partie des propriétés physiques de LiMO
3et des solutions
solides qui en dérivent est sensible à l’existence de défauts intrinsèques et
extrinsèques susceptibles d’apparaître dans ces matériaux (12 - 22). Le
phénomène connu sous le nom de « dommage optique » a été attribué par de
nombreux auteurs à la présence d’impuretés comme Cu(II) à des concentrations
extrêmement faibles dans les phases LiMO
3 .De plus l’insertion de cations,
comme Cu
2+, pouvant entraîner des déformations Jahn-Teller, présente un intérêt
fondamental en cristallochimie. D’autre part, les tantalates et niobates acquièrent
des propriétés photochromiques quand on introduit des ions W
6+ou Mo
6+dans la
matrice.
L’activité de recherche de notre équipe est axée sur la synthèse et la
caractérisation de nouvelles phases dérivées des niobates et des tantalates de
lithium et l’étude de la relation structure propriétés ferroélectriques. Plusieurs
travaux ont été développés sur ces phases non stoechiométriques obtenues par
insertion des cations bi, tri, tetra et hexavalents (23 - 35).
Ce mémoire comporte l’étude de deux systèmes de phases non
stoechiométriques synthétisées au voisinage de LiTaO
3et contenant des ions
Cu
2+ou W
6+. Nous l’avons divisé en huit chapitres
Le premier chapitre rappelle les propriétés ferroélectriques et structurales de
LiTaO
3ainsi que les différentes méthodes d’élaboration de ce matériau, le
chapitre II est consacré aux différentes techniques expérimentales mises en
œuvre pour la caractérisation des solutions solides synthétisées, l’identification
des phases au Cu
2+et au W
6+par diffraction de Rayons X et l’analyse
radiocristallographique font l’objet du chapitre III, dans le chapitre IV nous
examinons les principaux résultats d’analyse de la non stoechiométrie des
phases du Cu
2+et W
6+. On reporte dans le chapitre V les principaux résultats de
mesures diélectriques. Les techniques spectroscopiques, RPE d’une sonde de
Cu
2+et RMN des noyaux
6Li et
7Li concernant les phases au W
6+ont été
développées aux chapitres VI et VII, où on a inséré des extraits de nos
publications relatives à ces études spectroscopiques. La diffusion Raman dans
les phases au W
6+fera l’objet du chapitre VIII.
BIBLIOGRAPHIE
1- C. M. Verber, N. F. Hortman and A. M. Glass; Appl. Phys. Lett;. 3, 272 (1977)
2- S. M. Kostritskii and D. Kip; Phys. Status Solidi a- Appl. Res.; 16, 171 (1998)
3- D. Kip; Appl. Phys. B- lasers and optic, 6, 131, (1998)
4- Revue Electronique, n°156, Mars 2005.
5- P. Yeh, A. E. Chiou, J. Hong, P; Beckwith, T. Chang and M. Khoshnevisan; Opt. Engng.; 28; 328, (1989)
6- F. H. Mok, M. C. Tackitt and H. M. Stoll.; Opt. Lett.; 16; 605, (1991) 7- E. Krätzing and R. Orlowski; Appl. Phys.; 15; 133, (1978)
8- H. Kurz, E. Krätzig, W. Keune, H. Engelman, V. Gonser, B. Dischler and A. Räuber; Appl. Phys., 12, 12, (1977)
9- J. Imbrock, S. Wevering, K. Buse and E. Krätzig; J. Opt. Soc. Am. B-Optical Phys. 16 ; 1392, (1999)
10-A . Räuber; Curent Topics in Material Science (Ed. Kaldis E North-Holland, Amsterdam), 1; 481 , (1978)
11-E. Krätzing and O. F. Schirmer; Photorefractive Materials and their Application (Ed. P. Günter, J. P. Huignard, Springer, Berlin), (1988)
12- K. Nassau and E. M. Lines, Journal of Appl. Phys. 41, [2], (1970).
13- L.Kovacs, K. Polgar, Cryst. Res. Technol. 21,(6),101-104,(1986).
14- Iyi, N., Kitamura, K., Izumi, F., Yamamoto, J.K., Hayashi, T. Asano, H., Kimura, S. ; J.Solid State Chem. 101, 340-35, (1992).
15- Wilkinson, A.P., Cheetham, A,K., Jarman, R.H.,J. Appl. Phys. 74, 3080-3083, (1993).
16- Watanabe, T. Sota, K. Suzuki, N.Iyi, K. Kitamura and S. Kimura, J. Phys.: Condens. Mater 7, 3627-3635, (1995)
17- Boysen and F.Altorfer, Acta. Cryst., B50 , 405-414, (1994)
18- A. V. Yatsenko and E. M.Ivanova, Phys. Solid State, 37(8), (1995)
19- J. B. Thomson, C. Small, P. Lightfoot and P. Bruce, J. Mater. Chem. 5 (7), 1039-104,
(1995).
20- A.V.Yatsenko, E.N. Ivanova and N. A. Sergeev, Physica ,B (240), 254-262 ,(1997).
21- M Paul, M. Tabuchi and A. R. West, Chem. Mater. 9, 3206-3214 (1997)
22- S. M. Kaczmarek, M. Swirkowicz, R. Jablonski, T. Lukasiewicz and M. Kwasny; J.of. Alloys and Compounds; 300-301; 322-32, (2000)
23-B. Elouadi, M. Zriouil, J. Ravez and P. Hagenmuller ; Mat. Res. Bull. 16, 1099, (1981) 24-B. Elouadi, M. Zriouil, J. Ravez and P. Hagenmuller ; Ferroelectrics ; 56 , 21 , (1984) 25-M. Zriouil, B. Elouadi, J. Ravez and P. Hagenmuller, J. of Solid State Chem. 51 ; 53, (1985)
26-Zriouil, J. Senegas, B. Elouadi and J. B. Goudenough ; Mat. Res. Bull.; 20 , 679 ,(1985) 27- B.Elouadi and M.Zriouil, J.Solid State Chem., 64, 22, (1986).
28- Elouadi and E. Lotfi, J. of Solid State Chem. ; 67 , 308 , (1987) 29-B. Elouadi and F. E. Mouahid; Phase transitions; 9, 221 ,(1987) 30-B. Elouadi and F. E. Mouahid; Mat. Res. Bull.; 23, 241, (1988) 31-B. Elouadi and K. Khiat ; Ferroelectrics ; 94, 317, (1989)
32-B. Elouadi, E. Lotfi, L. Delmotte and J. M. Chezeau; Ferroelectrics; 157, 177, (1994) 33-B. Elouadi ; J. Chim. Phys. ; 88 ; 2229, (1991)
34-B. Elouadi and K. Khiat ; Ferroelectrics ; 158 , 25-30, (1994)
35- A. Assani, M. Zriouil and B. Elouadi ; Ferroelectrics ; 185 , 45 , (1996)
Chapitre I
GENERALITES
I - 1 : Généralités sur la ferroélectricité.
I.1.1 - Définition
I.1.2 - Propriétés des ferroélectriques
I.1.3 – Caractérisation des ferroélectriques
Bibliographie
I - 2 : Techniques d’élaboration du matériau LiTaO
3.
I. 2. 1 – Elaboration des monocristaux de LiTaO
3I. 2. 2 - Techniques de synthèses par gélation.
I. 2. 3 – Techniques de préparation de couches minces.
I. 2. 4 - Techniques de synthèses sol-gel.
I. 2. 5 - Techniques de synthèses de céramiques.
Bibliographie
I - 3 :Propriétés structurales et ferroélectriques de LiTaO
3.
I. 3. 1 – Eude structurale.
I. 3. 2 - Origine de la ferroélectricité dans LiTaO
3:
I.3. 3 – Techniques liée à la ferroélectricité
I.3. 4 – Applications technologiques de LiTaO
3:
Bibliographie
I -4 : Non- stoechiométrie dans LiTaO
3I.1 – GENERALITES SUR LA FERROELECTRICITE I. 1 . 1 :DEFINITION
Sont désignés sous le nom de ferroélectriques les matériaux non linéaires, dans lesquels existe une polarisation spontanée résultant de l’alignement des moments dipolaires même en l’absence de champ électrique extérieur.
I. 1 . 2 : PROPRIETESDESFERROELECTRIQUES :
L’existence d’un moment dipolaire permanent implique, en particulier, que le matériau est non centrosymétrique, condition nécessaire mais non suffisante pour engendrer des propriétés ferroélectriques. Des considérations de la symétrie cristalline permettent de prédire que sur les 32 classes de symétrie, 20 d’entre elles comportent un ou plusieurs axes polaires. Parmi ces 20 classes, dites piézoélectriques seules 10 possèdent un seul axe polaire. Lorsque les cristaux correspondants sont soumis à une variation de température, il apparaît des charges de signes opposés sur les faces perpendiculaires à l’axe polaire, c’est le phénomène pyroélectrique. Si le sens de la polarisation peut être inversé par application d’un champ électrique, le cristal est alors ferroélectrique. [I.1.1 - 2].
I. 1 .3 : CARACTERISATION DES FERROELECTRIQUES
Les matériaux ferroélectriques sont très sensibles aux effets thermiques. Lorsque le matériau est porté au-delà d’une température critique, appelée température de Curie Tc, la polarisation s’annule et le matériau passe d’une phase polaire à une phase non polaire le matériau n’est plus ferroélectrique mais devient para- électrique, la constante diélectrique relative ε’r passe par un maximum à T=Tc et pour T > Tc, ε’r (T) varie avec la température suivant une loi de Curie-Weiss de la forme : Tc T C − = r '
ε où C est la constante de Curie.
Un matériau ferroélectrique soumis à un champ électrique alternatif E, permet de décrire un cycle d’hystérésis polarisation – champ électrique (P – E) ; (Figure I.1). La portion BC, correspond à la saturation, tous les dipôles électriques sont orientés dans le même sens. OS exprime la polarisation spontanée. Au point E = 0, on a P = Pr= Polarisation rémanente, branche OD ; au point P = 0, on a E = Ec= Champ coercitif, branche OF.
Figure I – 1 –
L’étude d’un cycle d’hystérésis ne peut être envisagée que sur monocristaux ou échantillons polycristallins frittés possédant une grande rigidité diélectrique, des pertes diélectriques relativement faibles et une stabilité chimique [I.1.1].
Lorsque le champ coercitif est très élevé, le cycle d’hystérésis ne peut être saturé et Ps est alors approchée par intégration du coefficient pyroélectrique obtenu à l’aide de mesures de thermocourants [I.1.3].
Lorsque la température décroît, Ps croît rapidement puis de manière de plus en plus lente, ce comportement différencie un ferroélectrique d’un antiferroélectrique pour lequel Ps est toujours nulle ; car il possède deux sous réseaux ayant des polarisations égales et de sens opposés.
BIBLIOGRAPHIE
[I.1.1] - L. Eyraud, ed. Gauthier-Villars, 1967. Diélectriques Solides anisotropes et ferroélectricité [I.1.2] - D. Sivoukhine, Cours de Physique Générale Tome III, Edition MIR, Moscou,
Traduction Française par Sergguet Medvédev.
I - 2 – TECHNIQUES D’ELABORATION DU MATERIAU LiTaO3
Depuis les premières études réalisées par Matthias et Remeika en 1949 sur cristal de LiTaO3 [I.2.1] et par B. S.Razbirin, en 1965, sur une céramique de LiTaO3 [I.2.2] on assiste à
une avancée des nouvelles techniques d’élaboration du matériau LiTaO3 pour des applications
appropriées. Ces dernières années plusieurs études se sont orientées vers le développement de nouveaux process de synthèse pour surmonter le problème de la nonstœchiométrie.
I - 2 . 1 – Elaboration des monocristaux de LiTaO3
Les premiers cristaux ont été obtenus par A. A. Ballman (1965), [I.2.3] utilisant la technique de Czochralski, depuis des nouvelles techniques de croissances ont été entreprises, la stoechiométrie dépend des méthodes, des bains de préparations et de l’atmosphère du milieu, les principales techniques utilisées sont :
A - Technique de croissance de Czochralski
Cette technique consiste en un tirage d’un cristal à partir d’un germe mono-cristallin au contact d’un bain contenant une charge de poudre en fusion. Elle permet l’obtention des cristaux de bonne qualité et de taille importante.
B - Technique VTE ( Vapor Transport Equilibration)
Cette technique utilisée dans la préparation des cristaux stœchiométriques a été décrite par P. F.Bordui et al [I.2.4], elle consiste à placer un cristal de LiTaO3, à proximité d’une
poudre de métatantalate de lithium d’une certaine composition, portée à une température avoisinant 1100 °C, à l’air, pendant, 20h . Le rapport Li/Ta du cristal s’équilibre avec celui de la poudre par des mécanismes de transport sous forme de vapeur et de la diffusion à l’état solide.
C - Technique de tirage Czochralski par double creuset ( DCCZ)
Technique développée par K.Kitamura et al., [I.2.5] et perfectionnée par M.
Nakamura et al., [I.2.6]. Elle consiste à utiliser deux creusets concentriques. Le creuset
interne contient une poudre riche en Li2O, est utilisé pour la croissance Czochralski, alors que
le creuset externe contient une poudre de LiTaO3 de composition stœchiométrique.
D - Technique de Flux Growth ou d’Epitaxie
Un exemple de cette technique de croissance a été utilisée par Hsu, R. M. et al, [I.2.7], les cristaux préparés ont une forme rectangulaire de dimensions (47x36x23) µm.. T. Kawaguchi [I.2.8] a pu préparer des couches d’épitaxie en phase liquide.
E - Technique de croissance de fibres cristallines :
Croissance de fibres cristallines par la technique LHPG ( Laser Heated Pedestal Growth) développé par R. S. Feigelson [I.2.9] et utilisée par G. Boulon et son équipe [I.2.10] pour la synthèse de LiTaO3 pur et dopé par des métaux de transitions ou terres rares.
I - 2 . 2 - Techniques de synthèses par gélation.
On cite les exemples de synthèse par un procédé de gélation à partir des pentaethoxydes de Ta , Ta (OC2H5)5 et d’éthoxyde de Li, LiOC2H5, technique utilisée parN.
Puyoô-Castaings et al., [I.2.11] et la méthode de polymérisation complexe développée par J.
Szanics et al. utilisant un mélange de méthanol d’acide citrique d’éthylène glycol, du Li2CO3
et du TaCl5. [I.2.12] ou une technique de complexation d’un acide tantalique- préparé via une
solution d’oxalate du Ta et KHSO4- par une solution d’acide citrique et d’éthylène glycol, [I.2.13], par ces techniques, LiTaO3 est préparé, par pyrolyse à l’air entre 400-700°C.
I. - 2 . 3 – Techniques de préparation de couches minces.
Différents procédés ont été utilisés, par exemple :
- Les techniques physico-chimiques d’élaborations pyrosol (solutions d’acetylacétonate de Li et d’éthoxyde de Ta et/ou pulvérisations cathodiques sous faible pression d’un mélange air/ O2 à faible pression entre 500-600°C)utilisée parV. Bornand et al. [I.2.14].
- La technique dite (LPE)- qui consiste à préparer des couches d’épitaxie en phase liquide, elle a été développée par T. Kawaguchi et al, [I.2.15] et lui a permis de déposer des films de LiNb1-xTax O3 (0 ≤ x ≤ 0,4)
- La méthode rapportée par K.W. Chour [I.2.16] quiemploie les précurseurs LiOCH3
et Ta (OC2H5)5 dans les solvants 1 et 2 propanol (ou - butanol) l’opération est suivie de
calcination à 750° /5h, la couche mince de LiTaO3 déposée eststoechiométrique.
I. - 2. 4 - Techniques de synthèses sol-gel.
On cite le procédé de thermolyse, à 500°C/2h, d’un gel obtenu à partir d’un mélange Li2O et TaCl5 dans du méthanol, technique développée par M. D. Aguas et al. [I.2.17] et la
méthode de P. Phule et al[I.2.18].basée sur la condensation et hydrolyse des alkoxydes de Li et Ta, LiTaO3 suivie d’une calcinationentre 500°C et 600°C.
I - 2 . 5 - Techniques de synthèses de céramiques.
Différents protocoles de synthèse, en phase solide, ont été suivis par différents auteurs pour préparer des céramiques de LiTaO3, [I.2.19 - 28]. La matière première est toujours un
mélange stoechiométrique de Li2CO3 et Ta2O5, desséché entre 200°-300°C puis broyé dans
l’alcool ou l’acétone, avant de subir des traitements thermiques qui selon les auteurs varient de 600°C à 1300°C, les températures de frittages sont de l’ordre de 1250°C voire 1500°C. Les durées des traitements varient de quelques heures (1 à 12h) à quelques jours (1-10 jours) selon les procédures de chauffe, toutes les synthèses sont, en général, faites à l’air.
BIBLIOGRAPHIE :
[I.2.1] B. Matthias and J. P.Remeika, Phys. Rev., 76, 1886, (1949).
[I.2.2] B.S.Razbirin, translated from FizikaTverdogo Tela, 6, N°1,316-317,(1964) (English transl. Soviet Phys-Solid State ) , 6, L54, (1964))
[I.2.3] A.A Ballman, J. Am. Ceram. Soc., 48, 112, (1965)
[I.2.4] P. F. Bordui R. G. Norwood, C.D.Bird and J .T Carella, J. Appl. Phys, 78 (7) 4647. (1995) [I.2.5] K.Kitamura, J.K.Tamamoto, N.Iyi, S.Kimura, T.Hayashi, J.Cryst.Growth,113, 327.
(1991)
[I.2.6] M.Nakamura, S.Takekawa, Y.Furukawa, K.Kitamura, J.Cryst.Growth,245,267-272, (2002)
[I.2.7]. R .Hsu,E. N. Maslen, D. Du Boulay and N. Ishisawa, , Acta. Cryst. , B 53,420, (1997) [I.2.8] T. Kawaguchi, D. H. Yoon, M. Minakata, Y. Okada, M.Imaeda, T. Fukuda, J. Crystal
Growth, 152, 87, (1995)
[I.2.9]. R. S. Feigelson, Springer Ser. Opt. Sc.,47, 129, (1985)
[I.2.10] R. Burlot, M. Ferriol,, R. Moncorgé and G. Boulon, Eur. J. Solid State Inorg.Chem.,t 3, 1-8, (1998)
[I.2.11] N. Puyoô-Castaings,F. Duboudin, J. Ravez and P. Hagenmuller, Ma. Res. Bull., 22, 261- 268, (1987)
[I.2.12]. J. Szanics, T. Okubo and M. Kakihana , J.of Alloys and Compounds, 281, 206-210, (1998)
[I.2.13] J. Szanics and M. Kakihana , Chem. Mat., 11, 2760-2763, (1999)
[I.2.14] V. Bornand, I. Huet, Ph. Papet and E. Philippot, Deposition of LiTaO3 thin films by pyrosol process, Thin Solid Films, 307 - 239, (1997)
[I.2.15] T. Kawaguchi, D. H. Yoon, M. Minakata, Y. Okada, M.Imaeda, T. Fukuda, J. Crystal Growth, 152, 87, (1995)
[I.2. 16] K.W. Chour, R.C. Zhang, M.S.Goorsky, T.Takada, E.Akiba, T.Kumagar,K.Kawaguchi, M.L.Jensen, C.Eavesand and R. Xu. J. Crystal Growth, 181, 217-226, (1998)
[I.2.17] M. D. Aguas and I.P.Parkin, Journal of Materials Science Letters, 20, 57-58,(2001) [I.2.18] P. Phule, T. A. Deis, D. G.Dindiger., J. Mater. Res., 6,1567, (1991)
[I.2.19] T. Yamada , N. Nûzeki and H. Toyoda, Japan. J. Appl; Phys., 7, 298-299, (1968) [I.2.20] V. I. Nesterenko and G. Ismaîlzade.,Sov. Phys. Crystallogr. 18, N°1,112-113, (1973) [I.2.21] R. R. Neurgaonkart, T. C. Lim and E. J. Staples. Res. Bull.,13, 635-642, (1978) [I.2.22] A. Santero, R. S.Roth and M. Austin, ActaCryst., B38, 1094-1098, (1982)
[I.2.23] Y. Torii, T. Sekiya, T. Yamamoto, K. Koyabashi and Y. Abe, Mat. Res. Bull.,18, 1569- 1574, (1983)
[I.2.24] S.Kawakami, A. Tsuzuki, T. Sekiya, T. Ishikuro, M. Masuda and Y. Torii, Mat.Re. Bull. 20, 1435-1440, (1985)
[I.2.25] A. Huanosta and A. R. West, ,J. Appl. Phys., 61 (12), 5386-5391,(1987) [I.2.26] Marcus Paul, M .Tabuchi and A. R. West. Chem. Mater. 9, 3206-3214, (1997) [I.2.27] M. E. Villafuerta-Castrejon, J. A. Azamar-Barries and B. Perez, J. of Solid State
Chemistry , 140, 168-174, (1998).
[I.2.28] Y.Repelin, E. Husson, F. Bennani and C. Proust. Journal of Physics and Chemistry of Solids, 60, 819-825, (1999).
I . 3 – PROPRIETES STRUCTURALES ET FERROELECTRIQUES DE LiTaO3
I. 3 . 1 – ETUDE STRUCTURALE :
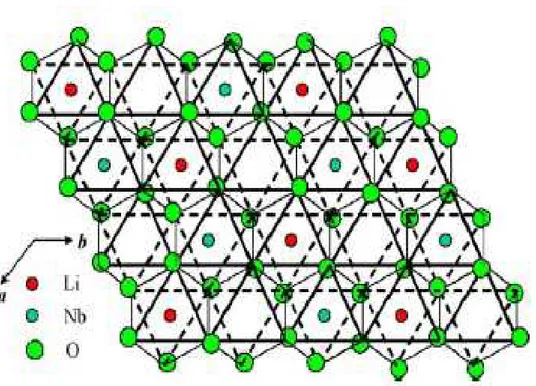
La structure cristalline de LiTaO3 a été déterminée à partir de la diffraction des rayons X et de
neutrons, les premiers travaux reviennent à S.C. Abrahams et al. [I. 3. 1 - 3]. A température ambiante, LiTaO3 est de système trigonal, classe 3m, groupe d’espace R3c.
L’arrangement spatial est apparenté à celui du corindon α-Al2O3 et de l’ilménite, seul l’ordre
cationique permet de différencier les 3 types structuraux Fig.I.2.
Dans le réseau idéal de LiTaO3 , 2/3 de sites octaédriques sont occupés par Li+ ou Ta5+, le 1/3
restant est vacant. Il y a 6 groupements formulaires par maille élémentaire. Tous les octaèdres, dans la structure réelle, sont irréguliers, ceux occupés par Li sont plus larges que ceux du Ta
[I.3. 4 - 5].
La disposition spatiale des oxygènes dans le réseau est telle que les octaèdres d’espèces différents (LiO6) et (TaO6) disposés le long de la direction [00.1] ⁄⁄⁄⁄⁄⁄⁄⁄ à l’axe
c
de la maille ont en commun une face, les chaînes d’octaèdres de même espèce (LiO6) ou (TaO6), dirigés le long de la rangée [-2 2 1] partagent un sommet. Les paires d’octaèdres, (LiO6) et (TaO6) inter-chaînes, disposés suivant les plans de base, selon la direction [1 -1 0] ont en commun des arrêtes. Ces arrangements cationiques induisent une polarisation spontanée responsable de la ferroélectricité dans ce matériau. (Fig.I.3 - 4)I - 3 . 2 - ORIGINE DE LA FERROELECTRICITE DANS LiTaO3 :
La découverte de la ferroélectricité dans le cristal LiTaO3 revient à Matthias et Remeika
(1949), qui ont constaté l’existence d’une polarisation de saturation dans le cycle d’hystérésis et d’une croissance rapide de la polarisation spontanée avec la température [[I.2.1]. La mesure de cette polarisation spontanée a été réalisée, indépendamment, par H. Iwasaki et al. (1967),
S. Wemple et al (1968) et A. M. Glass (1968), [I.3.6 - 8] ; les propriétés diélectriques,
thermiques et pyroélectriques ont été largement étudiés par A. M. Glass (1968). [I.3.8]. Dans le matériau cristallin, la structure des domaines ferroélectriques a été déterminée et mesurée par H. J. Levinstein et al (1966), la taille maximale est de 5 microns. [I.3.9].Les propriétés diélectriques de la céramique LiTaO3 ont été mesurées pour la 1ière fois par B. S. Razbirin
(1965) [I.2.2].
La variété ferroélectrique de LiTaO3 cristallise, à 25°C, avec un groupe d’espace R3c,
cette forme est stable jusqu'à 665°C, température de transition ferro-paraélectrique, au dessus de laquelle la symétrie devient R−3 c.
αααα- Al2O3 LiTaO3 FeTi O3 Mn4Nb2O9
[ 0 0 0 1]
_
[ 1 1 0 0 ]
Figure I - 2- : Arrangements structurales des oxydes de type corindon.
Figure I -3 -: Structure tridimensionnelle de LiMO3 ( M = Nb ou Ta)
Figure I - 4 -: Sens de polarisation spontanée dans LiMO3 (M=Nb ou Ta) suite à l’application d’un champ électrique.
A la transition ferroélectrique le déplacement coopératif des ions Li+ et Ta5+ hors des centres d’octaèdres oxygénés parallèlement à [00.1], entraîne l’apparition d’une polarisation spontanée Ps selon la direction c (Fig.I.4)
Plusieurs études ont été entreprises:[I.3.3]et[I.3.10 - 14] pour élucider le mécanisme et la nature de cette transition de phase qui peuvent être de deux types :
- Displacif : les dipôles apparaissant dans la phase ferroélectrique, (basse symétrie) sont le résultat du déplacement des ions par rapport à la position qu’ils occupent dans la phase paraélectrique.
- Ordre- désordre : dans la phase ferroélectrique les réarrangements des ions est à l’origine de la polarisation due aux sauts de Li entre leur sites normaux et les sites vacants, les dipôles existent même au-delà de la transition mais sont parfaitement désordonnés.
I - 3 . 3 - TECHNIQUES LIEES A LA FERROELECTRICITE
Les transitions ferroélectriques – para électriques peuvent être mises en évidence par de nombreuses techniques. .Parmi celles-ci nous citons :
- Diffraction X (discontinuité thermiques des paramètres et changement de groupe d’espace).
- Analyse Thermique Différentielle (ATD) : pics d’ATD à la transmission de phase. - Mesures diélectrique (maxima de ε'r et disparition de Ps à la température de Curie : disparition du cycle d’hystérésis (P, E)).
- Mesures élastiques, piézo-électriques et électrooptiques (optimum des constantes élastiques, coefficients piézoélectriques).
- Microscopie électronique et optique (réorientation ou disparition des domaines ferroélectriques).
- Spectroscopies : optiques: évolutions thermiques de la réponse du signal et des modes de vibration particulières des divers spectres jusqu’à T = Tc.
I - 3 . 4 – APPLICATIONS TECHNOLOGIQUES DE LiTaO3 :
Les propriétés piézoélectriques, pyroélectriques, électrooptiques et acoustiques ou leur combinaison ont fait du métantalate de lithium l’un des matériaux
ferroélectriques le plus étudié et le plus utilisé dans des domaines variés [I.3.8] et [I.3.15 - 32] tels que :
- Diélectriques pour condensateurs miniaturisés.
- Stockage des informations dans les mémoires pour ordinateurs par effet électrooptiques. - Imagerie infrarouge : applications pyroélectriques, piézo-électriques et électrooptiques. - Fabrication des thermistors utilisant les variations de capacité en fonction de la
température.
- Utilisation en optique non linéaire : LiNbO3 et LiTaO3 sont parmi les meilleurs doubleurs
de fréquence connus. - Ect…
BIBLIOGRAHPIE :
[I.3.1] S C. Abrahams, and J.L. Bernstein, J. Phys. Chem. Solids 28, 1685. (1967)
[I.3.2] S.C. Abrahams, W.C. Hamilton and A.Sequiera, J. Phys.Chem.Solids,28, 1693 (1967). [I.3.3] S.C. Abrahams,E. Buehler,W.C.Hamilton and S.C.Laplaca, J.Phys. Chem. Solids, 34,
521 (1973)
[I.3.4] S.C. Abrahams and P. Marsh, Acta Crystallogr. B42, 6 (1986)
[I.3.5] L. Rebouta, P.J.M. Smulders, D.O.Boerna, F. Agullo-Lopez, M.F.da.Silva and J.C.Soares, The American Physical Society, 48, 3600 (1993).
[I.3.6] H. Iwasaki, N. Ushida and T. Yamada, Japan. J. Appl. Phys. 6,1336(1967) [I.3.7] S. Wemple, M. DiDomenico and I. Camlibel, Appl. Phys. Letters,12,209,(1968) [I.3.8] A. M. Glass, Physical Review,172, N2, (1968),
[I.3.9] H. J. Levinstein, A. A. Ballman and C. D. Capio Communication, Bell Telephone Laboratory Incorporated,Murray Hill, Neww Jersy, (1966).
[I.3.10] E. J. Samuelsen andA. P.Grande, Z. Phys. B24, 207,(1976).
[I.3.11] M. R. Chowdhury, G. E. Peckhan and D. H.Saunderson, J.Phys. C11, 1671(1978) [I.3.12] W. D. Johnston, Jr. and I. P.Kaminow, Phys. Rev. 168, 1045 (1968).
[I.3.13] A. Penna, A.Chavesand S. P. S.Porto, Solid State Commun. 19,491 (1976) [I.3.14] M. Zhang and J. F. Scott, Phys. Rev.B 34, 1880, (1986)
[I.3.15] M. E. Lines, Solid State Communications,, 10, 793 (1972).
[I.3.16] A. F. Penna, A. Chaves and S. P. S. Porto, Solid Communications, 19, 491 (1976) [I.3.17] A. F. Penna, S. P. S; Porto and E. Wienner-Arnear, Solid State Communications 23, 377 (1977)
[I.3.18] – M. E. Lines and M. Glass, Phys. Rev. Letters, 39, 1362 (1977) [I.3.19] J. Ravez and F. Micheron, l’actualité chimique, Janvier (1979).
[I.3.20] H. Nishiyama, N. Saito, T. Yashima, K. Sato and Y. Inoue, Surface Science, Vol 427- 428, pp 152-156, (1999).
[I.3.21] Jun-ichi Kushibiki, Yuu Ono and Izumi Takanaga Electonics and Communications in Japan, Part 2, Vol 83, N°9, (2000)
[I.3.22] Chuansheng Feng and Pingmao Xu, Infrared Physics and Technology, 40, pp 61-70, (1999)
[I.3.23] N. Wakatsuki, S. Kudo and M. Chiba, Ultrasonics, 38,46-50, (2000) [I.3.24] De Micheli M., Ostrowsky. D. B., Barety J.P., Candi C., Carnera A and Papuchon M. ; Crystalline and optical quality of proton exchanged waveguides, J. Light Techn. 4 (7); 741, (1986).
[I.3.26] P. Granestrand et al. Electron. Letters, 22, 816 (1986).
[I.3.27] A. J. Moulson, J.M. Herbert; Electroceramics, Materials Properties and Applications, chapman and Hall, London 1990, Club E.A.A, Optoélectronique. [I.3.28] M.de Micheli, Journées d’électronique 1990, Club E.A.A., Optoélectronique, (1990).
[I.3.29] B. Desormière ; OPTO 91, p. 245-250. (1991).
[I.3.30] J. Imbrock, S. Wevering, K. Buse and E. Krätzig; J. Opt. Soc. Am. B-Optical Phys. 16 ; 1392 (1999)
[I.3.31] Y. Aoki, Y. Sekimoto, Y.Wada, W. Yamaguchi, R. Nomura and Y.Okuda, Phusica B, 329-333, 116-117, (2003).
I - 4 – NON-STOECHIOMETRIE DANS LiTaO3
LiTaO3 possède un réseau susceptible d’accueillir des ions par un mécanisme
d’insertion et /ou de substitution, donnant lieu à un large domaine de non-stoechiométrie. Dans toute préparation ou synthèse, le rapport Li/Ta varie dans un large domaine de composition, cette variation a une grande influence sur les propriétés physico-chimiques du matériau. [I.4.1 - 8]
L’étendue d’existence de la phase LiTaO3, en % molaire en Li2O, dépend des
méthodes et des conditions de synthèses, Par exemple, elle peut s’étendre de 46,0% à 50,4% pour un cristal selon [I.4.2, 6], ou de 47,5% à 49,5% pour une préparation par la technique VTE selon [I.2.4] et de 48,2% à 50,6% [I.4.3] voire de 44,0% à 54% [I.4.7] dans le cas de poudres suivant les protocoles de synthèses.
La non-stoechiométrie dans les composés LiMO3 (M = Nb, Ta) a été étudiée
depuis plus de 25 ans, différents modèles ont été proposés, dans la littérature, mais le mécanisme de non-stoechiométrie n’est pas complètement résolu [I.4.9 - 14].
BIBLIOGAPHIE:
[I.4.1] Roth R.S.,Parker H.S.,Brower. W. S., Waring J.L, Infast ion transport in solids; Solid-State battery and devices,Van Gool,W. Ed,North-Holland,Amsterdam,217-232 ,(1973) [I.4.2] -T. Yamada, N. Niizeki and H. Toyoda, Jap. J. Appl. Phys., 7 (3), 298-99, (1968)
[I.4.3] F. I. Kozhaev, S-A. Shwartsman, S.I. Suslova and V.A. Sokolov, Sov. J. Opt. Technol, 45 (5), 301-302, (1978)
[I.4.4] J. A. Allemann, Y. Xia, R.E. morriss, A. P. Wilkinson, H. Eckert, J.S. Speck, G. C. Levi and F. F. Lange; J. Mater Res., 11 (9); 2376-2387, (1996)
[I.4.5] A.A.Ballman, H.T.Levinstein, C.D.Capio and H. Brown “Curie temperature and Birefringence variation in Ferroelectric Lithium Metatantalate as a Function of Melt Stoichiometry,” J.Amer. Ceram. Soc., 50 , [12] 657-59 (1967)
[I.4.6] R.L. Barns and J.R. Carruthers,”Lithium Tantalate Single-crystal Stoichiometry,” J.Appl.Crystallogr, 3 [5], 395-99, (1970)
[I.4.7] B.A, Scott and G. Burns, J. of The American Ceramic Society, 55 [5], 225-229, (1972) [I.4.8] P.Lerner, C. Legras and J.P. Dumas: „Stoechiométrie des monocristaux de métaniobate
de lithium ». J. Cryst. Growth 3, 4 , 231-235, (1968)
[I.4.9] K. Nassau and E. M. Lines, Journal of Appl. Phys. 41, [2], (1970) [I.4.10] L.Kovacs and K. Polgar, Cryst. Res. Technol., 21 (6), 101-104, (1986)
[I.4.11] Iyi, N., Kitamura, K., Izumi, F., Yamamoto, J.K., Hayashi, T. Asano, H. and Kimura, S. ; J. Solid State Chem. 101, 340-352, (1992)
[I.4.12] Wilkinson, A.P., Cheetham, A,K., Jarman, R.H., J. Appl. Phys. 74, 3080-3083, (1993)
[I.4.13] Y. Watanabe, T. Sota, K. Suzuki, N.Iyi, K. Kitamura and S. Kimura, J. Phys.: Condens. Matter, 7, 3627-3635, (1995)
[I.4.14] D. Xue and K. Kitamura, J. of Physics and Chemistry of Solids, 66, 585-588, (2005)
Chapitre II
TECHNIQUES EXPERIMENTALES
II - 1 : Elaboration et caractérisation d’échantillons céramiques
II -1-1 : Méthodes de préparation.
II -1-2 : Méthodes d’analyses
II -1-2- 1 :.Analyse radiocristallographique
II -1-2- 3 :.Mesures de densités
II -1-2- 2 : Contrôle de poids
II – 2 : Spectroscopie d’impédance
II – 3 : Spectroscopie Raman et micro-Raman
II – 4 : Spectroscopie RPE
II - 1 : Elaboration et caractérisation d’échantillons céramiques II – 1 - 1 : Méthodes de préparation.
Nos matériaux ont été préparés par réaction de diffusion à l’état solide. Les oxydes Ta2O5,
WO3 et CuO et le carbonate Li2CO3, tous de haute pureté (>99,9% Merck type Opti Pur.),
sont préalablement portés à 200°C pour éliminer toute trace d’eau. Le mélange réactionnel servant à synthétiser les échantillons a été finement broyé dans un mortier d’agate puis placé dans des nacelles d’alumine avant de subir des traitements thermiques, entrecoupés de broyages, à des températures variant de 600 à 1000°C pendant 12h Les derniers traitements sont des opérations de frittage - pastilles pressées à la température ambiante sous 2 T. cm-2 sous forme de disques de diamètre 12mm et d’épaisseur 1mm environ et enrobés par la poudre de la même préparation. Les températures de préparation des céramiques sont de 1250°C/4h pour les phases au tungstène (W) et de 1350°C/4h pour les phases au cuivre (Cu)
Deux protocoles de synthèse ont été réalisés suivant les solutions solides au W ou au Cu: - chauffes à l’air ou sous courant d’oxygène pour les phases au tungstène (W) suivies
de refroidissements lents de l’ordre de 100°C/h,
- chauffes à l’air pour les phases au cuivre (Cu) suivies de refroidissement lent ou de trempes à l’air jusqu’à la température ambiante.
La pureté des produits est contrôlée par la variation de poids et par analyse radiocristallographique.
II - 1 -2 : Méthodes d’analyses.
II – 1 -2 - 1 :.Analyse radiocristallographique :
Cette analyse est faite sur poudre polycristalline à l’aide des diffractomètre à compteur type CGR thêta 60 ou SIMENS D5000, utilisant le rayonnement Kα d’une anticathode de cuivre. La mesure précise des distances inter-réticulaires est réalisée à l’aide d’un étalon interne : le Si (silicium) de haute pureté. Les paramètres cristallins ont été affinés en utilisant la méthode statistique des moindres carrés.
II – 1 - 2- 2 : Contrôle de poids :
Le contrôle de poids se fait par pesée avant et après chaque traitement thermique sur une balance de sensibilité 10-4 g.
Les premières pertes de poids, entre 600 - 700°C, correspondent, dans tous les cas au départ de CO2. Au delà de cette température nous n’avons retenu que les échantillons pour
lesquels cette perte n’a pas dépassé 1 % à 2 %.
II – 1 – 2 - 3 :.Mesures de densités
Les mesures sont déterminées par les méthodes de poussée hydrostatique et de pycnomètrie, le liquide utilisé est soit du bromobenzène soit de l’orthophtalate de diéthyle .
II - 2 : Spectroscopie d’impédance.
II - 2 -1 : Mesures diélectriques :
Les mesures sont réalisées à l’aide du pont automatique HP, 4262A. et LCR 4192A. Les mesures de la constante diélectrique sont effectuées, par la méthode du pont de Schering [II.2.1] sur des céramiques frittées, sous forme de disques circulaires d’environ 1mm d’épaisseur et 12mm de diamètre. Les faces circulaires sont recouvertes de couches conductrices d’argent.
La pastille est placée, entre deux électrodes cylindriques dans une cellule de mesure comportant un four et un thermocouple, les mesures se font sous vide ou sous atmosphère contrôlée. L’évolution thermique de la capacité, du facteur de dissipation de l’échantillon, est suivie de 25 à 800°C à des fréquences de 102 Hz, 103 et 104 Hz.
Dans tous les cas, les mesures se font par des chauffes et des refroidissements de 0.25 à 1°C/mm, ce qui permet d’apprécier la reproductibilité des résultats.
Les mesures de la capacité et du facteur de perte permettent la détermination des valeurs de
ε'
ret
ε″
r.
Dans un diélectrique réel la constance diélectrique est complexe de type :
ε
r* =ε
'r - jε
″r,Si un condensateur est branché sous une tension alternative : V =
ν
e jω t,il sera parcouru par un courant alternatif : i = Co dV/dt = jωCoν
e jω t.Rempli d’un isolant de constante
ε
r*la capacité est : C = (ε
'r - jε
″r) Co.Le courant i est alorsi = ω (j
ε
'r +ε
″r)ν
Co e jω tSoit : I' = ω
ε
'r Coν
et I″= ωε
″r Coν
L’angle de perte du diélectrique sera défini par : tg δ = = ' " I I = r r ' " ε ε BIBLIOGRAPHIE :
II - 2 - 2 : Mesures de la conductivité :
La variation de la conductivité électrique a été suivie en fonction de la température à 120Hz, 1 et 10KHz, sur les mêmes céramiques et en même temps que les mesures diélectriques.
II - 3 : Spectroscopie Raman et micro Raman
Nous avons utilisé la technique Raman à angle droit (90°) et la rétrodiffusion (µ - Raman) ; l’appareil de type Labram de John Yvon, avec un détecteur CCD, utilisant un laser He-Ne (6328 Ǻ) les spectres ne sont pas polarisés et le temps d’acquisition est de 5 secondes.
II - 4 : Spectroscopie RPE.
Les échantillons ont été placés dans des tubes en quartz, les spectres ont été enregistrés à à l’aide d’un appareil Varian V- 4502 à la température ambiante, le Klystron est utilisé sur la bande X (9,5 GHz), le temps d’enregistrement est de 5-10mn., l’étalon est le DDPH.
II - 5 : Spectroscopie RMN.
On a utilisé deux spectromètres, Bruker MSL 300 , Bo= 7,1 Teslas fréquences de résonances
de 6Li ( I=1) et 7Li ( I=3/2) respectivement à 44,168 et 116,638 MHz- et Varian CXP 200, Bo= 4,7 Teslas, fréquence du noyau 7Li à 77,7 MHz .
Les échantillons sont pesés puis compactés et placés dans des spinners en zircone, les paramètres statiques et dynamiques ont été mesurés à l’ambiante.
Suivant le mode du champ pulsé (FTR NMR) ou continu (CW NMR) différentes techniques d’analyse et d’ajustement ont été exploitées. Les constantes de couplages ont été déterminées par la technique MAS (rotation à l’angle magique), pour mesurer les temps spin-réseau T1 on
a utilisé la méthode inversion-recouvrement et pour les temps spin-spin T2 et les seconds
Chapitre III
IDENTIFICATION DES PHASES
AU VOISINAGE DE LiTaO
3DANS LES SYSTEMES
Li
2O - Ta
2O
5- (CuO)
2et Li
2O - Ta
2O
5- (WO
3)
2III - 1 : Identification des phases
III – 2 : Etudes radio cristallochimiques
III.2 - 1 : Système Li
2O - Ta
2O
5- (CuO)
2III.2 - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2III- 3 : Analyse des résultats cristallochimiques :
III.3 - 1 : Système Li
2O - Ta
2O
5- (CuO)
2III.3 - 2 : Système Li
2O - Ta
2O
5- (WO
3)
2III - 4 : Discussions et conclusions
III.4 - 1 : Binaire Li
2O– Ta
2O
5III.4 - 2 : SYSTEME Li
2O - Ta
2O
5- (CuO)
2III.4 - 3 : SYSTEME Li
2O - Ta
2O
5- (WO
3)
2III - 1 : IDENTIFICATION DES PHASES
Au cours de l’élaboration des phases dérivées de LiTaO3 et contenant du tungstène W6+
ou du Cu2+ nous avons adopté deux protocoles complémentaires de synthèses :
-
Pour le système Li2O - Ta2O5 - (WO3)2 l es synthèses ont été effectuées à l’air et sous atmosphère d’oxygène suivies de refroidissement lent.-
Pour le système Li2O - Ta2O5 - (CuO )2 les synthèses ont été réalisées en atmosphère de l’air ambiant suivies par des refroidissements lents ou de trempes.Ces études ont été motivées par notre objectif d’identifier et de caractériser les solutions solides apparaissant au voisinage de LiTaO3 à l’intérieur des diagrammes ternaires Li2O –
Ta2O5 – (MpOq),(M=Cu ou W) en tenant compte des paramètres physiques et chimiques
susceptibles d’influencer les équilibres de phases : i) modes de refroidissements,ii) températures de synthèses, iii) effet relatif de la pression partielle d’oxygène du milieu et leurs conséquences sur la stabilisation de certains degrés, etc…Les oxydes WO3, CuO et Li2O (issu
de la calcination de Li2CO3) présentent des volatilités non négligeables lorsqu’ils sont portés à
des températures supérieures à 1100°C. Il n’en est pas de même pour le pentoxyde réfractaire Ta2O5. Pour poursuivre les évolutions des synthèses, nous avons noté les colorations des
phases et suivi les pertes de masses au cours des différents traitements. Nous n’avons retenu que les échantillons pour lesquels la perte de masse n’excède pas 1% à 2%. A la fin des traitements thermiques, les phases au Cu ont des colorations, allant du gris foncé pour les synthèses par refroidissements lents au jaune-gris ou vert-gris pour celles préparées par trempe, alors que la couleur des composés à base de tungstène varie du jaune pâle ou vert foncé.
III – 2 : ETUDES RADIOCRISTALLOCHIMIQUES
L’analyse radiocristallographique aux rayons X nous a permis de mettre en évidence de nouvelles phases non-stoechiométriques dérivées de LiTaO3. Leurs limites ont été repérées
par l’apparition de raies supplémentaires sur les spectres de diffraction de Rayons X dont l’indexation a été faite par isotypie avec celui du composé défini LiTaO3 :
Les paramètres cristallins ont été calculés à partir des diffractogrammes X de poudres enregistrés avec un pas de ¼ de degré par minute. L’indexation des spectres de diffraction des rayons X a été opérée dans le système hexagonal avec un groupe d’espace trigonal R3c.
III – 2 - 1 : SYSTE ME Li2O - Ta2O5 - (Cu O)2
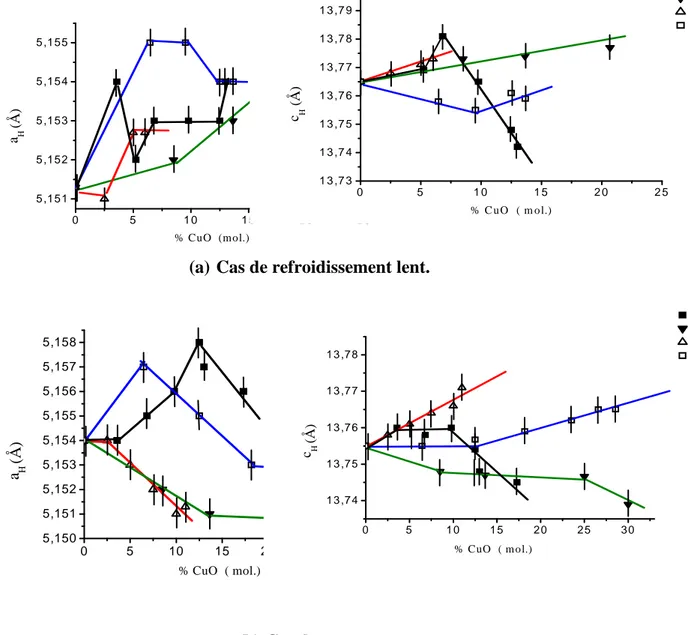
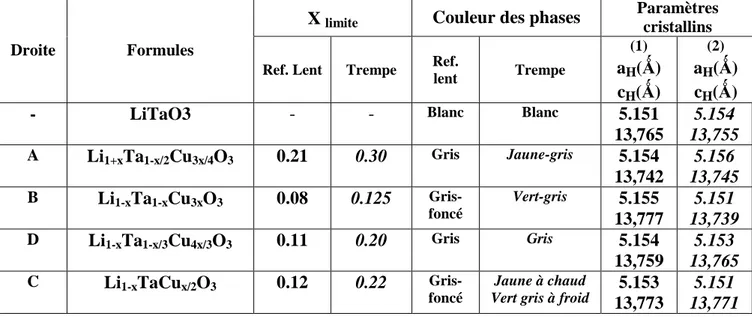
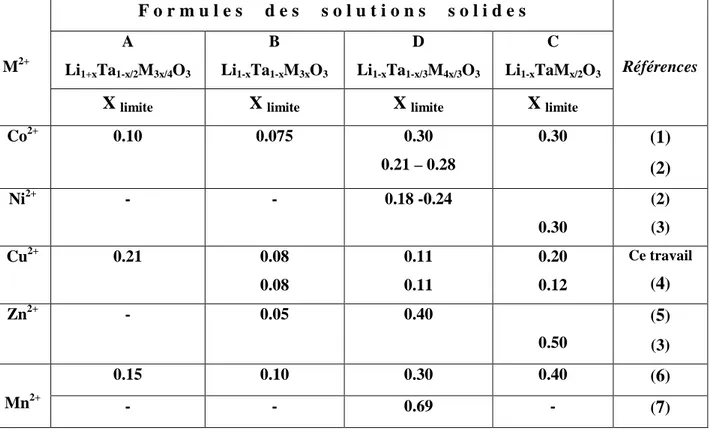
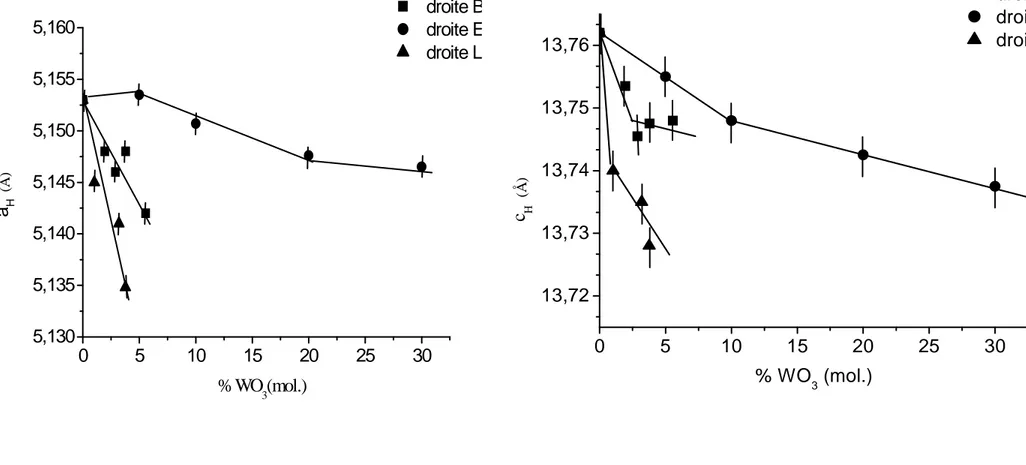
La Fig.III.1 récapitule les limites des solutions solides isolées au sein du diagramme ternaire après refroidissement lent ou après trempe. L’évolution des paramètres cristallins pour les droites A, B, C et D est représentée sur les figures III-2 (a – d)
Dans les Tableaux. III.1 et III.2 sont consignés les principaux résultats obtenus : limites de solutions solides, couleurs, paramètres des phases et compositions molaires,
III. 2 - 2 : SYSTE ME Li2O - T a2O5 - (WO3)2
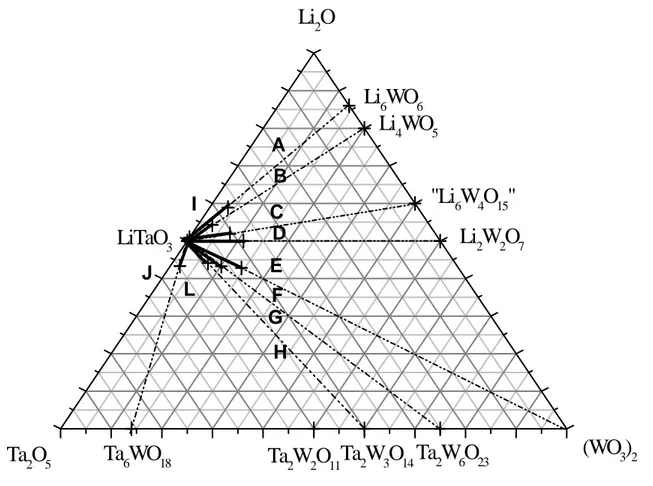
Sur la Fig..III.3 et le Tableau III. 3 ont été reportées les différentes phases synthétisées et les limites de leurs solubilités au voisinage de LiTaO3. Les droites E, F, G et H sont caractérisées
par une forte dissolution de WO3 dans le réseau LiTaO3 contrairement aux droites A, B et L.
Les droites C et D marquent une frontière entre ces deux domaines.
III – 3 : ANALYSE DES RESULTATS CRISTALLOCHIMIQUES :
III - 3 - 1 : SYSTE ME Li2O - T a2O5 - (Cu O)2
Les conditions de synthèse ont une influence sur l’évolution des paramètres cristallins.
- Pour la droite A, par refroidissement lent, le paramètre
c
H croît jusqu’à la compositionx=0.10 (6.8 % en CuO) et après il décroît, mais par trempe la décroissance est linéaire avec la composition.
- Pour les droites B et D, le paramètre
c
H varie dans le sens opposé, selon que le mode derefroidissement est lent ou brutal alors que le paramètre
a
H semble être peu sensible auprocessus de refroidissement.
-La droite C a le même comportement par trempe ou refroidissement lent.
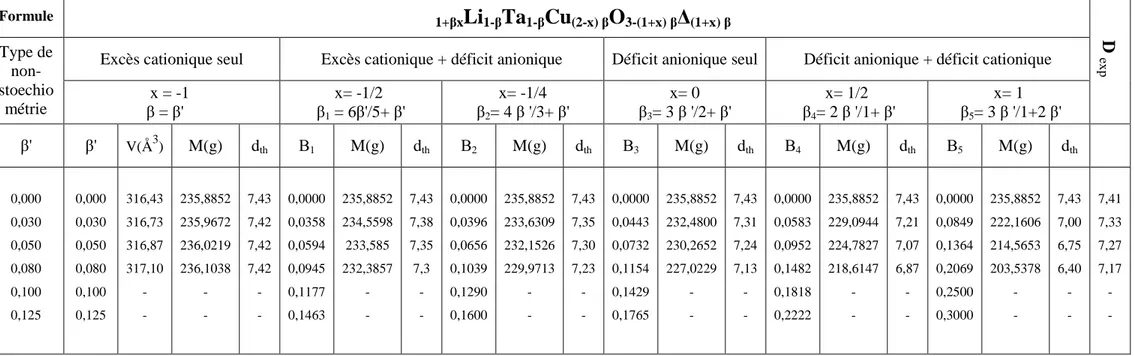
A titre de comparaison avec des résultats obtenus par d’autres auteurs sur des systèmes homologues contenant un élément de transition bivalent M2+( M= Co, Ni Mn), on donne dans le Tableau III.4 les limites des solutions solides isotypes de LiTaO3 (3.1 - 3.7)
Figure III -1 -
Etendues de différentes solutions solides dans le diagramme Li2O–Ta2O5–(CuO)2
Synthèses par refroidissements lents (a) et par trempes à l’air (b)
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 CuTa2O6 Cu 4Ta2O9 Li2CuO2 Ta2O5 Li2O (CuO)2 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 Ta2O5 Li2O (CuO)2 LiTaO3 Li2CuO2 CuTa 2O6 Cu4Ta2O9
(a)
(b)
LiTaO3(a) Cas de refroidissement lent.
(b)Cas de trempe.
Figure III - 2 -
Evolutions des paramètres cristallins a
Het c
Hen fonction de % molaire
en CuO selon le mode de synthèse
(a) par refroidissement lent
ou
(b) par trempe
0 5 1 0 1 5 20 2 5 5 ,151 5 ,152 5 ,153 5 ,154 5 ,155 (Å ) a H % CuO (mol.) A B C D 0 5 10 15 20 25 30 5,150 5,151 5,152 5,153 5,154 5,155 5,156 5,157 5,158 (Å ) a H % CuO ( mol.) A B C D 0 5 1 0 1 5 2 0 2 5 1 3 ,7 3 1 3 ,7 4 1 3 ,7 5 1 3 ,7 6 1 3 ,7 7 1 3 ,7 8 1 3 ,7 9 (Å ) c H % C u O ( m o l.) A B C D 0 5 1 0 1 5 2 0 2 5 3 0 1 3 ,7 4 1 3 ,7 5 1 3 ,7 6 1 3 ,7 7 1 3 ,7 8 % C uO ( m ol.) (Å ) c H A B C D
Figure III - 3 -
Etendue de différentes solutions solides synthétisées dans le diagramme Li2O – Ta2O5 – (WO3)2
I
J
L
H
G
F
E
D
C
B
A
Ta
6WO
18Ta
2W
2O
11Ta
2W
3O
14Ta
2W
6O
23Li
2W
2O
7"Li
6W
4O
15"
Li
4WO
5Li
6WO
6LiTaO
3(WO
3)
2Ta
2O
5Li
2O
Tableau III – 1 –
Formules et limites des solutions solides isolées à T=1300°C, par trempes ou
après refroidissements lents dans le ternaire Li
2O-Ta
2O
5-(CuO)
2X limite Couleur des phases
Paramètres cristallins Droite Formules
Ref. Lent Trempe Ref.
lent Trempe (1) aH(Ǻ) cH(Ǻ) (2) aH(Ǻ) cH(Ǻ)
- LiTaO3 - - Blanc Blanc 5.151
13,765 5.154 13,755 A Li1+xTa1-x/2Cu3x/4O3 0.21 0.30 Gris Jaune-gris 5.154 13,742 5.156 13,745 B Li1-xTa1-xCu3xO3 0.08 0.125 Gris-foncé Vert-gris 5.155 13,777 5.151 13,739 D Li1-xTa1-x/3Cu4x/3O3 0.11 0.20 Gris Gris 5.154 13,759 5.153 13,765 C Li1-xTaCux/2O3 0.12 0.22 Gris-foncé Jaune à chaud Vert gris à froid
5.153 13,773 5.151 13,771 (1) - Refroidissement lent (2) - Trempe
Tableau III – 2 –
Compositions molaires maximales des oxydes des solutions solides
isotypes de LiTaO
3Compositions maximales % (moles)
Droite Formule
Refroidisst lent Trempe à l’air
Li2O Ta2O5 (CuO)2 Li2O Ta2O5 (CuO)2 - LiTaO3 50 50 6.96 50 50 - A Li1+xTa1-x/2Cu3x/4O3 53,48 39,56 3,61 5,73 35,78 9,47 B Li1-xTa1-xCu3xO3 44,23 44,23 11,54 41,18 41,18 17,65 D Li1-xTa1-x/3Cu4x/3O3 44,50 48,17 7,33 37,50 45,83 16,67 C Li1-xTaCux/2O3 42,11 52,63 5,26 41,27 52,91 5,82