LE CORDON OMBILICAL HUMAIN, SOURCE DE
CELLULES POUR LE GENIE TISSULAIRE
Isolement, caractérisation et production de substituts humains
Thèse
Cindy Jean Hayward
Doctorat en biologie cellulaire et moléculaire
Philosophiae doctor (Ph.D.)
Québec, Canada
©Cindy Jean Hayward, 2016
Le cordon ombilical humain suscite beaucoup d’intérêt comme source de cellules à des fins de recherche et de thérapie. Quatre types cellulaires majeurs - les cellules épithéliales, stromales, musculaires lisses et endothéliales - composent les tissus solides du cordon ombilical. Quelques-uns de ces types cellulaires ont été utilisés en recherche scientifique depuis longtemps, alors que d’autres commencent à peine à dévoiler leur potentiel. Nous avons développé un protocole unique pour l’extraction séquentielle de tous ces types cellulaires d’un seul cordon ombilical, permettant ainsi la reconstruction à partir d’une même source. La combinaison des techniques de perfusion, immersion et explants a mené à la mise en culture et à l’expansion de ces cellules, dont les cellules épithéliales et les cellules stromales de la gelée de Wharton qui ont été caractérisées plus en détail par l’immunomarquage de protéines spécifiques. Leur potentiel pour la médecine régénératrice a été démontré par la production de tissus par génie tissulaire. Un vaisseau sanguin composé de cellules stromales et de cellules musculaires lisses du cordon ombilical démontra une résistance substantielle à l’éclatement. Les capacités de différenciation des cellules épithéliales ont été étudiées dans le contexte d’une peau bilamellaire reconstruite en combinaison avec des kératinocytes, des fibroblastes dermiques, et des cellules stromales de la gelée de Wharton. Les cellules épithéliales ont montré une différenciation similaire à celle des kératinocytes lorsque cultivées sur des fibroblastes dermiques et exposées à l’air, tandis que sur des cellules stromales du cordon, elles ont subi une désorganisation. Finalement, la différenciation des cellules stromales a été induite en culture vers plusieurs types cellulaires afin de compléter cette étude. L’ensemble des résultats fait ressortir l’importance non seulement de l’influence du milieu physique sur la croissance et la différenciation des cellules, mais également de l’impact de la provenance des cellules sur la qualité des tissus reconstruits.
Abstract
The human umbilical cord has received increasing attention as a source of cells for both research and therapeutic purposes. Four main cell types – epithelial, stromal, smooth muscle and endothelial cells – make up the solid tissues of the umbilical cord. Some of these cell types have been used in research for decades, while the potential of others is just being recognised. We have developed a unique protocol for the sequential extraction of all four cell types from a single umbilical cord, thus allowing the reconstruction of tissues and organs with cells from the same source. A combination of perfusion, immersion and explant techniques allows the successful extraction and expansion in culture of these cells. Further characterisation of the epithelial and Wharton’s jelly cells was carried out by immunofluorescent staining of specific proteins. The potential of these cells for use in regenerative medicine was demonstrated through the production of tissue-engineered constructs, including a blood vessel composed of umbilical cord stromal and smooth muscle cells which showed a substantial burst resistance under pressure. The capacity for differentiation of cord epithelial cells was studied in the context of a bilayered reconstructed skin substitute, in combination with keratinocytes, dermal fibroblasts, and Wharton’s jelly cells. These epithelial cells differentiated in a manner similar to keratinocytes when cultured on dermal fibroblasts and exposed to air, but under the same conditions on cord stromal cells they degenerated. Finally, to complete our study the Wharton’s jelly cells were induced to differentiate in vitro into various mesenchymal cell types. Globally, this work shows the importance of not only the culture conditions on the growth and differentiation of the various cell types, but also the important effect of the cell source on the resulting reconstructed tissues.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste d’abréviations ... xv
Remerciements ... xix
Avant-propos ... xxi
1 Introduction ... 1
1.1 Cellules et tissus, éléments de base des organes ... 2
1.1.1 Cellules souches ... 2
1.1.1.1 Définitions ... 2
1.1.1.2 Cellules souches hématopoïétiques ... 3
1.1.1.3 Cellules souches épidermiques ... 5
1.1.1.4 Cellules souches mésenchymateuses et leur différenciation ... 7
1.1.1.5 Cellules souches mésenchymateuses et fonction immunitaire ... 9
1.1.2 Sources de cellules souches ... 10
1.1.2.1 Tissus embryonnaires ... 10
1.1.2.2 Tissus gestationnels (structures extra-embryonnaires) ... 12
1.1.2.3 Le cordon ombilical ... 13 1.1.2.3.1 L'épithélium ... 14 1.1.2.3.2 La gelée de Wharton ... 15 1.1.2.3.3 La média ... 17 1.1.2.3.4 L'endothélium ... 18 1.1.2.4 Tissus adultes ... 19 1.1.2.5 Cellules reprogrammées ... 20
1.1.3 La peau humaine en tant que source de cellules et modèle de la différenciation épithéliale ... 23 1.1.3.1 L'épiderme ... 24 1.1.3.2 La couche basale ... 25 1.1.3.3 La couche épineuse ... 28 1.1.3.4 La couche granuleuse ... 29 1.1.3.5 La couche cornée ... 31 1.1.3.6 La jonction dermo-épidermique ... 32 1.1.3.7 Le derme ... 35 1.1.4 Protéines structurales ... 36
1.1.4.1 Les filaments intermédiaires en tant que marqueurs du stade de la différenciation ... 36
1.1.4.1.1 Les kératines ... 37
1.1.4.1.2 La vimentine ... 39
1.1.4.1.3 La desmine ... 40
1.1.4.1.4 Les neurofilaments ... 40
1.1.4.3 L’élastine ... 43
1.1.4.4 Les collagènes ... 44
1.2 Le génie tissulaire ... 48
1.2.1 Introduction et définition ... 48
1.2.2 Approches du génie tissulaire ... 49
1.2.2.1 Les modèles et les composants des substituts cutanés ... 49
1.2.2.1.1 Le gel de collagène ... 50
1.2.2.1.2 Le modèle d’éponge ... 50
1.2.2.1.3 L’auto-assemblage ... 50
1.2.2.2 Les modèles de vaisseaux sanguins ... 53
1.2.2.2.1 Les modèles à base de gels ... 55
1.2.2.2.2 Les tissus décellularisés ... 56
1.2.2.2.3 Les tissus auto-assemblés ... 56
1.2.2.2.4 Les échafaudages de polymères ... 57
1.3 Problématique et objectifs de recherche ... 59
1.3.1 Hypothèse et objectifs ... 60
2 Harvesting the Potential of the Human Umbilical Cord: Isolation and Characterisation of Four Cell Types for Tissue Engineering Applications ... 63
2.1 Abstract ... 64
2.2 Résumé ... 65
2.3 Abbreviations ... 66
2.4 Introduction ... 67
2.5 Materials and Methods ... 69
2.5.1 Culture Media ... 69
2.5.2 Enzymatic Solutions ... 70
2.5.3 Umbilical Cords ... 70
2.5.4 Isolation of Endothelial Cells ... 71
2.5.5 Isolation of Epithelial Cells ... 72
2.5.6 Isolation of Cells from Wharton's Jelly ... 72
2.5.7 Isolation of Smooth Muscle Cells from the Media ... 73
2.5.8 Maintenance of Cell Cultures ... 73
2.5.9 Cryopreservation of Cells ... 74
2.5.10 Tissue Reconstruction: Vascular Constructs ... 74
2.5.11 Bilayered Stromal/Epithelial Substitutes ... 74
2.5.12 Adipogenic Differentiation ... 75 2.5.13 Osteogenic Differentiation ... 75 2.5.14 Histology ... 76 2.5.15 Immunofluorescence Labelling ... 76 2.5.16 FACS Analysis ... 77 2.6 Results ... 78
2.6.1 Extraction of Four Cell Types from a Single Umbilical Cord ... 78
2.6.2 Epithelial Cell Culture and Characterisation ... 78
2.6.3 Wharton's Jelly: Matrix Components and Proteins Produced by its Cells in vivo and in Culture ... 82
2.6.5 Establishment of Smooth Muscle Cell Populations from the Umbilical Vein . 90
2.6.6 Endothelial Cell Culture and Characteristics ... 91
2.6.7 Tissue Engineering Applications Based on Umbilical Cord Cells ... 93
2.7 Discussion ... 95
2.8 Acknowledgements ... 100
2.9 References ... 101
3 Using Human Umbilical Cord Cells for Tissue Engineering: A Comparison With Skin Cells ... 107
3.1 Abstract ... 108
3.2 Résumé ... 109
3.3 Abbreviations ... 110
3.4 Introduction ... 111
3.5 Materials and Methods ... 113
3.5.1 Cell Extraction and Culture ... 113
3.5.2 Reconstructed Bilayered Stromal/Epithelial Substitutes ... 114
3.5.3 Population Doubling Calculations ... 115
3.5.4 Histological Analysis and Immunofluorescence Labelling ... 115
3.5.5 Electron Microscopy ... 116
3.6 Results ... 117
3.6.1 Cell Differentiation within the Substitute’s Epithelial Compartment is Influenced by Cell Origin ... 117
3.6.2 Detailed Evaluation of Keratinocyte-like Differentiation in the Epithelial Compartment ... 121
3.6.3 Impact of the Cell Source on the Resulting Stromal Compartment ... 123
3.6.4 Stromal Compartment Characterisation and Basement Membrane Formation ... 125
3.7 Discussion ... 128
3.8 Acknowledgements ... 131
3.9 References ... 132
4 Discussion générale ... 135
4.1 Extraction des cellules du cordon ombilical humain ... 136
4.1.1 Caractéristiques des cellules épithéliales du cordon ... 140
4.1.2 Caractéristiques des cellules de la gelée de Wharton ... 142
4.2 Reconstruction tissulaire ... 146
4.2.1 Caractéristiques des substituts de peau reconstruite ... 146
4.2.2 Lame basale ... 149
4.2.3 Caractéristiques des substituts dermiques et vasculaires reconstruits ... 150
4.3 Conclusion ... 153
5 Bibliographie ... 155
6 Annexe: Mechanical Properties of Tissue-Engineered Vascular Constructs Produced Using Arterial or Venous Cells ... 199
Avant-propos ... 199
Liste des tableaux
Tableau 1-1 Les kératines majeures des épithélia humains. ... 38 Tableau 1-2 Une comparaison de quelques types cellulaires exprimant l’α-actine
musculaire lisse ... 43 Tableau 2-1 Epithelial Cell Yield at Extraction and at Passage 0 ... 80 Tableau 2-2 Keratins Found in Umbilical Cord Epithelial Cells in situ and in vitro, in
Comparison with Skin Biopsy Samples ... 82 Tableau 2-3 Summary of the Observed Expression of Structural and Matrix Proteins in
Umbilical Cord WJC in situ and in vitro ... 87 Tableau 3-1 Composition of the Bilayered Stromal/Epithelial Substitutes ... 114 Tableau 3-2 Immunofluorescence Staining Results for Skin Substitutes After 21 Days of
Liste des figures
Figure 1-1 Les cellules souches. ... 3
Figure 1-2 Schéma de la génération de cellules hématopoïétiques. ... 4
Figure 1-3 Localisation des cellules souches dans l’épiderme et le follicule pileux. ... 6
Figure 1-4 Types cellulaires produits par les cellules souches mésenchymateuses. ... 7
Figure 1-5 Les voies de différenciation des cellules souches embryonnaires. ... 11
Figure 1-6 Les tissus gestationnels. ... 13
Figure 1-7 La structure du cordon ombilical humain. ... 14
Figure 1-8 La production de cellules pluripotentes induites. ... 20
Figure 1-9 La structure globale de la peau. ... 23
Figure 1-10 Les couches différenciées de l’épiderme. ... 25
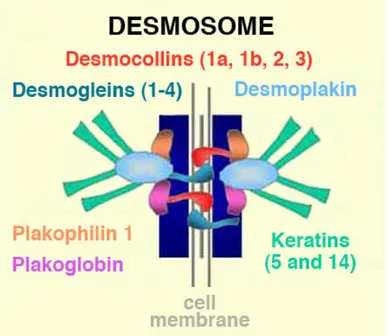
Figure 1-11 La structure des desmosomes. ... 27
Figure 1-12 Les couches différenciées de l’épiderme. ... 29
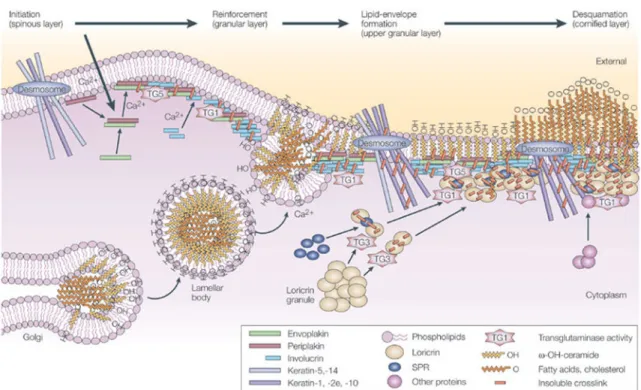
Figure 1-13 Les étapes dans la formation de l’enveloppe cornifiée. ... 30
Figure 1-14 La structure générale de la membrane basale. ... 33
Figure 1-15 La structure des hémidesmosomes et de la membrane basale. ... 34
Figure 1-16 Les sous-familles des collagènes et leur structure de base. ... 45
Figure 1-17 La structure des collagènes fibrillaires. ... 47
Figure 1-18 Schéma de la production des substituts cutanés par auto-assemblage. ... 52
Figure 1-19 Schéma de la production des substituts vasculaires par génie tissulaire. ... 55
Figure 2-1 Establishment of epithelial cell cultures from the umbilical cord. ... 79
Figure 2-2 Expression of key keratins in umbilical cord epithelial cells as detected by immunofluorescence staining. ... 81
Figure 2-3 Establishment of Wharton’s jelly cell cultures from the umbilical cord. ... 84
Figure 2-4 Structural and extracellular matrix proteins synthesised in situ by cells in the umbilical cord Wharton’s jelly. ... 85
Figure 2-5 Expression of structural and extracellular matrix proteins by Wharton’s jelly cells in culture. ... 86
Figure 2-6 Stromal cells from the Wharton’s jelly show characteristics of mesenchymal stem cells. ... 89
Figure 2-7 Establishment of smooth muscle cell cultures from the umbilical cord. ... 91
Figure 2-8 Establishment of endothelial cell cultures from the umbilical cord. ... 92
Figure 2-9 Each type of umbilical cord cell can contribute to unique reconstructed tissues produced using the self-assembly approach of tissue engineering. ... 94
Figure 3-1 Histological appearance of bilayered stromal/epithelial substitutes engineered using keratinocytes and stromal cells from different sources. ... 118
Figure 3-2 Histological appearance of bilayered stromal/epithelial substitutes engineered using umbilical cord epithelial cells and stromal cells from different sources. ... 120
Figure 3-3 Evaluation of the epithelial differentiation of bilayered stromal/epithelial substitutes after 7 days of culture at the air-liquid interface. ... 122
Figure 3-4 Expression profile of important components of the stromal compartment and basement membrane of bilayered stromal/epithelial substitutes. ... 126
Figure 3-5 Ultrastructural analysis of the WJC / ucEpi substitute after 7 days of immerged culture conditions. ... 127
Liste d’abréviations
ADN – Acide DésoxyribonucléiqueBPAG – Bullous Pemphigoid Antigen (antigène de la pemphigoïde bulleuse) BSA – Bovine Serum Albumin (albumine de sérum bovin)
cADN – Acide désoxyribonucléique complémentaire CD – Cluster of Differentiation (classe de différenciation) CE – Cellules endothéliales
CFU-F – Fibroblast Colony-Forming Units (unités de fibroblastes formant des colonies) CMH – Complexe Majeur d’Histocompatibilité (HLA en anglais)
CML – Cellules Musculaires Lisses
CSM – Cellules Souches Mésenchymateuses DF – Dermal Fibroblasts (fibroblastes dermiques)
DME, DMEM – Dulbecco-Vogt modified Eagle’s medium DMSO – Dimethyl Sulfoxide (diméthylsulfoxyde)
ECGF – Endothelial Cell Growth Factor (facteur de croissance endothéliale) ECM – Extracellular Matrix (matrice extracellulaire)
EDTA – ethylenediaminetetraacetic acid (acide éthylène diamine tétraacétique) EGF – Epidermal Growth Factor (facteur de croissance épidermique)
EIF – Épiderme Interfolliculaire
ES, ESC – Embryonic Stem Cell (cellule souche embryonnaire) FACS – Fluorescence-Activated Cell Sorting (cytométrie en flux) FCS – Fetal Calf Serum (sérum de veau foetal)
GAG – glycosaminoglycanes
GFAP – Glial FibrillaryAcidic Protein (protéine acide fibrillaire gliale) GFE – Gaine Golliculaire Externe
GFI – Gaine Folliculaire Interne
GvHD – Graft versus Host Disease (maladie du greffon contre l’hôte) HEPES – hydroxyethyl)-1-piperazine ethane sulphonic acid (acide
4-(2-hydroxyéthyl)-1-pipérazine éthane sulfonique)
HLA – Human Leukocyte Antigen (antigène leucocytaire humain)
HUVEC – Human Umbilical Vein Endothelial Cells (cellules endothéliales de la veine ombilicale humaine)
ICM – Internal Cell Mass (masse cellulaire interne) IF – Intermediate Filament (filament intermédiaire) IL-l – Interleukin-l (interleukine-l)
iPS – induced Pluripotent Stem cells (cellules souches pluripotentes induites) K – Keratin, Keratinocytes (kératine, kératinocytes)
LIF – Leukocyte Inhibiting Factor (facteur d’inhibition de la leucémie) LOEX – Laboratoire d’Organogenèse Expérimentale
LTBP – Latent TGF-β-Binding Protein (protéine liant le TGF-β)
MAGP – Microfibril-Associated GlycoProtein (glycoprotéine associée aux microfibrilles) MB – Membrane Basale
MSC – Mesenchymal Stem Cells (cellules souches mésenchymateuses)
MYOD1 – Myogenic Differentiation 1 (facteur de différenciation myogénique 1) NCS – Newborn Calf Serum (sérum de veau nouveau-né)
ND – Not Determined; non déterminé
NF-L, -M, -H – Low, Medium, High Neurofilament (neurofilaments à bas, moyen, haut poids moléculaire)
NO – Nitrogen Oxide P – Passage
PBS – Phosphate-Buffered Saline (tampon phosphate physiologique) PCL – Poly (ε-Caprolactone) (poly (ε-caprolactone))
PGA – Polyglycolic Acid (acide polyglycolique) pKi – point isoélectrique
PLA – Polylactic Acid (acide polylactique)
SEM – Standard Error of the Mean (erreur type de la moyenne) SMC – Smooth Muscle Cells (cellules musculaires lisses)
SPRs – Small Proline-Rich proteins (petites protéines riches en proline) T3 – 3,3',5 triiodo-L-thyronine
TGF-β – Transforming Growth Factor β (facteur de croissance transformant β) TRITC – Tetramethylrhodamine-5-(and-6)-Isothiocyanate (isothiocyanate de
tétraméthylrhodamine)
UC – Umbilical Cord (cordon ombilical)
ucEpi – umbilical cord Epithelial cells (cellules épithéliales du cordon ombilical) UV – Ultraviolet
vWF – von Willebrand factor (facteur von Willebrand)
Be humble, for you are made of earth; be noble, for you are made of stars. – Serbian proverb
Remerciements
Cette thèse n’aurait jamais vu la lumière du jour sans l’accueil et le soutien que j’ai reçu du Dr François A. Auger au sein du LOEX. En tant que directeur de recherche, il m’a encouragé à travers tous les défis qui se sont présentés pendant mes études plutôt tardives. Je tiens à témoigner ma grande reconnaissance et gratitude envers ma co-directrice, Julie Fradette, toujours soucieuse du travail bien fait et prête à donner de bons conseils. Elle partage avec moi le goût du langage bien écrit et m’a aidé à peaufiner mon texte au niveau de perfection auquel j’aspirais dans ma deuxième langue.
Je suis très reconnaissante envers Dan Lacroix, qui a été une source inépuisable de renseignements et de conseils, et qui a examiné avec diligence mes textes d’articles et de thèse afin de cibler l’expression exacte dont nous avions besoin. Et je remercie aussi Lucie Germain, qui m’a toujours ouvert sa porte pour mes questions, ainsi que Danielle Boucher, qui a toujours eu le temps de m’aider avec les détails administratifs.
Je voudrais remercier les examinateurs de ma thèse, Mme Renée Bazin, M. Guillaume Grenier et M. Jacques P. Tremblay, qui ont pris le temps de regarder mes travaux attentivement et avec intérêt. Je remercie aussi les organismes subventionnaires qui m’ont permis de réaliser ces études, en particulier le Conseil de recherche en sciences naturelles et génie.
Un grand merci à Rina Guignard, qui m’a initiée aux techniques d’extraction et de culture cellulaire et avec qui j’ai passé de longues heures, souvent de nuit, à faire des extractions complètes de cordon ombilical. Je voudrais offrir aussi un chaleureux merci à mes autres compagnons d’extraction et de culture cellulaire à travers les années: Murielle Rémy, Kathleen Baker, Todd Galbraith, Sophie Roberge et Sébastien Thériault.
Merci aux assistants de recherche qui m’ont grandement aidé par leurs conseils, leur aide et leur assistance technique à maintes reprises. Je pense en particulier à Nathalie Tremblay, Éric Grandbois, Valérie Trottier, Cindy Perron, Véronique Racine, Israël Martel, Sébastien Larochelle et Amélie Lavoie. Je témoigne également ma reconnaissance aux autres
chercheurs du LOEX et aux membres de leurs équipes, qui ont été généreux avec leurs conseils et l’aide pratique lorsque j’en avais besoin.
Mes photographies n’auraient pas eu le même éclat sans l’habile assistance de Claude Marin à Saint-Sacrement, et de Richard Janvier et son équipe de microscopie électronique à l’Université Laval. Merci à vous tous!
Finalement, c’est grâce au soutien de ma famille, et aux sacrifices qu’ils ont fait, que j’ai pu mener à bonne fin ce doctorat. Mon mari, Sergio, m’a appuyée et encouragée tout au long du chemin et a pris la relève à la maison lorsque je m’occupais de mes cellules en culture tard le soir. Sa compréhension et sa patience, de même que celles de mes enfants Aidan, Adriel, Rubria, Rhodric et Meritxell, sont grandement appréciées.
Avant-propos
Les travaux présentés dans cette thèse ont été effectués au Centre LOEX de l’Université Laval. Des subventions des Instituts de recherche en santé du Canada (IRSC), du Fonds de recherche du Québec - Santé (FRQS), du Réseau ThéCell du FRQS, et de la Fondation des pompiers du Québec pour les grands brûlés ont soutenu la réalisation des projets de recherche que j’ai entrepris. J’ai aussi été récipiendaire d’une bourse de formation au doctorat du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG). Cette thèse contient deux manuscrits pour lesquels je suis l’auteure principale, qui ont été publiés dans des journaux scientifiques et qui sont regroupés dans les chapitres 2 et 3. Les détails de leur publication et de la contribution des auteurs sont les suivants:
Chapitre 2: Harvesting the Potential of the Human Umbilical Cord: Isolation and Characterisation of Four Cell Types for Tissue Engineering Applications par Cindy J. Hayward, Julie Fradette, Todd Galbraith, Murielle Rémy, Rina Guignard, Robert Gauvin, Lucie Germain et François A. Auger. Cet article a été publié dans le journal Cells Tissues Organs (2013) 197 (1): 37-54 (DOI:10.1159/000341254), publié par S. Karger AG, Basel. Les expériences d’extraction de cellules et de mise au point ont été effectuées par moi-même, Todd Galbraith, Murielle Rémy et Rina Guignard, suivant le dessein conçu par François A. Auger. J’ai également entrepris les expériences de différenciation (avec Todd Galbraith) et la fabrication des substituts de peau (avec Rina Guignard), toujours avec le soutien et les conseils de mon directeur François A. Auger et de ma co-directrice, Julie Fradette, et pour les substituts de peau, de Lucie Germain. La production et l’analyse des substituts vasculaires ont été effectuées en collaboration avec Robert Gauvin. J’ai été responsable des analyses et de la rédaction du manuscrit, ainsi que du montage des photos, sous la supervision et avec l’aide inestimable de mon directeur et ma directrice. Mes co-auteurs ont aussi contribué à la révision du manuscrit pour publication.
Chapitre 3: Using Human Umbilical Cord Cells for Tissue Engineering: A Comparison With Skin Cells par Cindy J. Hayward, Julie Fradette, Pascal Morissette Martin, Rina Guignard, Lucie Germain et François A. Auger. Cet article a été publié dans le journal Differentiation (2014) 87 (3-4): 172-181, publié par Elsevier.
Les substituts de peau ont été construits par moi-même avec Rina Guignard, suivant les conseils très appréciés de Lucie Germain pour la conception et l’exécution des travaux. Pascal Morissette Martin a effectué les mesures d’épaisseur et a fait les analyses statistiques s’y rattachant. J’ai effectué les analyses histologiques et d’immunomarquage, la prise des photos en microscopie électronique, la rédaction du manuscrit ainsi que le montage des photos, toujours avec le soutien et les conseils de mon directeur François A. Auger et de ma co-directrice, Julie Fradette, et avec l’aide de mes co-auteurs.
1 Introduction
Le cordon ombilical humain est devenu une cible très prisée de la recherche scientifique dans les dernières années, avec l’expansion toujours croissante des travaux étudiant les processus de différenciation, ainsi que la reconstruction de tissus in vitro à partir de cette source de cellules. La possibilité de créer des tissus et des organes par génie tissulaire à des fins de recherche et de thérapie suscite un intérêt accru envers les cellules qui seraient aptes à une telle utilisation, et la perspective de pouvoir travailler avec des cellules ‘jeunes’ ayant accumulé un nombre relativement faible de divisions et qui auraient la capacité de se renouveler au long terme, est très motivante. Le cordon ombilical, une structure gestationnelle ne possédant pas de cellules souches embryonnaires, retient l’intérêt des chercheurs car il est facile à obtenir sans biopsie et sans controverse d’ordre éthique. De plus, il est une source de plusieurs types cellulaires, généralement exempts d’agents pathogènes.
Outre le sang du cordon ombilical, qui contient des cellules souches hématopoïétiques et mésenchymateuses et qui est à lui seul un domaine complet de recherche scientifique, il y a au moins quatre types cellulaires présents dans le tissu solide et dont l’extraction est devenue courante. Ils comprennent les cellules épithéliales, les cellules stromales, les cellules musculaires lisses et les cellules endothéliales. Ces deux derniers types sont très utiles en recherche (Jaffe et al., 1973b; Owens, 1995; L'Heureux et al., 1998; Bachetti et Morbidelli, 2000; Stephan et al., 2006; Tsigkou et al., 2010; Gauvin et al., 2011). Le cordon ombilical est une source pratique et abondante de ces cellules, avec ses artères et sa veine relativement larges et entourées d’une épaisse média (Moore, 1989). L’extraction de grandes quantités de cellules est donc peu compliquée et facilite la culture in vitro (Jaffe et al., 1973a). En ce qui concerne les cellules stromales du cordon ombilical, en particulier les cellules multipotentes de la gelée de Wharton, la recherche sur leurs propriétés de cellules souches est en pleine effervescence. L’utilisation des cellules stromales et des cellules épithéliales dans la reconstruction tissulaire a été peu abordée dans la littérature scientifique, d’où l’intérêt de regarder de plus près leurs caractéristiques.
1.1 Cellules et tissus, éléments de base des organes
1.1.1 Cellules souches
1.1.1.1 Définitions
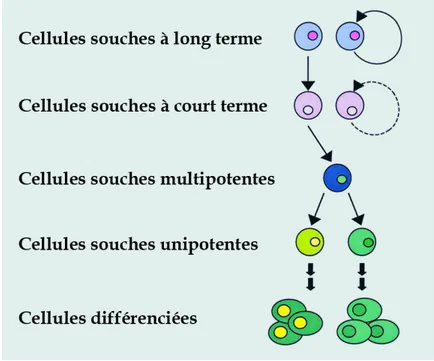
Une cellule souche est essentiellement une cellule qui se divise asymétriquement pour donner une autre cellule souche identique à la première, et une cellule fille qui peut proliférer et se différencier selon un cheminement particulier en plusieurs types cellulaires matures déterminés (Figure 1-1). Les cellules souches prolifèrent à long terme sans entrer en sénescence (Alison et al., 2002; Zuk et al., 2002). Chez l'adulte, des cellules souches se trouvent dans plusieurs tissus et organes, chaque sorte de cellule souche produisant des types cellulaires variés selon son potentiel, c’est-à-dire pluripotente, qui peut se différencier en tous les types cellulaires du corps (issus de tous les différents feuillets embryonnaires); multipotente, qui peut se différencier en plusieurs types cellulaires (du même feuillet embryonnaire); ou unipotente, qui ne se différencie qu’en un seul type cellulaire. Les plus étudiées sont peut-être les cellules souches hématopoïétiques et les cellules souches mésenchymateuses. Des cellules souches ont été également retrouvées dans la peau (Lajtha, 1979; Toma et al., 2001), le cerveau (Lendahl et al., 1990), la rétine de l'œil (Ahmad et al., 2000), l'intestin (Cheng et Leblond, 1974) et le foie (Alison et Sarraf, 1998), pour ne nommer que quelques organes.
Figure 1-1 Les cellules souches. Les cellules souches s'auto-renouvellent et peuvent en même temps produire des cellules filles ayant la capacité de proliférer et de se différencier en un ou plusieurs types cellulaires selon leur hiérarchie parmi les progéniteurs. Figure adaptée de Weissman et al. (2000).
1.1.1.2 Cellules souches hématopoïétiques
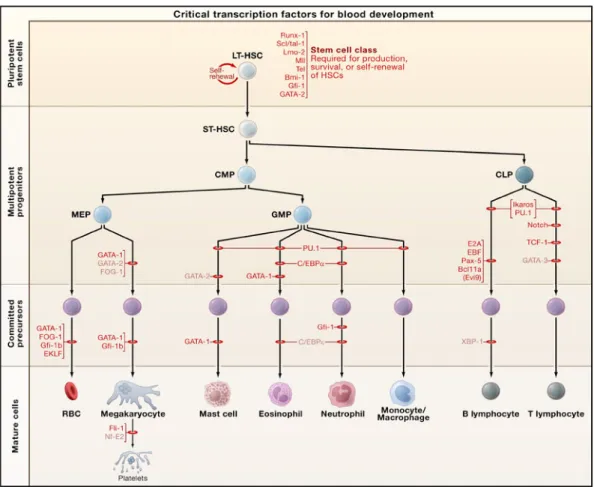
Le concept d’une cellule souche hématopoïétique, origine de toutes les cellules sanguines, fut proposé et ensuite démontré par Alexander Maximow (1906; 1909), ce qui est considéré le début de « l’ère des cellules souches » (Novik et al., 2009). Leur existence, pourtant, fut démontrée pour la première fois par les canadiens James Till et Ernest McCulloch (1961). À partir de leurs expériences, les cellules souches hématopoïétiques furent reconnues comme des cellules multipotentes, source de toutes les cellules du système sanguin (Becker et al., 1963), y compris les cellules lymphoïdes, les érythrocytes, les mégacaryocytes, les granulocytes et les macrophages à travers diverses cellules progénitrices dédiées chacune à la production de types cellulaires précis (Figure 1-2) (revu dans Orkin et Zon, 2008). Les cellules souches hématopoïétiques sont à la base des greffes de moelle osseuse depuis plusieurs décennies déjà (Bongso et Richards, 2004), grâce à leur capacité de reconstituer la fonctionnalité hématopoïétique de la moelle osseuse chez un receveur irradié avec ou sans chimiothérapie préparatoire. Chez l’adulte, elles se trouvent en majorité dans la moelle osseuse (Jacobson et al., 1951; Zanjani et al., 1993), mais pour les fins de la transplantation
on peut en récupérer aussi du sang circulant (Niskanen et al., 1979; Zvaifler et al., 2000), et du sang de cordon ombilical (Broxmeyer et al., 1989).
Figure 1-2 Schéma de la génération de cellules hématopoïétiques. Les cellules souches hématopoïétiques génèrent plusieurs types cellulaires à travers des cellules progénitrices multipotentes, chacune spécifique pour la production de certaines cellules sanguines. Figure tirée de Orkin et Zon (2008).
1.1.1.3 Cellules souches épidermiques
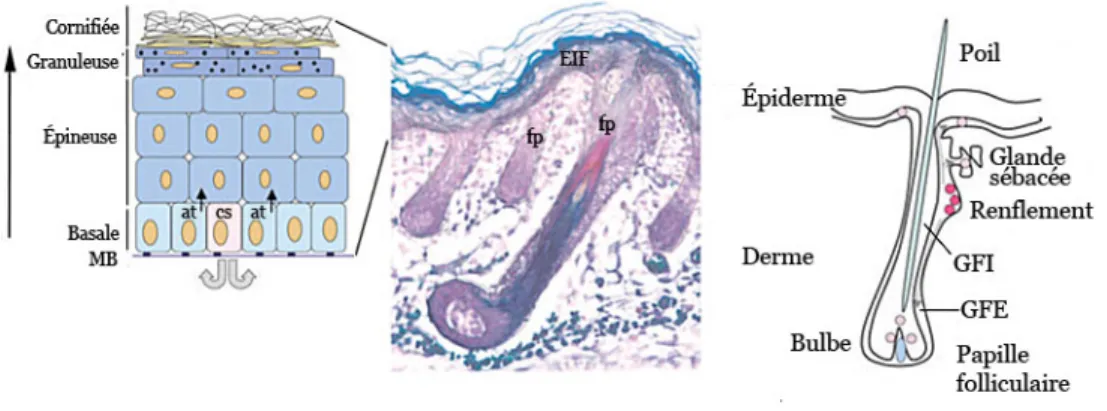
Les cellules souches épidermiques se trouvent principalement dans la couche basale de l’épiderme dans la peau interfolliculaire (Mackenzie et Bickenbach, 1985; Brouard et Barrandon, 2003), et dans le renflement folliculaire de la peau pileuse (Figure 1-3) (Cotsarelis et al., 1990). Ces cellules souches se divisent pour donner une cellule souche et une cellule amplificatrice transitoire (Lajtha, 1979; Lavker et Sun, 2000). Les cellules souches épidermiques entrent rarement en mitose, mais les cellules amplificatrices transitoires qui résultent de ces divisions se multiplient rapidement (Cotsarelis et al., 1990). En théorie, une cellule souche aurait la capacité de produire l’équivalent d’un épiderme adulte complet (Rochat et al., 1994). Dans la peau, les cellules amplificatrices (kératinocytes) se divisent encore un nombre limité de fois avant de se différencier et de monter vers la superficie de la peau. Les estimés de la fréquence de ces cellules souches varient de 10% des cellules basales à 0,01% (Schneider et al., 2003). Chaque cellule souche (interfolliculaire) serait la fondation d’une unité de prolifération épidermique, constituée d’environ 10 cellules basales, dont une cellule souche, et les cellules verticalement adjacentes générées par la division de ces cellules basales (Potten, 1975; 1981; Ghazizadeh et Taichman, 2001). Il est possible que des unités de prolifération plus grandes puissent dépendre de certaines cellules souches basales, mais la relation n’est pas encore bien définie (Ghazizadeh et Taichman, 2001). En général, les cellules souches sont responsables de la régénération de l’épiderme à leur proximité, mais des études ont montré que les cellules souches des follicules pileux peuvent également régénérer l’épiderme lors d’une blessure (Lavker et Sun, 2000; Taylor et al., 2000). Ces cellules souches multipotentes folliculaires sont capables de répondre aux signaux morphogénétiques en formant de l’épiderme, des follicules pileux et même des glandes sébacées (Oshima et al., 2001).
Figure 1-3 Localisation des cellules souches dans l’épiderme et le follicule pileux. À gauche, les couches de la peau stratifiée interfolliculaire, où les cellules souches (cs) se trouvent dans la couche basale adjacente à la membrane basale (MB). Les cellules souches produisent des cellules amplificatrices transitoires (at), qui se différencieront pour former les couches supérieures. Au milieu, une coupe histologique de peau de souris, colorée pour montrer les différentes parties du follicule pileux (fp). À droite, un dessin du follicule pileux montrant les cellules souches (en rouge), localisées dans la région du renflement. Ces cellules migrent par la suite pour peupler les régions du bulbe folliculaire, de la glande sébacée et de l’épiderme interfolliculaire (EIF). GFI – gaine folliculaire interne; GFE – gaine folliculaire externe. Figure adaptée de Morasso et Tomic-Canic (2005).
Les caractéristiques de la cellule souche épidermique ont été dévoilées au fur à mesure des recherches réalisées, souvent en utilisant la peau murine. Jusqu’à maintenant, il n’y a pas de marqueur spécifique qui soit unique aux cellules souches épidermiques; il y a plutôt une combinaison d’expression de plusieurs facteurs qui les distinguent des cellules amplificatrices et des cellules différenciées. Entre autres, ces cellules souches épidermiques humaines expriment la kératine 19 (Michel et al., 1996), ont une forte présence de la sous-unité intégrine β1 (Jones et al., 1995) et une adhérence accrue au collagène de type IV (Bickenbach et Chism, 1998), et sont positives pour l’intégrine α6 et négatives pour le CD71 (α6bri CD71dim) (Li et al., 1998; Tani et al., 2000). Une étude montra une sous-population de cellules épithéliales exprimant à la fois la kératine 15 et la kératine 19 dans le renflement des follicules pileux, ainsi que dans la peau interfolliculaire, qui serait importante dans le maintien de l’auto-renouvellement de la peau (Pontiggia et al., 2009).
1.1.1.4 Cellules souches mésenchymateuses et leur différenciation
On retrouve des cellules souches mésenchymateuses dans plusieurs tissus dont le plus connu est la moelle osseuse. Ces cellules seraient responsables de la production des tissus mésenchymateux - os, cartilage, muscle, tendon, ligament, et tissus adipeux, conjonctif et de la moelle - en réponse aux blessures et pour assurer l'homéostasie (Figure 1-4) (Caplan, 1994).
Figure 1-4 Types cellulaires produits par les cellules souches mésenchymateuses. Les cellules souches mésenchymateuses s’auto-renouvellent, et peuvent se différencier en tous les types cellulaires du squelette et du tissu conjonctif. Figure tirée de Frenette et al. (2013).
Les premières observations permettant de soupçonner l’existence de cellules souches non-hématopoïétiques dans la moelle osseuse furent celles du pathologiste allemand J. Cohnheim (1867). Il a utilisé l’injection d’un colorant insoluble dans les veines d’animaux afin d’étudier la guérison des blessures. Il a conclu que la plupart des cellules colorées, tant inflammatoires que fibroblastiques, qui se trouvaient dans la plaie en guérison étaient venues du sang, et par extension, de la moelle osseuse. Le travail d’Alexander Friedenstein et ses collègues dans les années 1960 et 1970 a mis en évidence la présence dans la moelle
osseuse d'une population de cellules progénitrices distinctes des cellules souches hématopoïétiques (Friedenstein, 1961; Friedenstein et al., 1968; 1976). Ces cellules, quiescentes in vivo, entraient dans le cycle cellulaire in vitro lors d'une stimulation adéquate et formaient des colonies ressemblant à des dépôts d'os ou de cartilage. Des expériences de greffe de morceaux de moelle osseuse chez la souris ont démontré que ces cellules étaient ostéogéniques et formaient du nouveau tissu osseux, et que les cellules hématopoïétiques qui l’ont colonisé par la suite ne provenaient pas du tissu greffé (Friedenstein et Kurolesova, 1971). Le même groupe de chercheurs a développé la méthode encore employée aujourd'hui pour isoler les cellules fibroblastiques de la moelle osseuse, en les sélectionnant par leur adhérence au plastique. Cette technique est utilisée en culture cellulaire puisque la plupart des cellules hématopoïétiques n’y adhèrent pas (Friedenstein et al., 1970).
Au fil des années, ces cellules ont reçu plusieurs dénominations, de CFU-F (acronyme de la terminologie anglaise pour fibroblast colony-forming units, unités de fibroblastes formant des colonies) et fibroblastes stromaux de la moelle (Kuznetsov et al., 1997) à cellules souches progénitrices (Conget et Minguell, 2000) et cellules souches mésenchymateuses (CSM, connues en anglais comme mesenchymal stem cells - MSC) (Caplan, 1994). Tous ces termes s'appliquent à des cellules d'une morphologie fibroblastique, dérivées du mésoderme (un des trois feuillets embryonnaires primaires, duquel se développent le squelette et les tissus conjonctifs (Carlson, 2014)). Une définition minimale décrit les CSM comme des cellules mononucléaires adhérentes au plastique qui peuvent se propager en culture, qui expriment les molécules CD73, CD90 et CD105 mais pas les CD34, CD45, ou CMH-DR, ni les marqueurs des monocytes ou des cellules B (CD14, CD33, CD3, CD19, entre autres), et qui ont le potentiel de se différencier en au moins les trois types cellulaires principaux du mésenchyme (Figure 1-4) (Pittenger et al., 1999; Dominici et al., 2006; Bourin et al., 2013): ostéocytes (Owen et al., 1987; Grigoriadis et al., 1988; Caplan, 1991; Haynesworth et al., 1992), chondrocytes (Johnstone et al., 1998; Majumdar et al., 2000), et adipocytes (Dennis et Caplan, 1996; Pittenger et al., 1996). D’autres études ont montré leur différenciation en ténocytes (Caplan et al., 1993) et en myotubes (Galmiche et al., 1993; Wakitani et al., 1995), et leur fonction comme stroma de soutien hématopoïétique (Dexter
effet, la plupart des techniques de culture cellulaire utilisées produisent des populations hétérogènes parmi lesquelles il est très difficile de distinguer la cellule souche 'véritable' des cellules précurseures plus ou moins déterminées vers les divers types cellulaires particuliers (Friedenstein et al., 1982; Kuznetsov et al., 1997; Phinney et al., 1999; Muraglia et al., 2000).
1.1.1.5 Cellules souches mésenchymateuses et fonction immunitaire
Il devient de plus en plus évident que les cellules souches mésenchymateuses jouissent d’un statut immunoprivilégié, et qu’elles exercent également des fonctions immunosuppressives dans le contexte de la greffe allogénique. L’hypothèse actuelle est que la régénération tissulaire lors d’une greffe de CSM a lieu non pas majoritairement par le remplacement des cellules endommagées, sinon à travers la production de facteurs de croissance et de signaux anti-inflammatoires par les CSM, ce qui stimule le processus de régénération (Caplan et Correa, 2011; Girdlestone et al., 2015). Il a été montré in vitro que les CSM suppriment de façon active la fonction ou la différenciation des monocytes, des cellules dendritiques, et des lymphocytes B, T et NK, par plusieurs moyens y compris le contact entre cellules et la sécrétion de divers facteurs solubles (Bartholomew et al., 2002; Di Nicola et al., 2002; Krampera et al., 2003; Aggarwal et Pittenger, 2005; Beyth et al., 2005; Glennie et al., 2005; Jiang et al., 2005; Corcione et al., 2006; Nauta et al., 2006; Spaggiari et al., 2006). Le sécrétome est devenu un aspect très important dans la recherche sur les cellules et leurs interactions; c’est l’ensemble des protéines sécrétées par une cellule, qui modifient non seulement le comportement de la cellule elle-même et des cellules avoisinantes, mais aussi celui des organes situés ailleurs dans le corps (Zullo et al., 2015). Beaucoup de ces protéines sont sécrétées sous forme de microvésicules et d’exosomes (Mathivanan et al., 2010; Mukherjee et Mani, 2013). Le sécrétome des cellules et des tissus est très spécifique, et peut être modifé en fonction des fluctuations dans l’état physiologique du corps. Ce sont ces facteurs qui interagissent avec d’autres cellules pour produire leurs effets immunomodulatoires, ainsi que l’activité paracrine qui stimule la réparation tissulaire (revu dans Lavoie et Rosu-Myles, 2013). Ces influences sur le microenvironnement qui le rendent plus propice à la régénération semblent être beaucoup plus importantes que l’incorporation des cellules souches ou différenciées greffées dans les modèles selon les
études entreprises à ce jour (De Miguel et al., 2012; van Koppen et al., 2012; Yi et Song, 2012; Lavoie et Rosu-Myles, 2013; Konala et al., 2016).
Il est généralement accepté que les CSM expriment les complexes d’histocompatibilité majeurs de classe I (CMH-A, -B, -C) mais non pas ceux de classe II tel le CMH-DR (Reyes et al., 2001; Jiang et al., 2002; Dominici et al., 2006; Suzdal'tseva et al., 2007). Les complexes d’histocompatibilité majeurs atypiques (CMH-E, CMH-F, CMH-G) ont été impliqués dans l’induction de la tolérance des lymphocytes NK envers les cellules de soi, ainsi qu’envers le fétus (Rouas-Freiss et al., 1997; Fanchin et Ayoubi, 2009). En particulier, l’expression de CMH-G par les CSM de la moelle osseuse supprime la fonction des lymphocytes T et NK, et induit certaines cellules T régulatrices (Selmani et al., 2008). En plus, les CSM n’expriment pas les molécules de surface CD80, CD86, CD40 et CD154 (CD40L) (Bartholomew et al., 2002; Dean et Bishop, 2003; Le Blanc et al., 2003). Les CD80, 86 et 40 sont des molécules co-stimulatrices qui activent les lymphocytes T allogéniques, et le CD40L stimule les lymphocytes B, menant à la sécrétion d’interleukines et de cytokines qui déclenchent une réponse immunitaire (Rothstein et Sayegh, 2003). L’absence de ces molécules évite cette activation, et confère un statut immunoprivilégié aux CSM.
En ce qui concerne les cellules de la moelle osseuse et du tissu adipeux, l’âge du donneur aurait des conséquences sur les propriétés immunomodulatoires des cellules greffées, et la différenciation des cellules au préalable augmenterait leur immunogénicité (Kuo et al., 2006; Caplan, 2009). Les cellules souches issues des tissus extra-embryonnaires sont préservées de cette complication des dommages accumulés au fil des années.
1.1.2 Sources de cellules souches
1.1.2.1 Tissus embryonnaires
Les cellules souches embryonnaires (abondamment connues dans les publications anglophones sous l’acronyme « ES cells » pour embryonic stem cells) proviennent de la masse cellulaire interne de l’embryon précoce. Ces cellules peuvent proliférer pendant un temps très prolongé in vitro sans perdre leurs qualités de cellules souches pluripotentes;
c’est-à-dire, qu’elles peuvent se différencier en tous les types cellulaires somatiques du corps (Figure 1-5) (Doss et al., 2004). Elles ont été isolées pour la première fois en 1981 chez la souris (Evans et Kaufman, 1981; Martin, 1981), et par la suite chez les rongeurs, les lapins, les porcs et les humains (revu dans Doss et al., 2004). Des conditions particulières sont nécessaires pour les maintenir dans un état non différencié: tout dépendant de l’espèce en question, il faut les cultiver en présence du facteur inhibiteur de la leucémie (LIF, acronyme de la terminologie anglaise pour Leukocyte Inhibiting Factor), ou bien les cultiver sur une couche nourricière de fibroblastes embryonnaires non-réplicatifs (Williams et al., 1988). Cette dernière condition est requise par les cellules souches embryonnaires humaines (Thomson et al., 1998). Une fois en culture, ces cellules peuvent être induites à se différencier en divers types cellulaires selon les facteurs ajoutés au milieu de culture.
Figure 1-5 Les voies de différenciation des cellules souches embryonnaires. Les cellules de la masse cellulaire interne (ICM), mises en culture avec du LIF, forment des sphères caractéristiques, et peuvent se différencier en types cellulaires dérivés des trois feuillets embryonnaires primaires. Figure tirée de Doss et al. (2004).
Il y a plusieurs problématiques inhérentes à l’utilisation des cellules souches embryonnaires en génie tissulaire. Tout d’abord, il y a les questions d’ordre éthique concernant l’utilisation des embryons pour des fins de recherche ou de thérapie. Ces inquiétudes touchent également l’emploi des oocytes énucléés pour recevoir des noyaux somatiques afin de produire des cellules différenciées qui seraient presque identiques génétiquement au receveur de la greffe. Au niveau technique, les protocoles de différenciation courants donnent comme résultat des populations de types cellulaires mixtes qui doivent être séparés avant leur utilisation, car l’implantation de cellules non différenciées mène à la formation de tératomes chez le receveur (Thomson et al., 1995; 1998). Les cellules différenciées risquent d’être rejetées par l’hôte qui les reçoit. Il faut donc soit maintenir un état d’immunosuppression chez l’hôte, soit modifier les cellules à greffer de telle façon qu’elles ne suscitent pas le rejet par le système immunitaire (Bongso et Richards, 2004; Cheng et al., 2014).
1.1.2.2 Tissus gestationnels (structures extra-embryonnaires)
D’autres tissus gestationnels servent comme source de cellules souches, y compris le placenta, l’amnion, le liquide amniotique, le cordon ombilical et le sang de celui-ci (Figure 1-6). Des cellules isolées du placenta ont été différenciées en ostéoblastes, en adipocytes et en cellules neuronales en culture (Yen et al., 2008). Des cellules épithéliales de l’amnion ont été induites à se différencier en cellules neuronales (Elwan et Sakuragawa, 1997; Kakishita et al., 2000; Miki et al., 2005; Ilancheran et al., 2007), hépatocytes, cellules pancréatiques, et cardiomyocytes, ostéocytes, adipocytes, et myocytes, sans être tumorigènes (Miki et al., 2005; Ilancheran et al., 2007). Quant au sang du cordon ombilical, il sert depuis longtemps comme source de cellules souches hématopoïétiques pour les greffes allogéniques, avec les premiers essais publiés par les frères Ende (1972), et la première greffe réussie en 1988 (Gluckman et al., 1989; Watt et Contreras, 2005). L'avantage de cette source réside d'abord dans l'accessibilité; la collecte de sang a lieu à la naissance de façon non invasive, et le sang peut être conservé pendant des années dans une banque de sang, avec le code CMH déjà déterminé pour une greffe ultérieure. Pour qu’une greffe de cellules souches hématopoïétiques réussisse, il faut que l’histocompatibilité entre le donneur et le receveur soit la plus élevée possible; c’est à dire que les codes CMH du
donneur et du receveur soient le plus semblables possible afin d’éviter l’attaque des tissus du receveur par les cellules greffées (la maladie du greffon contre l’hôte, connu en anglais comme « graft versus host disease » – GvHD). Il semblerait que les taux de réussite des greffes de sang de cordon moins parfaitement appariées sont semblables ou supérieurs à ceux des greffes de moelle osseuse appariées (Locatelli et al., 1999; Rocha et al., 2000; Laughlin et al., 2004). La reconstitution de la moelle osseuse par les cellules de sang de cordon est en général plus lente car la quantité de cellules souches disponibles d’un seul cordon est moins grande que celle obtenue par ponction de la moelle osseuse (Rocha et Gluckman, 2009).
Figure 1-6 Les tissus gestationnels. Les tissus gestationnels, qui comprennent entre autres le placenta, la membrane et le liquide amniotiques, le cordon ombilical et son sang, sont des sources de cellules souches multipotentes. Figure tirée de Ilancheran et al. (2009).
1.1.2.3 Le cordon ombilical
Le cordon ombilical est d’abord une structure foetale d'origine allantoïque qui sert de conduit pour le transport de l'oxygène, des nutriments et des déchets entre l'embryon ou le foetus et le placenta, et donc la circulation sanguine maternelle. Physiquement le cordon ressemble à un tube blanc tordu, plus ou moins translucide et d'une longueur moyenne de 35 à 50 cm à la naissance. Sa structure est simple, comprenant deux artères et une veine
enveloppées dans un tissu conjonctif mucoïde, et recouverte d'un épithélium mince à l'extérieur (Figure 1-7). Les vaisseaux du cordon ombilical, tout comme les veines et artères pulmonaires du côté droit du cœur, font exception à la norme anatomique selon laquelle le sang oxygéné se trouve dans les artères et le sang appauvri en oxygène dans les veines. Ici, les artères apportent le sang désoxygéné et les déchets foetaux au côté foetal du placenta, où un échange d'éléments solubles avec la circulation maternelle a lieu. Le sang maintenant oxygéné et plein de nutriments retourne à la circulation foetale via la veine ombilicale (Padykula, 1988; Moore, 1989).
Figure 1-7 La structure du cordon ombilical humain. A gauche, une section transversale du cordon ombilical qui montre les principales structures, y compris les artères et la veine entourées de la gelée de Wharton. A droite, une coloration au trichrome de Masson montre les différentes parties du tissu solide qui sont ciblées lors de l’extraction des cellules.
1.1.2.3.1 L'épithélium
L'épithélium du cordon ombilical est composé d'une mince couche de cellules épithéliales attachées à la membrane basilaire sous-jacente. C’est la seule partie du cordon ombilical à entrer en contact avec le liquide amniotique, donc l’épithélium sert de barrière entre les tissus internes et le liquide du sac amniotique. Souvent il n'y a qu'une seule épaisseur cellulaire, quoique des régions jusqu'à cinq cellules en épaisseur peuvent être trouvées. L'épithélium du cordon est contigu avec l'épithélium amniotique, d'où il est dérivé lors du développement précoce, ainsi qu’avec le périderme embryonnaire et, ensuite, l'épithélium foetal (Hoyes, 1969). Il y a pourtant des différences structurales entre ces épithélia à la fin
de la période de gestation (Mizoguchi et al., 2000). La morphologie de l'épithélium du cordon ombilical ressemble beaucoup à celle de l'épiderme foetal précoce avant sa kératinisation. Ce processus-ci n'a pas lieu dans l'épithélium du cordon ombilical à l'exception de la région adjacente au foetus (Schramm, 1962), la majorité de cet épithélium étant simple et squameux, en contraste à l'épithélium amniotique cuboïde (Bourne, 1962). On a suggéré que l'épithélium du cordon serait impliqué dans la production des composants du liquide amniotique durant la première étape de grossesse (Hoyes, 1969). En culture, les cellules épithéliales du cordon ombilical ont un comportement et des besoins semblables à ceux des kératinocytes de la peau (Ruetze et al., 2008).
1.1.2.3.2 La gelée de Wharton
Le tissu conjonctif du cordon ombilical, décrit par Thomas Wharton pour la première fois en 1656 et appelé la gelée de Wharton, est un tissu mucoïde lâche composé surtout de fibres de collagène entrelacées, de glycosaminoglycanes (GAG) – surtout l'acide hyaluronique (Schoenberg et Moore, 1958; Schoenberg et al., 1960) – et d'un réseau de microfibrilles glycoprotéiques (Meyer et al., 1983). Ce tissu entoure et protège les vaisseaux sanguins du cordon contre la compression et la torsion qui pourraient avoir lieu dans l'utérus avec les mouvements du bébé (Figure 1-7) (Chasnoff et Fletcher, 1977). Il a été difficile de donner une classification exacte aux cellules qui peuplent la gelée de Wharton, étant donné leurs caractéristiques inhabituelles. Tout comme les fibroblastes qui produisent la matrice extracellulaire des tissus conjonctifs du corps, les cellules stromales du cordon ombilical possèdent en abondance des granules de sécrétion de collagène, des appareils de Golgi, et des mitochondries. Par contre, leurs noyaux échancrés, leurs filaments contractiles, leurs vésicules pinocytotiques et leurs jonctions de type fibronexus (ou adhésions focales matures) sont des éléments typiques des cellules musculaires lisses. Les cellules de la gelée de Wharton contiennent également de l’α-actine de muscle lisse, de la vimentine, de la desmine et de la myosine non musculaire (Kasper et al., 1988; Takechi et al., 1993; Eyden et al., 1994), et donc sont semblables aux myofibroblastes quant à leur fonctionnalité (Nanaev et al., 1997; Kobayashi et al., 1998; Farias et al., 2011). Les premières observations publiées de ces cellules les identifiaient comme des cellules musculaires lisses (Chacko et Reynolds, 1954), mais Parry (1970) suggéra qu’il s’agît
plutôt de fibroblastes d’une morphologie distincte, qui ressemblaient à des cellules musculaires lisses. Takechi et al. (1993) ainsi que Farias et al. (2011) conclurent que les cellules étaient des fibroblastes modifiés qui pourraient participer à la régulation du flux sanguin du cordon ombilical grâce à leur contractilité, tandis que Eyden et al. (1994) proposèrent qu’elles seraient dérivées des péricytes ou cellules musculaires lisses. Ces cellules produisent activement les éléments de la matrice extracellulaire qui les entoure, et qui est essentielle pour protéger les vaisseaux sanguins contre la compression extérieure, grâce à la turgescence que cette matrice maintient (Schoenberg et Moore, 1958; Takechi et al., 1993; Nanaev et al., 1997).
Aujourd’hui la recherche se concentre surtout sur les propriétés de cellules souches mésenchymateuses caractérisant au moins une sous-population de ces cellules, et les applications qui en découlent. Le premier rapport de la différenciation des cellules stromales du cordon ombilical humain fut un brevet de Purchio et al. (1999) qui décrivait la formation de cartilage par ces cellules. Depuis 2002, plusieurs groupes de recherche ont commencé à publier les résultats d'expériences effectuées avec les cellules du tissu solide du cordon ombilical, tant humain qu'animal. Des études chez le porc (Mitchell et al., 2003) et avec des cellules humaines (Fu et al., 2004; 2006) ont démontré la capacité des cellules de la gelée de Wharton à former des cellules de type neuronal suite à une stimulation adéquate. Des ostéocytes, des adipocytes et des cardiomyocytes ont été également obtenus par la culture appropriée des cellules de la gelée de Wharton humaine (Wang et al., 2004). En utilisant des cellules isolées de l’adventice du cordon ombilical, désignées en tant que cellules périvasculaires, l’équipe du Dr Davies a montré la différenciation en ostéoblastes de ces cellules (Sarugaser et al., 2005; 2009) ainsi que leur différenciation en adipocytes, myocytes et chondrocytes (Sarugaser et al., 2009). Des cellules isolées de la couche subendothéliale de la veine ombilicale se sont différenciées en ostéocytes et en adipocytes (Covas et al., 2003; Romanov et al., 2003). Plus récemment, la différenciation des cellules stromales en cellules exhibant des caractéristiques hépatocytaires a été mise en évidence (Campard et al., 2008; Zhang et al., 2009; Zhao et al., 2009). Du côté de la reconstruction tissulaire, un mélange de cellules du tissu solide du cordon ombilical (veine, artères et gelée de Wharton) a servi à reconstruire des artères pulmonaires faites par génie tissulaire sur un
Tout comme les cellules souches de la moelle osseuse et autres tissus (voir les sections 1.1.1.5 et 1.1.2.4), les cellules stromales de la gelée de Wharton montrent des caractéristiques immunomodulatoires et la production d’un sécrétome qui promeut la régénération des tissus lésés, et leur utilisation comme adjuvant dans des essais cliniques ne cesse de croître (Prasanna et Jahnavi, 2011; Watson et al., 2015; ClinicalTrials.com, 2016). En particulier, les cellules du cordon ombilical n’expriment pas les CMH de type II même sous la stimulation par l’IFN, au contraire des cellules de la moelle osseuse, et elles auraient la capacité d’inhiber la prolifération des cellules cancéreuses (revu dans Ding et al., 2015). Elles semblent aussi supprimer la prolifération des lymphocytes d’une façon plus robuste que les CSM de moelle osseuse, tant in vitro comme dans des expériences de greffe chez les animaux (revu dans Prasanna et Jahnavi, 2011).
1.1.2.3.3 La média
Une média composée de cellules musculaires lisses entoure chacun des vaisseaux ombilicaux (Figure 1-7). La fonction primaire de ces cellules est la contraction nécessaire pour le mouvement du sang, mais elles sont aussi capables de produire de la matrice extracellulaire, et de proliférer au besoin (Schwartz et al., 1986; Owens, 1995). Les cellules musculaires lisses peuvent faire la transition entre ces deux phénotypes d’une façon réversible (Chamley-Campbell et al., 1979; Majesky et al., 2011). Les protéines contractiles les plus importantes dans ces cellules sont l’α-actine de muscle lisse et la myosine; on y trouve aussi la ß-actine non musculaire, la actine non musculaire et la γ-actine de muscle lisse (Kabsch et Vandekerckhove, 1992). Des variantes de la chaîne lourde de la myosine de muscle lisse et non musculaire sont présentes dans les cellules, ainsi que des isoformes de la chaîne légère. D’autres molécules typiquement trouvées comprennent la calponine, la vinculine, la caldesmone, la tropomyosine, et les filaments intermédiaires vimentine et desmine (Tang, 2008). La régulation précise de la contraction cellulaire s’effectue à travers des canaux ioniques et des récepteurs membranaires (Owens, 1995). Les cellules musculaires lisses extraites du cordon ombilical sont abondamment employées dans la recherche sur le métabolisme et les caractéristiques des cellules musculaires lisses, ainsi que dans la reconstruction tissulaire (L'Heureux et al., 1993;
Owens, 1995; L'Heureux et al., 1998; Sodian et al., 2006; Stephan et al., 2006; Gauvin et al., 2011; Bourget et al., 2013); revu dans (Weber et al., 2011; Auger et al., 2013).
1.1.2.3.4 L'endothélium
La surface luminale des vaisseaux sanguins du cordon ombilical est tapissée d’une couche de cellules endothéliales qui ont de multiples fonctions dans le corps humain. Entre autres, elles sont responsables du maintien d’une surface non thrombogénique dans les lumières des vaisseaux sanguins, de la régulation de la coagulation et de la fibrinolyse, des fonctions immunologiques, du contrôle de la vasomotricité, de la régulation de la perfusion et la perméabilité à travers les parois des vaisseaux, ainsi que de la libération des agents chimiques et la réponse aux facteurs solubles. Plusieurs sentiers biosynthétiques sont spécifiques à l’endothélium, tels la synthèse du NO, du facteur von Willebrand, de la prostacycline, de l’endothéline-1, et de la thromboxane A2 (revu dans Hayoz et Silacci, 2006). Les propriétés des cellules endothéliales du cordon ombilical (et d’autres sources) ont été examinées depuis longtemps, surtout dans l’étude de l’angiogenèse et son contrôle par la pharmacologie (Jaffe et al., 1973b; Gimbrone et al., 1974; Cozzolino et al., 1990; Black et al., 1998; Bachetti et Morbidelli, 2000; Guo et al., 2000; Fassina et al., 2004; Tremblay et al., 2005a), ainsi que dans la reconstruction de tissus vascularisés, vaisseaux sanguins et autres (Black et al., 1999; Schechner et al., 2003; Gibot et al., 2010; Guillemette et al., 2010; Rochon et al., 2010; Tsigkou et al., 2010; revu dans Hendrickx et al., 2011). Les cellules endothéliales de la veine ombilicale en particulier sont souvent employées dans les modèles de recherche, en partie dû à la facilité de leur obtention. Dans les publications scientifiques, elles sont souvent appelées des ‘HUVEC’, pour ‘human umbilical vein endothelial cells’. Ces cellules ont une morphologie caractéristique de pavés ronds en culture en monocouche, et tendent à former des tubules lorsque soumises aux stimuli appropriés et ensemencées dans des gels en trois dimensions, tel le Matrigel™ (Kubota et al., 1988), et dans des éponges de collagène (Black et al., 1998).
1.1.2.4 Tissus adultes
Chez l’adulte humain, plusieurs organes et tissus ont leurs réservoirs de cellules souches spécifiques. Outre les cellules souches de la moelle osseuse et de l’épiderme que nous avons déjà citées, les muscles, le système nerveux, l’épithélium intestinal, le foie, le sein, la prostate, les poumons, le pancréas, les ovaires, et le derme ont tous leurs populations de cellules souches (Church et al., 1966; Lewis, 1968; Cheng et Leblond, 1974; Alison et Sarraf, 1998; Stingl et al., 1998; Collins et al., 2001; Giangreco et al., 2002; Li et al., 2007; Szotek et al., 2008; Biernaskie et al., 2009).
De plus en plus, les chercheurs trouvent que des populations de cellules souches chez les tissus adultes sont plus polyvalentes que soupçonnées, se prêtant à la différenciation en types cellulaires autres que ceux de leurs tissus d’origine (Brazelton et al., 2000; Mezey et al., 2000), et même en types cellulaires d’une couche embryonnaire distincte (Kopen et al., 1999; Pittenger et al., 1999; Sato et al., 2005). Il est maintenant reconnu que des cellules progénitrices multipotentes se trouvent dans la plupart des tissus adultes (da Silva Meirelles et al., 2006). Les noms attribués à ces cellules sont variés, y compris cellules souches mésenchymateuses, cellules progénitrices multipotentes adultes, et cellules précurseurs dérivées de la peau, selon leur provenance et leurs caractéristiques démontrées. Elles ont été isolées du derme, du tissu adipeux, des tendons, des poumons, et du tissu stromal vasculaire (Toma et al., 2001; Zuk et al., 2001; Salingcarnboriboon et al., 2003; Sabatini et al., 2005; Yang et al., 2013). Plusieurs études indiquent que le compartiment périvasculaire serait un réservoir de cellules souches mésenchymateuses ou multipotentes, et que les caractéristiques spécifiques de chaque population de péricytes seraient déterminées par le tissu de résidence (Doherty et al., 1998; Bianco et al., 2001; Shi et Gronthos, 2003; Farrington-Rock et al., 2004; Dellavalle et al., 2007; Crisan et al., 2008; da Silva Meirelles et al., 2008).
1.1.2.5 Cellules reprogrammées
Il arrive dans certains cas que les cellules d’un patient sont atteintes par une pathologie et ne peuvent être ainsi employées pour une thérapie cellulaire. Il faut alors avoir recours à des sources alternatives de cellules, qui auraient besoin de modifications pour être aptes à l’utilisation voulue. Des cellules déjà différenciées peuvent parfois être menées à se dédifférencier ou à moduler leur état de différenciation vers celui d’un autre type cellulaire. Il y a plusieurs approches possibles: des cellules matures peuvent être induites en cellules pluripotentes (en anglais, « induced pluripotent stem cell », ou iPS; Figure 1-8), et par la suite différenciées dans un autre type cellulaire que celui d’origine, ou bien des cellules différenciées converties directement à un autre type cellulaire sans passer par une étape de dédifférenciation (reprogrammation directe, ou transdifférenciation).
Figure 1-8 La production de cellules pluripotentes induites. Ce schéma montre plusieurs stratégies employées pour la génération de cellules pluripotentes à partir de cellules somatiques ou de cellules germinales. Ces cellules pluripotentes induites peuvent par la suite se différencier en types cellulaires propres des trois feuillets embryonnaires. ES – embryonic stem; GS – germline stem. Figure tirée de Yamanaka et al. (2007).
Le transfert du noyau d’une cellule somatique dans un oocyte énucléé est à la base du clonage (Briggs et King, 1952; Wilmut et al., 1997; Gurdon et Byrne, 2003), mais le développement de l’embryon est difficilement achevé sans problèmes, et le processus est très inefficace (Gurdon et Byrne, 2003; Yamanaka, 2007). Chez les cellules somatiques adultes, l’état pluripotent a initialement été généré par la transduction rétrovirale des gènes de certains facteurs de transcription (Oct4, Sox2, Klf4, et c-Myc), tel que montré chez les fibroblastes murins et humains (Figure 1-8) (Takahashi et Yamanaka, 2006; Takahashi et al., 2007). La transduction lentivirale et adénovirale, ainsi que la transfection par plasmides, sont autant de façons d’introduire l’expression des gènes de ces facteurs de transcription (Brambrink et al., 2008; Okita et al., 2008; Stadtfeld et al., 2008). La transduction adénovirale et la transfection par plasmides sont temporaires et alors moins problématiques en ce qui concerne les mutations provoquées par leur insertion dans le génome, mais ces méthodes sont moins efficaces dans la reprogrammation que la transduction rétrovirale.
Une stratégie qui vise à complètement enlever les éléments introduits est celle des transposons piggyBac (Woltjen et al., 2009), où les transposons peuvent être enlevés une fois que l’état de pluripotence est établi de façon stable. Au lieu des gènes, les protéines mêmes, avec l’addition d’un peptide de pénétration, peuvent s’intégrer au noyau des cellules à partir du milieu de culture pour initier la transformation en cellules souches pluripotentes (Kim et al., 2009 (humain); Zhou et al., 2009 (souris)). Cette approche pour l’instant est moins efficace, mais évite les problèmes associés à l’ADN exogène. Finalement, des publications plus récentes ont montré que l’exposition des cellules cibles à des extraits d’oocytes mitotiques augmente l’efficacité des stratégies de dédifférenciation (Sylvestre et al., 2010 (mammifères); Ganier et al., 2011; Rathbone et al., 2013 (Xenopus)).
Théoriquement, les cellules pluripotentes obtenues par ces méthodes pourraient se différencier en n’importe lequel des types cellulaires du corps, et seraient une source polyvalente de types cellulaires spécifiques pour le génie tissulaire et la médecine régénératrice. Mais étant donné qu’aucune de ces stratégies n’est efficace à cent pourcent, une diversité de cellules reprogrammées en résulte qui doit être triée avant que les cellules
vraiment pluripotentes ne puissent être utilisées pour la génération de types cellulaires différenciés (Chan et al., 2009). De plus, tel que mentionné dans le cas des cellules souches embryonnaires, le risque de formation de tératomes par les cellules qui ne se différencient pas après un traitement d’induction n’est pas à négliger.
La stratégie de reprogrammation directe évite ces désavantages, car elle ne requiert pas une étape intermédiaire de dédifférenciation mais modifie un phénotype différencié à un autre, donnant ainsi un type cellulaire adulte. Le changement direct de type cellulaire fut montré lorsque l’équipe de Davis et al. a converti des fibroblastes en myocytes par la transfection du cADN d’un facteur défini, le MYOD1 (1987). Par la suite, des fibroblastes furent convertis en cardiomyocytes, neurones, chondrocytes et hépatocytes, et même des cellules hématopoiétiques (Ieda et al., 2010; Vierbuchen et al., 2010; Hiramatsu et al., 2011; Huang et al., 2011b; revu dans Takahashi, 2012). Dans une étude, des cellules épithéliales thymiques, qui sont d’origine endodermique, furent mises en culture et ensuite utilisées pour des greffes de follicules pileux, où elles ont contribué au renouvellement des follicules et même de l’épiderme (Bonfanti et al., 2010).
Cela dit, avec toutes les techniques il faut éviter de greffer des cellules qui ne sont que partiellement reprogrammées, car leurs propriétés sont inconnues et pourraient être très différentes de celles du type cellulaire ciblé. Aussi, très peu est connu de la mémoire épigénétique des cellules reprogrammées, y compris la possibilité et l’incidence de réversion qui pourrait avoir lieu (Kim et al., 2011a; Ohi et al., 2011; revu dans Takahashi, 2012).
1.1.3 La peau humaine en tant que source de cellules et modèle de la différenciation épithéliale
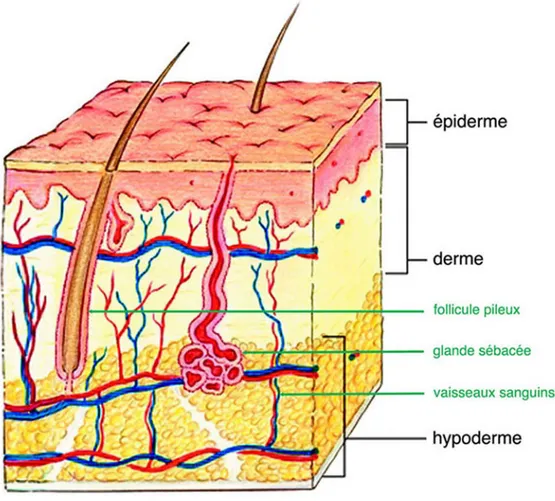
La peau est un organe complexe qui remplit plusieurs fonctions essentielles, telles que le contrôle de la température corporelle et de la perte d’eau, la synthèse de la vitamine D, l’exclusion des pathogènes, et la protection contre les blessures. Plusieurs récepteurs du toucher, de la température, et de la douleur se situent dans la peau, qui a également des fonctions immunologiques et excrétoires. La peau se renouvelle constamment, grâce aux cellules souches épithéliales qui remplacent les cellules perdues à la surface de l'épithélium par la desquamation (Holbrook et Wolff, 1987; Odland, 1991; Turksen et Troy, 1998).
Figure 1-9 La structure globale de la peau. Ce dessin de la peau et de l’hypoderme sous-jacent montre également la localisation des vaisseaux sanguins, des follicules pileux et des glandes sébacées. Figure modifiée de Farage et al. (2013).
La peau est un tissu idéal pour l'étude de la différenciation épithéliale, la régénération, la guérison et des cellules souches parce qu'elle est hautement différenciée et que le