Université d’Aix-Marseille Faculté de Pharmacie 27 Bd Jean Moulin – CS 30064 – 13385 Marseille
cedex 5 – France
Tél : +33 (0)4 91 83 55 00 – Fax : +33 (0)4 91 80 26 12
THESE
PRESENTEE ET PUBLIQUEMENT SOUTENUE DEVANT LA FACULTE DE PHARMACIE DE MARSEILLE
Le 5 Novembre 2019 Par
Mr LEROY Romain Né le 05/06/1989 à TOULOUSE
EN VUE D’OBTENIR
LE DIPLÔME D’ETAT DE DOCTEUR EN PHARMACIE
TITRE :
LA CURCUMINE : PROVENANCE ET POTENTIELS
THERAPEUTIQUES
JURY :
Président : Professeur Evelyne OLLIVIER Directeur de Thèse : Professeur Béatrice BAGHDIKIAN Membre : Professeur Paul MARIANI
« L’Université n’entend donner aucune approbation, ni
improbation aux opinions émises dans les thèses. Ces
opinions doivent être considérées comme propres à leurs
auteurs. »
Remerciements
Je remercie ma directrice de thèse le Docteur Baghdikian Béatrice pour m’avoir accepté à ses côtés afin de superviser l’élaboration de ma thèse malgré un planning chargé. Pour son temps et sa patience je lui suis reconnaissant.
Je remercie tous les membres du jury pour leur présence et leur point de vue sur mon travail.
Je remercie également toute l’équipe de la scolarité qui a toujours été là pour me diriger dans cette pyramide administrative. Leur gentillesse à mon égard tout au long de ma scolarité restera gravée.
Remerciements également à tous les enseignants de cette faculté qui m’ont permis d’acquérir toutes ces connaissances et ce savoir durant mon parcours.
Je dédie cette thèse à ma famille :
Pour m’avoir soutenue aussi bien financièrement que moralement tout au long de ces études. A Paul Mariani, pour sa présence malgré une période difficile, pour sa gentillesse et ses conseils avisés. A toi papa, qui a su être patient pour la finition de mes études. A toi maman, pour m’avoir toujours fait confiance dans mes choix (et pour la correction de cette dernière !). A mon frère, complice de toujours avec qui je partage des moments heureux même si parfois difficiles. A Alexandra que j’aime et qui est présente quoi qu’il arrive.
Table des matières
Liste des abréviations………..1
INTRODUCTION………2 I.
La curcumine
A.
Généralités………..…………..………3B.
Sources………..………5 1. Végétale………5 a) Historique………..5 b) Description……….………6 c) Classification……….…..8 d) Forme pulvérulente……….9 e) Extraction………11f) Isolement et quantification de la curcumine………13
2. Synthèse………..15
a) Biosynthèse de la curcumine………..15
b) Synthèse chimique de la curcumine………..16
(1) Méthode de Pabon………16
(2) Méthode de Pavolini……….18
C.
Propriétés physico-chimiques………181. Tautomérie……….…18
2. Biodisponibilité………20
D.
Les différentes formulations de curcumine……….221. Curcuma Base………..22 2. Curcumine-Pipérine………23 3. Curcumine-Huile essentielles……….24 4. Curcumine-Phospholipides……….24 5. Curcumine-Cyclodextrines………24 6. Curcumine-Fibres végétales………25 7. Les nano-curcumines……….25
II.
Potentiels Thérapeutiques
………..30A.
Curcumine et Oxydation/Inflammation………..301. Physiopathologie……….………….30
2. Les mécanismes anti-oxydants de la curcumine……….……..33
3. Les mécanismes anti-inflammatoires de la curcumine……….…..35
4. Domaines d’utilisation de la curcumine………39
5. Etude de cas de diabète in vivo……….………..….43
6. Etude de cas in vivo : l’artériosclérose………..……….48
B.
Curcumine et Cancer………55 1. Physiopathologie………..55 a) Le MDR……….56 b) La PgP………...57 c) MRP1………..60 d) NFκ-B………..612. Etude de cas in vitro : le cancer de la Prostate………62
C.
Curcumine et Maladies neuro-dégénératives………..691. Maladie d’Alzheimer………..69
a) Physiopathologie………70
b) Mécanismes d’action de la curcumine………..…………..72
2. Maladie de Parkinson………74
3. Autres pathologies………..75
III. CONCLUSION
………..771
ADN : Acide desoxyribonucléique NOS : NO Synthase
ARN : Acide ribonucléique MA : Maladie d’Alzheimer
B2O3 : trioxyde de bore MP : Maladie de Parkinson
GRAS : Generally recognized As Safe DCS : Diketide-CoA Synthases
FDA : Food and Drug Administration PLGA :Acide polylactique-coglycolique FAO : Food and Agriculture Organisation GSH : Glutathion
BMC : Bisdemethoxycurcumine AHH : Arylhydrocarbone hydroxylase
DMC : Demethoxycurcumine GPx : Glutathion peroxydase
MAO : Monoamine Oxydase
IMAO : Inhibiteur de la monoamine oxydase Sirt1 : Sirtuine 1
HFD : High Fat Diet Cu : Curcumine
PAL : phénylalanine ammonium-lyase HCT : l’hydroxycinnamoyl transferase C3H : cinnamate-3-hydroxylase C4H : la cinnamate-4-hydroxylase OMT : O-methyltransferase
4CL : 4-coumarate :CoA ligase DCS : Diketide-CoA Synthases CURS : Curcumine Synthases ROS : Espèce Réactive a l’Oxygène COX : Cyclo-oxygénase
PPAR : poly(ADP-ribose)polymérase
HPLC : Chromatographie Liquide Haute Performance NO : Monoxyde d’azote
2
Introduction
La curcumine provient du curcuma qui est une épice sacrée en
Inde où elle a toujours occupé une place importante dans la
tradition sociale, culinaire et médicinale. Le curcuma constitue
en effet l’une des principales composantes de la médecine
traditionnelle indienne, la médecine ayurvédique, qui est
probablement la plus vieille tradition médicinale de
l’humanité. Le curcuma fait partie des quelques 250 plantes
médicinales mentionnées dans une série de traités médicaux
datant d’environ 3 000 ans avant notre ère.
En Europe, où il fut introduit par les Romains au moment de la
conquête des Gaules, on appréciait le curcuma surtout pour sa
couleur. Les Grecs l’utilisaient pour teindre leurs vêtements,
tandis que les teinturiers du Moyen Âge s’en servaient pour
obtenir un très beau vert en le mélangeant à l’indigo.
Ces dernières années, les nombreuses recherches effectuées
en laboratoire ont montré l’intérêt de cette plante dans divers
domaines. Les études expérimentales se sont intensifiées à tel
point que sur plus de 1 500 articles référencés dans la base de
données de Medline, près de 900 articles ont été publiés depuis
2002 : le curcuma commence à livrer ses secrets et ses
multiples mécanismes d’action sont de plus en plus précis. Sur
la base de ces nouvelles acquisitions, des études cliniques de
phase I et II ont vu le jour, en particulier dans le domaine de la
cancérologie.
Cette thèse fera le point sur l’actualité des propriétés du
curcuma et de ses indications dans la prévention et le
traitement des maladies du XXIe siècle en médecine
occidentale.
3
I.
La Curcumine
A. Généralités
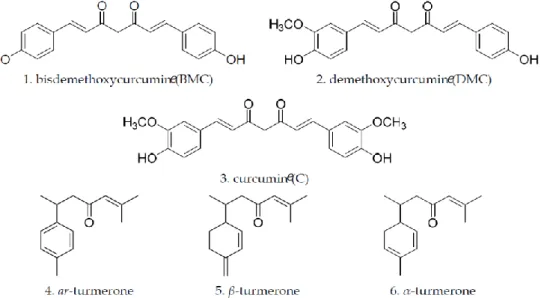
La curcumine fait partie d’un groupe moléculaire contenu dans le curcuma appelé « curcuminoïdes ».
L’isolement de la « matière colorante jaune » des rhizomes de curcuma décrit dans l’essai « Examen chimique de la racine de Curcuma » et publié dans le Journal de Pharmacie et Sciences Accessoires en 1815 par Vogel et Pelletier a permis sa découverte.
Sa structure chimique a été identifiée en 1910 par Lampe et Milobedzka.
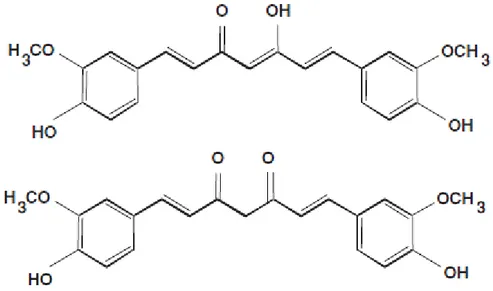
Figure 1 : Structures chimiques de la curcumine (enol et ceto)
Son nom chimique est (1E,6E)-1,7-bis(4-hydroxy-3-méthoxyphényl)-1,6-heptadiène-3,5-dione.
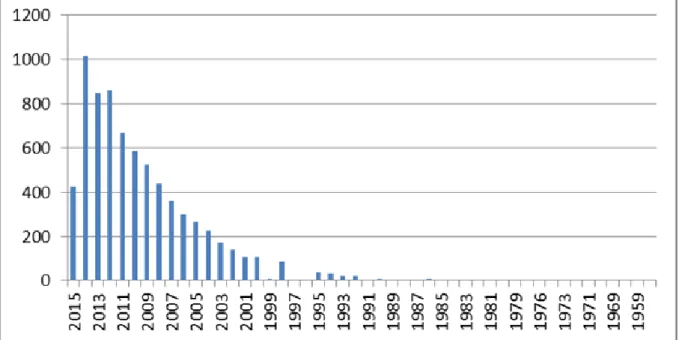
C’est à partir des années 70 que la curcumine anime la curiosité de la communauté scientifique et industrielle. Une multitude de recherches et de publications au 21ème siècle démontre les effets thérapeutiques de cette
4
Figure 2 : Schéma illustrant le nombre de publications sur la curcumine dans la base de données de Pubmed
Elle a été reconnue « GRAS » (Generally recognized As Safe) par la Food
5
B. Sources
1. Source Végétale
a) Historique
Le curcuma est la source naturelle la plus importante en curcumine. Le nom de genre « Curcuma » provient de la latinisation de l’arabe « al-kurkum » signifiant « jaune » et se référant à l’origine au safran.
Au XVIIIe siècle, le curcuma, sous son nom Terra merita (1)ou safran des
Indes, est importé en Europe par les grandes puissances navales
(Hollande, Royaume-Uni, Portugal et France). Son nom anglais « Tumeric » provient du latin Terra merita qui désignait la racine. Il est utilisé aussi bien pour ses propriétés tinctoriales (2) que médicinales (3).
Curcuma longa L. est l’espèce la plus utilisée et la plus étudiée de nos
jours. Les curcumas sont surtout connus pour les épices obtenues à partir du rhizome de quelques espèces du genre. Les autres espèces produisent des épices plus amères.
Le genre Curcuma L. comprend de 40 à 110 espèces selon les sources, originellement répandues dans les régions d’Asie tropicale et d’Australie septentrionale, aux précipitations très saisonnières. On observe la plus grande diversité dans le genre en Inde, en Birmanie et en Thaïlande, beaucoup moins en Chine, en Australie et dans le Pacifique Sud. Sa distribution est exclusivement intertropicale.
Ce Curcuma fait partie des ingrédients de la poudre de curry, à laquelle il confère sa couleur caractéristique. Il est cultivé en Inde, puis au Bangladesh, en Chine, en Thaïlande, au Cambodge, en Malaisie, en Indonésie et aux Philippines. L’Inde est à l’origine de 80 % de la production mondiale, et est le principal producteur et exportateur.
Bien que la curcumine soit issue de plusieurs genres comme Curcuma
xanthorrhiza, Curcuma Phaeocaulis mais aussi Curcuma zedoaria, le Curcuma longa reste la source la plus importante en curcuminoïdes que
6
b) Description
Le genre Curcuma fait partie de la famille des Zingibéracées dont le gingembre est le plus connu. Il compte quelque quarante espèces de vivaces à tubercules ou à rhizomes.
Le Curcuma longa est une plante herbacée rhizomateuse vivace ce qui signifie qu’elle peut vivre plusieurs années en subsistant l'hiver sous forme d'organes spécialisés souterrains protégés du froid et chargés en réserve.
Figure 3 : Photo de Plans de Curcuma longa
Le Rhizome
Le Curcuma longa possède de nombreux rhizomes (voir figure 2,3) dont un principal mesurant environ 5 cm x 2,5 cm et présentant à maturité de nombreux rhizomes latéraux aromatiques, cylindriques ou ellipsoïdes, de couleur gris-jaune à l’extérieur et orange sombre à l’intérieur.
7
La Feuille
Les feuilles sont généralement larges (7 à 25 cm) et longues (jusqu’à 50 cm) et sont uniformément vertes. Elles sont réparties sur deux rangées et sont alternées. Ses épis peuvent mesurer jusqu’à 20 cm et les fleurs sont stériles (voir figure 5).
Figure 5 : Partie haute de Curcuma longa avec fleur
La Fleur
Le genre Curcuma possède une multitude de fleurs se regroupant en inflorescences coniques (voir figure 5) sous forme d’épis et sont protégées par de grandes bractées. Elles sont verdâtres ou blanches avec un sommet rose et longues de 6 cm environ. Elles sont bisexuées, zygomorphes et tubulaires. L’androcée est composé d’une seule étamine fertile et aux staminodes. Quant au gynécée, il est tri-carpellé. Après fertilisation, le fruit prendra la forme d’une capsule globuleuse.
8
Exception faite du Curcuma longa qui est une plante stérile et qui se dissémine par division de son rhizome.
Pour le cultiver, il faudra éviter le soleil direct qui risque de brûler les feuilles mais aussi éviter les sols gorgés d’eau. Il est plus particulièrement adapté aux régions soumises à la mousson et aux forêts de feuillus (arbres avec des feuilles très développées).
c) Classification
Le sous-règne de cette plante est Trachéophyte signifiant qu’elle est pourvue de vaisseaux conducteurs. La super division est Spermatophyte car c’est une plante se reproduisant par l'intermédiaire de fleurs et de graines. Le terme Magnoliophytes (ou Angiospermes) signifie que c’est une plante à fleurs et donc qui porte des fruits.
9
d) Forme pulvérulente
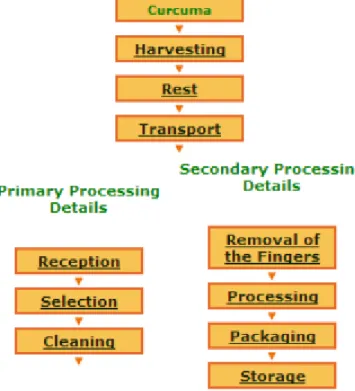
La fabrication de poudre de curcuma nécessite un procédé international défini par la « Food and Agriculture Organisation of United Nations » (FAO) pour lui permettre d’être exportée et utilisée industriellement.
Figure 7 : Processus international selon la FAO
Les rhizomes fraîchement récoltés sont nettoyés. Ensuite, on les fait bouillir une heure environ jusqu’à ce qu’ils soient mous pour permettre aux matières étrangères comme la terre d’être éliminées et à l’amidon d’être gélifié pour obtenir un séchage uniforme.
Après un premier séchage rapide, les rhizomes sont découpés grossièrement puis séchés plus longuement (15 jours) dans des tubes ventilés d’air chaud à 60°C et à l’abri de la lumière, la curcumine étant photosensible.
Pour enlever la couche externe du rhizome (écailles et radicelles), une érosion de sa surface est effectuée par des tambours rotatifs composés de maillages métalliques.
10
Enfin, le broyage et tamisage de ces morceaux de rhizomes permet l’obtention de la poudre de curcuma.
Figure 8 : Curcuma sous forme de poudre (droite) et de rhizome traité (gauche)
A cette étape, rhizomes traités et poudre sont commercialement exploitables pour l’utilisation culinaire.
Par contre, des analyses supplémentaires, qualitatives sur l’absence de matières étrangères et quantitatives sur la teneur en curcuminoïdes sont nécessaires pour le domaine thérapeutique (4).
11
e) Extraction
C’est le rhizome du curcuma fraichement récolté et nettoyé qui est utilisé. Il est coupé en morceaux assez fins puis séché pendant une semaine au soleil et soumis à un séchage avancé dans une étuve à 50°C pendant 5 à 6 heures.
Ensuite, les morceaux sont recoupés et mis en présence de solvants à température ambiante et à l’abri de la lumière pour l’extraction. C’est une extraction type solide-liquide à chaud. Le solvant le plus souvent utilisé est l’éthanol, moins coûteux que l’acétone recommandé par la Pharmacopée Européenne. Le filtrat, obtenu sur filtre papier sera ensuite évaporé sous pression réduite.
La qualité de l’extrait est évaluée par HPLC qui mesure sa teneur en curcumine.
Pour augmenter le rendement, on utilise Le Soxhlet, appareil qui permet de réaliser plusieurs cycles consécutifs d’extraction.
12
Le curcuma en poudre est placé dans une cartouche de papier au-dessus d’un ballon chauffé contenant le solvant. Ce dernier s’évapore, monte dans la chambre d’extraction et solubilise les curcuminoïdes. Cette chambre se remplit de solvant jusqu’à la vidange. Le mélange solvant-curcuminoïdes tombe dans le ballon. Seul le solvant est évaporé et les curcuminoïdes restent dans le ballon. L’excédent de solvant est condensé par un réfrigérant.
Ce cycle se reproduit plusieurs fois pour augmenter le rendement de l’extraction.
13
f) Isolement et quantification de la curcumine
Après obtention du mélange de curcuminoïdes par l’extraction selon la méthode du Sohxlet, la curcumine est isolée par chromatographie sur colonne de gel de silice.
Figure 11 : Mélange de curcuminoïdes après extraction de Curcuma longa
Les mélanges d’éluants (phase mobile) utilisés sont soit le dichlorométhane / acide acétique soit le méthanol / chloroforme (5). On obtient trois différentes fractions : la curcumine, puis la déméthoxy-curcumine et la bis-déméthoxy-déméthoxy-curcumine.
Pour obtenir un niveau de pureté supérieur, la fraction de curcumine peut être à nouveau soumise à une chromatographie sur colonne avec mélange chloroforme/acide acétique.
La détection et l’estimation de la quantité de curcumine pure obtenue se fait essentiellement par chromatographie liquide à haute performance (HPLC).
Pour cela, des colonnes C18 (sont utilisées comme phase stationnaire (apolaire). Des solvants polaires de différents gradients (contenant acétonitrile / eau) sont utilisés comme phase mobile (6).
C’est sur les plages de 350 à 450 nm et de 250 à 270 nm dans la région UV que l’on détecte les curcuminoïdes.
e e
14
Voici les résultats obtenus.
Figure 12 : Chromatogrammes HPLC de la solution d’étalons mélangés (A1: 430 nm, A2: 240 nm) et d’un échantillon de curcuma (B1: 430 nm, B2: 240 nm). Les pics ont été numérotés de la même manière que ceux de la figure 11
La BMC, la DMC puis la curcumine ont des temps de rétention compris entre 10 et 20 minutes.
L’aire des pics chromatographiques est proportionnelle à la concentration de produits analysés.
15
2. Synthèse
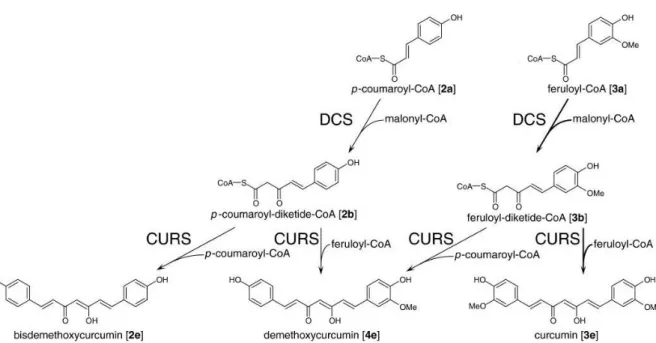
a) Biosynthèse de la curcumine
La biosynthèse de la curcumine est une synthèse composée de multiples étapes.
Figure 13 : Etape préliminaire de la biosynthèse des curcuminoïdes
A → Les premiers substrats cinnamoyl-CoA (1a), p-coumaroyl-CoA (2a) et feruloyl-CoA (3a) sont synthétisés à partir de la phénylalanine grâce à l’activité de la phénylalanine ammonium-lyase (PAL), de la 4-coumarate : CoA ligase (4CL) puis de la cinnamate-4-hydroxylase (C4H) et pour finir de l’action de l’hydroxycinnamoyl transferase (HCT), cinnamate-3-hydroxylase (C3H) et O-methyltransferase (OMT).
16
Puis les Diketide-CoA Synthases (DCS) permettent de fusionner le malonyl-Coa avec 2a et 3a pour obtenir le p-coumaroyl-diketide-Coa (2b) et feruloyl-diketide-CoA (3b). Et pour finir, les Curcumine Synthases (CURS) condensent une nouvelle molécule de 2a ou 3a pour obtenir le produit final. Ici, on utilise 2 feruloyl-CoA pour obtenir la curcumine (3e).
b) Synthèse chimique
(1) Methode 1 : Synthèse par Pabon (1964)
Pabon a synthétisé de la curcumine en utilisant de l’acétylacétone et des aldéhydes aromatiques substitués en présence de trioxyde de bore
(B2O3).
Figure 15 : Schéma général de la méthode Pabon
Plus en détail :
La première étape est la réaction de 2,4-dicétones avec des aldéhydes aromatiques substitués. Pour empêcher la participation des dicétones aux condensations de Knoevenagel, le dicétone est complexé avec du bore. Des amines primaires et secondaires sont utilisées comme catalyseurs pour fournir la basicité nécessaire à la déprotonation des groupes alkyle du dicétone.
17
Pour éliminer l’eau produite lors de la réaction de condensation, des capteurs d’eau tels que les borates d’alkyle sont employés. L'eau non éliminée peut réagir avec le complexe dicétone, réduisant ainsi le rendement en curcumine. Le complexe borique se dissocie en curcumine dans des conditions légèrement acides (ajout de HCl). De ce mélange réactionnel, la curcumine est séparée par cycles répétés de lavage et précipitation, puis isolée sur colonne chromatographique de gel de silice.
18
(2) Méthode 2 : Synthèse « one step » de Pavolini (1950)
Cette synthèse se fait en une seule étape. Elle a un rendement de 10% pour un temps de réaction de 30 minutes seulement. Pavolini utilise un équivalent d’acétylacétone avec deux équivalents de vanilline, le tout en présence du trioxyde de bore (B2O3).
Figure 17 : Schéma de synthèse de curcumine selon Pavolini
C. Propriétés physico-chimiques
La structure de la curcumine évolue en fonction de l’environnement chimique dans lequel elle se trouve (solvant, température, lumière).
Sa complexité lui confère une multitude d’interactions moléculaires d’où un grand nombre de cibles au niveau de l’organisme.
Pour étudier la pharmacocinétique et la pharmacodynamie de la curcumine, il est nécessaire d’en connaître ses propriétés physicochimiques.
1. Tautomérie
La curcumine possède des extrémités polaires reliées à un centre polaire par deux branches insaturées apolaires. C’est une molécule amphiphile. Celle-ci peut accepter et donner des liaisons hydrogène. Cette propriété provient du centre β-dicarbonyl, des deux noyaux phényles des extrémités et aussi des deux groupements méthoxy.
Son coefficient de partage élevé et sa libre rotation autour de liaisons carbone en font une molécule très réactive.
19
La β-dicétone de la curcumine se présente sous les formes énol et ceto qui sont codominantes en fonction des solvants présents.
Figure 18 : Forme céto-énolique de la curcumine
Figure 19 : Structures céto-énoliques de la curcumine en fonction des types de solvant
Dans un solvant apolaire, le tautomère enol est fermé par un H. Ce proton énolique H avec l’oxygène du carbonyle ne favorisent pas les liaisons H. Dans un solvant polaire, la création de liaisons H est favorisée et donc la forme énol ouverte est prédominante.
Dans l’organisme humain, la forme ouverte du tautomère énolique sera prédominante en raison de la présence de l’eau du plasma et des acides aminés polaires des protéines. Ceci explique le grand potentiel d’interactions de la curcumine dans le corps humain.
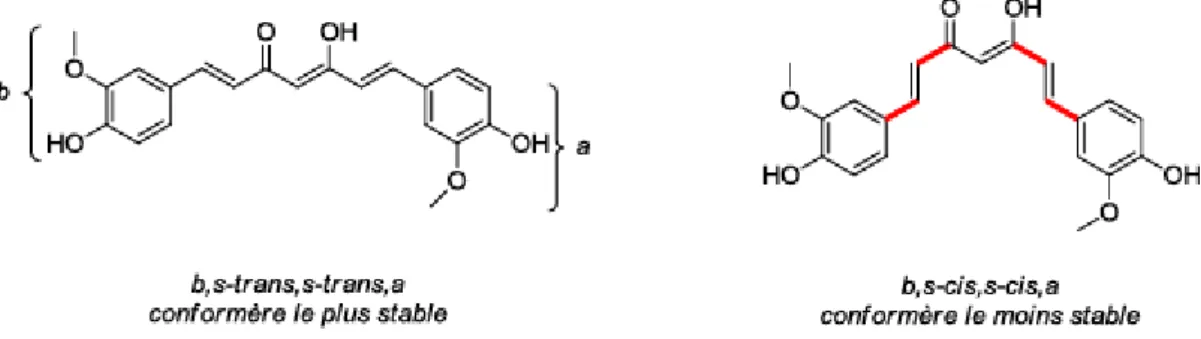
D’autre part, la curcumine est capable de modifier sa structure spatiale pour agir le plus efficacement sur son site d’action. Elle s’adapte à la configuration spatiale de la protéine sur laquelle elle se fixe grâce à ses trois doubles liaisons : on parle de conformère.
20
De plus, les groupements moléculaires de la curcumine font de celle-ci, un accepteur de Michael.
Figure 21 : Schéma de la Réaction de Michael
R et R’ : groupements électro-attracteur sur nucléophile (attiré par les charges positives) → donneur de Michael
R’’ : groupement « accepteur de Michael » B : base
La curcumine va pouvoir interagir avec des cibles « donneur de Michael » possédant des groupements amines, thiols ou thiolates.
2. La biodisponibilité
La valeur de son log P assez élevée fait que la curcumine est un composé pratiquement insoluble dans l’eau. Ce qui a pour conséquence que sa chaîne centrale peut interagir avec des aminoacides hydrophobes dans des sites actifs de protéines. Le deuxième avantage de cette lipophilie est la capacité de la curcumine à interagir avec les biomembranes.
Toutes ces propriétés font que cette molécule peut réagir avec un grand nombre de cibles au sein de l’organisme. Cependant la curcumine possède une faible biodisponibilité.
21
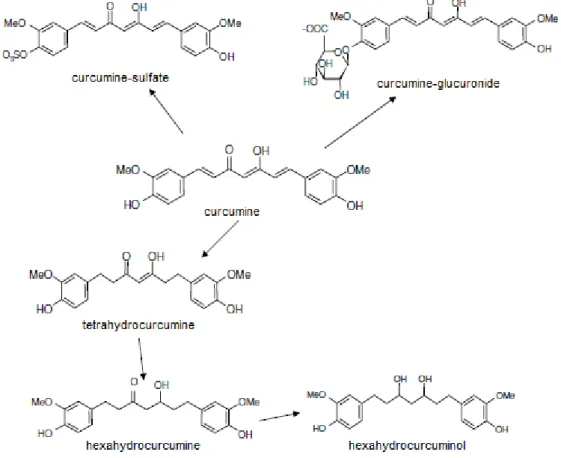
Elle est métabolisée en différents composés qui seront moins actifs voire inactifs. (fig 22)
22
D. Les différentes formulations de curcumine
Plusieurs formulations de curcumine existent sur le marché avec des biodisponibilités différentes :
Figure 23 : Absorption des différentes formes de curcumine par l’organisme
Sources :
- Shoba Gl, Joy D, Joseph T, Majeed M, Rajendran R, Srinivas P.S. Influence of Piperine one the Pharmacokinetics of Curcumin in Animals and Human Volunteers. Planta Med 1998 May;64(4):353-6
- Antony B, Merina B, Iyer V.S, Judy N, Lennertz K, Joyal S. A Pilot Cross-Over Study to Evaluate Human Oral Bioavailability of BCM-95CG (Biocurcumax), A Novel Bioenhanced Preparation of Curcumin. Indian J Pharm Sci 2008 Jul-Aug;70(‘):445
- Schiborr C, Kocher A, Behnam D, Jandasek J, Toelstede S, Frank J. The Oral Bioavailability of Curcumin From Micronized Powder and Liquid Micelles is Significantlu Increased in Healthy Humans and Differs Betweew Sexes. Mol Nutr Food Res 2014 Mar,58(“):516-27
- Cuomo J, Appendino G, Dern A.S, Schneider E, McKinnon T.P, Brown M.J, Togni S, Dixon B.M. Comparative Absorption of a Standardized Curcuminoid Mixture and its Lecithin Formulation. J Nat Prod 2011 Apr 25;74(4):664-9
- Dinesh kumar et al. Enhanced Bioavailability and Relative Distribution of Free (Unconjugated) Curcuminoids Following the Oral Administration of a Food-Grade Fromulation with Fenugreek Dietary Fibre: A randomised Double-Blind Crossover Study. Journal of Functional Foods 22 (2016): 578-587
1. Curcuma base
La curcumine administrée sans aucune modification ou couplage se voit très vite dégradée. En effet, lorsqu’elle est absorbée seule par voie orale, on la retrouve à près de 75% dans les selles. Lorsqu’elle est administrée par voie intraveineuse, près de 50% de la dose est excrétée dans la bile en moins de 5 heures. Par contre, la sécrétion urinaire reste très faible dans les deux cas (moins de 0.1% de la dose).
0 20 40 60 80 100 120 140 160 180 200 Abs orpt ion (U A)
23
2. Curcuma piperine
Figure 24 : Structure de la curcumine et de la pipérine
De par sa forte ressemblance structurale, la pipérine possède des propriétés communes avec la curcumine :
- Activité antioxydante - Activité antitumorale - Activité antipyrétique
La pipérine inhibe aussi la dégradation de médicaments et de produits naturels comme la curcumine dans un grand nombre de voies métaboliques via les enzymes :
- L’arylhydrocarbone hydroxylase (AHH)
- L’uridine diphosphate- (UDP-) glucuronyl transferase - L’ethylmorphine-N-demethylase
- La 7-Ethoxycoumarine-O-deethylase
- La 3-Hydroxy-benzo(a)pyrene glucuronidase - L’UDP-glucose déshydrogénase (UDP-GDH) - La 5-lipoxygenase
- La Cyclooxygenase-1 - Le Cytochrome P450
L’inhibition de ces enzymes par la pipérine permet l’augmentation de la concentration en curcumine active. L’administration concomitante de pipérine et curcumine augmente la biodisponibilité de cette dernière de 20 fois.
24
Par ailleurs, la pipérine augmente la perméabilité intestinale de par son activité pro-inflammatoire sur la muqueuse intestinale. Cela permet une meilleure absorption de la curcumine mais aussi d’endotoxines, de polluants, de protéines non-digérées (gluten) et d’autres substances toxiques. C’est la porte ouverte aux intolérances alimentaires et aux maladies auto-immunes.
3. Curcuma huile essentielle
La lipophilie de l’huile essentielle de curcumine augmente sa biodisponibilité de 7 fois. Il faut néanmoins des dosages élevés en curcumine (au moins 300mg) pour avoir une efficacité. La formulation Biocurcumax ® à base d’huile essentielle est sans danger pour l’organisme.
4. Curcumine + phospholipides
Vu que la curcumine est liposoluble, son association avec des phospholipides améliore son absorption par l’organisme. Sa biodisponibilité est multipliée par 19.
Ces phospholipides sont généralement des lécithines de soja ou de colza potentiellement allergisantes. La formulation Meriva ® en gélules contient 20% de curcuminoïdes pour 40% de lécithines et 40% de cellulose microcristalline.
5. Curcumine + cyclodextrines
La cyclodextrine est un agent hydrophile qui encapsule la curcumine et agit comme une coque de protection, lui conférant une bonne compatibilité dans les milieux aqueux. Elle est obtenue à partir de l’amidon de pomme de terre ou de maïs. La formulation Cavacurmin ® en est une qui permet une absorption 40 fois supérieure à la curcumine classique.
25
6. Curcumine + fibres végétales
Les fibres de fenugrec, solubles dans l’eau, contrebalancent le penchant hydrophobique de la curcumine. La formulation CurQfen ® présente deux intêrets :
- Une libération prolongée de curcuminoïdes grâce à la formation d’un gel dans le colon
- Une biodispinibilité de curcumine augmentée de 16 fois Tout ceci avec une totale innocuité.
7. Les « nanocurcumines »
L’étude faite par Yin-Meng Tsai et ses collaborateurs a optimisé la nano-formulation de la curcumine avec de l’acide polylactique-co-glycolique (PLGA) pour prolonger son temps de rétention dans l'organisme et améliorer sa biodisponibilité. L'évaporation d’un solvant émulsifiant à haute pression a été utilisée pour obtenir ces nanoparticules PLGA chargées en curcumine (NPCs).
Figure 26 : Evolution des Tailles des nanoparticules à différentes températures
26
Ces nanoparticules sont très fragiles et se conservent à 4°C pour garder leurs propriétés.
Chez le rat, après absorption orale de curcumine simple et de NPCs, on observe une augmentation significative de la concentration sanguine en curcumine. Le calcul de la biodisponibilité est de 0.21% pour la curcumine normale et de 4.71% pour la nano formulation soit 22 fois supérieure. (cf fig 27)
Figure 27 : Courbe de concentrations intraveineuses de curcumine après administration orale
La curcumine sous forme de nanoparticules est moins excrétée dans les selles que la curcumine en poudre (fig 28).
27
Figure 28 : Pourcentage de curcumine excrétée dans les selles
Par contre elle est excrétée de façon très faible dans les urines quelle que soit sa forme.
28
De cette étude, on peut en déduire que l'absorption de la curcumine est plus importante sous forme de nanoparticules.
Selon une étude menée sur 23 personnes avec de la curcumine couplée à du polysorbate 80, émulsifiant de synthèse (E433), l’absorption des NPCs est multipliée de 185 fois par rapport à la forme classique. Le polysorbate est controversé car soupçonné de toxicité pour les intestins à partir d’une certaine dose.
La formulation NovaSOL ®, gélules faiblement dosées en curmine (25 mg pour 500mg au total) soit près de 94% de polysorbate, est déconseillée sur de longues durées lors de Maladies Inflammatoires Chroniques de l’Intestin (MICI).
La formulation Theracurmin ® est une curcumine mélangée à de la glycérine et de la gomme végétale. Sa biodisponibilité n’est augmentée que de 27 fois pour une totale innocuité sur la santé. Certains laboratoires rajoutent du dioxyde de silicium (E551) pour son effet antiagglomérant nanoparticulaire, ce qui entraine une production de radicaux libres qui peuvent altérer l’ADN et causer des dommages aux tissus.
29
30
II.
Potentiels thérapeutiques
A. Curcumine et Oxydation/Inflammation
1.
Physiopathologie de l’inflammation
Il y a près de 50 ans, Denham Harman (7) a suggéré que les radicaux libres produits par la respiration aérobie causaient des dommages cumulatifs liés à l'oxygène, entraînant le vieillissement et la mort cellulaire.
L'oxygène est une molécule essentielle pour tous les organismes aérobies. Bien qu’il soit indispensable à toutes les cellules pour la production d'énergie chimique (ATP), il est aussi transformé en formes très réactives : espèces réactives de l'oxygène (ROS), qui sont toxiques pour les cellules (7,8). Environ 2% de l'oxygène réduit par les mitochondries forme du superoxyde (O2-) ou du peroxyde d’hydrogène
H2O2. Ces derniers interagissent avec les ions métalliques (réactions de
Heiber-Weiss et de Fenton) pour induire la génération de radicaux hydroxyles supplémentaires qui peuvent léser tous les composants de la cellule, y compris la membrane lipidique, l'ADN et les protéines (8).
L'oxyde nitrique (NO) est une espèce à radicaux libres (avec un électron libre). C’est une molécule lipophile à courte durée de vie produite à partir de la L-arginine par la NO synthase (NOS). Le NO est impliqué physiologiquement dans la signalisation intracellulaire, la vasorelaxation, la neurotransmission, l'inhibition de l'agrégation plaquettaire et la défense immunitaire.
Le NO réagit avec O2- pour former du peroxynitrite (ONOO-), qui est un
puissant oxydant.
La bioactivité du NO est liée à la production de nombreux intermédiaires réactifs dont certaines espèces réactives azotées (RNS) qui endommagent l'ADN ou entravent sa réparation (9).
Le stress oxydatif résulte d’un excès d’oxydation et est responsable de graves dysfonctionnements métaboliques, enzymatiques et génomiques de la cellule allant jusqu’à la perte de son intégrité. Il est à l’origine de la pathogénèse de nombreuses maladies humaines : inflammations, arthrites, athérosclérose, ischémies, maladies neurodégénératives (Parkinson, Alzheimer), cancers.
31
La nature a doté les organismes vivants d’un répertoire impressionnant de complexes antioxydants pour neutraliser l’oxydation, enzymes et petites molécules. Ces dernières sont principalement retrouvées dans les fruits et légumes.
Les mécanismes antioxydants sont complexes et agissent de concert pour diminuer la charge des ROS en les détournant vers des voies de réaction qui forment des produits moins réactifs.
Lorsque ces mécanismes sont dépassés, il existe des molécules sacrificielles (GSH, thiols) qui agissent comme un "tampon" réplicable ou recyclable pour absorber les impacts oxydatifs et l'énergie excédentaire (10).
Les défenses antioxydantes comprennent les éléments suivants :
- La superoxyde dismutase (SOD), qui accélère la dismutation de O.
2
-en H2O2,
- Les piégeurs de radicaux hydrophiles tels que l'ascorbate, l'urate et le glutathion (GSH)
- La catalase (CAT) et la glutathion peroxydase (GPx) qui convertissent le H2O2 en eau
GPx
2 GSH + H2O2 ---> GS–SG + 2 H2O
- Les piégeurs de radicaux lipophiles tels que les tocophérols, les flavonoïdes, les caroténoïdes et l'ubiquinol.
- Les enzymes impliquées dans la réduction de la forme oxydée des antioxydants de petites molécules (GSH réductase et ascorbate réductase) ou responsables de la teneur en thiols protéiques (thioredoxine réductase).
32
• Oxydation des thiols :
L'oxydant utilisé peut être O2, X2, H2SO4 …
Dans certains cas,
GR
GS–SG + NADPH + H+ ---> 2 GSH + NADP+
Le taux des protéines thiols est sans aucun doute un des marqueurs les plus pertinents de stress oxydatif.
Ces protéines thiols qui possèdent un atome de soufre, jouent un rôle « tampon » dans le sang. Lors de stress oxydatif important en intensité ou en durée, les thiols rétablissent la balance d’oxydo-réduction (redox) en éliminant des radicaux libres. Ils s’oxydent, sont éliminés et leur taux diminue.
33
Figure 31 : Schéma illustrant les mécanismes des ROS
2. Les mécanismes antioxydants de la curcumine :
La peroxydation des lipides est une réaction en chaîne à médiation radicalaire, conduisant à la destruction des membranes cellulaires.
Figure 32 : Schéma général de la peroxydation lipidique
La curcumine est connue pour protéger les biomembranes contre les dommages oxydants. Elle inhibe la peroxydation en éliminant les radicaux libres réactifs (11).
Elle est un antioxydant unique car elle possède :
- Deux groupes fonctionnels phénoliques contenant diverses quantités de substituants hydroxyle et méthoxy
34
- Des doubles liaisons carbone-carbone
A la différence de la plupart des antioxydants qui n’ont qu’un seul groupe fonctionnel phénolique ou un seul β-dicétone.
Une question concernant son activité antioxydante était de savoir si elle était due à l'hydrogène phénolique ou à l'hydrogène méthylénique central dans sa fraction heptadiénone.
Les recherches de Jovanovic et ses collaborateurs ont montré que la curcumine donne l'atome H du groupe méthylénique central dans des solutions aqueuses et acétonitrile acides et neutres (12).
Les recherches de Barclay et ses collaborateurs ont montré que la curcumine agit par son H phénolique (13).
En conclusion, les recherches de Priyadarsini ont montré que le groupe phénolique est essentiel pour l'activité de piégeage des radicaux libres et que la présence du groupe méthoxy augmente cette activité (14).
Selon la théorie fonctionnelle de la densité (DFT) :
- la forme énolique de la curcumine est significativement plus stable que la forme dicétone
- l'enthalpie de dissociation de liaison (c’est-à-dire l’énergie qu’il faut fournir pour couper la liasion) O-H phénolique est significativement inférieure à celle de la liaison centrale O-H
Ce qui suggère que l'extraction des atomes d'hydrogène a lieu dans le groupe phénolique (11,14,15).
Il a également été souligné que la contribution relative du groupe phénolique et du groupe méthylénique central sur l'activité antioxydante dépend du type de radical et du milieu de réaction (11,16).
35
3. Les mécanismes anti-inflammatoires de la curcumine
Selon l’état actuel de la Recherche, la propriété anti-inflammatoire de la curcumine semble être médiée par l'inhibition de l'induction des COX-2, LOX, iNOS, de l’inhibition de la production de cytokines comme l'interféron et le facteur de nécrose tumorale (TNF), et par l'activation de facteurs de transcription comme le NF-κB, et l’AP-1.
Action de la curcumine sur les cyclooxygénases et les lipoxygénases
Les propriétés anti-inflammatoires de la curcumine sont en partie attribuées à la suppression de la synthèse des prostaglandines (PG) (17). La cyclooxygénase (COX) est une enzyme clé responsable de la transformation de l'acide arachidonique en PG. Il se compose de deux isoformes différentes : COX-1 et COX-2.
36
La COX-1 est une isoforme constitutive présente dans la plupart des tissus et est généralement considérée comme une enzyme "d'entretien ménager" (18). Elle fonctionne en permanence en assurant des fonctions physiologiques : agrégabilité plaquettaire (par le thromboxane A2), protection de la muqueuse gastro-duodénale, régulation du flux sanguin rénal. Son inhibition est responsable de problématiques graves telles que l'ulcération gastroduodénale ou l'insuffisance rénale.
A l’inverse, la COX2 est dite « inductible », c’est-à-dire activée par les phagocytes exposés à une agression, les cytokines, les facteurs de croissance, les hormones de l'ovulation et de la grossesse, les oncogènes et les promoteurs tumoraux (19). Elle s'exprime dans les tissus du cerveau et de la moelle épinière mais aussi dans une grande variété d’autres tissus.
Figure 34 : Schéma de synthèse des leucotriènes et prostaglandines
La PGE2 et la PGI2 agissent sur les fibres musculaires lisses des vaisseaux : vasodilatation, augmentation de la perméabilité, œdème. La PGE2 facilite l’action des médiateurs de la douleur, inhibe l’activité des lymphocytes T suppresseurs, augmente la production d’immunoglobulines et diminue la production d’IL2 par les lymphocytes.
37
Le leucotriène B4 est le plus important des leucotriènes : il est le plus actif agent chimiotactique des polynucléaires, il active les phagocytes.
Les phénomènes de phagocytose par les polynucléaires neutrophiles augmentent la consommation d’oxygène et donc le stress oxydatif avec la formation de radicaux libres oxygénés : superoxydes O2-, eau oxygénée H2O2 et radicaux hydroxyles OH-. Ces radicaux libres,
toxiques, désorganisent les membranes cellulaires et favorisent la cytolyse. Le monoxyde d’azote (NO) est un autre radical libre produit par l’oxydation de l’arginine sous l’action d’une famille d’enzymes : les NO synthases ou NOS. Leur activation au cours de l’inflammation génère des quantités importantes de NO aux propriétés inflammatoires (vasodilatation, œdème, érythème).
La COX-2 induit la production de prostaglandines, médiateurs principaux de l’inflammation. De toute évidence, une diminution de COX-2 réduit l’inflammation.
On pourrait en déduire que les agents qui interfèrent avec la transcription de la COX-2 inhibent la tumorigenèse.
La surexpression de la COX-2, responsable d’une surproduction de PG, est impliquée dans la carcinogenèse de tumeurs du colon, rectum, sein, poumon, pancréas, estomac et prostate (20–22).
Des études ont montré que les métabolites de l'acide arachidonique (AA) dérivés des voies de la lipoxygénase (LOX) jouaient un rôle important dans la transduction des signaux liés à une surcroissance cellulaire, ce qui laisse suggérer qu’intervenir sur ces voies pourrait diminuer la progression du cancer.
De plus en plus d’études prouvent que la curcumine inhibe l'expression de la COX-2.
Kawamori démontrent que la curcumine d’origine alimentaire inhibe de façon significative l’enzyme nécessaire à la production d’AA, la phospholipase A2, dans la muqueuse colique (23). L’activation de COX et LOX est diminuée et donc le taux de PGE2 aussi.
Les métabolites de LOX qui favorisent l’adhésion, la croissance et la dissémination des cellules tumorales, sont aussi diminués (24).
La curcumine réduit l'expression de la COX-2 au niveau transcriptionnel contrairement aux inhibiteurs sélectifs de la COX-2, qui inhibent son activité catalytique (25).
Dans l’étude de Zhang, des cellules gastro-intestinales ont été exposées à deux promoteurs tumoraux connus : les acides biliaires (BA) et les esters
38
de phorbol (PMA). Ils ont montré une surinduction de COX-2 responsable d’une multiplication par 10 de la synthèse de PGE2 à l'origine de l'inflammation. La curcumine a diminué la production de la protéine COX-2 en inhibant son expression génétique (mesurée par l'ARNm) ainsi que la synthèse de la PGE2 et ce, de manière dose-dépendante (25).
Une autre étude présentée à la conférence de l'American Association for Cancer Research (AACR) en 1999 a montré une inhibition de la croissance tumorale de colon avec réduction de l’expression de l’ARNm de COX-2 proportionnelle à la concentration en curcumine (26).
Action de la curcumine sur la NO Synthase Inductible
Figure 35 : Synthèse du NO par la iNOS
L'oxyde nitrique synthase inductible (iNOS) joue aussi un rôle central dans la médiation de l'inflammation. Cette enzyme catalyse la désamination oxydative de la l-arginine pour produire du NO, médiateur pro-inflammatoire puissant.
L'expression accrue de l'iNOS a été observée dans plusieurs tissus tumoraux humains ainsi que chez des animaux à tumeurs induites chimiquement (27–29).
Des biopsies de tumeurs mammaires chez l'être humain présentaient des niveaux élevés d'iNOS. Ainsi, l'expression aberrante ou excessive de l'iNOS, comme dans le cas de la COX-2, est impliquée dans la pathogenèse du cancer.
Le NO agit en initiateur et promoteur de la carcinogénèse. Il augmente l’angiogenèse en stimulant vraisemblablement la production du facteur de croissance endothéliale vasculaire (VEGF) (30).
39
Par ailleurs, il réagit rapidement avec l'anion superoxyde pour produire le peroxynitrite, oxydant extrêmement puissant (ONOO-) (31). De nombreux rapports existent sur l'apoptose induite par le NO ou le peroxynitrite. Ce dernier est génotoxique et causes des lésions cellulaires (32). Il existe deux mécanismes innés luttant contre le cancer :
- La réparation des lésions de l’ADN par l’activation de l’ADN poly(ADP-ribose)polymérase (PPAR) (33).
- L’activation du p53 responsable de la mort cellulaire. -
Les agents pouvant inhiber sélectivement l'expression anormale d'iNOS, dont la curcumine, agissent comme un potentiel en chimioprévention.
4. Domaines d’utilisation de la curcumine
Athérosclérose
L'athérosclérose (du grec athêra signifiant « bouillie » et scleros signifiant « dur »), ou artériosclérose, est une maladie touchant les artères de gros et moyen calibre.
Figure 36 : Schéma d’une artère atteinte d’athérosclérose
Elle implique un dépôt de matières grasses, de cholestérol, de glucides simples et complexes, de plaquettes et de fibrine qui obstrue progressivement l’artère.
40
Elle conduit aussi à la formation d'un caillot sanguin (thrombus) à la surface de la plaque, qui en se détachant, bouche l'artère : sur une ou des artères coronaires, c’est l’infarctus.
Certains des mécanismes impliqués dans le développement de l'athérosclérose sont contrôlables :
- L'agrégation anormale des plaquettes
- L’inflammation (34,35)
- L'oxydation du cholestérol des lipoprotéines de basse densité (LDL-C)
La curcumine agit en tant qu’anti-agrégant plaquettaire. Cette propriété serait directement liée à l’inhibition du thromboxane A2 (promoteur de l’agrégation) ainsi qu’à l’activation des prostacyclines, inhibitrices de l’agrégation (36,37).
La curcumine est un puissant antioxydant, elle participe à l’élimination des radicaux libres et diminue les dommages cellulaires par son action sur iNOS.
La curcumine réduit l'inflammation, inhibe la formation de leucotriène et favorise la fibrinolyse (38,39).
De plus, la curcumine diminuerait le taux de cholestérol sanguin. Une étude sur des rats a montré cette capacité : des rats ayant reçu de la curcumine à 0,1 % pendant un régime à base de cholestérol avaient environ 50% en moins de cholestérol sanguin que les rats ayant reçu la même quantité de cholestérol sans curcumine (35).
Toutes ces actions démontrent l’importance de la curcumine dans la prévention de l'athérosclérose.
Le vieillissement
On a toujours essayé d’expliquer la nature du vieillissement. Certaines études soutiennent l'hypothèse de la théorie des radicaux libres(40). Ces espèces très réactives sont produites en continu lors du métabolisme normal et finissent par s'accumuler, endommageant l'ADN et d’autres macromolécules.
Des lésions dégénératives apparaissent jusqu’à la mort cellulaire : l'organisme vieillit et meurt.
41
La durée de vie potentielle d'une espèce est déterminée génétiquement mais les conditions environnementales dont l'alimentation peuvent la modifier. Harman a démontré que l'espérance de vie de nombreuses espèces augmente en rajoutant des antioxydants à l'alimentation (41,42). La curcumine diminue les complications induites par l'âge chez le rat (43).
Maladies auto-immunes
Le système immunitaire différencie les antigènes propres à l’individu et les antigènes du non-soi. Il protège l'hôte des pathogènes microbiens et des cellules malignes (44).
La défaillance de ce processus immuno-régulateur est responsable du développement des maladies infectieuses chroniques, des maladies auto-immunes et des tumeurs malignes.
Une maladie auto-immune implique un processus inflammatoire par l’activation :
- Des enzymes génératrices d'espèces réactives de l’oxygène comme les COX, la LOX, la xanthine déshydrogénase et l'iNOS (45) ainsi que la production des leucotriènes et des prostaglandines. - Des cytokines pro-inflammatoires dont l'interleukine (IL)-12 qui
permet la différenciation des lymphocytes T en lymphocytes T auxiliaires 1 (Th1).
Cette différenciation est responsable de l’aspect auto-immun de la maladie et l'axe IL-12/Th1 est devenu une nouvelle cible moléculaire dans le traitement des maladies auto-immunes à médiation cellulaire Th1. Ceci a été démontré dans la polyarthrite rhumatoïde et la myocardite auto-immune (46).
Dans le psoriasis, autre maladie auto-immune, on considère que chez un patient génétiquement prédisposé, des stimuli externes initient la production de cytokines et de chimiokines par les kératinocytes. Il s’ensuit une cascade d’évènements moléculaires et cellulaires dont la différenciation de lymphocytes T naïfs en lymphocytes T auxiliaires de type Th-1 et Th-17 qui produisent, entre autres, de l’interféron-γ, de l’IL-17 et de l’IL-22 responsables du développement des lésions.
Bosman a mis en avant l’effet favorable de la curcumine sur un modèle murin de psoriasis (47).
Heng et ses collaborateurs ont montré l’efficacité de la curcumine en traitement topique sur des lésions psoriasiques chez des patients et selon des critères cliniques, histologiques et immunologiques. Ils relient l’effet
42
antipsoriasique à la modulation de l'activité phosphorylase-kinase (Phk) par la curcumine.
En effet, cette activité est augmentée dans le psoriasis non traité et elle est diminuée par un analogue de la vitamine D3 (inhibiteur indirect de PhK) et par la curcumine de façon plus importante (48).
Le Diabète
Le stress oxydatif est un des facteurs environnementaux importants dans la physiopathologie du diabète.
Il est responsable d’une production accrue de ROS (49) et d’une diminution des systèmes antioxydants de la cellule. Il a été montré que la curcumine agit en sauvegardant les antioxydants endogènes et en améliorant leur fonction (50).
De plus, des concentrations élevées de glucose liées à l’alimentation favorisent la production de radicaux libres par les trois voies biochimiques suivantes :
o Les produits finaux de glycation avancée (AGE) (51) o L'activation de la protéine kinase-C (52)
o La voie de l'aldose réductase (53)
Un autre facteur important d’augmentation des ROS est le TNF (54). Il serait un lien entre l'obésité et le diabète (55) et serait associé à la résistance à l'insuline (56).
Les antioxydants présents dans les aliments et les plantes médicinales sont des modulateurs potentiels de l'apparition et de la progression des complications du diabète.
Parmi eux, la curcumine s’est montrée d’un grand intérêt car elle intervient directement dans les différents mécanismes de cette pathologie en diminuant le stress oxydatif.
Son action antidiabétique semble être médiée par :
- Les propriétés antioxydantes et anti-inflammatoires de la curcumine - L’interférence avec l'absorption alimentaire du glucose, la stimulation du pancréas pour produire et sécréter plus d'insuline (55).
43
5. Etude de cas de diabète (in vivo)
La rétinopathie diabétique a été étudiée chez le rat par R.A.Kowluru et M.Kanwar.
L'objectif de cette étude a été d'examiner l'effet de la curcumine sur le stress oxydatif et l'inflammation de la rétine du rat diabétique.
Méthode :
Un diabète a été induit par la streptozotocine sur un groupe de rats. Peu après cette induction, la moitié du groupe a reçu un régime alimentaire supplémenté par 0,05 % de curcumine en poudre et l’autre moitié a reçu le même régime sans curcumine pendant 6 semaines puis ont été sacrifiés.
Leur rétine a été étudiée pour quantifier le stress oxydatif et les marqueurs pro-inflammatoires par rapport à un groupe de rats sains.
Figure 37 : Effet de la curcumine sur le stress oxydatif induit par le diabète sur la rétine.
Norm = normal ; Diab = diabète ; Diab + Curc = diabète + curcumine (a) La capacité antioxydante totale de la rétine.
(b) La GSH rétinienne a été mesurée dans l'homogénat rétinien déprotéinisé . Chaque échantillon a été mesuré en double, et les valeurs sont représentées en moyenne ± écart-type de 7-8 rats dans le groupe diabétique et de 7-9 rats dans les groupes normal et diabète + curcumine.
La capacité antioxydante des tissus rétiniens et du GSH a diminué d'environ 30-35 % (figure 37) pendant que le taux de 8-OHdG est resté élevé à plus de 70 % (figure 38) chez les rats diabétiques comparativement aux rats témoins normaux du même âge.
44
Cette 8-hydroxydésoxyguanosine est un désoxyribonucléoside (ADN) résultant de l'oxydation de la désoxyguanosine dont le taux est utilisé comme marqueur biochimique du stress oxydant.
L'administration de curcumine a stoppé la diminution de la capacité antioxydante.
Figure 38 : Effet de la curcumine sur les niveaux d'ADN modifiés par oxydation sur la rétine.
Les taux de 8-OHdG ont été mesurés dans la rétine par méthode ELISA. Les valeurs sont représentées en moyenne ± écart-type de 6 à 8 rats dans chaque groupe
Chez les mêmes rats, l'administration de curcumine a significativement diminué l’oxydation de l'ADN rétinien ; les valeurs de 8-OHdG dans le groupe diabétique traité à la curcumine et le groupe témoin normal montraient une faible différence (figure 38).
45
Figure 39 : Effet de la curcumine sur les taux de nitrotyrosine rétinienne dans le diabète.
La nitrotyrosine a été quantifiée dans la rétine. La figure représente un écart-type moyen de ± 6 rats dans les groupes normal et diabétique + curcumine et de 7 rats dans le groupe diabétique.
Six semaines de diabète ont augmenté la nitrotyrosine dans la rétine d'environ 60 % par rapport aux valeurs obtenues chez des rats témoins normaux (figure 39).
La supplémentation en curcumine a stoppé cette augmentation.
Figure 40 : Effet de la curcumine sur l'augmentation des taux d’IL-1β rétinienne induite par le diabète
IL-1β a été quantifiée dans la rétine par test ELISA.Les valeurs d’IL-1β (pg IL-1β/mg protéine) sont des
valeurs moyennes ± écart-type obtenues chez 8 rats diabétiques et 8 rats diabétiques + curcumine et 6 rats dans le groupe normal.
46
La concentration de la cytokine inflammatoire IL-1β et son expression protéique étaient augmentées de 30 % dans la rétine des rats diabétiques (figure 40).
Figure 41 : Effet de la curcumine sur l'activation du NF-kB
L'activation du NF-kB a été déterminée dans l'homogénat rétinien par la méthode ELISA en utilisant un anticorps spécifique de la sous-unité p65 de NF-kB. La figure représente un écart-type moyen de ± 5-6 rats dans chacun des 3 groupes.
Dans la même rétine, le facteur de transcription qui est sous le contrôle d’IL-1β, NF-kB, a également été activé environ 2 fois (Figure 41).
47
Les concentrations de VEGF ont été mesurées dans la rétine de rats dans les groupes normaux, diabétiques et diabétiques + curcumine à l'aide d'un kit ELISA. Les résultats sont présentés sous la forme d'un écart-type moyen de ± 6 rats atteints de diabète et de 7 rats dans les groupes normal et diabète + curcumine.
L’augmentation de VGEF chez le rat diabétique est inhibée par la curcumine.
Résultats :
Dans la rétine des rats diabétiques, on observe :
- La diminution de la capacité antioxydante et du niveau de GSH (forme réduite de glutathion) d'environ 30-35%
- L’augmentation de l'ADN modifié par oxydation (8-OHdG) et de la nitrotyrosine de 60-70%.
- L’augmentation des taux d’interleukine-1β (IL-1β) de 30%, du facteur de croissance endothélial vasculaire (VEGF) de 110% et du facteur de transcription nucléaire (NF-kB) de 100%
L'administration de curcumine a inhibé l'augmentation induite par le diabète :
- Des marqueurs inflammatoires dans la rétine :
o Les taux d’IL-1β ont diminué de façon significative chez les rats diabétiques recevant de la curcumine
o L'activation du NF-kB a également diminué de façon significative
- Du facteur de croissance endothélial VEGF (Figure 12)
Elle a restauré le capital anti-oxydant de la rétine du rat diabétique et empêché la modification de l’ADN et l’augmentation de la nitrotyrosine. Elle n'a eu qu'un effet bénéfique partiel sur la GSH rétinienne.
Ces effets ont été obtenus sans modification de la glycémie. Conclusion :
Ces études sur la curcumine sont les premières qui tendent à montrer l’inhibition des anomalies rétiniennes induites par un stress oxydatif accru et des réactions inflammatoires dans le diabète.
Elle pourrait donc être un traitement d'appoint utile pour diminuer le développement de la rétinopathie qui menace la vue des patients diabétiques.
48
6. Etude de cas in vivo : l’artériosclérose
Le vieillissement est un facteur de risque d’artériosclérose. L'obésité et le trouble du métabolisme des glycolipides sont induits par l’excès d'apport de matières grasses et de sucres. Ils sont responsables du stress oxydatif ainsi que de la réaction inflammatoire associée à la sécrétion anormale d'adiponectine et de cytokines pro-inflammatoires à l’origine des maladies liées à l’artériosclérose (57–63).
On sait que la curcumine a des effets hypoglycémiants et hypolipémiants (64–66), et son apport devrait réduire différents troubles causés par un régime riche en graisses (High Fat Diet : HFD).
L'enzyme antioxydante HO-1 est l'un des médiateurs des différentes actions de la curcumine (67,68). Elle métabolise l'hème et produit des ions fer, du monoxyde de carbone et de la biliverdine.
La biliverdine est immédiatement convertie en bilirubine par réduction, et on a récemment rapporté qu'elle affecte l'expression de l'oxyde nitrique synthase endothéliale (eNOS) et de la sirtuine 1 (Sirt1) (69–72).
HO-1 est donc connue pour exercer des actions antioxydantes, anti-inflammatoires, immuno-régulatrices et anti-âge.
Des études chez la souris ont déjà montré les effets de la curcumine sur des lésions vasculaires causées par le HFD. La curcumine a une action anti-artériosclérose en diminuant l'absorption du cholestérol, l'expression des récepteurs macrophages capteurs (TLR4), et le système rénine-angiotensine (64,73,74).
Etude utilisant 80 souris mâles :
- 20 souris avec nourriture standard (MF) - 20 souris avec nourriture HFD
- 20 souris avec nourriture HFD enrichie en curcumine (HFD-Cu) - 20 souris avec nourriture HFD enrichie en curcumine et SnMP
(HFD-CuSnMP)
Toutes ces souris ont été nourries pendant 72 semaines.
Des souris âgées de huit semaines faisaient partie d’un groupe témoin jeune (groupe y-CTL).
SnMP (Stannous Mesoporphyrin) est un inhibiteur de l’hème-oxygénase (HO-1) dans les cas d’hyperbilirubinémie.
49
Figure 43 : Résultats des paramètres étudiés
Comme l'indique le tableau, il n'y avait pas de différences significatives dans le volume d'ingestion d'aliments entre les différents groupes.
Bien que la glycémie dans le groupe HFD soit significativement plus élevée que dans le groupe MF, la glycémie dans le groupe HFD + Cu était significativement plus basse que dans le groupe HFD.
Dans le groupe HFD, le taux de cholestérol total (CT) dans le sang était significativement plus élevé que dans le groupe MF ; cependant, le taux de CT dans le groupe HFD + Cu était significativement inférieur à celui du groupe HFD.
50
Comparativement au groupe MF, le poids dans le groupe HFD a augmenté de façon significative à l'âge de 12 semaines et s'est poursuivi jusqu'à l'âge de 80 semaines.
Comparativement au groupe HFD, le gain pondéral a été significativement supprimé à l'âge de 12 semaines dans le groupe HFD + Cu et est resté relativement constant jusqu'à l'âge de 80 semaines.
Comparativement au groupe HF+Cu, le gain pondéral a été significativement supprimé à 28 semaines dans le groupe HFD + Cu + SnMP, et est resté constant jusqu'à 80 semaines (Fig 44).
Des études ont montré que la curcumine augmente l'expression de HO-1 (67,68).
Figure 45 : Taux aortique de protéine HO-1
On remarque que le taux de protéine HO-1 dans les groupes HFD, MF et témoins est relativement semblable alors que ce taux est augmenté pour les groupes HFD-Cu et HFD-Cu-SnMP (Fig 45).
51
L'activité enzymatique de HO-1 a aussi été évaluée par coloration immunohistochimique de la bilirubine dans la paroi du vaisseau aortique.
Figure 46 : Coupe d’un vaisseau aortique avec coloration immunohistochimique de cellules musculaires lisses aortiques
Une augmentation de la bilirubine (teinte en brun) est observée dans le groupe HFD-Cu alors qu’elle a disparu dans le groupe HFD + Cu + SnMP.
Figure 47 : Concentration sanguine de bilirubine
Tout ceci est bien confirmé par la concentration sanguine de bilirubine : son taux a bien augmenté dans le groupe HFD-Cu alors qu’il est semblable pour les groupes HFD-Cu-SnMP, témoins, MF et HFD.
On évalue l’activité antioxydante de HO-1 avec analyse quantitative de superoxyde par coloration à la dihydroethidine (DHE).
52
Figure 48 : Paroi vasculaire colorée à la DHE
Comme le montre la figure 48, une augmentation de la production de superoxyde est observée dans le groupe MF. Cette hausse s'accentue dans le groupe HFD. Dans le groupe HFD + Cu, le taux de superoxyde est comparable à celui du groupe y-CTL.
Dans le groupe HFD + Cu + SnMP, l’action de la curcumine est inhibée. Le stress oxydatif systémique a aussi été évalué avec la concentration urinaire de 8OHdG.
Figure 49 : Concentration urinaire en 8-OHdG
Dans le groupe MF et le groupe HFD, la 8-OHdG urinaire a augmenté de façon significative comparativement à celle du groupe y-CTL.
53
Il n'y a pas eu de différence significative entre le 8OHdG urinaire du groupe HFD + Cu et du groupe y-CTL.
L'effet antioxydant lié à la curcumine a été inhibé dans le groupe HFD + Cu + SnMP
La Sirt1 est une protéine enzymatique humaine, codée par le gène Sirt1 situé sur le chromosome 10 humain et correspondant à une NAD+ dépendante lysine désacétylase.
La Sirt1 fait partie des gènes suppresseurs de tumeurs et intervient dans de nombreux mécanismes de l’inflammation. Elle pourrait être protectrice contre l'athérome en améliorant la résistance et la fonction de l'endothélium (75).
Figure 50 : Taux de Sirt1 aortique
On remarque que les taux de Sirt1 sont semblables dans le groupe témoin et celui de HFD-Cu alors qu’ils se sont effondrés dans les groupes MF et HFD. L’activité anti-oxydante du groupe HFD-Cu-SnMP a également été inhibée.
Une dernière expérience a mis en avant l’action de la curcumine sur l’inflammation de la paroi vasculaire. Elle est réalisée sur le monocyte chemoattractant protéine 1 (MCP1) qui est une cytokine pro inflammatoire et sur la β-galactosidase qui est un marqueur de la sénescence.
54
Figure 51 : (A) Activité de la β-gal colorée dans l’intima de l’aorte thoracique (B) Taux de MCP1-ARNm (par RT-PCR) et MCP-1 (ELISA)
Figure 51-A : une augmentation de l'activité β-Gal est observée dans le groupe MF et HFD comparativement au groupe y-CTL. Dans le groupe HFD + Cu, son activité est identique au groupe y-CTL alors que les effets de la curcumine ont disparu dans le groupe HFD + Cu + SnMP.
Figure 51-B : l'expression du gène MCP-1 dans l'aorte a augmenté de façon significative dans le groupe HFD par rapport au groupe y-CTL. Ce taux de HFD-Cu est resté identique à celui du groupe y-CTL.
Les taux sanguins de MCP-1 dans le groupe MF et le groupe HFD ont augmenté de façon significative par rapport à ceux du groupe y-CTL et le
taux de HFD-Cu n’a montré aucune différence significative avec y-CTL. Encore une fois, les effets de la curcumine ont été supprimés dans
55
L'expression du MCP-1 (monocyte chemoattractant protein 1) est stimulée par l'inflammation et une lésion tissulaire3, intervenant dans la genèse de
l'athérome.
En conclusion, la curcumine a des effets bénéfiques possibles, tels qu’une action anti-inflammatoire, une action antioxydante et diverses activités physiologiques in vivo. Cette étude suggère que la curcumine neutralise l’évolution de l’artériosclérose déclenchée par l'administration prolongée de HFD chez la souris ainsi que l’inflammation et le vieillissement vasculaire.
La curcumine pourrait être un aliment prophylactique de l’artériosclérose.
B. Curcumine et cancers
Dans un cancer, la cellule atteinte ne meurt pas.
La capacité des cellules cancéreuses à ne pas subir l'apoptose contribue de façon critique à la genèse et à la progression du cancer et représente une cause importante de résistance aux médicaments anticancéreux (76). La présence ou le développement d'une résistance aux médicaments anticancéreux est la principale cause d'échec de la chimiothérapie dans la majorité des formes les plus courantes de cancer (cancer du poumon, du côlon, du sein et du col utérin).
Cette résistance aux chimiothérapies est, soit déjà présente au moment du diagnostic, elle est dite intrinsèque ou de novo, soit, peut se développer après traitement, elle est dite acquise (77,78).
La résistance intrinsèque est responsable de l’échec du traitement initial, la résistance acquise est responsable d’une évolution précoce malgré différents traitements.
1. Physiopathologie
Les cellules cancéreuses échappent à l'apoptose en surexprimant des protéines inhibitrices de l’apoptose (PAI) comme Bcl-2, NFκ-B, Akt, ce qui leur donne un avantage en termes de survie.
On observe même une régulation à la hausse des signaux de survie de la cellule cancéreuse avec des chimiothérapies conventionnelles à de