© Thiebaud Meinsohn, 2019
Caractérisation des lignines d'érable rouge et d'érable à
sucre pour la formulation d'adhésifs
Mémoire
Thiebaud Meinsohn
Maîtrise en sciences du bois - avec mémoire
Maître ès sciences (M. Sc.)
ii
Caractérisation des lignines d’érable rouge et
d’érable à sucre pour la formulation d’adhésifs
Mémoire
Thiébaud Meinsohn, ing.f.
Sous la direction de :
iii
Résumé
L’utilisation d’adhésifs issus de matériaux renouvelables dans les composites à base de bois, et en particulier dans l’industrie des panneaux, suscite beaucoup d’intérêt depuis de nombreuses années. Aujourd’hui, des résines pétro-sourcées comme l’Urée-Formaldéhyde (UF), la Mélamine Urée-Formaldéhyde (MUF) ou encore le Phénol-Formaldéhyde (PF), se sont imposées face aux résines bio-sourcées et ce depuis le début du XXème siècle par leur efficacité, mais surtout leur faible coût supporté par le développement des industries pétrochimiques.
Cependant, avec le déclin programmé du pétrole et la sensibilité croissante du public face aux problématiques environnementales, de nombreux industriels se tournent de plus en plus vers des voies alternatives aux résines pétro-sourcées.
Parmi les pistes alternatives étudiées, outres les résines bio-sourcées à base de soja, les lignines représentent un type de polymères qui semblent susciter un regain d’intérêt comme sources d’adhésif. En effet, les lignines, que l’on retrouve notamment dans le bois, constituent l’adhésif naturel des plantes supérieures et sont situées principalement au niveau des parois cellulaires où elles assurent la cohésion entre les fibres et la rigidité de l’ensemble de l’architecture végétale. De plus, leur structure polyphénolique leur permet une réactivité similaire à celle observée chez les résines phénoliques d’origines pétro-sourcées. La transition de l’industrie papetière vers des unités de bio-raffinage, où les co-produits de la mise en pâte telles que les lignines seront mieux valorisées et le développement rapide de la chimie verte où les « déchets » de l’industrie du bois, tels que les écorces, seront eux aussi mieux utilisés sont autant de facteurs qui pourraient favoriser le développement de nouveaux adhésifs bio-sourcés dans les prochaines années.
L’objectif de ce projet était de déterminer le potentiel de valorisation des écorces d’érable rouge, Acer rubrum, et d’érable à sucre, Acer saccharum, par le truchement des lignines qu’elles contiennent en d’en faire une source de production d’adhésifs naturels destinées à des panneaux de particules de bois exempts de formaldéhyde. Ces lignines ont été à la base de différentes formulations de résines dont l’une s’est révélée plus efficace comme adhésif comparativement à certaines résines pétro-sourcées.
iv
Abstract
The use of adhesives from renewable materials in wood composites, particularly in the panel industry, has been a subject of interest for many years. Nowadays, the main petrochemical resins used such as Formaldehyde (UF), Melamine Urea-Formaldehyde (MUF) or even Phenol-Urea-Formaldehyde (PF), stood out versus natural resins in the early XXth century by their efficiency, but especially their low cost carried by the development of the petroleum industries.
However, with the programmed shortage of oil, and the increasing sensitivity of the public towards environmental issues, more and more manufacturers are looking for alternatives to the pretrochemical resins.
Among these studied alternatives, except the soya-based adhesives, lignins are a type of polymer that raised an interest as adhesive. Indeed, inside the wood, lignins are the natural adhesive of superior plants and are mainly located in wood cells where they bind fibers and maintain the rigidity of the whole plant architecture. Moreover, their polyphenol structure allows a similar reactivity to what is observed with petrochemical resins. The transition from paper mills to biorefinery units, where the co-products of pulping such as lignin are valued and the rapid development of green chemistry where the "wastes" of the wood industry, such as barks, are used, are all factors that suggest the growth of these new bio-sourced adhesives in the upcoming years.
The objective of this project was to study the potential valorization of the red maple, Acer rubrum, and sugar maple, Acer saccharum, barks by the recovery of their lignins and to use them as a source of bioadhesive for wood panels free of formaldehyde. Based on these lignins, different resins were developed, one of which proved to be more successful than some petrochemical ones.
v
Table des matières
RESUME ... III ABSTRACT ... IV LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... VIII LISTE DES ABREVIATIONS ET DES SIGLES ... X REMERCIEMENTS ... XI
INTRODUCTION ... 1
CHAPITRE I : REVUE BIBLIOGRAPHIQUE ... 3
1. LES ECORCES ... 4
1.1. Généralités ... 4
1.2. Production et utilisation des écorces ... 6
2. LES ERABLES ... 8 2.1. Le genre Acer ... 8 2.2. L’érable rouge ... 10 2.3. L’érable à sucre ... 13 3. LES LIGNINES ... 15 3.1. Généralités ... 15
3.2. Production des lignines dans les milieux industriels et leurs applications... 17
3.3. Les lignines comme adhésifs ... 20
3.3.1. Modifications des lignines ... 21
3.3.2. Agents de réticulation ... 22
3.3.3. Activation enzymatique ... 23
4. MISE EN PATE ORGANOSOLV ... 24
4.1. Principe de la mise en pâte organosolv ... 24
5. OBJECTIFS ET HYPOTHESE DE TRAVAIL ... 29
CHAPITRE II : MATERIEL ET METHODES ... 30
1. CARACTERISATION DES ECORCES D’ERABLE ROUGE ET D’ERABLE A SUCRE ... 31
1.1. Calibration des écorces ... 31
1.2. Mesure de l’humidité ... 31
1.3. Détermination de la quantité d’extractibles ... 32
1.4. Détermination du taux de lignines ... 33
1.5. Détermination de la quantité de glucides ... 35
1.6. Détermination de la quantité de cendres ... 36
2. MISE EN PATE ORGANOSOLV ... 37
2.1. Calibration des écorces ... 37
2.2. Pré-extraction ... 37
2.3. Délignification et récupération des lignines ... 38
3. ANALYSE DES LIGNINES ORGANOSOLV ... 40
3.1. Analyse Klason des lignines organosolv ... 40
vi
3.3. Analyse des lignines organosolv par spectroscopie infrarouge ... 41
3.4. Analyse des lignines organosolv par spectroscopie de résonance magnétique nucléaire ... 41
3.5. Analyse thermogravimétrique des lignines organosolv ... 41
4. REALISATION DES ADHESIFS A BASE DE LIGNINES ... 42
4.1. Formulation des adhésifs à base de lignines ... 42
4.2. Préparation des adhésifs à base de lignines ... 44
4.3. Analyses complémentaires des adhésifs à base de lignines ... 46
5. REALISATION DES PANNEAUX DE PARTICULES ET TESTS MECANIQUES ... 46
5.1. Préparation des panneaux de particules ... 46
5.2. Essais mécaniques ... 48
CHAPITRE III : RESULTATS ET DISCUSSIONS... 49
1. CARACTERISATION DES ECORCES D’ERABLES ROUGE ET D’ERABLE A SUCRE ... 50
2. ANALYSE DES LIGNINES ORGANOSOLV ... 52
2.1. Analyse Klason des lignines organosolv ... 52
2.2. Analyse des lignines organosolv par chromatographie sur gel perméable ... 53
2.3. Analyse des lignines organosolv par spectroscopie infrarouge ... 55
2.4. Analyse des lignines organosolv par spectroscopie de résonance magnétique nucléaire ... 57
2.5. Analyse thermogravimétrique des lignines organosolv ... 59
3. ANALYSES COMPLEMENTAIRES DES ADHESIFS A BASE DE LIGNINES D’ECORCE D’ERABLE ROUGE ... 61
4. ESSAIS MECANIQUES ... 64
5. DISCUSSION ... 74
CONCLUSION ... 76
BIBLIOGRAPHIE ... 78
ANNEXES ... 89
1. METHODE DE CALCUL DE LA MOR ET MOE DANS LE CADRE DE TESTS DE FLEXION SIMPLE ... 89
vii
Liste des tableaux
TABLEAU 1 : EXEMPLES DE CONDITIONS DE MISE EN PATE ORGANOSOLV (JOHANSSON ET AL. 1987) ... 25 TABLEAU 2 : DIFFERENTES MISES EN PATE ORGANOSOLV ET LEUR SYSTEME DE SOLVANT
(STEVANOVIC 2018) ... 26 TABLEAU 3 : CONSTITUANTS PRINCIPAUX DE L'ECORCE D'ERABLE ROUGE ET DE L'ERABLE
A SUCRE MESURES AU COURS DE L’ETUDE ... 51 TABLEAU 4 : COMPARAISON DE LA PURETE DES LIGNINES ORGANOSOLV DE L'ECORCE
D'ERABLE ROUGE ET D'ERABLE A SUCRE ... 52 TABLEAU 5 : ANALYSE DE LA PERMEATION DU GEL POUR DES ECHANTILLONS DE LIGNINES DE BOIS ET D'ECORCE ... 54 TABLEAU 6 : ANALYSE QUANTITATIVE RMN AU 31P DES HYDROXYLES DANS LES LIGNINES
ORGANOSOLV D'ECORCES D'ERABLE ROUGE ET D'ERABLE A SUCRE EN MMOL DE OH PAR G DE LIGNINE ... 57 TABLEAU 7 : RESULTATS DE L'ANALYSE TGA DES LIGNINES D’ECORCES D'ERABLE ROUGE
ET D'ERABLE A SUCRE SOUS FLUX D’AZOTE ... 59 TABLEAU 8 : ANALYSE DE LA PERMEATION DU GEL POUR LES ECHANTILLONS DE LIGNINE
D’ECORCES D'ERABLE ROUGE BRUTE AVANT ET APRES REACTION ENZYMATIQUE... 61 TABLEAU 9: RESULTATS DE L'ANALYSE STATISTIQUE APPLIQUEE AUX DIFFERENTES
FORMULATIONS A BASE DE LIGNINE D'ERABLE ROUGE ET D'ERABLE A SUCRE ... 67 TABLEAU 10: RESULTATS DE L'ANALYSE STATISTIQUE COMPARANT LA FORMULATION A
BASE DE LIGNINE D'ERABLE ROUGE AVEC ENZYME A UNE RESINE INDUSTRIELLE ET A UNE FORMULATION A BASE DE TANNINS... 70 TABLEAU 11: RESULTATS DE L'ANALYSE STATISTIQUE COMPARANT LES DIFFERENTS
viii
Liste des figures
FIGURE 1 : ÉCORCE D'ERABLE ROUGE (A GAUCHE) ET D’ERABLE A SUCRE (A DROITE)
(RESSOURCES NATURELLES CANADA 2015) ... 5 FIGURE 2 : AIRE DE REPARTITION DU GENRE ACER (WIKIMEDIA COMMONS 2018) ... 8 FIGURE 3 : AIRE DE REPARTITION DE L'ERABLE ROUGE EN AMERIQUE DU NORD (WIKIMEDIA COMMONS 2013) ... 10 FIGURE 4 : AIRE DE REPARTITION DE L'ERABLE A SUCRE EN AMERIQUE DU NORD
(WIKIMEDIA COMMONS 2013) ... 13 FIGURE 5 : STRUCTURE PHENYLE PROPANE DES LIGNINES SIMPLIFIEES DE FEUILLU ... 15 FIGURE 6 : MONOMERES DES LIGNINES ... 16 FIGURE 7 : A) STRUCTURE D'UN PHENOL AVEC SES TROIS SITES REACTIFS 2-4-6 ET
STRUCTURE D’UNE LIGNINE AVEC UN SITE REACTIF 3, B) RETICULATION ENTRE UNE LIGNINE ET DU FORMALDEHYDE (HEMMILA ET AL. 2017) ... 21 FIGURE 8 : COUPLAGE DE RADICAUX PHENOXYL DE LIGNINES APRES TRAITEMENT
ENZYMATIQUES (WIDSTEN & KANDELBAUER 2008) ... 23 FIGURE 9 : MECANISME PROPOSEE DE LA CHELATION FE 3+ AVEC LES FRACTIONS
PHENOLIQUES ACTIVES DES LIGNINES DURANT LE PROCESSUS DE DELIGNIFICATION (KOUMBA YOYA & STEVANOVIC 2016). ... 28 FIGURE 10 : EXTRACTEUR A REFLUX UTILISE POUR LA PRE-EXTRACTION ... 37 FIGURE 11 : REACTEUR PARR SERIE 4848 UTILISE POUR LA MISE EN PATE ... 38 FIGURE 12 : SCHEMATISATION DU PROCEDE DE MISE EN PATE ORGANOSOLV UTILISE POUR
CE PROJET ... 39 FIGURE 13 : MODELE ENVISAGE DE LA REACTION ENZYMATIQUE DE LA LACCASE SUR LES
LIGNINES ... 42 FIGURE 14 : ALDOLISATION DE LIGNINES PAR DES TANNINS DANS LE BUT DE CREER UN
ADHESIF LIBRE DE FORMALDEHYDE ... 44 FIGURE 15 : SCHEMATISATION DU MONTAGE UTILISEE POUR LA REACTION ENZYMATIQUE
... 45 FIGURE 16 : PRESSE UTILISEE POUR LA FABRICATION DES PANNEAUX A BASE DE LIGNINES
ET APPAREILLAGE UTILISE POUR LES TESTS MECANIQUES ... 48 FIGURE 17 : ANALYSE COMPAREE DE LA CHROMATOGRAPHIE PAR GEL PERMEABLE DES
LIGNINES D’ECORCES D’ERABLE ROUGE ET D’ERABLE A SUCRE... 54 FIGURE 18 : ANALYSE PAR SPECTROSCOPIE INFRAROUGE A TRANSFORMEE DE FOURIER, EN
ABSORBANCE, DES LIGNINES D'ECORCES D'ERABLE ROUGE ET D'ERABLE A SUCRE .... 56 FIGURE 19 : SPECTRE DE L’ANALYSE COMPARATIVE RMN 31P DES LIGNINES D’ECORCES
D’ERABLE ROUGE ET D’ERABLE A SUCRE ... 58 FIGURE 20 : SPECTRE DE L'ANALYSE TGA DES LIGNINES D’ECORCES D'ERABLE ROUGE ET
D'ERABLE A SUCRE ... 60 FIGURE 21 : ANALYSE COMPAREE DE LA CHROMATOGRAPHIE PAR GEL DE PERMEATION
DES LIGNINES D’ECORCES D’ERABLE ROUGE AVANT ET APRES REACTION
ENZYMATIQUE ... 62 FIGURE 22 : ANALYSE PAR SPECTROSCOPIE INFRAROUGE A TRANSFORMEE DE FOURIER DES LIGNINES D'ECORCES D'ERABLE ROUGE BRUTE ET APRES REACTION ENZYMATIQUE . 63 FIGURE 23 : COMPARAISON DES MOR DES PANNEAUX DE PARTICULES DES FORMULATIONS
A BASE DE LIGNINE D’ECORCES D'ERABLE ROUGE ET D'ERABLE A SUCRE BRUTES AINSI QU'APRES REACTION ENZYMATIQUE ... 65
ix
FIGURE 24 : COMPARAISON DES MOE DES PANNEAUX DE PARTICULES DES FORMULATIONS A BASE DE LIGNINE D’ECORCES D'ERABLE ROUGE ET D'ERABLE A SUCRE BRUTES AINSI QU'APRES REACTION ENZYMATIQUE ... 65 FIGURE 25 : COMPARAISON DES MOE DES PANNEAUX DE PARTICULES DES FORMULATIONS
A BASE DE LIGNINES D’ECORCES D'ERABLE ROUGE AVEC ENZYME, DE MUF ET DE TANNINS ... 69 FIGURE 26 : COMPARAISON DES MOR DES PANNEAUX DE PARTICULES DES FORMULATIONS
A BASE DE LIGNINE D’ECORCES D'ERABLE ROUGE AVEC ENZYME, DE MUF ET DE TANNINS ... 69 FIGURE 27 : COMPARAISON DES MOE DES PANNEAUX DE PARTICULES DES FORMULATIONS
A BASE DE LIGNINES D’ECORCES D’ERABLE ROUGE ET TANNINS ... 72 FIGURE 28 : COMPARAISON DES MOR DES PANNEAUX DE PARTICULES DES FORMULATIONS
x
Liste des abréviations et des sigles
A : absorbance
ABTS : acide 2,2'-azino-bis(3-éthylbenzothiazoline-6-sulphonique) BTX : benzène, toluène, éthylène
E : épaisseur de l’éprouvette F : facteur de correction
FT-IR : spectroscopie infrarouge à transformée de Fourier GPC : chromatographie sur gel perméable
HMTA : hexamethylenetetramine anhydre MDF : Medium density fibreboard
MOE : module d’élasticité MOR : module de rupture
MUF : Mélamine Urée-Formaldéhyde Mw : masse molaire moyenne
PD : polydiversité
PF : Phénol-Formaldéhyde PEI : polyethylenimine
pMDI : 4,4'-diisocyanate de diphénylméthylène RMN : résonance magnétique nucléaire
SMT : sodium metaborate tetrahydraté
Tris-HCl : Tris(hydroxymethyl)aminomethane hydrochloride THF : tétrahydrofurane
xi
Remerciements
Je tiens tout d’abord à remercier le professeur Tatjana Stevanovic pour la confiance qu’elle a su m’accorder sur la conduite de ce projet ainsi que sur les différentes missions qu’elle a pu me confier au cours de ces deux années. Sa supervision comme ses recommandations auront été plus que bienvenues.
Je tiens aussi à remercier M. Clermont Levasseur et sa société LEVACO INC. pour sa contribution financière et matérielle à la réalisation de ce projet mais aussi le Consortium de Recherche et Innovations en Bioprocédés Industriels au Québec (CRIBIQ) et le Ministère de l’Économie, de la Science et de l’Innovation du Québec via son Programme de Soutien à la Valorisation et au Transfert (PSVT).
Je remercie le docteur Georges Koumba pour toute l’aide qu’il a pu m’apporter pendant mes recherches. Son expertise, ses connaissances et ses propositions auront guidé ce projet sur toute sa durée.
Merci à Yves Bédard, technicien expert, pour sa patience et le temps qu’il a su prendre pour m’aider dans les différentes manipulations que j’ai eu à faire.
Je remercie également les personnes suivantes qui m’ont accompagné pendant ses deux années et qui ont su m’intégrer dans leur équipe à savoir les docteurs Nellie Francezon, Caroline Quéant, Thibaud Geoffroy, Romaric Méda ainsi que M. Sagar Bhatta.
De même je tiens à saluer tous les membres du CRMR, du département des sciences du bois et de la forêt et de l’Université Laval pour leurs différentes contributions à la réussite de ces deux années notamment, messieurs Luc Germain, Daniel Bourgault, David Lagueux, Jean Ouellet, Pierre Audet, Normand Paradis, Pierre Audet et Yann Giroux, ainsi que mesdames, Marthe Larouche, Caroline Trahan et Guylaine Bélanger.
Enfin, je tiens à remercier mes proches et ma famille pour leur soutien tout au long de ce projet en particulier ma sœur qui malgré la conduite de son doctorat à su trouver le temps de m’aider à de nombreuses reprises.
1
Introduction
Au Canada chaque année, ce sont 17 millions de mètres cubes (m3) d’écorce qui sont produits par les industries forestières dans le cadre de leurs activités. Sur cette production, plus de la moitié serait enfouie, pour revitaliser les sols forestiers, ou incinérée à des fins de production d’énergie(FENG et al. 2013). Pourtant, cette matière, riche en éléments organiques, tels que les lignines, des extractibles (terpène, et composés phénoliques comme les tannins), des minéraux ou encore des glucides (cellulose, hémicellulose, amidon, gommes glucidiques…), est d’un grand intérêt pour le développement de la chimie verte face à l’urgence de l’épuisement des ressources pétrolières et aux problématiques liés au développement durable.
Présents dans les forêts de l’est de l’Amérique de Nord et espèces emblématiques du Canada, l’Érable rouge et l’Érable à sucre représentent un enjeu économique majeur notamment pour ce qui est de la production de sirop ou à celle de meubles, de planchers ou d’autres éléments en bois. Toutefois, les activités sylvicoles liées à cette même production de sirop et la transformation du bois des érables génèrent d’importantes quantités d’écorce et l’accumulation de cette dernière constitue une source de polluant dans la mesure où des études désignent son enfouissement comme un procédé pouvant impacter la qualité des nappes phréatiques (SWEET & FETROW 1975). Dans un contexte de compétitivité et d’innovation, la valorisation de ces écorces en produits à haute valeur ajoutée pourrait être intéressante pour l’industrie forestière en général et ainsi permettre de trouver de nouveaux débouchés économiques pour un produit encore sous-exploité. En effet, autrefois considérée comme un co-produit difficilement valorisable, car abondante en minéraux et impuretés, l’écorce suscite, suite à des études récentes un regain d’intérêt notamment dans la production de lignine dont les propriétés adhésives sont bien connues par les milieux de recherche et d’industrie du bois (CETIN & OZMEN 2002).
Par ailleurs, l’exportation de panneaux de particules a rapporté au Canada plus d’un milliard de dollars US et ce pour la seule année 2015 (Statistique Canada 2018). Or, les adhésifs majoritairement utilisés dans la fabrication des panneaux actuellement commercialisés contiennent du formaldéhyde dans leur formulation. Rappelons ici que le formaldéhyde est molécule connue pour sa toxicité et ses conséquences graves sur la santé.
2
Ce produit ayant été répertorié comme cancérogène certain par le Centre International de Recherche sur le cancer qui dépend de l’Organisation Mondiale de la Santé, son taux
d’exposition maximale a été fixé à 0.1mg / m3 pour une durée de 30 minutes (World Health
Organisation 2002).
Ainsi, la valorisation de coproduits de l’industrie forestière, qui pourraient trouver un épilogue dans le développement de nouveaux marchés tels que celui d’adhésifs plus propres mais aussi économiquement viables, est le fondement de ce projet aux enjeux écoresponsables.
Au cours de projet, plusieurs facteurs ont été étudiés afin d’optimiser les formulations d’adhésifs à base de lignines organosolv : l’origine des lignines extraites, à savoir de l’écorce d’érable rouge ou d’érable à sucre, la nature du milieu réactionnel (acide ou basique), les différents durcisseurs testés et le niveau des tannins présents dans la formulation. La qualité des adhésifs formulés a été comparée au travers de panneaux de particules soumis à des tests de flexions simples.
3
4
1. Les écorces
1.1.
Généralités
Communément, le terme d’écorce est utilisé pour décrire la partie la plus externe, celle visible à l’œil nu, des racines et de la tige des plantes ligneuses qui scientifiquement correspond au rhytidome (du grec rhutidôma, « ridé et rugueux »). L’écorce, qui peut représenter jusqu’à 20% du poids total de la plante, est plus précisément composée de deux grandes couches, une partie interne, le périderme associé au liber et une partie externe, le rhytidome, cité précédemment.
Associé au périderme, le liber est un tissu conducteur élaboré où circule la sève, sécrétée dans les feuilles vers les autres parties de l’arbre, via des tubes criblés associés à des cellules compagnes, des fibres, et du parenchyme.
Le périderme, est un tissu végétal formé de trois sous tissus, le phellogène, le phelloderme et le phellème (ou suber/liège). Le phellogène est un tissu vivant qui génère vers l’intérieur le phelloderme (croissance ou différenciation centripète) et génère vers l’extérieur le phellème (croissance ou différenciation centrifuge). Le phelloderme, assure l’accumulation de réserve tandis que le phellème, lui, assure un rôle de protection par la présence de subérine dans les parois des cellules qui le composent (polymère de lipides associé à des cires et imperméables à l’eau).
Les années passant, les cellules du phellème subérisées deviennent imperméables aux gaz et à l’eau et meurent entrainant aussi la mort de tout le périderme. Des couches successives de ces cellules se mettent en place et forment alors le rhytidome.
5
Figure 1 : Écorce d'érable rouge (à gauche) et d’érable à sucre (à droite) (Ressources Naturelles Canada 2015)
Au niveau moléculaire et chimique, les écorces se composent de biopolymères nombreux et variés tels que des polysaccharides, des tannins, des subérines et des lignines. Ces molécules sont à l’origine du rôle principal de l’écorce qui est de protéger la plante d’attaque physique ou biologique. Par exemple les tannins sont des molécules ralentissant la décomposition tandis que les lignines et les subérines participent à la défense de l’individu face aux insectes. Des études ont ainsi montré que chez le chêne blanc (Quecus alba), l’arbre concentrait son écorce en lignine jusqu’à 40 % des tissus totaux, pour renforcer sa rigidité et participer au maintien de son port droit, et concentrait ses lignines en unités guaïacyles, plus résistantes à la dégradation que les autres unités de lignines, et renforçait ainsi sa résistance aux champignons (VANE et al. 2006).
6
1.2.
Production et utilisation des écorces
L’écorce est une matière exploitée par l’être humain depuis des temps immémoriaux. En effet, nos ancêtres avaient trouvé à ce produit de nombreuses utilisations dans des domaines tout aussi nombreux. Par exemple, c’est de l’écorce des canneliers (arbres et arbustes du genre Cinnamomum) que l’on tire une épice, la cannelle. Dans ce même domaine de l’alimentation, les tannins, dont le tan servait aussi à tanner les cuirs, issus de certains chênes (Quercus) et châtaignier (Castanea), sont toujours utilisés dans l’industrie du vin pour les besoins de la vinification. Les écorces contiennent aussi des molécules aux vertus médicinales comme la quinine et la quinidine issu du quinquina (Cinchona) ou encore l’aspirine issue de l’écorce du saule blanc (Salix alba). Dans le domaine des matériaux, les Premières Nations du Canada utilisaient l’écorce du bouleau à papier ou bouleau à canot (Betula papyrifera) pour imperméabiliser leurs embarcations tandis qu’en Europe elle était utilisée pour isoler les toitures des habitations. Le liège, tiré de l’écorce du chêne du même nom (Quercus suber) est encore utilisé pour ses propriétés isolantes et d’imperméabilité aux gaz et à l’eau dans la fabrication de bouchons, de panneaux, ou de vêtements et équipement de sécurité. De même des fibres textiles obtenues par teillage de l’écorce de tilleul (Tilia) ont des débouchés dans le domaine vestimentaire. C’est de l’écorce du mûrier à papier ou mûrier de Chine (Broussonetia papyrifera) que dès le IIème siècle les chinois ont mis au point les premiers papiers, et les mêmes techniques sont toujours utilisées de manières artisanales au Népal avec l’écorce de Iokta (Daphne papyracea). Enfin, dans les domaines de l’horticulture et de l’agriculture, les écorces, et plus particulièrement les écorces de pins, sont appliquées sur les sols (paillis) pour ralentir leurs dégradations ou l’évaporation de l’eau, les enrichir en matière organiques et attirer la micro faune, ou encore servir de filtre naturel pour favoriser la décontamination. Ces phénomènes, découverts au Canada dans les années 1970 via des rameaux de bois de feuillus, sont au cœur de la technologie des bois raméaux fragmentés (BRF) qui se redéveloppe de nos jours avec les demandes en pratiques vertes et durables (GUAY et al. 1983).
7
Aujourd’hui, les écorces sont majoritairement produites en amont de la filière bois lors des opérations forestières, des travaux forestiers et des activités de première transformation. En forêt, l’abattage, l’ébranchage, l’écorçage ou encore les différents transports du bois sur les chantiers sont les principales sources de la production d’écorce. Plus tard, c’est à l’entrée des usines de transformations des grumes ou des billots qu’une nouvelle production d’écorce se fait. En effet, que ce soit pour les besoins des scieries, des papèteries ou des fabricants de panneaux, le bois est écorcé et les écorces s’accumulent alors sur les sites de productions.
En 2014, le Conseil de l’industrie forestière du Québec (CIFQ) estimait que près de 2.3 millions de tonnes métriques anhydres d’écorce avaient été produites annuellement la province de Québec (CIFQ 2014). Sur ces 2.3 millions, on observe qu’environ la moitié a été brûlée dans les usines pour la production d’énergie afin de chauffer les sites ou permettre le fonctionnement des équipements, comme les séchoirs ou les points d’eau chaude pour dégeler les bois en hiver. Mais une grande quantité était brûlée sans en retirer une quelconque valorisation, ou répandue dans ou sur les sols. L’épandage sur les sols forestiers participe à leur protection en apportant une couche supplémentaire face aux poids des engins qui les érodent et les dégradent. L’enfouissement des écorces, permet la revitalisation des sols, entre autres, par, la dégradation des lignines et donc un « recyclage » du carbone qu’elles contiennent dans de nouveaux arbres. Toutefois, il présente aussi l’inconvénient de participer à la contamination des eaux souterraines en laissant les divers constituants chimiques des écorces, se dégrader et s’accumuler (CHARBONNEAU 1990). Dans ces conditions, il est justifié de trouver de nouvelles voies de valorisation de ces écorces.
Le bioraffinage forestier ou du bois est une piste qui permettrait de valoriser les écorces. Dans les années 1990, les notions de chimie associées au bois faisaient référence aux méthodes de mise en pâte papetière et dans une plus faible mesure, au fait de trouver une utilité aux lignines produites lors de la récupération de la pâte à papier. Aujourd’hui, le bioraffinage forestier se décline dans une recherche de valeur ajoutée de tous les composants chimiques des co-produits industriels. Ainsi avant de bruler ou d’enfouir les écorces, il serait souhaitable de trouver des applications aux constituant tels que les lignines comme source d’adhésifs ou dans d’autres secteurs destinés aux matériaux composites.
8
2. Les érables
2.1.
Le genre Acer
En phylogénie, les érables désignent les arbres et les arbustes du genre Acer appartenant à la famille des Sapindacées elle-même incluse dans l’ordre des Sapindales. Parmi ce genre, on compte près de 128 espèces dont la grande majorité se retrouve en Asie, mais aussi en Europe, en Amérique du Nord et au nord de l’Afrique. Seulement une espèce, l’Acer laurinum, est présente dans l’hémisphère sud.
Figure 2 : Aire de répartition du genre Acer (Wikimedia commons 2018)
D’un point de vue morphologique, l’arbre peut varier de 10 à 45 m de hauteur tandis que les arbustes ne dépassent pas les 10 m. Leur feuillage est principalement caduc, bien que quelques minorités asiatiques soient sempervirentes. De plus, les feuilles, dans une grande majorité, sont reconnaissables à leur forme palmée et nervurée. De même, les fruits appelés samares sont caractéristiques de l’espèce. Toujours regroupées par deux, en disamare, ce fruit en forme d’hélice est transporté par le vent et permet à l’arbre de se disperser sur de très grandes distances.
9
A l’échelle du Canada, les érables représentent environ 3.0% du volume total de bois, c’est-à-dire près de 1 402 560 m3 sur 47 320 480 m3 et en termes de surface, 8 681 280 ha sur 347 575 830 ha (NFI 2013).
Les utilisations des érables sont nombreuses et varient en fonction des espèces. Utilisés comme arbres d’ornement, le bois des érables présente une diversité d’utilisation. Les espèces dites « dures » comme l’érable à sucre en Amérique du Nord sont utilisées pour les matériels sportifs devant encaisser les chocs comme les quilles et allées de bowling, les queues de billard, mais surtout les battes de baseball. Pouvant être utilisés en construction, si la qualité le permet, les érables sont aussi très utilisés en ameublement pour leur aspect. Des singularités comme entre autres les loupes, les piqures de broussin, ou encore les flammes donnent un aspect très recherché au bois pour les besoins décoratifs des meubles mais aussi d’instrument de musique. De plus, en ce qui concerne les instruments de musique, le bois d’érable possède de bonnes propriétés acoustiques ce qui en fait un excellent choix pour ce type d’utilisation. Les érables sont aussi transformés dans les papèteries pour l’obtention de pâte à papier. Leurs fibres, résistant bien au séchage, produisent un papier épais, opaque, et de bonne qualité pour l’impression et l’écriture. Enfin, les érables sont particulièrement connus pour la production de sucre et de sirop. Trois essences d’érable sont principalement utilisées pour l’obtention de ces produits originaux, l’érable à sucre (Acer saccharum), l’érable rouge (Acer rubrum) et l’érable noir (Acer nigrum). Chaque année, entre l’hiver et le printemps les acériculteurs récoltent l’eau circulant dans l’arbre et qui précède la sève, la concentre par évaporation et produisent ainsi le sirop. Cette industrie est loin d’être anecdotique pour le pays. Le Canada est le premier producteur de sirop et de sucre d’érable avec 80 % de la production mondiale et le Québec avec 72% de la production canadienne engrange grâce à cette industrie près de 800 000 000 de dollars US chaque année (FPAQ 2018).
10
2.2.
L’érable rouge
L’érable rouge, (Acer rubrum), aussi connu au Canada sous le nom d’érable des plaines ou « soft maple » (érable tendre), est l’essence de bois la plus répandue dans le Nord-Est du continent Américain (ELBERT & LITTLE 1953). Ceci est dû au fait que cet arbre est capable de s’adapter et de pousser dans des conditions et des sols aux pH très différents, des marais au sols secs en passant par presque tous les types d’environnement entre ces deux extrêmes. Ainsi on le retrouve du Nord du Manitoba jusqu’à Terre-Neuve et au Sud du Texas jusqu’en Floride. En Europe, l’essence aurait été introduite au XVIIème siècle au Royaume-Uni en provenance de la Virginie, d’où le nom vernaculaire d’érable de Virginie usité en France.
Figure 3 : Aire de répartition de l'érable rouge en Amérique du Nord (Wikimedia commons 2013)
11
Facile à identifier, la répartition géographique de l’érable rouge a toutefois un impact sur son port et son aspect général d’où le fait qu’il soit l’érable présentant le plus de variations morphologiques (USDA 2011). Ainsi, l’arbre moyen atteint fréquemment les 25 m de haut et ne dépasse que rarement les 40 m (Northern Ontario Plant Database 2018) et les 1 m de diamètre bien que certains individus puissent atteindre les 2 m s’ils ne font face à aucune compétition. L’absence de compétition conduit aussi l’arbre à développer plus de branches que ceux en forêt et donc à présenter un port en forme de couronne.
De même, si rien ne vient perturber leur existence ils peuvent vivre jusqu’à 300 ans, alors que la moyenne se situe plus entre 100 et 200 ans. Leurs feuilles, caduques, font environ 10 cm de long comme de large et sont disposées en opposition sur la tige. Comme évoqué précédemment, la nature du sol a un impact sur l’arbre qui se traduit également sur leur couleur. Quant au printemps et en été les feuilles, lobées, sont vert clair sur leur face supérieure et blanche sur la face inférieure, elles prennent une coloration plus rouge que jaune-orangée si l’arbre est planté dans un sol plus humide que sec.
Les arbres, comme leurs fleurs, rouges, sont soit mâles soit femelles mais des exceptions sont possibles. Ainsi certains arbres sont monoïques, d’autres dioïques avec des fleurs mâles et femelles portées sur la même inflorescence ou non. Certains individus, selon l’environnement, sont même capables de changer de sexe, de mâle à femelle et inversement mais aussi d’hermaphrodite à mâle ou femelle seulement (WALTERS & YAWNEY 1990). Les fleurs d’érable rouge font partie des premières à s’ouvrir au printemps et produisent par la suite les fruits caractéristiques du genre, les samares, plus ou moins longs et lourds en fonction de l’écologie de leurs porteurs. En ce qui concerne l’écorce, celle-ci est d’apparence grise et lisse sur les jeunes et se craquèle en s’assombrissant avec l’âge. Ces variations de morphologie des érables rouge en font de bons arbres d’ornement, mais leur bois leur donne aussi toute une gamme d’utilisation. Celui-ci, est considéré comme « tendre » par rapport au bois d’érable à sucre lui considéré comme « dur », et son aspect, comme pour la morphologie de l’arbre varie en fonction de son environnement. L’aubier est généralement grisâtre et peut être plus ou moins sombre avec des mouchetures naturelles. Le duramen, quant à lui, peut fluctuer d’un rouge foncé à un rouge clair mais est bien démarqué de l’aubier. Le bois dans son ensemble présente un grain et une texture fine.
12
Mécaniquement, l’érable rouge est moins résistant que les érables dits durs et donc n’est pas recommandé pour des utilisations de plancher ou de plan de travail. Toutefois, il se prête très bien aux utilisations ou la solidité n’est pas le premier besoin comme les menuiseries, meubles où portes par exemple, et les décors comme les moulures et les tournages (American hardwood export council 2018). Son bois est aussi usité comme bois de chauffage même si on lui préfèrera des essences plus calorifiques. Enfin l’érable rouge est utilisé dans la production de sirop et de sucre d’érable bien que l’érable à sucre et l’érable noir lui soit préféré car leur saison de récolte est plus longue.
13
2.3.
L’érable à sucre
Acer saccharum, plus connu sous le nom d’érable à sucre ou de « hard maple », en référence à sa dureté, est une essence de bois surtout connue pour être la source principale de sirop d’érable. Moins répandu l’érable rouge, l’érable à sucre se retrouve au Canada du Manitoba jusqu’en Nouvelle-Ecosse et aux Etats-Unis du Missouri à la Caroline du nord en passant par le Tennessee. Préférant les climats frais, il s’accommode néanmoins lui aussi de la plupart des sols (GODMAN et al. 1990). Toutefois, c’est une essence sensible qui supporte peu la compétition dans les forêts matures et la pollution avec ses conséquences comme l’acidification des sols et les pluies acides ce qui a conduit l’arbre à disparaitre peu à peu des zones urbaines (The New York Times 1996).
Figure 4 : Aire de répartition de l'érable à sucre en Amérique du nord (Wikimedia commons 2013)
14
Généralement plus grand que l’érable rouge, l’érable à sucre atteint en moyenne les 35 m de haut (Northern Ontario Plant Database 2018) avec certains individus remarquables atteignant les 45 m. Il vit aussi plus longtemps que l’espèce décrite précédemment puisqu’un individu en bonne santé peut vivre jusqu’à 400 ans.
Les feuilles ont 5 lobes plus prononcés que ceux de l’érable rouge, sont aussi plus grandes, font environ 20 cm de largeur et tournent, elles aussi, au rouge à l’automne après être passées au jaune et à l’orange.
En ce qui concerne les fleurs, des différences notables sont à remarquer. Elles sont jaunes-vertes et portent à la fois les étamines et les pistils mais seulement un des sexes fonctionnent. De plus, alors que les fleurs d’érable rouge fleurissent avant l’arrivée des feuilles, celles d’érable à sucre s’ouvrent au même moment.
Le bois de son aubier est naturellement blanc crème mais peut prendre des teintes rouges-brunes. Le duramen se distingue plus difficilement de l’aubier que chez les érables tendres. Lui aussi rouge brun, il peut être plus ou moins clair en fonction des individus mais aussi de l’environnement. Comme pour l’érable rouge son grain est fin et droit avec des mouchetures naturelles mais des singularités peuvent aussi apparaître comme par exemple des zébrures.
La sensibilité de cet arbre à la pollution n’en fait plus un premier choix pour une utilisation d’ornement. Toutefois, son bois est dur et lourd avec de bonnes propriétés mécaniques. Il résiste aussi bien à l’abrasion et à la flexion. De fait, on l’utilisera pour des planchers de constructions individuelles mais aussi publiques où la circulation est intense comme les installations sportives. Il se prête aussi très bien, comme les bois plus tendres, à l’ameublement ou aux décorations (American hardwood export council 2018).
Néanmoins l’utilisation première de cette essence reste la production de sirop. Cette production se répartit entre le Canada et les Etats-Unis mais c’est dans la province du Québec qu’elle se concentre (FPAQ 2018). Cette industrie, dont les produits sont en hausse de consommation depuis quelques années, donne du travail à plus de 10 000 sociétés de productions dont plus de 6 000, rien que sur le territoire du Québec.
15
3. Les lignines
3.1.
Généralités
Les lignines, du latin lignum qui signifie bois, forment la troisième famille de biomolécules par ordre d’abondance sur Terre après la cellulose et l’hémicellulose (Biomass for energy: conference (C20) 1979). Elles sont apparues il y a 380 millions d’années chez les premières plantes vasculaires et les premiers arbres suite à une augmentation de la concentration en oxygène dans l’atmosphère et ont ainsi permis le développement des végétaux en milieu terrestre (MEYER-BERTHAUD et al. 1999).
Décrites dès 1813 par le chimiste suisse Augustin Pyramus de Candolle (DE CANDOLLE 1813), les liens des lignines avec la cellulose seront établis par le français Anselme Payen en 1839 avant qu’elles ne soient officiellement nommées en 1856 par Franz Ferdinand Schulze. Toutefois il faudra attendre près d’un siècle, en 1927, pour que leur structure de phénylpropane soit établie.
16
Les chimistes s’accordent difficilement sur la description de ces macromolécules polymères de polyphénols du fait de leur grande variabilité inter et intra espèce conditionnée par l’environnement, d’où la dénomination de lignines au pluriel et non au singulier.
Cependant, ce réseau tridimensionnel complexe pourrait se résumer à une unité de phénylpropane, dont les monomères seraient trois monolignols issus d’un acide aminé, la phénylalanine, ayant subi une cascade de réactions enzymatiques complexes.
L’alcool coumarylique, ou unité H pour hydroxyphényle
L’alcool coniférylique, ou unité G pour guaïacyle
L’alcool sinapylique, ou unité S pour syringyle
Figure 6 : Monomères des lignines
Troisième composant du bois derrière la cellulose et les hémicelluloses, les lignines sont au cœur du procédé de lignification des plantes et végétaux ligneux qui transforment les cellules de ces végétaux en bois. Les lignines en se déposant dans la lamelle moyenne, la paroi primaire et la couche S1 de la paroi secondaire, lient les fibres du bois les unes aux autres et assurent à ces plantes rigidité, et donc un port droit, une imperméabilité à l’eau, une résistance à l’implosion lors de la conduction de la sève brute et une résistance à la décomposition. Les cellules lignifiées se retrouvent principalement dans deux tissus végétaux : le sclérenchyme qui est un tissu de soutien et le xylème où se transportent les liquides comme l’eau, les sels minéraux ou la sève. Ainsi, si la cellulose confère au bois ses
17
propriétés reconnues en traction et compression, ce sont les lignines qui lui apportent sa rigidité en flexion.
3.2.
Production des lignines dans les milieux industriels
et leurs applications
Actuellement les lignines sont principalement produites, ou plutôt co-produites, dans les usines de pâtes et papiers. Celles-ci sont extraites du bois lors des mises en pâtes chimiques Kraft, sulfite, soda ou organosolv, et séparées de la cellulose qui est le produit recherché pour la fabrication des pâtes à papier. Les procédés sont maîtrisés et relativement simples. Il s’agit de « cuire » le bois dans des solutions chimiques de différentes natures : un mélange d’hydroxyde sodium (NaOH), de carbonate de sodium (NaCO3) et sulfure de sodium (Na2S) pour la cuisson Kraft, d’acide sulfureux (H2SO3) en
présence d’un excès d’anhydride sulfureux (SO2) libre et d’un sel bisulfite pour le procédé
au sulfite et d’un solvant organique accompagné d’un catalyseur acide pour la mise en pâte organosolv. Dans ces solutions, les lignines se solubilisent tandis que les polysaccharides insolubles, les fibres, restent en suspension. La modification du pH, accompagnée par de l’évaporation et de la filtration permettent de récupérer les lignines sous la forme d’un solide brun et de recycler les réactifs.
La récupération des lignines est un processus qui a longtemps été vu comme une opération parallèle à la production de cellulose dans les industries de pâtes et papiers. L’objectif de ces compagnies étant principalement d’obtenir une pâte la plus blanche possible, les mises en pâte chimiques courantes (Kraft et sulfites) solubilisent les lignines pour les retirer efficacement. Les lignines issues de ces techniques diffèrent alors chimiquement des lignines « naturelles » ou « natives » qui structurent les plantes, par la présence de souffre ou de glucides résiduels, et sont qualifiées de lignines « techniques » ou « industrielles ». Les lignines sont couramment brûlées pour permettre la production d’énergie et assurer le fonctionnement du site industriel. Elles présentent une forte teneur en carburant (26-28 MJ par tonne de lignine sèche) qui pourrait même concurrencer celle issue du charbon (LORA 2010 ; TOMANI et al. 2011). Cependant, de toutes les
18
applications possibles avec les lignines, l’énergie est celle qui a la plus faible valeur ajoutée (HOLLADAY et al. 2007).
Des études ont démontré un potentiel non négligeable de valorisation des lignines non brûlées. Sur les 100 000 000 de tonnes de lignines techniques produites chaque année par l’ensemble des acteurs, 70 000 000 de tonnes pourraient être valorisées autrement que pour de la production d’énergie mais seulement 2 % sont effectivement commercialisées pour, entre autres, la formulation d’agents dispersants, surfactants ou d’adhésifs (REUTERS 2017). De plus, le département de l’énergie des États-Unis d’Amérique a estimé que 225 000 000 de tonnes de lignines pourraient extraites des 1.3 milliard de tonnes de biomasse disponible sur son territoire (BERLIN & BALAKSHIN 2014). Sachant les lignines ont le potentiel de se substituer aux dérivés du pétrole tels que le xylène, le butadiène, le benzène, le toluène, l’éthylène ou encore le propylène, qui constituent un marché de 400 000 000 000 $US, des débouchés autres que la combustion doivent être envisagés (BERLIN & BALAKSHIN 2014).
Parmi ces débouchés, certains présentent une plus haute valeur ajoutée que la combustion et sont déjà une réalité. Des lignines se retrouvent alors déjà dans des aliments pour animaux, des liants et dispersants, des nouveaux matériaux composites dans les milieux de la construction, de l’agriculture et du textile. Les recherches scientifiques récentes s’intéressent également à la substitution par les lignines de nombreux dérivés du pétrole répartis en trois groupes de produits : les BTX (benzène, toluène et xylène, cités précédemment), les polymères et notamment les adhésifs et les fibres de carbone (LCF). En 2017 ce sont près de 2 000 brevets qui ont été déposés contenant le mot lignines contre un peu plus de 500 en 2008 (Organisation mondiale de la propriété intellectuelle 2018). Cette observation révèle une véritable concurrence des laboratoires et centres de recherche sur le sujet et en particulier celui des fibres de carbone car elles constituent le marché ayant le plus d’opportunités (BERLIN & BALAKSHIN 2014).
Cependant, l’utilisation des lignines techniques est encore limitée et cela en grande partie à cause des différentes modifications qu’elles ont subies lors de leur production et récupération. Comme évoqué précédemment, les principales méthodes de mise en pâte chimique se concentrent sur la pureté de la cellulose et non des lignines mais, alors que la quantité n’est pas un problème au vu des volumes produits, les applications des lignines
19
sont très dépendantes de leur qualité (BERLIN 2011 ; GOSSELINK et al. 2010 ; CHUNG & WASHBURN 2012). Ainsi, on retrouve dans les lignines issues des liqueurs, du soufre, des cendres, des glucides résiduels lesquels contaminent et modifient leurs fonctions chimiques. De plus, lors du processus de délignification les lignines natives subissent d’importantes modifications dans leurs structures moléculaires. L’hydrolyse des liaisons β-O-4, points faibles des lignines, réduit les chaînes moléculaires et donc le poids des lignines et entraine aussi l’augmentation des fonctions hydroxyles phénoliques. Cette réaction conduit à la diminution des groupes hydroxyles aliphatiques, des fractions aliphatiques oxygénées qui se saturent ou bien encore à l’augmentation des fonctions carbonyles. Toutefois, suite à ces phénomènes, les fragments de lignines peuvent se recondenser ou se repolymériser et former des chaînes encore plus longues avec un poids moléculaire élevé ce qui a pour effet de diminuer leur réactivité.
Alors, pour assurer mais aussi améliorer la qualité des lignines techniques, de nouvelles méthodes d’extraction émergent. Celles-ci, en plus de chercher à conserver la structure native des lignines, cherchent à s’inscrire dans les démarches du développement durable et du biorafinnage. Ces méthodes sont, d’une part, plus respectueuses de l’environnement, avec l’utilisation de solvant verts ou de techniques mécaniques et thermiques, et d’autre part, permettent de valoriser l’ensemble des composants du matériau traité. Parmi ces nouvelles méthodes d’extraction, on peut citer par exemple la mise en pâte organosolv qui comme pour les mises en pâte Kraft ou sulfite, plus répandues, isole les fibres du bois mais en limitant les dégradations des lignines par l’emploi d’un solvant organique ; le « steam explosion » ou vapocraquage qui utilise de la vapeur d’eau pour éclater la matière ligneuses et en isoler les constituants ; ou bien encore l’hydrolyse acide des lignines et ses variantes, utilisées notamment sur les résidus agricoles et ligneux en Europe de l’Est depuis les années 1930.
20
3.3.
Les lignines comme adhésifs
Comme évoqué précédemment, les applications possibles des lignines sont très dépendantes de leur qualité, c’est-à-dire de leur structure et/ou de la présence de résidus des mises en pâte. La connaissance de cette structure est d’ailleurs ce qui a décidé les premières utilisations des lignines, notamment en tant d’adhésifs pour les produits à base de bois, pour remplacer les dérivés du pétrole. La cause en est la structure phénolique des lignines qui leur permet de se substituer aux phénols dans la composition des résines, même si les applications industrielles restent encore très limitées. En effet la plupart de leurs utilisations visent à réduire le coût des résines PF et UF mais leur faible réactivité, due à la disparition d’un site réactif par rapport à une molécule de phénol (Figure 7), entraine une augmentation des temps de presse incompatible avec les besoins de productivité.
Toutefois depuis les vingt dernières années des lignines ont pu être utilisées dans des entreprises. Une première fois en faisant réagir des lignines pouvant être issues de procédés sulfite, Kraft, d’extrait organique ou d’hydrolyse vapeur, avec du formaldéhyde pour obtenir des lignines méthylées et ensuite ajouter ces lignines à une résine PF à raison de 20 à 30% du poids total (CALVE 1991). Cette application a pu se faire dans des fabriques nord-américaines de contreplaqués où le temps de presse n’est pas un facteur limitant de la production (CALVE 1991). Et une seconde fois, pour des panneaux de fibre haute densité dans différentes sociétés à partir du système Shen basé sur la coagulation et la réticulation de la lignine, issue de procédé sulfite, par un minéral acide fort et des sels d’aluminium comme catalyseurs (SHEN 1974 ; SHEN 1977 ; PIZZI 2006). Ce système basé sur des résines à base de lignines pures fut l’un des rares à réussir là où d’autres, comme le procédé Nimz (lignosulfate, provenant de procédé sulfite et peroxyde d’hydrogène) ont échoué à cause de temps de presse encore une fois trop longs ou de la corrosion des équipements (NIMZ & HITZE 1980).
Dans le même temps, le marché des adhésifs pour les produits à base de bois a été évalué comme devant atteindre plus de 5 milliards de dollars US en 2026 (Reuters 2017). Ainsi, le potentiel que représente l’utilisation des lignines comme base à la fabrication de ces résines présente un intérêt majeur pour les acteurs de la filière. Parmi toutes les
21
recherches qui ont été faites sur le sujet, sont évoquées ci-après les modifications des lignines, les agents de réticulations ainsi que l’utilisation d’enzymes.
Figure 7 : a) Structure d'un phénol avec ses trois sites réactifs 2-4-6 et structure d’une lignine avec un site réactif 3, b) Réticulation entre une lignine et du formaldéhyde
(HEMMILA et al. 2017)
3.3.1. Modifications des lignines
Parmi toutes les modifications pouvant être apportées aux lignines, les plus courantes sont la méthylolation (en présence de formaldéhyde) ou hydroxyméthylation, la phénolation et la déméthylation. La méthylolation est pour les résines PF la modification la plus intéressante, par son faible coût, mais aussi par son efficacité ; le système lignine méthylolée, PF et 4,4'-diisocyanate de diphénylméthylène (pMDI) énoncé précédemment a été reconnu comme une grande avancée dans le domaine des adhésifs à base de produit naturel (PIZZI 2006). Toutefois, des réactions parallèles non désirées comme la réaction des molécules de formaldéhyde entre elles (réactions de Cannizzaro) augmentent les émissions de formaldéhyde ce qui est un point négatif et non négligeable de cette formulation. De plus, le succès de la méthylation est très dépendant des paramètres de la mise en pâte, de la température et de la pression (BENAR et al. 1999).
22
La phénolation est une réaction qui se passe en deux étapes. Dans un premier temps, les lignines réagissent avec les molécules de phénol, puis, dans un second temps, les lignines phénolées sont combinées avec le formaldéhyde. Des articles font état d’un remplacement des phénols par des lignines organosolv phénolées jusqu’à 30% pour produire des panneaux de particules aux propriétés mécaniques comparables à ceux contenant des résines PF (CETIN & OZMEN 2002) et jusqu’à 50% pour la préparation d’adhésifs aux propriétés mécaniques semblables aux résines PF (ALAM KHAN et al. 2004).
La faible réactivité des lignines par rapport aux molécules de phénol s’explique par la présence additionnelle de groupements méthoxy sur les cycles aromatiques. La déméthylation des lignines permet d’augmenter les sites réactionnels.
3.3.2. Agents de réticulation
Dans le contexte de diminution voire de suppression du formaldéhyde des formulations des résines, des laboratoires ont expérimenté le remplacement total du PF par des lignines en combinaison avec des agents de réticulations. Ces molécules ou catalyseurs permettent de former des réseaux tridimensionnels avec d’autres molécules, telles que le glyoxal, un aldéhyde moins toxique mais moins réactif que le formaldéhyde, l’isocyanate, le pMDI ou les tannins, (EL MANSOURI et al. 2007 ; NAVARRETE et al. 2012). Ces réactions sont permises par la présence de groupements aliphatiques et hydroxyles sur les molécules de lignines et qui forment avec le pMDI ou l’isocyanate des fonctions uréthane. En 2007, El Mansouri et al. (EL MANSOURI et al. 2007) ont mis au point des adhésifs à partir de lignosulfates glyoxylées et du pMDI avec un ratio de 60/40. Les panneaux de particules formés avec cette résine ont passé avec succès les normes internationales
(European Norm EN 312-5). En 2012, Navarrete et al. (NAVARRETE et al. 2012)ont eux
aussi développé des panneaux ayant validé les standards de ces produits avec des résines de lignines glyoxylées Kraft et organosolv mélangées avec des tannins de mimosa pour un ratio de 40/60.
23
3.3.3. Activation enzymatique
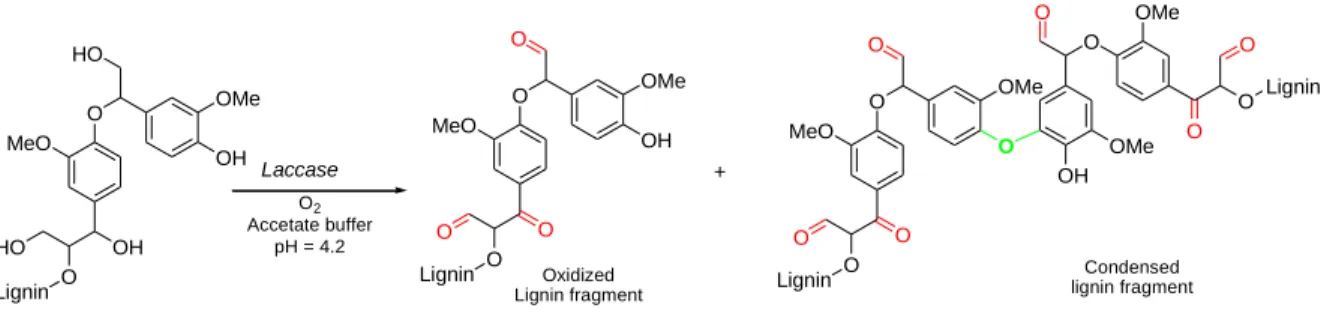
L’activation enzymatique des lignines est une formulation intéressante dans l’auto réticulation des lignines (STEWART 2008, FELBY et al. 2004). Plusieurs expérimentations rapportent une formation réussie de panneaux de fibres de type medium density fibreboard, MDF, avec des résines basées sur une activation enzymatique des lignines (NASIR et al. 2013 ; FELBY et al. 2004). Les enzymes utilisées pour ces réactions sont les laccases et les peroxidases qui sont deux enzymes naturelles produites notamment par la pourriture blanche des champignons mais aussi issues d’autres plantes, bactéries et animaux. Les champignons de la pourriture blanche sont responsables de la biodégradation du bois et de tous les matériaux lignocellulosiques. Ces enzymes oxydent les groupements phénoliques des lignines en phénoxy-radicaux, lesquelles sont alors capables de s’auto réticuler entre elles (Figure 8). La différence entre ces deux enzymes est que la première est activée par l’oxygène tandis que la seconde s’active en présence de peroxyde d’hydrogène. L’oxydation des fonctions alcool permet l’apparition de fonctions aldéhydes similaires au méthanal, qui compose la plupart des résines industrielles. Ces fonctions mettent en place des liaisons carbone-carbone entre les différentes particules de bois au sein d’un panneau, et sont à l’origine de l’efficacité de l’adhésif.
Figure 8 : Couplage de radicaux phénoxyl de lignines après traitement enzymatiques (WIDSTEN & KANDELBAUER 2008)
24
4. Mise en pâte organosolv
4.1.
Principe de la mise en pâte organosolv
L’utilisation de solvant organique pour la délignification du bois a été proposée dès 1931 par Kurt TAYENTHAL et Theodor KLEINERT (KLEINERT & TAYENTHAL 1931) mais le terme et le procédé organosolv n’ont été déposés par ce dernier qu’en 1968 (KLEINERT 1968). Les principaux avantages de cette cuisson sont entre autres de ne pas nécessiter l’imprégnation des copeaux par le solvant comme pour une cuisson Kraft. Mais aussi de permettre la récupération d’une lignine et d’extractibles de haute qualité et donc à haute valeur ajoutée ou encore de recycler les solvants organiques utilisés par distillation ce qui diminue la pollution des cours d’eau et le dégagement d’odeurs gênantes.
Le principe d’obtention d’une pâte organosolv est comparable dans les grandes lignes à celui d’une pâte Kraft. Il s’agit d’une cuisson à hautes température et pression de copeaux de bois dans un lessiveur où la lignine est séparée de la cellulose et des hémicelluloses par l’action de produits chimiques. Dans le cadre du procédé organosolv la température de cuisson peut varier de 80°C sous pression atmosphérique pour un solvant de type phénol, à 250 °C pour du butanol, toutefois, la gamme de température retenue pour cette étude est comprise entre 120 et 220°C (KLEINERT 1968). Les solvants organiques utilisés sont très nombreux et incluent entre autres l’acétone, le méthanol, l’éthanol, le butanol, l’éthylène glycol, l’acide formique ou bien encore l’acide acétique (Tableau 1), avec des concentrations variant de 40 à 100% et la présence ou non d’un catalyseur acide. Pour des considérations de processus, ces solvants sont presque toujours mélangés à de l’eau pour, diminuer la pression de vapeur et le pH qui entraine et précipite les hémicelluloses. Dans ces conditions, les liaisons éthers des lignines sont hydrolysées et celles-ci se solubilisent dans les solvants organiques où elles peuvent être isolées.
25
26
Aujourd’hui, le butanol, en retirant plus de lignine que la plupart des autres solvants et étant insoluble dans le l’eau ce qui facilite sa récupération, semble être le meilleur solvant pour ce type de cuisson, cependant son prix très élevé ne le rend pas compétitif et, dans les faits, on lui préfèrera l’éthanol pour justement son plus faible coût et sa simplicité de récupération.
La diversité des solvants, catalyseurs ou procédés utilisables ont divisé le procédé organosolv global en de nombreux sous-procédés dont certains exemples sont présentés dans le Tableau 2 ci-dessous.
Tableau 2 : Différentes mises en pâte organosolv et leur système de solvant (STEVANOVIC 2018)
Parmi ces exemples, on peut citer le procédé alcell dont une usine pilote avait été installée au Nouveau-Brunswick entre 1989 et 1996. Le site produisait une pâte jugée de meilleure qualité qu’une équivalente issue d’un procédé sulfite et des co-produits commercialisables dans un rendement économiquement viable (PYE & LORA 1991). Plus récemment, le système lignol exploité dans l’ouest canadien, fractionne la biomasse forestière en trois composés à haute valeur ajoutée à savoir une cellulose blanchie, une lignine pure et de l’éthanol cellulosique. Dans un contexte de disparition programmée des carburants issus de sources fossiles, les procédés organosolv pourraient se développer
27
rapidement pour assurer la production de biocarburant comme le bioéthanol accompagné par la récupération de lignine de haute qualité.
Dans le cadre de cette étude sur la caractérisation des lignines d’écorces d’érable rouge et d’érable à sucre dans la formulation d’adhésifs, un procédé organosolv a été utilisé pour réaliser l’extraction des lignines. Ce procédé mis au point par l’équipe de recherche du professeur Stevanovic utilise un mélange d’eau et d’éthanol à 95% en combinaison avec du chlorure de fer hexa hydraté (FeCl3) comme catalyseur précédé par une extraction à
l’éthanol-eau.
L’intérêt de la pré-extraction est de retirer les extractibles avant la mise en pâte pour prévenir les réactions de condensation entre ceux-ci et les lignines. Le taux de récupération de lignines est alors plus faible sur l’écorce que sur le bois après cuisson mais leur qualité en est augmentée ce qui permet de penser que le taux de lignines récupérées n’est pas faussé par la présence d’extractibles, plus abondants dans les écorces. Pour la mise en pâte,
le choix du catalyseur FeCl3 est basé sur deux phénomènes (Figure 9) qui ont pour objectifs
de préserver la structure native des lignines mais aussi leur qualité en sortie de délignification. D’une part, l’action de l’ion chlorure Cl- sur les liaisons hydrogène au sein
des glucides semble améliorer la rupture de la liaison lignines-glucides (ZHAO et al. 2013) et conduit ainsi à des lignines moins chargées en résidus de glucides. D’autre part, l’action de l’ion ferrique Fe3+ préviendrait la formation de quinone méthide et ultimement la
dégradation des lignines ce qui permet ainsi de conserver leur structure naturelle (GUILLON et al. 2001).
28
Figure 9 : Mécanisme proposée de la chélation Fe 3+ avec les fractions phénoliques actives des lignines durant le processus de délignification (KOUMBA YOYA &
29
5. Objectifs et hypothèse de travail
Après les résultats encourageants de la précédente étude du laboratoire sur les lignines d’écorce d’érable à sucre, l’hypothèse de travail est que, basé sur la littérature, les lignines organosolv d’écorce d’érable rouge se prêtent aussi à une application comme adhésifs, libre de formaldéhyde, pour des panneaux de particules de bois et que, éventuellement, l’une de ces lignines se prêtent mieux que l’autre à ces applications.
Afin de valider ces hypothèses, plusieurs objectifs de travail ont été fixés. Le premier est de déterminer, par différentes caractérisations chimiques normalisées, la quantité de lignines présente dans les deux écorces afin de déterminer le potentiel de production et de valorisation de celles-ci.
Par la suite, ces lignines seront récupérées par un procédé de mise en pâte organosolv breveté dont l’avantage est de conserver au mieux la structure native des lignines.
Une fois les lignines acquises, différentes analyses chimiques et physiques sont effectuées pour déterminer laquelle des deux lignines se prêtent le mieux à l’application comme adhésif.
Enfin, après avoir formulées différentes résines, des tests de flexion sont effectuées sur des panneaux de particules de bois assemblées avec ces lignines pour confirmer les hypothèses de départ et de conclure quant au potentiel d’utilisation des lignines d’écorces dans cette application.
30
31
1. Caractérisation des écorces d’érable rouge et
d’érable à sucre
Afin de déterminer le potentiel de récupération de lignines dans les écorces d’érable rouge et d’érable à sucre, il était important de faire une caractérisation de leurs différents constituants. Cette détermination d’indice chimique se pratique sur une matière broyée et tamisée et suit un ensemble de normes et de standards adaptés au matériel et aux dispositions du laboratoire.
1.1.
Calibration des écorces
Les échantillons d’écorces, après un premier broyage réalisé par le fournisseur LEVACO INC, sont lavés pour les débarrasser de différents contaminants tels que le sable, les feuilles ou le bois et rebroyées à l’aide d’un broyeur à marteau. Après avoir obtenu une matière plus fine, les écorces, une fois sèches, sont tamisées via un tamis à secousses afin de ne récupérer que celles dont la taille se situe entre 40 et 60 mesh soit 425 et 250 µm. Ces particules sont finalement placées dans un sac de polythène fermé pour permettre la stabilisation de l’humidité.
1.2.
Mesure de l’humidité
En chimie du bois, les résultats mesurés sont toujours exprimés en fonction de la masse anhydre de l’échantillon. C’est pourquoi avant chaque mesure d’indice il est essentiel de calculer l’humidité du matériau. La procédure est explicitée dans la norme ASTM D1107-96 Standard test method for ethanol-toluene solubility of wood (ASTM International. D1107-96 2013) et consiste à placer dans un creuset en verre taré, 2 g d’écorce placé dans une étuve à 105°C jusqu’à constance du poids. Dans le cadre de ce projet, cette étape a toujours été réalisée avant chaque détermination d’indices chimiques et en triplicata. L’humidité se calcule alors ainsi :
32
Équation 1 : Détermination du taux d’humidité
où H % : humidité des écorces en pourcentage (%),
Mh : masse humide des écorces en gramme (g), Mo : masse anhydre des écorces en gramme (g).
1.3.
Détermination de la quantité d’extractibles
En plus d’être exprimés sur la masse anhydre, les constituants de l’écorce sont aussi exprimés en pourcentage d’écorce extraite. Les extraits du bois comme de l’écorce sont un ensemble de molécules organiques diverses comprenant des polyphénols, des gommes, des résines, des acides gras ou bien encore des cires qui ne font pas partie de la structure des parois des cellules du bois comme la cellulose, les hémicelluloses ou les lignines, mais qui peuvent altérer les réactions chimiques de détermination de celles-ci. Leur mesure et retrait sont standardisés et se déroulent en deux temps.
Tout d’abord, les écorces sont extraites dans un appareil de soxhlet pendant 6 h dans 150 ml d’une solution d’éthanol-toluène (1 L – 427 ml). Après extraction, le solvant est évaporé et la masse d’extrait est pesée après avoir séché 24 h dans une étuve à 105°C. Cette extraction, conforme à la norme ASTM D1107-96, permet de retirer les molécules solubles au solvant apolaire comme les cires, les graisses, les résines ou les gommes.
Puis l’écorce extraite sèche est à nouveau extraite dans 100 ml d’hydroxyde de sodium à 1 % à ébullition pendant 1 h. L’écorce est alors filtrée et lavée à l’eau chaude (100 ml) puis à l’acide acétique 10 % (50 ml) avant d’être rincée une dernière fois à l’eau. Après avoir été séchée, la masse d’écorce est pesée. Par différence on obtient la masse d’extraits emportés par ce solvant polaire, et des glucides de faible masse moléculaire,