Développement d'un milieu sans sérum et d'un
procédé à grande échelle pour la prolifération de
cellules humaines précurseurs du muscle
Thèse
Victor Parent
Doctorat en Génie Chimique
Philosophiae doctor (Ph.D.)
Québec, Canada
© Victor Parent, 2017
Développement d'un milieu sans sérum défini et
d'un procédé à grande échelle pour la prolifération
de cellules humaines précurseurs du muscle
Thèse
Victor Parent
Sous la direction de :
Alain Garnier, directeur de recherche
Jacques P. Tremblay, codirecteur de recherche
iii
Résumé
La dystrophie musculaire de Duchenne (DMD) est une maladie génétique affectant un garçon sur 3500. Elle entraîne une dégénération progressive et irréversible des muscles. Actuellement, la maladie est incurable et aucune thérapie ne permet de traiter les patients de façon efficace et sécuritaire.
La thérapie cellulaire, qui consiste à injecter des cellules musculaires humaines saines, les myoblastes, dans les muscles des personnes atteintes de la DMD, a déjà donné des résultats cliniques prometteurs. Par contre, quelques problèmes entravent le développement de cette thérapie. Entre autre, le milieu de culture utilisé pour l’expansion des myoblastes contient du sérum fœtal bovin (FBS). Le FBS est un produit animal non défini pouvant être contaminé par des bactéries, des virus ou des prions. Les risques possibles pour la santé des patients peuvent entraver l'acceptation de la thérapie. Il est donc préférable de remplacer le FBS par un mélange d'additifs définis, notamment par des cytokines. De plus, les procédés de production actuels sont inadéquats pour répondre à la demande en cellules musculaires. Ce projet vise à élaborer un milieu de culture sans sérum pour la prolifération in vitro des cellules musculaires et à développer un procédé de production à grande échelle de ces cellules.
Pour développer un milieu sans sérum, une méthode en boucle a été utilisée. Celle-ci se divise en 3 étapes : a) monter une banque de facteurs potentiels en identifiant les récepteurs cellulaires par RT-PCR et par un criblage de la littérature, b) tester ces facteurs en culture en utilisant, entre autre, une planification statistique des expériences (DOE) permettant de vérifier les effets individuels et synergiques de ces additifs et c) ajouter les additifs générant une réponse bénéfique au milieu de culture. Cette boucle a été itérée jusqu'à ce que le nombre de facteurs testés soit suffisant pour que la réponse cellulaire avec le nouveau milieu soit comparable au milieu avec FBS. Pour atteindre l'objectif de mise à l’échelle, le projet s’est limité à la sélection de microporteurs permettant une adhésion efficace des myoblastes.
Suite à l'essai par DOE de 9 milieux de base et de 72 additifs, un milieu sans sérum, le LOBSFM, a été développé. Il s'agit, à notre connaissance, du seul milieu de culture sans sérum existant qui est aussi efficace que le milieu traditionnel pour la prolifération des myoblastes. Un brevet a été déposé pour protéger ce milieu. Il permet la prolifération spécifique des myoblastes (~80% myoblastes dans la culture, vérifié par marquage immunocytochimique) aussi efficacement que le milieu standard contenant 15% de FBS, durant au moins 60 jours de culture. De plus, les myoblastes cultivés dans le LOBSFM conservent leur capacité de fusionner et ainsi former des fibres musculaires. Pour ce qui est du procédé de culture, les microporteurs poreux Cytoline2™ ont permis d'obtenir une concentration cellulaire finale de 1,5E6 cell/mL, comparable à la culture en flacon statique. Les pores protègent les myoblastes contre les contraintes hydrodynamiques et permettent une récupération simple des cellules.
iv
Abstract
Duchenne muscular dystrophy (DMD) is a genetic disease affecting one boy out of 3500. It leads to progressive and irreversible muscle degeneration. Currently, there is no cure for this disease and no therapy allows an efficient and safe treatment.
Cell therapy consists in injecting healthy human muscle cells, myoblasts, into the muscles of DMD patients. Promising results have been obtained in clinical trials using this approach. However, some problems need to be overcome. Particularly, the original culture medium used to expand myoblasts contains Foetal Bovine Serum (FBS). FBS is an undefined product derived from animal, which can be contaminated with bacteria, viruses or prions. The possibility of harmful consequences for the patients hampers the acceptability of the therapy, so FBS must be replaced by a mixture of defined factors such as specific recombinant cytokines. Moreover, the production processes are currently inappropriate to meet the demand for muscle cells. Therefore, this project aims to develop a serum-free medium for the in vitro proliferation of muscle cells and a large-scale process for the production of those cells.
A multi-step method was used to develop the serum-free medium. It is divided into three main steps: a) to build a panel of potential factors from a screen of the literature followed by the detection of more than 100 receptors and autocrine factors using RT-PCR, b) to test those factors in culture using statistical design of experiment (DOE) allowing to verify individual and synergistic effects and c) to add the factors that generate beneficial response to the culture medium. Those steps are followed until a cellular response comparable to the culture in standard medium is obtained. To achieve the scale-up objective, the project was limited to the selection of microcarriers that allowed the proper adhesion of myoblasts.
The potential factors identified in the first stage, together with additional ones taken from the literature, formed a panel of 9 basal culture media and 72 additives that have been tested by means of DOE. At the end of this process, a serum-free medium, LOBSFM, was developed. To our best knowledge, it is the only existing efficient serum-free medium for myoblast proliferation and a patent has been obtained to protect its use. It allows a specific expansion of myoblasts (~80% myoblasts, verified by immunostaining) comparable to a standard medium containing 15% FBS over a 60-day culture period. Moreover, myoblasts kept their ability to form muscle fibers. Porous microcarriers Cytoline2 allowed a final cell concentration of 1.5E6 cells/mL, comparable to cell expansion in static culture plate. The pores protected the cells against mechanical stresses while the cell recovery remained easy.
v
Table des matières
RÉSUMÉ ... III ABSTRACT ... IV TABLE DES MATIÈRES ... V LISTE DES TABLEAUX ... XII LISTE DES FIGURES ... XV ABRÉVIATIONS ... XX ÉPIGRAPHE ... XXIII AVANT-PROPOS ... XXIV
CHAPITRE 1 : INTRODUCTION ... 1
CHAPITRE 2 : REVUE DE LITTÉRATURE ... 3
2.1. TISSU MUSCULAIRE ... 3
2.1.1. Anatomie musculaire ... 3
2.1.2. Myogenèse ... 5
2.1.2.1. Caractérisation des cellules myogéniques ...5
2.1.2.1.1. Facteurs de transcription ...5
2.1.2.1.2. Protéines ciblées pour les marquages ...7
2.1.2.1.3. Réparation musculaire ...9
2.2. DYSTROPHIE MUSCULAIRE ... 11
2.2.1. Dystrophie musculaire de Duchenne : caractéristiques et progression ... 11
2.2.2. Dystrophine ... 14 2.2.3. Dystrophie de Becker ... 15 2.2.4. Traitements ... 15 2.2.4.1. Généralités ...15 2.2.4.2. Thérapie cellulaire ...16 2.2.4.2.1. Généralités ...16
2.2.4.2.2. Défis de la thérapie cellulaire ...17
2.2.4.2.3. Cellules utilisées pour les transplantations ...18
2.2.4.2.3.1. Myoblastes ...18
2.2.4.2.3.2. Cellules souches ...19
2.2.4.2.4. Viabilité des cellules et contrôle des rejets de greffe ...21
2.2.4.2.5. Migration des myoblastes in vivo ...22
2.2.4.2.6. Résultats in vivo ...22
vi
2.2.4.3.1. Traitements pharmaceutiques ne visant pas la réexpression de la dystrophine ni de
l’utrophine...23
2.2.4.3.2. Traitements pharmaceutiques visant la ré-expression de la dystrophine ...25
2.2.4.4. Thérapies avec modifications génétiques ...25
2.2.4.4.1. Thérapie génique ...25
2.2.4.4.2. Sauts d’exons, CRISPR/Cas9 et méganucléases ...26
2.2.4.4.3. Surexpression de l’utrophine ...26
2.3. CULTURE CELLULAIRE ... 27
2.3.1. Généralités ... 27
2.3.2. Règlementation ... 28
2.3.3. Milieux de culture de base ... 29
2.3.4. Sérum ... 30
2.3.4.1. Problématique du sérum ...31
2.3.4.2. Milieux sans sérum ...32
2.3.4.3. Milieux sans sérum commerciaux ...34
2.3.4.4. Approches expérimentales ...34
2.3.5. Culture de myoblastes à grande échelle ... 35
2.3.5.1. Introduction ...35
2.3.5.2. Cultures statiques ...37
2.3.5.3. Lits garnis ...37
2.3.5.4. Flacons et bioréacteurs agités ...38
2.3.5.4.1. Microporteurs ...39
2.3.5.4.2. Vitesse d’agitation ...42
2.4. COMMUNICATION CELLULAIRE ... 42
2.4.1. Introduction ... 43
2.4.2. Récepteurs ... 44
2.4.2.1. Récepteurs tyrosine et serine/threonine kinase ...45
2.4.2.2. Récepteurs contenant une activité enzymatique intrinsèque ...47
2.4.3. Voies de signalisation ... 47
2.4.4. Cycle cellulaire ... 49
2.4.5. Cytokines et facteurs de croissance ... 50
2.4.5.1. Généralités, définitions et caractéristiques ...50
2.4.5.2. Cytokines et muscles ...52
2.4.5.3. Les systèmes immunitaire et endocrinien ...54
2.4.5.3.1. Les cytokines pro-inflammatoires ...55
2.4.5.3.1.1. Interleukines-1 (IL-1s) ...55
2.4.5.3.1.2. Facteur de nécrose tumorale (TNF) ...56
2.4.5.3.2. Facteurs anaboliques ...57
2.4.5.3.3. Interactions entre les cytokines pro-inflammatoires et l’IGF-1 ...59
vii
2.4.5.3.3.2. Voies de signalisation Wingless (Wnt) et Notch ...60
2.4.5.4. Cytokines protéines kinases ...61
2.4.5.4.1. Facteur de croissance épidermique (EGF)...61
2.4.5.4.2. Facteurs de croissance des fibroblastes (FGF) ...62
2.4.5.4.2.1. FGF-1 ...62
2.4.5.4.2.2. FGF-2 ...63
2.4.5.4.2.3. FGF-4 ...63
2.4.5.4.2.4. FGF-6 ...63
2.4.5.4.3. Follistatine ...63
2.4.5.4.4. Facteur de croissance hépatique (HGF) ...64
2.4.5.4.5. Facteur stimulant les colonies de macrophages (M-CSF) et le facteur stimulant la formation de colonies (CSF) ...64
2.4.5.4.6. Facteurs de croissance dérivés des plaquettes (PDGF) ...64
2.4.5.4.7. Facteurs de croissance transformant (TGF) et les protéines morphogénétiques osseuses (BMPs) ...65
2.4.5.4.7.1. TGF-β ...65
2.4.5.4.7.2. TGF-α ...66
2.4.5.4.7.3. Protéines morphogéniques osseuses (BMPs) ...66
2.4.5.4.8. Facteur de croissance des cellules endothéliales vasculaires (VEGF) ...66
2.4.5.5. Cytokines hématopoïétiques et Interleukines (IL) ...67
2.4.5.5.1. Interleukine-6 (IL-6) ...67
2.4.5.5.2. Facteur inhibiteur de leucémie (LIF) ...67
2.4.5.5.3. Érythropoïétine (EPO) ...68
2.4.5.6. Autres cytokines ...68
2.4.5.6.1. Sonic Hedgehog (SHH) ...68
2.4.6. Autres éléments d’un milieu de culture ... 69
2.4.6.1. Hormones ...69
2.4.6.2. Lipides ...70
2.4.6.3. Matrice extracellulaire (ECM) ...70
2.4.6.4. Autres protéines ...71
2.4.6.5. Additifs non définis : milieu conditionné aux macrophages (MCM) ...72
2.5. CONCLUSION DE LA REVUE DE LITTÉRATURE ... 77
CHAPITRE 3 : MATÉRIEL ET MÉTHODES ... 79
3.1. MATÉRIAUX ET ÉQUIPEMENTS ... 79
3.1.1. Milieu de culture ... 79
3.1.2. Cellules ... 84
3.1.3. Cytokines ... 84
3.1.4. Dosage de protéines totales Bradford ... 85
3.1.5. Gels électrophorèse ... 85
viii 3.1.7. Marquage ... 86 3.1.8. Microporteurs ... 86 3.1.9. RT-PCR ... 87 3.1.10. Autres produits ... 87 3.2. ÉQUIPEMENT ... 89 3.2.1. Centrifugeuse ... 89
3.2.2. Congélation des cellules ... 89
3.2.3. Cryostat pour couper les muscles de souris ... 89
3.2.4. Enceinte de confinement biologique ... 89
3.2.5. Incubateur ... 89
3.2.6. LC/MS ... 89
3.2.7. Lecteur multi-plaques ... 89
3.2.8. Matériaux de culture ... 89
3.2.9. Microscope à fluorescence inversé ... 90
3.2.10. Plaque agitatrice ... 90 3.2.11. Purificateur d’eau ... 90 3.2.12. Spectrophotomètre ... 90 3.2.13. Thermocycleur ... 91 3.2.14. Vortex... 91 3.3. MÉTHODES EXPÉRIMENTALES ... 91
3.3.1. Méthodes générales de culture ... 91
3.3.1.1. Méthode de digestion enzymatique d’une biopsie musculaire ...91
3.3.1.2. Méthode de culture des myoblastes en flacons statiques ou dans des plaques multi-puits ...92
3.3.1.3. Méthode de différentiation des myoblastes ...92
3.3.1.4. Méthode de détachement des cellules ...92
3.3.1.5. Méthode de congélation des cellules ...93
3.3.1.6. Méthode de décongélation des cellules ...93
3.3.1.7. Culture et activation des macrophages ...93
3.3.1.8. Fabrication du milieu de culture sans sérum ...94
3.3.2. Compte cellulaire ... 95
3.3.2.1. Méthode de compte cellulaire à l’hémacymètre ...95
3.3.2.2. Méthode de compte cellulaire indirect ...96
3.3.2.2.1. CyQUANTMD (Molecular Probes, C7026) ...96
3.3.2.2.2. XTT (MD Biosciences Inc., 409005) ...96
3.3.3. Marquage des cellules et des muscles ... 96
3.3.3.1. Marquage cellulaire de la desmine ou de la chaîne lourde de la myosine (pour une plaque 24 puits) ...97
ix 3.3.3.3. Marquage à l’hématoxyline-éosine ...98 3.3.3.4. Marquage au NKH-1 ...98 3.3.4. Fractionnement du sérum (FBS) ... 98 3.3.5. Biologie moléculaire ... 99 3.3.5.1. Purification de l’ARNm ...99
3.3.5.2. Transcriptase inverse et réaction en chaîne par polymérase (RT-PCR) ... 100
3.3.5.2.1. Transcriptase inverse (RT) ... 100
3.3.5.2.2. Réaction en chaîne par polymérase (PCR) ... 100
3.3.5.3. Gel d’agarose ... 101
3.3.5.3.1. Solution tampon TBE 5X (Tris-Acide Borique-EDTA) ... 101
3.3.6. Méthode de culture en flacons agités sur microporteurs ... 102
3.3.6.1. Inoculation ... 102
3.3.6.2. Trypsination des microporteurs ... 102
3.3.7. Plans statistiques d’expériences (DOE) et tests de prolifération... 102
CHAPITRE 4 : RESULTATS ... 107
4.1. CRIBLAGE DE MILIEUX DE CULTURE DE BASE ... 107
4.2. DETERMINATION DES RECEPTEURS CELLULAIRES PAR RT-PCR ... 110
4.3. CRIBLAGE DE FACTEURS EN CULTURE ... 114
4.3.1. Effets primaires d’une banque d’additifs ... 116
4.3.2. Plans d’expérience ... 125
4.3.2.1. DOE sur le bFGF, EGF, IGF-1, IGF-2 et HGF ... 125
4.3.2.2. DOE sur le FGF-4 et le FGF-9 ... 129
4.3.2.3. DOE sur les PDGF, TNFα et VEGF ... 130
4.3.2.4. DOE sur l’IL-1α, IL-1β, FGF-4 et IGF-1 ... 132
4.3.2.5. DOE sur IL-1α, IL-1β, bFGF et IGF-1 ... 133
4.3.2.6. DOE sur des additifs de la matrice extracellulaire (ECM) ... 134
4.3.3. Essais sur les IL-1 ... 136
4.3.3.1. Plans d’expériences avec les IL-1 ... 136
4.3.3.2. Exposition intermittente aux IL-1s ... 138
4.3.3.3. Effet des IL-1s sur l’expression du marqueur desmine ... 139
4.3.3.4. Effet des IL-1 sur la fusion des myoblastes ... 140
4.3.3.5. Effet de la concentration des IL-1 sur la fusion des myoblastes ... 142
4.3.3.6. Réversibilité de l’inhibition de la fusion des IL-1 ... 143
4.3.3.7. Effet des IL-1s sur les marqueurs myogénine et Myf5 ... 144
4.4. OPTIMISATION DES CONCENTRATIONS DES COMPOSANTS DU MILIEU DE CULTURE ... 145
4.4.1. Interleukines (IL-1α, IL-1β) ... 145
4.4.2. Essai de prolifération avec un mélange de cytokines aux concentrations réduites 147 4.5. TEST SUR LE MILIEU LOBSFM ... 149
x
4.5.1. Test de comparaison avec un milieu sans sérum commercial ... 149
4.5.2. Effet de la concentration cellulaire initiale ... 150
4.5.3. Effets des passages ... 151
4.5.4. Culture à long terme ... 152
4.6. ESSAIS DU LOBSMF PAR D’AUTRES LABORATOIRES ... 161
4.6.1. Genethon ... 161
4.6.2. The Biomedical Research Centre, University of British Columbia ... 164
4.7. MISE A L’ECHELLE ... 165
4.7.1. Sélection de microporteurs en condition statique ... 165
4.7.2. Sélection de microporteurs en condition agitée ... 166
CHAPITRE 5 : DISCUSSION ... 170
5.1. MÉTHODES DE CULTURE ... 170
5.1.1. Contrôler la variabilité et les erreurs expérimentales ... 170
5.1.2. Utilisation de différentes sources de myoblastes ... 171
5.1.3. Comptes cellulaires ... 171
5.1.4. Conditions générales ... 172
5.1.5. Détection de l’expression des récepteurs et cytokines autocrines par RT-PCR ... 174
5.1.6. Approche expérimentale pour tester les facteurs ... 174
5.2 SÉLECTION DU MILIEU DE BASE ... 176
5.3 EFFETS DES ADDITIFS ... 177
5.3.1 Cocktail d’additifs de base ... 177
5.3.2 Cytokines ... 178
5.3.2.1 Interleukines-1 (IL-1α et IL-1β) ... 178
5.3.2.2 IGF-1 ... 179
5.3.2.3 Facteurs de croissance des fibroblastes (FGFs) ... 180
5.3.2.4 Facteur de croissance épidermique (EGF) ... 181
5.3.3 Autres... 182
5.3.3.1 B27 ... 182
5.3.3.2 Facteurs d’adhésion ... 182
5.3.3.3 Albumine bovine (BSA) ... 183
5.3.3.4 Insuline, transferrine et sélénium (ITS) ... 183
5.3.3.5 Dexamethasone ... 184
5.4 UTILISATION DE PRODUITS CONFORMES POUR LA THÉRAPIE CELLULAIRE ... 184
5.4.1.1 Analyse économique ... 187
5.4.1.1.1 Milieu de culture LOBSFM ... 187
5.4.1.1.2 Procédés de production ... 189
5.5 MISE À L’ÉCHELLE ... 193
xi
5.7 MILIEU LOBSFM ... 195
5.8 RECOMMANDATIONS ET ESSAIS FUTURS ... 199
CHAPITRE 6 : CONCLUSION ... 204 CHAPITRE 7 : BIBLIOGRAPHIE ... 206 CHAPITRE 8 : ANNEXES ... 224 8.1 RÉCEPTEURS ... 224 8.2 MÉTHODE CYQUANTMD ... 226 8.3 EXEMPLES DE CALCULS ... 226
8.3.1 Comparaison des logiciels d’analyse des plans d’expérience ... 226
8.3.2 Méthode d’analyse des plans d’expériences avec Excel ... 229
8.3.3 Additifs testés individuellement ... 235
8.3.4 Autres équations utilisées ... 237
8.4 STRATÉGIE DE CHANGEMENT DE MILIEU ... 237
8.5 ARTICLE PUBLIÉ DANS LE JOURNAL CANADIEN DE GÉNIE CHIMIQUE (20 AOÛT 2016) ... 238
xii
Liste des tableaux
Tableau 1 : Cellules souches en essais chez les animaux (Cossu et Sampaolesi, 2007) ... 20
Tableau 2 : Comparaison du coût de protéines recombinantes et purifiées à partir de plasma sanguin par litre de milieu de culture (prix valide en 2014). ... 27
Tableau 3 : Concentrations des différents composés dans le FBS (source : Hyclone SH30541). ... 31
Tableau 4 : Caractéristiques des systèmes de production cellulaire (Boudreault, 2001). ... 36
Tableau 5 : Exemples de microporteurs disponibles commercialement: poreux (A) et pleins (B) (Davis, 2002). ... 41
Tableau 6: Exemples des 6 grandes familles de récepteurs ... 45
Tableau 7 : Fonctions des principales protéines dans le milieu de culture. ... 72
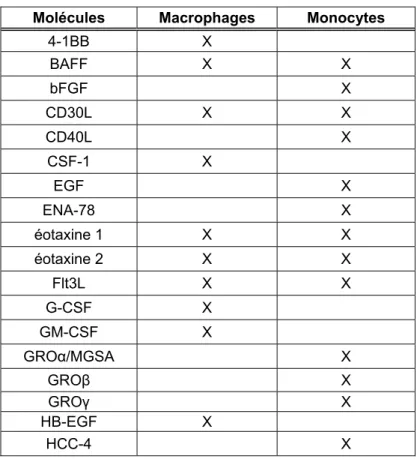
Tableau 8 : Molécules sécrétées par les monocytes/macrophages (Rappolee, Mark et al., 1988; Massimino, Rapizzi et al., 1997; Fitzgerald, O'Neill et al., 2001) ... 73
Tableau 9 : Résumé des effets de certaines molécules sur les myoblastes. ... 74
Tableau 10: Compositions des milieux de base Ham’s F12 (Invitrogen), RPMI1640 (Invitrogen) et MCDB120 (Ham, St-Clair et al., 1988). ... 80
Tableau 11 : Supplément de Ham (Ham, St Clair et al., 1988). ... 82
Tableau 12: Composants du B27 (Invitrogen 12587-010). ... 83
Tableau 13: Composition du N2 (Invitrogen 17502-048). ... 83
Tableau 14: Composition de l’ITS (Invitrogen 41400-045). ... 83
Tableau 15: Milieu de culture pour macrophages. Le LPS est ajouté seulement pour activer les macrophages. ... 83
Tableau 16 : Exemple de plan fractionné 25-1, de résolution V, 16 expériences sont nécessaires (1=composé présent dans le milieu de culture, -1=absent). Ce type de plan permet de déterminer les effets primaires et d’interactions à 2 facteurs. Les interactions supérieures sont supposés négligeables. ...103
Tableau 17: Liste des milieux de culture de base criblés. ...107
Tableau 18: Caractéristiques des oligonucléotides utilisés. ...110
Tableau 19 : Liste des 50 gènes détectés par RT-PCR, avec une indication de leur niveau d’expression dans les myoblastes. ...114
Tableau 20 : Composition du SFMD et concentrations des facteurs testés. ...117
Tableau 21 : Analyse de variance avec les facteurs significatifs positifs (verts) et négatifs (rouge) sur la croissance cellulaire (n=2). 119 Tableau 22: Concentrations des composants du milieu SFMD-V1 et des facteurs testés. ...119
Tableau 23 : Facteurs avec effets significatifs négatifs (rouges) et positifs (verts) sur la croissance cellulaire en comparaison avec le SFMD (jaune), n=2. ...120
xiii Tableau 25 : Les facteurs avec des effets significatifs négatifs (rouges) et positifs (verts) au
cours de deux expériences. ...123
Tableau 26: Concentraitons des composants du milieu de culture SFMD-V3. ...124
Tableau 27 : Facteurs avec effets significatifs négatifs (rouges) et positifs (verts) sur la croissance cellulaire en comparaison avec le LOBSFM, n=2. ...125
Tableau 28 : Concentrations des composants du SFMD-V4 et des cytokines testées. ...125
Tableau 29: Plan factoriel 25-1 pour bFGF, EGF, IGF-1, IGF-2 et HGF. ...126
Tableau 30: bFGF, EGF, IGF-1, IGF-2 et HGF : Coefficients de régression significatifs, p-value, effets par rapport à la moyenne de chaque effets significatifs, et vérification de la validité du modèle (F), n=3. ...128
Tableau 31 : Concentrations des composants du milieu SFMD-V5 et des cytokines testées. ...129
Tableau 32 : Effets individuels et d’interactions du FGF-4 et FGF-9 en plan complet 22, n=2. ...130
Tableau 33: Concentrations des composants du milieu SFMD-V6 et des cytokines testées. ...130
Tableau 34 : Plan factoriel 25-1 pour PDGF-AA, PDGF-AB, PDGF-BB, TNFα et VEGF. ...131
Tableau 35 : Effets individuels et d’interactions de PDGF, TNFα et VEGF en plan fractionné 2 5-1, n=3. ...131
Tableau 36: Concentration des composants du milieu SFMD-V7 et des cytokines testées...132
Tableau 37: Effets individuels et d’interactions des IL-1α, IL-1β, FGF-4 et IGF-1 en plan complet 24, n=2. 133 Tableau 38: Concentrations des composants du milieu SFMD-V8 et des cytokines testées. ...134
Tableau 39 : Effets individuels et d’interactions de bFGF, IGF-1, IL-1α et IL-1β en plan complet 24, comptes à l’hémacymètre. ...134
Tableau 40 : Concentrations des composants du milieu SFMD-V9 et des cytokines testées. ...135
Tableau 41 : Expérience #1 : Coefficients de régression significatifs, p-value et effets par rapport à la moyenne de chaque effet significatifs. Les comptes sont faits au CyQuantMD, n=3. ...135
Tableau 42 : Expérience #2 : Coefficients de régression significatifs, p-value et effets par rapport à la moyenne de chaque effet significatifs, les comptes sont fait à l’hémacymètre, n=2. ...136
Tableau 43: Concentrations des composants du SFMD-V10 et des cytokines testées. ...136
Tableau 44: Effets primaires et d’interactions entre l’IL-1α et l’IL-1β (correspond à la Figure 35A). ...138
Tableau 45: Effets primaires et d’interactions entre l’IL-1α et l’IL-1β (correspond à la Figure 35B). ...138
Tableau 46: Composition du SFMD-V11 et les concentrations facteurs testés. ...146
Tableau 47 : Composition des milieux de cultures testés. ...148
xiv Tableau 49: Facteurs avec effets significatifs négatifs (rouges) et positifs (verts) sur la
croissance cellulaire en comparaison avec le LOBSFM, n=2. ...150
Tableau 50: Compositions du LOBSFM. ...153
Tableau 51 : Pourcentage et nombre de cellules positives à la desmine avant et après une exposition de 48 heures dans un milieu de fusion. ...158
Tableau 52 : Catégories de risques et coûts de certaines composantes du LOBSFM. ...186
Tableau 53 : Détails des coûts pour la fabrication du milieu de culture LOBSFM ...188
Tableau 54: Coûts des différents systèmes de culture pour la production de 3x1010 myoblastes .192 Tableau 55 : Tableau de caractéristiques des récepteurs. ...224
Tableau 56 : Coefficients de régression et p-values calculés avec le logiciel SAS et par Excel. ...226
Tableau 57 : Analyse des résidus du modèle développé avec le logiciel SAS et Excel. ...227
Tableau 58 : Plage des Y représentant le nombre de cellules totales. ...230
Tableau 59 : Plage des X représentant le plan d’expérience ...231
Tableau 60 : Tableau des résultats de la régression, avec les facteurs non-significatifs (rouges) et ceux significatifs (sans couleur) ...232
Tableau 61 : Tableau des résultats de la deuxième régression. ...232
Tableau 62 : Paramètres statistiques obtenues à partir de la régression. ...234
xv
Liste des figures
Figure 1: Coupe transversale d’un muscle squelettique (Koesterer). ... 4
Figure 2: Expression des MRF selon le stade de différentiation des cellules myogéniques, panneau A (Rudnicki, Le Grand et al., 2008), et expression des MRF dans les cellules satellites, panneau B (Yin, Price et al., 2013). ... 6
Figure 3: Étapes de différentiation des cellules compromises dans la lignée myogénique et les marqueurs associés (panneaux A et B), ainsi que la localisation des marqueurs des cellules satellites (panneau C – exemple d’une cellule satellite). Sources: A) (Hawke et Garry, 2001) B) (Deasy, Jankowski et al., 2001), C) (Yin, Price et al., 2013). ... 9
Figure 4: Processus de réparation des fibres musculaires endommagées (Hawke et Garry, 2001). ... 11
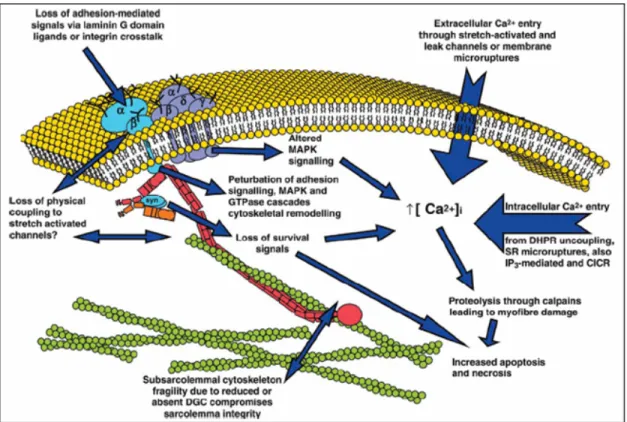
Figure 5: Évènements menant à l’augmentation de calcium intracellulaire et ses conséquences (Batchelor et Winder, 2006). ... 13
Figure 6: La structure et les principales composantes de la dystrophine (Voisin et de la Porte, 2004). ... 14
Figure 7: Étapes de la thérapie cellulaire: de la biopsie à la greffe (Labreque et Bouchard, 1991) . 17
Figure 8 : Provenance des cellules potentielles pour la thérapie cellulaire (Farini, Razini et al., 2009). ... 20
Figure 9: Composition sommaire du sérum (Tirumalai, Chan et al., 2003). ... 31
Figure 10: Méthode suggérée afin de formuler un milieu sans sérum (Zimmerman, Vierck et al., 2000). ... 33
Figure 11: Procédés de culture cellulaire, A) bouteilles roulantes (Integra Biosciences 2010), B) plaques multi-puits (VWR 2010), C) bioréacteur agité (Lab A. Garnier 2009), D) plaques multi-étages (Corning 2008), E) T-flask (The Research Enterprise 2010) et F) fibres creuses (MembPure 2007) ... 36
Figure 12: Exemples de spinner flasks, avec différents types d’agitateurs (Bellco 2010) ... 38
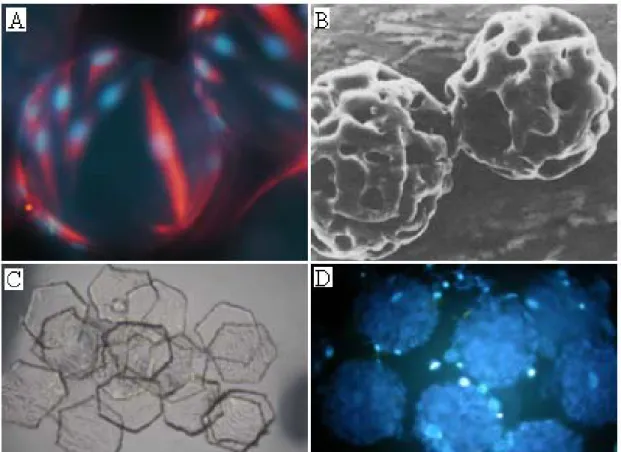
Figure 13: Exemples de microporteurs A) Microporteur plein en dextran Cytodex 1MD (GE
Healthcare) couvert de myoblastes marqués à la desmine (rouge) et au Dapi (bleu) (Lab. A. Garnier 2007), B) microporteur poreux en gélatine Cultispher-GMD (Percell Biolytica), C)
Microhex-2DMD (Nunc) en polystyrène (Lab. A. Garnier 2007) et D) microporteur poreux
Cytopore 1TM (GE Healthcare) en cellulose avec un traitement de surface au DEAE,
cellules marqué au Dapi (bleu) (Lab. A. Garnier 2007). ... 40
Figure 14: Illustration des principes de communications entre les cellules : autocrine (bleu), paracrine (vert) et endocrine (rouge) (V.Parent 2008). ... 44
Figure 15: Le facteur de croissance se lie et induit la dimérisation et l’autophosphorylation du récepteur et une cascade de réactions s’ensuit (Cooper et Hausman, 2007). ... 46
xvi Figure 16: Plan sommaire des cascades de signalisation induites par différents ligands
(Hanahan et Weinberg, 2000). ... 49
Figure 17: A) Le cycle cellulaire complet (Lebart et Mariani, 2004) et B) Le signal du mitogène libère le complexe cyclineD/cdk4 de son inhibiteur p16 (Cip/Kip sur le schéma) (Sherr et Roberts, 1999). ... 50
Figure 18: A) Les principales cytokines qui affectent les muscles ainsi que les cellules émettrices (Hawke et Garry, 2001) et B) les effets des cytokines sur les cellules musculaires (Charge et Rudnicki, 2004). ... 53
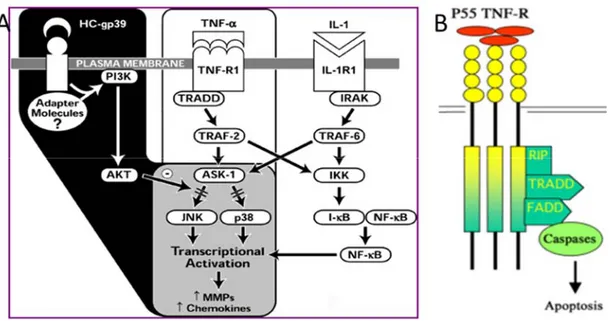
Figure 19: Voies de signalisation induites par le TNF et l’IL-1. : A) MAPK (Ling et Recklies, 2004) et B) Caspases (Waterston et Bower, 2004). ... 54
Figure 20: Voies de signalisation induites par les IGFs (Ader, 2007). ... 59
Figure 21: Schéma simplifié des actions des cytokines pro-inflammatoires et anaboliques (carrés roses) sur la différentiation, la dédifférenciation et la prolifération des myoblastes humains. Les molécules encerclées font parties des MRFs, les carrés foncés indiquent les protéines d’ancrages et les voies de signalisation ou de leurs intermédiaires, les lignes rouges représentent la répression d’une molécule alors que les flèches noires indiquent l’activation ou la production d’un signal (V. Parent). ... 61
Figure 22: Le graphique de probabilité normale montre des points situés sur une droite autour de la moyenne (carrés roses) qui servent à déterminer la variance. La variance est utilisée pour déterminer si les points aux extrémités qui sortent de la droite (losanges bleus) sont significatifs. ...105
Figure 23 : Graphique de résidus standardisés en fonction de la valeur estimée. Les résultats montrés ont été calculé avec SAS (losanges bleus) et Excel (carrés rouges) ...106
Figure 24: Compte cellulaire évalué selon la méthode XTT en fonction du temps avec 5 milieux différents, à 15 % (lignes pointillées) et 2 % (lignes pleines) de FBS (n=2). ...108
Figure 25: Concentration de myoblastes en fonction du temps mesuré par un compte à l'hémacymètre dans des milieux avec 2% FBS (n=2). ...109
Figure 26: Culture de myoblastes BB13M dans les milieux RPMI/F12/MCDB120 (A), RPMI/F12 (B) et RPMI (C) après 6 jours de culture. Les photos sont prisent avec un grossissement de 20X. ...110
Figure 27 : Amplicons des gènes testés ayant migré sur un gel d’agarose, illustrant l'échelle d'intensité approximative utilisée. La taille des amplicons est déterminée en comparant avec les échelles de masse moléculaire aux deux extrémités du gel. ...114
Figure 28 : Banque de composés testés, organisés par famille de composés ...115
Figure 29 : Comptes à l’hémacymètre en plaques 6 puits sur 8 jours de culture à n=2 (A), % de cellules desmine+ (%desmine+ indiqué au-dessus des colonnes du graphique) dans les différents milieux à 20 jours de culture à n=2 (B). ...118
xvii Figure 31 : Test de prolifération sur des additifs potentiels avec des comptes au CyQuantMD.
Les graphiques A) et B) font partie de la même série d’expérience (expérience 1), n=3. ...122
Figure 32: Résultats de prolifération sous différentes conditions en plaques 6 puits, n=2. ...124
Figure 33 : Fluorescence en fonction du temps pour les 17 milieux de culture du plan factoriel et du milieu standard (MCDB120+15%FBS), n=3. ...127
Figure 34: Les effets primaires de l’EGF, du bFGF et de l’IGF-1 en fonction du temps. ...129
Figure 35: Effets de l’IL-1α et l’IL-1β: A) et B) DOE complet avec les IL-1s (comptes à l’hémacymètre, n=2). Les photos montrent les myoblastes dans le milieu sans interleukines-1 (C) et dans les milieux contenant des IL-1 (D), photos prisent au jour 16 de l’expérience 1. Les photos sont prisent avec un grossissement de 20X. ...137
Figure 36 : Stimulation des myoblastes avec les IL-1s pendant 1 heure (X verts) et 6 heures (triangles bleus), n=2...139
Figure 37: Marquage à la desmine (rouge) et au Dapi (bleu) dans le milieu LOBSFM avec et sans IL-1s, après 15 jours de culture. Les photos sont prisent avec un grossissement de 20X. ...140
Figure 38: Marquage à la chaîne lourde de myosine après 4 jours dans un milieu de fusion, le contrôle positif consiste en du RPMI/F12/MCDB120+ITS, A) pourcentage total de cellules positives à la chaîne lourde de myosine (MHC+) et B) nombre de noyaux par fibre. ...141
Figure 39: Cellules gardées à confluence pendant 4 jours dans un milieu de différentiation (RPMI/F12/MCDB120+ITS) traitées avec A) 10 ng/mL IL-1α, B) 10 ng/mL IL-1β, C) contrôle positif, et D) 10 ng/mL EGF. Les chaînes lourdes de myosine sont marquées avec du MF20 (vert) et les noyaux au Dapi (bleu). Les photos sont prisent avec un grossissement de 20X. 142
Figure 40: Marquage au MF20 pour détecter la MHC et déterminer l’effet des IL-1 sur la fusion des myoblastes, pour des concentrations de 0 à 100 ng/mL. Les photos sont prisent avec un grossissement de 20X. ...143
Figure 41: Myoblastes laissés à confluence dans un milieu de fusion additionné 1α et d’IL-1β (10 ng/mL de chaque) pendant 48 heures (A), puis le milieu est changé pour du milieu de fusion sans IL-1 pendant 24 heures (B) et pendant 72 heures (C). Les photos sont prisent avec un grossissement de 20X. ...144
Figure 42 : Western Blot pour la myogénine et le Myf5 pour A) contrôle positif avec huMPC différenciés, B) huMPC en phase proliférative avec IL-1β, C) et D) huMPC dans le milieu de fusion suite au retraits de l’IL-1α et de l’IL-1β respectivement. ...145
Figure 43: Prolifération des H49 en fonction de la concentration de A) IL-1α et B) IL-1β à 5 jours (rose) et 7 jours (bleu), n=4. ...147
Figure 44 : Essais de prolifération sur un cocktail de cytokines à des concentrations réduites (cercles bleus) et sur le milieu de culture MCDB120 (triangles verts), n=2. ...148
Figure 45 : Comparaison du LOBSFM (cercles rouges) avec le milieu sans sérum commercial de Lonza (carrés roses), le milieu de base SkBMMD supplémenté des additifs du LOBSFM
xviii (triangles verts), le LOBSFM congelé et décongelé (étoiles mauves) et du standard (losanges bleus). ...150
Figure 46 : Expérience sur l’impact de la concentration cellulaire initiale (Losanges bleus - 5E3 cell/mL, Carrés rouges – 1E4 cell/mL, Triangles verts – 2E4 cell/mL) sur le temps de doublement (lignes pointillées), n=4. ...151
Figure 47 : Expérience sur l’effet des passages (Losanges bleus – P1, Carrés rouges – P2, Triangles verts – P3) sur le temps de doublement (lignes pointillées), n=2. ...152
Figure 48: Facteur d’expansion (exemple du calculs à la section 8.6) en fonction du temps (A) et temps de doublement en fonction du temps (B) avec des BB13M dans le LOBSFM (carrés, rouges – exp#1, rouges avec intérieurs jaunes – exp#2) et le standard (losanges, bleus –exp#1, bleus avec intérieurs jaunes -exp#2), les H49 dans le LOBSFM (cercles rouges) et le standard (cercles bleus), et les H51 dans le LOBSFM (triangles rouges) et le standard (triangles bleus). ...154
Figure 49: Graphiques % de cellules exprimant la desmine en fonction du temps pour différentes expériences. A) Cellules BB13 mois dans le milieu standard (losanges bleus) et LOBSFM (carrés rouges), B) Cellules homme-49 (cercles) et homme-51 (triangles) dans le milieu standard (bleu) et le LOBSFM (rouge). ...155
Figure 50: Marquages de BB13M à la desmine (Rouge), chaîne lourde de myosine (vert) et noyaux (bleu). Cellules ayant proliférées dans LOBSFM (A à F) et cellules ayant proliférées dans le standard (G à I). Certaines photos montrent des myoblastes transférés dans un milieu de fusion (D à H). Photos prisent après 1 semaine de culture (D et G), 2 semaines (A), 4 semaines (B, F, H) et 6 semaines (C, E, I). Les photos sont prisent avec un grossissement de 20X. ...156
Figure 51: Coloration à la desmine (rouge) et Dapi (bleu) sur des myoblastes BB13M ayant proliférés 70 jours dans le LOBSFM. Les photos sont prisent avec un grossissement de 20X. ...157
Figure 52: Marquage à la desmine avant (rouge) et après (vert) la fusion des myoblastes par rapport avec le nombre de cellules total (noir). Fusion effectuée après 25 jours de culture, n=2. ...158
Figure 53: Suivi des marqueurs myogéniques sur une période de 44 jours par RT-PCR. Le contrôle négatif est de l’ARN de macrophages. ...160
Figure 54 : Résultats de FACS sur des cellules H49 cultivées dans le milieu standard et le LOBSFM: A) graphique compte vs intensité, B) graphique compte vs intensité (Rose – standard, Jaune - LOBSFM), C) et D) sont des graphiques granulosité en fonction de la taille pour le standard et le LOBSFM respectivement. ...160
Figure 55 : Essais de prolifération sur des myoblastes dans 4 milieux différents. ...161
Figure 56 : Pourcentage de cellules CD56+ suite au FACS de cellules ayant proliférées dans le milieu standard, LOBSFM sans IL-1s et LOBSFM avec IL-1s. ...162
xix Figure 57 : Résultats de marquage avec un anticorps contre MyoD (rouge gauche), MHC (MF20 - vert centre) et noyaux (DAPI - bleu droite) dans le milieu standard (haut), LOBSFM sans IL-1s (centre) et LOBSFM avec IL-1s (bas). ...163
Figure 58 : Pourcentage de cellules positives CD56+ (bleu), MyoD+ (rouge) et Desmine+ (vert) dans le milieu standard, le LOBSFM sans IL-1s et le LOBSFM avec IL-1s. ...164
Figure 59 : Clonogénicité en fonction du nombre de cellules ensemencées (CD31-, CD45-, sca1-, et α7+) dans 3 milieux différents. ...165
Figure 60 : Essais de microporteurs non-poreux (Cytodex – A, B et C, 2D Microhex - F) et poreux (Cytoline – D et E) en conditions statiques dans le milieu standard. Les échelles sont estimées à partir des diamètres moyens des microporteurs. ...166
Figure 61 : Culture de myoblastes dans le milieu standard avec des microporteurs non-poreux Cytodex. Les échelles sont estimées à partir des diamètres moyens des microporteurs. ...167
Figure 62: Concentration en fonction du temps pour une culture en flacon agité dans le LOBSFM avec des microporteurs Cytodex, n=1. ...168
Figure 63 : Courbes de croissance des myoblastes en flacon agité avec les microporteurs poreux CytolineMD (carrés roses) et CytoporeMD (losanges bleus) ...169
Figure 64 : Nombre de cellules récupérées dans le surnageant après 3 jours de culture pour la culture. ...169
Figure 65 : Approche expérimentale proposée pour l’élaboration d’un milieu sans sérum (V. Parent, 2015). ...176
Figure 66 : Coûts par litre des constituants pour la fabrication du milieu sans sérum ...189
Figure 67 : Coûts selon les procédés pour générer 3x1010 myoblastes. Le coût pour le
bioréacteur agité est une moyenne de 3 options de microporteurs. ...192
Figure 68 : Concentration cellulaire en fonction de la fluorescence avec la méthode CyQuantMD. 226
Figure 69 : Graphique des résidus du modèle développé avec le logiciel SAS et Excel. ...229
Figure 70 : Données obtenues suite à la standardisation des résultats ...233
Figure 71 : Méthodes de changement de milieu : Série 1 : Changer tous le milieu à tous les jours, Série 2 : Changer 50 % du milieu à tous les jours, Série 3 : Changer tous le milieu à tous les 2 jours, Série 4 : Changer 50 % du milieu à tous les 2 jours, Série 5 : Changer tous le milieu à tous les 3 jours, Série 6 : Changer 50% du milieu à tous les 3 jours, Série 7 : Changer tous le milieu à tous les 4 jours, Série 8 : Changer 50 % du milieu à tous les 4 jours ...237
xx
Abréviations
ADN : ADNc : ADP : AON : ARN : ARNm : ATP : BMD : BMP: BPCC: BPF: BPL : BSA : CD : CNTF: CSF: CT-1: Da: DAPI : DMD : DMEM : DMSO : DO: DOE : ECM : EDTA : EGF : EPO: FACS: FAK: FBS: FGF : GCSF: GF: GLP: Acide DésoxyribonucléiqueAcide Désoxyribonucléique Complémentaire Adenosine Diphosphate
Antisens Oligoribonucléotides Acide Ribonucléique
Acide Ribonucléique Messager Adénosine Triphosphate Becker Muscle Dystrophy Bone Morphogenic Proteins
Bonnes Pratiques en Culture Cellulaire Bonnes Pratiques de Fabrication Bonnes Pratiques de Laboratoire Bovine Serum Albumin
Cluster of Differentiation Ciliary neurotrophic factor Colony Stimulating Factor Cardiotrophin-1
Dalton
4',6-diamidino-2-phenylindole Duchenne Muscular Dystrophy Dulbecco’s Modified Eagle Medium Dimethyl sulfoxide
Densité Optique Design Of Experiment Matrice Extracellulaire
Ethylenediaminetetraacetic acid Epidermal Growth Factor Erythropoïetin
Fluorescence-activated cell sorting Focal Adhesion Kinase
Fetal Bovine Serum Fibroblast Growth Factor
Granulocyte Colony Stimulating Factor Growth Factor
xxi GM-CSF: GMP: HARV: HB-EGF: HBSS: HGF: IGF : IGFBP: IL : ITS : JAK : LPA : LIF : LOBSFM : LPS : MACS: MAPK: MCDB: MCM : M-CSF: MEM: MHC : MMP: MPC : MRF : MSC : NCAM : NGF: NK: NKH1: NO: Pax : PBS: PDGF: PGE2: pH: RAGE:
Granulocyte-macrophage colony-stimulating factor Good Manufacturing Practices
High-Aspect Ratio Vessel
Heparin Binding Epidermal Growth Factor Hank's Buffered Salt Solution
Hepatocyte Growth Factor Insulin-Like Growth Factor
Insulin-Like Growth Factor Binding Protein Interleukin
Insulin Transferrin Selenium Januse Kinase
Lysophosphatidic acid Leukemia Inhibitory Factor
Laboratoire Optimisation des Bioprocédés Serum Free Medium Lipopolysaccharides
Magnetic-activated cell sorting Mitogen-activated protein kinases
Molecular, Cellular, and Developmental Biology Macrophage Conditionned Medium
Macrophage colony-stimulating factor Minimum Essential Medium Eagle Myosin Heavy Chain
Metalloprotéinases Matricielles Muscle Precursor Cells
Muscle Regulatory Factors Mesenchymal Stem Cells Neural Cell Adhesion Molecule Nerve Growth Factor
Natural Killer
Natural Killer Cell Marker Nitric Oxide
Paired box
Phosphate Buffer Saline
Platelet-Derived Growth Factors Prostaglandine E2
Potentiel Hydrogène
xxii RPMI : RTK: RT-PCR: SERCA: SHH : SMP: SOS: STAT: TFA: TGF: TNF: VEGF: Wnt:
Roswell Park Memorial Institute medium Récepteurs Tyrosine Kinase
Reverse transcription polymerase chain reaction Sarco/endoplasmic reticulum Ca2+-ATPase
Sonic HedgeHog
Skeletal Muscle Precursor Son Of Sevenless
Signal Transducer and Activator of Transcription Trifluoroacetic acid
Transforming Growth Factor Tumor Necrosis Factor
Vascular endothelial growth factor Wingless Factor
xxiii
Épigraphe
‘The disease is one of the most interesting and at the same time the most sad, of all those with which we have to deal: interesting on account of its peculiar features and mysterious nature; sad on account of our powerlessness to influence its course, except in a very slight degree, and on account of the conditions in which it occurs. It is a disease of early life and of early growth. Manifesting itself commonly at the transition from infancy to childhood, it develops with the child’s development, grows with his growth - so that every increase in stature means an increase in weakness, and each year takes him a step further on the road to a helpless infirmity, and in most cases to an early and inevitable death.’
Sir William Gower au sujet de la dystrophie musculaire de Duchenne (Mueller, Emery et al., 2003)
xxiv
Avant-propos
Mes travaux de recherche ont été effectués au département de génie chimique de l’Université Laval sous la direction du Dr. Alain Garnier et la codirection du Dr. Jacques P. Tremblay. Le projet a mené à la publication d’un article, au dépôt d’un brevet pour le milieu de culture et à l’octroi d’une licence à la compagnie Stem Cells Technologies pour la fabrication et la distribution du milieu LOBSFM développé.
L’article et le brevet ne font pas partie du corps principal de la thèse et sont insérés dans la section des Annexes. L’article s’intitule ‘Rational design of a serum-free culture medium for the growth of human myoblasts destined to cell therapy’, il a été publié dans le Journal Canadien de Génie Chimique le 20 août 2016. Victor Parent en est l’auteur principal, et les co-auteurs sont le Dr. Alain Garnier, Professeur au département de génie chimique de l’Université Laval, et le Dr. Jacques P. Tremblay, professeur titulaire au département d’anatomie-physiologie de l’Université Laval. Le brevet s’intitule ‘Culture medium for myoblasts precursors thereof and derivatives thereof’. Il a été déposé le 22 septembre 2009 et publié le 25 mars 2010. Le déposant est l’Université Laval. Les coinventeurs sont le Dr. Alain Garnier et le Dr. Jacques P. Tremblay. Le Dr. Garnier et le Dr. Tremblay ont supervisé les travaux, fourni le matériel et mis à disposition les installations nécessaires pour la réalisation de ce projet. Plus précisément, j’ai effectué les expériences de croissance cellulaire et les essais RT-PCR, ainsi que les marquages immunocytochimiques dans le laboratoire du Dr Garnier. Les essais in vivo sur des souris, le FACS et les Western Blot furent réalisés dans les laboratoires du Dr Tremblay.
1
Chapitre 1 : Introduction
Ce projet s’intègre dans le développement d’une thérapie cellulaire contre la Dystrophie Musculaire de Duchenne (DMD). Celle-ci consiste à injecter des cellules musculaires saines dans les muscles des patients dystrophiques afin qu’elles augmentent la résistance des fibres musculaires face aux dommages causés notamment par les contractions des muscles. Par contre, le développement de cette thérapie est entravé par l’utilisation de FBS dans le milieu de culture des myoblastes et les procédés de production actuels sont inadéquats pour répondre à la demande en cellules musculaires. Le FBS, un produit animal non défini de composition variable de lot en lot, peut être contaminé par des bactéries, des virus ou des prions d'origine inconnue, mettant la santé des patients à risques. Conséquemment, l’approbation des essais cliniques auprès des instances règlementaires est ardue et limitée à des patients à un stade avancé de la maladie. Il est donc préférable de remplacer le FBS par un mélange d'additifs définis. Une emphase est portée aux cytokines recombinantes qui sont des molécules signalisatrices contrôlant la prolifération et la différentiation des cellules. De plus, les cellules musculaires doivent être cultivées à grande échelle. Présentement, les myoblastes sont cultivés dans des systèmes peu productifs, notamment en flacons statiques. Des systèmes plus productifs, par exemples des bioréacteurs agités, permettraient de remédier à cette problématique.
Les objectifs de ce projet consistent donc: 1) à élaborer un milieu de culture sans sérum défini permettant l'expansion des myoblastes humains comparables en nombre, en vitesse de croissance et en propriétés à des myoblastes cultivés en milieu contenant du sérum et 2) développer un procédé de production extrapolable pour l’expansion in vitro de ces myoblastes.
Pour atteindre l’objectif 1), Zimmerman et al. ont proposé une méthode en boucle. Celle-ci se divise en 3 étapes: a) monter une banque de facteurs potentiels, b) tester ces additifs en culture et c) ajouter les additifs générant une réponse bénéfiques au milieu de base. Cette boucle est itérée jusqu’à ce que la réponse cellulaire soit jugée satisfaisante (Zimmerman, Vierck et al., 2000). Pour réaliser l'étape a), nous avons choisi de i) sélectionner dans la littérature les additifs définis reconnus pour stimuler la prolifération des cellules musculaires et de ii) déterminer le profil d’expression des récepteurs ou des protéines sécrétées par les myoblastes en utilisant la méthode de la transcriptase inverse suivi d’une réaction en chaîne par polymérase (RT-PCR) et de gels d'électrophorèse. Pour réaliser l'étape b), les facteurs potentiels identifiés en a) ont été testés en culture, soit individuellement ou par le biais de plans statistiques d’expérience (DOE) à 2 niveaux. Le niveau inférieur était généralement l'absence du facteur alors que le niveau supérieur utilisé provenait de la littérature. Les plans factoriels étaient soit fractionnés ou complets.
2 Pour atteindre l’objectif 2), le projet a été divisé en trois phases a) sélectionner le type de microporteurs permettant une adhésion efficace des myoblastes, b) déterminer une méthode d’inoculation des flacons agités et c) tester les conditions de culture en flacons agités (100 mL à 500 mL) avec les meilleurs microporteurs.
Le milieu de culture sans sérum doit supporter une croissance spécifique des myoblastes équivalente ou supérieure au milieu avec sérum, en évitant la formation de myotubes et en évitant la différentiation des myblastes en un autre type de cellule. De plus, les cellules devaient garder leur pouvoir de fusion in vitro et in vivo. Finalement, puisque l’objectif global du projet est d’augmenter la sécurité de la thérapie cellulaire, il faut éviter, autant que possible, les composantes de milieux de culture dérivés d’animaux.
La thèse est divisée en 8 chapitres. Tout d’abord l’introduction, puis la revue de littérature, le matériel et les méthodes, les résultats, la discussion, la conclusion, la bibliographie et les annexes.
3
Chapitre 2 : Revue de littérature
La revue de littérature est divisée en 4 sections principales. La première section porte sur le tissu musculaire et permet au lecteur de se familiariser avec le fonctionnement et la composition des muscles, ainsi qu’avec les principes régulant la myogenèse. La deuxième section présente les aspects fondamentaux de la DMD et des différentes approches thérapeutiques sur lesquelles repose l’espoir de traiter les patients dystrophiques. Un accent particulier sera mis sur la thérapie cellulaire ainsi que sur les problématiques reliées à cette approche. La troisième section porte sur la culture cellulaire, plus spécifiquement sur les composantes des milieux de culture et des procédés de grande échelle. La quatrième section traite de la communication entre les cellules, des récepteurs cellulaires, des voies de signalisation et des cytokines.
2.1. Tissu musculaire
2.1.1. Anatomie musculaire
Les muscles contribuent, chez l’adulte, à 40% de la masse corporelle et sont de trois types : lisses, cardiaques et squelettiques (Mueller, Emery et al., 2003). Les muscles ciblés par la présente recherche sont les muscles squelettiques, qui sont formés d’un ensemble de myofibrilles regroupées à l’intérieur d’une membrane, le sarcolemme, formant des fibres musculaires. Les fibres musculaires, regroupées en fascicules, parcourent toute la longueur du muscle. Chaque fibre musculaire et chaque fascicule sont entourés d’un réseau de fibres de collagène (endomysium et périmysium). Toutes les fibres musculaires sont enveloppées d’une membrane plasmique ainsi que par la lamine basale. La lamine basale ainsi que l’endomysium constituent le sarcolemme (Arms et Camp, 1995). La Figure 1 montre une coupe transversale d’un muscle squelettique.
4
Figure 1: Coupe transversale d’un muscle squelettique (Koesterer).
Il existe trois populations principales de cellules mononucléaires pouvant être isolées à partir du muscle: deux types de cellules engagées dans la voie myogénique (myoblastes et cellules satellites) ainsi qu’une population de cellules souches. Les cellules satellites ont une localisation et une morphologie distincte. Elles furent observées pour la première fois au microscope électronique chez la grenouille (Mauro, 1961). Elles sont situées en périphérie des fibres musculaires, entre la membrane plasmique et la lamine basale, et sont responsables de la réparation des fibres endommagées (Yin, Price et al., 2013). Elles forment environ de 2 à 7% des noyaux associés à une fibre et sont normalement en état de quiescence, mais s’activent lorsque les fibres musculaires adjacentes se brisent. Les cellules satellites activées sont appelées myoblastes, ou cellules précurseuses de muscles (MPC). Les myoblastes entrent en phase proliférative et se fusionnent aux fibres endommagées afin de les réparer (Carlson, 1973; Bischoff, 1994; Mueller, Emery et al., 2003; Rudnicki, Le Grand et al., 2008). À partir d’une biopsie musculaire de 1 g, environ 105
myoblastes peuvent être extraits. Ce gramme de muscle peut générer jusqu'à 5X1012 myoblastes,
puisque en moyenne chaque myoblastes peut se diviser 25 fois sans perte de capacité de fusion (Webster, Pavlath et al., 1988). La troisième population est celle des cellules souches musculaires. Ces cellules expriment aussi d’autres marqueurs, par exemple des marqueurs hématopoïétiques, et contribueraient à la régénération des fibres musculaires (Qu-Petersen, Deasy et al., 2002). Ces cellules souches peuvent se différencier en cellules hématopoïétiques ainsi qu’en cellules musculaires (Seale, Asakura et al., 2001), et peuvent s’auto-renouveler (Deasy, Jankowski et al., 2001).
5
2.1.2.
Myogenèse
La myogenèse est le processus de différentiation des cellules myogéniques, à partir des cellules mononuclées jusqu’à la formation de myotubes. Ces changements permettent la régénération des muscles et sont contrôlés par des signaux provenant de l’environnement. Les stades de différentiation cellulaire peuvent être discriminés avec des marqueurs spécifiques à différentes étapes de progression.
2.1.2.1.
Caractérisation des cellules myogéniques
Les cellules musculaires peuvent être caractérisées à l’aide de plusieurs marqueurs qui permettent de déterminer le stade de différentiation des cellules myogéniques. Ces marqueurs sont importants dans l’étude de caractérisation de cultures hétérogènes provenant de biopsies musculaires. La caractérisation des populations peut être vérifiée par marquage immunocytochimique, par immunocytochimie ou par cytométrie en flux. Ces techniques permettent de repérer un complexe antigène/anticorps, lié à une cellule, par le biais d’une molécule fluorescente.
2.1.2.1.1. Facteurs de transcription
Les cellules myogéniques peuvent être caractérisées par le biais des facteurs de régulation myogéniques (MRF), qui sont des facteurs de transcription, consistant en Myf5, MyoD, MRF4 et la myogénine. Les MRF sont essentiels à l’initiation et à la progression de la myogenèse (Sterrenburg, Turk et al., 2004). La Figure 2 montre les MRF associés aux stades de progression de la différentiation des cellules myogéniques.
6
Figure 2: Expression des MRF selon le stade de différentiation des cellules myogéniques, panneau A (Rudnicki, Le Grand et al., 2008), et expression des MRF dans les cellules satellites, panneau B (Yin, Price et al., 2013).
Myf5 est un marqueur qui apparaît dans les cellules souches commises dans la voie myogénique; c’est donc un excellent marqueur pour vérifier la détermination myogénique. Il est le seul MRF a être exprimé seulement dans les cellules mononuclées (Merrick, Stadler et al., 2009) et servirait à réguler la régénération des cellules satellites. Myf5 est cependant insuffisant pour activer le programme myogénique puisqu’il n’est pas impliqué dans la différentiation cellulaire, mais est l’initiateur de l’expression de la MyoD. Valdez et al croient que Myf5 et MyoD sont des facteurs de transcription redondants puisqu’il a été observé qu’ils peuvent se remplacer l’un l’autre. Malgré que l’expression de Myf5 diminue lors de la différentiation, MyoD maintient son expression autant dans les myoblastes en prolifération que dans les myotubes (Tajbakhsh, Rocancourt et al., 1997; Valdez,
7 Richardson et al., 2000; Charge et Rudnicki, 2004). Les myoblastes déficients en MyoD sont incapables de compléter leur différentiation (Langen, Van Der Velden et al., 2004). Également, MyoD régule l’entrée et la sortie du cycle cellulaire (Halevy, Novitch et al., 1995; Muntoni, Brown et al., 2002).
La myogénine et le MRF4 sont exprimés plus en aval que Myf5 et MyoD, c’est-à-dire lorsque les myoblastes initient la formation de myotubes (Tajbakhsh, Rocancourt et al., 1997). Ils induisent la différentiation des myoblastes en myocytes, qui se fusionnent ensuite pour former des fibres musculaires (Muntoni, Brown et al., 2002; Charge et Rudnicki, 2004). MRF4 pourrait alors servir à la maturation des myofibres (Charge et Rudnicki, 2004). MRF4 et la myogénine contrôlent les gènes des protéines contractiles. Les gènes de ces protéines sont contrôlées par un coactivateur contenant un fragment ‘E-box’, qui est un site de liaison des MRFs. Notamment, un de ces coactivateurs est le MEF2 (Pownall, Gustafsson et al., 2002) qui, tout comme les corépresseurs Twist et ID2, sont fortement sur-exprimés lors du processus de réparation musculaire (Zhao et Hoffman, 2004).
Les autres facteurs importants impliqués dans la myogenèse sont la famille ‘paired box’ (Pax), le sonic hedgehog (SHH) et les facteurs Wingless (wnt) (Sterrenburg, Turk et al., 2004). Pax7 est exprimé chez les cellules souches myogéniques, et est important afin de régénérer la population de cellules satellites. Pax7 contrôle la prolifération des cellules satellites et empêche leur différentiation (Sincennes, Brun et al.). Pax3 et Pax7 contrôlent l’expression de la MyoD et sont essentiels à l’activation du processus myogénique (Wang et Rudnicki, 2011; von Maltzahn, Jones et al.). Les progéniteurs somitiques Pax3+/Pax7+ sont considérés les précurseurs des cellules satellites dans
les muscles adultes. Plusieurs de leurs effets sont redondants, mais Pax7, qui est exprimé après Pax3, a aussi des propriétés anti-apoptotiques (Seale, Sabourin et al., 2000; Kassar-Duchossoy, Giacone et al., 2005; Relaix, Montarras et al., 2006; Merrick, Ting et al., 2007; Merrick, Stadler et al., 2009). D’autre part, SHH, ainsi que wnt-1 et wnt-3, induisent la myogenèse des tissus somitiques in vitro (Munsterberg, Kitajewski et al., 1995).
2.1.2.1.2.
Protéines ciblées pour les marquages
Les cellules peuvent être identifiées par des anticorps de protéines spécifiques. Celles-ci peuvent être des protéines du cytosquelette ou des récepteurs sur la surface des cellules. Entre autres, le marquage à la desmine, une protéine du cytosquelette essentielle à la formation des myotubes, permet d’identifier les cellules satellites ainsi que les myoblastes et les myotubes. La desmine est exprimée par les myoblastes en prolifération et son expression augmente lors de la différentiation en myotube (Capetanaki, Milner et al., 1997; Charge et Rudnicki, 2004). Afin d’identifier les myoblastes qui sortent du cycle cellulaire et se différencient pour former des fibres musculaires, un marquage avec la chaîne lourde de la myosine (MHC) peut être utilisé (Raheem, Huovinen et al.,
8 2010). Les cultures primaires peuvent aussi être purifiées par FACS avec le marqueur de surface NKH1, aussi appelé NCAM ou CD56. Le NCAM est une glycoprotéine importante pour les interactions entre les cellules. Elle est présente sur la surface membranaire des cellules des muscles squelettiques, mais aussi des neurones et des cellules tueuses naturelles (NK) (Cunningham, Hemperly et al., 1987; Rutishauser, Acheson et al., 1988). Elle est donc un peu moins spécifique que la desmine. D’autre part, la réparation musculaire peut être détectée par une élévation de la concentration de créatine kinase (Sorichter, Mair et al., 2001). Un autre marqueur fréquemment utilisé est le diamidino-2-phenylindole (DAPI). Celui-ci colore les noyaux en se liant à l’ADN double brin (Morikawa et Yanagida, 1981). La Figure 3 montre les étapes de différentiation musculaire ainsi que les marqueurs associés à chacun des stades.
9
Figure 3: Étapes de différentiation des cellules compromises dans la lignée myogénique et les marqueurs associés (panneaux A et B), ainsi que la localisation des marqueurs des cellules satellites (panneau C – exemple d’une cellule satellite). Sources: A) (Hawke et Garry, 2001) B) (Deasy, Jankowski et al., 2001), C) (Yin, Price et al., 2013).
2.1.2.1.3. Réparation musculaire
Lorsque le muscle se brise, plusieurs types de cellules environnantes s’activent et coordonnent la réparation musculaire avec des signaux extracellulaires spécifiques (Joe, Yi et al., 2010). La première phase de la réparation musculaire est la nécrose des tissus endommagés et l’activation de la réponse inflammatoire (Tidball, 1995; Charge et Rudnicki, 2004). À ce moment, les fibres endommagées et les cellules environnantes sécrètent certains facteurs servant à activer les
10 cellules myogéniques. Tout d’abord, les cellules inflammatoires envahissent le site endommagé. Les neutrophiles arrivent puis, après 48 heures, les macrophages deviennent les cellules inflammatoires prédominantes qui phagocytent les débris cellulaires. De plus, les cellules fibreuses et adipeuses s’activent et génèrent des signaux qui favorisent la myogénèse. Par contre, si la blessure est chronique, ces cellules vont former des tissus fibreux et graisseux (Charge et Rudnicki, 2004; Joe, Yi et al., 2010).
Les signaux extracellulaires sont des cytokines et des facteurs de croissance (GF) qui poussent les cellules satellites quiescentes à s’activer, à entrer dans le cycle cellulaire et à proliférer. Cette activation initie la myogenèse, une série d’évènements complexes qui implique la différentiation de cellules satellites en cellules précurseures de muscle et la fusion de celles-ci pour former des fibres musculaires (Miller, Thaloor et al., 2000; Muntoni, Brown et al., 2002). Une fibre musculaire endommagée active les cellules satellites le long de cette fibre, menant à la prolifération et à la migration des cellules satellites au site de réparation. Suite à la phase de prolifération, les cellules satellites retournent sous la lamine basale pour initier d’éventuels cycles de prolifération (Hawke et Garry, 2001). Ce processus, contrôlé par les MRF, est présenté à la Figure 4.
Lors de la réponse inflammatoire, les cellules satellites quiescentes (Pax7+, MyoD-, desmine-,
myogénine-) s’activent (Pax7+, MyoD+), entrent dans le cycle cellulaire, prolifèrent et se divisent soit
de façon asymmétrique, produisant un myoblaste et une cellule satellite, soit de façon symétrique produisant deux cellules satellites, deux myoblastes ou deux cellules indéterminées (Moss et Leblond, 1971; Kuang, Kuroda et al., 2007; Kuang, Gillespie et al., 2008). Les myoblastes qui expriment la myogénine (Pax7+, MyoD+, myogénine+, desmine+) se fusionnent aux fibres
endommagées alors que certains retournent à l’état quiescent (Pax7+, MyoD-, desmine-,
myogénine-) (Miller, Thaloor et al., 2000; Conboy, Karasov et al., 2007; Yin, Price et al., 2013). Le
contrôle de la division de ces cellules est très dynamique et l’équilibre entre l’auto-renouvellement et la différentiation est primordial pour maintenir une capacité de réparation musculaire durable. Le nombre de cycles de prolifération, pour une cellule diploïde normale, est limité. Conséquemment, la réparation constante des fibres musculaires et la division continuelle des cellules satellites poussent ces dernières à entrer en sénescence prématurément (Mitchell et Pavlath, 2004).
11
Figure 4: Processus de réparation des fibres musculaires endommagées (Hawke et Garry, 2001).
2.2. Dystrophie musculaire
Les dystrophies musculaires sont caractérisées par la destruction et l’affaiblissement des muscles, causée par la nécrose et la fibrose musculaire. Elle s’attaque à tous les types de muscles, soit squelettiques, lisses et cardiaques. La sévérité de la dystrophie musculaire est très variable, passant d'une dégénération musculaire générale à une simple dystrophie oculaire (Mueller, Emery et al., 2003; Voisin et de la Porte, 2004).
2.2.1. Dystrophie musculaire de Duchenne : caractéristiques et
progression
Le présent projet de production massive de cellules musculaires en milieu sans sérum s’intègre dans une initiative globale ambitieuse: le développement d’un traitement contre la dystrophie musculaire de Duchenne (DMD). Cette maladie, qui atteint 1 garçon sur 3500, est la maladie génétique la plus répandue (Voisin et de la Porte, 2004). Elle fut nommée en reconnaissance au docteur français G. Duchenne de Boulogne (1808-1875) qui identifia il y a 150 ans les signes et symptômes de la DMD, qu’il qualifia alors de paralysie pseudo-hypertrophique (Bogdanovich, Perkins et al., 2004). La contribution majeure du Dr Duchenne est l’étude des tissus d’un même
12 patient à différents stades de la maladie. Par la suite, plusieurs médecins du 19e siècle ont fait des
contributions majeures dans la compréhension et le diagnostic de la maladie. Notamment, un médecin anglais, Edward Meryon (1809-1880), conclut que la dystrophie est une maladie héréditaire affectant généralement les garçons. Il démontra également que la DMD n’est pas une maladie du système nerveux. William Gower (1845-1915) conclut que la maladie est héritée de la mère et qu’elle est limitée aux garçons. Wilhem Heinrich Elb (1840-1921) posa l’hypothèse que la dystrophie musculaire n’est pas qu’une seule et unique maladie. Il fut donc crédité pour avoir classifié les différents groupes de dystrophies. Peter Emile Becker, en 1955, fit la lumière sur une forme de dystrophie musculaire plus bénigne, la dystrophie musculaire de Becker (BMD) (Mueller, Emery et al., 2003).
La DMD est une forme de dystrophie causée par une mutation du chromosome X provoquant une dégénérescence progressive des fibres musculaires. Tous les types de dystrophies sont liées à une mutation du même gène sur ce chromosome, le plus long de tout le génome humain. Il comprend 2,5 millions de bases et le locus précis des mutations est le Xp21. Le gène fut découvert par Kunkel et est responsable de l’encodage de la dystrophine (Hoffman, Brown et al., 1987; Bogdanovich, Perkins et al., 2004). La maladie est héréditaire dans le tiers des cas, mais les 2/3 sont le résultat d’une nouvelle mutation sans historique familial de la maladie (Manzur, Kinali et al., 2008). Puisque la taille du gène de la dystrophine est énorme, il est plus vulnérable aux mutations et différentes erreurs dans les gènes causent la dystrophie. Conséquemment, environ 65% des DMD sont causées par une délétion dans le gène qui décale le cadre de lecture, 10% sont dues à des répétitions de certains exons et le reste à des mutations ponctuelles, des erreurs d’épissage ou un codon stop prématuré. Généralement, un cadre de lecture décalé par une mutation mène à la DMD, alors qu’une mutation qui conserve le cadre de lecture, moins sévère, induit une BMD (Barton-Davis, Cordier et al., 1999; Manzur, Kinali et al., 2008).
Les effets de la DMD se font sentir dès le stade embryonnaire. En effet, chez les embryons de souris mdx (modèle animal de la dystrophie musculaire de Duchenne, elle possède un codon d’arrêt à l’exon 23 du gène de la dystrophine), le nombre et la densité des fibres musculaires sont réduits, les fibres sont mal alignées et leurs noyaux sont souvent centraux, des défauts cardiaques sont observés, les cellules souches musculaires sont en hyperprolifération et ont un taux élevé d’apoptose (Merrick, Stadler et al., 2009). Les patients atteints de DMD ont une quantité élevée de certaines enzymes, particulièrement la créatine kinase (Mueller, Emery et al., 2003). Le taux de créatine kinase augmente lorsque les myofibres se détériorent (Charge et Rudnicki, 2004), et les muscles sont progressivement remplacés par du tissu fibreux. Cette fibrose est augmentée par une grande concentration d’une protéine qui se lie aux facteurs de croissance analogues à l’insuline (IGFBP), qui séquestre l’IGF et limite sa biodisponibilité pour les cellules satellites. Ceci limite la prolifération des myoblastes (Hawke et Garry, 2001). De plus, la concentration en calcium