Recherche des molécules bioactives antidiabétiques
dans les extraits d’écorces de racines de Myrianthus
arboreus
Thèse
Pierre Betu Kasangana
Doctorat en sciences du bois
Philosophiae doctor (Ph. D.)
Québec, Canada
Recherche des molécules bioactives antidiabétiques
dans les extraits d’écorces de racines de Myrianthus
arboreus
Thèse
Pierre Betu KASANGANA
Sous la direction de :
Tatjana Stevanovic, directrice de recherche
Pierre Haddad, codirecteur de recherche
iii
Résumé
Myrianthus arboreus est une essence de la forêt tropicale d’Afrique dont les tissus contiennent des molécules bioactives intéressantes. Les données ethnopharmacologiques africaines attribuent à l’extrait aqueux d’écorces de racines de M. arboreus des effets thérapeutiques notamment antidiabétique. Le but de cette thèse était de valider ce potentiel à travers trois séries des bioessais cellulaires in vitro, d’identifier les principes actifs et d’élucider les mécanismes d’actions par lesquels la plante exerce son activité sur le diabète.
Une étude préliminaire sur les différents extraits et fractions obtenus à partir de solvants de force de polarité croissante (dichlorométhane, éthanol, méthanol, eau) a été menée et a démontré un excellent potentiel antioxydant de l’extrait éthanolique et de sa fraction acétate d’éthyle comparable à celui de l’Oligopin®, un extrait commercial riche en
proanthocyanidines. Ces résultats ont corrélé avec les teneurs en acides hydroxicimiques et en proanthocyanidines, deux classes de polyphénols présentes dans l’extrait et la fraction acétate d’éthyle.
Ensuite, les résultats des bioessais cellulaires indiquent qu’aucun extrait ou fraction n’a été capable de stimuler le transport de glucose dans les cellules musculaires C2C12. A l’inverse, l’extrait éthanolique, sa fraction hexanique et sa fraction enrichie en alcaloïdes se sont démarqués par leur effet sur le contrôle de l’homéostasie hépatique du glucose. Parallèlement, la fraction acétate d’éthyle a uniquement démontré un profil plus prometteur en diminuant la production de glucose dans le foie. Plus précisément, ces extraits et fractions ont significativement inhibé l’activité du glucose-6-phostaptase (G6Pase) via la stimulation des voies insulino-dépendante (Akt) et – indépendante (AMPK), à l’exception de la fraction EAc qui n’active que l’AMPK. Ce dernier mécanisme est semblable à celui de la metformine, l’hypoglycémiant oral le plus utilisé dans le monde. D’autre part, les extraits et fractions bioactifs ont également augmenté l’activité de la glycogène synthétase (GS) suite à la phosphorylation de la glycogène synthase kinase-3.
Le sous-fractionnement de la fraction hexanique guidé par les deux bioessais a conduit à l’isolation de sept composés majeurs, dont quatre nouveaux triterpènes
iv
pentacycliques ayant un fragment férulate. L’acide 3β-O-trans-féruloyl-2α,19α-dihydroxyurs-12-en-28-oïque (H1), l’acide 2α-acetoxy-3-β-0-trans-féruloryl-19α-hydroxyl-12-en-28-oïque (H3) et l’acide ursolique (H5) sont responsables, en grande partie, de l’activité antidiabétique de la fraction hexanique. Ils ont démontré le même mécanisme d’action que l’extrait éthanolique en diminuant l’activité de la G6Pase et en augmentant celle de la GS ainsi qu’en activant les voies de signalisation impliquées. Le H3 s’est démarqué par son effet le plus puissant et comparable à celui de l’extrait éthanolique et sa fraction hexanique dans toutes les expériences.
D’autre part, le sous-fractionnement de la fraction acétate d’éthyle guidé par les même bioessais a permis d’isoler cinq composés phénoliques, dont deux regioisomères C-glycosyl flavone à savoir isoorientine et orientine, ainsi que trois composés phénoliques très connus tels que l’acide chlorogénique, l’acide protocatéchique et l’aldéhyde
protocatéchique. Dans tous les bioessais, isoorientine s’est démarqué avec ses effets remarquables en diminuant l’activité de la G6Pase, et augmentant celle de la GS, comparable à la fraction acétate d’éthyle.
En conclusion, les résultats de cette thèse soutiennent le potentiel antidiabétique de M. arboreus rapporté dans la médecine traditionnelle africaine. Cette activité implique essentiellement le contrôle de l’homéostasie de glucose au niveau du foie à travers les voies de signalisation médiées par l’Akt, l’AMPK et la GSK-3. Les composés actifs tels que les dérivés féruliques de triterpène (H1 et H3) ainsi que le C-glycoside du flavones l’isoorientine (E1), avec un potentiel anti-diabétique prometteur pourront servir comme nouveaux candidats thérapeutiques des préparations traditionnelles ou pour des fins thérapeutiques ultérieures. Ces molécules bioactives vont représenter les marqueurs importants pour toute homologation future de cet extrait naturel de l’ethnopharmacologie congolaise.
v
Abstract
Myrianthus arboreus is a tree of the tropical rainforest of Africa the tissues of which contain promising bioactive compounds. African ethnopharmacological data attribute to the aqueous extract of M. arboreus root bark therapeutic effects including antidiabetic. The aim of this thesis was to validate this potential through three series of cell-bioassays, to identify the principle responsible for this activity and to elucidate the mechanisms of actions by which this plant extract exerts its antidiabetic activity.
A preliminary study on different extracts and fractions performed with solvent of increasing polarity (dichloromethane, ethanol, methanol and water) has revealed an excellent antioxidant potential of ethanol extract and of its ethyl acetate fraction comparable to that of Oligopin®, a commercial extract rich in proanthocyanidins. This result was well correlated
with the levels of hydroxycinnamic acids and proanthocyanins, two classes of polyphenols present in the extract and its antioxidant fraction.
In addition, the results of cell bioassays indicate that no extract or fraction was able to stimulate glucose transport in C2C12 muscle cells. In contrast, the ethanolic extract, its hexane and the alkaloid-enriched fractions stood out by their effect on the control of hepatic glucose homeostasis. Similarly, the ethyl acetate fraction only demonstrated a more promising profile by decreasing glucose production in the liver. Specifically, these extracts and fractions significantly inhibited glucose-6-phostaptase (G6Pase) activity via insulin-dependent (Akt) and -ininsulin-dependent (AMPK) pathway stimulation, except for the ethyl acetate ethanolic fraction which only activated AMPK. The latter mechanism is similar to that of metformin, the most widely used oral hypoglycemic drug in the world. On the other hand, bioactive extracts and fractions also increased the activity of glycogen synthase (GS) through the phosphorylation of glycogen synthase kinase-3.
Sub-fractionation of the hexane fraction guided by the two bioassays resulted in the isolation of seven major compounds, including new pentacyclic triterpenes having a ferulate fragment. 3β-O-trans-feruloyl-2α, 19α-dihydroxyurs-12-en-28-oic acid (H1), 2α-acetoxy-3-β-O-trans-feruloryl-19α-hydroxyl-acid 12-en-28- oic acid (H3) and ursolic acid (H5) which
vi
are responsible, to a large extent, for the antidiabetic activity of the hexane fraction. The active constituents exhibit the same mechanism of action as the EtOH extract by decreasing the activity of G6Pase, increasing that of GS and activating signaling pathways involved. The H3 stood out for its most powerful effect which was determined to be comparable to that of the ethanolic extract and to its Hexane fraction in all experiments.
On the other hand, bioassay-guided fractionation of ethyl acetate fraction led to the isolation of five phenolic compounds, including two regioisomers C-glycosyl flavons namely isoorientin and orientin, along with three well-known phenolic compounds, chlorogenic acid, protocatechuic acid and protoctehuic aldehyde. In all experiments, isoorientin (E1) stood out with its most powerful effects, by decreasing the activity of G6Pase and increasing the GS.
Altogether, the results of the present thesis support the antidiabetic potential of M. arboreus reported by African folk medicine, which involves control of glucose homeostasis in the liver via Akt, AMPK and GSK-3 phosphorylation. The bioactive molecules ferulic derivatives of triterpenes (H1 and H3), and C-glycosyl flavone E1 determined in studied extracts and fractions were determined to have a promising anti-diabetic activity, can be used as new therapeutic candidates for traditional preparations or for future therapeutic purposes. These molecules can also be used as markers for future authentifications of the natural products based on Myrianthus arboreus root bark extracts.
vii
Table des matières
Résumé ... iii
Abstract ... v
Liste des Figures ... xi
Liste des tableaux ... xiii
Liste des abréviations ... xiv
Remerciement ... xviii
Avant-propos ... xix
Introduction ... 1
Chapitre I. Revue de littérature... 5
I.1 Homéostasie énergétique... 5
I.1.1 Transporteurs de glucoses ... 6
I.1.2 Principales voies de signalisation activées par l’insuline... 11
I.2 Diabète sucré ... 17
I.2.1 Données sur la prévalence et incidence du diabète dans le monde et en Afrique 17 I.2.2 Classifications étiologiques du diabète ... 18
I.2.3 Physiopathologie du diabète de type 2 ... 20
I.2.4 Complications du diabète ... 26
I.2.5 Traitement du diabète ... 27
I.2.6 Biomasse forestière comme source de nouveaux composés bioactifs antidiabétiques ... 33
I.3 Myrianthus arboreus ... 35
I.3.1 Étude botanique ... 36
I.3.2 Données ethnopharmacologiques ... 37
I.4. Composés phytochimiques isolés de Myrianthus arboreus ... 38
I.4.1 Alcaloïdes ... 38
I.4.2 Terpénoides ... 48
I.4.3 Polyphénols ... 61
Chapitre II. Objectifs, stratégie expérimentale, matériels et méthodes ... 72
II.1 Objectif de la thèse... 72
II.2 Stratégie expérimentale ... 73
II.3 Matériels et méthodes ... 74
II.3.1 Échantillons ... 74
viii
II.3.3 Dosages des composés phénoliques par spectrophométrie UV-visible ... 75
II.3.4 Bioessais cellulaires in vitro ... 75
II.3.5 Analyses chromatographiques ... 80
II.3.6 Analyses structurales ... 83
II.3.7 Stratégie utilisée pour la détermination de structures à partir des spectres RMN (1D et 2 D) ... 86
Chapitre III. Study of Polyphenol Content and Antioxidant Capacity of Myrianthus Arboreus (Cecropiaceae) Root Bark Extracts ... 88
III.1 Resumé ... 88
III.2 Abstract ... 89
III.3 Introduction ... 90
III.4 Experimental Section ... 92
III.4.1 Material sampling ... 92
III.4.2 Extraction and Separation of Sub-Fractions ... 92
III.4.3 Chemical Composition of Crude Extracts ... 93
III.4.4 Evaluation of Antioxidant Activity ... 95
III.4.5 Statistical Analysis ... 98
III.5 Results and Discussion ... 98
III.5.1 Content of Polyphenols ... 98
III.5.2 Antioxidant Capacities Determined by Different Methods ... 100
III.5.3 Correlations between the Content in Various Polyphenols and Antioxidant Capacities ... 105
III.6 Conclusions ... 109
Chapitre IV. Root bark extracts of Myrianthus arboreus P. Beauv. (Cecropiaceae) exhibit anti-diabetic potential by modulating hepatocyte glucose homeostasis ... 110
IV.1 Resumé ... 110
IV.2 Abstract ... 110
IV.3 Introduction ... 112
IV.4 Materials and Methods ... 114
IV.4.1 Plant material ... 114
IV.4.2 Extraction and separation of fractions ... 114
IV.4.3 Cell culture ... 116
IV.4.4 Cytotoxicity assay (LDH Test)... 116
IV.4.5 Glucose uptake bioassay ... 116
ix
IV.4.7 Glycogen synthase assay ... 117
IV.4.8 Western blot analysis ... 118
IV.4.9 Statistical analysis ... 119
IV.5 Results ... 119
IV.5.1 LDH Test (Cytotoxicity) ... 119
IV.5.2 Lack of effect of M. arboreus root bark extracts and fractions on muscle glucose transport ... 120
IV.5.3 Effect of M. arboreus extracts and fractions on hepatic glucose production .. 121
IV.5.4 Effects of Alk, EtOH and its fractions on phosphorylation of AMPK and Akt in H4IIE cells ... 123
IV.5.5 Effect of M. arboreus extracts and fractions on glycogen synthesis in liver cells ... 124
IV.5.6 Effect of extract and fractions of M. arboreus on GSK-3 phosphorylation .... 126
IV.6 Discussion ... 128
IV.7 Conclusion ... 131
Chapitre V. Bioactive pentacyclic triterpenes from root bark extract of Myrianthus arboreus ... 132
V.1 Résumé ... 132
V.2 Abstract ... 133
V.3 Introduction ... 134
V.4 Results and discussion ... 135
V.5 Experimental section ... 145
V.5.1 Plant Material ... 145
V.5.2 Chemicals ... 145
V.5.3 General Experimental Procedures ... 146
Chapitre VI. Antidiabetic effect of flavone C-glycoside isolated from root bark of Myrianthus arboreus ... 152
VI.1 Résumé ... 152
VI.2 Abstract ... 153
VI.3 Introduction ... 154
VI.4 Results and discussion ... 155
VI.4.1 G6Pase and GS activities of M. arboreus sub-fractions ... 155
VI. 4.2 Bio-guided-isolation on bioactive compounds of M. arboreus ... 156
VI. 4.3 Effects of compounds (1-5) on G6Pase and GS enzymes ... 161
VI.4.4 Effects of E1, E2 and E3 on phosphorylation of AMPK and GSK-3β ... 162
x
VI.6 Experimental section ... 165
VI.6.1 General Experimental Procedures ... 165
VI.6.2 Plant Material ... 165
VI.6.3 Extraction, isolation and structure elucidation ... 166
VI.6.4 Cell culture ... 167
VI.6.5 Cytotoxicity assay ... 167
VI.6.6 Glucose-6-phosphatase assay ... 168
VI.6.7 Glycogen synthase (GS) assay ... 168
VI.6.8 Western blot analysis ... 169
VI.6.9 Statistical analysis ... 170
Conclusions générales et pespectives ... 171
Bibiographie ... 177
ANNEXE ... 190
Annexe I Fractionnement bio-guidé de l’extrait éthanolique de M. arboreus ... 190
Annexe II Analyses de l’extrait ethanolique de M. arboreus par HPLC-DAD ... 191
Annexe III Analyse de la structure du composé H1 ... 193
Annexe IV Analyse de la structure du composé H2 ... 197
Annexe V Analyse de la structure du composé H3 ... 199
Annexe VI Analyse de la structure du composé H4 ... 203
Annexe VII Identification des composés H5, H6, H7 par GC-MS ... 206
Annexe VIII D'autres informations de l'activité antidiabétique de la fraction d'hexane 207 Annexe IX Analyse de la structure du composé E1 ... 208
Annexe X Analyse de la structure du composé E2 ... 212
Annexe XI Identification des proantocyanidines dans la sous-fraction SFE3 par UPLC-MS/MS ... 216
xi
Liste des Figures
Figure I-1 Effets de l’insuline sur les hépatocytes ... 10
Figure I-2 Les voies de signalisation de l'insuline ... 12
Figure I-3 Les mécanismes d'action des différences voies: Akt et AMPK ... 15
Figure I-4 Les principales classes des hypoglycémiants oraux ... 29
Figure I-5 (A) Carte d'Afrique avec zones surbrillance où est localisé la plante M. arboreus (B) Carte de la RD. Congo avec la flèche indiquant la ville du Bas-Congo où ont été récoltées les écorces de racine ... 35
Figure I-6 Les feuilles et fruits de la plante M. arboreus ... 36
Figure I-7 Structure chimique du Miglitol, un alcaloïde antidiabétique ... 38
Figure I-8 Structure chimique des alcaloïdes cyclopeptidiques isolés des feuilles de M. arboreus ... 42
Figure I-9 Structure générale des alcaloïdes cyclopetidiques ... 43
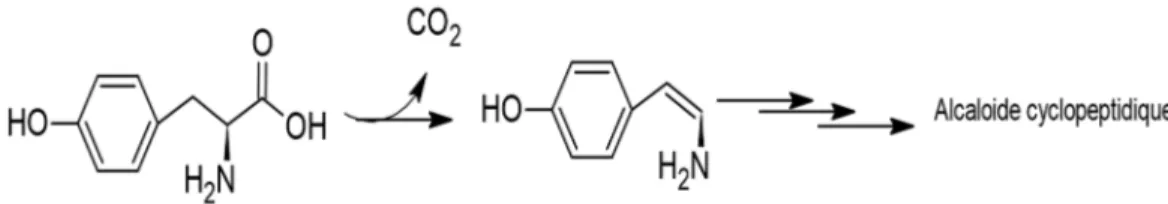
Figure I-10 Biosynthèse des alcaloïdes cyclopeptidiques : Réaction de décarboxylation du phénylalamine ... 44
Figure I-11 Voie biosynthétique des alcaloïdes cyclopeptidiques ... 45
Figure I-12 Structure chimique de l’isoprène ... 48
Figure I-13 Biosynthèse des terpènes ... 49
Figure I-14 Squelettes de structure oléanane et stérane ... 50
Figure I-15 Schéma biosynthétique des triterpènes tétracycliques et des stérols ... 51
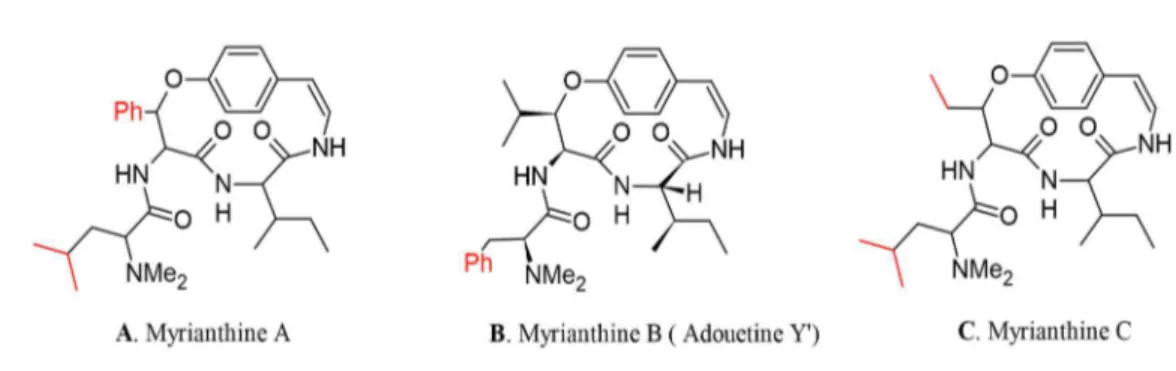
Figure I-16 Biogénèse du lupane, germanicane, taraxastane, oléanane et des ursanes ... 53
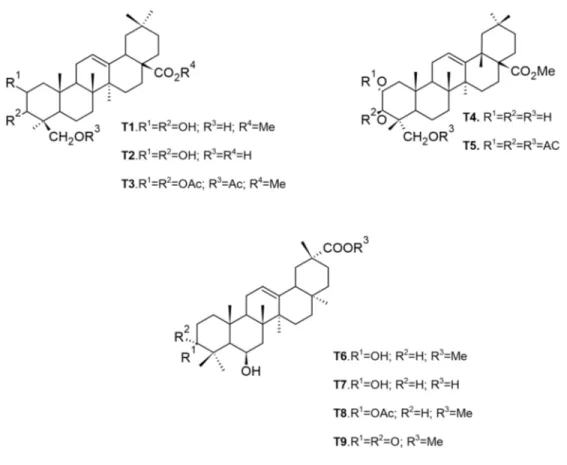
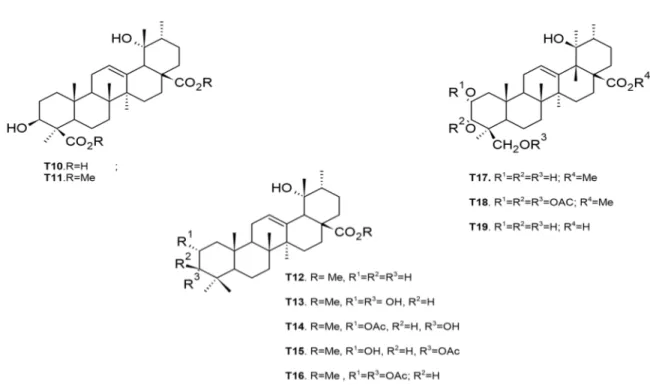
Figure I-17 Structures chimiques de triterpènes de type oléanane isolés des écorces de tronc et du bois de racines de M. arboreus ... 55
Figure I-18 Structures chimiques de triterpènes de type ursane isolés des écorces du tronc et du bois de racines de M. arboreus ... 56
Figure I-19 Relations entre les sous-classes de flavonoïdes (tirée de Stevanovic et al., 2009) ... 62
Figure I-20 Formation des O- et C-glycosyl flavonoïdes (A et B) et exemples de quelques flavonoïdes simples ... 65
Figure I-21 Exemples des quelques acides phénoliques ... 66
Figure I-22 Exemples d’une lignane (A) et de stilbène (B) ... 67
Figure I-23 Biosynthèse des composés phénoliques ... 68
Figure I-24 Structure de myrianthiphylline isolé de M. arboreus ... 69
Figure II-1 Les cellules musculaires C2C12 durant la differenciation des myoblastes (J0) en myotubes (J5) ... 77
Figure II-2 La lignée cellulaire H4IIE à 70% de confluence ... 78
Figure II-3 La lignée cellulaire HepG2 : (A) à 40% de confluence et (B) à 90% de confluence ... 79
Figure III-1 Radical scavenging activities of M. arboreus extracts/fractions determined by the reduction of DPPH free radical... 100
Figure III-2 Total antioxidant capacity of M. arboreus AQ extract, EtOH extract and its fractions. ... 101
Figure III-3 Kinetic profiles of fluorescein consumption in the presence and absence of M. arboreus extracts and its fractions.. ... 103
xii
Figure III-4 Kinetic profiles of pyrogallol consumption in the presence and absence of M.
arboreus extracts/its fractions ... 105
Figure III-5 Spearman’s correlation between different antioxidant methods. ... 106 Figure IV-1 Extraction of the crude of M. arboreus using solvents of different polarity . 115 Figure IV-2 Effects of extracts/fractions of M. arboreus on muscle glucose transport .... 121 Figure IV-3 Effects of extracts/fractions of M. arboreus on hepatic glucose production.
Glucose-6-phosphatase assay was carried as described under “Materials and Methods” .. 122
Figure IV-4 Effect of M. arboreus extracts/fractions on the modulation of
insulin-dependent (Akt) and -ininsulin-dependent (AMPK) pathways in H4IIE cells. ... 124
Figure IV-5 Effect of M. arboreus extracts/fractions on glycogen synthesis in cultured
hepatocytes. Glycogen synthase assay was carried as described under “Materials and Methods”. ... 125
Figure IV-6 Effect of M. arboreus extracts on phosphorylation of GSK-3 in HepG2 cells.
The cells were treated for 18h with vehicle control or extracts and fractions at their
respective maximal non-toxic concentrations (Table1)... 127
Figure V-1 Effect of sub-fractions obtained from the hexane fraction on the activity of
G6Pase (A) and GS (B).. ... 136
Figure V-2 Structures of compounds H1 to H7 ... 139 Figure V-3 COSY (blue bold) and HMBC (red arrows) correlations of H1, H3 ... 140 Figure V-4 Effect of compounds isolated from the active sub-fractions, on the activity of
G6Pase (A) and GS (B). ... 142
Figure V-5 Effect of bioactive compounds isolated from the active fractions, on kinases
regulating G6Pase and GS activities. ... 144
Figure VI-1 Effect of sub-fractions obtained from the EAc fraction of M. arboreus on the
activity of G6Pase (A) and GS (B).. ... 156
Figure VI-2 HPLC chromatogram of (A) ethyl acetate extract fraction of M. arboreus root
bark and (B) its SFE1 and (C) SFE2 sub-fractions, identifying the five major compounds presented in FigureVI-3. ... 157
Figure VI-3 Structures of compounds E1 to E5 ... 158 Figure VI-4 Effect of compounds isolated from the active sub-fractions, on the activity of
G6Pase (A) and GS (B). ... 162
Figure VI-5 Effect of extracts, fractions and bioactive compounds of M. arboreus on
xiii
Liste des tableaux
Tableau I-1 Principaux transporteurs du glucose (tirée de Rao et al.2013 [55]) ... 7 Tableau I-2 Classifications des alcaloïdes à partir de leur précurseur acide aminé ... 40 Tableau I-3 Comparaison des structures des alcaloïdes isolés de M. arboreus ... 43 Tableau I-4 Quelques triterpènes isolés des écorces du tronc et du bois de racines de M.
arboreus ... 58
Tableau III-1 Total phenols (TP), Total flavonoids (TFv), Proanthocyanidins (PAs) and
Total hydroxycinnamic acids (THCA) of the extracts and ethanolic fractions ... 99
Tableau III-2 ORACPRG, ORACFl and ORACPRG/ORACFl ratio values of M. arboreus
extract and fraction. ... 104
Tableau III-3 Spearman’s correlation coefficients obtained between antioxidant activities
and the polyphenolic composition of M. arboreus extracts. ... 107
Tableau IV-1 Maximal non-toxic concentrations of plant extracts obtained to various
extract and fractions of M. arboreus (µg/mL) ... 120
Tableau V-1 NMR (700 MHz) Data [δH in ppm, mult., (J in Hz)] of compounds H1-4 in
DMSO-d ... 140
Tableau VI-11H [ppm, mult. (J in Hz)] and 13C NMR Data of Compounds E1 and E2 in
xiv
Liste des abréviations
AICAR : 5-Aminoimidazole-4-carboxamide ribonucléotid AMPK : AMP-activated protein kinase
CREB : c-AMP-response element-binding proteins DPP-4 : Dipeptidyl peptidase-4
FOXO : Forkhead transcription factors G6P : Glucose-6-phosphate
G6Pase : Glucose-6-phosphatase GLUT : Glucose transporter GS : Glycogène synthétase GSK-3 : Glycogen synthase kinase-3
FID : Fédération internationale du diabète (FID), IDF : International Diabetes Federation
J : Constante de couplage en hertz
NF-κB : Nuclear Factor Kappa-light-chain-enhancers of activated B cells OMS : Organisation mondiale de la santé
PDK1 : Phosphoinositide-dependant kinase 1 PEPCK : phosphoénolpyruvate cacrboxykinase PI3-K : Phosphatidylinositol 3-kinase
PP1 : Protéine phosphatase 1
PPARγ : Peroxisome proliferator-activated receptor-γ MS : Spectrométrie de masse
m/z : Rapport masse sur charge
RMN : Spectroscopie de résonance magnétique nucléaire RMN 1 H : Etude RMN 1D du proton
xv RMN 13C : Etude RMN 1D du carbone XV
RMN COSY : Etude RMN de type COrrelation SpectrocopY
RNM HMBC : Etude RMN de type Heteronuclear Multiple Bond Coherence RMN HSQC : Etude RMN de type Heteronuclear Single-Quantum Correlation RMN NOESY : Etude RMN de type Nuclear Overhauser Effect SpectroscopY ROS : Dérivés réactifs de l’oxygène
TNF-α : Tumor necrosis factor-α TZDs : Thiazolidinediones
VLDL : Very low density lipoproteins
TOF : Spectrométrie de masse à temps de vol UPLC : Chromatographie liquide ultra performance UV : Détecteur UV-visible
xvi
À ma famille A mes ami (e)s, d’ici et d’ailleurs Pour le soutien et les encouragements reçus !
xvii
« Suis ton étoile, va jusqu'où ton rêve t'emporte… » C.D. dans « I believe in you »
xviii
Remerciement
Je rends un vibrant hommage à ma directrice de thèse, Tatjana Stevanovic Janezic, pour m’avoir accepté dans son Laboratoire de chimie du bois et surtout d’avoir dirigé ce projet de thèse. Je resterai profondément marqué par la confiance dont elle m’a témoigné et la passion pour la chimie du bois qu’elle m’a transmise tout au long de ces années d’études en maîtrise et au doctorat.
Que soit vivement remercier le Professeur Pierre Haddad, mon codirecteur, pour avoir m’accueilli avec bienveillance dans son Laboratoire des produits de santé naturels et des maladies métaboliques de l’Université de Montréal. J’ai bénéficié de lui une solide formation dans le domaine de la pharmacologie du diabète et des bioessais cellulaires in vitro. Je ne saurai oublier sa patience légendaire et ses commentaires très pertinents qui ont permis à l’aboutissement heureux de ce travail de recherche.
Je n'aurais pas pu travailler dans deux laboratoires sans le soutien tant moral, spirituel qu’humain des communautés jésuites de la rue Dauphine, de Bellarmin ainsi que de deux provinces jésuites du Canada français et de l'Afrique Centrale. A chacun de vous, un grand merci pour le sens d’amitié et de compagnonnage que nous avons partagé ensemble.
Je m’en voudrais de ne pas remercier de tout cœur les techniciens de laboratoire Yves Bédard, du laboratoire de chimie du bois et à Pierre Audet du laboratoire de RMN pour leur conseil et apport dans ce travail. Il en est de même pour l’ensemble du personnel du CRMR, en particulier pour Guylaine Bélanger et Marthe Larouche pour leur professionnalisme et leur sourire. Aux post-doctorants Hoda Eid, Abir Nachar, Mayra Sanchez, Yannick Viano, Nicolas Auclair, je vous prie de trouver à travers ses lignes toutes mes sincères gratitudes pour l’aide scientifique recue durant ce temps de recherche.
Enfin, je remercie toutes les personnes qui, de près ou de loin, ont marqué, mon parcours académique. Aux professeurs Khasa Damas, Maurice Nsinkungu, et à mes amis Serge Mukendi, Géraud Essau, pour votre amitié, votre affection et vos encouragements.
xix
Avant-propos
Ces travaux de recherche dans le cadre du doctorat ont été rendus possible grâce à la bourse offerte par la congrégation des Pères Jésuites (la Compagnie de Jésus) dont je suis membre. Bon nombre d’analyses aux laboratoires ont été couvertes par la bourse Projet-Pilote obtenue de l’Institut pour la nutrition et les aliments fonctionnels (INAF) de l’Université Laval.
Le présent travail a été réalisé sous la direction de Mme Tatjana Stevanovic, professeure titulaire au Département des Sciences du Bois de l’Université Laval et sous la codirection de M. Pierre Haddad, professeur titulaire au Département de pharmacologie et physiologie de l’Université de Montréal.
Ce travail de recherche a été effectué dans trois laboratoires à savoir le laboratoire de Chimie du bois du Professeure Stevanovic, le laboratoire de Produits de santé naturels et maladies métaboliques du Professeur Pierre Haddad et le laboratoire de chimie (session RMN) du département de chimie de l’Université Laval.
Les résultats de ces travaux de recherche sont présentés dans cette thèse sous un format d’articles scientifiques. La thèse a été rédigée selon les critères établis par la Faculté des études supérieures et postdoctorales (FESP) de l’Université Laval. Le chapitre 1 présente la revue de littérature et le chapitre 2 décrit le contexte, les objectifs, les stratégies expérimentales et les matériels et méthodes. Les chapitres 3, 4, 5 et 6 présentent les résultats de cette thèse sous forme d’articles et une conclusion générale sous une note de recommandations futures sanctionne ce travail de thèse.
xx
Les quatre articles rédigés ou publiés sont les suivants :
Article 1
Kasangana, P.B., Haddad, P.S., Stevanovic, T. (2015) . Study of polyphenol content and antioxydant capacity of Myrianthus Arboreus (Cecropiaceae) root bark extracts.
Antioxidants, 4(2) :410-426, 10.3390/antiox4020410
Article 2
Pierre Betu Kasangana, Abir Nachar, Hoda M. Eid, Tatjana Stevanovicand Pierre S. Haddad
( 2018) , Root bark extracts of Myrianthus arboreus (Cecropiaceae) exhibit anti-diabetic potential by modulating hepatocyte glucose homeostasis, Journal of ethnopharmacology, 211( 30) , 117-125 https://doi.org/10.1016/j.jep.2017.09.017
Article 3
Pierre Betu Kasangana, Hoda M. Eid , Pierre S. Haddad and Tatjana Stevanovic, Bioactive pentacyclic triterpenoids from root bark of Myrianthus arboreus used traditionally to treat type 2 diabetes symptoms, soumis au Journal of natural products
Article 4
Pierre Betu Kasangana, Abir Nachar, Hoda M. Eid , Pierre S. Haddad and Tatjana Stevanovic, Antidiabetic effect of flavone C-glycosides isolated from root bark of Myrianthus arboreus, à soumettre dans Phytomedicine
Le rôle des co-auteurs dans la préparation de ces articles est divisé comme suit: l’auteur principal des articles, Pierre Betu Kasangana, candidat au Ph. D., a fait la revue de littérature complète, a effectué tous les travaux expérimentaux (bioessais cellulaires et analyses structurales) ainsi que la première version anglaise de l’article. Les Professeurs Tatjana Stevanovic et Pierre Haddad, en tant que directrice et co-directeur, ont coordonné les travaux expérimentaux chacun dans leur domaine d’expertise, ont proposé de multiples corrections et propositions pertinentes qui ont grandement amélioré l’approche scientifique et la présentation des documents, autant du côté du fond que de la forme. Les Dr. Hoda Eid ainsi qu’Abir Nachar, agissant comme post-doctorants du Professeur Pierre Haddad, ont suivi de près mes travaux expérimentaux, ont participé à l’interprétation des résultats et ont corrigé la première version de l’article.
xxi
Les résultats issus de ce travail de recherche ont également fait l’objet de présentations orales et d’affiches techniques lors de congrès scientifiques.
Chapitre de Livre
García-Pérez M E., Kasangana P. B., Stevanovic, T. “Bioactive Polyphenols for Diabetes and Inflammation in Psoriasis Disease” in, Studies in Natural Products Chemistry, Amsterdam, Elsevier, Vol. 52, 2017
Présentations orales
Kasangana P.B., Haddad P., Stevanovic T. Identification de différentes classes phytochimiques des extraits d’écorces de Myrianthus arboreus, CRB, département de sciences du bois, Séminaire, 13 février 2013, Québec, Canada
Kasangana P.B., Haddad P., Stevanovic T. Caractérisation chimique des extraits d’écorces de racines de Myrianthus arboreus, ACFAS, congrès, 21-16 may 2014, Montréal, Canada Kasangana P.B., Haddad P., Stevanovic T. Criblage chimique et fractionnement bio-guidé des extraits d’écorces de Myrianthus arboreus, CRIBIQ, colloque, 22-23 septembre 2014, Montréal, Canada
Kasangana P.B., Haddad P., Stevanovic T. Analyses chimiques des extraits bioactifs antidiabetiques d’écorces de racines de Myrianthus arboreus, colloque facultaire, 12-13 novembre, 2014, Québec, Canada
Kasangana P.B., Abir N., Eid H., Haddad P., Stevanovic T. Isolation bio-guidée des nouveaux dérivés de triterpènes pentacycliques de Myrianthus arboreus, ACFAS, congrès, 07-09 mai 2018, Chicoutimi, Canada
xxii
Présentation par affiches scientifiques
Kasangana P.B., Haddad P., Stevanovic T. Etudes phytochimiques et pharmacologiques des extraits d’écorces de Myrianthus arboreus, CRMR, colloque, 14 mai, 2014, Trois-Rivières, Canada
Kasangana P.B., Haddad P., Stevanovic T. Phytochemical and therapeutic properties of the root bark extracts of Myrianthus arboreus, Programme Fast/ INAF, 5ième Symposium étudiant sur les aliments fonctionnels et les produits de santé naturels, 23-25 mai, 2014, Winnipeq, Canada
Kasangana P.B., Haddad P., Stevanovic T. Chemical and therapeutic properties of the root bark extracts of Myrianthus arboreus, 13th European workshop on lignocellulosics and Pulp 2014, June 23-27, Séville, Espagne
Kasangana P.B., Abir N., Eid H., Haddad P., Stevanovic T. Antioxidant and antidiabetic effects of polyphenols-rich extracts of Myrianthus arboreus, 7th International Conference on Polyphenols and Health 2015, octobre 27-30, Congress Center Tours, France
Kasangana P.B., Abir N., Eid H., Stevanovic T., Haddad P. The anti-diabetic potential of the root bark extracts of Myrianthus arboeus (Cecropiaceae) in cultured hepatocyte cells, MDRC, Febrery.2, 2017, Montreal, Canada
Kasangana P.B., Abir N., Eid H., Haddad P., Stevanovic T. Isolation bio-guidée des nouveaux dérivés de triterpènes pentacycliques de Myrianthus arboreus, ACFAS, colloque, 07-09 mai, 2017, Chicoutimi, Canada
1
Introduction
La recherche de nouvelles molécules thérapeutiques d’origine naturelle fait l’objet de beaucoup d’études actuellement. Cette tendance peut être largement expliquée par l’impérieuse nécessité de trouver de nouveaux traitements, en raison notamment de l’efficacité mitigée de certains médicaments et des effets secondaires indésirables causés par les médicaments synthétiques ou combinatoires [1, 2]. Devant la multitude de sources naturelles disponibles, la biomasse forestière présente un intérêt particulier du fait qu’elle constitue une ressource abondante et renouvelable [3, 4]. En fait, elle demeure l’une des meilleures réserves quasi-inépuisables de nouveaux agents bioactifs et potentiellement valorisables [4]. Selon l'Organisation Mondiale pour la Santé (OMS), environ 80% de la population mondiale a recours aux préparations traditionnelles à base de plantes en tant que soins de santé primaires [5]. De même, plus 25 % des médicaments modernes sont préparés à base de plantes qui ont, au départ, été utilisées traditionnellement. Finalement, un autre 25% sont inspirés des produits naturels ou proviennent d’hémisynthèse. Par ailleurs, de plus en plus de médicaments à base de plantes sont largement utilisés dans le commerce international [1, 2].
Vue la diversité des espèces forestières, la recherche de molécules bioactives doit forcément être orientée [3, 4]. En effet, cette diversité se traduit naturellement par une chimiodiversité tout aussi importante. Celle-ci est d'ailleurs très spécifique en raison des particularités physico-chimiques de chaque essence. Dès lors, la connaissance des données ethnopharmacologiques, telles que les préparations traditionnelles des essences ou leurs usages pharmaceutiques, constitue un atout majeur pour cibler les plantes réputées par leur efficacité dans le traitement des maladies [6]. Le savoir traditionnel fournit ainsi une mine d’information extrêmement précieuse afin de mener à bien des recherches sur les plantes. En effet, sur les 250 000 à 300 000 espèces de plantes inventoriées que l'on trouve sur terre, des études notent 5 à 15% seulement qui ont fait l'objet de recherches de composés bioactifs [4]. Ce qui sous-entend que beaucoup d’essences n’ont pas encore fait l’objet d’études approfondies, notamment phytochimiques et pharmacologiques [4, 6]. En ce sens, bien des composés restent à découvrir comme nouveaux candidats thérapeutiques des préparations traditionnelles ou qui pourraient servir au développement des médicaments pour traiter ou
2
prévenir notamment beaucoup de maladies chroniques sociétales consécutives à l’obésité ou à une inflammation chronique dont le diabète de type 2.
La progression du diabète de type 2, qui est la forme majeure de diabète sucré, a pris des proportions épidémiques à travers le monde au cours des deux dernières décennies. Cette évolution accélérée touche aussi bien les pays industrialisés que les pays en voie de développement du fait d’une forte prévalence d’obésité, d’un mode de vie malsain et du vieillissement de la population. En 2017, plus de 425 millions de personnes dans le monde ont souffert de diabète de type 2 et 325 autres millions ont présenté une intolérance au glucose et donc un risque élevé de développer le diabète de type 2. Si cette tendance se poursuit, la prévalence du diabète pourrait élever à 629 millions en 2048, selon la Fédération internationale du Diabète [7]. Toutefois, les études renseignent que les sujets diabétiques ne succombent pas généralement à l'hyperglycémie ou à la dyslipidémie chronique mais à leurs complications micro- et/ou macro vasculaires. Les complications microvasculaires affectent principalement le rein (néphropathie diabétique), les nerfs périphériques (neuropathie diabétique) et la rétine (rétinopathie diabétique) alors que lésions macrovasculaires conduisent aux maladies cardiovasculaires. Pris ensemble, ces complications sont la cause du niveau élevé de mortalité dans le monde, estimée à 4,0 millions en 2017 et équivalant à un décès toutes les huit secondes[7]. La prise en charge thérapeutique et la prévention de cette pathologie reposent nécessairement et avant tout sur la compréhension des mécanismes qui conduisent au développement du diabète de type 2 [8].
Sur le plan physiopathologique, le diabète de type 2 est caractérisé par une diminution de la sensibilité à l’insuline dans certains tissus cibles tels que le foie, le muscle et les tissus adipeux, ainsi qu’une diminution de la sécrétion de l’insuline par les cellules ß du pancréas[9, 10]. La perte d’efficacité de l’insuline sur les tissus cibles se traduit notamment par une augmentation de la production hépatique de glucose, une moindre inhibition de la lipolyse dans le tissu adipeux et une diminution de la captation de glucose par le muscle squelettique [11-13]. Mis à part les tissus adipeux, le muscle squelettique et le foie sont les principaux contributeurs de la diminution de l’hyperglycémie postprandiale et à jeun observée chez les sujets diabétiques [7,8]. En effet, 70 à 80% de glucose alimentaires sont absorbés par les
3
cellules musculaires pour y être métabolisé et environ 30 % de glucose sont entreposés sous forme de glycogène dans le foie[14, 15].
Des études récentes ont montré que l’homéostasie du glucose peut également être régulée par une kinase qui est impliquée dans le contrôle de l’homéostasie énergétique. Cette Kinase appelée AMP-activated protein Kinase (AMPK) est activée par suite d’un stress métabolique (augmentation du ratio AMP/ATP dans une cellule) [16, 17]. Lorsqu’elle est phosphorylée, elle est active et va stimuler les voies cataboliques productrices de l’ATP, notamment l’augmentation de l’entrée de glucose dans les muscles et la diminution de la production hépatique du glucose [18-20]. L’activation de l’AMPK est, aujourd’hui, considérée comme une cible thérapeutique importante dans le traitement de maladies métaboliques sociétales, y compris le diabète de type 2. Un des antidiabétiques oraux le plus utilisé, la metformine, agit particulièrement sur l’AMPK. La metformine est un dérivé de guanidine qui est un produit naturel isolé de Galéga officinalis. Une avalanche d’étude a également démontré que l’AMPK est la cible thérapeutique pour les plantes médicinales issues de la médecine traditionnelle de diverses sociétés [21, 22]. Ainsi, la recherche progresse sur plusieurs fronts, mais celui des médicaments à base de plantes ouvre certainement des voies prometteuses dans le traitement de la physiopathologique du diabète de type 2 [23].
Myrianthus arboreus est un arbre ou un arbuste de foret secondaire des régions tropicales d’Afrique dont les différents tissus contiennent plusieurs molécules bioactives (alcaloïdes, triterpènes, polyphénols) à effets thérapeutiques intéressants [6, 24-26]. Les données ethnopharmacologies africaines le classent parmi les plantes médicinales les plus utilisées [27-29]. Il possède des vertus antidiabétiques assez remarquables, ce qui rend son usage très courant chez les patients souffrant du diabète de type II. En République Démocratique du Congo, la pharmacopée a recours aux écorces de racines de M. arboreus pour soigner traditionnellement le diabète de type 2 [27, 30-33]. Des décoctions d’écorces sont administrées aux patients et les résultats obtenus se révèlent, selon les tradipraticiens congolais, être satisfaisant. Aucune étude scientifique n’a, jusqu’ici, été menée pour confirmer ou infirmer l’activité antidiabétique de ce décocté.
4
Dans ce contexte, le premier objectif de ce projet de recherche vise à valider le potentiel antidiabétique de différents extraits de ces écorces et de leurs fractions par le biais d’une série de bioessais cellulaires in vitro, ce qui n’a jamais été réalisé [8]. Des études antérieures se sont surtout focalisées sur les effets antioxydants [34], antibactériens [29, 35], anti-infectieux des extraits de feuilles [27, 36, 37]. En plus, un composé un cinnamate de lignane, à savoir la myrianthianllin, trois alcaloïdes et plusieurs acides triterpéniques ont été isolés de différentes parties de la plante, notamment des écorces de bois, du bois et des feuilles [38-43]. Les propriétés antidiabétiques de myrianthianllin ou de trois alcaloïdes n’ont jamais été démontrées [25, 26]. Parmi les triterpènes isolés, l’acide tormentique (T13) a été identifié comme responsable de l’activité antidiabétique des extraits de la potentille, une plante de la famille de Rosacée [44]. Les acides arjunolique (T4), ursolique (T12) et euscaphique (T14) sont en revanche à l’origine des vertus antidiabétiques de certaines plantes telles que Folium Eriobotryae, Terminalia Arjuna et de Combretum nelsonii [45-47]. Dans cette optique, notre projet veut innover en identifiant par une approche de fractionnement le(s) composé(s) responsable(s) de l’activité antidiabétique d’écorces de racine de M. arboreus. Cette démarche devra aboutir à confirmer si l’activité dévolue aux écorces provient d’une molécule particulière ou d’une synergie entre plusieurs composés.
Cette thèse s'articule en trois parties principales : la première partie constitue une revue des données bibliographiques sur les effets de l’insuline sur le métabolisme du glucose; le diabète et ses complications ainsi que l’ensemble des travaux antérieurs portant sur M. arboreus. La deuxième partie porte exclusivement sur les objectifs du projet de recherche, le matériel et les méthodes. La dernière rassemble tous les résultats sous forme d’articles scientifiques. Le premier article porte sur l’activité antioxydante des extraits de la plante, le deuxième sur l’activité antidiabétique des extraits et fractions et leurs mécanismes d’actions. Le troisième et le quatrième article présenteront les résultats sur le fractionnement bioguidé de l’extrait bioactif, l’isolation des composés actifs, leurs caractéristiques chimiques et l’élucidation des mécanismes d’action par lesquels M. arboreus exerce son effet. Une discussion et conclusion générale suivi des perspectives futures mettront fin à ce travail.
5
Chapitre I. Revue de littérature
I.1 Homéostasie énergétique
L’homéostasie énergétique est un processus indispensable pour la survie de l’organisme. Elle est un état d’équilibre dynamique entre les dépenses et les apports d’énergie, exprimé principalement sous forme d'adénosine triphosphate (ATP). Elle favorise ainsi le maintien de la stabilité du milieu interne de l’organisme [14, 48, 49]. Cet équilibre est principalement assuré par deux classes essentielles de nutriments : les glucides et les lipides; les protéines jouant également un rôle quoique plus complexe. Les deux substrats semblent tellement complémentaires quant à leur capacité à couvrir les besoins énergétiques dans leur voie finale commune (respectivement, le cycle de Krebs et oxydation phosphorylante) que l’on pourrait les penser redondants [14]. Cependant, les lipides sont d’abord stockés comme source d’énergie dans les tissus adipeux avant leur utilisation ultérieure alors que les glucides représentent une fraction importante du métabolisme énergétique qui est plus rapidement utilisable [11, 20].
De tous les glucides, le glucose est le principal substrat utilisé pour fournir de l’énergie aux différents tissus de l’organisme. Il peut être métabolisé soit par la voie aérobique ou anaérobique, conduisant ainsi à la formation de l’ATP. Le glucose est considéré comme la principale source d'énergie pour le corps, et surtout pour le cerveau (25%). Dans les conditions physiologiques normales, une personne en bonne santé a une glycémie normale (glycémie à jeun autour de 3.5-5.6 mmol/L et glycémie post-prandiale autour de 4.40 – 6.94 mmol/L) [14, 50]. Le maintien de la glycémie autour des valeurs normales est assuré par plusieurs hormones dont l’insuline qui occupe une place prépondérante et unique à certains égards [14].
L’insuline, sécrétée par les cellules β-pancréatiques, est une hormone majeure dans les adaptations des voies métaboliques liées aux variations de l’environnement glucidique [14, 51]. Elle inhibe la production hépatique de glucose, active son stockage dans le foie, son transport et son stockage dans les muscles et le tissu adipeux. L’insuline agit en modulant
6
l’activité de protéines déjà présentes (enzymes, transporteurs) mais peut également modifier l’expression de gènes spécifiques [48, 51].
I.1.1 Transporteurs de glucoses
Le glucose est polaire et hydrophile, il ne peut être donc pas diffuser à travers la double couche lipidique de la membrane cellulaire. De ce fait, l’organisme s’est doté d’un système de transport membranaire, lequel facilite l’entrée du glucose dans des cellules [52]. Il existe deux grandes familles des transporteurs de glucose (Tableau I-1) [53]. La première, composée des cotransporteurs de glucose dépendant du sodium (SGLT : sodium-glucose co-transporters), est responsable du transport actif. Les SGLT sont surtout exprimés au niveau de l’intestin et des reins; ils facilitent le transport actif de glucose contre son gradient de concentration en utilisant l’énergie dérivée du gradient électrochimique du sodium, mis en place principalement par la pompe à sodium [52, 54].
La deuxième famille de transporteur du glucose est indépendante du Na+. Contrairement au système précédent, ce deuxième type de transporteurs est largement exprimé dans presque toutes les cellules [54]. Le transport du glucose à travers la membrane cellulaire s’effectue dans la direction de son gradient de concentration et n’utilise donc pas d’énergie pour ce faire. Ce processus est appelé diffusion facilitée. Les transporteurs de glucose indépendants du sodium (ou GLUT pour « GLUcose Transporter ») sont une famille de 14 protéines structurellement apparentées (GLUT1-14). Ils sont codés par des gènes distincts et distribuées dans les différents organes. Les GLUT4 sont les principaux transporteurs de glucose sensibles à l’insuline, ils se trouvent essentiellement chez les cellules musculaires squelettiques, les cellules musculaires cardiaques et les adipocytes [14, 53, 54].
7
Tableau I-1 Principaux transporteurs du glucose (tirée de Rao et al.2013 [55])
I.1.1.1 L’effet de l’insuline sur les myocytes
Suite à un repas, le taux de glucose dans le sang augmente provoquant un changement dans le niveau des hormones réglant l’homéostasie de glucose [14]. En général, 75% du glucose circulant est capté par les muscles pour y être métabolisé [14, 15]. Du point de vue de mécanisme d’action, l’insuline se fixe sur son récepteur et déclenche l’autophosphorylation de ce dernier et l’activation de la voie des IRS. Il existe plus d’une isoforme des IRS, dont les plus importantes sont IRS1 et IRS2 [56]. Dans les muscles squelettiques, la forme majoritaire est l’IRS1 qui, une fois phosphorylée par l’activité tyrosine kinase du récepteur, se fixe sur la sous-unité régulatrice de la PI3 kinase, P85. Ceci a pour effet de libérer la sous-unité catalytique de la PI3Kinase, P110, pour aboutir à la
8
phosphorylation de phospholipides inositides tel que la conversion du PIP2 en PIP3 (13). Par la suite, ces phospholipides permettent d’activer des sérines thréonines kinases telles que Akt/PKB. Celles-ci activent par la suite la transcription des gènes impliqués dans l’expression de certaines enzymes-clés de la glycolyse, de la synthèse de glycogène, et de l’oxydation mitochondriale. La translocation des GLUT4 facilite le transport de glucose vers l’intérieur des cellules musculaires [54]. Une fois dans la cellule, le glucose est phosphorylé en glucose-6-phosphatase par la glucokinase. Cette étape est considérée comme la première étape dans la glycolyse ainsi que le stockage de glucose sous forme de glycogène [15]. La majorité du glucose capté par les cellules musculaires est transformée par les réactions enzymatiques d’oxydo-réduction de la glycolyse et du cycle de Krebs. Le glucose est oxydé en pyruvate. Le pyruvate est métabolisé en ATP par le cycle de Krebs et, les intermédiaires énergétiques de la glycolyse, le NADH2 et FADH2, sont oxydés lors de leur utilisation dans la chaine respiratoire. En dehors de la voie PI3 kinase, la transmission du signal insulinique va également activer la voie MAP kinase. Celles-ci vont activer les kinases tels que p90rsk impliquée dans la synthèse protéique et des facteurs de transcription tels que p62TCF impliquées dans la prolifération et la différentiation cellulaire [14].
I.1.1.2 L’effet de l’insuline sur les hépatocytes
Le foie joue un rôle capital dans le maintien de l’homéostasie glucidique dans l’organisme. Il est à la fois capable de produire et de stocker du glucose [11, 57]. Au cours d’un jeûne et de l’exercice physique, la production hépatique de glucose provient du catabolisme du glycogène (la glycogénolyse) et de la synthèse de glucose à partir des substrats non-glucidiques tels que les acides aminés (la néoglucogenèse). En revanche, après un repas, le glucose absorbé par les intestins est stocké au foie sous forme de glycogène (glycogénogenèse) pour être libéré sous forme de glucose lors du jeûne ou de l’activité physique.
Au niveau du foie, la première étape est le captage du glucose qui est assuré par le transporteur GLUT2. Après son transport dans l’hépatocyte, le glucose est transformé en G6P par la glucokinase. Cette enzyme est présente exclusivement dans le foie et dans la
9
cellule pancréatique. L’étape limitante de la glycogénogenèse est assurée par l’enzyme glycogène synthase (GS). Celle-ci catalyse l’incorporation d’unités de glucose dans la chaîne de glycogène en élongation à partir d’UDP-glucose ; c’est de cette façon que le glycose est stocké sous forme de glycogène. La GS est régulée par une kinase importante, la glycogène synthétase kinase-3 (GSK-3) [58, 59]. La voie de l’insuline agit sur la GSK-3 par un mécanisme de phosphorylation. Ainsi, lorsque la GSK-3 est phosphorylée, elle est devenue inactive. Ceci lève l’inhibition de la glycogène synthétase causée par sa phosphorylation, augmentant ainsi la synthèse du glycogène [13, 15]. La GS est une sérine/thréonine kinase impliquée dans plusieurs maladies comme le diabète, le cancer, l’inflammation et l’Alzheimer ; mais, inévitablement, elle joue un rôle indispensable dans glycogénogénèse[13, 58].
La néoglucogenèse est l’inverse de la glycolyse ; en effet elle permet la production du glucose et ceci à partir des précurseurs non-glucidiques [60]. Elle est réalisée au niveau du cytosol dans le foie. L’activation de cette voie s’observe à la suite d’un jeûne prolongé, lorsque les nutriments apportés par l’alimentation ainsi que les stocks de glycogène ne permettent plus de satisfaire les besoins énergétiques de l’organisme. On observe dans cette situation un manque d’ATP ainsi que l’excès d’AMP. La néoglucogenèse est aussi activée chez les patients diabétiques. Cette voie enregistre plusieurs réactions enzymatiques qui s’enchaînent pour synthétiser du glucose et le libérer dans la circulation sanguine. Parmi les enzymes impliquées dans la néoglucogenèse, trois enzymes assurent le contrôle des réactions de cette voie : la phosphoénolpyruvate carboxykinase (PEPCK), la fructose-1,6-biphosphatase et la glucose-6-phosphatase (G6Pase). Ces trois enzymes font l’objet d’une régulation hormonale. En effet, suite à l’ingestion d’un repas, l’insuline tend à réguler le niveau de glucose dans le sang, en inhibant la voie de la néoglucogenèse hépatique [11, 12]. Cette inhibition est expliquée par le fait que l’insuline active ses récepteurs, ce qui augmente la phosphorylation de l’Akt. Ceci agit sur les facteurs de transcription responsables de l’expression de deux de ces trois enzymes clefs de la voie de la néoglucogenèse : soit la PEPCK et la G6Pase [57, 61]. De cette façon, les facteurs de transcription seront expulsés du noyau et l’expression des enzymes sera inhibée, ce qui va entrainer la diminution de la production hépatique du glucose [13]. A l’inverse, pour une personne diabétique, on observe une augmentation de la production hépatique du glucose, qui justifie, en grande partie,
10
l’hyperglycémie à jeun constatée. Cet effet est dû au déficit dans la voie de signalisation insulinique (la résistance à l’insuline), qui est à l’origine du diabète sucré, un problème majeur de santé publique aujourd’hui.
Figure I-1 Effets de l’insuline sur les hépatocytes (tirée de Saltiel and Kahn, 2001 [57])
L’étape limitante de la néoglucogenèse est catalysée par la G6Pase (Figure I-1). Cette enzyme est localisée dans le réticulum endoplasmique (RE) du foie, du rein et de l’intestin et aboutit à la libération du glucose finale dans le sang. Cette enzyme joue donc un rôle critique dans le maintien de la glycémie normale ; ainsi la faiblesse ou l’absence d’inhibition de son expression par l’insuline contribue de manière considérable à établir l’hyperglycémie observé dans le diabète [57, 61].
I.1.1.3 L’effet de l’insuline sur les tissus adipeux
Lorsque les apports énergétiques sont supérieurs aux dépenses énergétiques, le glucose qui pénètre dans les adipocytes est métabolisé en acides gras puis stocké sous forme de triglycérides, par la voie de la lipogenèse de novo [62]. Le terme de lipogenèse proprement
11
dit désigne la néosynthèse d’acides gras à partir du glucose. Après l’entrée du glucose dans l’adipocyte, grâce à des transporteurs spécifiques (GLUT-1 et 4), le glucose est dégradé en pyruvate. À son tour, ce pyruvate est métabolisé en acétyl CoA par la pyruvate déshydrogénase (PDH) dans la mitochondrie. La membrane mitochondriale n’étant pas perméable au passage de l’acétyl coA vers le cytoplasme, ce dernier est alors converti en citrate. Par réaction inverse, le citrate est encore métabolisé en acétyl CoA pour être redirigé vers le cytoplasme. L’acétyl coA est alors métabolisé en malonyl CoA par l’acétyl CoA carboxylase (ACC). Le malonyl coA et l’acétyl coA sont les substrats d’un complexe enzymatique, la fatty acid synthase (FAS), qui génère des acyls coA à longue chaine (AGCL). Ces derniers sont ensuite estérifiés avec du glycérol pour synthétiser des triglycérides; qui seront par la suite stockés comme source d’énergie. Du point de vue du mécanisme d’action, l’insuline module la synthèse des lipides à partir du glucose en activant des facteurs de transcription qui contrôlent l’expression de gènes lipogéniques, dont le plus connu est SREBP-1 (stérol response element-binding protein 1). Cette dernière active par exemple l’expression génique de la FAS [63].
I.1.2 Principales voies de signalisation activées par l’insuline
Tel que mentionné, l’insuline joue un rôle anabolique majeur dans la mise en réserve des substrats glucidiques et lipidiques. Ses effets résultent de sa liaison à un récepteur membranaire spécifique exprimé en priorité sur ses trois tissus cibles, le foie, le muscle et le tissu adipeux. Ce récepteur possède une activité tyrosine-kinase qui ouvre à deux voies majeures de signalisation de l’insuline.
I.1.2.1 Récepteur et action de l’insuline
En circulation dans le sang, l’insuline se lie à son récepteur présent à la surface de la plupart des cellules de l’organisme mais exprimé surtout dans ses trois principaux tissus cibles, à savoir le foie, le muscle et le tissu adipeux. Le récepteur de l’insuline est composé de deux chaînes α extracellulaires reliées par des ponts disulfures à deux chaînes β
12
transmembranaires, formant ainsi un hétérodimère. Chaque sous-unité α possède un site actif de liaison de l’insuline situé de part et d’autre d’une séquence riche en cystéines qui permet la formation de ponts disulfure structurant ce domaine. Cependant, l’activation complète du récepteur se fait sous l’action de l’insuline qui se lie avec une forte affinité sur les deux sous-unités. La liaison de l'insuline à son récepteur entraîne l'autophosphorylation de la sous-unité β du récepteur sur un certain nombre de tyrosines et déclenche une série d’évènements qui débute par un changement conformationnel du récepteur, suivi d’une autophosphorylation sur les résidus tyrosine. Cette autophosphorylation augmente aussi l’activité tyrosine kinase du récepteur envers des substrats exogènes, appelés Insulin Receptor Substrates (IRS), qui inclut notamment les protéines IRS-1, IRS-2 et Shc. La phosphorylation des IRS engendre ensuite une cascade de signalisation intracellulaire impliquant plusieurs substrats intracellulaires et enzymes cytosoliques, tels que la phosphatidylinositol-3 (PI 3) kinase et GRB-2 (growth factor receptor-bound protein 2).
13
Il existe deux principales voies de signalisation de l’insuline: la voie de la phosphatidylinositol-3 kinase PI3-kinase et celle de la MAP (mitogen activated protein) - kinase (Figure I-2) [14].
I.1.2.2 La voie de signalisation de la PI3-Kinase
La voie de la PI3-kinase est impliquée en priorité dans les effets métaboliques de l’insuline. L’enzyme PI3-K est constituée d’une unité catalytique, la p-110, et une sous-unité régulatrice, la p-85. Au fait, lorsque le récepteur de l’insuline a activé les IRS par une réaction de phosphorylation des résidus tyrosines, les IRS vont à leur activer la PI3 kinase par le biais des domaines SH2 de sa sous-unité régulatrice P85. Une fois activée, la PI3 kinase catalyse la phosphorylation de lipides membranaires formant ainsi des PI (3,4,5) P3, qui eux se fixe au domaine Plecstrin Homology (PH) de la protéine AKT au niveau de la membrane plasmique. Il en va de même pour les Phosphatidylinositide-dependent kinases (les PDK1/2), qui entraînent elles aussi la phosphorylation d’autres protéines relais intracellulaires impliquées dans les effets métaboliques de l’insuline. On peut citer en exemple leur action sur des enzymes clés du métabolisme du glucose telles que la glycogène synthase (GSK) mais aussi sur certains facteurs de transcription comme les forkhead transcription factors (FOXO) et certaines protéines comme les cAMP response element-binding proteins (CREB).
I.1.2.3 La voie de signalisation de Ras-MAPK
C’est la voie impliquée en priorité dans les effets sur la croissance et la différenciation cellulaire[64]. Lors que l’IRS est phosphorylé; il interagit avec une protéine d’adaptation Grb2 qui recrute la protéine SOS (Son Of Sevenless). Cette association active alors de la protéine Ras dont la fonctionnalité dépend aussi de son interaction avec la protéine SHP-2. Cette dernière a été préalablement activée par l’IRS. La protéine Ras active alors une cascade de sérine/thréonine kinases telles les protéines de la voie des MAPK (e.g. ERK). Une fois
14
phosphorylée, la protéine ERK est transloquée dans le noyau et active alors la transcription de gènes codant pour la prolifération et la différenciation cellulaire. In fine, la voie MAPK est commune à de nombreux facteurs de croissance et permet d’activer l’expression génique et la prolifération. Il a été aussi observé que les voies PI3 kinase/PKB et MAP kinase sont interconnectées et participent à l’activation l’une de l’autre.
Une autre voie de signalisation induite par l’activation du récepteur à l’insuline est celle qui favorise, tout comme celle de l’Akt, le métabolisme du glucose en augmentant la capture cellulaire de glucose. Cette voie est appelée la voie de CAP/Cbl/TC10. Certaines études montrent que cette voie est active dans le muscle cardiaque et qu’elle est altérée avec l’obésité et la déficience en insuline.
I.1.2.4 Autre voie de signalisation : Régulation et activation de l’AMPK
En dehors de la voie de signalisation de l’insuline décrite ci-haut, l’homéostasie du glucose est régulée par d’autres facteurs impliqués dans le contrôle énergétique. C’est le cas de la voie médiée par l’AMP-activated protein kinase (AMPK) dont les voies de signalisations sont indépendantes de celles de l’insuline [65].
L’AMPK est une enzyme ubiquitaire présentée comme le senseur métabolique de la cellule. Elle participe à la régulation du métabolisme énergétique, de la prise alimentaire et de la sensibilité des tissus en réponse aux signaux métaboliques et hormonaux. Elle est constituée de 3 sous-unités α, β et γ. Cette kinase est activée suite à un stress métabolique lors des situations de carence énergétique comme l’absence de glucose, l’exercice physique, l’ischémie ou l’hypoxie et lors de l’inhibition ou le découplage de la chaîne de respiration mitochondriale. La carence énergétique se manifeste par une chute de production de l’ATP et donc une augmentation du ratio AMP/ATP dans une cellule. Une fois activée, l’AMPK participe au maintien de l’homéostasie énergétique cellulaire en inhibant les voies anaboliques et en stimulant les voies cataboliques productrices de l’ATP (Figure I-3)
Dans le muscle squelettique, l’AMPK active la translocation des GLUT4 vers la membrane cytoplasmique et augmente par la suite le transport de glucose par un mécanisme
15
différent de celui de la voie insulino-dépendante. La p38 MAPK semble être activée par plusieurs stimulateurs de l’AMPK comme AICAR (5-Aminoimidazole-4-carboxamide ribonucleotide) et les découpleurs mitochondriaux. Ce mécanisme semble être responsable de l’effet de l’AMPK sur l’activation des GLUT4 présents sur la surface cellulaire [16].
L’AMPK diminue aussi la néoglucogenèse essentiellement en inhibant certains facteurs de transcription responsables de l’expression des enzymes clefs comme la PEPCK et la G6Pase[65]. Ces facteurs de transcription regroupent les c-AMP-response element-binding protein (CREB), l’hepatocyte nuclear factor-4α (HNF-4α) et la famille des forkhead (FOXO1) [18, 66].
Figure I-3 Les mécanismes d'action des différences voies: Akt et AMPK (tirée de Eid et Haddad, 2014 [20])
L’AMPK joue aussi un rôle important dans le contrôle du métabolisme lipidique en phosphorylant et inactivant l’ACC. L’ACC catalyse la transformation de l’acétyl-CoA en
16
malonyl-CoA ce qui, dans le foie et le tissu adipeux, constitue la première réaction de la biosynthèse des acides gras. En inactivant l’ACC, l’AMPK devient donc responsable d’une inhibition de la synthèse des acides gras dans ces tissus lipogéniques. L’AMPK a également un effet de régulation à long terme sur la transcription des gènes de la lipogenèse, ACC et synthase des acides gras, en inhibant l’expression et l’activité des facteurs de transcription SREBP1c (sterol regulatory element binding protein 1c) et ChREBP (carbohydrate response element binding protein). En outre, dans le foie mais également dans les muscles striés (squelettiques et myocardiques), le malonyl-CoA produit par l’ACC joue le rôle d’élément régulateur : il bloque, en effet, le transport des acides gras du cytosol vers la mitochondrie en inhibant la carnitine-palmitoyl transférase-1 (CPT-1) [16].
Ainsi, l’activation de l’AMPK est considérée comme une cible thérapeutique importante dans le traitement de maladies métaboliques dont le diabète de type 2 [67]. Par ailleurs, un des antidiabétiques oraux le plus utilisé et le plus vendu dans le monde, la metformine, qui agit sur l’AMPK [17].
17
I.2 Diabète sucré
Le diabète est une maladie métabolique caractérisée par une hyperglycémie chronique et une perturbation des métabolismes glucidique, lipidique et protéique [50]. Il résulte d’un déficit de sécrétion de l’insuline par les cellules β-pancréatiques et/ou de l’action de cette hormone au niveau de tissus cibles, notamment les tissus adipeux, les cellules du foie et musculaires [7, 50-52].
Selon l'OMS, le diabète est diagnostiqué lorsque la glycémie à jeun atteint plus de 7,0 mmol / L (126 mg / dl) ou lorsque la glycémie atteint plus de 11,1 mmol / L (200 mg / dl) 2 heures après un test oral de tolérance au glucose (OGTT). Il existe également deux états pré-diabétiques. D’abord, lorsque la glycémie à jeun varie de 6,1 à 6,9 mmol / L (110 à 125 mg / dl), ou lorsque la tolérance au glucose altérée (impaired glucose tolerance ou IGT) est caractérisée par une glycémie comprise entre 7,8 mmol / L et 11,1 mmol / L (140 mg / dl à 200 mg / dl) 2 heures après l'OGTT [68]. Récemment, les critères de diagnostic de l’Association Américaine du Diabète (ADA, American Diabetes Association) ont été révisées et la mesure de l’hémoglobine glyquée (HbA1c) supérieure à 48 mmol/mol (soit 6.5%) était ajoutée [7, 68].
I.2.1 Données sur la prévalence et incidence du diabète dans le monde et en
Afrique
Le diabète est sans doute devenu l’une des plus grandes crises de santé publique au XXIe siècle. Le diabète de type 2, la forme la plus prévalente de diabète, a progressé parallèlement aux changements socioculturels. Chaque année, de plus en plus de personnes développent cette maladie pouvant entraîner des complications qui bouleversent leur vie.
En 2015, la Fédération internationale du diabète (FID) a estimé que plus de 415 millions d’adultes (âgés de 20 à 79 ans) dans le monde sont atteints du diabète de type 2 [7]. Et, plus de 318 millions personnes présentent une intolérance au glucose qui les expose à un
18
risque potentiel de développer la maladie à l’avenir. Si cette progression n’est pas freinée, 642 millions d’adultes souffriront du diabète d’ici 2040 [7].
Par ailleurs, la prévalence du diabète ne cesse d’augmenter dans la plupart des régions du monde, notamment dans les régions d’Afrique. On observe que sur 415 millions de personnes souffrants du diabète, 14 millions sont africains. Qui plus est, le continent africain se distingue par la proportion la plus élevée des personnes non diagnostiquées ; plus de deux tiers (66,7 %) des populations ignorent qu’elles souffrent de cette maladie. La République Démocratique du Congo est un pays africain où les ravages des diverses maladies métaboliques ne contredisent pas l’épidémie mondiale du diabète de type 2 [7, 32]. Avec plus de 1.8 millions de diabétiques, la RDC fait partie des 4 pays les plus peuplés d’Afrique qui compte le plus grand nombre de personnes atteintes de diabète. Il occupe, en effet, la deuxième place après l’Afrique du Sud qui enregistre 2.3 millions [7].
I.2.2 Classifications étiologiques du diabète
L’étiologie de la maladie permet de distinguer quatre types de diabète : type 1, type 2, diabète gestationnel et les autres types (parmi lesquels des déficiences génétiques conduisant à un déficit en insuline, des altérations génétiques des cellules bêta pancréatiques, des diabètes mitochondriaux, et plusieurs endocrinopathies ou maladies du pancréas). La majorité des cas de diabète sont représentés par les diabètes de type 1 et de type 2 (respectivement environ 15 % et 80 % des cas), le reste étant constitué par des formes plus rares, telles que le diabète MODY (maturity-onset diabetes of the young) [50, 69].
I.2.2.1 Diabète de type 1
Le diabète de type 1 (DT1) est dû à la destruction auto-immune des cellules β-pancréatiques qui conduit à un déficit absolu de la sécrétion de l’insuline [50, 69]. Les facteurs génétiques et environnementaux sont à l’origine du processus étiologique de cette maladie, dont l’évolution aboutit à une dépendance envers l’administration exogène de
![Tableau I-1 Principaux transporteurs du glucose (tirée de Rao et al.2013 [55])](https://thumb-eu.123doks.com/thumbv2/123doknet/5002084.124341/29.918.129.797.184.698/tableau-principaux-transporteurs-glucose-tirée-rao-al.webp)
![Figure I-3 Les mécanismes d'action des différences voies: Akt et AMPK (tirée de Eid et Haddad, 2014 [20])](https://thumb-eu.123doks.com/thumbv2/123doknet/5002084.124341/37.918.175.757.492.912/figure-mécanismes-action-différences-voies-ampk-tirée-haddad.webp)


![Figure I-16 Biogénèse du lupane, germanicane, taraxastane, oléanane et des ursanes (adaptée de Augustin et al., 2011 [124])](https://thumb-eu.123doks.com/thumbv2/123doknet/5002084.124341/75.918.141.761.105.994/figure-biogénèse-germanicane-taraxastane-oléanane-ursanes-adaptée-augustin.webp)